2. RISULTATI E DISCUSSIONE
2.1 Copolimerizzazione radicalica tra 4-vinilbenzilcloruro e 4-terz-butilstirene
2.1.1 Reazioni di polimerizzazione radicalica
I monomeri commerciali 4-vinilbenzilcloruro (VBC) e 4-terz-butilstirene (tBS) sono stati utilizzati per la preparazione di omopolimeri e copolimeri mediante reazioni di polimerizzazione a catena in massa, in presenza di un iniziatore di tipo radicalico. Una polimerizzazione a catena viene definita radicalica quando i portatori della catena cinetica sono radicali liberi. Un radicale libero è rappresentato da un frammento molecolare ottenuto dalla rottura omolitica di un legame covalente; l’elettrone spaiato così ottenuto non partecipa ad alcun legame. La presenza di un elettrone libero rende il radicale una specie altamente reattiva, in grado di addizionarsi a molecole contenenti legami multipli (es. etilene, stirene, cloruro di vinile, butadiene, ecc.): questa reattività verso i composti insaturi costituisce la base della polimerizzazione radicalica. La polimerizzazione radicalica viene quindi condotta in presenza di iniziatori
radicalici che possono dare origine a radicali liberi in seguito a decomposizione
termica, ossidoriduzione o fotodegradazione. Il decorso del processo può essere schematicamente rappresentato dalla seguente sequenza di reazioni:
• → −R 2R R Dissociazione • → + • M RM R Inizio • → + • (n-1)M RM M RM n-1 Propagazione • + → + • X RM X M RMn-1 n Trasferimento Y RM Y M RMn-1 • + • → n Termine
Nel primo stadio, di dissociazione dell’iniziatore, si genera il radicale primario R•. La rottura omolitica del legame può avvenire per via termica, fotochimica o per reazioni di ossidoriduzione (iniziatori redox). Il metodo più comune è quello della dissociazione termica o fotochimica di legami relativamente deboli di sostanze quali perossidi organici ed inorganici, idroperossidi, azo e diazocomposti, mono e di solfuri, ecc.
Un perossido largamente utilizzato è il benzoilperossido (BPO), che a temperature superiori a ∼40 °C dà luogo alla scissione omolitica:
• ∆ → 2C H COO H COOOCOC H C6 5 6 5 6 5
Un azocomposto tra i più utilizzati è invece il 2,2’-azo-bis-isobutirronitrile (AIBN):
C CH3 CN H3C N N C CH3 CN CH3 C CH3 CN H3C ∆ 2 + N2
che decompone a temperature superiori a ∼ 50o C.
Il radicale primario R• reagisce rapidamente con monomeri insaturi attaccando il legame π e formando un nuovo radicale al quale resta unito:
•
→
+ • M i P1 R k in cui • 1P rappresenta il primo radicale della catena in accrescimento, M è il monomero e ki è la costante cinetica dello stadio d’inizio.
Dopo l’inizio si ha l’addizione del monomero sul primo radicale della catena in accrescimento e la catena si propaga con lo spostamento del centro attivo radicalico all’estremità della stessa; a questo stadio ne seguono rapidamente moltissimi altri che costituiscono una serie di reazioni di crescita, racchiuse nella seguente espressione:
• + • +
→
1 i i p i M P P k ,in cui i rappresenta il numero di unità monomeriche contenute nel radicale in accrescimento.
L’attacco del monomero sul primo radicale della catena in accrescimento può avvenire su una delle due estremità: dalla testa o dalla coda. Generalmente, nelle polimerizzazioni radicaliche di monomeri vinilici la struttura della catena in accrescimento contiene sequenze testa-coda (regioselettività).
I processi di trasferimento e di terminazione possono aver luogo sia con molecole normalmente presenti nella miscela di polimerizzazione (unità monomeriche, catene in accrescimento, iniziatore, eventuali impurezze, ecc.), che con molecole opportunamente aggiunte per regolare il peso molecolare del prodotto polimerico, il quale dipende dal rapporto tra velocità di propagazione e quelle di trasferimento e terminazione.
La copolimerizzazione a catena (radicalica o ionica) di due monomeri può essere descritta mediante due tipi di specie in accrescimento *
1
M e *
2
M , caratterizzate rispettivamente da unità monomeriche terminali del tipo M1 e del tipo M2.
Nel caso che si escluda, come spesso accade, l’effetto “penultimo”, le quattro possibili reazioni di propagazione sono:
* 1 1 * 1 M M M + k
→
11[ ]
*[ ]
1 1 11 11 k M M v = * 2 2 * 1 M M M + k→
12[ ]
*[ ]
2 1 12 12 k M M v = * 1 1 * 2 M M M + k→
21[ ]
*[ ]
1 2 21 21 k M M v = * 2 2 * 2 M M M + k→
22 v22= k22[ ]
M2*[ ]
M2Per catene sufficientemente lunghe si può affermare che i monomeri vengono consumati quasi esclusivamente nelle reazioni di propagazione, per cui la loro velocità di entrata nella catena polimerica deve risultare uguale a quella della loro scomparsa dalla miscela di alimentazione. Ciò equivale a scrivere:
[ ]
[ ]
[ ]
[ ]
[ ]
1 * 2 21 1 * 1 11 1 k M M k M M dt M d = + −[ ]
[ ]
[ ]
[ ]
[ ]
2 * 1 12 2 * 2 22 2 k M M k M M dt M d = + − Ponendo 12 11 1 kk r = e 21 22 2 kkr = si ottiene l’equazione di copolimerizzazione:
[ ]
[ ]
[ ]
[ ]
[ ]
[ ] [ ]
1 2[ ]
2 2 1 1 2 1 2 1 M r M M M r M M M d M d + + =dove r1 ed r2 sono i rapporti di reattività relativa e rappresentano le velocità relative di addizione (al centro attivo) del monomero corrispondente al centro attivo rispetto all’altro monomero. Ponendo
[ ]
[ ]
n M d M d 2 1 = e[ ]
[ ]
M x M 2 1 = si ottiene: 2 1 r x 1 x r x n + + =Tale equazione consente di calcolare la composizione istantanea
[ ]
[ ]
⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ 2 1 M d M d del copolimero che trae origine da una miscela di monomeri di cui siano noti il rapporto delle concentrazioni[ ]
[ ]
⎟⎟⎠⎞ ⎜⎜ ⎝ ⎛ 2 1 M Me i rapporti di reattività monomerica (r1 ed r2). La sua applicabilità è generale e prescinde dal tipo di iniziatore e dalla sua natura, sia essa radicalica oppure ionica.
Le copolimerizzazioni a catena possono essere suddivise in tre categorie in base al valore assunto dal prodotto tra i rapporti di reattività:
- se r1⋅ r2 = 1 si ha la copolimerizzazione “ideale”: i due monomeri mostrano la stessa reattività verso i due centri attivi e si ottiene un polimero casuale (random);
- se r1 ⋅r2<1si ha la copolimerizzazione “alternata”: ogni centro attivo preferisce
sommarsi all’altro monomero: in particolare, per r1=r2 si ottiene un polimero alternato perfetto;
- se r1⋅r2>1 si ha la copolimerizzazione “a blocchi”: ciascun centro attivo
2.1.2 Sintesi degli omopolimeri
E’ stata condotta l’omopolimerizzazione dei monomeri VBC e tBS mediante polimerizzazione radicalica in massa a 70 °C per 30 min, in presenza di α,α’-azobisisobutirronitrile (AIBN) come iniziatore radicalico, in percentuale molare dell’1%.
Il PtBS è stato utilizzato solo come materiale di riferimento, mentre con il PVBC è stata tentata anche la preparazione di un film sottile mediante deposizione su capsula di Petri di vetro ed evaporazione del solvente. Il film ottenuto è risultato però troppo fragile e vetroso.
2.1.3 Sintesi dei copolimeri
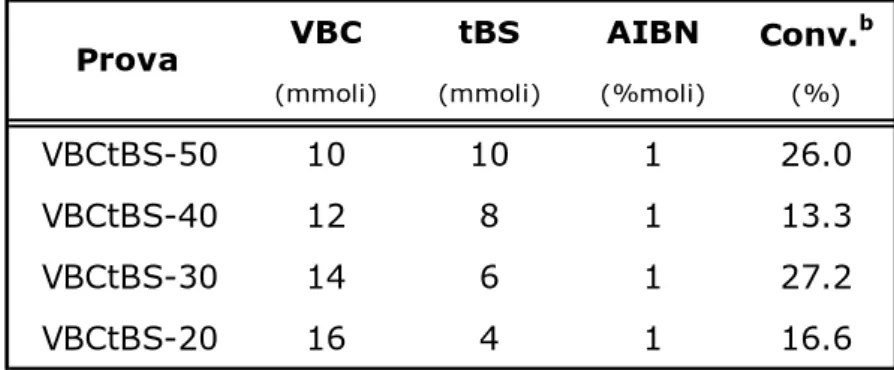
Le prove di copolimerizzazione tra VBC e tBS sono state condotte mediante reazione radicalica in massa a 70 °C per 30 min, in presenza dell’1% in moli di AIBN come iniziatore radicalico. Le diverse prove eseguite sono riassunte in Tabella 2.1.1. Si sono effettuate prove a bassa concentrazione per realizzare una distribuzione omogenea dei due comonomeri nelle catene polimeriche.
Tabella 2.1.1 Copolimerizzazione radicalica in massa di VBC con tBS in presenza di AIBNa
VBC tBS AIBN Conv.b
(mmoli) (mmoli) (%moli) (%)
VBCtBS-50 10 10 1 26.0 VBCtBS-40 12 8 1 13.3 VBCtBS-30 14 6 1 27.2 VBCtBS-20 16 4 1 16.6 a Per 30 min. a 70o C b
Calcolata come (peso polimero/peso monomero)*100
Prove di solubilità hanno mostrato che tutti i campioni polimerici sintetizzati sono solubili in cloroformio a temperatura ambiente. Tutti i composti sono stati caratterizzati mediante spettroscopia FT-IR ed 1H-NMR, analisi elementare, calorimetrica differenziale a scansione (DSC) e termogravimetrica (TGA), e cromatografia di permeazione su gel (GPC).
2.1.4 Caratterizzazione degli omopolimeri e dei copolimeri
2.1.4.1 Caratterizzazione spettroscopica FT-IR
Attraverso un’analisi qualitativa dei due omopolimeri sono state messe in evidenza le frequenze di assorbimento dei gruppi funzionali presenti in ciascun omopolimero (Figura 2.1.1 e Figura 2.1.2) che verranno poi utilizzate per il riconoscimento delle bande relative ai prodotti di copolimerizzazione.
4000 3500 3000 2500 2000 1500 1000 500 1445 2920 830 675 Ass o rbanz a Numeri d'onda (cm-1) 1265
4000 3500 3000 2500 2000 1500 1000 500 0.0 0.2 0.4 0.6 0.8 1.0 830 1463 1363 2868 2963 A sso rba n za Numeri d'onda (cm-1)
Figura 2.1.2 Spettro FT-IR del poli(terz-butilstirene) (PtBS)
Nello spettro FT-IR relativo all’omopolimero PVBC si possono osservare le due bande che caratterizzano il gruppo clorometilenico: a 1265 cm-1 (δ
w CH2-Cl) e a 675 cm-1(ν C-Cl). Nello spettro invece relativo all’omopolimero PtBS si possono osservare le tre bande che sono riconducibili al gruppo terz-butilico: a 2963 cm-1 (ν
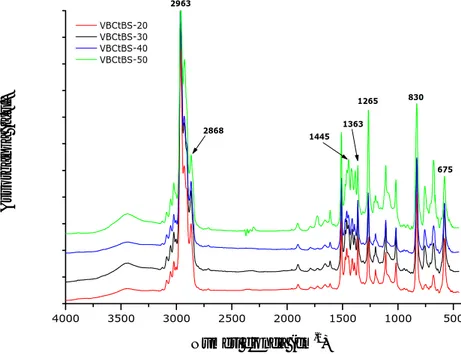
as CH3 terz-butilici), a 2868 cm-1 (ν s -CH3 terz-butilici) e a 1363 cm-1 (δs -CH3 terz-butilici). 4000 3500 3000 2500 2000 1500 1000 500 1445 2963 2868 1363 675 830 1265 VBCtBS-20 VBCtBS-30 VBCtBS-40 VBCtBS-50 A ssorban z a (a. u .) Numeri d'onda (cm-1)
Figura 2.1.3 Spettro FT-IR dei prodotti di copolimerizzazione (VBCtBS) ottenuti partendo da miscele a
Gli spettri FT-IR dei prodotti di copolimerizzazione (Figura 2.1.3) mostrano le bande attribuibili ad entrambi gli omopolimeri dei corrispondenti comonomeri di partenza (Figura 2.1.1 e Figura 2.1.2). In particolare, negli spettri di tutti i prodotti esaminati sono presenti sia le bande a 1265 cm-1 e 675 cm-1, relative al gruppo CH
2-Cl dell’unità VBC, che quelle a 2963 cm-1, 2868 cm-1 e 1363 cm-1, relative al gruppo terz-butilico dell’unità tBS. Inoltre, il picco a 1250 cm-1, relativo al cloruro di metile (ν CH
2-Cl), mostra un’intensità crescente al crescere della percentuale di VBC nel copolimero.
2.1.4.2 Determinazione dei pesi molecolari
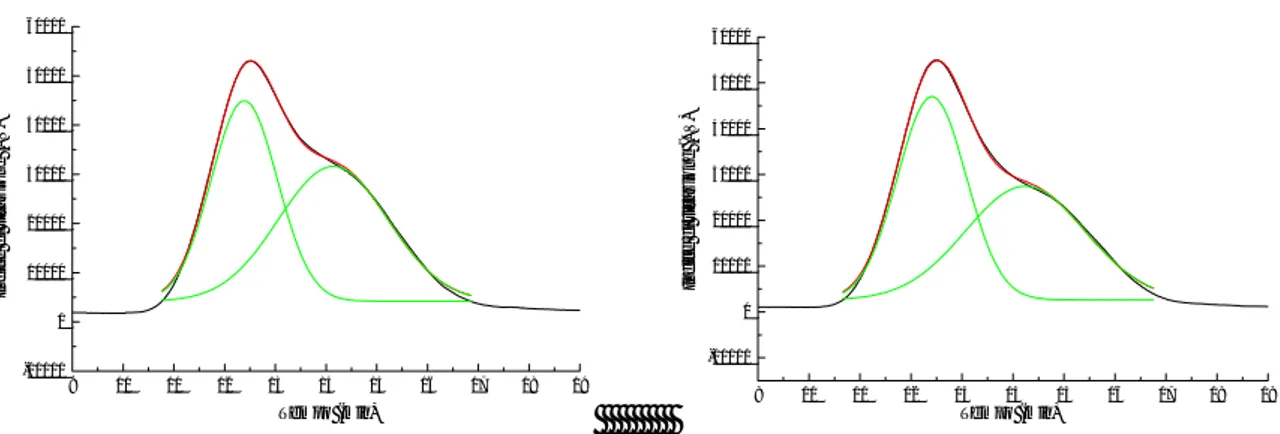
I pesi molecolari dei prodotti polimerici ottenuti sono stati determinati mediante cromatografia di permeazione su gel (GPC) in cloroformio. L’omopolimero PVBC e i prodotti ottenuti dalla polimerizzazione condotta con il 50, 30 e 20% di monomero VBC in alimentazione hanno mostrato una distribuzione bimodale su cui è stata effettuata un’analisi di deconvoluzione (Figura2.1.4 e Figura 2.1.5).
9 10 11 12 13 14 15 16 17 18 19 -40000 -20000 0 20000 40000 60000 80000 In d ic e d i ri fra z io n e ( µ V) Tempo (min) 9 10 11 12 13 14 15 16 17 18 19 -10000 0 10000 20000 30000 40000 50000 In d ice d i ri fra z io n e ( µ V) Tempo (min)
Figura2.1.4 Cromatogramma GPC del PVBC (sinistra) e del prodotto VBCtBS-20 (destra) con le relative
curve di deconvoluzione
L’andamento bimodale mostrato dal cromatogramma GPC dell’omopolimero PVBC (Figura2.1.4) indica la presenza di catene polimeriche aventi due distribuzioni dei pesi
molecolari differenti (di un fattore 10). Tale differente distribuzione può essere ad esempio ricondotta a probabili reazioni di trasferimento che possono generare anomalie strutturali ed un abbattimento dei pesi molecolari61.
9 10 11 12 13 14 15 16 17 18 19 -10000 0 10000 20000 30000 40000 50000 60000 Indic e di r if ra z ion e ( µ V) Tempo (min) 9 10 11 12 13 14 15 16 17 18 19 -10000 0 10000 20000 30000 40000 50000 60000 In di c e di r if ra z ione ( µ V) Tempo (min)
Figura 2.1.5 Cromatogramma GPC di VBCtBS-30 (sinistra) e di VBCtBS-50 (destra) con le relative curve di
deconvoluzione
L’andamento bimodale dei prodotti di copolimerizzazione (Figura2.1.4 e Figura 2.1.5) potrebbero anche suggerire la presenza di una miscela dei due omopolimeri o di uno di essi (o entrambi) con una frazione di copolimero VBC-co-tBS. Inoltre, conducendo la reazione di polimerizzazione ad una temperatura di 70 °C potrebbero essere stata promossa la formazione di catene polimeriche a basso peso molecolare, dell’ordine di 5 kDa.
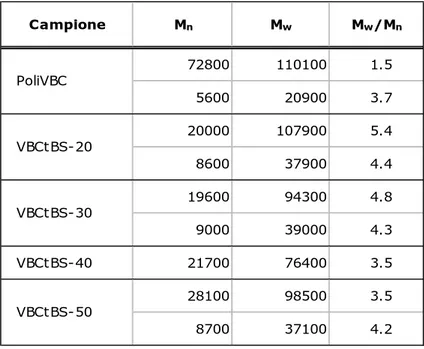
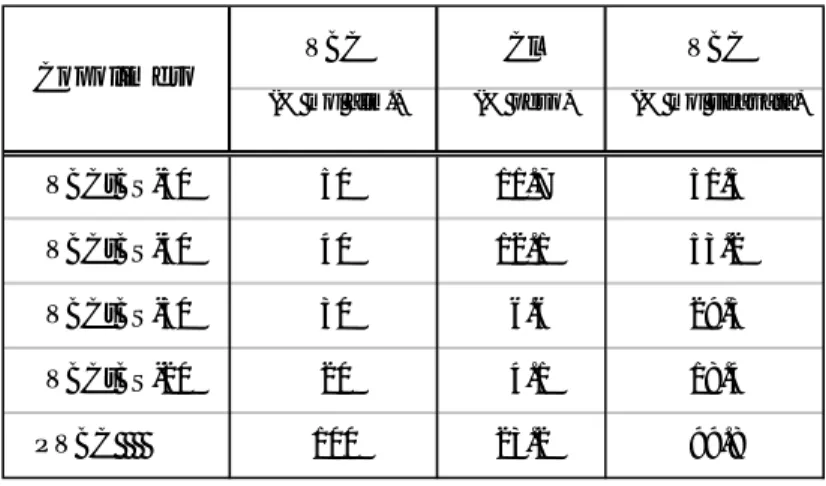
I valori sperimentali dei pesi molecolari ricavati dalle analisi di deconvoluzione sono riassunti nella Tabella 2.1.2. Come si può notare l’introduzione di unità tBS comporta un allargamento della polidispersità, dovuto principalmente ad una diminuzione del peso molecolare medio numerale Mn.
Tabella 2.1.2 Pesi molecolari medi dei campioni polimerici sintetizzati e relativa dispersione, determinati mediante analisi GPC in cloroformio e deconvoluzione.
Campione Mn Mw Mw/Mn 72800 110100 1.5 5600 20900 3.7 20000 107900 5.4 8600 37900 4.4 19600 94300 4.8 9000 39000 4.3 VBCtBS-40 21700 76400 3.5 28100 98500 3.5 8700 37100 4.2 PoliVBC VBCtBS-20 VBCtBS-30 VBCtBS-50
2.1.4.3 Determinazione della composizione dei prodotti di copolimerizzazione
La composizione dei prodotti ottenuti dalla reazione di polimerizzazione radicalica tra il VBC e il tBS è stata ricavata attraverso l’uso dell’analisi elementare e della spettroscopia 1H-NMR.
Analisi Elementare
L’analisi elementare è stata condotta per indagare la quantità di cloro contenuta nei campioni; da tale valore si è poi risaliti alla percentuale di unità monomeriche di VBC mediante la seguente espressione:
100 PA PM PM Cl 100 PA PM moli VBC Cl VBC tBS Cl tBS ⋅ ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ − + ⋅ = % ) ( %
dove:
PMtBS = peso molecolare dell’unità tBS PMVBC= peso molecolare dell’unità VBC PACl = peso atomico del cloro
Nella
Tabella 2.1.3 vengono riportate le percentuali di cloro determinate dall’analisi elementare e le corrispondenti percentuali di unità VBC rilevate nei campioni .
Tabella 2.1.3 Composizione dei copolimeri ricavata dai dati dell’analisi elementare
VBC Cl VBC
(% mol alim.) (% peso) (% mol ricavata)
VBCtBS-50 50 11.7 51.5 VBCtBS-40 40 12.1 53.2 VBCtBS-30 30 6.6 29.3 VBCtBS-20 20 4.1 18.4 PVBC 100 23.2 99.8 Copolimero
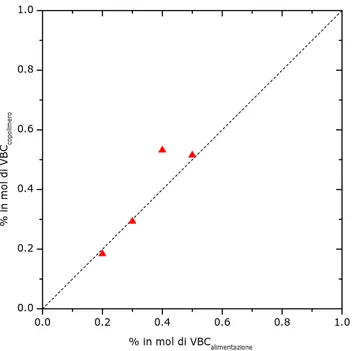
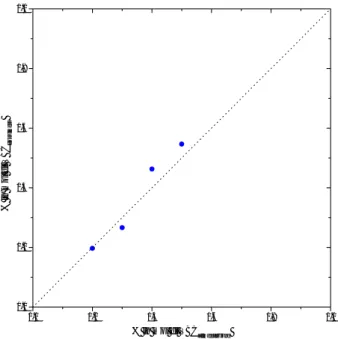
In Figura 2.1.6 vengono riportate le composizioni molari dei prodotti di copolimerizzazione, ricavate dall’analisi elementare, in funzione della composizione delle corrispondenti miscele di alimentazione. Tranne che per il campione VBCtBS-40, la percentuale di VBC riscontrata nei prodotti VBCtBS corrisponde a quella utilizzata in alimentazione.
0.0 0.2 0.4 0.6 0.8 1.0 0.0 0.2 0.4 0.6 0.8 1.0 % in m ol d i VB Cco pol imer o % in mol di VBCalimentazione
Figura 2.1.6 Percentuale di unità VBC nei prodotti vs la percentuale di monomero VBC nelle corrispondenti
miscele di alimentazione (dai dati dell’analisi elementare)
Analisi spettroscopica 1H-NMR
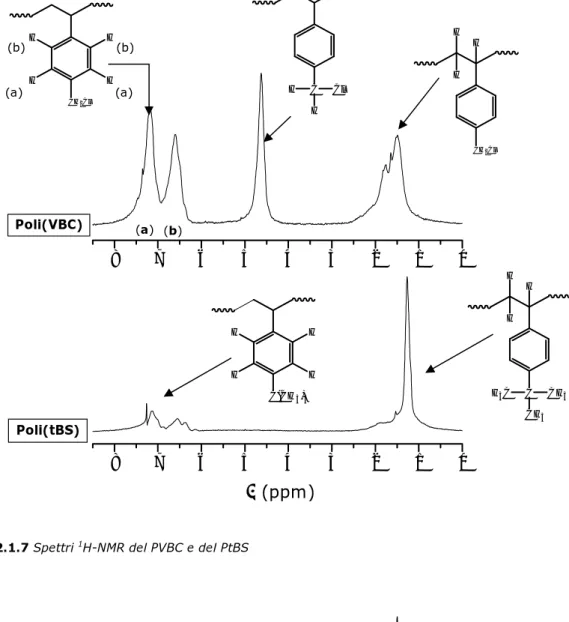
Negli spettri 1H-NMR degli omopolimeri PVBC e PtBS (Figura 2.1.7) sono presenti due gruppi di segnali nella zona compresa tra 0 e 3 ppm e tra 6 e 8 ppm relativi rispettivamente agli idrogeni idrocarburici e a quelli benzenici. Il PVBC presenta inoltre un netto segnale intorno a 4 ppm relativo ai due idrogeni del gruppo clorometilenico. Gli spettri 1H-NMR dei prodotti di copolimerizzazione mostrano la presenza di segnali attribuibili ad entrambe le unità monomeriche (Figura 2.1.8). Si può notare inoltre che, come prevedibile, all’aumentare del contenuto di unità VBC aumenta l’intensità del segnale a 4.5 ppm, relativo agli idrogeni clorometilenici (Figura 2.1.9).
Figura 2.1.7 Spettri 1H-NMR del PVBC e del PtBS
9 8 7 6 5 4 3 2 1 0
δ (ppm)
Figura 2.1.8 Spettro 1H-NMR del composto VBCtBS-30
8 7 6 5 4 3 2 1 0
δ
(ppm) Poli(tBS) 8 7 6 5 4 3 2 1 0 Poli(VBC) C H Cl H CH2Cl H H H H CH2Cl H H H C H H H CH3 H3C CH3 C(CH3)3 H H H H (a) (a) (b) (b) (a) (b)5.0 4.5 4.0 Poli(VBC-co-tBS)20% Poli(VBC-co-tBS)30% Poli(VBC-co-tBS)40% Poli(VBC-co-tBS)50% δ (ppm)
Figura 2.1.9 Spettri 1H-NMR normalizzati nella regione dei protoni clorobenzilici dei campioni di
poli(VBC-co-tBS) a diversa composizione chimica.
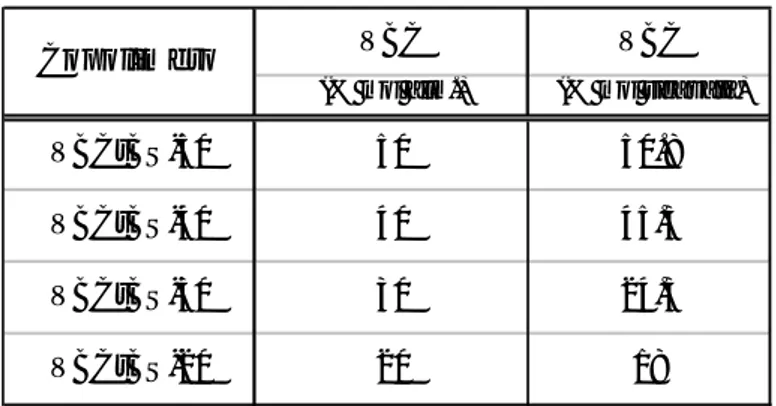
Dalle aree integrate dei segnali relativi alle due diverse unità monomeriche presenti nei prodotti di copolimerizzazione, sia pure nei limiti della sensibilità strumentale, sono state calcolate le composizioni chimiche dei diversi campioni (Tabella 2.1.4).
Tabella 2.1.4 Composizione dei copolimeri ricavata dai dati dell’1H-NMR
VBC VBC
(% mol alim.) (% mol ricavata)
VBCtBS-50 50 50.8
VBCtBS-40 40 45.3
VBCtBS-30 30 24.3
VBCtBS-20 20 18
Copolimero
La percentuale di unità monomeriche VBC è stata calcolata mediante la formula:
2 A 16 7 2 A A 2 A 100 VBC % 1 1 2 1 (mol) + ⎟ ⎟ ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎜ ⎜ ⎝ ⎛ − ⋅ ⋅ = copolimero dove:
A1 = area del picco relativo ai due protoni del gruppo –CH2Cl
La composizione dei composti analizzati calcolata mediante i dati 1H-NMR risulta sostanzialmente in accordo con quella calcolata attraverso i dati dell’analisi elementare. Anche attraverso questa indagine si può infatti constatare che la composizione dei prodotti di reazione nei due comonomeri corrisponde all’incirca a quella delle corrispondenti miscele di alimentazione (Figura 2.1.10).
0.0 0.2 0.4 0.6 0.8 1.0 0.0 0.2 0.4 0.6 0.8 1.0 % in mo l d i VB Cco p o lim e ro % in mol di VBCalimentazione
Figura 2.1.10 Percentuale di unità VBC nei prodotti VBCtBS vs la percentuale di monomero VBC nelle
corrispondenti miscele di alimentazione (dai dati 1H- NMR).
2.1.4.4 Determinazione dei rapporti di reattività di VBC e tBS
L’indagine condotta sui prodotti di copolimerizzazione mediante analisi elementare e 1H-NMR è stata in grado di determinare soltanto il contenuto dei due comonomeri, ma non ha fornito sufficienti indicazioni sull’effettiva presenza di un copolimero tra il VBC ed il tBS. Pur tuttavia, con i valori di composizione calcolati sono stati ricavati i rapporti di reattività della coppia di comonomeri (r1 e r2) mediante il metodo di Kelen e
Tale metodo si basa sulla regressione lineare dei dati sperimentali mediante l’equazione:
(
r1+r2/a)
⋅ζ−r2/a =η [1.1]
dove a è un parametro ricavato dai dati sperimentali ed η e ξ sono variabili correlabili rispettivamente alla composizione dei monomeri nel copolimero e nell’alimentazione. I rapporti di reattività vengono quindi calcolati dai valori delle intercette tra la retta [1.1] e le rette ξ = 0 e ξ = 1, mediante le relazioni:
) (0
r1 =η r2 =−η(1)⋅a
Calcolo dei rapporti di reattività dai dati dell’Analisi Elementare
Utilizzando i dati di composizione ottenuti attraverso l’analisi elementare, escludendo il punto sperimentale relativo alla prova VBCtBS40 che sembra discostarsi in modo rilevante dagli altri punti sperimentali (Figura 2.1.11), è stata ricavata la seguente equazione del fit lineare:
738 0 007 2. ⋅ζ− . = η da cui si ricava: rtBS =1.3 e rVBC =1.4 0.3 0.4 0.5 0.6 0.7 0.0 0.2 0.4 0.6 ξ η
Figura 2.1.11 Grafico di Kelen-Tudos del sistema VBC/tBS dai dati di composizione ricavati dall’analisi
Calcolo dei rapporti di reattività dai dati 1H-NMR
L’equazione del fit lineare (Figura 2.1.12), ricavato dai dati sperimentali dell’1H-NMR, è la seguente: 699 0 882 1. ⋅ζ− . = η da cui si ricava: rtBS=1.2 e rVBC=1.6 0.35 0.40 0.45 0.50 0.55 0.60 0.65 -0.1 0.0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 η ξ
Figura 2.1.12 Grafico di Kelen-Tudos del sistema VBC/tBS dai dati di composizione ricavati dall’analisi NMR
I valori dei rapporti di reattività r1 e r2, calcolati sia sulla base dei dati dell’analisi elementare che su quelli dell’1H-NMR, indicherebbero che qualora i prodotti della polimerizzazione fossero effettivamente dei copolimeri, essi sarebbero di tipo casuale in quanto risulta essere r1⋅r2 > 1. In particolare, entrambe le tecniche d’indagine portano a valori di rtBS < rVBC, ma entrambi >1, il che indicherebbe una maggiore tendenza del VBC a formare dei blocchi rispetto al tBS.
2.1.4.5 Analisi termiche
Le caratteristiche termiche del composto VBCtBS-50 e degli omopolimeri PVBC e PtBS sono state indagate mediante analisi termogravimetrica (TGA) e calorimetria differenziale a scansione (DSC).
Analisi termogravimetrica (TGA)
Le analisi termogravimetriche dei prodotti della copolimerizzazione e degli omopolimeri preparati sono state effettuate tra 25 e 700 °C ad una velocità di scansione di 10 °C/min, in atmosfera d’azoto.
Tabella 2.1.5 Valori dei paramentri termogravimetrici degli omopolimeri e del copolimero VBCtBS-50
Nella Tabella 2.1.5 vengono riportati i valori delle temperature di inizio decomposizione (Td), quelli delle temperature corrispondenti alla massima variazione istantanea di perdita in peso per ciascuno stadio di decomposizione (Ti), quelli delle perdite percentuali in peso associate ad ogni stadio di decomposizione (∆Wi) ed il residuo a 700 °C/Wr. Nella Figura 2.1.13 viene riportato il tracciato termogravimetrico dei polimeri indagati.
VBC Td T1 ∆W1 T2 ∆W2 T3 ∆W3 Wr (% moli) (oC) (oC) (% ) (oC) (% ) (oC) (% ) (% ) PVBC 100 320 382 27.8 470 24.4 522 8.6 39.2 VBCtBS-50 50 330 403 16.7 438 27.9 515 37.7 17.7 PtBS 0 365 424 98.7 1.3 Campione
0 100 200 300 400 500 600 700 800 0 20 40 60 80 100 Pe so ( % ) Temperatura (oC) poli(tBS) poli(VBC) poli(VBC-co-tBS)-50%
Figura 2.1.13 Curve TGA del PVBC, del PtBS e del copolimero VBCtBS-50
Dai dati riassunti in Tabella 2.1.5 si può osservare che l’omopolimero PtBS presenta una maggiore stabilità termica rispetto al PVBC e degrada completamente, in un unico stadio, con un residuo a 700 °C molto prossimo a zero (∼1%). La degradazione termica dell’omopolimero PVBC, invece, avviene in due stadi: il primo a circa 320 °C, con una perdita in peso di circa il 28%, e il secondo a circa 520 °C, con una perdita in peso totale di circa il 60%. Tale andamento risulta in accordo con quello riportato in letteratura64, dove viene ipotizzato un meccanismo di degradazione che porta alla formazione di HCl.
La degradazione termica del composto VBCtBS-50, ottenuto dalla polimerizzazione di una miscela equimolecolare dei due comonomeri, sembra seguire un andamento intermedio rispetto a quello degli omopolimeri.
In base ai risultati ottenuti da questa indagine, risulta che i polimeri analizzati sono potenzialmente utilizzabili in applicazioni tipo membrana per celle a combustibile, in quanto la loro temperatura di degradazione risulta ben al di sopra di 200 °C.
Analisi Calorimetrica Differenziale a Scansione (DSC)
Gli omopolimeri PVBC e PtBS e il composto VBCtBS-50 sono stati sottoposti ad un ciclo di riscaldamento-raffreddamento-riscaldamento, nell’intervallo di temperatura 25-200 °C, ad una velocità di 10 °C/min, per avvicinarsi alle condizioni di equilibrio termico. I dati analizzati si riferiscono solo alla seconda fase di riscaldamento, in quanto le proprietà termiche iniziali sono strettamente dipendenti dai vari trattamenti a cui i campioni sono stati sottoposti.
Come si può osservare dai dati riportati sul termogramma in Figura 2.1.14, entrambi gli omopolimeri mostrano un valore di temperatura di transizione vetrosa (Tg) che li caratterizza come materiali di tipo vetroso. In particolare, il PtBS ha un valore della Tg di circa 40 °C maggiore rispetto a quello del PVBC a causa della presenza del gruppo
terz-butilico ad elevato ingombro sterico.
40 60 80 100 120 140 160 180 200 -0.25 -0.20 -0.15 -0.10 -0.05 0.00 0.05 0.10 Tg= 146oC Tg= 101oC Tg= 119oC Poli(VBC-co-tBS)-50 Poli(tBS) Poli(VBC) Fl u sso di ca lor e (W /g) Temperatura (o C)
Figura 2.1.14 Termogramma DSC di PVBC, PtBS, del composto VBCtBS-50 e rispettivi valori della Tg
(midpoint)
Sul termogramma DSC del PVBC sembrerebbe esserci un secondo valore di Tg intorno ai 115 oC, circa 15 oC superiore rispetto al valore di 101 oC, che potrebbe
risultare coerente con la presenza di una miscela di omopolimeri aventi due pesi molecolari molto diversi (di un fattore pari a 10).
Risulta, comunque, che il composto VBCtBS-50, ottenuto dalla polimerizzazione di una miscela equimolecolare di VBC e tBS, mostra un solo valore di Tg che potrebbe indicare, nel caso di un copolimero, una struttura molecolare in cui non vi sono blocchi distinti e definiti delle due unità.
Provando comunque a confrontare il valore sperimentale della Tg con quello calcolato teoricamente si è riscontrata una perfetta concordanza. Il valore teorico è stato ricavato dall’equazione di Fox65 per i copolimeri ideali:
dove WVBC, WtBS, Tg(VBC) e Tg(tBS) sono rispettivamente le percentuali in peso e le temperature di transizione vetrosa dei due omopolimeri. Inserendo, infatti, nell’equazione di Fox i seguenti valori sperimentali:
WVBC = 49.8% WtBS = 50.2% Tg(VBC) = 101.4 °C Tg(tBS) = 145.6 °C
si ottiene il seguente valore teorico della Tg per il copolimero corrispondente: Tg(VBCtBS-50) = 119.6 °C
Se si trattasse effettivamente di un copolimero, il composto VBCtBS-50 rappresenterebbe un copolimero ideale, ma potrebbe invece trattarsi, con maggiori probabilità, di una miscela dei due omopolimeri.
100 1 T W T W T 1 g(tBS) tBS g(VBC) VBC g ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ + =
2.1.5 Amminazione quaternaria delle unità VBC nei copolimeri
L’omopolimero PVBC ed il composto VBCtBS-50 sono stati fatti reagire in una soluzione di dimetilformammide (DMF) con un eccesso molare di 1,4-diazabiciclo[2.2.2]ottano (Dabco) (1:1,5 in moli) allo scopo di promuovere la reazione tra il gruppo amminico della base e quello clorobenzilico del prodotto polimerico, in accordo con lo schema rappresentato in Figura 2.1.15. La scelta dell’ammina è stata rivolta nei confronti della Dabco sia per la sua elevata reattività che per valutare le sue capacità di reticolazione. In molti casi, infatti, una reticolazione può migliorare la stabilità termo-meccanica del materiale.
CH2 CH CH2 CH CH2Cl CH3 C CH3 CH3 CH2 CH CH2 CH C(CH3)3 NN CH2 CH CH2 CH C(CH3)3 Cl -Cl -x y Dabco DMF, 80 °C 2-3 ore x y x y
Figura 2.1.15 Reazione di amminazione quaternaria delle unità clorobenziliche del VBC con la Dabco
La reazione è stata condotta per 2-3 h a 60 °C, poi la soluzione è stata versata in una capsula di Petri e messa ad asciugare in una stufa a 80 °C per una notte. Il film ottenuto dopo la completa evaporazione del solvente, si è presentato con una elevata fragilità, evidenziata da numerose crepe lungo il bordo esterno (Figura 2.1.16).
L’aggiunta di acqua, necessaria per il distacco del film dalla capsula, ha confermato la fragilità del film stesso (Figura 2.1.17).
Figura 2.1.16 Film di VBCtBS-50 dopo reazione con Dabco e evaporazione del solvente
Figura 2.1.17 Film di VBCtBS-50 dopo aggiunta di acqua
2.1.5.1 Amminazione con Dabco in presenza di benzil cloruro (BzCl)
Il metodo di preparazione impiegato, consistente nell’ottenimento di film per evaporazione del solvente di soluzioni di polimero, non è stato in grado di generare strutture meccanicamente stabili a causa, molto probabilmente, dell’elevata densità di reticolazione del polimero indotta dalla Dabco. Allo scopo di limitare tale densità, pur
mantenendo lo stesso numero di siti in grado di essere convertiti in funzionalità a conduzione anionica, il campione VBCtBS-40 è stato amminato in DMF con la Dabco in presenza di una precisa quantità di cloruro di benzile (BzCl).
Il cloruro di benzile ha lo scopo di:
• entrare in competizione con i gruppi clorometilenici del polimero, riducendo così il grado di reticolazione della struttura macromolecolare finale senza limitare il numero dei siti ionici;
• quaternizzare la Dabco, introducendo così cariche positive capaci della conduzione ionica;
• abbassare la Tg del film finale a causa del suo basso peso molecolare; la sua presenza avrebbe quindi la funzione di plastificante.
Il cloruro di benzile è stato aggiunto assieme alla Dabco in un rapporto molare 1:1, mantenendo l’eccesso molare di Dabco rispetto alle unità clorobenziliche inalterato (1:1,5 in moli). Il film ottenuto per evaporazione del solvente e asciugato in stufa a 80 °C per una notte (Figura 2.1.18), è risultato molto meno fragile e più omogeneo di quello ottenuto senza l’aggiunta del cloruro di benzile (Figura 2.1.17). Inoltre, ricoprendo il film con acqua si è ottenuto rigonfiamento e distacco dalla superficie di vetro della capsula di Petri.
Sul film trattato con la Dabco in MeOH in presenza di BzCl è stata condotta un’indagine FT-IR. Allo scopo di effettuare un’identificazione più dettagliata delle bande registrate, e stabilire quindi l’avvenuta funzionalizzazione o meno dei gruppi clorometilenici del VBC, sono stati preparati dei sali della Dabco con il cloruro di benzile. In particolare sono stati utilizzati due diversi rapporti molari: 1:1 per ottenere il sale “mono” e 1:2 per ottenere il sale “bis” (Figura 2.1.19).
Su entrambi i sali sono stati registrati degli spettri FT-IR per identificare le bande riconducibili alla presenza dei gruppi d’ammonio quaternari della Dabco mediante confronto con lo spettro FT-IR dell’ammina terziaria.
CH2Cl N N Cl Cl CH2 H2C N N DMF CH2Cl N N Cl DMF CH2 N N +
Cloruro di benzile Dabco
2 BzBisDab + Cloruro di benzile BzMonoDab Dabco
1800 1600 1400 1200 1000 800 600 400 1157 1057 1313 1455 Assor banz a (u. a .) Numeri d'onda (cm-1) DABCO
Figura 2.1.20 Spettro FT-IR della Dabco
1800 1600 1400 1200 1000 800 600 400 BzCl-Dabco-sale MONO BzCl-Dabco-sale BIS 1186 1090 1067 1057 1073 1313 1455 Asso rb an z a (u .a.) Numeri d'onda (cm-1)
Figura 2.1.21 Spettro FT-IR dei sali MONO e BIS tra la Dabco e il BzCl
Nello spettro FT-IR della Dabco, nella zona compresa tra 1800 e 400 cm-1 (Figura 2.1.20), risultano di particolare rilevanza le bande che cadono a 1157 e 1057 cm-1, relative allo stiramento del legame C-N e quelle a 1454 e 1313 cm-1 relative alla deformazione dei legami N-C-H. Risulta infatti dalla letteratura66, che a seguito della
formazione di un sale d’ammonio quaternario, nello spettro FT-IR la Dabco si possono rilevare due nuove bande tra quelle a 1455 e 1313 cm-1. Negli spettri FT-IR registrati sui due sali (mono e bis) della Dabco con il cloruro di benzile (Figura 2.1.21) sono effettivamente stati riscontrati tali nuovi assorbimenti, visibili in corrispondenza delle frecce blu. Si nota, inoltre, che passando dal sale mono a quello bis le bande relative al legame C-N, 1057 e 1186 cm-1 non sono più presenti. Ciò sembra essere in accordo con il fatto che nel sale bis entrambi gli atomi di azoto sono stati convertiti in sale d’ammonio quaternario. La presenza di soli atomi di azoto positivi potrebbe essere correlabile alle due bande osservabili a 1090 e 1067 cm-1 nello spettro del sale bis. Tali bande potrebbero corrispondere ad uno spostamento di quelle a 1057 e 1073 cm-1 del sale mono verso frequenze più alte per effetto della presenza di una carica positiva sul legame C-N.
1800 1600 1400 1200 1000 800 600 400 1265 1265 1460 1313 1185 1073 1058 VBCtBS40 VBCtBS40-Dabco-BzCl As s o rb a n z a ( u .a .) Numeri d'onda (cm-1)
Figura 2.1.22 Spettro FT-IT del composto VBCtBS-40 prima e dopo amminazione con la Dabco in presenza
di BzCl
Sullo spettro del composto VBCtBS-40 si possono individuare alcune nuove bande rivelate dopo il trattamento con la Dabco in presenza di BzCl (Figura 2.1.22). In particolare, risultano interessanti le bande a 1460, 1313, 1185, 1073 e a 1058 cm-1.
il cloruro di benzile, si potrebbe ipotizzare che tali assorbimenti siano riconducibili alla presenza di un sale di tipo “mono”.
Oltre alla presenza di nuove bande, nello spettro di VBCtBS-40 trattato con Dabco e BzCl si può riscontrare che la banda relativa alla deformazione del legame CH2-Cl (1265 cm-1) è sempre presente ed ha intensità paragonabile a quella rilevata sul film non trattatato: ciò potrebbe essere dovuto alla presenza di un eccesso, rispetto alla Dabco, di gruppi clorometilenici del cloruro di benzile o delle unità VBC.
Dopo essere stato caratterizzato mediante spettroscopia FT-IR, il film ottenuto dalla reazione di amminazione con la Dabco è stato condizionato per una notte mediante aggiunta di una soluzione di KOH 1M. La soluzione basica ha lo scopo di sostituire i controioni Cl- della membrana polimerica con quelli OH-, responsabili della conduzione anionica.
Purtroppo la procedura di condizionamento ha reso il film altamente fragile (Figura 2.1.23) e quindi impossibile la sua caratterizzazione come membrana.
Figura 2.1.23 Film di VBCtBS-40 amminato in DMF con la Dabco in presenza di BzCl dopo condizionamento
in KOH
Alla luce dei risultati riportati nel presente capitolo, non siamo in grado di confermare l’ottenimento di copolimeri tra il VBC e il tBS dalla polimerizzazione radicalica in massa condotta a 70 oC. Occorrerebbero infatti ulteriori verifiche per escludere l’ipotesi, già
avanzata in precedenza, secondo cui dalla polimerizzazione radicalica si è ottenuta una miscela dei due omopolimeri. Al momento, quindi, l’unica osservazione che si può trarre da quest’indagine è che la formazione di film polimerici preparati a partire da derivati amminati del PVBC o dai suoi derivati con il tBS sembra non essere la via ottimale per l’ottenimento di membrane a scambio anionico a causa dell’elevata fragilità del derivato macromolecolare.
Studi recententemente pubblicati60,67 hanno evidenziato come sia possibile eliminare il problema della fragilità del polimero ionico immobilizzando il sistema macromolecolare di PVBC all’interno di una matrice inerte di polipropilene come supporto. Nel presente lavoro di tesi, uno sviluppo in tal senso è stato condotto mescolando in soluzione il PVBC, preparato attraverso un processo di polimerizzazione radicalica, con un copolimero a blocchi stirene-butadiene-stirene (SBS) con caratteristiche di elastomero termoplastico. La preparazione dei film compositi, lo studio della loro morfologia e proprietà di conduzione saranno descritti nel capitolo seguente.