Capitolo 1 Introduzione –
1.1 cellule mesenchimali stromali e cellule progenitori mesodermali.
1.1.1 La staminalità
Si definiscono staminali le cellule che presentano due caratteristi-che fondamentali: la capacità di andare incontro a fenomeni di au-to-rinnovamento (self-renewal) e la capacità di dare origine ad una o più linee cellulari. Possono essere classificate in base al potenzia-le proliferativo e in base all’origine.
Per quanto riguarda il primo caso si possono suddividere in :
totipotenti cioè capaci di dare origine a qualsiasi tipo di cellula, si
hanno solo negli stadi pre-blastocisti;
pluripotenti non sono più in grado di sviluppare tessuti
extra-em-brionali, possono differenziare in ogni tipo di cellula dell’organi-smo, ma non dare origine ad un embrione. Si trovano nella massa interna della blastocisti (ICM);
multipotenti sono in grado di dare origine ad un numero
limita-to di tipi cellulari, si trovano in stalimita-to di embriogenesi più avanzalimita-to ma anche nell’adulto;
unipotenti capace di generare un solo tipo di cellule.
In base all’origine si dividono invece in cellule staminali
embrio-nali (ESC), provenienti cioè da tessuti embrioembrio-nali o adulte (ASC)
mi-nor potenzialità differenziatava.
1.1.2 Le cellule mesenchimali stromali
Nell’ambito delle cellule multipotenti adulte sono state individua-te ormai da molti anni le cosiddetindividua-te cellule staminali mesenchimali (mesenchymal stem cell), più recentemente rinominate come cellu-le mesenchimali (o multipotenti) stromali (mesenchymal/multipo-tent stromal cell, MSC)55.
Queste cellule sono facilmente ottenibili in vitro ed espandibili per alcuni passaggi ma la loro esistenza in vivo non è stata ancora suf-fragata da dati certi.
Benché culture di cellule mesenchimali siano state realizzate a par-tire da diversi campioni biologici come polpa dentaria, cordone om-belicale1, tessuto adiposo2, fegato3 ecc.. la fonte principale per
ot-tenere culture di MSC rimane il midollo osseo. Questo campione biologico è stato infatti il più utilizzato fin dai lavori pionieristici di Friedenstein il quale, per primo, scoprì l’esistenza di queste cellu-le. Queste inizialmente mostravano solamente una capacità osteo-genica4, lo stesso Friedenstein mise a punto il sistema che
tutt’og-gi è lo standard principale per l’identificazione delle MSC: il conto delle unità formanti colonie fibroblastoidi (colony forming unit-fi-broblasts CFU-F)5.
Le MSC appartengono alla categoria delle cellule adulte multipo-tenti, questo perché poste in adeguate condizioni di cultura posso-no differenziare in diversi tipi cellulari e soposso-no in grado di fare auto rinnovamento. È infatti ben dimostrato che le MSC possono origi-nare alcune linee mesodermali ed in particolare condrociti, adipo-citi, osteoblasti, cellule muscolari e tenociti6/7.
Nonostante siano ottenibili da campioni e tessuti molto diversi tra loro non è ancora stato rintracciata in vivo una cellula che sia chia-ramente il corrispettivo delle MSC coltivabili. Si ha quindi un pa-radosso dato che è possibile mettere in coltura, differenziare ed espandere in vitro un tipo di cellula della quale non si conosce chia-ramente l’esistenza di un corrispettivo in vivo.
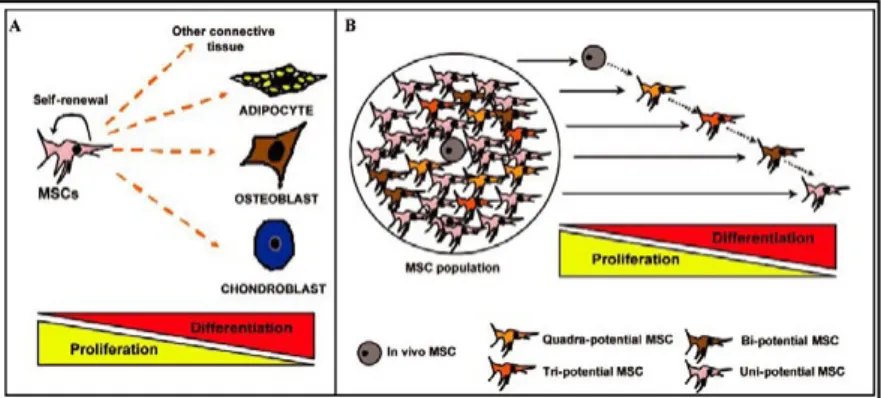
Studi intensi sono stati condotti per analizzare le varie differenzia-zioni in vitro. Esistono due possibili modelli di differenziamento delle MSC: con il primo si ipotizza che le MSC si comportino come cellule staminali capaci di fare self-renewal oppure di differenzia-re didifferenzia-rettamente a seconda degli stimoli ricevuti, il secondo modello
invece è di tipo a “cascata”, simile a quello delle cellule emopoie-tiche, con il quale si ipotizza che dalla MSC, in seguito a divisioni asimmetriche, si originino cellule più differenziate, con potenzia-le generativo e differenziativo sempre minore, che vanno a dispor-si nella colonia.
Figura 1: modelli differenziativi delle MSC: A) multipotenza diretta, B) a cascata Questa seconda teoria è suffragata dal fatto che non tutte le MSC all’interno di una colonia mostrano la stessa capacità differenzia-tiva, ad esempio alcune cellule alla periferia della colonia si dimo-strano capaci solo di differenziarsi in osteoblasti.
In particolare studi recenti8 hanno messo in risalto la possibilità che le MSC vadano incontro ad una cascata simile a quella delle cellule emopoietiche secondo lo schema riportato nelle figure.2 e 3,
dove i cinque lineage rappresentati sono: mioblasto (M), adipocita(A), cartilagine(C), osteoblasto(O), fibroblasto(F). L’etero-geneità della popolazione mesenchimale stromale è quindi uno dei principali limiti riguardanti lo studio di queste cellule, infatti non si ha mai una popolazione omogenea, quanto piuttosto una varietà di progenitori più o meno committed.
Figura 3: differenziamento a cascata
1.1.3 Isolamento e propagazione delle MSC
La possibilità di coltivare MSC partendo da diversi tessuti ha evi-denziato un’ulteriore eterogeneità in questo popolazione cellulare. Un criterio di identificazione per le MSC è la capacità di formare colonie fibroblastoidi in vitro e di differenziare inosteoblasti, adi-pociti e condrociti.
La possibilità di formare colonie è dovuta alla capacità delle cellu-le mesenchimali stromali di duplicarsi senza differenziarsi, di fare cioè self-renewal tramite divisioni simmetriche.
A livello di antigeni superficiali le cellule Mesenchimali Stami-nali sono definite dalla International Society of Cellular Therapy (ISCT)55 come cellule CD14-, CD34-, CD45- (tre tipici marcatori di
CD79a- o CD19-, HLA-DR-, CD105+ (Endoglina), CD90+
(glicopro-teina di membarana Thy-1), CD73+. Benché nessuno di questi
mar-catori sia specifico per le cellule mesenchimali un uso combinato di questi può consentire di identificare la popolazione mesenchi-male stessa.
Sta inoltre sta emergendo il ruolo del marcatore SSEA-49,
stori-camente considerata una glicoproteina espressa solamente in certi stadi di sviluppo embrionale, come marker per MSC poco mature e con maggiori capacità differenziative10.
Per quanto riguarda l’isolamento delle MSC esistono diverse me-todologie. Quella storicamente sviluppata per prima, ed ancora og-gi più utilizzata, è l’arricchimento della componente mononuclea-ta tramite centrifugazione su gradiente di densità del campione di midollo osseo. In alternativa possono essere effettuate selezioni po-sitive o negative, volte ad isolare le MSC tramite FACS o tramite immunoseparazione su colonnina, sfruttando anticorpi coniugati a biglie metalliche.
La frazione ottenuta viene poi seminata su plastiche trattate in ma-niera da favorire l’adesione e fatta crescere in un terreno conten-te diversi fattori di crescita. Dopo 14 giorni sarà possibile colorare con Giemsa e contare le colonie di cellule fibroblastoidi formatesi (CFU-F assay). Come già detto queste cellule devono essere capa-ci di differenziarsi almeno verso tre differenti lineage in particola-ri condizioni:
Osteoblasti: terreno con acido ascorbico, dexametasone,
β-glicerofosfato.
Adipociti: terreno con dexametasone, insulina e IBMX.
Condrociti: terreno con Transformation grow factor β1 (TGF- β1)
e acido ascorbico.
Maggiori dettagli sulle metodologie differenziative e sulla verifi-ca dell’effettivo funzionamento sono discussi nel verifi-capitolo su mate-riali e metodi.
1.1.4 Il ruolo nella nicchia
Per le MSC è stato, ormai da tempo, ipotizzato un ruolo fondamen-tale nella nicchia emopoietica.
La nicchia di una cellula staminale è l’insieme delle cellule e della matrice che la circondano e che, grazie a una serie di segnali, rego-lano il comportamento della cellula staminale stessa, mantenendo
l’omeostasi. Ad esempio la nicchia regola i fenomeni di differenzia-mento e di self-renewal.
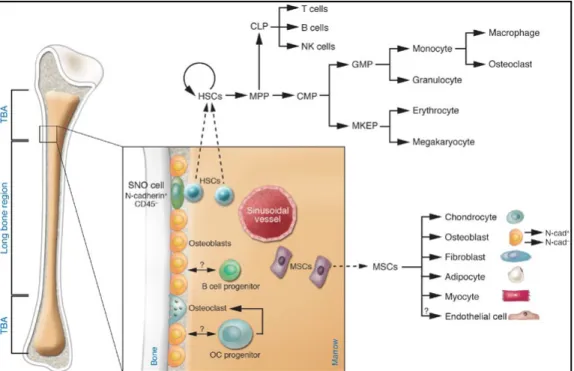
Per le cellule staminali emopoietiche (HSC) il concetto di nicchia è stato introdotto nel 1978 da Schofield11 e comprende l’ambiente
re-golativo delle HSC nel midollo osseo. Qui le HSC si trovano circon-date da cellule stromali e a contatto con due tipi diversi di ambien-te: l’endostio e i vasi sinusoidali. Entrambi gli ambienti influenzano in maniera specifica le HSC, formando così due nicchie distinte: la nicchia osteoblastica e la nicchia vascolare. Il modello attuale pre-vede che le HSC siano presenti sia nella nicchia a livello di vasi si-nusoidali, che a livello di endostio, esse sono quindi regolate da segnali provenienti da cellule endoteliali, dalle cellule stromali e dagli osteoblasti (in particolare osteoblasti N-Caderina+, CD45-)12.
Le MSC hanno come ruolo nella nella nicchia quello di supporta-re l’emopoiesi e di aumentasupporta-re l’homing delle HSC nel midollo tra-mite interazioni cellula cellula e secrezione di determinati fattori. Per quanto riguarda il supporto all’emopoiesi sono importanti alcu-ne Integrialcu-ne, CD34, CD40 e CD43 per l’adesioalcu-ne e la secrezioalcu-ne dei fattori di crescita IL6/7/8/11/12/14/15, LIF, SCF, M-CSF. Nel pro-cesso di homing sono invece importanti le Integrine per l’adesione e la secrezione di altri fattori di crescita quali SDF-113.
Secondo vari modelli anche le MSC sarebbero residenti nel midol-lo e regolate dalla stessa nicchia delle HSC e mobilizzate a formare i vari tipi di cellula di cui sono capaci.
Ovviamente nella nicchia sono fondamentali i processi di adesio-ne e di invasioadesio-ne, alcuni esempi: alti livelli di MMP9 sono asso-ciati alla mobilitazione delle HSC, la presenza di N-Caderina sugli osteoblasti è fondamentale per interagire con le HSC, mentre il le-game tra Osteopontina e Integrina β1 è fondamentale per la mobi-litazione delle HSC14, in maniera similare le molecole di adesione sono importanti per quanto riguarda la componente stromale del-la nicchia. Particodel-larmente interessante è l’andamento delle mole-cole di adesione Integrine e Caderine nelle HSC in relazione al fat-tore di trascrizione c-Myc, implicato nella proliferazione cellulare. Infatti all’aumentare del numero di molecole di adesione si ha un calo nell’attivazione di c-Myc e viceversa, in modo da avere cellu-le in divisione pronte ad essere mobilitate e cellucellu-le quiescenti anco-rate alla nicchia15.
Figura 4: La nicchia ematopoietica
1.1.5 Utilizzi clinici delle MSC
La possibilità di ottenere queste cellule multipotenti da ogni paziente ha porta-to ad ipotizzare immediatamente alcune possibili applicazioni cliniche.
Queste possono raggrupparsi principal-mente in:
Medicina rigenerativa: l’ingegneria
tis-sutale si basa classicamente sull’inseri-mento in un sito da rigenerare di un so-stegno in materiale inerte (scaffold) contenente le cellule che si attiveranno per la rigenerazione stessa.
In questo campo le cellule mesenchima-li hanno trovato largo impiego, in parti-colare abbiamo tre principali metodologie
di intervento: le MSC vengono caricate in
vitro sullo scaffold, appena aderiscono il
supporto viene impiantato;
le cellule vengono caricate sullo scaffold e messe a crescere per alcuni giorni in terreno adeguato e successivamente ven-gono impiantate;
viene impiantato uno scaffold al quale le cellule sono capaci di aderire e si lascia maturare direttamente in vivo l’impianto. Anche la sola iniezione localizzata di MSC si è dimostrata essere efficace nel migliorare sensibilmente la rigenerazione e ne esistono molti validi esempi su mo-delli animali di vario genere16.
Attività regolatoria: le MSC secernono
bioatti-ve, tra cui un gran numero di citochine, ad esempio SDF-1 e fatto-ri di crescita che possono migliorare la fatto-rigenerazione in seguito a traumi di diverso tipo.
Sono ad esempio in fase di studio o di prova su modelli anima-li esperimenti volti a valutare l’efficacia dell’inserzione di cellule MSC nel sito da rigenerare in maniere da aumentare l’efficacia del processo17.
Sempre per la loro capacità di secernere una gran quantità di fattori bioattivi e per il loro fondamentale ruolo nella nicchia emopoietica, le MSC possono avere una funzione molto importante nei trapianti di midollo osseo. Benché i meccanismi non siano ancora perfetta-mente chiari, emerge da diversi studi come le MSC abbiano un ruo-lo nell’inibire l’espansione dei linfociti T, diminuendo così la pos-sibilità dell’insorgere di una graft versus host a seguito di trapianto allogenico, grave forma di aggressione, spesso mortale, delle cellu-le immunitarie trapiantate contro l’ospite18.
Terapie cellulari: le MSC sono utilizzate, in trial a dirversi stadi
di sviluppo, come agenti effettrici di una efficace terapia cellulare. In particolare sono in corso studi a diverso livello sull’impiego del-le MSC in rapporto a molte malattie, prevadel-lentemente ossee (arti-ti, osteoporosi, ecc).
Ad esempio le MSC sono impiegate nella cura dell’Osteogenesi im-perfecta19, malattia genetica che comporta uno sviluppo della
strut-tura ossea non fisiologico.
1.1.6 Le cellule precursori mesodermali
Vista l’impossibilità di avere colture cellulari di MSC omogenee, la ricerca negli ultimi anni si è mossa alla ricerca di precursori di queste ultime, per avere cellule con caratteristiche non eterogenee, con eventuali maggiori capacità differenziative ed isolabili in vivo. Le principali popolazioni cellulari scoperte in questo campo sono: MIAMI, MAPC, VSEL.
MAPCs(multipotent adult progenitor cells). Identificate in un
la-voro pubblicato nel 2002 su Nature dal gruppo della prof. Verfai-lile sia nel midollo umano che in quello murino19. Queste celule si
mostrano positive per quanto riguarda alcuni marcatori embriona-li come Oct4, SSEA-1 e Rex1, sono capaci di differenziare in
cellu-le mesenchimali, ma anche verso tessuti ectodermali e endodermali. Se trapianta-te in blastocisti possono sviluppare tut-ti i tessutut-ti, le cellule MAPC di topo mo-strano capacità replicativa se coltivate in presenza di LIF, PDGF e EGF (fino a 120 PD), se trapiantate in vivo vanno ad ar-ricchire anche la componente emopoieti-ca midollare.
La bassa resa e l’espressione ad esempio di SSEA-1 e Rex-1 le differenziano dalle MPC.
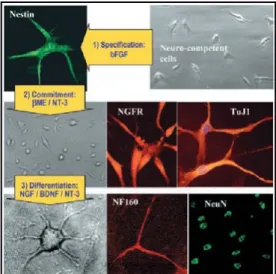
MIAMI (marrow-isolated adult mul-tilineage inducible). Isolate
inizialmen-te nel 2004 da midollo osseo umano, ri-chiedono condizioni di cultura particolari (bassa tensione di ossigeno) ed esprimono anche esse Oct4 e Rex120. Oltre alla
diffe-renziazione in cellule mesenchimali stro-mali, paiono capaci di indirizzarsi ver-so un destino neuronale esprimendo sia marcatori intrermedi (NGRFR, Tubulina J) che più terminali (NF16II, NeuN).
Figura 5: differenziamento delle MIAMI cells
Inoltre in particolari condizioni di cre-scita mostrano marcatori tipici di cellule pancreatiche senza però averne un chiaro fenotipo maturo.
Le differenti capacità proliferative e nla necessità di condizioni di cultura molto stringenti sottolineano le differenze tra MIAMI cells e MPC.
VSELs (Very small embrionic-like cells). Sono cellule isolate in midollo di
ratto con un dimensione molto piccola e molto rare. Mostrano però anche esse la capacità di generare tessuti dei diversi fo-glietti embrionali e l’espressione di Oct 4 e altri marcatori di staminalità21.
Inol-tre per questa popolazione cellulare sono stati condotti alcuni studi dove, pur non dimostrandone l’esistenza in vivo, se ne mostra la capacità ad essere mobilizzate nel sangue periferico e viene quindi pro-posta l’affascinante ipotesi che queste cel-lule possano costituire un pool di celcel-lule poco differenziate capaci di circolare tramite il sangue perifeico e di agire in caso di necessità22.
In tale contesto si inseriscono le
Meso-dermal Progenitor Cells (MPC), che si
vanno ad affiancare alle altre popolazioni cellulari descritte come precursori delle cellule mesenchimali stromali23/24. Anche
se non è perfettamente chiarito se le MPC e questi tipi di cellule siano effettivamen-te popolazioni diverse, se siano piuttosto diversi stadi di sviluppo della stesso tipo di cellule o se le loro differenze siano do-vute ad artefici generati dai differenti me-todi di cultura, è comunque certo che le MPC mostrino alcune peculiarità
rispet-to alle altre popolazioni cellulari analizzate.
Nel caso di MIAMI, MAPCS e VSEL si tratta di cellule ottenibili solo tramite complesse metodiche e difficili da mantenere, le Me-sodermal Progenitor Cells sono invece un tipo di precursore iso-labile facilmente e in maniera relativamente economica. Le MPC vengono infatti coltivate a partire dalla stessa frazione midollare arricchita in cellule mononucleate usata per le colture di MSC e, al-dilà dei diversi terreni e piastre di coltura, non richiedono partico-lari accorgimenti tecnici rispetto alla coltura di cellule mesenchi-mali stromesenchi-mali.
Queste cellule vengono isolate in terreno contenete siero umano ed appaiono morfologicamente ben distinte dalle MSC in quanto mo-strano in vitro una forma definita “a uovo fritto”, cioè arrotondate con un ispessimento citoplasmatico, il quale non necessariamente corrisponde alla zona nucleare. Tale morfologia è nettamente di-versa dalle cellule mesenchimali stromali, che mostrano invece una forma fibroblastoide, affusolata (Fig.6).
Figura 6: Coltura mista di MSC (fibroblastoidi) e MPC (rotondeggianti) Queste differenze morfologiche sono evidenziabili anche trami-te citometria a flusso, in quanto analizzando con questa trami-tecnica campioni di MPC si ottengono tipicamente valori di side scatter
maggiori rispetto alle cellule mesenchimali stromali, ad evidenzia-re una maggior granulosità citoplasmatica delle MPC rispetto al-le MSC.
A differenza delle cellule mesenchimali staminali che hanno feno-meni di self-renewal in vitro e possono propagarsi fino a un massi-mo di 50-100 PD, le MPC sono quiescenti e non vanno incontro a divisione cellulare nel loro mezzo di cultura.
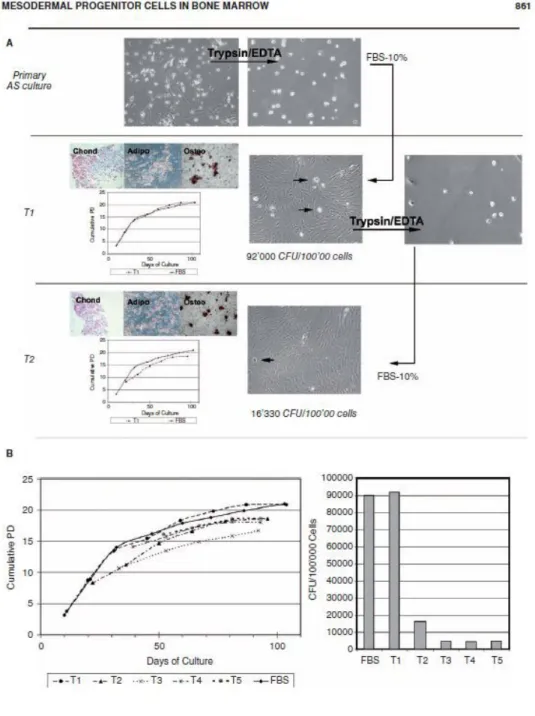
Le MPC non riescono a differenziare direttamente nei vari linea-ge mesodermali in presenza di adeguati stimoli come le cellule me-senchimali staminali, ma riescono ad andare in contro a differen-ziazione in MSC in un adeguato mezzo di cultura, successivamente sarà possibile avere un differenziamento osteogenico, adipogenico o condrogenico. Un modo per quantificare e qualificare le cellule mesenchimali stromali è quello di vedere quante colonie fibrobla-stoidi riescono a formare (CFU-F) e se siano capaci di differenziare in adipociti, condrociti e osteoblasti. Le MSC ottenute da MPC so-no state testate per esiminarne queste potenzialià proliferative. Nel dettaglio: da colture primarie di MPC vengono rimosse le cellule MSC eventualmente contaminanti tramite tripsina, le MPC rima-ste vengono coltivate in presenza di terreno con il 10% di siero fe-tale bovino (FBS) che induce la differenziazione in MSC. Dopo 15 giorni è stato possibile staccare con tripsina una prima generazio-ne (T1) di cellule indotte al destino mesenchimale. Le cellule MPC rimaste sono state ripiastrate in terreno contenete 10%FBS per al-tre due settimane, a questo punto sono state di nuovo tripsinizate ottenendo una generazione T2 di cellule fibroblastoidi. Il procedi-mento è stato ripetuto fino alla generazione T5. Tutte queste cinque generazioni sono state capaci di differenziare in condrociti, adipo-citi e osteoblasti. Inoltre è stata analizzata la loro capacità di forma-re colonie e il loro tasso di cforma-rescita, espforma-resso come tasso cumula-tivo di duplicazione cellulare (Cumulative PD). I risultati indicano che l’andamento della crescita cellulare non varia nelle generazioni successive ed è paragonabile all’andamento in un controllo di MSC. A diminuire con le generazioni è invece il numero di CFU. Que-sto è stato interpretato come sintomatico del fatto che le MPC sia-no capaci di generare MSC con sia-normale potenziale di duplicazione e di differenziamento mentre il calo del numero di CFU è correla-to col calo del numero delle MPC che nel frattempo si sono trasfor-mate in cellule mesenchimali (Fig.7).
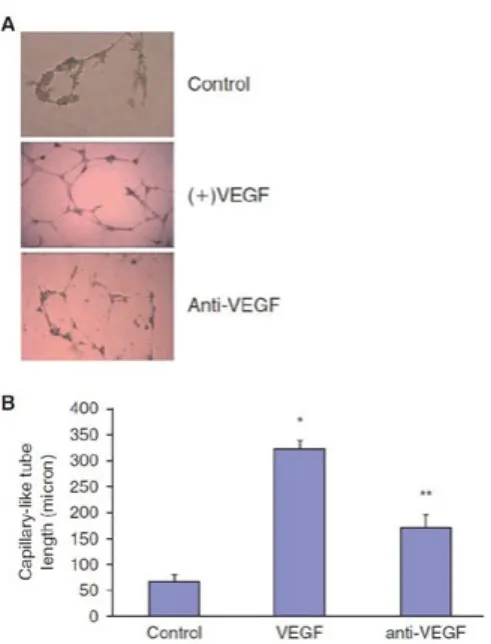
Le MPC inoltre hanno la caratteristica, peculiare rispetto alle cellule mesenchi-mali, di poter formare cellule endoteliali se poste in un adeguato mezzo. L’effetti-va differenziazione in cellule endotelia-li è confermata tramite l’anaendotelia-lisi di speci-fici marcatori, sono cioè cellule CD90-,
CD133-, KDR+ e CD31+, e tramite la
capa-cità di formare strutture simili a capillari (tube-like formation, Fig.8).
Figura 8: capacità differenziativa in cellule endoteliali Oltre alla morfologia rotondeggiante, all’assenza di attività mitotica e alla ca-pacità di differenziarsi in cellule endote-liali le MPC mostrano altre caratteristi-che specificaratteristi-che.
A livello di coltura cellulare le MPC mo-strano peculiari capacità adesive in quan-to sono aderenti su polistirene idrofobico e resistono al distacco in seguito a dige-stione con Tripsina, questo è il principio che permette di allestire un isolamento
selettivo di queste cellule e di ovviare ad eventuali contaminazioni di cellule me-senchimali stromali.
Le due popolazioni cellulari mostrano inoltre differenze, evidenziabili sia tra-mite citometria a flusso che tratra-mite im-munofluorescenza, rispetto ad alcuni an-tigeni espressi. A tal proposito le MSC sono descritte come cellule CD105+,
CD90+, MSCA-1+, CD34-, CD45-
men-tre l’espressione di SSEA-4 non è sem-pre evidenziabile26/55, le MPC sono invece
CD34-, CD45- e CD105+ ma anche CD90-,
SSEA-4+ e MSCA-1-. Questo è
particolar-mente interessante, perché le differenze di marcatori superficiale possono essere sfruttate in successivi studi di isolamento di un corrispettivo in vivo delle MPC, si possono infatti ricercare cellule CD105+,
CD90- e SSEA-4+, oltre che utilizzare in
generale queste differenze per distingue-re le due popolazioni cellulari.
Le MPC esprimono livelli elevati di al-deide deidrogenasi (ALDH) e, carattestica unica in tessuti adulti, esprimono ri-levabili livelli di OCT-4 (POU domain, class 5, transcription factor 1), NANOG e SSEA-4.
In particolare la presenza di OCT4 e NA-NOG è interessante poiché entrambe so-no largamente ricoso-nosciute come marca-tori di pluripotenza e di staminalità, in particolare il complesso che OCT-4 for-ma con SOX2 è il principale fattore at-tivo nel mantenimento della pluripotenza nelle cellule staminali embrionali27 ed è
inoltre uno dei quattro fattori fondamen-tali necessari per la riprogrammazione delle cellule in staminali indotte (iPS)28.
nor-malmente persa man mano che una cellula staminale embrionale si differenzia e non dovrebbe essere rintracciabile nell’adulto, se non in alcune cellule tumorali, dove è spesso evidenziata una riattiva-zione di OCT4. La sua presenza in cellule non cancerose nell’indi-viduo adulto è quindi un fenomeno piuttosto singolare.
Da notare però che le cellule MPC non esprimono SOX2, che nor-malmente agisce formando un dimero con OCT4 agendo così da fattore di trascrizione, queste cellule trascrivono però SOX15, per il quale è nota29 la capacità di legare OCT4 e di agire in sinergia
con esso, è inoltre espresso ad alti livelli FBX15, marcatore talvol-ta utilizzato per verificare l’attività di OCT4. È stalvol-tato quindi propo-sto un modello in cui OCT agisce dimerizzando con Sox15 e atti-vando pathway alternativi a quelli regolati dall’etero dimero OCT4/ SOX230.
Essendo le MPC un questo tipo precursore isolato recentemente, non si hanno a disposizione in letteratura ancora molti dati. Appa-re però evidente come le peculiarità di questo tipo di cellule la Appa- ren-dano molto interessante sia dal punto di vista della ricerca di ba-se che da quello della ricerca applicata. In particolare questo studio si concentrerà sull’analisi delle molecole di adesione espresse dal-le MPC, con un particolare riguardo al confronto con la situazione presente nelle cellule mesenchimali stromali, in maniera da eviden-ziare particolarità delle une e delle altre che abbiano un significa-to funzionale.
1.2 Adesione cellulare
Concettualmente si corre il rischio, allestendo una coltura in
vitro, di considerare una cellula come un’entità a se stante
men-tre, all’interno di un organismo, il comportamento della cellula è in gran parte influenzato dalla sua nicchia, dove una particolare importanza è ricoperta dai fenomeni di adesione, una cellula in
vivo infatti ha interazioni sia con altre cellule che con la matrice
extracellulare circostante.
Lo studio della tipologia di adesione assume un particolare inte-resse nelle MPC e nelle MSC sia per le diverse capacità adesive che mostrano, che per ipotizzare un eventuale comportamento in
vivo.
1.2.1 Adesione cellula-matrice
La matrice è la sostanza che circonda la cellula, secreta dalle cellule stesse, conferisce ai tessuti molte delle loro caratteristiche fisiche ed è inoltre fondamentale nella comunicazione di segnali cellulari.
Il ruolo di collegamento tra cellula e matrice è essenzialmente affidato alle Integrine e, in parte minore, ad alcuni proteoglicani transmembranali
1.2.2 Le Integrine
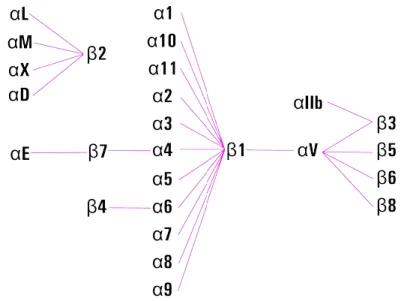
Le integrine sono una super famiglia formata da un gran numero di proteine di membrana le quali riconoscono molecole della ma-trice o molecole presenti su altre superfici cellulari, solo raramente si combinano con ligandi solubili.
Nell’uomo esistono 18 subunità α e 8 β, la proteina per funzionare correttamente deve essere composta da una subunità di entram-be le tipologie. Non è stata evidenziata un’omologia tra subunità α e β, mentre all’interno delle subunità α l’omologia è attorno al 30% e tra le β di circa il 45%31. Questo mostra come questi geni possano essere considerati paraloghi, probabilmente evoluti per duplicazione genica.
La distribuzione dei vari geni per le subunità integriniche nell’uo-mo non è concentrata in un unica zona ma dispersa su vari cronell’uo-mo- cromo-somi, anche se esistono alcuni cluster di espressione. Un esempio sono le subunità αL, αM, αD e αX nei leucociti, le quali si trovano raggruppate in un unico cluster.
Figura 9: Combinazioni possibile tra subunità integriniche. Non tutte le possibili combinazioni di subunità α e β sono state descritte nei vari organismi, questo indica una specifica affinità
tra alcune subunità.
Nell’uomo ad esempio esistono ventiquattro diverse associazio-ni, di cui 11 presenti solo nei leucociti, questo è dovuto al ruolo primario le Integrine assumono nei processi di motilità e invasio-ne cellulare. Infatti il funzionamento dei globuli bianchi si basa su questo tipo di processi dinamici che garantiscono un miglior controllo sull’intero organismo permettendo ai globuli bianchi di arrivare con efficienza nei siti di infezione.
1.2.3 Ruolo delle Integrine
Diversi tipi di integrine sono correlate con diverse funzioni e sono quindi, a seconda di essa, espresse in maniera ubiquitaria o solo in particolari cellule.
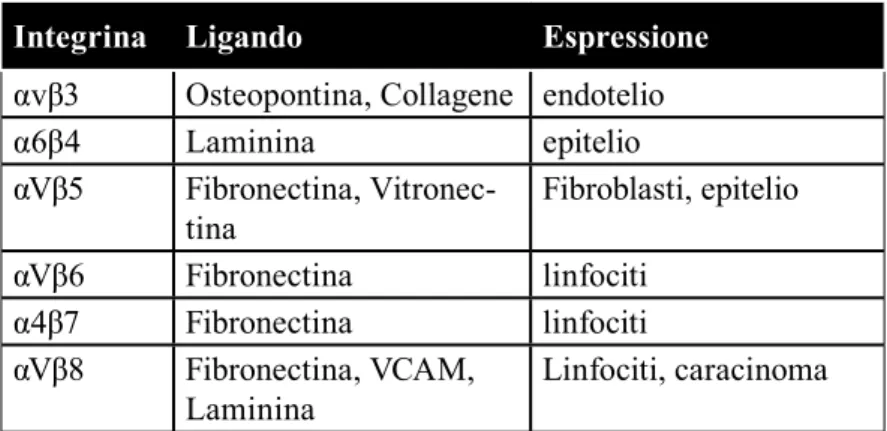
In tabella 132 sono riportate i ligandi principali delle integrine descritte nell’uomo:
Integrina Ligando Espressione
α1β1 Collagene, Laminina ubiquitario
α2β1 Collagene, Laminina ubiquitario
α3β1 Collagene, Laminina,
Fibronectina Epitelio,fibroblasti
α4β1 Fibronectina, VCAM Leucociti, fibroblasti
α5β1 Fibronectina ubiquitario
α6β1 Laminina Piastrine, linfociti T
α7β1 Laminina Muscolo, epitelio
α8β1 Osteopontina,
Vitronec-tina, Fibronectina epitelio
αVβ1 Osteopontina,
Vitronec-tina, Fibronectina fibroblasti
αLβ2 ICAM leucociti
αMβ2 Fibrinogeno, Fattore X,
ICAM-1 Monociti, granulociti
αXβ2 Fibrinogeno Monociti, granulociti
αIIbβ3 Fibrinogeno,
Integrina Ligando Espressione
αvβ3 Osteopontina, Collagene endotelio
α6β4 Laminina epitelio
αVβ5 Fibronectina,
Vitronec-tina Fibroblasti, epitelio
αVβ6 Fibronectina linfociti
α4β7 Fibronectina linfociti
αVβ8 Fibronectina, VCAM,
Laminina Linfociti, caracinoma
Tabella 1: le integrine nell’uomo
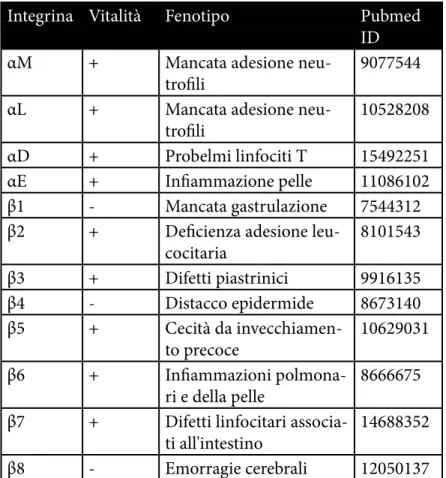
Esperimenti di knock-out in modelli murini evidenziano come il blocco dell’espressione di certe Integrine porti alla formazione di fenotipi con deficienze fisiologiche o di sviluppo molto gravi.
Integrina Vitalità Fenotipo
Pubmed
ID
α1
+
Ridotta angiogenesi e
riparazione ossea
8626034
α2
+
Ridotta adesione
piastri-nica e morfogenesi
12107118
α3
-
Difetti in reni, polmoni
e pelle
8951069
α4
-
Difetti placenta e cuore
7539359
α5
-
Difetti mesodermali e
vascolari
7508365
α6
-
Distacco epidermide,
difetti nella neurogenesi
8673141
α7
+
Distrofia muscolare
9354797
α8
-
Difetti renali
9054500
α9
-
Difetti drenaggio
linfa-tico
10866676
Integrina Vitalità Fenotipo
Pubmed
ID
αM
+
Mancata adesione
neu-trofili
9077544
αL
+
Mancata adesione
neu-trofili
10528208
αD
+
Probelmi linfociti T
15492251
αE
+
Infiammazione pelle
11086102
β1
-
Mancata gastrulazione
7544312
β2
+
Deficienza adesione
leu-cocitaria
8101543
β3
+
Difetti piastrinici
9916135
β4
-
Distacco epidermide
8673140
β5
+
Cecità da
invecchiamen-to precoce
10629031
β6
+
Infiammazioni
polmona-ri e della pelle
8666675
β7
+
Difetti linfocitari
associa-ti all'intesassocia-tino
14688352
β8
-
Emorragie cerebrali
12050137
Tabella 2: KO in modelli murini
1.2.4 La struttura proteica e l’attivazione delle Integrine
Una volta tradotte le integrine sono glico-proteine transmembra-nali con una corta coda C-terminale intra-citoplasmatica ed un complesso dominio N-terminale extra-cellulare. La parte esterna dell’eterodimero attivo si lega alle molecole affini, mentre la par-te inpar-terna comunica con il citoscheletro tramipar-te propar-teine adattatri-ci. In questo modo l’integrina può agire trasportando messaggi nel-le due direzioni, il nel-legame di certe monel-leconel-le all’esterno può attivare una trasduzione del segnale all’interno della cellula (outside-in si-gnalling), allo stesso modo un certo segnale cellulare può essere comunicato all’esterno tramite l’attivazione delle integrine (inside-out signalling). Questo dimostra come le Integrine non siano del-le mere strutture di ancoraggio e necessitino quindi di una fine
re-golazione, oltre a quella trascrizionale, che le faccia passare da uno stato attivo ad uno inattivo. In particolare alcune evidenze mostra-no come ci sia un tipo di regolazione allosterica: il legame dell’inte-grina con determinate molecole infatti fa cambiare conformazione all’eterodimero attivandolo o inattivandolo, questo legame può es-sere con molecola sia intra che extra-citoplasmatiche, permettendo così la bidirezionalità delle vie di segnale (Fig.10).
Figura 10: attivazione inside-out ed outside-in Ciò è analizzabile con esperimenti di microscopia elettronica su preparazioni purificate di Integrine. Queste in un mezzo ricco di io-ni calcio assumono una conformazione ripiegata a V (forma inatti-va), mentre se forniamo in soluzione dei peptidi che si uniscono ai
siti specifici di legame le Integrine assumeranno una forma diste-sa (forma attiva) dove sono evidenziate due molecole (le due subu-nità α e β) ben distinte che si uniscono nell’unica testa contenente il sito di legame. Questi dati sono analizzati in maniera più accurata e confermati tramite cristallografia a raggi X. L’interazione con il ligando fa quindi assumere all’eterodimero la conformazione diste-sa, che permette il legame di proteine intracitoplasmatiche. Anche il legame di certe proteine intracitoplasmatiche fa assumere la con-formazione attiva, estesa, all’Integrina, rendendola più affine agli specifici ligandi extracellulari. Questo permette di generare sia se-gnali inside-out che outside-in.
Figura 11: Le integrine si ancorano alla matrice ed al citoscheletro
Nello specifico il legame della Talina alla porzione intra-cellula-re dell’Integrina permette la formazione della forma attiva inte-grinica. Questa diventerà così affine per i ligandi specifici extra cellulari(Inside-out signaling). Questa segnalazione inside-out può essere attivata da diverse molecole di segnale come l’inositolo bi-sfosfato (PIP2) che promuove l’attivazione della Talina. Allo stes-so modo la presenza di alte concentrazioni di Ligandi extra cellu-lari fa assumere all’Integrina una conformazione distesa, capace di legare molecole interne alla cellula dando origine alla trasduzione del segnale (Outside-in signaling).
Analizzando più finemente la struttura proteica si possono trovare diversi domi-ni funzionali nelle integrine.
Figura 12: struttura primaria Integrine
Figura 13: struttura ripiegata dell-Integrina Il principale dominio funzionale è rap-presentato dal dominio I (Inserted do-main), anche noto come fattore A di Von Willebrand, un dominio di circa 200 resi-dui aminoacidici presente in più della me-tà delle subunime-tà α e che, se presente, rap-presenta il principale domino di legame.
Figura 14: Sito MIDAS chiuso (Sx) e aperto (Dx) La struttura dei vari domini α I è nota e conservata. Ad esempio sappiamo che la mutazione da lisina a cisteina nel domino I dell’integrina αL porta alla formazione di un ponte disolfuro che stabilizza la for-ma aperta del domino I rendendolo molto più affine a ICAM 1 e 3. Strutturalmen-te è composta da alcune α-eliche che cir-condano un foglietto β centrale. Per l’ef-fettivo funzionamento del dominio è poi necessario il legame di uno ione Mg2+
co-ordinato da cinque residui aminoacidici, il sito di legame con il catione divalente è denominato metal ion-dependent adhe-sion site (MIDAS). Particolare importan-za ha la conformazione del sito MIDAS che può essere chiusa o aperta variando sensibilmente l’affinità per il catione. A determinare il tipo di conformazione so-no i residui amiso-noacidici che coordinaso-no lo ione.Il dominio αI è stato cristallizzato in tre diverse conformazioni: chiusa, in-termedia ed aperta. In mancanza del li-gando il dominio α I si trova in confor-mazione chiusa. Particolare importanza ricopre la catena α7 del dominio I, che muovendosi modifica lo stato aperto o chiuso del sito MIDAS.
Figura 15: modificazione allosterica nel sito MIDAS Un abbassamento dell’elica α7 induce uno stato aperto del sito MI-DAS e una conseguente maggior affinità per il substrato, allo stes-so modo una forte concentrazione di substrato porta a una apertura del sito MIDAS e al conseguente movimento dell’elica α7. A sup-porto di questo è stato dimostrato che inibitori del dominio α I, che stabilizzano la struttura impedendo il movimento dell’elica α7, ini-biscono le vie di segnale sia outside-in che inside-out di integrine contenenti il dominio αI.
Un’interazione ben studiata è quella tra ICAM-1/3 e le integrine αLβ2, dove il dominio I di αL è responsabile del legame con ICAM. In particolare il sito di legame è centrato su un residuo di glutam-mato (E34) del dominio D1 di ICAM1, il quale entra in stretto con-tatto con il catione bivalente del dominio MIDAS. Questa unione è facilitata dall’ambiente ricco di residui idrofobici creato tra le due proteine nel sito di legame.
Aldilà della presenza o meno del dominio α I, le subunità α e β delle integrine sono, come già detto, strutturalmente glicoproteine trans-membranali di tipo 1 con un grosso dominio extra-cellulare e un piccolo dominio intra-citoplasmatico (tranne che per l’Integri-na β4). Quando sono il’Integri-nattive la testa della proteil’Integri-na è ripiegata ver-so la membrana evidenziando una forma a V. La parte N-terminale (extra-cellulare) della subunità α si ripiega a formare sette domini β-propeller e, se presente, il dominio I si inserisce tra i foglietti β 2 e 3 del β-propeller. Le subunità β possiedono un dominio omolo-go ad α I chiamato dominio β I-like, il quale contiene due segmenti addizionali rispetto ad α I, e che entra in contatto con il β-propeller. Il β-propeller sull’altro lato rispetto ad I-like lega degli ioni Ca++.
Anche I-like contiene un sito MIDAS e due siti con funzione simi-le: LIMBS e AMIDAS.
È noto che peptidi recanti la sequenza Arg-Gly-Asp (RGD) legano le integrine, in particolare il catione Mg2+ del sito MIDAS nel
do-minio I-like, lega Asp, mentre Arg è legata da un residuo Asp sul β-propeller. Il dominio β I-like è responsabile del legame in assen-za del dominio αI, mentre nel caso di presenassen-za di entrambi i do-mini fondamentale è la corretta interazione tra di essi, come di-mostrato da esperimenti biochimici e di mutagenesi. Si evidenzia infatti come il dominio MIDAS del dominio β I-like sia necessa-rio per far abbassare l’elica α7 di α I in maniera da attivare il sito di legame, attirando in conformazione aperta un residuo di glutam-mato di quest’ultima. Questo è evidenziato in particolare mutan-do (Fig.16) :
1. il residuo conservato di Glu con una Cys in maniera da inibire il
le-game con il sito MIDAS e ottenendo un’integrina sempre inattiva,
2. una alanina in Cys nel sito MIDAS che fa sì che questo rimanga
sempre inattivo che produce un’integrina non funzionante,
3. mutando in Cys sia l’Ala di MIDAS che il Glu di a I si forma
inve-ce un ponte disolfuro che genera una integrina costitutivamente attiva.
Importanti strutturalmente sono i domini della subunità α Thigh, Calf e Genu attorno ai quali avviene il movimento di attivazione, infatti letteralmente i nomi nome di questi tre domini significano coscia, polpaccio e ginocchio, in quanto il movimento che compio-no attivandosi ricorda la flessione di una gamba.
1.2.5 Emidesmosomi ed adesioni focali
Due delle principali strutture di adesione in cui sono coinvolte le integrine sono gli emidesmosomi e le adesioni focali.
Gli emidesmosomi sono il più comune sistema di ancoraggio del-le celludel-le epiteliali alla matrice extracellulare. Qui l’integrina α6β4 viene fortemente espressa e si lega assieme ad un particolare colla-gene, il Collagene XVII e alla Laminina, il componente principa-le della lamina basaprincipa-le. Dal lato citoplasmatico invece l’Integrina e il Collagene XVII legano due proteine: la Distonina e la Plectina le quali interagiscono non con l’Actina come solitamente succede ma con dei filamenti intermedi di Cheratina.
Figura 17: emidesmosomi Le adesioni focali sono strutture che integrano il segnale di adesio-ne dando il via ad una trasduzioadesio-ne del segnale verso il nucleo. Nel sito di adesione tra cellula e matrice, per opera di diverse inte-grine, le proteine Talina o Paxillina, che si legano alle subunità ri-spettivamente α e β, reclutano la chinasi FAK, una Tyr-chinasi. Le molecole di FAK si fosforilano tra loro una volta reclutate
attivan-dosi e creando un sito di ancoraggio per SRC, un’altra tyr-chinasi. SRC fosforila a sua volta alcune proteine tra cui FAK su un particoalre residuo di Tyr. Si crea così un punto di ancoraggio per diverse proteine attivando anche la via della MAP chinasi.
Figura 19: immunofluorsecenza di adesioni focali verde-->actina; rosso-->fosfotirosina
Figura 20: fibroblasti B)normali C)deficenti in FAK dopo 2h di cultura
1.2.6 Proteoglicani transmembranali
Oltre alle integrine anche alcuni proteoglicani possono agire come molecole di legame tra cellula e matrice.
I proteoglicani sono grosse molecole, sintetizzate e livello cellulare e principalmente secrete all’esterno, che contribuiscono alla forma-zione della matrice extracellulare. Sono costituite da
glicosamino-glicani (GAG) legati ad un core proteico tramite un ponte tetrasaccaridico compo-sto da xilosio-galattosio-galattosio-acido glucoronico (Fig.18), i GAG sono etero-polisaccaridi formati da ripetizioni di un disaccaride contente un amino-zucchero (solitamente solfatato) ed un acido uroni-co (gluuroni-coronato o idurinato).
Dei vari proteoglicani prodotti alcuni ri-mangono in posizione transmembrana-le transmembrana-legati al doppio strato fosfolipidico da ancore GPI (glicosil-fosfatidil-inositolo). Tra questi particolarmente importante è il Sindecano che può agire sia come co-re-cettore per l’FGF (fibroblast growth fac-tor) che come molecola di legame alla Fi-bronecina di matrice.
Anche altri proteoglicani rimangono in posizione trans-membranale ma non sono coinvolti attivamente nell’adesione cellu-lare. Un esempio è il Betaglicano implica-to come corecetimplica-tore per il fatimplica-tore di cre-scita TGF-β (Tranforming Growth Factor – β).
1.2.7 La matrice extracellulare (ECM)
La matrice extracellulare è composta da svariate componenti sintetizzate e dispo-ste dalla cellule dispo-stesse. La diversa propor-zione delle varie componenti della matri-ce conferismatri-ce la specificità ai vari tipi di tessuto connettivo.
Le principali molecole che contribuisco-no alla formazione della ECM socontribuisco-no:
Proteoglicani e Ialuronato. I
proteo-glicani sono molecole composte da uno scaffold proteico su cui si inseriscono di-versi GAG. I vari GAG si differenziano per il tipo degli zuccheri che le
compon-gono e per le loro modificazioni. I princi-pali sono: lo Ialuronato, il Condroitin sol-fato, il Dermatan solsol-fato, l’Eparan solfato e il Cheratan solfato. Tra questi lo Ialu-ronato mostra un comportamento parti-colare in quanto non si trova solitamente associato a proteine, non subisce modifi-cazioni come la solforilazione sui suoi residui e ogni singola molecola raggiun-ge dimensioni notevoli, arrivando a con-tenere fino a 25000 unità disaccaridiche.
Figura 21: Link tra core proteico e GAG Tutti i GAG hanno l’importante caratteri-stica di presentare numerose cariche ne-gative. Queste attirano cationi, come Na+, richiamando così notevoli quantità di ac-qua nella matrice. La pressione dell’acac-qua contribuisce così a rendere resistenti al-la compressione i vari tipi di tessuto con-nettivo. La maggior parte dei proteoglica-ni prodotti dalla cellula vengono secreti all’esterno dove possono aggregarsi tra loro ed agire anche come regolatori delle attività di varie proteine solubili.
Gli aggregati di proteoglicani possono raggiungere dimensioni impressionanti, ad esempio alcune molecole di Aggreca-no possoAggreca-no unirsi tramite delle proteine linker su uno scaffold formato da una mo-lecola di ialuronato formando così un
ag-gregato di dimensioni paragonabili a quelle di un batterio.
Il ruolo dei proteoglicani nella regolazione delle attività cellulari è vario. Il Sindecano ad esempio lega FGF, regolandone l’oligomeriz-zazione e il corretto riconoscimento da parte del recettore cellula-re. L’Eparan solfato invece, in processi di infiammazione, trattiene le chemochine aumentando la loro attività. Altri proteoglicani han-no invece la capacità di diminuire l’attività di alcune proteine le-gandole come succede,ad esempio, nel caso del legame tra Decori-ne e TGF-β.
Collagene. È la componente proteica della matrice più abbondante,
secreta dalle cellule del tessuto connettivo, forma circa il 25% della massa proteica in un mammifero. Tipicamente è formato da tre su-bunità, dette catene alfa, le quali si avvolgono una sull’altra. Ogni catena α è composta da una serie di circa 1000 aminoacidi organiz-zati a formare un’elica levogiro. Queste eliche sono molto ricche in Prolina e Glicina.
Nel genoma umano ci sono 42 geni che codificano per le subunità di collagene e la loro espressione tessuto-specifica unita alla capa-cità di combinarsi in diversi modi determina le caratteristiche tipi-che di un determinato collagene. Di tutte le possibili combinazioni solo quaranta sono però state effettivamente trovate in cellule uma-ne (Tabella 3).
Tipo Distibuzione
Fenotipo in mutanti
Formazione
di fibrille I Ossa, tendini, pelle legamenti, cornea, organi interni
Difetti ossei
II Cartilagine, dischi interverte-brali, notocorda, umor vitreoNanismo, difetti
cartilaginei
III Pelle, vasisangui-gni, organi interni
rottura dei vasi,
problemi di
giun-zione cellulare
V Come tipo I
Come tipo III
Tipo Distibuzione
Fenotipo in mutanti
Associato afibrille IX Cartilagine
Artrite
Formazione
reticolo IV Lamina basale
Sordità, probelmi
glomerulari
VII Epitelio squamoso
stratificato
Squamosità della
pelle
Transmem-brana XVII Emidesmosomi
Squamosità della
pelle
Core in
pro-teoglicani XVIII Lamina basale
Tabella 3: tipologie di collagene Le molecole di collagene vanno incontro a numerose modificazio-ni post-traduzionali e sono poi successivamente indirizzate alla se-crezione. Problemi nella produzione del collagene portano a com-plicate forme patologiche, ad esempio un difetto nella produzione del collagene di tipo I porta allo sviluppo di Osteogenesi imperfec-ta, una malattia per la quale sono in corso trials molto avanzati che implicano l’utilizzo di cellule stromali mesenchimali.
Figura 22: cross-link in una fibrilla di collagene Le molecole di collagene, vista la loro scarsa solubilità, tendono ad autoassemblarsi formando legami crociati tra le varie molecole e assumendo una conformazione fibrillare. L’organizzazione delle fi-brille è peculiare dei vari tipi di tessuto, generalmente associate al-le fibrilal-le si trovano altri tipi di collagene, come il IX e il XII, che presentano una struttura leggermente diversa e compartecipano al-la formazione delle fibrille stesse.
Le fibrille si raggruppano a formare le vere e proprie fibre di colla-gene. Queste fibre conferiscono al tessuto capacità di resistenza
al-la tensione, così come i GAG con le loro proprietà osmotiche con-feriscono quella alla compressione.
Elastina. Oltre alle fibre di collagene il connettivo si
caratteriz-za per l’ulteriore presencaratteriz-za di altre fibre capaci di conferire le pro-prietà elastiche. La componente principale capace di conferire que-sta caratteristica fisica è l’elastina. Tale proteina è caratterizzata da due domini, uno responsabile della capacità elastica e l’altro re-sponsabile della formazione di legami incrociati tra varie molecole di elastina. A conferire le particolari caratteristiche di questa teina sembrano essere la struttura “random coil” del dominio pro-teico capace di arrotolarsi e svolgersi agendo così come una molla. Assieme all’elastina concorrono a formare le fibre elastiche anche altre proteine, che costituiscono le così detto microfibrille. Tra di esse è particolarmente importante la glicoproteina Fibrillina, una sua mutazione porta infatti allo sviluppo della sindrome di Marfan.
Figura 23: Sezione di aorto di cane, fibrille di elastina,
Fibronectina. È un’altra proteina fondamentale per la matrice.
Co-me i proteoglicani è implicata nella regolazione della motilità cellu-lare, organizza la matrice e l’attacco delle cellule ad essa.
La Fibronectina è una proteina molto conservata nei vertebrati e si trova sotto forma di dimero, le cui subunità sono unite da un pon-te disolfuro (Fig.22). A seconda del numero di legami disolfuro la fibronectina può essere solubile o insolubile. Ogni subunità ha di-versi domini funzionali separati da una struttura coil. Nel genoma umano vi è un solo gene codificante per la fibronecina e la differen-za tra le varie molecole è data dallo splicing alternativo.
Questo tipo di proteine può formare fibrille solo in prossimità di cellule che esprimono particolari integrine, il loro legame fa espor-re siti di polimerizzazione alla Fibronectina. In particolaespor-re attraver-so studi di mutagenesi si è evidenziato come il legame necessiti del-la sequenza RGD (Arg-Gly-Asp) neldel-la Fibronectina. Le integrine fanno quindi da collegamento tra l’esterno della cellula (Fibronec-tina) e l’interno (citoscheletro), dimostrando anche in questo caso la loro fondamentale funzione di trasporto del segnale in entrambe le direzioni. Infatti può essere sia la Fibronectina a legare l’integri-na facendo partire ul’integri-na trasduzione del segl’integri-nale verso l’interno, sia il legame di specifiche molecole intracellulari a far assumere all’inte-grina la forma attiva capace di legare la Fibronectina.
Figura 25: esempio di dimero di fibronectina, in evidenza sequenza RGD
1.2.8 La degradazione della matrice
Le cellule, che producono le singole com-ponenti della matrice, sono allo stesso tempo responsabile della sua degradazio-ne a seconda delle degradazio-necessità, ad esempio in caso di tessuti da riparare o per consen-tire la motilità cellulare, ma anche per un normale turn-over delle componenti del-la ECM stessa. La digestione deldel-la ma-trice serve quindi alle cellule per poter-si muovere e dividere anche se circondate da matrice, questo processo è fondamen-tale per attraversare la lamina basale, ca-pacità alla base della caca-pacità dei tumori di metastatizzare.
I classici enzimi deputati alla digestio-ne della matrice sono le metalloproteina-si, che dipendono per il proprio funziona-mento da Ca2+ e Zn2+ e le Serina proteasi.
Questi effettori hanno un amplio spettro di azione e collaborano inoltre con Colla-genasi ed altri enzimi specifici per la di-gestione per la didi-gestione di un solo tipo di proteina.
La digestione della ECM deve essere fi-nemente regolata, in particolare agiscono tre meccanismi di controllo:
Attivazione locale. Le proteasi vengono solitamente secrete come inattive e pos-sono venire attivate solo in caso di neces-sità. Il Plasminogeno è, ad esempio, una proteasi molto abbondante nel flusso san-guigno che necessita però di essere ta-gliata da altre proteasi per formare così la plasmina, la forma attiva.
Legame con i recettori superficiali. Mol-te cellule hanno recettori che legano pro-teasi limitandone la diffusione e localiz-zandole solo dove servono. Un esempio
sono le uPA, le urochinasi attivatrici del Plasminogeno, che vengono legate da uno specifico recettore presente in prossimità dei terminali assonici e in altre cellule in fase di sviluppo. Il recettore però può ve-nir espresso anche da cellule metastatiche e può quindi essere considerato un buon marker per alcune patologie.
Secrezione di inibitori. Le cellule pro-ducono e secernono anche inibitori del-le metalloproteinasi (TIMPs) e inibito-ri delle Seinibito-rina proteasi detti Serpine. Gli inibitori sono molto specifici e agiscono bloccando il sito attivo della proteasi. In particolare l’over-espressione delle TIM-Ps riduce o blocca l’attività migratoria di molte cellule
1.2.9 Molecole di adesione cellula-cellula
Oltre alla matrice extra-cellulare le cellu-le devono ancorarsi anche cellu-le une alcellu-le al-tre, in questo caso le protagoniste non so-no le integrine ma altre classi di proteine.
Caderine: sono le principali responsabili
del legame tra più cellule ed agiscono tra-mite un legame omofilico. Possono divi-dersi in classiche (caderine E/N/P/VE) o non classiche (caderine T/23, protocade-rine, Flamingo, Fat, Fat1, desmocolina), questa divisione è dovuta ad un evento di duplicazione cellulare molto antico. Mu-tazioni in queste molecole creano fenoti-pi letali o con gravi disfunzioni ed inoltre per funzionare correttamente necessitano di Ca2+.
Le Caderine oltre che per l’adesione so-no importanti nelle vie di segnale, esatta-mente come lo sono le Integrine, possono infatti comunicare con il citoscheletro
at-traverso le proteine Catenine.
Selectine: sono espresse su alcune cellule del sangue ed
endotelia-li, strutturalmente sono proteine trans-membranali capaci di legare particolari carboidrati (dominio lectinico) e agiscono regolando so-pratutto il flusso dei leucociti nel sangue e nel circolo linfatico. Esi-stono tre tipi di selectina: L espressa dai globuli bianchi, E espressa su cellule endoteliali e P presente su piastrine e cellule endotelia-li in prossimità di un’infezione. Negendotelia-li organi endotelia-linfoidi le cellule en-doteliali esprimono oligosaccaridi che sono riconosciuti dalle L-selectine dei leucociti che possono così accumularvisi, invece nei siti di infezione sono le cellule endoteliali ad esprimere P-selectine che vengono riconosciute da carboidrati di superficie di piastrine e globuli bianchi favorendo così la risposta all’infiammazione stessa.
Membri della famiglia delle immunoglobuline: sono molecole di
adesione appartenenti alla famiglia delle immunoglobuline con do-minio di legame omologo ad esempio agli anticorpi.
Servono sia per legami eterofilici, ad esempio con l’Integrina αLβ2 che media il processo di extra-vasation, che per legami omofilici. Le principali componenti di questa famigla sono le proteine ICAMs, VCAMs, PECAMs e NCAMs, ognuna di queste molecole ha diver-si isotipi tradotti diver-sia da differenti geni che processati con splicing alternativi.
1.2.10 Strutture cellulari di invasione
Oltre alla già descritte adesioni focali sono state descritte anche al-tre strutture cellulari che conferiscono alla cellula sia la capacità di aderire che quella di degradare la matrice.
Due strutture che vengono analizzate in questo lavoro, e sono stret-tamente correlate tra loro, sono il podosoma e l’invadosoma32.
Il podosoma è una struttura originariamente descritta come di for-ma anulare o di punto ricca in Actina ed identificata in fibroblasti trasformati dal virus del sarcoma di Rous. Ad oggi questa struttura è stata descritta in varie tipologie cellulari, vi sono stati quindi di-versi cambiamenti nel formalismo della definizione, i quali ci dico-no che il podosoma è una struttura di adesione altamente dinamica, ricca in actina e ritrovata in cellule di derivazione monocitaria, cel-lule di carcinoma e alcuni fibroblasti trasformati33.
È una struttura formata da un core actinico circondato da una se-rie di componenti che si possono ritrovare anche nelle adesioni fo-cali. Negli ultimi anni i podosomi sono emersi come strutture con un’importanza fisiologica e non solo come dei semplici artefatti do-vuti alla cultura in vitro48. Nella formazione e regolazione del
po-dosoma sono implicate diverse chinasi, in particolare SRC, FAK, GTPasi della famiglia Rho come Rac1, RhoA e Cdc42, ma anche strutture citoscheletriche come i microtubuli e i filamenti interme-di. Un particolare ruolo nella polimerizzazione dell’actina è assun-to dal complesso Arp2/3 specifico per quesassun-to tipo di strutture. I podosomi appaiono localizzati nella periferia cellulare e sono piut-tosto instabili e in continua formazione, la loro durata media è in-fatti di 2-10 minuti47.
Gli invadopodia invece hanno un tempo di turn-over molto più lungo, di alcune ore, la loro collocazione è sia periferica che in con-comitanza del nucleo e condividono numerose componenti mole-colari con i podosomi. Mentre i podosomi svolgono un ruolo sia in processi di l’invasione che di adesione cellulare, lo stesso non si può dire per gli invadipodia, dove non vi sono evidenze certe che confermino una loro implicazione in fenomeni di nell’adesione. Gli invadipodia inoltre appaiono più grandi (max 8 x 5 μm) rispetto ai podosomi (max 1 x 0,4 μm)47.
Figura 26: Adesioni focali, podosomi e invadipodia Mentre i podosomi sono stati descritti su monociti, cellule epiteliali e cellule muscolari liscie, gli invadipodia sono stati individuati con certezza su particolari cellule tumorali e fibroblasti trasformati, ma questo non esclude che essi possano trovarsi anche su cellule sane. Per l’identificazione sia di podosomi che di inavdipodia sono stati proposti diversi marcatori, ma non esistono molecole che possano da sole identificare in modo specifico la presenza di tali strutture.
Sono però importanti indizi la presenza di dot actinici polimeriz-zati circondati da diverse molecole tra cui la Gelsolina, la Vinculi-na, alcune integrine tra cui la β2, è inoltre importante la presenza di Cortactina, Fosfotirosina, WASp e del complesso Arp2/3, così co-me l’assenza di Focal adhesion kinase (FAK) e la sintesi di co- metal-loproteinasi specifiche (MMP2/7/8/9/12)48.
Figura 24: visione dall’alto e frontale di:
a-f macrofagi umani primari esprimenti podosomi; g-l cellule di adenoma murino esprimenti invadipodia. Verde-->alexa fluor 488-fibronectina, Rosso-->F-actina. Si nota come l’invadipodia intacchi maggiormente la matrice
Secondo un lavoro del 200247 l’espressione indotta di Cdc42 attiva
la formazione di strutture podosomiali complete ma non funzio-nanti, per questo oltre ai marker molecolari sono necessarie test funzionale di invasione e di digestione della matrice extra-cellula-re per poter identificaextra-cellula-re una struttura podosomiale.
Comples-si polime-rizzazione actina/cito-scheletro Enzimi de-gradazione ECM Adesione Via di
segnale Proteine adattatrici
Cortactina MT1-MMP integrine(b1/2/3/4,a3b 1,a6b1,amb 2,avb3) Src Tks7fish
WASp/N-Wasp MMP-2 talina APAF-110 Paxillina
Actina MMP-9 vinculina Eps8 Grb-2
Arp2/3
complex NHE1 Zixina Rac1 RACK1
SM22 ARF6 PAK1 Plectina
Cdc42 Dinami-na 2 PIX F-Actinina RhoA Fimbrina p190 Gelsolina p120 TRPM7 PI3K Pyk2
Figura 25: a)macrofagi primari(podosoma) rosso-->F-Actina, verde-->WASp
b)cellule muscolari lisce(podosoma) rosso-->F-Actina,verde-->a-actinina-GFP c)hUVEC rosso-->F-Actina,verde-->a-actinina d)rosette di F-actina in fibroblasti trasformati e)cellule di melanoma (invadipodia) blu-->F-actina, rosso-->cortactina
1.2.11 Il ruolo delle Integrine nelle MSC
Essendo le MSC cellule ampiamente indagate e studiate dalla co-munità scientifica, con particolare riguardo all’espressione di mo-lecole superficiali e al comportamento nella nicchia, sono disponi-bili in letteratura molte informazioni riguardanti l’espressione nelle MSC di integrine ed altre importanti molecole implicate in proces-si di adeproces-sione.
Un breve excursus sui questi dati può essere sintetizzato dalla ta-bella seguente:
Integrina Metodologia Referenza (PMID)
αVβ3 FACS Kardang,
Fi-sher(16995818) β1 FACS Aslan(16601078) α2, α3, αV, β1 FACS Chang(17013867) α1, α3, α4, αV FACS Neuss(15153617) α2, α3, αV, β1, β3 FACS Grayson(15176898) α1, α2, α3, α5, α6, β1, β3, β4 FACS Majumdar(12595759) αIIb, α3, α5, α10, αV, β1, β3, β5 Microarray Goessler(16391830) α2, α3, α4, α5, α6, β1, β2, β3, β5, β6 PCR Chastain(16602124)
β1 Western blot Lee(14738854 )
α2, β1 Western blot Meyers(15660414 )
α2, α4, α5, α6, α11,
αV, β1, β5 Spettrometria di massa Foster(16210410)
Tabella 5: espressione delle integrine in cellule mesenchimali stromali Ovviamente il puro dato di espressione di una certa integrina è po-co interessante se non analizzata alla luce della sua po-connotazione funzionale. Per questo è stata analizzato l’andamento nell’espres-sione e la funzionalità del pattern integrinico in particolari condi-zioni:
Differenziamento osteogenico. Un lavoro del 200133
eviden-zia come cellule MSC esprimano le integrine α1β1, α2β1, α5β1, α6β1,αVβ3 e αVβ5 e come aderiscano su Laminina, Fibronectina, Collagene tipo IV e Vitronectina.
Con esperimenti di blocco tramite anticorpi specifici per varie ti-pologie di integrine si evidenzia come l’adesione su Collagene, La-minina e Fibronectina sia mediata dall’Integrina β1, mentre quello su Vitronectina sia mediata dall’Integrina αVβ3. Inoltre il blocco di β1 provoca un netto calo nella capacità di differenziamento osteo-genico delle MSC.
Da uno studio high troughput34 tramite metodi di
spettrofotome-tria di massa si nota come durante il differenziamento osteogeni-co vengano sovraespresse le integrine α2 e α11 osteogeni-così osteogeni-come la β1 e la produzione di Versicano, Tenascina (proteina implicata nella moti-lità cellulare) e CD44 (recettore ialuronato).La produzione di inte-grina α2β1 è aumentata anche dalla presenza di desametasone35, un
composto chimico usato per questo tipo di differenziamento, quin-di l’interazione tra integrina α2β1 e collagene tipo I sembra fonda-mentale nel processo di differenziamento osteogenico. Altri studi dimostrano come la presenza di Laminina 5, capace di aumenta-re la capacità osteogenica delle MSC, comporti un’iper-esprimeaumenta-re l’integrina α3β136, mentre la presenza di sialoproteine ossee
aumen-ti l’espressione di αVβ3e MMP237.
Differenziamento condrogenico. Si evidenzia come in questo
ca-so le integrine α5β1 e αIIbβ3 siano down-regolate, mentre il recet-tore per la Vitronectina, αVβ3, rimanga inalterato38.
Trasformazioni neoplastiche. Diversi gruppi di ricerca
convergo-no sul fatto che le integrine α4β1 e α5β1 controlliconvergo-no il traffico del-le celludel-le del-leucemiche e il loro rapporto con del-le celludel-le stromali come le MSC. Assenza di integrine α4 e α5 nella linea K562 impedisce a queste cellule di interagire con quelle stromali39. In particolare per
questa adesione le MSC producono grandi quantità di Fibronecti-na. Bloccando con anticorpi la Fibronectina nel sito di legame con le integrine viene inibito il contatto tra MSC e cellule tumorali40.
Anche per cellule tumorali dell’epitelio prostatico è dimostrata l’in-terazione con le MSC tramite le integrine α2β1 delle cellule mesen-chimali41.
1.3 Scopo della tesi
Le Mesodermal Progenitor Cells (MPCs) sono una popolazione cellulare umana, recentemente isolata, di precursori stromali po-co differenziati.
In letteratura sono disponibili solamente pochi dati riguardanti questa popolazione cellulare che, viste le peculiari caratteristiche espresse, possono invece risultare come un importante campo di studio per ricerche sia di base che applicate. Per questo questa tesi vuole ampliare il numero di dati in possesso della comunità scien-tifica sulle Mesodermal Progenitor Cells.
In particolare, data l’importanza delle molecole di adesione in pro-cessi di motilità e nell’omeostasi della nicchia, si è scelto di focaliz-zare l’attenzione dello studio proprio sulle Integrine e sulle mole-cole di adesione espresse dalle MPC, con un particolare riguardo al confronto con l’espressione delle stesse molecole sulle più studiate cellule mesenchimali stromali.
A questo scopo sono state allestite colture cellulari di MPC e di MSC, analizzata l’effettiva differenza in termini di caratteristiche di crescita cellulare, capacità differenziative e caratteristiche cito-fluorimetriche.
Allestite le colture sono stati successivamente individuati 84 geni implicati in processi di adesione ed invasione cellulare,
successi-vamente sono state messe a punto una serie di reazioni di Real Ti-me-PCR per questi geni partendo da cDNA proveniente da MSC e MPC in maniera da evidenziare le differenze nell’espressione geni-ca di molecole di adesione tra queste due popolazioni.
Individuati geni di particolare interesse, espressi in maniera signi-ficativamente differente sulle due popolazioni cellulari, si procede-rà ad un analisi proteica per ipotizzare un ruolo strutturale o fun-zionale dei prodotti dell’espressione dei geni stessi.