100
5- SCOPO DELLA TESI
101
Scopo della presente tesi è quello di caratterizzare il miele prodotto in alcune aree dell’Appennino pistoiese, verificando la possibilità di identificare l’area geografica di provenienza attraverso l’analisi dei pollini. Il fine è quello di fornire un valido strumento agli apicoltori interessati a valorizzare il proprio prodotto e una garanzia per il consumatore in quanto si renderebbe possibile attraverso l’esame di un campione di miele di origine sconosciuta stabilirne l’appartenenza o meno a questo areale.A questo studio si accompagna un’analisi dei campioni presi in esame in termini di qualità e freschezza, volta a dare una valutazione generale dell’operato degli apicoltori locali.
102
6- MATERIALI E METODI
103
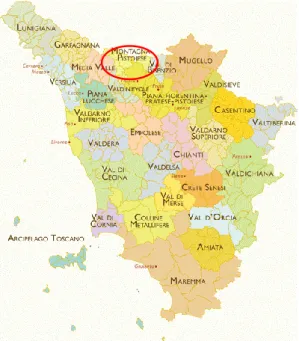
La montagna pistoiese occupa la parte settentrionale della provincia di Pistoia nel versante meridionale dell’Appennino Tosco-Emiliano, tra Lucca e Firenze. Questa porzione montuosa si estende per 492 km2 dalle vette dell’Alpe delle Tre Potenze (1940 m), presso il Passo dell’Abetone, a nord-ovest, fino al Monte La Croce (1318m), nella riserva dell’Acquerino, a sud-est. La parte nord-occidentale più “alpina” è incisa dalla valle maggiore della Lima e dalle valli minori del Sestaione, della Verdiana, del Limestre, e della Liesina, proseguendo a sud-ovest nelle valli dei torrenti Pescia e Nievole fino alla piana pistoiese. La parte sud-orientale più “appenninica”, per i rilievi di altitudine inferiore, è percorsa dal tratto iniziale del fiume Reno e dai suoi affluenti Limentra e Limentrella (Recati, 1990).Figura 9: Aree geografiche della Toscana, in evidenza la montagna pistoiese (http://brunelleschi.imss.fi.it/ist/iaccesso-geo.html)
104
Figura 10: L'area presa in esameL’Appennino pistoiese insieme a quello modenese e bolognese costituisce la parte più elevata di tutto l’Appennino settentrionale e dal punto di vista orografico si divide in due catene distinte con andamento nord-ovest sud-est: Corno alle Scale-Libro Aperto-Monte Cimone e Monte Caligi-Monte Rondinaio-Alpe di San Pellegrino, saldate tra loro dal passo dell’Abetone. Le formazioni geologiche principali che caratterizzano questa porzione di Appennino sono costituite in minima parte da rocce calcaree mesozoiche affioranti nell’alta Val di Lima, fra Bagni di Lucca e la catena dall’Alpe delle Tre Potenze, e costituiscono i terreni più antichi della regione. Si tratta essenzialmente di formazioni calcaree che si sono depositate in mari poco profondi e che nel corso di milioni di anni, hanno subito innalzamenti e sprofondamenti del bacino di sedimentazione. Sopra di esse poggia una possente formazione denominata “macigno oligocenico”, composta da strati di arenaria più o meno compatti e da intercalazioni argilloso-marmose che costituisce quasi per intero le due catene suddette. L’ultima formazione geologica di questa area sono le “argille scagliose” che contengono in modo caotico numerosi frammenti di rocce, delle dimensioni più svariate: calcari compatti e marmosi, diaspri, marmi, quarziti, arenarie, argille variegate, rocce eruttive basiche etc. Queste ultime formazioni sono state
105
generate dalla sedimentazione di frane sottomarine circa 40 milioni di anni fa. L’azione esercitata dagli agenti atmosferici, dai corsi d’acqua e dai ghiacciai nell’Era Quaternaria ha ammorbidito la forma del rilievo appenninico, osservando il paesaggio infatti si notano pendii morbidi e sempre uguali, dossi tondeggianti e creste regolari, intercalate da valli profonde (Fedeli, 2006).Le diversità climatiche, le locali condizioni di esposizione e altitudine del territorio e le abbondanti precipitazioni favoriscono la presenza e lo sviluppo di oltre mille specie vegetali. Nella pendice sud occidentale, compresa tra i 400 e i 600 m s.l.m., sono presenti coltivazioni di olivo mentre il resto del comprensorio, fra i 600 e i 1600 m s.l.m., è contraddistinto da grandi superfici di boschi demaniali (gestiti dal C.F.S. o dalla Comunità Montana), in buon parte governati a ceduo, ma con una forte tendenza alla riconversione all’alto fusto, a causa del cambiamento di politiche e obiettivi sempre più tesi a una conduzione naturalistico-ricreativa della zona. La maggior parte dei terreni boscati di proprietà privata è attualmente governata a ceduo a prevalenza di castagno o misto. Tra le specie arboree più rappresentate in questa zona abbiamo faggi (Fagus sylvatica), abeti bianchi (Abies alba) e rossi (Picea excelsa), pini neri (Pinus nigra), cerri (Quercus cerris), aceri (Acer pseudoplatanus), betulle (Betula alba), ciliegi selvatici (Prunus avium) e altre ancora. In alta quota, sopra i 1600 m, il piano montano è privo di vegetazione arborea. La copertura del terreno è data da una cotica erboso-arbustiva acida più o meno infeltrita, densa e profonda, costituita prevalentemente da ginepri nani (Juniperus montana) e notevoli estensioni a mirtillo blu (Vaccinium uliginosum) e nero (Vaccinium myrtillus). È possibile in queste zone trovare anche alcune specie erbacee tipiche delle aree montane come la Gentiana, Saxifraga, Eriphorum (Ferretti, 2007).
La fauna dell’Appennino pistoiese è costituita da una notevole varietà di animali tipici e di specie comuni diffuse nel resto d’Europa. In generale sono presenti grandi mammiferi ungulati come cervi, caprioli, daini, mufloni, cinghiali e mammiferi minori come lepri, scoiattoli, tassi, donnole e faine. Il recente ritorno del lupo, avvistato lungo i crinali, conferma la buona conservazione dell’habitat naturale del territorio. La famiglia dei volatili è presente con numerose varietà: tordi, merli, scriccioli, picchi, ghiandaie, pettirossi e, tra i rapaci, le poiane, i falchi, l’aquila reale e infine i notturni come l’allocco, il gufo e la civetta. Tra i rettili, oltre alla lucertola, al ramarro e all’orbettino, si trovano esemplari appartenenti alla famiglia dei serpenti come il biacco, il saettone e la biscia dal collare. In tutto il comprensorio vive la vipera comune. Nei laghetti d’alta quota abitano il tritone alpestre e la rana temporaria, presenti solo sul crinale
106
appenninico. Nei torrenti possiamo trovare infine la salamandra pezzata, la trota fario, molto presente, e il gambero d’acqua dolce (Fedeli, 2006).Tutta la zona quindi si mostra molto ricca da un punto di vista naturalistico e si distingue per la presenza di numerose aree di particolare interesse quali l’Orto botanico forestale di Abetone, la Riserva naturale orientata di Campolino, la Riserva naturale biogenetica di faggio di Pian degli Ontani, la Riserva naturale biogenetica di Acquerino, la Foresta del Teso, la Macchia Antonini (Fedeli, 2006).
107
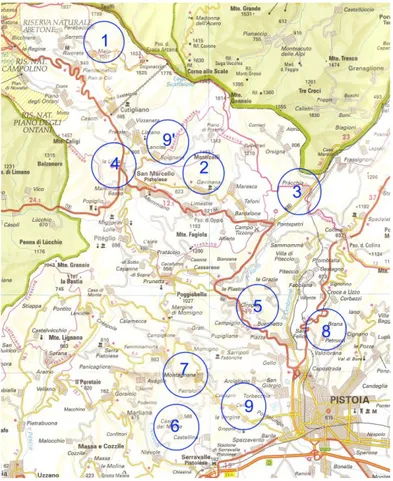
6.2 - La raccolta dei campioniFigura 11: Le località di provenienza dei campioni esaminati
Per lo svolgimento di questa indagine ho raccolto un totale di 35 campioni da 1 kg di cui 21 per l’anno 2007 e 14 per l’anno 2008, rivolgendomi a 9 apicoltori della zona. Di questi 7 sono apicoltori professionisti e 2 sono hobbysti. Più precisamente provengono da apicoltori professionisti i campioni che ho raccolto nelle aree di La Lima (4), Cireglio (5), Il Melo (1), Casore del Monte (6), Celle (9), Gavinana (2), Montagnana (7), mentre sono apicoltori hobbysti quelli che hanno gli apiari nelle zone di Pracchia (3) e di Valdibrana (8). Tra i professionisti alcuni praticano il nomadismo:
108
Area da cui hoprelevato il miele (vedere cartina)
Area in cui lo stesso apicoltore pratica il nomadismo
4 Pratica nomadismo nei pressi del paese di Montiano (GR) per la produzione di miele di girasole, e nella zona di Rosignano (LI) per la produzione di miele di sulla ed erba medica
5 Località Poggio dei Papi, nei pressi di Quarrata, (provincia di Pistoia) in cui produce un miele di millefiori primaverile
9 9’(ho prelevato un campione anche da questa area) località Spignana, in cui produce il miele di melata di abete
I mieli che ho raccolto, secondo quanto indicato dagli apicoltori, sono un totale di 16 di acacia, 12 di castagno, 6 poliflora e uno di melata di abete (nell’areale esaminato non si ha produzione di altre tipologie di miele).
Ho etichettato ogni campione con un codice alfanumerico in modo da garantire l’anonimato del produttore durante le analisi e permettere la successiva identificazione dell’Azienda nonché dell’area di bottinatura.
109
Per ogni campione di miele raccolto ho riportato:- data del prelievo; - località del prelievo;
- origine botanica dichiarata dall’apicoltore; - esito delle analisi effettuate.
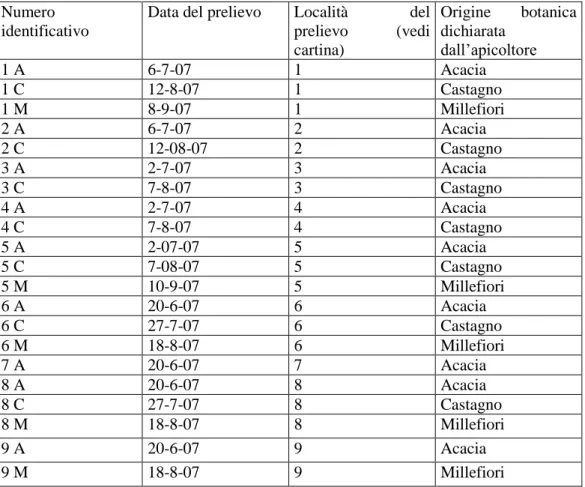
Tabella 1: Elenco dei campioni raccolti nel 2007
Numero identificativo
Data del prelievo Località del prelievo (vedi cartina) Origine botanica dichiarata dall’apicoltore 1 A 6-7-07 1 Acacia 1 C 12-8-07 1 Castagno 1 M 8-9-07 1 Millefiori 2 A 6-7-07 2 Acacia 2 C 12-08-07 2 Castagno 3 A 2-7-07 3 Acacia 3 C 7-8-07 3 Castagno 4 A 2-7-07 4 Acacia 4 C 7-8-07 4 Castagno 5 A 2-07-07 5 Acacia 5 C 7-08-07 5 Castagno 5 M 10-9-07 5 Millefiori 6 A 20-6-07 6 Acacia 6 C 27-7-07 6 Castagno 6 M 18-8-07 6 Millefiori 7 A 20-6-07 7 Acacia 8 A 20-6-07 8 Acacia 8 C 27-7-07 8 Castagno 8 M 18-8-07 8 Millefiori 9 A 20-6-07 9 Acacia 9 M 18-8-07 9 Millefiori
110
Tabella 2: Elenco dei campioni raccolti nel 2008Numero Data del prelievo Località del prelievo (vedi cartina) Origine botanica dichiarata dall’apicoltore 1 A 10-7-08 1 Acacia 1 C 16-8-08 1 Castagno 2 C 16-8-08 2 Castagno 3 A 5-7-08 3 Acacia 3 C 10-8-08 3 Castagno 4 A 5-7-08 4 Acacia 4 C 10-8-08 4 Castagno 5 A 5-7-08 5 Acacia 5 C 10-8-08 5 Castagno 6 A 27-6-08 6 Acacia 7 A 27-6-08 7 Acacia 8 M 20-8-08 8 Millefiori 9 A 28-6-08 9 Acacia 9’ Me 2-8-08 9’ Melata d’abete Grafico 1 Acacia: 45,7% Castagno: 34,3% Poliflora: 17,1% Melata: 2,9%
Origine botanica dei campioni raccolti nel 2007 e
nel 2008 secondo quanto dichiarato dagli
111
6.3 - Le analisi effettuatePer svolgere le analisi fisico-chimiche relative al controllo della qualità e dell’origine botanica del miele mi sono rivolta al CRA-Istituto Nazionale di Apicoltura di Bologna, fatta eccezione per l’analisi melissopalinologiaca che ho eseguito a Pisa sotto la guida dell Dott. Cesare Biondi, esperto mellissopalinologo.
I controlli ufficiali richiedono la conformità del prodotto alle norme di legge. Attualmente il riferimento normativo in Italia è rappresentato fondamentalmente dal Decreto Legislativo 21 Maggio 2004, n. 179, adottato per dare attuazione alla Direttiva 2001/110/CE concernente la produzione e commercializzazione del miele e che ha sostituito e abrogato la precedente Legge 12 Ottobre 1982, n. 753, con tutte le modifiche successivamente intervenute. Per quanto riguarda le determinazioni i metodi di analisi ufficiali sono quelli previsti dal D. M. 25 Luglio 2003 (in Gazzetta Ufficiale n. 185 dell’11 Agosto 2003) (Sabatini, 2007, b).
1- Determinazione del contenuto di acqua
Il limite stabilito dalla legge per il tenore in umidità del miele è del 20% (D. lgs. 179 del 21 Maggio 2004). È noto che il contenuto in acqua condiziona la conservabilità del prodotto e che da questo punto di vista il valore ottimale è anche più basso.
La determinazione del contenuto di acqua avviene mediante la misura dell’indice di rifrazione effettuata servendosi di un rifrattometro. L’indice di rifrazione del miele è infatti funzione del suo contenuto in acqua. Per ottenere un risultato preciso occorre utilizzare miele esclusivamente liquido e alla temperatura di 20°C (Sabatini, 2007, b). Nel caso in cui il miele sia cristallizzato occorre liquefarlo a bagnomaria a 50°C circa all’interno di un recipiente chiuso (provetta o altra vetreria) a perfetta tenuta, avendo cura di riempirlo totalmente, fino alla completa dissoluzione dei cristalli. Poiché l’indice di rifrazione varia col variare della temperatura e la lettura va effettuata a temperatura ambiente è bene mantenere il rifrattometro nell’ambiente di analisi alcune ore prima dell’uso assieme al campione da analizzare.
Il procedimento di analisi è il seguente:
omogeneizzare bene il campione da analizzare prima di procedere con la misurazione dell’umidità, questo per evitare che si abbia una parte più superficiale più liquida e
112
quella sottostante più solida (si eviterà in questo modo di compiere un errore nella misurazione dovuto a una non rappresentatività del campione). si pone una goccia di miele fra i prismi del rifrattometro , dopo essersi assicurati che questi siano ben puliti e asciutti;
si effettua la lettura (è bene aspettare circa 2 minuti se si usa un rifrattometro Abbe o 4 minuti se si usa un rifrattometro digitale).
Figura 14: Rifrattometro di Abbe
Nel caso in cui la temperatura a cui si effettuano le misure non sia di 20°C occorre applicare una correzione all’indice di rifrazione:
T > 20°C → +0,00023 per ogni °C T < 20°C → -0,00023 per ogni °C
Che corrisponde circa ad un aumento o a una diminuzione dell’umidità dell’1% per ogni grado di temperatura in più o in meno.
Il calcolo dell’umidità percentuale si fa a partire dall’indice di rifrazione secondo questa formula:
U = -396,14 x [i.r. + (T-20) x 0,00023] + 608,87
113
2- Sostanze insolubili in acquaLa frazione del miele insolubile è rappresentata da elementi naturalmente presenti (granuli di polline) e particelle solide di varia natura (frammenti di cera, di insetti, di polvere). Il contenuto di sostanze insolubili si ottiene mediante determinazione gravimetrica dopo separazione per filtrazione da una soluzione acquosa di miele e rappresenta un criterio di valutazione della pulizia del prodotto. La legge prevede un contenuto massimo di 0,1/100 g in genere e di 0,5/100 g per il miele torchiato (D. lgs. 179 del 21 Maggio 2004) (Sabatini, 2007, b). È possibile accompagnare l’analisi delle sostanze insolubili nel miele con il Filth Test, esame eseguito allo scopo di identificare la natura delle sostanze estranee presenti. Quest’ultima analisi può indirizzarci sul tipo d’inquinamento che ha subito il miele, sia esso dovuto a mezzi o metodi di lavorazione oppure ad organismi infestanti che in prevalenza appartengono alla classe degli artropodi (Domenichini, 1984).
La misurazione delle sostanze insolubili si esegue utilizzando dei filtri in cellulosa. Prima di procedere è sempre necessario omogeneizzare il campione (come per tutte le analisi sul miele). Metodo di analisi:
è necessario portare i filtri a massa costante e per questo si pongono in una stufa a circa 110°C per un’ora;
si pesano i filtri e si ripongono nuovamente nella stufa procedendo a intervalli di mezz’ora fino a quando non si ottengono due pesate uguali (massa costante);
quindi si pongono i filtri in un essiccatore fino al raggiungimento della temperatura ambiente;
114
a questo punto è necessario pesare circa 20 mg di miele e scioglierlo in acqua a 80°C e miscelare;
poi la soluzione di miele viene filtrata sotto aspirazione su un filtro;
il filtro usato dovrà essere nuovamente posto nella stufa e riscaldato più volte fino a ottenere una massa costante;
La misurazione delle sostanze insolubili avviene per differenza fra il peso del filtro dopo e prima dell’uso.
Dovendo calcolare il valore percentuale la formula da seguire sarà la seguente:
Tenore sostanze insolubili (%) =
0
2
1
m
)
- m
(m
* 100 dove:m0 = massa del campione (g)
m1 = massa del filtro con le sostanze insolubili (g)
m2 = massa del filtro (g)
(Sabatini, 2001)
Per completare l’analisi delle sostanze insolubili sarebbe è possibile eseguire un “filth test” per determinarne la natura. Da studi svolti all’inizio degli anni ’90 presso l’Università di Pisa è emerso che nella maggior parte dei casi la presenza di residui insoluti nei campioni è imputabile alla mancata igienicità dei locali di smielatura. Molto spesso parte dell’artopodofauna presente nei locali di estrazione finisce nei contenitori al momento dell’estrazione e successivamente frazionandosi inquina il miele stoccato nei decantatori. Tra le impurità più frequentemente rinvenute nel miele abbiamo anche le particelle combuste dovute a un uso eccessivo dell’affumicatore (Pinzauti, 1993, b).
3- Determinazione dell’attività diastasica
L’indice diastatico, espresso in unità diastasiche per grammo di miele, viene determinato mediante metodo fotometrico con l’impiego di un substrato insolubile di amido, legato al gruppo cromoforo blu, che viene idrolizzato dall’enzima presente. Il metodo prevede l’uso come reattivo di pastiglie commerciali (Sabatini, 2007, b).
115
Il D. lgs. n.179 del 21 Maggio 2004 fissa per il miele destinato all’alimentazione diretta valori di indice diastasico ≥ 8 (unità Schade) che si riduce a valori ≥ 3 ud per mieli con basso tenore naturale di enzimi (quali agrumi, corbezzolo, acacia etc.) e tenore in HMF non superiore a 15 mg/kg (Messia, Candigliota, Caboni, Marconi, 2004).Misurazione della diastasi con metodo Phadebas:
È opportuno predisporre in anticipo l’apparecchiatura per il riscaldamento della soluzione di miele e accendere lo spettrofotometro almeno 30 minuti prima della lettura. Si pesa in un bicchiere 1 g di miele.
Si scioglie l’aliquota con una soluzione tampone acetato a pH 5,2 e si porta a volume in un matraccio tarato a 100 ± 0,1 ml.
È importante portare a termine l’analisi entro un’ora dalla preparazione della soluzione di miele.
Si introducono 5 ± 0,05 ml di soluzione di miele in una provetta da 20 ml e si riscalda a bagnomaria o in un riscaldatore a 40°C per 15 minuti. Si predispone anche un bianco trasferendo in una provetta 5 ml di tampone acetato e si procede esattamente come per il campione.
Dopo 15 minuti (tempo necessario per riscaldare la soluzione) si aggiunge sia al campione sia al bianco una pastiglia di reattivo Phadebas, usando le apposite pinzette per evitare qualsiasi contatto.
Si avvia il contaminuti.
Si agita ogni provetta per 10 secondi.
Dopo 15 minuti esatti si interrompe la reazione introducendo nelle provette 1 ml di idrossido di sodio 0,5 M.
Si agitano le provette per almeno 5 secondi.
Si filtrano le soluzioni su un filtro di carta e si effettua la misurazione spettrofotometrica utilizzando celle da 1 cm a 620 nm contro acqua.
116
Figura 17: La filtrazione della soluzione di miele con aggiunta del reattivo Phadebas e di idrossido di sodio L’assorbanza del bianco va sottratta a quella del campione e si ottiene ΔA620.
In accordo con il documento della European Honey Commission il valore dell’indice diastatico si calcola mediante la formula di regressione ottenuta dal confronto del presente metodo con il metodo ufficiale di riferimento (Schade).
Indice Diastasico = 28,2 * (ΔA620) + 2,64
28,2 = pendenza della retta;
ΔA620 = assorbanza del campione a 620 nm;
(Sabatini, 2001)
Per i mieli a basso indice diastasico (inferiore a 6 UD) va applicata la seguente formula: Indice Diastasico = 35,165 * (ΔA620) – 0,464
Oppure è necessario utilizzare il metodo Schade
Il risultato si esprime in Unità Schade approssimando alla prima cifra decimale (Persano Oddo, Pulcini, 2002)
117
4- Determinazione dell’idrossimetilfurfurale (HMF)Il limite legale, relativo al prodotto fino al termine del periodo di commercializzazione, è di non più di 40 mg/kg (D. lgs. n.179 del 21 Maggio 2004) (Sabatini, 2007, b). Secondo alcuni autori tale limite sarebbe assolutamente troppo elevato ed inappropriato per garantire la qualità e la freschezza del miele con particolare riferimento ai mieli che presentano valori di pH>4,5 per i quali il limite previsto dovrebbe essere significativamente ridotto. È stato dimostrato infatti che per raggiungere il valore di 40 mg/kg i mieli con pH elevato devono essere sottoposti a una temperatura di 70° per 72 ore circa e anche per i mieli con bassi valori di pH tale limite si consegue solo dopo drastici e prolungati trattamenti termici (Messia, Candigliota, Caboni, Marconi, 2004). Per questo motivo, per assicurare al consumatore un livello di freschezza ottimale si considera che nel prodotto fresco, prima del processo di confezionamento, il contenuto di HMF non debba essere superiore a 10 mg/kg (Sabatini, 2004, a).
La recente normativa ha inoltre introdotto il limite di HMF di 80 mg/kg per il miele di origine dichiarata da regioni con clima tropicale e miscele di tali tipi di miele (Direttiva 2001/110/CE del Consiglio del 20 Dicembre 2001, allegato II). Si tratta di prodotti che, a causa del clima caldo del paese di origine, già al momento dell’estrazione presentano elevati valori di HMF. La determinazione, in base al metodo di analisi ufficiale (D. M. 20 Luglio 1984 - Metodi di analisi ufficiali per il miele, in G.U. n. 282 del 12 Ottobre 1984), viene effettuata per HPLC. Metodo HPLC:
È importante verificare le condizioni dello strumento a ogni ciclo di analisi mediante iniezione di una soluzione certificata a titolo noto. I parametri considerati sono: tempo di ritenzione, numero di piatti teorici e asimmetria.
Si inietta la soluzione di riferimento il numero di volte necessario a ottenere una risposta stabile. La risposta strumentale si ritiene stabile quando la differenza fra le ultime due risposte non è maggiore del limite di reperibilità calcolato in fase di taratura. È bene riportare i valori dell’ultima iniezione relativamente al tempo di ritenzione,
asimmetria e numero di piatti teorici nella carta di controllo per strumenti. Preparazione del campione:
- Il campione deve essere conservato a una temperatura inferiore a 10°C.
- È necessario pesare 10 g di miele in un bicchiere da 50-100 ml, sciogliere con circa 25 ml di acqua e trasferire il quantitativo in un matraccio tarato da 50 ml e portare a volume. In questo modo ottengo una soluzione campione.
118
- Filtrare la soluzione campione con un filtro da 0,45 µg, scartando i primi millilitri(circa 2 ml).
Si effettuano le analisi nelle seguenti condizioni operative: - velocità del flusso 1 ml/minuto
- volume di iniezione 10-50 µl - lunghezza d’onda 285 nm
Condizionare la colonna per 30 minuti al flusso di esercizio, prima di procedere con l’analisi.
Iniettare la soluzione campione con una siringa per cromatografia liquida. La macchina usa 10 µl di soluzione, se ne inietto di più l’eccesso viene espulso.
La misurazione deve essere effettuata entro un’ora dallo scioglimento del miele.
Per l’accettazione del ciclo di analisi è necessario iniettare la soluzione di riferimento anche alla fine del ciclo: il ciclo analitico è accettato se i valori che si ottengono rientrano nei limiti di ripetibilità ottenuti in fase di taratura.
La concentrazione di HMF nel campione viene calcolata confrontando l’area del picco della soluzione campione con quella della soluzione di riferimento, tenendo conto del fattore di diluizione del miele e del titolo effettivo della soluzione di riferimento.
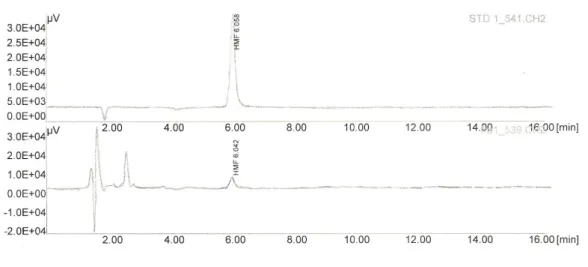
Figura 18: Strumentazione per eseguire l’analisi della concentrazione di HMF mediante metodo HPLC
119
Si usa così la seguente relazione:HMF (mg/kg) =
As
fd
Cs
Ac
*
*
Dove:Ac = area della soluzione campione;
Cs = concentrazione della soluzione di riferimento (mg/l), è pari ai milligrammi di HMF pesati e
moltiplicati per 0,05;
fd = fattore di diluizione del miele, pari a 5;
As = area media della soluzione di riferimento calcolata dalla soluzione iniettata all’inizio e alla
fine dell’analisi.
Figura 19: Grafici ottenuti dall'analisi mediante metodo HPLC della soluzione di riferimento (grafico superiore) e del campione 1A del 2008 (grafico inferiore)
I risultati vengono espressi in mg di HMF per kg di miele approssimando alla prima cifra decimale.
(Sabatini, 2001)
120
5- Determinazione di pH, acidità libera, acidità combinata o lattoni e acidità totaleLa normativa prevede solo la valutazione dell’acidità libera, ma il metodo potenziometrico applicato consente di determinare, nell’ambito della stessa analisi, anche pH, acidità combinata o lattoni e acidità totale, che si ottiene dalla somma di acidità libera e lattoni (Sabatini, 2007, b). L’importanza data alla misura dell’acidità libera nel miele è dovuta alla possibilità, attraverso questa, di controllare l’eventuale aggiunta al miele di zuccheri estranei e in particolare di zucchero invertito, in quest’ultimo caso infatti le tracce residue degli acidi necessari per l’idrolisi fanno ovviamente aumentare l’acidità (oltre a contribuire alla formazione di HMF) (Sangiorgi, Ferretti, 1996). L’attuale normativa ha elevato il limite massimo di acidità libera a 50 meq/kg in quanto alcuni tipi di miele, come miele di timo e melata di metcalfa, presentano un elevato contenuto in acidità. È stato inoltre introdotto un limite di 80 meq/kg per il miele ad uso industriale (Direttiva 2001/110/CE del Consiglio del 20 Dicembre 2001, allegato II) (Sabatini, 2007, b).
Metodo:
per effettuare questa misura è necessario pesare circa 10 g di miele in un bicchiere da 110 ml e scioglierli con 75±0,5 ml di acqua;
Figura 20: La pesatura di circa 10 g di miele
si immerge l’apposito elettrodo e il termometro nella soluzione di miele e si avvia il programma di titolazione con NaOH (0,005 N) selezionando i comandi richiesti fino alla persistenza per circa 10 secondi di un valore di pH di almeno 8,3.
121
si mantiene in agitazione la soluzione mediante un agitatore magnetico.
a titolazione avvenuta si seleziona il programma di aggiunta dell’eccesso di NaOH e retrotitolazione con H2SO4.
Figura 21: Strumenti per eseguire l’esame del pH e di acidità libera e lattoni nel miele
Acidità libera (meq/kg) =
P
N
V *
* 1000 Dove:
V= ml di H2SO4 usati per la titolazione;
N= normalità della titolazione; P= peso (g). Lattoni (meq/kg) =
P
N
V *
)
000
.
10
(
* 1000 10000= eccesso di NaOH in ml.122
6- Analisi melissopalinologicaOgni miele, a meno che non sia stato sottoposto a particolari procedimenti di filtrazione, contiene quantità più o meno elevate di granuli pollinici che derivano in gran parte dai fiori stessi su cui il nettare è stato raccolto. Sulla base del riconoscimento di tali pollini, dalle percentuali relative in cui essi compaiono e dall’identificazione di eventuali indicatori di melata (alghe unicellulari, spore e ife fungine che si sviluppano nella melata) è possibile risalire con buona approssimazione alle fonti di bottinaggio delle api, cioè all’origine botanica e geografica del miele (Persano Oddo, Sabatini, 2000).
La determinazione dell’origine botanica è possibile nei mieli in cui la sorgente di nettare o di melata contenga elementi microscopici tipici e in cui il contenuto primario non sia stato alterato per aggiunta secondaria (per esempio durante l’estrazione) o rimozione. L’esame effettuato sul miele viene comunque chiamato analisi pollinica e si definisce melissopalinologia quella branca della palinologia che studia per l’appunto il polline contenuto nel miele al fine di ottenere informazioni sull’origine botanica del miele stesso. Secondo i metodi raccomandati dalla Commissione Internazionale di Botanica Apistica, l’analisi melissopalinologica può essere qualitativa e quantitativa. La seconda consiste in una valutazione della quantità assoluta di elementi figurati per unità di peso (Sabatini, 2007, b) e si rende necessaria ogni qual volta si desideri stabilire se il miele in questione sia realmente stato estratto per centrifugazione (Hodges, 1984).
L’esame del contenuto pollinico di un miele viene effettuato attraverso un particolare procedimento analitico che prevede la separazione dei granuli pollinici e degli altri elementi figurati presenti in un miele, attraverso diluizione e centrifugazione di un’aliquota di miele; il sedimento ottenuto viene incluso fra due vetrini per microscopia e analizzato al microscopio ottico (Sabatini, 2007, b).
Metodo d’analisi dell’analisi pollinica qualitativa:
Si pesano circa 10 g di miele (o 20 grammi nel caso di mieli poveri di polline come per esempio il miele di acacia);
Si sciolgono in acqua (30-40 ml);
Si centrifugano in provetta a circa 3500 giri;
123
Eliminato il surnatante si aggiunge altra acqua e si centrifuga nuovamente (per eliminare completamente gli zuccheri presenti);
Eliminata ancora la parte acquosa, si trasferisce il sedimento su di un vetrino porta oggetto;
Si mette ad asciugare su di un fornello a bassa temperatura;
Si appone un vetrino coprioggetto con una goccia di gelatina glicerinata;
Si osserva al microscopio ottico a 100, 400, 600 e 1000 ingrandimenti, annotando i pollini riconosciuti (tipologia e quantità).
(Biondi, 2000)
Per valutare meglio la struttura dei granuli pollinici si può eseguire un preparato colorato, utilizzando gelatina glicerata con l’aggiunta di fucsina basica. Nel caso dei mieli ricchi di colloidi è opportuno utilizzare per sciogliere il miele, una soluzione di acido solforico o idrossido di potassio (Sabatini, 2007, b).
Occorre fare molta attenzione nel trasferire tutto il sedimento, ottenuto a seguito della centrifugazione, sul vetrino porta oggetto perché conoscendo il peso del materiale centrifugato e contando un’opportuna quantità di campi di visione microscopica è possibile risalire alla quantità di granuli pollinici presenti in 10 g di miele (Biondi, 2000).
Il principio dell’analisi si basa sul fatto che i granuli pollinici si differenziano morfologicamente l’uno dall’altro e quindi esaminati al microscopio sono riconoscibili come appartenenti a una specie, a un genere o a una famiglia botanica (Sabatini, 2007, b).
L’analisi può essere d’orientamento o completa. Nel primo caso ci si limita all’identificazione degli elementi più comuni e alla ricerca di quelli che abbiano un particolare significato per le finalità dell’analisi. L’analisi completa richiede l’identificazione più approfondita possibile di tutti i pollini e degli altri elementi osservati nel sedimento (Sabatini, 2007, b).
Nel conteggio sono previsti tre livelli di accuratezza:
Stima: si contano 100 granuli pollinici e gli elementi indicatori di melata a essi corrispondenti;
Determinazione delle classi di frequenza: si contano 200-300 granuli pollinici e i corrispondenti indicatori di melata. Se il polline proviene solo da poche specie è sufficiente solo il conteggio di 200 granuli;
124
Conteggio con espressioni percentuali: la presentazione dei risultati nella forma percentuale è possibile solo se sono stati contati almeno 1200 granuli pollinici. Il conteggio è effettuato su due preparazioni ottenute separatamente dallo stesso miele. (Sabatini, 2007, b)
I pollini di piante anemofile (che sfruttano per l’impollinazione l’azione del vento) e entomofile (in cui l’impollinazione avviene per mezzo degli insetti), ma prive di nettare, vanno annotati separatamente. Tra questi è da ritenere importante nel miele la presenza di granuli pollinici di Graminaceae, Cyperaceae, Rumex spp., Quercus, Amaranthus (Sabatini, 2007, b).
Non rivestono un ruolo importante i pollini di Conifere (Abies, Pinus, Picea, Juniperus, Larix, Taxus), Betulla spp., Fagus spp., Carpinus spp., Populus spp., Alnus, Corylus spp., Urtica spp., Typha spp., Juncaceae. Le seguenti piante sono note come prive di nettare ma più o meno entomofile: Papaver spp., Plantago spp., Thalictrum spp., Chenopodiaceae, Ambrosia spp., Artemisia spp. È dubbia la posizione delle Cistaceae e di Filipendula spp. che in genere non producono o quasi nettare (Sabatini, 2007, b).
Durante lo studio dei pollini ci si accorgerà che la dimensione del granello è il criterio di discriminazione più immediato. I granelli hanno dimensioni variabili che vanno da pochi micron a oltre 200 micron:
Tabella 3: Classificazione dei pollini in base alle dimensioni dei granuli
Caratteristiche dei pollini Dimensioni
Pollini molto piccoli < 20 micron Pollini piccoli Tra 20 e 30 micron
Pollini medi Tra 30 e 50 micron
Pollini grandi Tra 50 e 100 micron Pollini molto grandi > 100 micron
Rientrano nella categoria dei pollini molto piccoli quelli di Myosotis (circa 6 x 12 micron) e di Castanea (circa 10 x 15 micron). Un polline grande può essere quello del genere Convolvolus con la specie Convolvolus arvensis (circa 50 x 60 micron) e Convolvolus sepium (circa 70 x 80 micron). Pollini molto grandi sono quelli appartenenti alle Cucurbitaceae con dimensioni anche di oltre 200 micron (Sabatini, 2007, b).
125
Figura 22: Granuli pollinici rispettivamente di Prunus f., Castanea, Robinia pseudoacacia,Quercus ilex, Erica, Salix (Baudone, 2005), Fraxinus ornus, Graminaceae
(www.provincia.bz.it) e Olea f. (www.asmaeallergia.it) visti a vari ingrandimenti
Un altro criterio di classificazione è la forma del granulo. Nella valutazione della forma più specificatamente ci si aiuta osservando il polline al microscopio da due diverse posizioni: la prima, in vista polare, quando l’asse ottico coincide con l’asse polare; la seconda, in vista equatoriale, quando l’asse ottico risulta perpendicolare all’asse polare stesso. Salvo nel caso di pollini sferici si potranno osservare forme diverse utili alla classificazione. Inoltre i granelli di polline al momento della germinazione presentano, salvo alcuni casi (pollini inaperturati), aperture da cui si diparte il tubetto pollinico dove il materiale genetico transita verso la cellula uovo. Le aperture possono essere di forma e numero variabile. Un’altra caratteristica discriminatoria tra i pollini è la natura della loro superficie: possiamo avere pollini con superficie liscia (superficie psilata), oppure con piccole scabrosità costituite da minuti processi o granulazioni (superficie scabrata), oppure processi simili a verruche (superficie verrucata). Inoltre la superficie può essere striata, con striature più o meno evidenti e ordinate (striato-rugata), può presentare reticolatura con maglie di varia grandezza. Infine bisogna ricordare che la sezione ottica equatoriale che si ottiene con un buon ingrandimento evidenzia lo spessore
126
dell’esina e dell’intina del granello osservato fornendo in definitiva un ulteriore elemento di classificazione da associare agli altri (Biondi, 2000). I pollini malformati vengono ugualmente conteggiati, nei limiti in cui il loro riconoscimento è possibile (Sabatini, 2007, b).Gli elementi indicatori di melata consistono in spore fungine e ife (specialmente di fumaggini), alghe microscopiche e particelle di cera prodotte dagli insetti che emettono la melata stessa (Sabatini, 2007, b).
Numerosi tipi pollinici non possono essere identificati a livello di genere o di specie. I nomi specifici devono essere utilizzati solo nel caso in cui l’identificazione possa essere fatta con sufficiente grado di sicurezza. In tutti gli altri casi si deve aggiungere al nome scientifico una nota che indichi che il termine è usato con significato più ampio di quello con cui viene normalmente impiegato. Si usa la seguente terminologia:
Gruppo: quando si fa riferimento a una specie precisa (per esempio Trifolium repens gr.) e si è certi dell’appartenenza del polline ignoto allo stesso genere botanico o a un genere affine;
Forma: quando ci si riferisce a un genere botanico (per esempio Eucalyptus f., o forma “M” per le Labiatae) e si è certi dell’appartenenza alla stessa famiglia botanica;
Tipo: quando il polline sconosciuto rivela una somiglianza con un altro polline noto, ma non si è in grado di affermare che appartenga alla stessa famiglia botanica (ci si può riferire a un genere o a una famiglia, per esempio Moraceae t.).
Nell’espressione dei risultati, per l’analisi qualitativa, i tipi pollinici identificati vengono riportati utilizzando una nomenclatura convenzionale. L’indicazione delle frequenze viene espressa in relazione all’accuratezza delle analisi secondo le seguenti indicazioni (Sabatini, 2007, b).
Se il conteggio è stato eseguito con livello di accuratezza minimo, i risultati vengono espressi secondo la seguente terminologia:
- molto frequente, per i pollini che costituiscono più del 45 % del totale; - frequente, per i pollini che costituiscono dal 16 al 45 % del totale; - raro, per i pollini che costituiscono dal 3 al 15 % del totale; - sporadico, per i pollini che costituiscono meno del 3 % del totale.
Se il conteggio è stato eseguito a livello di determinazione delle frequenze, i risultati vengono espressi secondo la terminologia:
127
- polline di accompagnamento (16-45%);- polline isolato importante (3-15%); - polline isolato (<3%).
Se sono stati contati 1200 o più granuli pollinici le frequenze possono essere espresse in percentuale, con una precisione dell’1%. L’uso di decimali non appare comunque giustificato; i pollini presenti con una frequenza dell’1% o inferiori sono indicati come “presenti” (Sabatini, 2007, b).
Se viene determinata la frequenza degli elementi indicatori di melata (IM), nei risultati viene impiegata la seguente nomenclatura in cui P è la frequenza totale dei pollini di piante nettarifere:
- quantità non rilevante: IM/P = 0,00 – 0,09; - piccola quantità: IM/P = 0,10 – 1,49; - media quantità: IM/P = 1,50/2,99; - elevata quantità: IM/P = 3,00 – 4,49; - quantità molto elevata: IM/P > 4,50.
Si giunge così alla definizione di uno spettro pollinico complessivo che, interpretato alla luce delle conoscenze dei rapporti esistenti per ciascuna pianta fra numero dei granuli pollinici e quantità di nettare, permette di ottenere informazioni sulle origini florali principali e secondarie dei mieli esaminati, nonché sulla eventuale presenza di melata. È così possibile definire, confermare o meno una denominazione botanica (Sabatini, 2007, b).
L’origine botanica di un campione di miele può essere dedotta dalla frequenza dei pollini e degli elementi indicatori di melata contenuti nel suo sedimento, integrata, se necessario, con i risultati dell’analisi quantitativa (Sabatini, 2007, b).
In generale si considera che un miele provenga principalmente da una determinata origine botanica (uniflorale) se il polline della pianta in questione è dominante (superiore al 45%). I pollini di piante non nettarifere sono esclusi dal conteggio. Si considera che un miele provenga principalmente dalla melata quanto il rapporto IM/P > 3 (Sabatini, 2007, b).
Queste indicazioni non sono però sempre rispettate. Infatti si conoscono piante con polline iperrappresentato (per esempio Cynoglossum, Castanea, Eucalyptus) in cui il polline è presente in percentuale maggiore rispetto al contributo in nettare dato dalla pianta al miele, e piante con polline iporappresentato (per esempio Citrus, Lavandula, Robinia, Tilia, Medicago, Epilobium)
128
in cui il polline è presente in quantità limitata anche in caso di mieli uniflorali (Sabatini, 2007, b).Occorre tenere presente inoltre la possibilità di contaminazione secondaria o terziaria. Tutto ciò induce a un’estrema cautela nell’interpretazione dei risultati dell’analisi pollinica per la determinazione dell’origine botanica (Sabatini, 2007, b).
Terminato il conteggio gli spettri pollinici bruti vengono elaborati con idonei ausili informatici in maniera da mettere in evidenza le forme polliniche comuni alla maggior parte dei mieli studiati. Questo tipo di elaborazione viene condotta sia sui risultati complessivi che su quelli relativi alle diverse tipologie di miele identificate in fase di campionamento o nel corso delle analisi stesse. Si ottengono così “forme polliniche guida” o “spettri guida”. I taxa ritenuti esclusivi dei mieli studiati sono considerati come “forme polliniche traccianti”. Si ricercano ugualmente i campioni che si allontanano dallo schema di identificazione, in quanto non presentano né gli spettri guida né le forme polliniche traccianti. È necessario anche considerare analoghe informazioni riguardanti mieli di altre zone geografiche per valutare le effettive possibilità di differenziazione (Piana, Persano Oddo, 2001).
129
7- RISULTATI
130
7.1 - Determinazione del contenuto di acquaCampioni Umidità % 2007 Umidità % 2008
1 A 17,5 17,8 1 C 17,4 16,3 1 M 17,6 2 A 18,0 2 C 18,1 18,2 3 A 17,4 20,2 3 C 17,9 17,1 4 A 17,7 17,1 4 C 17,3 16,3 5 A 17,2 17,2 5 C 17,1 17,0 5 M 16,4 6 A 16,4 16,0 6 C 15,4 6 M 16,3 7 A 17,4 15,5 8 A 16,5 8 C 16,7 8 M 15,6 16,0 9 A 15,1 15,1 9 M 15,4 9’Me 15,1
Da questa tabella si evidenzia che i valori di umidità percentuale registrati nei campioni raccolti nel 2007 e nel 2008 sono tutti conformi al limite stabilito dal D. lgs. 179/2004 (inferiore al 20%) ad eccezione del campione 3 A del 2008 (20,2%).
Prendo in analisi separatamente i mieli di acacia e quelli di castagno e millefiori. Questo per evidenziare eventuali differenze legate al diverso periodo di bottinatura e di prelievo del campione. Per ogni tipologia di miele metto in evidenza inoltre l’altitudine dell’area di provenienza per verificare se è possibile stabilire una relazione fra questo fattore e la presenza di umidità nel miele.
Inizio con i mieli di acacia. Per il 2007 il valore più elevato di umidità relativa è stato registrato nel campione 2 A, relativo a un miele raccolto in località Gavinana, mentre nel 2008, come ho detto prima, il valore più alto è stato quello del campion 3 A, prelevato in località Pracchia. In entrambe le annate il valore più basso si è registrato nel campione 9 A, miele raccolto in località Celle. L’umidità media risulta uguale a 17,02% nel 2007 e 16,9% nel 2008.
131
Nei grafici che seguono ho indicato con una linea verde l’umidità media e con una linea rossa il limite del 20% di umidità.Grafico 2 Grafico 3 13 14 15 16 17 18 19 20 21 200-400 m slm 400-600 m slm 600-800 m slm 800-1000 m slm %
UMIDITA' % DEI MIELI DI ACACIA DEL 2007 IN BASE ALL'ALTITUDINE DELL'AREA DI PROVENIENZA
=17,02 9A 8A 7A 6A 5A 4A 3A 2A 1A L max 13 14 15 16 17 18 19 20 21 200-400 m slm 400-600 m slm 600-800 m slm 800-1000 m slm %
UMIDITA' % DEI MIELI DI ACACIA DEL 2008 IN BASE ALL'ALTITUDINE DELL'AREA DI PROVENIENZA
=16,98
9A 7A 6A 5A 4A 3A 1A
132
Calcolando la deviazione standard si nota come ci sia una maggiore variabilità nei campioni del 2008 rispetto a quelli del 2007. Questa risulta infatti pari a 0,89 nel 2007 e 1,72 nel 2008. Sembra inoltre che sia presente una correlazione fra l’altitudine dell’area di provenienza e l’umidità presente nel miele: osservando il grafico si apprezza l’andamento crescente dei valori andando dai campioni raccolti ad altitudini tipicamente collinari verso quelli raccolti in alta montagna.Questo potrebbe essere dovuto alle temperature inferiori a cui sono esposti gli apiari soprattutto durante le ore notturne, che determinerebbero una minore evaporazione dell’acqua, alla maggiore presenza di vegetazione, che in alcuni momenti del giorno può portare a mettere in ombra gli apiari, alla maggiore presenza di umidità notturna. Nei singoli casi sarebbe comunque opportuno prendere in considerazione il microclima presente nell’area di raccolta: ad esempio per il campione 3 A, che presenta un’umidità relativa alta, credo che sia opportuno sottolineare come questa sia dipesa forse da una non corretta collocazione dell’apiario stesso, distante solo qualche decina di metri da un corso d’acqua. Bisogna ricordare inoltre che si tratta di un apicoltore hobbysta, quindi sicuramente meno esperto nella conduzione dell’apiario e nelle pratiche di smielatura.
Per quanto riguarda i mieli di castagno faccio lo stesso tipo di analisi dei dati.
Grafico 4 13 14 15 16 17 18 19 20 21 200-400 m slm 400-600 m slm 600-800 m slm 800-1000 m slm %
UMIDITA' % DEI MIELI DI CASTAGNO DEL 2007 IN BASE ALL'ALTITUDINE DELL'AREA DI PROVENIENZA
8C 6C 5C 4C 3C 2C 1C
=17,1 L max
133
Grafico 5Dai grafici si evidenzia come il valore massimo di umidità per il miele di castagno si sia registrato sia nel 2007 che nel 2008 nel campione 2 C rispettivamente con il 18,1 e il 18,2 %, raccolto in località Gavinana (da notare che lo stesso apicoltore nel 2007 aveva riportato il valore più alto di umidità per il miele di acacia). I valori più bassi invece si registrano per il 2007 nel campione 6 C con 15,4 %, raccolto in località Casore del Monte, e nel 2008 nei campioni 1 C e 4 C, raccolti rispettivamente in località Il Melo e La Lima, entrambi con un tenore in umidità relativa pari al 16,3 %.
Il valore medio dell’umidità risulta essere del 17,1% per il 2007 e del 17% nel 2008. Calcolando la deviazione standard questa risulta pari a 0,89 nel 2007 e 0,78 nel 2008.
Nei campioni di miele di castagno non sembra così evidente la relazione fra altitudine e umidità percentuale, anche se per quanto riguarda quelli raccolti nel 2007, fatta eccezione per alcuni valori, sembrerebbe esserci anche qui un andamento crescente. Per i campioni del 2008 risulta difficile fare questo tipo di analisi, non tanto per il numero inferiore di dati disponibili ma per la minore varietà nelle aree di raccolta.
I mieli di millefiori mostrano dei livelli di umidità mediamente inferiori a quelli registrati nelle altre tipologie di miele, addirittura nessuno supera il 18 %, con un valore medio del 16,2 %. Sono tutti campioni di poliflora autunnali, raccolti fra la fine di agosto e la prima decina di
13 14 15 16 17 18 19 20 21 600-800 m slm 800-1000 m slm %
UMIDITA' DEI MIELI DI CASTAGNO DEL 2008 IN BASE ALL'ALTITUDINE DELL'AREA DI PROVENIENZA
1C 2C 3C 4C 5C =16,98 L max
134
settembre, ma la natura stessa, più varia, di questi mieli fa sì che sia più difficile stabilire con una certa precisione il periodo di bottinatura delle api.Grafico 6
Si evidenzia comunque anche in questo caso un aumento dell’umidità percentuale nel miele spostandosi dalle aree collinari verso quelle montane.
Atraverso l’analisi dei dati raccolti dalla Stazione Agrometereologica di Pistoia (presso il Centro Sperimentale per il Vivaismo) si evidenzia che le precipitazioni piovose nella provincia di Pistoia nel periodo compreso fra l’inizio di Maggio e la metà di Giungo del 2007 sono state pari a 109,8 mm, mentre nello stesso periodo del 2008 risultano pari a 97,2 mm; risulta inoltre che tra il 15 giugno e il 15 Luglio del 2007 sono state pari a 1,4 mm, mentre negli stessi giorni nel 2008 sono caduti 7,8 mm di pioggia. Considerato che per lo più le api bottinano i fiori di acacia appunto fra l’inizio di maggio e la metà di giugno e i fiori di castagno fra la metà di giugno e la metà di luglio, con variazioni dovute prevalentemente ai diversi tempi di fioritura alle varie altitudini, si osserva come nei campioni di miele di acacia in tre casi, su sette presi in esame, il valore di umidità relativa del 2007 risulti effettivamente superiore a quello del 2008, in due casi rimane invariato, e in due casi è addirittura più alto quello del 2008 rispetto a quello del 2007. Non sembra quindi esserci una così stretta relazione fra l’entità delle precipitazioni nel periodo di bottinatura e l’umidità relativa del miele, ma si potrebbe forse attribuire una maggiore importanza alla presenza di fattori locali (presenza di un microclima diverso nelle
13 14 15 16 17 18 19 20 21 200-400 m slm 400-600 m slm 600-800 m slm 800-1000 m slm %
UMIDITA' % DEI MIELI POLIFLORA DEL 2007 IN BASE ALL'ALTITUDINE DELL'AREA DI PROVENIENZA
9M 8M 6M 5M 1M
=16,21 L max
135
varie aree, diversa esposizione solare degli apiari, diverse attenzioni dell’apicoltore durante le visite in apiario e al momento della smielatura).Grafico 7 Grafico 8 13 14 15 16 17 18 19 20 21 1A 3A 4A 5A 6A 7A 9A %
Codice identificativo del campione
Confronto fra l'umidità % nei mieli raccolti nello
stesso apiario nei 2 anni (2007 e 2008)
2007 2008 13 14 15 16 17 18 19 20 21 1 C 2 C 3 C 4 C 5 C %
Codice identificativo del campione
Confronto fra l'umidità % nei mieli di castagno raccolti
nello stesso apiario nei 2 anni (2007 e 2008)
2007
136
Per i campioni di miele di castagno invece si nota come i valori del 2007 siano sempre più alti di quelli del 2008, fatta eccezione per il 2 C in cui comunque c’è solo una leggera differenza. Anche in questo caso non sembra esserci una stretta relazione fra l’entità delle precipitazioni piovose e l’umidità relativa del miele. Bisogna comunque considerare che i dati che ho sopra elencato si riferiscono all’intera provincia di Pistoia e difficilmente si può risalire con esattezza a quale sia stata l’effettiva situazione metereologica di ogni singola zona presa in esame.137
7.2 - Sostanze insolubili in acquaCampioni Sostanze insolubili (g/kg)
2007 Sostanze insolubili (g/kg) 2008 1 A 0,03 0,05 1 C <0,01 0,05 1 M 0,03 2 A 0,03 2 C 0,08 0,03 3 A 0,03 0,04 3 C 0,04 0,07 4 A 0,04 0,03 4 C 0,03 0,05 5 A 0,03 0,07 5 C 0,04 0,05 5 M 0,04 6 A 0,03 0,07 6 C 0,04 6 M 0,02 7 A 0,03 0,05 8 A 0,04 8 C 0,06 8 M 0,03 0,05 9 A 0,04 0,05 9 M 0,05 9’Me 0,05
Per quanto riguarda la presenza di sostanze insolubili nel miele ho provato nel grafico seguente a confrontare fra loro i mieli prodotti dai singoli apicoltori. La presenza di sostanze insolubili nel miele è indice di igiene della lavorazione, ma dai dati riportati si nota una grande variabilità tra i campioni raccolti da uno stesso apicoltore. Questo può far pensare a eventi accidentali che possono avere influito pesantemente sulla presenza di sostanze insolubili in questi campioni. Per risalire alla natura di questi eventi sarebbe stato necessario probabilmente eseguire un Filth Test (utile per identificare la tipologia delle sostanze presenti nel miele).
138
Grafico 9 AC AC AC C AC AC ACAC ACM AC ACM A A A ACM M AM AMe0
0,01
0,02
0,03
0,04
0,05
0,06
0,07
0,08
0,09
0,1
1
2
3
4
5
6
7
8
9
g
/100
g
Codice identificativo dell'azienda apistica
Sostanze insolubili nei campioni del 2007 e del 2008
139
In ogni caso tutti i mieli analizzati presentano un tenore in sostanze insolubili inferiore a 0,1 g/kg, limite stabilito dal D. lgs. 179/2004. Il valore più basso si registra nel campione 1 C del 2007 (inferiore a 0,01 g/kg) mentre il valore più alto è quello del campione 2 C del 2007 (0,08 g/kg). Osservando il grafico si nota come, fatta eccezione per i campioni 2 C e 4 A, ci sia stata una maggiore presenza di sostanze insolubili nei campioni del 2008 rispetto a quelli del 2007. Un andamento così trasversale mi fa pensare che sia intervenuto qualche fattore indipendente dall’osservazione delle norme igieniche da parte dei singoli apicoltori: ad esempio potrebbe essere stato un anno in cui si sono avute maggiori fioriture (e quindi presumibilmente maggiori quantità di polline raccolte dalle api) o, sempre facendo delle ipotesi, potrebbe esserci stata una maggiore presenza di parassiti legata a fattori climatici che potrebbero averne favorito il replicarsi.140
7.3 - Determinazione dell’attività diastasicaCampioni Diastasi (ud/kg)
2007 Diastasi (ud/kg) 2008 1 A 5,2 5,8 1 C 14 7,8 1 M 18 2 A 13,8 2 C 13,4 9,9 3 A 7,4 7,7 3 C 13,1 10,7 4 A 6,5 4,8 4 C 10,8 8,7 5 A 5,9 5,4 5 C 11,8 10 5 M 11,7 6 A 5,9 10,8 6 C 14,5 6 M 7,4 7 A 5,8 4,8 8 A 6,9 8 C 18,3 8 M 10,6 8 9 A 7,9 6,4 9 M 9,4 9’Me 9,7
141
Grafico 10Grafico 11
Ho preso in esame separatamente i mieli di acacia da tutti gli altri in quanto solo per questi l’esame del tenore in diastasi rappresenta anche un’indicazione di origine botanica: si tratta di una varietà di miele (come altre che ho riportato sopra) in cui il questo valore è naturalmente basso e sono tollerati quindi valori fino a 3 ud/kg. Considerato il fatto che sono trascorsi alcuni mesi dal momento della raccolta dei campioni al momento in cui sono state effettuate le analisi
0 2 4 6 8 10 12 14 16 18 20 1A 2A 3A 4A 5A 6A 7A 8A 9A ud/ kg
Codice identificativo del campione
Valori di diastasi nei campioni di miele di acacia
2007 2008 =6,9 L min 0 2 4 6 8 10 12 14 16 18 20 1C 1M 2C 3C 4C 5C 5M 6C 6M 8C 8M 9M 9’Me ud/ kg
Codice identificativo del campione
Valori di diastasi nei campioni di miele di castagno, poliflora e melata
2007 2008
=11,5 L min
142
è normale trovare dei valori non molto alti. Si nota che quasi tutti i campioni analizzati presentano un tenore in diastasi inferiore a 8 ud/kg, fatta eccezione per il 2 A del 2007 e il 6 A del 2008.In ogni caso tutti i valori sono superiori alle 3 unità diastasiche per chilo indicate come limite inferiore accettabile per il commercio del miele di acacia per uso alimentare (D. lgs. 179/2004). Per i campioni di altri tipi di miele invece il tenore in diastasi non dovrebbe mai essere inferiore alle 8 ud/kg. Vediamo che in realtà nei campioni 6 M del 2007, 1 C e 8 M del 2008 si registrano dei valori inferiori, questo potrebbe indicare una composizione pollinica diversa da quella dichiarata dall’apicoltore, così come una conservazione inadeguata del prodotto (forse a temperature troppo elevate) o anche eventuali trattamenti con il calore effettuati dall’apicoltore allo scopo di allontanarne in parte l’umidità (se si fa un confronto si nota che gli stessi campioni alla misurazione dell’umidità relativa avevano riportato valori compresi fra il 16 e il 16,3% di umidità). Non è possibile affermare con certezza che questo sia avvenuto in quanto potrebbero esserci dei mieli in cui il tenore in umidità è analogo già all’origine. Anche nei mieli che ho analizzato ho registrato dei valori anche più bassi in campioni che invece non riportano un tenore in diastasi eccessivamente basso come per esempio il 5 M e il 6 C del 2007. Resta comunque un’ipotesi da tenere in considerazione.
143
7.4 - Idrossimetilfurfurale (HMF) Campioni HMF (g/kg) 2007 HMF (g/kg) 2008 1 A 0,7 4,2 1 C < 0,1 1,4 1 M 1,1 2 A 2,3 2 C 0,8 1,3 3 A 1,4 2,6 3 C 2 0,6 4 A 2,7 4,7 4 C < 0,1 0,6 5 A 3,1 4,5 5 C 0,3 3,6 5 M 2,6 6 A 2,3 18,5 6 C < 0,1 6 M 1,8 7 A 2,2 3,3 8 A 12,9 8 C < 0,1 8 M 8,5 11,3 9 A 3,8 8,2 9 M 5 9’Me 20,8144
Grafico 12Grafico 13
Come ho detto prima l’HMF nel miele appena estratto viene considerato praticamente assente, si forma col passare del tempo per degradazione degli zuccheri. Vediamo nel grafico come in effetti la maggior parte dei mieli analizzati, 31 su 35, abbiano un tenore in HMF inferiore a 10 g/kg (valore considerato indice di ottima qualità in termini di freschezza del miele); addirittura 29 di questi si collocano su valori inferiori a 5 g/kg. Bisogna sottolineare la presenza comunque
0 5 10 15 20 25 30 35 0-5 5,1-10 10,1-15 15,1-20 20,1-25 n. ca m pi oni HMF (g/kg)
Numero di campioni in relazione alla quantità di HMF (2007 e 2008) 0 2 4 6 8 10 12 14 16 18 20 22
1A1C1M2A2C3A3C4A4C5A5C5M6A6C6M7A 8A8C8M9A9M9’Me
g/
kg
Codice identificativo del campione
HMF nei mieli del 2007 e del 2008
2007 2008
145
di alcuni campioni come il 6 A del 2008, l’8 A del 2007, l’8 M del 2008 e il 9’Me del 2008, in cui si raggiungono valori più alti.Premesso che nessuno di questi campioni supera il limite indicato dal D. lgs. 179/2004 (40 mg/kg), vorrei ugualmente fare alcune considerazioni riguardo alla presenza di campioni come l’ 8 M del 2008 che aveva anche un tenore in diastasi piuttosto basso e per il quale mi sentirei di considerare probabile l’eventualità che sia stato trattato con il calore; per quanto riguarda i campioni 6 A del 2007 e 8 A del 2008 anche in questo caso potrei ipotizzare la pratica di trattamenti con calore. Tenuto conto del fatto che il campione 8 A e 8 M provengono dallo stesso apicoltore questo potrebbe farmi supporre anche in questo caso un trattamento termico (da notare che anche il campione 8 M del 2007, per quanto presenti un valore di HMF inferiore ai 10 mg/kg, si discosta in modo significativo dalle altre misurazioni). Per il campione 6 A l’evidente differenza nel tenore di HMF tra i due anni mi fa ipotizzare un mescolamento con miele dell’anno precedente nel 2008 (ipotesi resa ancora più probabile dal fatto che, in base a quanto riportato nel rapporto annuale della produzione e commercializzazione del miele e anche in considerazione di quanto sostenuto da tutti gli apicoltori che hanno partecipato a questo studio, la produzione di acacia nel 2008 sarebbe stata nettamente inferiore a quella del 2007). Il campione 9’Me è quello che mostra un livello di HMF più alto tra i campioni raccolti; andando a osservare il grafico riferito alle diastasi si nota come nello stesso campione vi sia un livello di diastasi piuttosto basso (9,7). Questo potrebbe far pensare a una conservazione troppo protratta nel tempo, forse aggiunta di miele dell’anno precedente, o la pratica di trattamenti termici. Dello stesso apicoltore ho un altro campione di millefiori che presenta valori di HMF comunque non troppo bassi, sebbene inferiori ai 10 mg/kg.
Osservando i campioni in cui ho dei valori di HMF inferiori a 5, e quindi da considerarsi freschi, è interessante notare come tra i mieli raccolti da uno stesso apicoltore spesso ci sia un valore leggermente superiore nel miele di acacia rispetto al castagno, fa eccezione solo il miele raccolto nell’azienda apistica 3 nel 2007. Questo potrebbe essere a causa del tempo di conservazione maggiore, un mese - un mese e mezzo, che ha comportato un leggero aumento di questo valore, ma bisogna considerare anche che nel miele di acacia l’HMF è normalmente più alto rispetto al miele di castagno.
146
Grafico 14 A C A C A C A C A C A C A C A C 0 1 2 3 4 5 1 3 4 5 g/ kgCodice indicativo dell'azienda apistica
Confronto fra il contenuto di HMF nei mieli di castagno e di acacia (divisi per azienda apistica)
A-07 C-08
2007 2008
147
7.5 - Determinazione di pH, acidità libera, acidità combinata o lattoni e acidità totaleCampioni PH 2007 PH 2008 1 A 4,2 3,8 1 C 5,6 5,4 1 M 4,7 2 A 4,1 2 C 5,1 5,5 3 A 4,2 4,2 3 C 4,9 5,6 4 A 4,1 3,9 4 C 5,8 5,8 5 A 4,1 3,9 5 C 5,3 5,4 5 M 4,9 6 A 4,1 4,1 6 C 5,6 6 M 4,2 7 A 3,9 4 8 A 4,1 8 C 5,5 8 M 4,7 4,8 9 A 4,1 4,1 9 M 4,5 9’Me 4,6
Il pH è considerato uno degli indicatori dell’origine botanica del miele, in quanto nei mieli uniflorali tende ad avere valori pressoché costanti.
Dai grafici che ho riportato di seguito si nota come in effetti ci sia un andamento piuttosto costante nel pH dei mieli uniflorali, fatta eccezione per i campioni di miele di castagno del 2007.
Facendo la media dei valori di pH registrati nei campioni di acacia del 2007 ottengo un valore pari a 4,1, mentre per quelli del 2008 la media risulta 4.
Per quanto riguarda invece i campioni di miele di castagno si ottiene per il 2007 un valore medio pari a 5,4 e per il 2008 pari a 5,5.
Quindi attraverso l’esame del pH appare possibile distinguere con precisione l’appartenenza del miele a una di queste due specie botaniche.
148
Il pH dei mieli poliflora è molto vario e può talvolta sovrapporsi a quello dell’acacia o del castagno, lasciando perciò un margine d’incertezza nella determinazione dell’origine botanica di un campione. Il parametro pH, quindi, da solo non è sufficiente a fornire un’indicazione precisa.Grafico 15
Grafico 16
Nel grafico 20 gli stessi dati sono rappresentati in forma di istogramma.
1A 2A 3A 4A 5A 6A 7A 8A 9A 1M 5M 6M 8M 9M 1C 2C 3C 4C 5C 6C 8C 3,5 4 4,5 5 5,5 6 6,5 7 pH pH 2007 Acacia Millefiori Castagno 1A 3A 4A 5A 6A 7A 9A 9'Me 1C 2C 3C 4C 5C 8M 3,5 4 4,5 5 5,5 6 6,5 7 pH pH 2008 Acacia Millefiori Castagno Melata
149
Grafico 17Prendo in esame ora i valori di acidità libera, lattoni e acidità totale.
Tabella 4: Risultati di acidità libera, lattoni e acidità totale relativi ai campioni del 2007
Campioni Acidità libera Lattoni Acidità totale
1 A 6,6 1,5 8,1 1 C 7,6 0,6 8,2 1 M 10,4 3,6 14 2 A 7,9 2,7 10,6 2 C 11,7 2 13,7 3 A 9,1 2,8 11,9 3 C 12,3 3 15,3 4 A 7,2 2,1 9,3 4 C 6,7 0,5 7,2 5 A 7,2 2,3 9,5 5 C 9,3 1,8 11,1 5 M 14,3 3,4 17,7 6 A 8,8 2,2 11 6 C 8,5 1,6 10,1 6 M 10,9 2,4 13,3 7 A 8,8 3,7 12,5 8 A 9,7 3,5 13,2 8 C 10,9 2 12,9 8 M 15,4 4,3 19,7 9 A 7,9 3,2 11,1 9 M 19,5 5,8 25,3 3,5 4 4,5 5 5,5 6 6,5 7 1A 2A 3A 4A 5A 6A 7A 8A 9A 1M 5M 6M 8M 9M 1C 2C 3C 4C 5C 6C 8C 9’Me Codice identificativo del campione
pH
2007 2008
150
Grafico 18Tabella 5: Risultati di acidità libera, lattoni e acidità totale relativi ai campioni del 2008
Campioni Acidità libera Lattoni Acidità totale
1 A 12,5 5,7 18,2 1 C 17,6 1,9 19,5 2 C 9,1 1,2 10,3 3 A 21,8 6,8 28,6 3 C 9 1,3 10,3 4 A 10,6 4,5 15,1 4 C 7,7 1,1 8,8 5 A 9,4 3,7 13,1 5 C 11,2 0,9 12,1 6 A 11,7 5,3 17 7 A 9,1 3,2 12,3 8 M 13,2 2,6 15,8 9 A 11,1 4,3 15,4 9’ Me 20,1 3,6 23,7 0 5 10 15 20 25 30 35 1A 1C 1M 2A 2C 3A 3C 4A 4C 5A 5C 5M 6A 6C 6M 7A 8A 8C 8M 9A 9M meq /kg
Codice identificativo del campione
Acidità libera e lattoni nei campioni del 2007
Lattoni Acidità libera
151
Grafico 19Queste tre misure sono tra loro collegate: l’acidità totale infatti non è altro che la somma delle altre due.
Prendo in esame in particolare l’acidità libera perché è l’unico parametro per cui la normativa prevede un limite.
Dalle tabelle e dai grafici riportati sopra si evidenzia come tutti i campioni presi in esame rientrino abbondantemente nel limite stabilito di 50 meq/kg (da cui si deduce un buon operato da parte degli apicoltori).
0 5 10 15 20 25 30 35 1A 1C 2C 3A 3C 4A 4C 5A 5C 6A 7A 8M 9A 9’ Me m eq /kg
codice identificativo del campione
Acidità libera e lattoni nei campioni del 2008
Lattoni Acidità libera
152
7.6 - Analisi melissopalinologicaTabella 6(1): Percentuale di pollini presenti nei campioni 1 A, 1 C, 1 M, 2 A, 2 C, 3 A, 3 C del 2007 (p=presente in tracce)
Specie botaniche Campioni
1° 1C 1M 2A 2C 3A 3C Abies Acacia f Acer pseud. Gr 1 4 7 p 8 p Actinidia p Aesculus 1 1,5 5 p Ailanthus p p Allium Alnus p Artemisia p Asparagus acutifolius gr Astragalus/Oninis f p Borrago Brassica f p p 1 1,5 p Bryonia Campanula Castanea 42 100 81 6 100 38 98 Catalpa Centaurea jacea gr Chamaerops f 1 Cistus p <1 p Citrus Clematis p p <1 Compositae A p p Compositae H (Eupatorium f) p p Compositae H (Helianthus f) p Compositae H (Senecio f) Compositae S (Arctium f) Compositae S (Carduus f) p Compositae T p p p 1,5 p p Convolvulus Cornus sanguinea <1 p Coronilla/Hippocrepis f p 1,5 Corylaceae p p Cynoglossum Dorycnium f Dyospiros Echium p 12 p Epilobium Erica 2 <1 p <1 Eucalyptus
153
Specie botaniche Campioni
1A 1C 1M 2A 2C 3A 3C Euphorbia p Filipendula Fraxinus ornus 3 1 <1 4 p Galega f Galium Genista f p p 6 1 Geranium Gleditsia p p Graminaceae p 2 p p 1 Hedera p Hedysarum Helianthemum p p p Hypericum Ilex <1 Juglans <1 Juncus f p Knautia Labiatae L 1 Lagerstroemia Ligustrum f p Liliaceae Linaria f Liriodendron Lotus 1 p p Lythrum Magnolia Malvaceae Medicago sativa Melilotus <1 Mercurialis Nigella Olea f 2 p Onobrychis <1 Papaver f p <1 p Parthenocissus Pinus f p 1,5 p Plantago p 1 Potentilla f p Poterium 1,5 Prunus f p p 2 7 p 12 1 Querqus ilex gr 26 2 p 3 Querqus robur gr 1 p <1 p 1 Ranunculus repens gr p p Ranuncolaceae (altre) p p
154
Specie botaniche Campioni
1A 1C 1M 2A 2C 3A 3C Rhamnus Rhinanthus f 1 1,5 p Robinia 16 p 4 35 p 20 p Rosa f p p p Rubus f p 2 p <1 Rumex 1 p 1 Salix 2 1 3 <1 Sambucus ebulus Sambucus nigra 2 4 p 2 Scabiosa Sedum f p <1 p Sinapis f <1 Stellaria f P Teucrium p p Thymus f Tilia Trifolium pratense gr <1 Trifolium repens gr p 1 p Umbelliferae p p Urticaceae p p Verbascum 1 p p Verbena Viburnum Vicia Vitis p Xanthium Zea
Tabella 7 (2): Percentuale di pollini presenti nei campioni 4 A, 4 C, 5 A, 5 C, 5 M, 6 A, 6 C del 2007 (p=presente in tracce)
Specie botaniche Campioni
4A 4C 5A 5C 5M 6A 6C Abies Acacia f p p p p p Acer pseud. Gr 3 p 5 Actinidia Aesculus Ailanthus p p Allium Alnus Artemisia Asparagus acutifolius gr p Astragalus/Oninis f p p <1 Borrago Brassica f 2 <1 11 p 1 p