UNIVERSITÀ DI PISA - FACOLTÀ DI AGRARIA
Corso di Laurea Specialistica in Produzione e Difesa dei Vegetali
(curriculum Produzione dei Vegetali)
IMPIEGO DI ACQUE RICCHE IN BORO NELLE
COLTURE DI SERRA A CICLO CHIUSO
Candidata: Barbara Ferrini
Matr. 294037
Relatori:
Prof. Alberto Pardossi
Dr. Giulia Carmassi
2
INDICE
PREMESSA
1. INTRODUZIONE pag.
1.1 IL BORO IN NATURA 4
1.2 IL BORO NELLA CATENA ALIMENTARE 9
1.3 IL BORO NELLE PIANTE 11
2. PARTE SPERIMENTALE
2.1 SCOPO DELLA PROVA 182.2 MATERIALE E METODI 19 2.3 RISULTATI 24 2.4. DISCUSSIONE 37 BIBLIOGRAFIA 43 RIASSUNTO 48 SUMMARY 50
3 PREMESSA
L'agricoltura assorbe la maggior parte delle risorse idriche. Si calcola che a livello mondiale circa il 70 % dell'acqua prelevata dai fiumi, dai laghi e dalle falde sotterranee sia destinato all'irrigazione. L'agricoltura irrigua ha avuto il suo massimo sviluppo nel secolo scorso, quando questa tecnica è stata applicata nei paesi del Sud del mondo, principalmente Cina, India, Pakistan.
L'irrigazione è praticata con modalità diverse in base alle aree geografiche, alle condizioni climatiche, ai livelli di tecnologia e automazione, contribuendo così a stabilizzare la produzione delle colture sfruttando al massimo i fattori produttivi . I prelievi per usi irrigui superano in molte zone le capacità di apporto naturale e quella di ricostituzione delle riserve idriche, causando la salinizzazione delle falde freatiche per l’eccessivo emungimento delle acque , senza valutarne il contenuto idrico. Questo fenomeno è diffuso nelle zone costiere dove l’infiltrazione delle acque marine và a sostituire la riserva di acqua dolce creando anche dissesti idrogeologici del sottosuolo. Su 270 milioni di ettari di superficie irrigata totale si stima che 20-30 milioni siano colpiti da questo fenomeno.
È necessario pianificare gli usi e razionalizzare le risorse idriche disponibili ciò è reso possibile da importanti interventi come: l’uso di tecniche irrigue ad alta efficienza; uso di culture adatte alla specifiche condizioni climatiche, pedologiche e socio-economiche; impiego di acque reflue depurate; sistemi di irrigazione di dimensioni ridotte; sistemi di drenaggio artificiale che permettano di evitare il fenomeno della salinizzazione; educazione e controlli sul corretto impiego di concimi e fitofarmaci, difesa delle terre più fertili da altri utilizzi (es. inurbamento). Infine, occorre sottolineare che il consumatore può fare molto acquistando prodotti di stagione, di provenienza locale o nazionale, prodotti biologici oppure prodotti col marchio di qualità. L’interesse personale verso la produzione di ortaggi è nato durante il percorso di studi, appassionandomi così alle attività svolte dal Dipartimento di Biologia delle piante agrarie. Le attività all’interno mi hanno arricchita su un piano pratico, operando in serra e successivamente in laboratorio; apprendere il metodo d’indagine è un occasione che permette di riassumere l’obiettivo e le tecniche con cui si vuol raggiungere.
4
Capitolo 1: IL BORO
1.1 IL BORO IN NATURA
Il Boro (B) è l’unico non-metallo del Gruppo XIII nella tavola periodica degli elementi e presenta, dal punto di vista elettrochimico, comportamenti simili al silicio e al carbonio. Come questi due elementi, infatti, il B è in grado di formare composti molecolari covalenti. Tuttavia presenta un numero di valenza inferiore a quello degli orbitali che lo rende “elettron-deficiente” permettendogli la formazione di legami dativi ad esempio con metalli. Ciononostante, grazie alle sue piccole dimensioni unite a una forte energia di ionizzazione, tende più facilmente a formare legami covalenti (Kot 2008).
Il B è generalmente presente in natura come ossi-composto: borati, acido borico, ossido di boro e sodio borato sono composti generalmente stabili eccetto che per deidratazione ad alte temperature (Boron 1998). L’atomo di B può essere circondato da un’innumerevole quantità di gruppi molecolari tra cui gli acetossili (RCOO-), i perossidi (ROO-), gli alogeni ecc. (Johnson, 2005).
Mentre la presenza e la ripartizione del B nella biosfera sono state stimate in maniera più o meno precisa (Tabella 1 Kot, 2008), molte incertezze rimangono sul ciclo del B nell’ambiente.
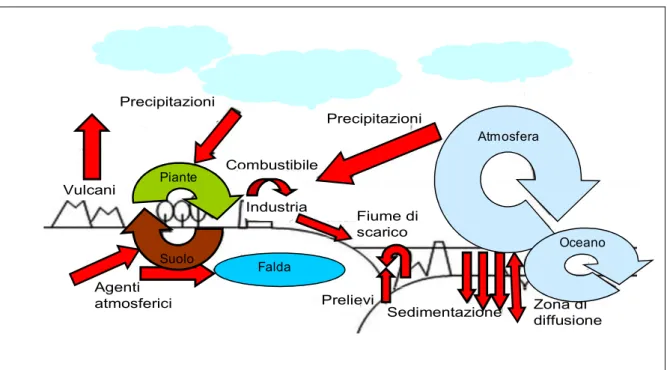
Tre principali cicli (pianta-terreno, oceano-crosta oceanica e atmosfera-oceano) sono stati individuati da diversi autori (Figura 1; Kot, 2008). Tuttavia, l’entità dei flussi con cui il B si muoverebbe attraverso i vari compartimenti della biosfera resta incerta e gli studi effettuati a tal proposito presentano una certa eterogeneità. Alcuni autori sostengono che la maggiore mobilitazione, al livello naturale del B, avvenga attraverso le emissioni vulcaniche a scapito delle riserve accumulate nella crosta terrestre (0,017-2,10 x 109 Kg per anno). Una minore, seppure consistente, percentuale sarebbe attribuita alla degradazione chimico-fisica delle
5
rocce sedimentarie e del suolo (0,043-0,15 x 109 kg per anno). Comunque, un’imponente mobilitazione del B avviene anche attraverso processi antropologici, principalmente legati all’industria del vetro e dei detergenti (0,31-1,36 x 109 kg per anno). A questo proposito si stima che il consumo di B sia aumentato del 4,7 % dal 2001 al 2005. Una significativa importanza assumono pure i processi di combustione fossile (0.20-0.44 x 109 kg per anno) (Kot, 2008).
Tabella 1. Riserve di boro nella biosfera (Kot, 2008).
Riserve Contenuto (Kg)
Crosta continentale e oceanica 1018
Oceani 1015 Acqua di falda 1011 Ghiacciai 1011 Depositi di carbone 1010 Depositi commerciali di B 1010 Biomassa 1010 Acqua superficiale 108
Tre principali cicli (pianta-terreno, oceano-crosta oceanica e atmosfera-oceano) sono stati individuati da diversi autori (Figura 1; Kot, 2008). Tuttavia, l’entità dei flussi con cui il B si muoverebbe attraverso i vari compartimenti della biosfera resta incerta e gli studi effettuati a tal proposito presentano una certa eterogeneità. Alcuni autori sostengono che la maggiore mobilitazione, al livello naturale del B, avvenga attraverso le emissioni vulcaniche a scapito
6
delle riserve accumulate nella crosta terrestre (0,017-2,10 x 109 Kg per anno).
Comunque, un’imponente mobilitazione del B avviene anche attraverso processi antropologici, principalmente legati all’industria del vetro e dei detergenti (0,31-1,36 x 109 kg per anno). A questo proposito si stima che il consumo di B sia aumentato del 4,7 % dal 2001 al 2005. Una significativa importanza assumono pure i processi di combustione fossile (0.20-0.44 x 109 kg per anno) (Kot, 2008).
Vulcani Agenti atmosferici Suolo Falda Prelievi Sedimentazione Zona di diffusione Oceano Oceano Atmosfera Precipitazioni Precipitazioni Piante Fiume di scarico Industria Combustibile Piante Suolo Falda Atmosfera Oceano
Figura 1. Il turn-over del B nell’ambiente (Kot, 2008).
Il B è presente nell’atmosfera in forma gassosa o come particolato e la sua concentrazione può variare tra 0,2 e 300 µg L-1 (Rose-Koga et al., 2006). Tuttavia, considerando l’attività agricola e la salute umana, la presenza del B è maggiormente studiata nelle soluzioni acquose e nel terreno.
In effetti, il B torna dall’atmosfera al suolo proprio tramite i fenomeni meteorici che possono talora arricchire di questo elemento le acque superficiali. Tuttavia, la concentrazione di B nell’acqua piovana non raggiunge valori troppo elevati e oscilla tra 0,0003 e 0,009 mg L-1. La
7
concentrazione di B, nei corsi d’acqua superficiali o nei bacini idrici, in condizioni normali, varia invece tra 0,009 e 0,3 mg L-1. Per quanto riguarda l’acqua proveniente da falde sotterranee, il contenuto in B può essere estremamente variabile con concentrazioni che vanno da 0,017 a 1,90 mg L-1. Questi valori possono aumentare notevolmente nelle vicinanze di zone con attività geotermica a causa della sua forte concentrazione nelle acque termali (0,2-72 mg L-1). Nell’area Mediterranea ad esempio, la concentrazione di B nelle riserve idriche può arrivare a valori di 3-13 mg L-1 nelle zone più esposte come (Val di Cornia, Italia) come evidenziato da un recente progetto di ricerca (BOREMED, http://boremed.brgm.fr/). Meno variabile invece è il livello del B nelle acque marine, dove la concentrazione media risulta stabile intorno a 4,5 mg L-1 sulla media mondiale (Kot, 2008).
Il B è presente nell’atmosfera in forma gassosa o come particolato e la sua concentrazione può variare tra 0,2 e 300 µg L-1 (Rose-Koga et al., 2006). Tuttavia, per fini connessi all’attività agricola e alla salute degli esseri viventi, la presenza del B è maggiormente studiata nelle soluzioni acquose e nel terreno.
In effetti, il B torna dall’atmosfera al suolo proprio tramite i fenomeni meteorici che possono talora arricchire di questo elemento le acque superficiali. Tuttavia, la concentrazione di B nell’acqua piovana non raggiunge valori troppo elevati e oscilla tra 0,0003 e 0,009 mg L-1. La concentrazione di B, nei corsi d’acqua superficiali o nei bacini idrici, in condizioni normali, varia invece tra 0,009 e 0,3 mg L-1. Per quanto riguarda l’acqua proveniente da falde sotterranee, il contenuto in B può essere estremamente variabile con concentrazioni che vanno da 0,017 a 1,90 mg L-1. Questi valori possono aumentare notevolmente nelle vicinanze di zone con attività geotermica a causa della sua forte concentrazione nelle acque termali (0,2-72 mg L-1). Nell’area Mediterranea ad esempio, la concentrazione di B nelle riserve idriche può arrivare a valori di 3-13 mg L-1 nelle zone più esposte come (Val di Cornia, Italia) come evidenziato da un recente progetto di ricerca (BOREMED, http://boremed.brgm.fr/). Meno variabile invece è il livello del B nelle acque marine, dove la concentrazione media risulta
8
stabile intorno a 4,5 mg L-1 sulla media mondiale (Kot, 2008).
Una serie di studi condotti nell’ambito del Progetto UE-BOREMED (http://boremed.brgm.fr/) ha messo in evidenza come la presenza di B nelle acque sotterranee non sia causata da una contaminazione antropica legata all’attività urbana, agricola e/o industriale (rilascio di detersivi, fertilizzanti, ecc.), ma dall’attività geotermica pleistocenica dell’area. Le acque superficiali del fiume Cornia e dei suoi affluenti che costituiscono la principale ricarica dell’acquifero alluvionale hanno concentrazioni in boro significativamente superiori a quelle misurate nelle acque superficiali. I contenuti in B del Cornia (e dei suoi affluenti) sono causate dall’interazione delle acque con la matrice fine dei sedimenti che costituiscono l’acquifero (Weinthal et al., 2005).
Il B è presente nel terreno sotto diverse forme (soluzione ricircolante, frazione organica e frazione minerale). La presenza del B in un terreno è fortemente influenzata dal pH della soluzione ricircolante, dalla tessitura, dall’umidità e dalla temperatura (Kot, 2008).
Diversi autori riportano una correlazione positiva fra la disponibilità di B nel terreno e pH per valori compresi tra 3 e 9 (Bingham et al., 1971; Elrashidi e O’Connor, 1982). Un’eccessiva umidità nel terreno può provocare importanti perdite di B legate ai fenomeni di lisciviazione (Kot, 2008), mentre nei terreni argillosi il B viene più facilmente trattenuto, in parte per i ridotti fenomeni di percolazione delle acque e in parte per la forte capacità delle argille di formare complessi stabili con questo ione (Mattigod et al., 1985). La presenza di sostanza organica nel terreno costituisce una riserva importante di B grazie alla presenza di questo elemento in molti composti organici come già riportato. Alcuni autori hanno mostrato non solo che la presenza di B nella sostanza organica del terreno può essere superiore a quella nella frazione minerale (Yermiyahu et al., 2001; Lemarchand et al., 2005), ma anche che l’assorbimento del B è positivamente influenzato dalla concimazione con materiali organici (Yermiyahu et al., 2001). Quindi, le concentrazioni di B nei terreni risultano molto basse, tanto da provocare carenze, nelle aree molto umide con terreni ben drenati come accade in
9
alcune regioni della Cina, Giappone o USA (Tanaka e Fujiwara, 2008), mentre eccessi di B si verificano nei climi aridi come sperimentato nell’area Mediterranea, Cile, Perù (Nord), Sud dell’Australia e California (Kot, 2008; Tanaka e Fujiwara, 2008). Comunque, eccessi di B nel terreno dipendono fortemente anche dalla vicinanza di acque geotermiche come già menzionato.
1.2 IL BORO NELLA CATENA ALIMENTARE
Alcuni recenti studi hanno evidenziato che l’assenza di B determinerebbe squilibri nel sistema immunitario aumentando anche il rischio di artriti nei ratti (Nielsen 200). Altri autori individuano nel B una delle concause scatenanti il morbo della mucca pazza (Kot 2008). La presenza di B negli esseri viventi può variare notevolmente (Figura 2; Bowen, 1966). L’importanza del B negli animali e nell’uomo è stata evidenziata a partire dagli anni 80 (Nielsen 2000). Maggiore incertezza è legata agli effetti dannosi che un’eccessiva assunzione di B può avere sull’organismo animale o umano. In Tabella 2 (Kot, 2008) sono riportati i limiti stabiliti da diversi paesi per il B nelle acque potabili.
batteri alghe marine fauna marina flora terrestre fauna terrestre B contenuto mg / Kg
10
Tabella 2. Concentrazioni massime di B ammesse nell’acqua potabile (Kot, 2008).
Paese/Organizzazione Concentrazione (mg L-1) Canada 5,0 Unione Europea 1,0 Russia 0,5 USA 0,3 WHO 0,3
Secondo quanto riportato in una recente Opinione dell’EFSA (European Food Safety Agency, 2004), il B è presente negli alimenti come borato ed acido borico. Non è stata stabilita nessuna specifica funzione biochimica per il B in animali o uomo. Nell’uomo il B può influenzare il metabolismo e l’utilizzo di altri nutrienti, in particolare il calcio, per il quale si sono ottenuti benefici durante il processo di calcificazione. Studi svolti su cavie con dieta alimentare priva di B hanno riportato effetti avversi sulla crescita, sulle concentrazioni di ormoni steroidei e la calcificazione della ossa. Gli effetti di diete con concentrazioni di boro basse sono marcati e proporzionati alla bassa concentrazione di altri nutrienti (vitamina D, magnesio).
La disponibilità di dati sul B, nei paesi dell’Unione europea, è piuttosto limitata. A parte l’acqua, i vegetali e la frutta sono fra le più importanti fonti di B legate all’alimentazione umana (Tanaka e Fujiwara, 2008).
Il B come borato è assorbito prontamente (>90%) dall'intestino umano ed è distribuito uniformemente in tutti i tessuti ed organi e può attraversare la placenta nel genere animale. Il B assorbito è espulso con le urine. L'ingestione di B a livelli superiori ai 13 mg/giorno per Kg di peso corporeo ha mostrato (su topo, ratto, cane e maiale) effetti avversi, durante lo svilupo
11
e la riproduzione. Su topi e ratti in alrte prove non si è avuto alcun effetto tumorale. L'ingestione di acido borico alla dose giornaliera di 0.14 - 0.43 g per Kg di peso corporeo, per periodi che variano da alcuni giorni a settimane, ha dato luogo a disturbi gastrointestinali come nausea, diarrea e dolore addominale. I dati sugli effetti del B nell’uomo non sono stati sufficienti per stabilire un livello di tolleranza. Quest’ultimo è stato calcolato valutando i disturbi provocati a basse concentrazioni di B negli animali. Per l’uomo, invece, il livello di tolleranza è stato estrapolato moltiplicanto per un coefficiente di sicurezza pari a 60 (che tiene conto della variabilità tra ratti e uomo, nonché tra individui diversi) ottenendo un valore di 9.6 mg/Kg di peso corporeo al giorno (ADI), equivalenti a 10 mg per persona adulta. Tale quantità diminuirebbe in funzione dell’età per scendere fino a 3 mg al giorno nei bambini di età compresa tra uno e tre anni.
1.3 IL BORO NELLE PIANTE
Il boro è considerato come un microelemento polivalente nella pianta, essenziale a molti processi metabolici tra cui il metabolismo degli acidi nucleici, carboidrati, proteine, acido indolacetico e fenolo, inoltre favorisce l’integrità delle membrane cellulari ed è un costituente della parete cellulare. Tuttavia, i processi molecolari di questi ruoli sono per la maggior parte sconosciuti (Tanaka e Fujiwara 2008). Recentemente è stato evidenziato come il B costituisca un elemento essenziale per la formazione della parete cellulare grazie alla sua capacità di stabilire legami con le pectine (Kobayashi et al. 1996; O'Neill et al., 2004).
Tra tutti i micronutrienti la deficienza in boro è una delle carenze nutrizionali più largamente diffuse a causa della sua mobilità nel terreno che lo rende facilmente lisciviabile (Kot, 2008). Essa si manifesta principalmente attraverso una crescita ridotta causata dalla sua scarsità nelle pareti e membrane cellulari. Così, l’espansione fogliare e radicale risultano ridotte come pure la dominanza apicale e lo sviluppo di fiori e frutti, determinando una generale riduzione di
12
qualità e quantità nel prodotto finale (Brown et al., 2002; Tanaka e Fujiwara, 2008).
Il B viene assorbito dalla pianta a livello radicale come acido borico. L’assorbimento di questo elemento avviene per lo più passivamente seguendo i gradienti di concentrazione tra l’ambiente esterno e i tessuti della pianta. Comunque, in linea generale sono riconosciuti tre modelli di trasporto: i) trasporto passivo legato alla permeabilità dei lipidi di membrana al B; ii) trasporto attivo, attraverso canali specifici (BOR); iii) trasporto attivo attraverso canali regolati dall’attività di proteine (NIP) Figura 3; Takano et al., 2008). Nelle lunghe distanze il B è trasportato soprattutto per via xilematica seguendo i flussi transpiratori; questo spiega parzialmente anche l’accumulo di tale elemento nella parte marginale delle foglie più vecchie (Brown e Shelp, 1997).
13
Nei tessuti della pianta il B è difficilmente ritraslocato, quindi in situazioni di carenza le parti giovanili ne risentono in maniera più accentuata a causa dell’accumulo di questo elemento nelle parti più vecchie della pianta. Tuttavia, alcuni studi hanno mostrato che in alcune specie (melo, mandorlo, pesco e susino) il B è ben distribuito nelle diverse porzioni della pianta, anche quando la sua presenza nel suolo è scarsa, mostrando addirittura un leggero aumento della concentrazione nelle foglie più giovani (Brown e Shelp, 1997). Esistono quindi due modelli di comportamento: un primo tipico di piante, come alcune specie arboree, in grado di rimobilizzare il B per via floematica, ed un secondo tipico di molte specie orticole, ad esempio, che sono appunto di rimobilizzare questo elemento. Nel primo caso il trasporto per via floematica sarebbe legato al trasporto di fotosintetati (mannitolo e sorbitolo), ai quali il B si lega attraverso i gruppi idrossilici in posizione cis. Comunque, diversi studi riporterebbero la rimobilizzazione del B, anche in piante che non producono alcoli, attraverso canali specifici per il B (girasole) (Noguchi et al., 2000). Tuttavia, questo comportamento sarebbe indotto solo in caso di carenza.
In conclusione, il B nella pianta è trasportato/assorbito passivamente soprattutto in condizioni non limitanti sfruttando la permeabilità della membrana cellulare mentre, in situazioni di deficienza, il trasporto/assorbimento attivo di questo ione aumenterebbe come risposta della pianta a questo tipo di stress (Tanaka and Fujiwara 2008) (Fig. 3).
La tossicità da boro
Il boro è un microelemento necessario alla nutrizione delle piante ma se è presente a livelli eccessivi nel terreno o nell’acqua di irrigazione può essere fitotossico ed il confine tra il livello di concentrazione considerato ottimale per la crescita ed il livello di tossicità per le piante è molto stretto (Gupta et al., 1985).
I primi sintomi inerenti la tossicità da B si manifestano, nella maggior parte della piante, con una leggera clorosi fogliare la quale evolve in necrosi. Queste aree, collocate dapprima sul
14
margine fogliare, si allargano dall’esterno verso l’interno e presentano una concentrazione di B significativamente superiore rispetto al tessuto “sano” della foglia (Nable et al., 1997). Tuttavia, nelle specie in cui il B si muove per via floematica (melo, pero e pesco) i sintomi evolvono in disordini metabolici che riguardano i meristemi primari e gli organi riproduttivi. Come conseguenza, in alcuni casi la tossicità da B influenza indirettamente il prodotto attraverso un ridotto sviluppo fogliare con evidente perdita di attività fotosintetica e transpiratoria. In questo caso, gli effetti del B si manifestano tardi nella coltivazione e generalmente nelle foglie più vecchie, inoltre i tessuti non intaccati risultano comunque funzionanti. Questo limiterebbe gli effetti della tossicità, principalmente in colture a ciclo breve. In altri casi invece, la tossicità da B influenza in maniera diretta la produzione delle piante agrarie poiché compromette lo sviluppo quantitativo e qualitativo del frutto (Nable et al., 1997). Al contrario, la maggior parte delle specie coltivate manifestano uno scarso accumulo di B nelle radici.
Tabella 3. Soglia di tolleranza alla concentrazione di B (mg L-1) nell’ambiente radicale per diverse colture (Knott’s Handbook, 1997; Nable et al. 1997).
0.2-0.4 0.5-1 1-2 2-4 4-6 10-15
Avocado Aglio Avena Carciofo Barbabietola Asparago
Fagiolo Cipolla Broccoli Carota Pomodoro
Melo Cetriolo Cavolfiore Prezzemolo
Mais Cavolo
Patata Erba medica Peperone Lattuga
Pisello Melone Radicchio Sedano
15
La tolleranza delle piante alla tossicità del B è largamente variabile da specie a specie presentando pure una forte differenza intravarietale. Può riguardare l’intera pianta o singoli organi (Nable et al., 1997). All’interno della stessa specie, varietà più tolleranti presentano una concentrazione di B nei tessuti significativamente più bassa delle varietà meno tolleranti. Questo comportamento è stato osservato nel frumento, pomodoro, girasole, limone, carciofo e in alcune leguminose e sarebbe legato alla capacità della pianta di escludere il B dall’assorbimento attraverso una ridotta permeabilità dei lipidi di membrana. Invece, recenti studi (Miwa et al., 2007; Sutton et al., 2007) hanno mostrato che in Arabidopsis la tolleranza del B è fortemente legata alla presenza dei canali BOR (BOR4, BOR1, Bot1) essenziali nei processi di estrusione del B dal citoplasma (efflusso).
In Tabella 3 (Nable et al. 1997; Maynard e Hockmuth, 2007) sono riportate le soglie di tolleranza al B per diverse specie coltivate
Interazione tra salinità e boro
L'inquinamento salino delle falde idriche sotterranee è un fenomeno che determina la diminuzione del gradimento dell'acqua, fino a renderla inutilizzabile, per gli usi potabili, civili, agricoli, zootecnici ed industriali. Alcuni effetti diretti derivanti dall'uso di acque a maggiore salinità sono: l'aumento del consumo di detergenti, la formazione d'incrostazioni nelle caldaie, i maggiori costi di trattamento, soprattutto nelle utilizzazioni industriali, l'influenza sulla crescita delle piante e la riduzione del raccolto.
L'inquinamento salino può essere ricondotto a quattro modalità principali. La prima, rischiosa per i pozzi situati in prossimità della costa, risiede nel fenomeno dell'intrusione marina nelle terre emerse, per cui acque salate penetrano, formando un vero e proprio cuneo al di sotto delle acque dolci sotterranee. La seconda causa della salinizzazione è la risalita lungo gli alvei dei fiumi delle acque marine sotto quelle fluviali, per cui le prime contaminano quelle fluviali e quelle di falda con cui vengono in contatto. La terza causa è la lisciviazione di terreni e
16
rocce. I1 flusso idrico sotterraneo contribuisce a solubilizzare, in determinate condizioni idrogeologiche, sostanze che incrementano la salinità delle acque sotterranee. La quarta causa è imputabile all'attività antropica.
Elevate quantità di boro, in associazione ad alte concentrazioni di sali nelle acque di irrigazione (NaCl), si trovano spesso in regioni aride o semiaride (ad esempio, in Israele). Diversi lavori presenti in bibliografia hanno considerato proprio l’aspetto della tossicità da boro in associazione allo stress salino su diverse colture, come pomodoro e cetriolo (Alpaslan and Gunes 2001), pomodoro (Ben-Gal and Shani 2002), melone (Edelstein et al. 2005) e peperone (Yermiyahu et al. 2008). In sostanza, in tutti i lavori sopra citati, gli autori riportano alcune conclusioni che si possono così riassumere:
• In presenza di elevate concentrazioni di boro nell’acqua di irrigazione si osserva in generale una riduzione di produzione e di traspirazione della coltura;
• Questo effetto è comunque ridotto quando la coltura è esposta simultaneamente a stress salino e ad eccesso di B: si ha quindi un effetto di antagonismo tra i due tipi di stress, per cui il risultato di due stress combinati è inferiore alla somma dei due effetti considerati singolarmente (Ben-Gal e Shani, 2002; Yermiyahu et al., 2008);
• Poiché la produzione diminuisce con l’incremento della concentrazione di boro nelle foglie, ma la salinità riduce l’incremento di boro nei tessuti fogliari, la risposta produttiva della coltura risulta maggiormente correlata alla concentrazione di boro nell’acqua di irrigazione, o nella soluzione ricircolante, piuttosto che al livello di boro nei tessuti fogliari (Ben-Gal e Shani, 2002);
• L’ipotesi più accreditata, riguardo la relazione tra boro e salinità, è la riduzione di traspirazione dovuta all’effetto osmotico da stress salino, la quale riduce l’assorbimento di boro da parte della pianta (in presenza di boro è ridotto l’assorbimento del cloro ed in presenza di cloro è ridotto l’assorbimento del boro) (Yermiyahu et al., 2008);
17
• La risposta della pianta alla tossicità da boro è diversa anche a seconda della tolleranza alla salinità della coltura stessa, infatti colture sensibili alla salinità, come il cetriolo, sono influenzate di più rispetto a colture più tolleranti come il pomodoro che risultano più tolleranti anche alla tossicità da boro. Probabilmente in queste colture i meccanismi di esclusione dei sali controllano anche l’eccessivo assorbimento del boro (Alpaslan e Gunes, 2001).
Alcuni lavori riportano gli effetti dello stress da eccesso di boro o “boro + salinità” sul sistema antiossidante di lattuga (Eraslan et al., 2007a), pomodoro (Cervilla et al., 2007) e pomodoro e peperone (Eraslan et al., 2007b)
Eraslan et al. (2007a) hanno osservato in lattuga un aumento della resistenza stomatica, dello stress ossidativo e dei danni alle membrane, incremento dell’attività degli enzimi antiossidanti (SOD, CAT, APX) e accumulo di acido ascorbico e prolina come difesa dallo stress ossidativo, conseguenza dello stress salino e da eccesso di boro. In uno studio simile Eraslan et al. (2007b) hanno osservato anche su pomodoro e peperone un aumento dell’accumulo di prolina, della nitrato-riduttasi e della permeabilità delle membrane. Cervilla et al. (2007) hanno condotto uno studio sullo stress ossidativo su due diverse cultivar di pomodoro sottoposto a livelli tossici di boro. Egli ha osservato un danno ossidativo alle foglie di pomodoro ed un generale aumento degli enzimi antiossidanti; il lavoro ha evidenziato anche un incremento dell’attività di molecole antiossidanti non-enzimatiche, come ascorbato e glutanione, che potrebbero essere coinvolte nella funzione protettiva contro lo stress ossidativo.
18
Capitolo 2: PARTE SPERIMENTALE
2.1 SCOPO DELLA PROVA
Nell’orticoltura in serra, i sistemi di coltivazione fuori suolo a ciclo chiuso minimizzano il consumo idrico grazie al recupero della soluzione circolante (Gallardo et al., 2009; Massa et al., 2010). Ad eccezione dei Paesi Bassi, l’applicazione commerciale di questi sistemi è scarsa perché la loro gestione è più difficile rispetto alle coltivazioni a ciclo aperto. La salinità (che determina la conducibilità elettrica, EC) è il parametro più difficile da gestire nei sistemi chiusi (Carmassi al., 2007; Varlagas al., 2010) in quanto le sostanze presenti nella soluzione nutritiva (SN) sono in concentrazioni superiori a quella di assorbimento (cioè, il rapporto ione / razione di acqua assorbita dall'apparato radicale). La SN è reimmessa in circolo finché la CE e/o la concentrazione di ioni potenzialmente tossici raggiungono i valori massimi prestabiliti, altrimenti viene scaricata, almeno in parte (Massa et al., 2010). Questo sistema è chiamato semi-chiuso e dà luogo ad oscillazioni della EC e alla concentrazione di elementi minerali nella soluzione nutritiva.
In modo particolare, nelle regioni aride o semiaride elevate concentrazioni di B si trovano spesse associate ad elevati livelli di salinità nel suolo e / o nell’acqua di irrigazione, (Ben-Gal e Shani et al., 2003; Bianchini et al., 2005). L’interazione tra la salinità e la tossicità B è stata studiata in specie diverse, come broccolo (Smith et al., 2010), melone (Edelstein et al., 2005), pepe (Yermiyahu et al., 2008), cetriolo e pomodoro (Alpaslan e Gunes et al., 2001). Questi studi hanno dimostrato che la salinità riduce gli effetti da eccesso di B. Ovvero il ridotto assorbimento idrico radicale riduce anche l’assorbimento e la traslocazione alla parte aerea del B (Ben-Gal and Shani et al., 2002; Alpaslan and Gunes et al., 2001). Secondo alcuni autori, la tolleranza delle colture all’eccesso di B può aumentare con la tolleranza alla salinità, specialmente da NaCl, per gli stessi meccanismi di esclusione del Na e del Cl (Alpaslan and
19
Gunes et al., 2001; Ben-Gal and Shani et al., 2002). Il B, inoltre, sembra aumentare la tolleranza alla concentrazione di NaCl riducendo l’assorbimento radicale e l’accumulo di cloruro nei germogli (Yermiyahu et al., 2008).
Sono stati pubblicati molti studi sull'effetto di NaCl nelle colture idroponiche a ciclo chiuso (Carmassi et al., 2007; Massa et al., 2010; Varlagas et al., 2010). Minor attenzione è stata rivolta,invece, allo studio degli effetti del B e del NaCl nei sistemi fuori suolo a ciclo chiuso. In questa prova sperimentale, su pomodoro (Solanum lycopersium L.) in serra, sono stati studiati gli effetti della tossicità da NaCl e B. Le piante sono state coltivate fuori suolo su substrato di perlite, le condizioni climatiche sono state quelle tipiche del Mediterraneo nella stagione primaverile-estiva, nell'acqua d'irrigazione il NaCl era presente con concentrazioni pari a 2,0 e 10,0 m mol-3 e / o il B 23,1 e 185 mmol m-3, corrispondente a 0,25 e 2,0 mg L-1. L'esperimento è stato condotto nel 2009 in condizioni semi-commerciali in quanto: i) si è simulato la disponibilità di acque con concentrazioni moderate di NaCl e di B, in quanto le colture di serra, notoriamente poco toleranti alla salinità e alla tossicità di element come il B, non possono essere allevate in condizioni di stress severo per essere remunerative, ii) la SN, è stata scaricata quando le CE superava 6,0 dS m-1 e i nitrati (N-NO3) scesa al di sotto di 1,0 mol m-3 rispettando la legislazione italiana sullo smaltimento delle acque reflue (Massa et al., 2010). Questa modalità di gestione ha dato luogo ad oscillazioni della CE e alla concentrazione di elementi minerali nella soluzione nutritiva.
2.2. MATERIALI E METODI
Lo studio è stato effetuato su piante di pomodoro (Solanum lycopersicum L., cv. Caramba); il ciclo colturale è stato di 169 giorni, compreso tra l’inizio della primavera e l'estate del 2009. I semenzali di 5 settimane sono stati trapiantati il 5 marzo in sacchi di perlite con una densità di 3.0 piante per m2 (6 piante per sacco, ogni sacco conteneva 30 L di perlite).
20
Le piante sono state allevate verticalmente su un unico fusto. Per migliorare l’impollinazione è stato utilizzato un vibratore per stimolare la produzione di polline e agevolarne la diffusione. Con la maturazione del primo palco fruttifero si è eseguita una prima defogliazione, seguita successivamente da altre due a distanza di qualche settimana.
Tesi sperimentali e gestione della soluzione nutritiva
Il sistema a ciclo chiuso utilizzato nell'esperimento era dotato di un serbatoio che raccoglieva l'acqua drenata dal substrato; il serbatoio era sistematicamente riempito con SN preparata con acqua di pozzo opportunamente aggiustata per le concentrazioni di NaCl e B (acido borico) in modo da simulare la disponibilità di quattro diversi tipi di acqua con cui preparare le soluzioni nutritive: FWLB (NaCl, 2.0 mol m-3; B, or 23.1 mmol m-3); FWHB (NaCl, 2.0 mol m-3 NaCl in 2009; B, 185 mmol m-3); SWLB (NaCl, 10.0 mol m-3; B, 23.1 mmol m-3); SWHB (NaCl, 10.0 mol m-3; B, 185 mmol m-3).
L’acqua di pozzo utilizzata conteneva inoltre: Mg 0.75 mol m-3; Ca 1.52 mol m-3; Fe 8.9 mmol m-3; Zn 2.1 mmol m-3; Mn 2.7 mmol m-3.
La SN conteneva le seguenti concentrazioni di macronutrienti (mol m-3) e oligoelementi (mmol m-3): N-NO3 11; P-H2PO4 1.2; K 7.0; Mg 0.75; Ca 4.0; Fe 17.8; Zn 5.0; Cu 2.7; Mn
10.0. NO-3 era l'unica forma di azoto presente nella SN. La CE della SN preparata con FW e SW è stata rispettivamente 1,80 e 2.70 dSm-1.
Una o due volte la settimana è stata ripreparata la SN con cui venivano riempiti giornalmente i serbatoi degli impianti idroponici; le SN erano preparate aggiungendo volumi adeguati di soluzione madre e aggiustando il pH con acido solforico a 5.5-6. Le diverse soluzioni nutritive sono state conservati in serra, all'interno di serbatoi chiusi. Ogni trattamento è iniziato 13 giorni dopo il trapianto (DAP) fino alla fine dell’esperimento utilizzando tre bancali (repliche) per ogni trattamento, ciascuno di 10 m2 ciascuno con 30 piante e una vasca di miscelazione da 80 L. Il volume della SN nel ciclo, compresa quella contenuta nel
21
substrato, era di 120 L (12 Lm-2). Ogni qualvolta il livello dell'acqua nel serbatoio di miscelazione diminuiva di circa 10 L veniva riempito utilizzando la SN con l'opportuna concentrazione di B e il valore di CE. Quasi ogni giorno è stata controllata la CE e il pH, che se necessario veniva corretto con acido solforico diluito portandolo a 5,5-6. L'assorbimento di acqua è stato inizialmente compensato con la soluzione nutritiva; quando la CE raggiungeva 4,5 dS m-1 il serbatoio di miscelazione è stato riempito solo con acqua di acquedotto, FW e di pozzo SW (per cinque/otto giorni, in genere) finchè la concentrazione di N-NO3 non scendeva
al di sotto del livello critico di concentrazione di 1.0 mol m-3, quando la SN del serbatoio veniva scaricata. È stato scelto questo valore perchè 20 mg L-1 (1.42 mol m-3) è il massimo contenuto di N-NO3 consentito dall'attuale normativa italiana derivata dalla Direttiva Europea
per le acque reflue scaricate in acque superficiali (Massa et al., 2010). La procedura è stata applicata simultaneamente a tutte le repliche di ogni tesi. L'irrigazione a goccia (12 ugelli per sacchetto) è stata controllata automaticamente da un timer spesso modificato durante il periodo vegetativo al fine di soddisfare la domanda di acqua della coltura; durante i picchi di evapotraspirazione sono stati programmati 10 interventi irrigui al giorno. La frazione di lisciviazione era di 0,5-0,6.
Determinazioni
I paramentri climatici sono stati costantemente monitorati grazie ad una stazione meteorologica posta nella parte centrale della serra e collegata ad un data logger. I valori di temperatura e di radiazione solare registrati all’interno della serra, durante la coltivazione sono stati riportati in Figura 4. Una o due volte la settimana sono stati raccolti i campioni della soluzione ricircolante ed effettuate analisi di laboratorio mediante cromatografia ionica (N-NO3, P-H2PO4), assorbimento atomico (K, Ca, Mg, Na, Cu, Fe, Mn, Zn) e colorimetria (B; metodo Azometina-H; Page et al., 1982). Sia per l'acqua che per i macronutrienti sono stati determinati i bilanci (somministrazione, perdita con le acque di drenaggio e per
22
differenza, il consumo della coltura). Con un misuratore di volume è stato determinato l'assorbimento di acqua giornaliero e la quantità di SN (o acqua) utilizzata per riempire automaticamente il serbatoio di miscelazione; il funzionamento corretto del contatore è stato verificat ogni due settimane. La perdita di acqua per evaporazione dal substrato e le infiltrazioni erano trascurabili. La perdita di acqua con il drenaggio è stata calcolata moltiplicando il numero degli scarichi per il volume di soluzione nutritiva (8.0 L m-2) scaricata in ciascun lavaggio. Il consumo idrico totale è stato calcolato sommando l'acqua di drenaggio all'acqua assorbita dalla coltura. La fornitura totale o lisciviazione dei nutrienti e Na è stata calcolata dal volume e dalla concentrazione di ioni delle nuove soluzioni o di SN di drenaggio, in quest'ultima è inclusa la soluzione residua presente alla fine della coltivazione. L'assorbimento di minerali della coltura è stato calcolato come differenza tra l'offerta e la lisciviazione. Questo approccio è utilizzato spesso per stimare l'assorbimento di nutrienti in coltura fuori suolo (ad esempio Incrocci et al., 2006 Gallardo et al., 2009) in quanto sono trascurabili le perdite dovute alla precipitazione di sali e/o volatilizzazione (ad esempio N; Daum e Shenck, 1998).
L'incidenza delle necrosi fogliari a causa della tossicità da B è stata determinata in 4 occasioni (40, 80, 123 e 169 DAP) come segue. Ad ogni campionamento, sono state raccolte sei foglie nella parte basale, mediana e apicale in ogni una tesi e, attraverso delle foto digitali opportunamente elaborato al computer, è stata determinata la percentuale della superficie colpita dalla necrosi. Il danno è stato stimato come media ponderata in base alla superficie delle singole foglie campionate da una stessa pianta.
In varie occasioni (88, 125 e 165 DAP), utilizzando uno strumento portatile (Plant Efficiency Analyser, PEA; , Hansatech, UK) è stata determinata la fluorescenza della clorofilla a campionando, tra le 9.00 e le 10.00 e tra le 12.00 e le 13.00, sia le foglie basali e sia quelle mediane. Sulle stesse foglie, alla fine della giornata è stato prelevato un campione della
23
lamina (in prossimità della zona utilizzata per la misura della fluorescenza) per la determinazione del contenuto di clorofilla, estratta usando il metanolo come solvente.
La crescita della coltura è stata determinata con il rilievo distruttivo a 123 giorni dal trapianto e alla fine della stagione di crescita. Di ciascun campione sono stati determinati l'area fogliare, il peso fresco e secco di fusto, foglie e frutti. I germogli laterali e le foglie basali sono stati rimossi periodicamente e considerati nel calcolo della biomassa prodotta dalla coltura. In ogni campionamento è stata determinata la concentrazione di B nei vari organi vegetativi, tenendo separati i piccioli dalle foglie. I campioni sono stati lavati con acqua potabile, risciacquati con acqua deionizzata, essiccati in stufa a 80 °C e digeriti con una miscela di acido nitrico e perclorico in tubi di teflon posti sotto cappa a 230°C per un’ora. Il B è stato determinato con lo spettrofotometro secondo il metodo dell'Azometina-H.
Il numero dei fiori e dei frutti su ogni racemo è stato contato due volte a settimana. I frutti maturi sono stati raccolti 1-3 volte a settimana a partire dal 78 giorno dopo il trapianto (metà maggio). I seguenti parametri di qualità sono stati determinati sulla purea ottenuta dai frutti commerciali raccolti dal quinto e dal decimo grappolo raccolta dal quinto al decimo palco: residuo secco (dopo essiccamento a 80° C), pH, CE, comtenuto totale di solidi solubili (con un rifrattometro), acidità titolabile (con NaOH 0,1 mM ed espressa come acido citrico) e concentrazione di B. Il B è stato determinato anche sul residuo secco di ciascun campione.
Analisi statistica
E’ stato adottato uno schema sperimentale a blocco randomizzato. L’analisi della varianza a due vie (ANOVA, la separazione delle medie (test LSD) e l’analisi della regressionE sono state condotte con il software Statgraphics Plus 5.1 (Manugistic, Rockwille, USA).
24
2.3. RISULTATI
Condizioni di crescita
Le condizioni climatiche all’interno della serra erano quelle tipiche delle zone Mediterranee tra la fine dell’inverno e l’estate (Figura 4). La temperatura dell’aria ( TA ) è aumentata nel
corso della stagione con valori massimi superiori a 30 °C (la media è stata di 32,3) e nelle ultime settimane superiori a 40 °C. Durante la notte la temperatura non è mai scesa sotto 17 °C. La temperatura del substrato (TSUB) era strettamente correlata alla TA (TSUB = 0.825 TA +
4.932; R2 = 0.814; n = 156),anche se le oscillazioni di TSUB erano molto più evidenti rispetto
a quelle TA. TSUB è stata sempre al dì sopra di 26 °C e non ha mai superato i 35 °C,
approssimativamente. La radiazione solare giornaliera oscillava tra 1,39 e 14,99 MJ m-2 con una media di 9,33 MJ m-2; il valore cumulato nella stagione è stato di 1.465,4 MJ m-2 .
10 30 50 70 90 110 130 150 170 0 10 20 30 40 50 Mean T Min. T Max. T 0 6 12 18 24 30 R a d ia z io n e ( M J m -2 ) Rad
Giorni dal trapianto
T e m p e ra tu ra ( °C )
Figura 4. Valori medi della temperatura dell’aria (minima, massima e media) e della
radiazione solare all’interno della serra utilizzata per l’esperimento condotto nel 2009 sul pomodoro coltivato senza suolo a ciclo semi-chiuso.
25
La SN è stato scaricata, rispettivamente, tre e sette volte nei trattamenti con FW e SW (Figura 5). Ciò ha provocato notevoli oscillazioni della CE e delle concentrazioni dei vari elementi minerali nella SN, come illustrato nella Figura 5, dove per sinteticità sono state riportate solo le concentrazioni di Na e B. 0 50 100 150 200 250 0 5 10 15 20 25 30 FWLB SWLB
days from planting
C o n ce n tr a zi o n e d i B (m o l m -3) 0 2 4 6 8 10 FWLB FWHB
days from planting
B ( m m o l m -3) E C ( d S m -1 ) 0 20 40 60 80 100 120 140 160 0 300 600 900 1200 0 5 10 15 20 25 30 FWHB SWHB
Giorni dal trapianto
C o n c e n tr a z io n e d i B (m o l m -3) 0 20 40 60 80 100 120 140 160 180 0 2 4 6 8 SWLB SWHB
Giorni dal trapianto
B ( m m o l m -3) E C ( d S m -1 )
Figura 5. Concentrazione di B e CE nella soluzione nutritiva di colture a ciclo semi-chiuso di
pomodoro in serra condotte utilizzando diverse sorgenti di acqua irrigua: FWLB, 2.0 mol m-3 NaCl e 27.5 mmol m-3 B; FWHB, 2.0 mol m-3 NaCl e 183.0 mmol m-3 B, SWLB, 10.0 mol m-3 NaCl e 27.5 mmol m-3 B; SWHB, 10.0 mol m-3 NaCl e 183.0 mmol m-3 B. Valori medi (+SE) di tre replicati. Gli asterischi vicini all’ascisse dei grafici sulla destra indicano quando la soluzione nutritiva era scaricata.
26
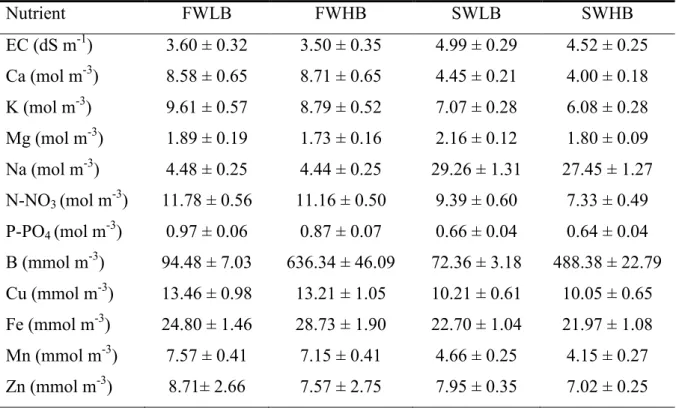
La concentrazione media di Ca, Mg, Fe e Cu nella soluzione circolante è stata in genere superiore alla loro concentrazione nella SN di riempimeno, mentre nel caso di altri nutrienti le concentrazioni erano praticamente uguali o leggermente inferiori (Tabella 4). Come previsto, in FWLB e FWHB la concentrazione di Na e Cl era molto inferiore a quelle misurate nelle colture SWLB e SWHB (Tabella 4). Nei campioni raccolti dai vari trattamenti di fertirrigazione il rapporto molare tra Na e Cl era intorno a 1 (dati non riportati). La concentrazione del B nell’acqua d’irrigazione non ha inciso sulla concentrazione degli altri minerali (Tabella 4).
Tabella 4. Valori medi della CE e della concentrazione di elementi minerali nella soluzione
nutritiva di colture a ciclo semi-chiuso di pomodoro in serra condotte utilizzando diverse sorgenti di acqua irrigua: FWLB, 2.0 mol m-3 NaCl e 27.5 mmol m-3 B; FWHB, 2.0 mol m-3 NaCl e 183.0 mmol m-3 B, SWLB, 10.0 mol m-3 NaCl e 27.5 mmol m-3 B; SWHB, 10.0 mol m-3 NaCl e 183.0 mmol m-3 B. Valori medi (+ES) di 20 (FWLB e FWHB) o 28 (SWLB e FWHB) misure condotte in triplicate, durante l’esperimento.
Nutrient FWLB FWHB SWLB SWHB EC (dS m-1) 3.60 ± 0.32 3.50 ± 0.35 4.99 ± 0.29 4.52 ± 0.25 Ca (mol m-3) 8.58 ± 0.65 8.71 ± 0.65 4.45 ± 0.21 4.00 ± 0.18 K (mol m-3) 9.61 ± 0.57 8.79 ± 0.52 7.07 ± 0.28 6.08 ± 0.28 Mg (mol m-3) 1.89 ± 0.19 1.73 ± 0.16 2.16 ± 0.12 1.80 ± 0.09 Na (mol m-3) 4.48 ± 0.25 4.44 ± 0.25 29.26 ± 1.31 27.45 ± 1.27 N-NO3 (mol m-3) 11.78 ± 0.56 11.16 ± 0.50 9.39 ± 0.60 7.33 ± 0.49 P-PO4 (mol m-3) 0.97 ± 0.06 0.87 ± 0.07 0.66 ± 0.04 0.64 ± 0.04 B (mmol m-3) 94.48 ± 7.03 636.34 ± 46.09 72.36 ± 3.18 488.38 ± 22.79 Cu (mmol m-3) 13.46 ± 0.98 13.21 ± 1.05 10.21 ± 0.61 10.05 ± 0.65 Fe (mmol m-3) 24.80 ± 1.46 28.73 ± 1.90 22.70 ± 1.04 21.97 ± 1.08 Mn (mmol m-3) 7.57 ± 0.41 7.15 ± 0.41 4.66 ± 0.25 4.15 ± 0.27 Zn (mmol m-3) 8.71± 2.66 7.57 ± 2.75 7.95 ± 0.35 7.02 ± 0.25
27
Non vi era alcuna differenza significativa della CE tra FWLB e FWHB e della concentrazione di B tra SWLB e SWHB (Figura 5, Tabella 4). In SWLB e SWHB la CE media era di 4.75 dS m-1 negli altri trattamenti era 3,55 dS m-1 (Tabella 4). L’aumento progressivo della conducibilità elettrica era associato all’accumulo di Na e Cl (dati non riportati), con una significativa correlazione (R2 = 0.925, per Na; R2 = 0.885, per Cl) tra la CE e la concentrazione di ioni.
La concentrazione del B tendeva ad aumentare in tutti i trattamenti (Tabella 4), ovviamente la sua media è stata molto più elevata per le piante coltivate con HB (Tabella 4). A causa degli scarichi più frequenti di soluzione nutritiva, la concentrazione di B è stata notevolmente inferiore SWHB (488.38 ± 22.79) e in FWHB (636.34 ± 46.09).
Relazioni idriche e minerali
Le caratteristiche dell’acqua d’irrigazione non hanno inciso in modo significativo sull’assorbimento giornaliero dell’acqua, che è variato tra 0,59 e 5,14 L m-2 con una media di 3.51 L m-2. L’assorbimento cumulativo medio dell’acqua è stato di 548.1 ± 23.8 L m-2. Rispetto al trattamento con FW, il consumo totale dell’acqua era leggermente superiore nelle colture SW a causa dei lavaggi periodici (56 vs 24 L m-2).
Il B e la concentrazione di NaCl nell’acqua d’irrigazione, non hanno influito sull’assorbimento totale (apparente) delle sostanze nutritive (a parte il B e il Na), che è stato calcolato in base al bilancio di massa, cioè calcolando la quantità dei nutrienti somministrati con la SN ricaricata e dilavata con l’acqua di drenaggio (dati non riportati). Il termine “apparente” indica che l’assorbimento comprende anche i nutrienti che si accumulano nel substrato. Come previsto, in SWLB e SWHB si è registrato un assorbimento maggiore di Na e Cl di 3-4 volte superiore a quello di FWLB e FWHB e senza effetti significativi dovuti dalla concentrazione di B.
Nella Tabella 5 sono riportati i contenuti di B dei diversi tessuti vegetali delle piante di pomodoro campionati alla fine della stagione di crescita. Risultati simili sono stati trovati a
28
123 giorni dal trapianto (dati non riportati), quando i valori erano leggermente inferiori in tutti gli organi. Le foglie, in generale, presentavano un maggior contenuto di B nella lamina piuttosto che nel picciolo e nei vicini internodi dello stelo (Tabella 5). L’uso di acqua ricca in B ha determinato un sensibile aumento della concentrazione di B nella lamina fogliare indipendentemente dal nodo, mentre ha influenzato in minor misura il contenuto di questo elemento in altri tipi di tessuto (Tabella 5). Inoltre, il contenuto di B nella lamina, indipendentemente dal nodo, era significativamente inferiore in SWHB rispetto a FWLB (Tabella 5) .
FWLB
FWHB
SWLB
SWHB
0.0
0.4
0.8
1.2
1.6
B B B A ANOVA NaCl ns B *** NaCl x B **days from planting
A
s
s
o
rb
im
e
n
to
d
i
B
(
g
m
-3)
Figura 6. Accumulo totale di B nella parte aerea di piante di pomodoro coltivate a ciclo
semi-chiuso in serra utilizzando diverse sorgenti di acqua irrigua: FWLB, 2.0 mol m-3 NaCl e 27.5 mmol m-3 B; FWHB, 2.0 mol m-3 NaCl e 183.0 mmol m-3 B, SWLB, 10.0 mol m-3 NaCl e 27.5 mmol m-3 B; SWHB, 10.0 mol m-3 NaCl e 183.0 mmol m-3 B. Valori medi (+ES) di tre replicati. Le lettere indicano differenze significative (5%) tra i trattamenti in base alla’ANOVA e al test LSD.
29
L’impiego di acqua ricca in B ha aumentato, rispetto agli altri trattamenti, la quantità di B rilevata nei vari organi della parte aerea (foglie, steli e frutti), in maggiore misura in FWHB rispetto a SWHB (Figura 6). I valori per FWLB e SWLB sono riportati in Figura 6 e sono simili all’assorbimento apparente del B derivato dal bilancio di massa, mentre negli altri due trattamenti c’è stata una notevole differenza tra i due valori e questo suggerisce che la deposizione di una notevole quantità di B (0.4-0.5 g m-2) nella zona radicale (substrato e radici).
Tabella 5. Contenuto di B in diversi tipi di foglia, nello stelo e nei rachidi fogliari di piante di
pomodoro coltivate a ciclo semi-chiuso in serra utilizzando diverse sorgenti di acqua irrigua: FWLB, 2.0 mol m-3 NaCl e 27.5 mmol m-3 B; FWHB, 2.0 mol m-3 NaCl e 183.0 mmol m-3 B, SWLB, 10.0 mol m-3 NaCl e 27.5 mmol m-3 B; SWHB, 10.0 mol m-3 NaCl e 183.0 mmol m-3 B. Valori medi (+ES) di tre replicati. In ogni riga, le lettere indicano differenze significative (5%) tra i trattamenti in base alla’ANOVA e al test LSD.
FWLB FWHB SWLB SWHB ANOVA1 NaCl B NaCl x B Stelo Basali 56.2 ab 62.5 a 48.4 b 59.4 a ns Ns ns Mediane 51.7 b 65.2 a 47.3 b 67.2 a * ** * Apicali 51.2 b 56.1 ab 53.2 ab 58.1 a ns ns ns Picciolo fogliare Basali 52.5 bc 78.6 a 48.0 c 68.4 ab ns ns * Mediane 36.9 b 66.9 a 40.8 b 73.8 a ** ** ** Apicali 57.0 b 96.1 a 48.2 b 83.6 a ns ns ns Lamina fogliare Basali 140.0 c 326.7 a 135.0 c 280.0 b ** ** ** Mediane 97.5 c 362.6 a 98.8 c 256.0 b ** ** ** Apicali 106.2 c 335.2 a 95.3 c 253.5 b ** ** ** 1
30
Tossicità da boro
Solo le piante FWHB e SWHB hanno mostrato sintomi chiari di tossicità da B (necrosi fogliari; Figura 7). I sintomi sono comparsi a 35-40 giorni dal trapianto e la lora gravità, espressa come percentuale dell’area fogliare colpita da clorosi e necrosi, è aumentata nel tempo (Figura 8). Utilizzando i dati della % di area fogliare necrotizzata e il contenuto di B nelle foglie delle colture FWHB e SWHB a 123 e 169 giorni dopo il trapianto, è stata calcolata una significativa regressione esponenziale tra la percentuale di area fogliare necrotizzata e il contenuto fogliare di B (Figura 9).
Figura 7. La necrosi mostrata dalle foglie dei nodi basali in piante di pomodoro coltivate a
ciclo semi-chiuso in serra utilizzando diverse sorgenti di acqua irrigua: in alto, FWHB, 2.0 mol m-3 NaCl e 183.0 mmol m-3 B; in basso, SWHB, 10.0 mol m-3 NaCl e 183.0 mmol m-3 B. Le foto sono state scattate dopo tre mesi dall’inizio del trattamento.
31 0 30 60 90 120 150 180 0.00 0.06 0.12 0.18 0.24 0.30 0 5 10 15 20 25 30 FWHB SWHB * * *
Giorni dal trapianto
D a n n o f o g li a re
Figura 8. Evoluzione del danno fogliare (necrosi indotte dal B) in piante di pomodoro
coltivate a ciclo semi-chiuso in serra utilizzando diverse sorgenti di acqua irrigua: FWHB, 2.0 mol m-3 NaCl e 183.0 mmol m-3 B; SWHB, 10.0 mol m-3 NaCl e 183.0 mmol m-3 B. Valori medi (+ES) di tre replicati. L’asterisco indica una differenza significativa tra i due trattamenti.
I sintomi da tossicità da B sono comparsi prima sulle foglie vecchie di FWHB e alla fine dell’esperimento, tutte le foglie di FWHB e SWHB hanno presentato i sintomi tipici della tossicità da B, anche se in maggior misura in FWHB rispetto a SWHB (Figura 8). Al termine della prova, quando anche le piante FWLB hanno mostrato dei piccoli sintomi di tossicità da B, sono stati ottenuti questi valori: in FWHB 21.2 ± 2.5; in SWHB 12.6 ± 1.5.
Le necrosi fogliari sono state il risultato dell’accumulo di B ai margini delle foglie, come indicato dalle diverse concentrazioni di B al centro e alla periferia della lamina (Figura 8). Infatti, nella porzioni centrali, che non hanno mostrato alcun sintomo visibile, non vi erano differenze di concentrazione di B, tra i diversi trattamenti (Figura 1). Al contrario la concentrazione di B ai margini fogliari è stata sempre superiore in FWHB (786 ± 77.8) rispetto a SWHB (488.20 ± 35.6).
32 100 200 300 400 500 0.00 0.06 0.12 0.18 0.24 0.30 0 5 10 15 20 25 30 Y = 0.011 e0.0087 X R2 = 0.965 FWLB SWLB
Contenuto di B nella lamina fogliare (mg kg-1 DW)
In d ic e d i d a n n o
Figura 9 La relazione tra il danno fogliare (necrosi indotte dal B) e il contenuto di B nella
lamina fogliare di piante di pomodoro coltivate a ciclo semi-chiuso in serra utilizzando diverse sorgenti di acqua irrigua: FWHB, 2.0 mol m-3 NaCl e 183.0 mmol m-3 B; SWHB, 10.0 mol m-3 NaCl e 183.0 mmol m-3 B. Valori medi (+SE) di tre replicati. L’equazione della regressione esponenziale è riportata nel grafico.
In tre occasioni, dopo circa tre, quattro e cinque mesi dal trapianto, è stata valutata la condizione fisiologica delle piante di pomodoro coltivate la fluorescenza della clorofilla a nelle aree asintomatiche delle fogli basali e mediane. Le misurazioni sono state effettuate sia al mattino sia intorno a mezzogiorno con un fluorimetro portatile che forniva, tra i vari parametri, il rapporto Fv/Fm e il cosidetto ‘performance index’ (PI). La TA durante le misure di
fluorescenza oscillavano tra 25 e 35°C (approssimativamente) al mattino e tra 30 e 40°C a metà giornata, con punte di 42°C nel caso dell’ultimo prelievo. In tutte le occasioni, il rapporto Fv/Fm e PI non sono stati influenzati né dalla fertirrigazione né dal tipo di foglia (dati
33
0.01; PI = 1.67 ± 0.28) rispetto al mattino (Fv/Fm = 0.81 ± 0.01, PI = 3.17 ± 0.24). Le
differenze tra i valori riscontrati tra i due orari sono state particolarmente marcate al terzo rilievo (dati non riportati).
FWLB
FWHB
SWLB
SWHB
0
100
B AB c B a A b c Lamina centrale Margini ANOVA Lamina Margini NaCl ns ns B *** NaCl x B ns ns200
700
1200
1700
C
o
n
te
n
u
to
d
i
B
(
m
g
k
g
-D W)
Figura 10. Contenuto di B in diverse zone delle foglie basali di piante di pomodoro coltivate
a ciclo semi-chiuso in serra utilizzando diverse sorgenti di acqua irrigua: FWLB, 2.0 mol m-3 NaCl e 27.5 mmol m-3 B; FWHB, 2.0 mol m-3 NaCl e 183.0 mmol m-3 B, SWLB, 10.0 mol m-3 NaCl e 27.5 mmol m-3 B; SWHB, 10.0 mol m-3 NaCl e 183.0 mmol m-3 B. Valori medi (+ES) di tre replicati. Le lettere indicano differenze significative (5%) tra i trattamenti in base alla’ANOVA e al test LSD.
Abbiamo anche osservato che la composizione della SN, la posizione delle foglie e il momento del campionamento non avevano influenzato in modo significativo il contenuto fogliare di clorofilla, che è stato mediamente di 111,7 ± 7,3 µg cm-2.
34
Crescita e produzione di frutti
Per quanto riguarda l’accumulo di sostanza secca non sono emerse differenze significative tra i trattamenti; le piante hanno prodotto, in media, 2,54 ± 0,21 g m-2 (parte aerea) con un indice di raccolta di 0,57 ± 0,21. L’indice di area fogliare (LAI) è stato pressoché identico in tutti i trattamenti almeno fino a 123 giorni dopo il trapianto (dati non riportati); alla fine dell’esperimento, però, il LAI era significativamente più basso nelle colture allevate con la più alta concentrazione di B (in media, 2,14 ± 0,18 g m-2) rispetto alle altre (1,70 ± 0,20 g m
-2
). Non è stata, inoltre, osservata alcuna differenza significativa sul LAI da parte della salinità. Occorre far notare che il LAI è stato inferiore al termine della coltivazione perché le defogliazioni e le sfemminellature sono proseguite anche dopo la cimatura delle piante, avvenuta dopo il penultimo prelievo distruttivo.
La concentrazione di NaCl e B nella SN non ha avuto alcun effetto significativo sul numero dei fiori e dei frutti (dati non riportati) di nessuno dei dodici racemi lasciati sulle piante. In tutti i trattamenti, la fioritura e l’allegagione sono avvenute regolarmente tra il 30° e il 125° giorno dopo il trapianto; la raccolta è iniziata 78 giorni dopo il trapianto (metà maggio) ed è continuata per circa tre mesi. Invece, è stata notata un’influenza della posizione del nodo sul fusto in quanto il numero dei fiori e dei frutti, la dimensione di questi ultimi e quindi la produzione totale per palco è diminuita dal basso verso l’alto (Figura 11). Per quanto riguarda l’indice di allegazione (rapporto % tra fiori e frutti) non c’è stato alcun effetto evidente legato alla posizione del nodo e le percentuali oscillavano tra il 48% e il 65% (Figura 11).
Il B non ha avuto alcun tipo di effetto sulla produzione totale dei frutti e sul loro peso medio, che invece sono stati leggermente, ma significativamente, inferiori nelle tesi irrigate con SW rispetto alle altre due (Tabella 6). Il numero dei frutti non differiva significativamente tra FWLB, FWHB, SWLB e SWHB (Tabella 6). Quasi tutti i frutti erano commercializzabili e solo pochissimi sono stati scartati a causa del calibro troppo piccolo o perché spaccati o colpiti da marciume apicale e da scolorimento.
35 0 2 4 6 8 10 Fiori Frutti 0 20 40 60 80 100 Allegagione N o . d i fi o ri o d i fr u tt i p e r p ia n ta A lle g a g io n e ( % ) 1 2 3 4 5 6 7 8 9 10 11 12 0 60 120 180 240 0.0 0.2 0.4 0.6 0.8
Peso medio dei frutti Produzione
Numero del nodo
P e s o m e d io ( g ) P ro d u z io n e n p e r p a lc o ( k g )
Figura 11. Numero di fiori e di frutti, e percentuale di allegagione, nei diversi racemi di
piante di pomodoro coltivate in serra ciclo semi-chiuso. Valori medi di 12 replicati.
L’influenza del regime di fertirrigazione sulla qualità delle bacche è stata studiata determinando una serie di parametri chimici in laboratorio sui frutti commerciali raccolti dal quinto e decimo grappolo. Non sono state riscontrate differenze significative tra i due palchi (dati non riportati) e, quindi, l’ANOVA è stata condotta raggruppando i dati dei due palchi. Il
36
contenuto di NaCl e B nell’acqua di irrigazione non ha influenzato il pH della frutta e l’acidità titolabile considerando che l'aumento della salinità (NaCl) ha comportato un incremento significativo, solo per SWLB, sia del residuo secco sia del contenuto di solidi solubili totali (Tabella 6).
Tabella 6. Produzione totale di frutti e caratteristiche qualitative delle bacche commerciali in
piante di pomodoro coltivate a ciclo semi-chiuso in serra utilizzando diverse sorgenti di acqua irrigua: FWLB, 2.0 mol m-3 NaCl e 27.5 mmol m-3 B; FWHB, 2.0 mol m-3 NaCl e 183.0 mmol m-3 B, SWLB, 10.0 mol m-3 NaCl e 27.5 mmol m-3 B; SWHB, 10.0 mol m-3 NaCl e 183.0 mmol m-3 B. Valori medi (+ES) di tre replicati. In ogni riga, le lettere indicano differenze significative (5%) tra i trattamenti in base alla’ANOVA e al test LSD.
FWLB FWHB SWLB SWHB
ANOVA1
NaCl B NaCl x B
Produzione (kg m-2) 21.9 a 20.9 a 19.7 b 19.6 b * ns ns
Numero di frutti (m-2) 117.3 a 117.5 a 116.2 a 115.6 a ns ns ns
Peso medio dei frutti (g) 186.7 a 177.6 ab 169.9 b 169.6 b * ns ns
pH 4.02 a 4.04 a 4.01 a 4.02 a ns ns ns
EC (dS m-1) 5.92 b 5.58 b 6.53 a 6.32 a ** ns ns
Residuo secco (% FW) 5.54 b 5.79 b 6.11 a 5.61 b * ns *
Contenuto totale di solidi solubili (°Brix)
4.00 b 4.00 b 4.50 a 4.08 b * * *
Acidità titolabile (%) 0.57 a 0.57 a 0.62 a 0.63 a ns ns ns
1
37
La concentrazione di B nei frutti non è stata influenzata dalla salinità (dati non riportati) ma è stata leggermente superiore in FWHB e SWHB rispetto a FWLB e SWLB. Nei frutti allevati con alta concentrazione di B nella’acqua il contenuto di B in media era 2.81 ± 0.10 mg L-1 (nel succo) o 47.8 ± 2.0 mg Kg-1 nel residuo secco, rispetto a 2.17 ± 0.11 mg L-1 o 39.1 ± 25 mg Kg-1 nelle colture SW. Si è stimato che ogni giorno bisognerebbe mangiare 3,6 kg di pomodori coltivati in FWHB, e ancor di più quelli raccolti dalle altre culture, per superare la dose massima giornaliera di B stabilita per le persone adulte dalla European Food Safety Authority (EFSA, 2004) .
2.4 DISCUSSIONE
Nel nostro esperimento, condotto in condizioni semi-commerciali, il risultato principale dell’uso di acqua ricca in B è stato la comparsa dei tipici sintomi della tossicità provocata da questo elemento: la clorosi e successiva necrosi dei margini fogliari (Figure 7 e Figura 8 Bergmann, 1992).
Il B è assorbito dalle radici come H3BO3 e tende ad accumularsi nelle foglie mature in quanto
viene trasportato soprattutto attraverso lo xilema e si deposita alla fine della corrente traspiratoria (Nable et al. 1997). Le nervature pennate tipiche del pomodoro spiegano perché in questa specie le lesioni interessano soprattutto i margini delle foglie, diversamente dalle foglie parallelinerve. Al contrario, nelle specie vegetali che riescono a mobilizzare il B anche attraverso il floema i sintomi sono in genere mostrati dai frutti, dalla corteccia e/o dai tessuti cambiali (Brown and Hu, 1996).
Le bruciature fogliari non hanno mai interessato le piante allevate con l’acqua LB e sono state assai più gravi nelle piante FWHB rispetto a quelle SWHB (Figure 7). In accordo con altri autori (e.g., Francois, 1984; Smith et al., 2010), la gravità del danno, espressa come percentuale dell’area fogliare necrotica, era correlata al contenuto, di B, delle foglie (Figure
38
9), che a sua volta dipendeva dalla concentrazione di questo elemento nella soluzione nutritiva.
Molti autori (Ferreyra et al., 1997; Ben-Gal and Shani, 2002; Eldestein et al., 2005; Yermiyahu et al., 2007; Smith et al., 2010 a, b) riportano che la salinità da NaCl può alleviare l’effetto della tossicità da B riducendo l’assorbimento d’acqua e l’accumulo nelle foglie, considerando che il B è assorbito passivamente dalle radici ed è traslocato con trasporto di massa. Anche nel nostro lavoro, abbiamo osservato che la salinità relativamente elevata dell’acqua irrigua ha ridotto la gravità dei sintomi fogliari, ma questo non ha una vera e propria base fisiologica. Infatti, a causa della progressiva salinizzazione della SN provocata dall’accumulo del NaCl e, in minor misura, di altri minerali (es. Ca, Mg e Mg; Tabella 4), la CE tendeva ad aumentare più rapidamente nelle tesi con SW determinando così un aumento della frequenza del ricambio della soluzione nutritiva (Figura 5) e, quindi, una riduzione della concentrazione media del B nel mezzo di crescita (Tabella 4). Inoltre, né la salinità né la concentrazione di B hanno influenzato l’assorbimento idrico. Pertanto, si può concludere che l’effetto protettivo da parte della salinità nei confronti della tossicità da B è indiretto o, se vogliamo, di tipo tecnologico, legato cioè al particolare regime di fertirrigazione imposto dall’uso di acque più saline.
Anche nelle foglie con evidenti bruciature, le zone centrali asintomatiche sono rimaste verdi e vitali a giudicare dai valori determinati con il fluorimetro, che non sono risultati significativamente diversi nei vari trattamenti. L’efficienza fotosintetica, così valutata, è stata certamente più condizionata dall’orario delle misure. Infatti, abbiamo rilevato valori significativamente più bassi a mezzogiorno rispetto al mattino, verosimilmente a causa delle maggiori TAIR.
Inoltre, la già commentata assenza di differenze tra i vari trattamenti nell’assorbimento idrico, determinato per oltre il 95% dalla traspirazione, suggerisce che la conduttanza stomatica non sia stata influenzata dal regime di fertirrigazione considerando anche che non c’erano
39
differenze nel LAI. Questi dati sembrano quindi escludere un effetto del B sull’efficienza fotosintetica, in accordo peraltro con i risultati di altri autori, ad esempio Bastias et al. (2004). Questi ultimi autori, infatti, hanno visto che nel mais, sottoposto a condizionin di stress salino ed eccesso di B, la fotosintesi e lo stato idrico fogliare erano influenzati negativamente soltanto dalla salinità. Al contrario, nel pomodoro allevato in idroponica Nada et al. (2010) hanno osservato che il tasso di fotosintesi e la conduttanza stomatica erano significativamente ridotti con concentrazioni di B nella SN di 4 o più mg L-1.
Pertanto, si può anche concludere che la tossicità del B nel nostro caso si evidenziava attraverso una riduzione della superficie fogliaire fotosinteticamente attiva.
Nonostante questo, non sono stati rilevati effetti negativi della concentrazione elevata di B nell’acqua irrigua sull’accumulo di sostanza secca della coltura e sulla produzione di frutti (Tabella 6). Questi risultati sono in accordo con altri. Gli effetti del B sulla crescita e sulla produzione di colture, come il pomodoro, è funzione della concentrazione di B nel terreno o nell’acqua irrigua come pure nei tessuti fogliari (Francois, 1984; Ben-Gal and Shani, 2002, 2003, Eraslan et al., 2007; Yermiyahu et al., 2007; Smith et al., 2010a, b).
Francois (1984) riportano che nel pomodoro coltivato su sabbia la produzione di frutti non diminuiva fintanto che la concentrazione di B nel mezzo di crescita o nelle foglie non saliva sopra, rispettivamente, 10 mg L-1 e 1106 mg kg-1 (dopo circa tre mesi di coltivazione), anche se le bruciature fogliari si manifestavano a concentrazioni ben più basse. In base a quanto riportato da Ben-Gal and Shani (2002), la riduzione della produzione nel pomodoro si aveva solo con concentrazioni di B nell’acqua irrigua superiori a 0.74 mol m-3 con CE di 3.0-6.0 dS m-1, valori simili a quelli ottenuti nella nostra prova. Infatti, abbiamo registrato una concentrazione media di B nella SN di 630 mmol m-3 con valori massimi intornto a 1213 mmol m-3 (FWHB; Figura 10), che appunto sono comparabili ai valori soglia per la diminuzione della produzione riportati da Francois (1984), Ben-Gal and Shani (2002) e Eraslan et al. (2007).