CAPITOLO 1
CAPITOLO 1
CAPITOLO 1
CAPITOLO 1
Caratteristiche
Caratteristiche
Caratteristiche
Caratteristiche della specie
della specie
della specie
della specie
MASCHIO ADULTO DI DAINO MASCHIO ADULTO DI DAINO MASCHIO ADULTO DI DAINO MASCHIO ADULTO DI DAINO
Caratteristiche della specie
Caratteristiche della specie
Caratteristiche della specie
Caratteristiche della specie
1.1
Paleontologia, evoluzione e distribuzione attuale
I fossili dei primi Ungulati, simili agli attuali Cervidi, sono stati rinvenuti in Eurasia e Nord America e si fanno risalire al Miocene, circa 20 milioni di anni fa. La storia evolutiva successiva non è ancora del tutto chiara, ma i vari reperti trovati ne delineano le tappe fondamentali.
La massima evoluzione si è avuta nel Pliocene con la comparsa di Cervidi collocabili alla base delle varie sottofamiglie poi differenziatesi.
La sottofamiglia Cervinae, a cui appartiene il daino, si sarebbe evoluta da un cervo rinvenuto in Cina, caratterizzato da tre cime per ogni palco (Azzaroli, 1948). Ciò sarebbe supportato dal ritrovamento del daino fossile Dama sericus, caratterizzato da palchi con palmatura simmetrica rispetto all’asse della stanga e con pile più alte rispetto al daino attuale (Teilhard de Chardin e Trassaert, 1937), nella regione del Shansi in Cina.
Al primo periodo interglaciale del Pleistocene risalgono i reperti fossili di Dama nestii, ritrovati in Valdarno e Olivola in Italia, e ad Oltenia in Romania (Azzaroli, 1948). Il Dama clactoniana, ritrovato negli scavi di Clacton-on-Sea, Essex, risale al secondo periodo interglaciale, circa 250.000 anni fa. Questo daino fossile è sicuramente il più vicino a quello odierno e rispetto a questo presentava dimensioni maggiori (circa un terzo in più) e una terza cima anteriore sul palco. Molti reperti, fatti risalire all’ultimo periodo interglaciale, sono stati ritrovati in Danimarca, Germania, Polonia, ex Unione Sovietica, Grecia, Italia, Francia, Gibilterra (Chapman e Chapman, 1975).
Durante l’ultima glaciazione (Wűrm), si assiste ad una critica contrazione dell’areale distributivo del daino, tanto da arrivare a sfiorare l’estinzione (Halternorth, 1958); sopravvissero solo piccole popolazioni nell’area mediterranea (Spagna, Italia centro meridionale e Balcani), destinate comunque a scomparire successivamente per motivi ancora ignoti (Masseti e Rrustioni, 1988). Non risentirono degli effetti della glaciazione soltanto le popolazioni dell’attuale Turchia e della Macedonia dai quali nuclei superstiti ripartì, infatti, la diffusione della specie, mediata dall’uomo. I Fenici nel X secolo a.C. reintrodussero il daino nelle regioni del Mediterraneo occidentale;
regioni d’Europa. I Normanni contribuirono ulteriormente all’ampliamento dell’areale di distribuzione, portandolo in Gran Bretagna.
Dal punto di vista sistematico si distinguono due sottospecie di daino: Dama dama
dama, la sottospecie europea, e Dama dama mesopotamica, la sottospecie persiana.
Attualmente il daino persiano si trova decisamente in pericolo di estinzione ed è rifugiato in zone del Khuzestan, lungo i fiumi Karkheh e Dez nell’Iran sud-occidentale, del Dasht-i-Naz nel Nord-Iran e dell’isola di Ashk sul lago Uroomieh nell’Iran nord-occidentale (Harrington, 1977; Trense, 1989) (cartina 1.1).
Il daino europeo è diffuso in cinque continenti (Africa, Asia, Europa, Oceania, Sud America; cartina 1.1). In Italia le popolazioni più consistenti in numero si trovano nelle tenute di S. Rossore e di Castel Porziano, nei parchi del Circeo e della Maremma, oltre che in numerose tenute di caccia e riserve minori (cartina 1.2). In Sardegna il daino si è estinto alla fine degli anni ’60 (Schenk, 1976), ma dall’inizio degli anni ’80 sono partiti progetti di reintroduzione nelle province di Oristano e Sassari (Apollonio com. pers.). E’ evidente, quindi, che la distribuzione attuale del daino europeo è frutto in massima parte dell’intervento umano. Per questa sottospecie esiste il problema opposto a quella persiana: nelle zone in cui sono assenti i predatori naturali del daino è opportuno evitare il soprannumero mediante un continuo controllo numerico dei capi, così da impedire il degrado vegetazionale ed il possibile effetto negativo sullo stato fisico e sanitario della popolazione stessa, nelle aree in cui è impossibile o comunque difficile una sua espansione o diffusione all’esterno.
Cartina 1.2 Distribuzione del daino in Italia. (Apollonio et al., 2004)
1.2
Sistematica
Il daino è stato per molti anni considerato appartenente al genere Cervus, a cui si ascrive il cervo europeo (Cervus elaphus) e il cervo sika (Cervus nippon). Oggi il daino viene più frequentemente classificato nel genere Dama che, pur rimanendo strettamente imparentato al genere Cervus, presenta caratteristiche distintive tali da giustificare la nuova suddivisione sistematica:
• I maschi adulti di daino presentano palchi con una palmatura distale ben delineata, notevolmente differente dalle ramificazioni che si dipartono da un’asta presenti nel tipico palco di cervo.
• Il maschio di daino adulto non ha la criniera.
• I canini nell’arcata superiore sono assenti, presenti invece nelle formule dentarie di entrambi i sessi del genere Cervus.
La classificazione più recente del daino è perciò: Regno: Animalia Phylum: Chordata Subphylum: Vertebrata Classe: Mammalia Sottoclasse: Teri Superordine: Ungulata Ordine: Artyiodactyla Sottordine: Ruminantia Famiglia: Cervidae Sottofamiglia: Cervinae Genere: Dama Specie: Dama dama Sottospecie europea: Dama dama dama
Sottospecie persiana: Dama dama mesopotamica
L’ibridazione tra le due sottospecie produce prole fertile: quest’aspetto, in aggiunta alle differenze morfologiche non rilevanti, come le maggiori dimensioni dei palchi nel daino persiano, ha portato a non considerarle due specie differenti.
La sottospecie oggetto di questa tesi è quella europea.
1.3
Morfologia e biologia
1.3.1 Struttura scheletrica e adattamenti cursori
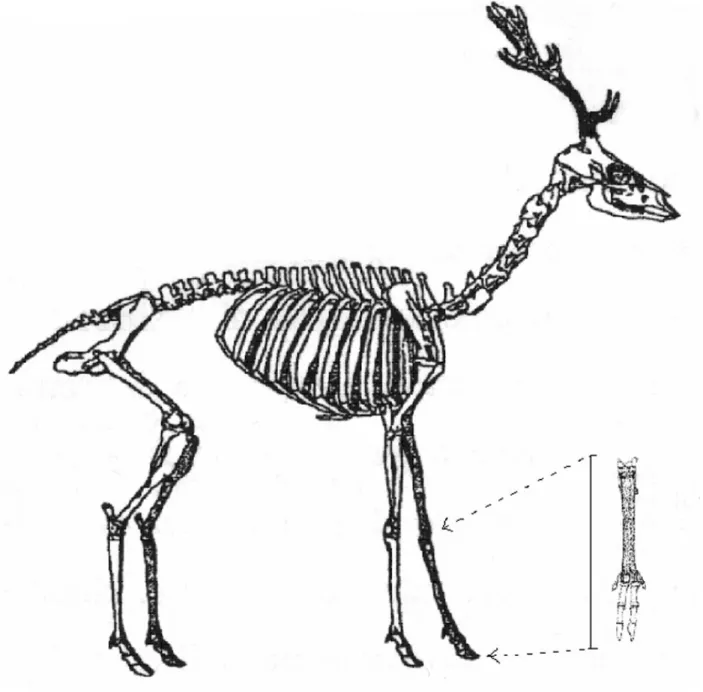
Lo scheletro di un daino è costituito da 208 ossa. Le 41 vertebre della colonna vertebrale sono suddivise nelle seguenti sezioni: 7 cervicali, 13 toraciche, 6 lombari, 4 sacrali fuse a formare l’osso sacro e 11 coccigee (figura 1.1).
Le 13 paia di coste sono connesse allo sterno tramite la cartilagine costale. La cintura toracica, priva di clavicola, rende la spalla libera di muoversi in avanti e indietro e favorisce, di conseguenza, una maggiore falcata ed un migliore posizionamento dell’arto per una spinta più efficace.
Nell’arto anteriore il 3° e 4° osso metacarpale sono fusi a dare l’osso cannone, struttura che contribuisce all’aumento della compattezza e della resistenza dell’arto. Il 1° osso metacarpale è scomparso, mentre il 2° e il 5° sono vestigiali e posizionati in corrispondenza dell’estremità prossimale dell’osso cannone, uno su ciascun lato. Questa configurazione è nota come condizione plesiometacarpale ed è tipica di tutta la sottofamiglia Cervinae, quindi anche del cervo. Nella sottofamiglia Odocoileinae, a cui appartengono il capriolo (Capreolus capreolus), l’alce (Alces alces) e la renna (Rangifer tarandus), si ha invece la condizione telimetacarpale, nella quale il 2° e 5° osso metacarpale sono situati all’estremità distale dell’osso cannone. Le falangi distali del 3° e 4° dito sono ricoperte da un astuccio corneo a formare uno zoccolo su cui l’animale poggia l’intero peso corporeo (condizione unguligrada). Per questo il daino, come tutti gli appartenenti all’ordine Artyodactyla, è un parassone, in contrapposizione all’ordine Perissodactyla, a cui appartengono cavallo (Equus
caballus), tapiro (Tapirus terrestris) e rinoceronte nero (Diceros bicornis), definiti
mesassoni poiché scaricano il peso corporeo solo sul 3° dito. Le falangi del 2° e 5° dito sono estremamente ridotte, ricoperte da un astuccio corneo posizionato posteriormente allo zoccolo; queste falangi non hanno funzione di sostegno.
La struttura dell’arto posteriore è simile a quella dell’arto anteriore. Il 3° osso metatarsale è fuso con il 4° a costituire un osso cannone caratterizzato da un solco a decorso longitudinale sulla faccia anteriore dell’osso che si chiude a dare una sorta di tubicino all’estremità distale; quest’aspetto è comune a tutti i Cervidi. Il 2° e 5° osso metatarsale mancano del tutto.
Figura 1.1 Scheletro di daino maschio.
In basso a destra si può notare la posizione delle ossa dell’estremità inferiore dell’arto anteriore, fuse e ridotte in numero rispetto all’arto di un Mammifero primitivo (da Chapman e Chapman, 1997, modificato).
Gli adattamenti cursori del daino, caratteristici di tutti gli Ungulati e che trovano la loro massima espressione nei Cervidi, sono forse l’aspetto morfologico-funzionale più interessante insieme alle specializzazioni alimentari che saranno trattate più avanti. La necessità di essere veloci per sfuggire ai predatori e quella di spostarsi per
cercare il cibo sono state le spinte evolutive determinanti nella selezione di tali adattamenti cursori.
La lunghezza della falcata è aumentata grazie a tre fattori:
1. Gli arti anteriori e posteriori si sono allungati e questo processo ha interessato soprattutto le parti distali, vale a dire al di sotto rispettivamente di omero e femore.
2. La perdita della clavicola che ha svincolato il cinto toracico dallo sterno.
3. L’acquisizione di maggiore libertà da parte della scapola comporta un guadagno di circa 11 cm nella falcata.
La colonna vertebrale ha acquistato notevole capacità di compressione ed espansione.
Anche la frequenza della falcata è aumentata grazie alla presenza dei seguenti adattamenti morfologici:
• Alleggerimento degli arti nelle loro parti distali al quale contribuisce notevolmente il concentramento della muscolatura nelle parti prossimali. Infatti, l’80% del peso dell’arto è situato sopra al carpo/tarso.
• Aumento del numero di pezzi dell’arto che si muovono nella stessa direzione. Quindi un arto diritto, già alleggerito distalmente, diventa più facile da trascinare in avanti. Inoltre lo sviluppo di una serie di strutture che servono a rendere più rigido il complesso delle ossa degli arti, come l’osso cannone, evita che l’arto possa avere movimenti laterali controproducenti nell’economia della corsa.
Il vantaggio finale, dovuto alla presenza di tutte queste caratteristiche morfologiche, è rappresentato dal fatto che un modesto sforzo muscolare produce un ampio movimento dell’arto.
Gli adattamenti coinvolgono anche i legamenti: il grosso legamento nucale, che permette il sollevamento del cranio connettendo l’occipitale con l’osso sacro, collabora con la muscolatura omonima. Il legamento si trova a riposo, quando il capo non è chinato, perciò durante la corsa non è necessario un eccessivo dispendio di energia per tenere la testa diritta, ciò va incontro anche alle esigenze dei maschi che devono sostenere il peso del palco. Un altro legamento di particolare interesse è quello che corre lungo l’osso cannone e si attacca alla prima falange che permette all’arto, quando è sollevato da terra durante la corsa, di spostarsi rapidamente all’indietro in modo da favorire ulteriormente l’aumento della frequenza della falcata.
1.3.2 Dentatura e stima dell’età dai denti
Il daino nel corso della vita presenta due dentizioni. La prima, temporanea o da latte, è costituita da 20 denti con cui il piccolo nasce. Questi saranno perduti entro i primi 26 mesi di vita per essere sostituiti dai 32 denti che costituiscono la seconda dentizione, quella definitiva. I 20 denti decidui dei piccoli sono suddivisi in 6 incisivi, 2 canini e 12 premolari. Le tappe dell’eruzione della dentatura definitiva sono:
1. Comparsa dei primi denti definitivi, i primi molari (superiore ed inferiore) a circa 3 mesi di età.
2. Comparsa del primo incisivo (inferiore) a 9-12 mesi.
3. Comparsa del secondo molare (superiore ed inferiore) e del secondo incisivo (inferiore) a 13-16 mesi.
4. Comparsa del terzo incisivo (inferiore) e del canino (inferiore) a 17-20 mesi. 5. Comparsa del secondo e terzo premolare (superiori ed inferiori) e del terzo
molare (superiore ed inferiore) a 21-24 mesi.
6. Comparsa del primo premolare (superiore ed inferiore) a 25-26 mesi.
Tra un animale e l’altro possono variare gli intervalli che intercorrono tra la comparsa dei vari denti.
Nel daino adulto la formula dentaria di ogni emiarcata, rispettivamente superiore e inferiore è la seguente:
Emiarcata Incisivi Canini Premolari Molari
superiore 0 0 3 3
inferiore 3 1 3 3
con un numero totale di denti pari a 32.
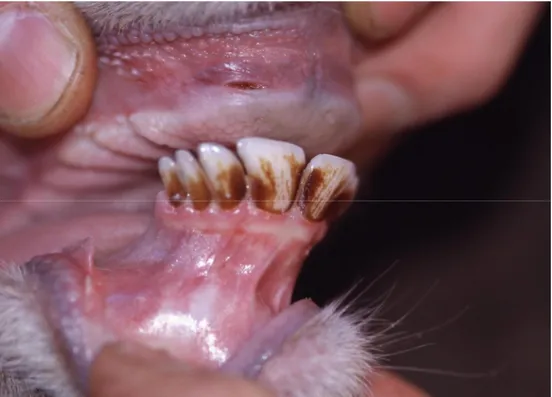
Come si evince dalla formula dentaria, l’arcata superiore è costituita da 12 denti contro i 20 di quella inferiore. I canini e gli incisivi dell’arcata superiore sono stati sostituiti da un cercine gengivale, costituito da tessuto fibroso ricoperto di tessuto epiteliale e utilizzato per strappare l’erba. Gli incisivi e i canini inferiori costituiscono una sorta di spatola che ben si addice, facendo pressione sul cercine superiore, a tagliare i vegetali (foto 1.1).
I canini ed i premolari sono separati dal diastema tipico dei mammiferi con regime alimentare strettamente erbivoro. I premolari, molariformi, e i molari sono di tipo selenodonte: ciascuno ha due coppie di alte cuspidi (quadritubercolati), due radici e sono caratterizzati da creste a forma di falce sulla superficie atte a tranciare i vegetali. Questi denti continuano a crescere nel corso della vita, allo scopo di controbilanciare l’usura continua.
Foto 1.1 Particolare degli incisivi in una femmina adulta.
Si evidenzia un particolare della dentatura. Si notino gli incisivi e i canini incisiviformi dell’arcata inferiore ed il cercine connettivale gengivale superiore.
L’analisi della dentatura è il metodo più attendibile per stimare l’età di un daino al momento della sua cattura. Nei giovani si considerano le diverse categorie di denti definitivi già comparsi, mentre negli adulti si valuta l’usura che è in correlazione diretta con l’età. Un dente usurato presenta creste consumate in modo differenziale come conseguenza del fatto che i vari strati che lo costituiscono (più internamente dentina rivestita da smalto) sono consumati durante la masticazione. Ovviamente l’usura dei denti è condizionata dal tipo di alimentazione dell’animale (per esempio se vengono masticati vegetali più o meno ricchi in sali di silice). Tuttavia si può ragionevolmente presupporre che tra individui appartenenti alla stessa popolazione e
che occupano la stessa area il grado di usura maggiore o minore sia in relazione della sola età.
Un ulteriore e più accurato metodo per stimare l’età dai denti degli adulti consiste nel conteggio degli anelli di cemento che si depongono annualmente a livello delle radici di incisivi e molari. L’età viene quindi determinata mediante il conteggio delle bande di deposizione del cemento (McCullough e Beier, 1986). Questa tecnica, per quanto accurata, non è applicabile sul campo, poiché necessita di strumenti di laboratorio e richiede la rimozione del dente; è quindi limitata ad animali deceduti.
1.3.3 Suddivisione in classi di età e loro riconoscimento
Secondo Apollonio e Toso (1988) nel daino si possono distinguere le seguenti classi di sesso ed età:
Femmine:
• giovane: età inferiore ad un anno; • adulta: età superiore ad un anno. Maschi:
• giovane: età inferiore ad un anno;
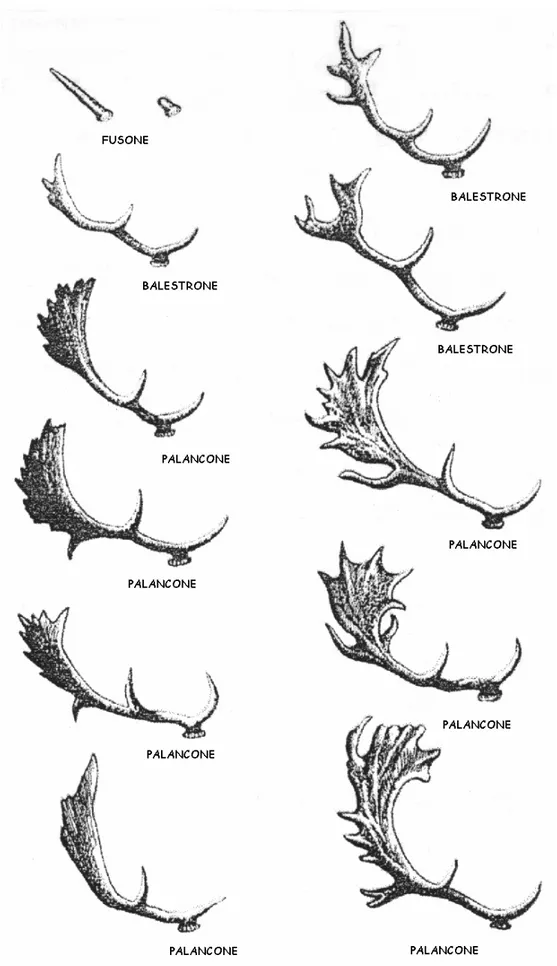
• fusone: età compresa tra uno e due anni, con palchi limitati a bottoni o aste prive di ramificazioni;
• balestrone: età compresa tra due e quattro anni, con palchi ramificati ma palmatura poco sviluppata;
• palancone: età superiore ai quattro anni, con palchi ramificati e palmatura terminale ben sviluppata.
I piccoli di entrambi i sessi sono riconoscibili dalle femmine grazie ad un muso più corto e schiacciato; presentano, inoltre, una minore ampiezza toracica ed è netta la sproporzione tra le zampe ed il resto del corpo.
1.3.4 Dimensioni e peso
Nel daino i maschi adulti raggiungono dimensioni e pesi maggiori rispetto alle femmine: l’altezza al garrese varia tra 85-95 cm, la lunghezza totale è di 160-185 cm, coda esclusa, e il peso varia da 65 a 100 kg. Entrando nel merito delle classi di età, i fusoni hanno un peso compreso tra 32 e 55 kg, i balestroni tra 55 e 80 kg.
Le femmine non superano i 75-85 cm di altezza al garrese e 140-160 cm di lunghezza ed hanno un peso variabile da 40 a 60 kg. È quindi apprezzabile un notevole dimorfismo sessuale sia nel peso che nelle dimensioni.
Il peso del neonato è in media 4.5 kg. I piccoli di 10-12 mesi hanno un peso compreso tra i 25 e i 28 kg (Mantovani, 1992).
1.3.5 Caratteristiche del mantello e muta
Nel daino si distinguono quattro principali varietà di colorazione del mantello: • Tipica
• Menil • Bianca • Melanica
Nella varietà tipica la testa, la parte superiore del collo, la schiena, i fianchi e la porzione superiore ed esterna degli arti sono di colore marrone-rossastro. La schiena ed i fianchi sono costellati di macchie chiare a dare la caratteristica pomellatura che in tutti gli altri Cervidi (ad eccezione del cervo axis, Axis axis, e del cervo sika) è presente solo nei primi mesi di vita, quando risulta essenziale per il mimetismo dei piccoli. In corrispondenza della linea centrale dei fianchi e lungo quella obliqua sui quarti posteriori, le macchie chiare formano una linea continua. Una linea scura corre longitudinalmente dalla nuca alla coda lungo la colonna vertebrale. La parte inferiore della testa, del collo, la pancia e la faccia interna degli arti sono di colore più pallido. Lo specchio anale è bianco ed è circondato da una linea nera; la parte superiore della coda è nera mentre la sua faccia inferiore è bianca. In inverno la pomellatura diviene quasi impercettibile e il manto assume una colorazione grigio-marrone.
La varietà menil è molto simile alla tipica, ma i colori sono più chiari e la pomellatura in inverno rimane molto più evidente.
La varietà bianca non è una forma di albinismo. Infatti, benché gli occhi e gli zoccoli siano più chiari rispetto alle altre varietà, non sono privi di pigmentazione. Alla nascita il colore del manto è crema scuro e col passare degli anni diventa bianco. Questa varietà è decisamente sfavorita nella mimesi e persiste, infatti, solo in parchi gestiti dall’uomo e soprattutto privi di predatori.
Nella varietà melanica il daino presenta schiena e fianchi grigio scuro o neri con pomellatura grigia appena percettibile o addirittura assente e lo specchio anale è
grigio-nero. Le parti inferiori della testa, il collo e la pancia sono marrone-grigio più chiaro. In questo caso il manto invernale è più chiaro di quello estivo.
Nella Tenuta di S. Rossore i capi melanici rappresentano il 20-30% circa della popolazione totale, mentre i restanti presentano il mantello tipico (Apollonio com.pers.). Le regole genetiche della trasmissione della colorazione non sono ancora state del tutto chiarite, ma probabilmente la colorazione tipica è una forma dominante rispetto alla melanica.
I tentativi di semi-domesticazione del daino da parte dell’uomo e l’utilizzo a scopo venatorio hanno portato alla comparsa di ulteriori colorazioni, più o meno riconducibili alle quattro categorie fondamentali appena descritte.
A primavera e in autunno si verifica la muta del pelo. La muta autunnale permette il ripristino del mantello più ispido e più folto, adatto a sopportare i rigori invernali.
La pelliccia è formata da due tipi di peli: • Peli primari
• Peli secondari
I peli primari sono ispidi, spessi e misurano dai 4 ai 13 cm. I peli secondari sono più fini e intercalati ai primari. Il pigmento, in tutte le varietà, è più concentrato in corrispondenza dell’estremità libera del pelo.
I peli della coda sono ispidi e lunghi circa 11 cm. Nelle femmine è presente inoltre un ciuffo di peli immediatamente sotto la vulva, corrispondente al “pennello” nei maschi (ciuffo di peli che riveste l’astuccio del pene).
1.3.6 Apparato digerente
Come in tutti i Ruminanti, lo stomaco del daino è composto da 4 camere (figura 1.2): 1. Rumine
2. Reticolo 3. Omaso 4. Abomaso
Le prime tre camere sono estroflessioni dell’esofago, mentre lo stomaco vero, l’equivalente di quello degli altri mammiferi, è l’abomaso. Il rumine (compartimento più grande) e il reticolo (il più piccolo) hanno pareti molto robuste per contrastare l’azione abrasiva dei vegetali ingeriti. Tutte le componenti dell’apparato digerente sono costituite da epiteli caratterizzati da estroflessioni (villi nel rumine, lamine a
pagina di libro nell’omaso, poligoni nel reticolo), che servono ad ampliare la superficie assorbente.
L’animale al pascolo ingerisce quantità ingenti di vegetali, accumulando le parti solide nel rumine ed inviando quelle liquide all’omaso e all’abomaso. Il cibo ingoiato viene solo parzialmente masticato. Nel rumine il cibo è inumidito, agitato e mescolato con i microrganismi simbionti che abitano questo compartimento. Le grosse particelle di cibo galleggiano sulla sommità del fluido del rumine e passano poi al reticolo, un sacco a fondo cieco la cui parete presenta suddivisioni ad alveare. Qui si formano piccoli boli alimentari che vengono rigurgitati, quando l’animale è a digiuno in un posto sicuro, e nuovamente masticati ed ingoiati nel rumine. Solo dopo che il materiale è finemente triturato passa dal rumine, attraverso l’omaso, nell’abomaso, dove è aggredito dagli enzimi digestivi tipici dei vertebrati. Gli enzimi agiscono sul materiale vegetale, sui prodotti di fermentazione provenienti dal rumine e sui microrganismi stessi, rompendo le loro pareti cellulari e liberando le proteine e i carboidrati che essi contengono.
Dall’abomaso il cibo digerito passa nel piccolo intestino, dove sono assorbiti i prodotti sia della digestione microbica che di quella acida.
La consistente flora batterica simbionte, localizzata nel rumine, è fondamentale: essa è in grado di produrre l’enzima cellulasi, necessario per l’attacco delle pareti cellulari cellulosiche delle cellule vegetali. Solo pochissimi metazoi (alcuni molluschi e artropodi) sono capaci da soli di produrre l’enzima cellulasi. La cellulosa viene così scissa nel disaccaride cellobiosio, a sua volta scisso in due molecole di glucosio dall’enzima cellobiasi.
Vari ceppi batterici acidificanti fermentano i prodotti di digestione di polisaccaridi, proteine e lipidi con produzione di acido acetico, butirrico e propionico, anidride carbonica e idrogeno molecolare. Infine i batteri metanogeni riducono l’anidride carbonica a metano. Quest’ultimo gas, prodotto in abbondanza dal processo di fermentazione, viene dissipato in parte mediante riassorbimento nel circolo sanguigno ed in parte per espulsione diretta dalla bocca.
La densità e la composizione della flora microbiologica dello stomaco variano con l’età (nei piccoli in fase di allattamento predominano i lattobacilli), con la dieta e con le condizioni fisiologiche dell’animale. Nel periodo riproduttivo, per esempio, quando i maschi entrano in una fase di vera e propria anoressia fisiologica, lo stomaco contiene proporzionalmente meno microrganismi.
Nel piccolo, durante l’allattamento, le prime tre camere sono meno sviluppate rispetto all’abomaso che è direttamente coinvolto nella digestione del latte materno. Man mano che cresce la percentuale di vegetali nella dieta, il reticolo ed il rumine aumentano in volume in modo corrispondente all’incremento della flora batterica. La capacità di sfruttare il cibo, nonostante abbia uno scarso apporto nutrizionale, è in relazione al rapporto esistente tra le dimensioni del rumine dell’animale e la sua mole corporea. Il capriolo (C. capreolus), che ha un rumine di piccole dimensioni, deve essere estremamente selettivo nella scelta del cibo da ingerire (foglie, gemme, giovani rami) per poter soddisfare il proprio fabbisogno energetico. Lo stambecco, invece, avendo un rumine molto ampio, può nutrirsi di grandi quantità di vegetali, che possono, per questo motivo, anche avere uno scarso potere nutrizionale (Hoffmann, 1978).
Considerando tutto ciò, gli erbivori possono essere suddivisi in pascolatori e brucatori sulla base della qualità del cibo utilizzato (Hoffmann, 1978). I pascolatori possono utilizzare anche specie vegetali con elevate quantità di fibra, come le graminacee, in
sono costretti a selezionare di più il cibo, preferendo specie meno coriacee e ad alto contenuto energetico, come le gemme e gli apici fogliari. Il daino può essere definito un pascolatore selettivo, collocandosi in una posizione intermedia tra le due precedenti (Hoffmann, 1978). La specie, infatti, ha dimostrato una notevole plasticità trofica; la dieta varia notevolmente a seconda della stagione e dell’area occupata, ma è fondamentalmente erbacea ed arbustiva. Le erbe più comunemente consumate appartengono ai generi Agrotis, Festuca, Halcus e Poa (Jackson, 1974); in inverno le foglie del Rubus spp. e Hedera rappresentano un’importante riserva alimentare (Chapman e Chapman, 1997). Nella Tenuta di S. Rossore i generi arborei ed arbustivi preferiti comprendono Fraxinus, Quercus, Alnus, Crataegus, Carpinus,
Populus e Salix. In questa zona le differenze tra dieta primaverile e autunnale
consistono essenzialmente in un incremento nel consumo di monocotiledoni (Bruno e Apollonio, 1991). Tra i frutti che risultano appetibili vi sono le ghiande in autunno, more, faggiole, castagne e le drupe del biancospino (Chapman e Chapman, 1997). Il daino assume l’apporto idrico necessario dai vegetali stessi, dalla rugiada e solo raramente beve nei corsi d’acqua e nelle pozze temporanee.
1.3.7 Ghiandole cutanee
In tutti i macrosmatici le ghiandole con i loro secreti giocano un ruolo fondamentale nella comunicazione intraspecifica. Nel daino sono presenti ghiandole sudoripare e sebacee secretrici. Esse si distinguono in interdigitali, metatarsali e suborbitali in base alla diversa localizzazione corporea; sono tutte ghiandole pari e presenti in entrambi i sessi. Nel maschio è presente inoltre una ghiandola prepuziale.
Le ghiandole metatarsali si trovano sulla parte esterna di ciascun arto posteriore, immediatamente al di sopra del garretto, e sono identificabili per la presenza di un cuscinetto ovale di peli più pallidi. Il secreto è ceroso, di odore pungente ed è presente tutto l’anno.
Le ghiandole interdigitali sono sebacee e si trovano alla base dell’arto, sulla linea mediana, subito sopra lo zoccolo in una piccola tasca. Il secreto è una sostanza giallo pallida, cerosa, di odore non spiacevole ed è anch’esso prodotto tutto l’anno. Sotto la finestra orbitale si trovano le ghiandole suborbitali, sebacee e sudoripare. Le ghiandole prepuziali sono situate a livello dell’astuccio del pene: attive nel periodo riproduttivo, conferiscono all’urina un odore forte e pungente.
L’autunno rappresenta la stagione in cui si evidenzia l’importanza della comunicazione intraspecifica odorosa nel daino. In tutto il periodo che precede la riproduzione i maschi adulti raspano il terreno e schiantano la vegetazione con i palchi nei territori del lek e in tutta l’area limitrofa. Essi orinano sulle “raspate”, lasciando il proprio odore individuale. Inoltre, strofinando il muso sugli “schianti” effettuati a livello di alberi e arbusti, rilasciano il secreto prodotto dalle ghiandole suborbitali, che durante questo periodo risultano ipertrofiche.
1.3.8 Sviluppo del feto
Nelle prime settimane dopo il concepimento (ottobre-novembre), un feto di daino subisce uno sviluppo abbastanza lento fino al momento in cui la placenta non si è completamente formata. Una volta che quest’ultima adempie efficacemente alle sue funzioni di trasporto di sostanze nutritive, di eliminazione dei cataboliti e permette gli scambi gassosi adeguati, lo sviluppo subisce una rapida accelerazione. Infatti da una lunghezza del feto pari a 3 cm e con un peso di 2 gr, registrabili a 6 settimane dal concepimento (novembre-dicembre), si arriva ad una lunghezza di 55 cm e ad un peso di 4.5 kg, misure raggiunte una volta completato lo sviluppo embrionale dopo 27 settimane.
1.3.9 Struttura dei palchi
I palchi sono una caratteristica morfologica presente in tutti gli appartenenti alla famiglia dei Cervidi, fatta eccezione per i generi Moscus e Hydropotes, e sono strutture ben diverse dalle corna. Queste ultime, caratteristiche della famiglia dei Bovidi, sono presenti spesso in entrambi i sessi, persistono per tutta la vita e sono costituite da un nucleo osseo (di origine mesodermica) incapsulato da un astuccio corneo (di origine ectodermica).
I palchi, invece, sono caratteri sessuali secondari presenti solo nei maschi se si escludono renna e caribù (entrambe sottospecie di Rangifer tarandus) in cui essi si ritrovano anche nelle femmine. I palchi, inoltre, vanno incontro, sotto il controllo ormonale, ad un ciclo annuale di crescita e caduta; la loro struttura è puramente ossea, quindi di natura solo mesodermica.
Secondo Pough et al. (1993) i palchi sono un carattere derivato dei Cervidi che si è affiancato man mano al carattere primitivo costituito dai canini. I Cervidi
alle zanne, come nel piccolo daino asiatico muntjac (Muntiacus reevesi). Addirittura i moschi, appartenenti alla sottofamiglia più primitiva dei Cervidi (sottofam. Moschinae) non hanno i palchi e presentano canini superiori a crescita continua usati nei combattimenti tra i maschi. I palchi inizialmente sarebbero nati come scudo dagli attacchi dei canini dell’avversario, ma poi ne avrebbero rilevato la funzione. Infatti, è indicativo che nei Cervidi più evoluti, come il daino, siano assenti i canini nell’arcata superiore; nel cervo, invece, pur esistendo un canino rudimentale, è stato mantenuto il comportamento di mostrare, alzando il labbro superiore, una “zanna” che in effetti non esiste più.
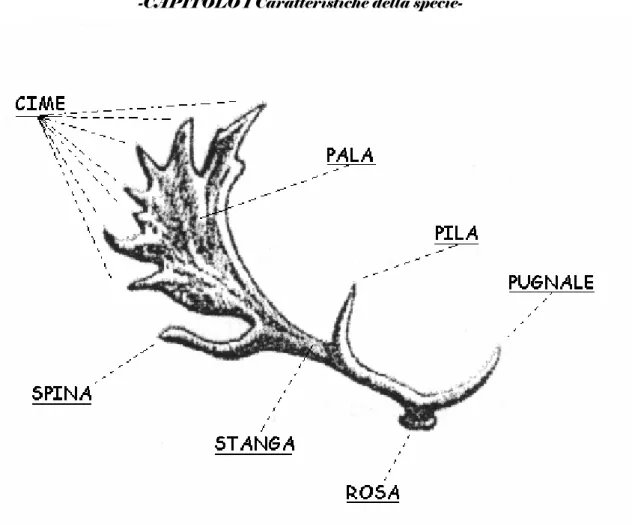
I palchi prendono origine da estensioni delle ossa frontali, dette “peduncoli”, formate dal periostio che ricopre le ossa frontali e irrorate da vasi sanguigni in comune con le stesse. I piccoli nascono senza peduncoli che nei maschi iniziano a svilupparsi dal sesto o settimo mese di vita. Lo sviluppo dei peduncoli viene attivato da un adeguato tasso ematico di ormoni androgeni (testosterone); la castrazione poco dopo la nascita, infatti, impedisce lo sviluppo sia dei peduncoli che dei palchi. A circa un anno di età, durante il mese di aprile, inizia la crescita del primo paio di palchi. A primavera fattori ambientali, quali fotoperiodo e temperatura, stimolano l’adenoipofisi a produrre e mettere in circolo somatotropina (STH), che controlla e stimola la crescita dei palchi. In questo periodo il testosterone si trova a livelli minimi e di conseguenza anche la spermatogenesi. Durante la crescita del palco il tessuto osseo generato dai peduncoli, inizialmente riccamente vascolarizzato, è vivo e ricoperto da un epitelio particolare denominato velluto, dotato anch’esso di vasi sanguigni, ed anche di tessuto nervoso (innervazione da parte del nervo cranico trigemino). La crescita termina verso metà agosto, quando l’ossificazione è completa e viene raggiunta la forma finale. Con la diminuzione del fotoperiodo, l’adenoipofisi inizia ad immettere in circolo gonadotropine, che hanno come bersaglio le cellule testicolari di Leydig, ha così inizio la spermatogenesi in preparazione al periodo riproduttivo di ottobre. Giunti a questo punto, sotto l’influenza dell’elevato tasso di ormoni in circolo, il tessuto osseo alla base dei palchi prolifera a formare un cercine che comprime i vasi sanguigni, togliendo l’apporto sanguigno a livello cutaneo. Il velluto così muore e viene perso, scoprendo l’osso sottostante. All’inizio questo è biancastro, ma lo sfregamento dei palchi contro gli alberi, operata dai maschi per liberarsi del velluto morto, impregna i canalicoli ossei di Havers di tannini ed altre sostanze presenti nelle piante.
La spermatogenesi arriva al culmine in corrispondenza del periodo riproduttivo (autunno), per poi diminuire gradualmente durante l’inverno, fino a che si ritorna, in primavera, ad una situazione di quiescenza sessuale. In questo periodo la base del palco, subito sopra il peduncolo, è attaccata dagli osteoclasti e la degenerazione di questa zona porta alla caduta del palco. I primi a perderlo sono i palanconi; seguono in successione le altre classi d’età. I palchi dei fusoni possono essere semplici bozze di circa 3 cm (bottoni), ma anche aste non ramificate lunghe fino a 20 cm (fusi). Il secondo paio di palchi, in cui compaiono ramificazioni, aumenta in dimensioni; dai tre anni d’età inizia a divenire evidente la palmatura che caratterizzerà il palco del daino adulto e si allargherà di anno in anno (figure 1.3-1.4-1.5).
Figura 1.4 Tipologie di palchi, suddivise per classi di età. (fusone=1 anno, balestrone=2-3 anni, palancone ≥ 4 anni)
Figura 1.5 Palco di daino.
La forma dei palchi è strettamente individuale, legata quindi a fattori genetici; tuttavia non bisogna trascurare alcuni fattori in grado di influire sul normale sviluppo del palco. Per esempio è necessario considerare la quantità e la qualità di apporto alimentare, spesso condizionate dalla densità della popolazione, le ferite nel velluto in fase di crescita ed eventuali stress derivati da malattie.