Principi di NMR
CAPITOLO 1
PRINCIPI FISICI DI RISONANZA MAGNETICA
1.1 Principi di NMR
Neutroni e protoni, dotati di spin 1/2, formano in molti casi nuclei atomici con spin diverso da zero ed a tale spin è associato un momento magnetico. L’applicazione di un intenso campo magnetico tende ad allineare il momento magnetico lungo direzioni preferenziali; a differenti orientazioni del momento magnetico corrispondono differenti stati energetici. Come espresso dalla formula di Larmor, la differenza tra i vari livelli energetici è proporzionale al momento magnetico ed alla intensità del campo magnetico applicato. Irraggiando un sistema di nuclei con un’onda elettromagnetica di frequenza pari alla frequenza di Larmor è possibile fornire energia al sistema nucleare: tale effetto è noto come risonanza magnetica nucleare (NMR).
In questo paragrafo verranno descritti i principi fisici alla base del fenomeno della risonanza magnetica nucleare. Si illustrerà, qualitativamente, come la tecnica NMR consenta di ottenere informazioni utili su di un sistema di nuclei dotati di momento magnetico: in particolare saranno presi in esame nuclei con spin 1/2 come l’idrogeno. Quest’ultimo, dato l’elevato fattore giromagnetico e la grande abbondanza all’interno delle strutture biologiche, riveste un ruolo primario per studi in ambito biofisico.
Principi di NMR
1.1.1 Spin e momento magnetico nucleare
Lo spin è un fenomeno quanto-meccanico che giustifica l’interazione di un nucleo con un campo magnetico. Lo spin viene indicato con I, detto anche numero quantico di spin. Tale parametro può assumere soltanto valori interi o semi-interi, dipendenti dal numero di protoni e neutroni presenti nel nucleo; se I = 0 il nucleo non avrà interazioni con un campo magnetico. Noi ci interesseremo del nucleo dell’atomo di idrogeno, che ha un solo protone ed ha I = 1/2.
Ad ogni nucleo è associato un momento angolare p dato da:
p = π 2
h I (1.1)
dove h = 6,63 x 34 J x sec è la costante di Planck. 10−
Poiché il nucleo ha una carica elettrica ad esso è associato un momento magnetico di dipolo µ dato da:
µ = γ p (1.2)
con γ che viene detto fattore (o rapporto) giromagnetico.
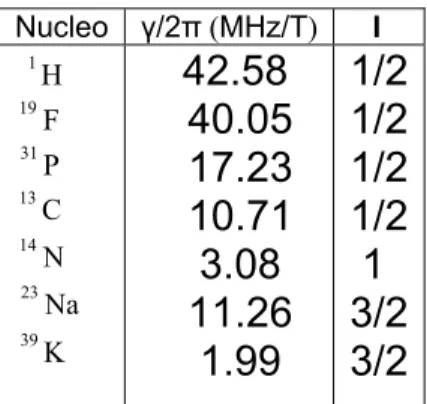
Nucleo γ/2π (MHz/T) I H 1 F 19 P 31 C 13 N 14 Na 23 K 39
42.58
40.05
17.23
10.71
3.08
11.26
1.99
1/2
1/2
1/2
1/2
1
3/2
3/2
Principi di NMR
1.1.2 Interazione dei nuclei con un campo magnetico statico:
modello quantico e modello classico
La presenza di un momento di dipolo magnetico fa sì che i nuclei con spin diverso da zero si comportino in un campo magnetico come una barretta magnetica avente due poli (nord e sud), assumendo quindi opportuni orientamenti.
Secondo il modello quantico il numero di tali orientamenti è pari a (2I+1), i quali corrispondono ai diversi livelli energetici permessi: per nuclei con I=1/2 si hanno due stati di energia, corrispondenti uno ad un orientamento di µ parallelo al campo applicato (stato a bassa energia) e l’altro ad un orientamento di µ antiparallelo al campo applicato
(stato ad alta energia). La differenza di energia tra due livelli adiacenti è data da:
0 B 0 B ∆E = µB0/I = γ π 2 h 0 B (1.3)
Facendo ricorso alla legge di Planck si nota che transizioni da un livello di energia ad uno adiacente possono essere indotte applicando radiazioni aventi frequenza /2π, dove
= γ . Tale frequenza viene detta “frequenza di Larmor” ed il fenomeno viene detto
risonanza magnetica nucleare (NMR); nel campo biofisico, dove si utilizzano campi
magnetici dell’ordine dei Tesla, la frequenza di Larmor assume valori nel range delle radiofrequenze.
L ω L
ω B0
Da ora in poi considereremo soltanto nuclei con I=1/2, in ragione dell’elevato valore del fattore giromagnetico (tab. 1.1): fattori giromagnetici maggiori permettono di avere la stessa separazione fra livelli energetici utilizzando campi magnetici statici inferiori.
Con I=1/2 si hanno perciò soltanto due livelli energetici; in un sistema omogeneo all’equilibrio termico abbiamo un numero di nuclei con µ parallelo al campo applicato
ed un numero di nuclei con µ antiparallelo al campo applicato e tali quantità sono legate secondo la relazione:
L n 0 B U n B0
Principi di NMR ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ ∆ = kT E exp n n U L (1.4)
dove k =1,38 x 10−23 J/°K è la costante di Boltzmann e T è la temperatura assoluta. Nel caso dell’idrogeno a temperatura ambiente e con =1 Tesla si ha che differisce da di solo 3 parti su un milione; quindi in questo caso con una tecnica NMR non si potrebbero ottenere misure significative, se non aumentando l’intensità del campo magnetico statico oppure diminuendo la temperatura (entrambe le soluzioni si rivelerebbero molto sfavorevoli per il paziente).
0
B nL
U
n
Secondo il modello classico, invece, in un campo magnetico statico sono permessi tutti gli orientamenti per i nuclei dotati di spin; per I=1/2 si ritrovano i risultati ottenuti con il modello quantico.
Nel modello classico l’interazione tra µ e è spiegata mediante l’esistenza di un “momento torcente” τ dato da:
0 B τ = µ Λ B0= t ∂ ∂p (1.5)
Facendo le opportune sostituzioni, basandosi sulle relazioni ricavate in precedenza, si ricava la seguente formula:
t ∂ ∂µ = ωLΛ µ (1.6) con ωL= - γB0;
da ciò si evince che ogni nucleo precede in senso orario attorno alla direzione di applicazione del campo magnetico statico con velocità angolare ed un certo angolo di precessione. Si nota quindi che la frequenza di precessione nel modello classico corrisponde alla frequenza di Larmor ricavata nel modello quantico.
L ω
Passando adesso a considerare un sistema di nuclei presenti in un campione si ha che la magnetizzazione globale M è ottenuta come:
Principi di NMR =
∑
i i µ M (1.7)All’equilibrio termico non esiste coerenza di fase tra i vari nuclei, in modo tale che si può considerare nulla la componente di M perpendicolare alla direzione di : esiste comunque una componente di M lungo la direzione di dovuta appunto all’azione del momento torcente. La grandezza di tale componente corrisponde all’eccesso di spin ricavato nel modello quantico (eq.1.4). Operando poi le dovute sostituzioni, in accordo all’eq.(1.6) si ottiene anche per M una relazione di moto:
0 B 0 B t ∂ ∂M= Λ M (1.8) L ω
e quindi notiamo che anche il vettore magnetizzazione M di tutto il campione ha un moto di precessione analogo a quello di ogni singolo nucleo. E’ proprio tale grandezza che sarà determinante in ogni esperimento NMR.
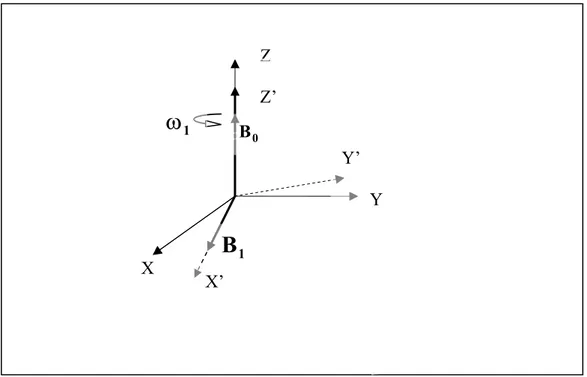
1.1.3 Impulsi a radiofrequenza
Come già anticipato in precedenza in condizioni di risonanza magnetica si invia al sistema di nuclei in esame un’onda elettromagnetica di frequenza pari a quella di Larmor: in genere si sceglie un’onda polarizzata circolarmente nel piano ortogonale al campo magnetico statico . In un sistema di riferimento fisso come quello usato in precedenza la magnetizzazione M percorrerebbe una spirale, ossia avrebbe un moto molto complicato e difficile da visualizzare. A questo punto risulta utile introdurre un sistema di riferimento ruotante con velocità angolare rispetto all’asse individuato dalla direzione di , che da ora in poi supporremo sempre parallelo all’asse z del sistema di riferimento fisso; in tale
0
B
1
Principi di NMR rappresentazione si chiamerà il campo magnetico ruotante associato ad un’onda polarizzata circolarmente e con velocità angolare
1 B 1 ω parallela a B0. Z
Figura 1.1: Sistema fisso (x y z) e sistema ruotante (x’ y’ z’ ) solidale con il campo magnetico di un’onda elettromagnetica di velocità angolare polarizzata circolarmente nel piano x y.
1 B
1 ω
Nel sistema di assi ruotante l’espressione della magnetizzazione è la seguente:
M = Mx'i’ + My'j’ + Mz'k’ (1.9)
Andando a derivare ad entrambi i membri della (1.9) e tenendo conto che per i versori
i’, j’, z’ si ha: t ∂ ∂ 'i = ω1Λ i’ , t ∂ ∂ 'j = ω1Λ j’ , t ∂ ∂ 'k = ω1Λ k’ Z’ X X’ 1
B
Y’ Y 0 B 1ω
Principi di NMR otteniamo: rot fisso t t ⎟⎠ ⎞ ⎜ ⎝ ⎛ ∂ ∂ = ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ ∂ ∂M M +ω1Λ M (1.10)
dove i pedici si riferiscono ai 2 sistemi di riferimento, uno fisso (x y z) e l’altro rotante (x ’ y ’ z ’).
Sostituendo l’eq.(1.8), riferita al sistema di riferimento fisso, nella precedente si ottiene:
rot t ⎟⎠ ⎞ ⎜ ⎝ ⎛ ∂ ∂M = γM Λ Beff (1.11) dove Beff = B0+ ω1/ γ + B1.
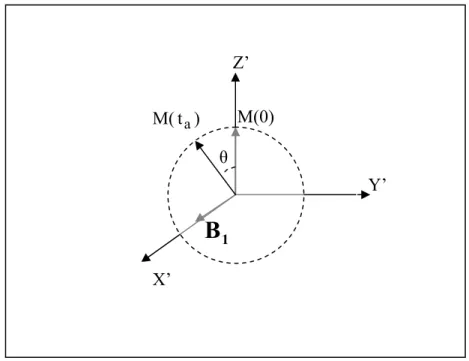
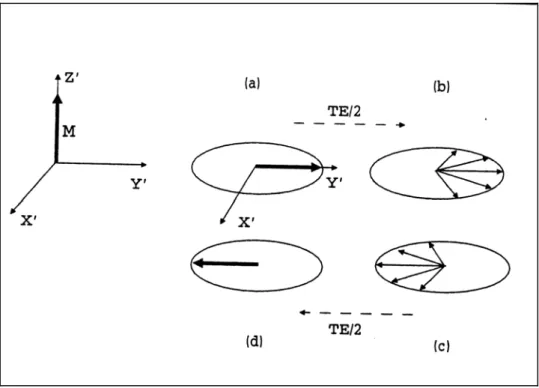
In condizioni di risonanza ( = -γ ) si ha = , cioè la magnetizzazione M precede (nel sistema rotante) in senso orario intorno al campo magnetico con velocità angolare pari a γ . Ciò comporta che anche con un debole campo (nella pratica alcuni ordini di grandezza inferiore a ) è possibile allontanare la magnetizzazione dalla posizione di equilibrio (parallela al campo magnetico ). L’angolo di rotazione della magnetizzazione rispetto alla posizione iniziale è proporzionale all’intensità del campo ed al tempo di applicazione dell’onda elettromagnetica:
1 ω B0 Beff B1 1 B 1 B B1 0 B 0 B 1 B a t θ = γB1 ta (1.12)
Principi di NMR
Z’
Figura 1.2: Applicazione di un campo magnetico in condizioni di risonanza: nel sistema ruotante la magnetizzazione M precede intorno a .
1 B 1 B
1.1.4 Equazione di Bloch
Per ricavare le equazioni del moto della magnetizzazione (§ 1.1.3) si è assunto che i nuclei del sistema interagissero esclusivamente con il campo statico ed il campo oscillante . Tale ipotesi è giustificata soltanto per brevi intervalli di tempo in cui è possibile trascurare le interazioni dei singoli nuclei con il bagno termico e con gli alti nuclei adiacenti. In una situazione reale esistono infatti dei fenomeni di rilassamento, i quali fanno sì che la magnetizzazione, anche dopo una perturbazione, tenda a riassumere la posizione di equilibrio parallela al campo magnetico statico. L’equazione di moto risultante per la magnetizzazione M nel sistema fisso, detta “equazione di Bloch”, è la seguente: 0 B 1 B 0 M
(
)
(
)
1 0 y x T M M T M M t z 2 k j i B M M γ Λ − + − − ∂ ∂ = (1.13) θ M(0) M(t )a Y’B
1 X’Principi di NMR
dove e sono i tempi di rilassamento caratteristici del sistema (che verranno poi analizzati in seguito), B è il campo magnetico globale applicato e i, j, k i versori degli assi x,y,z. Nel sistema di riferimento ruotante l’eq.1.13 è ancora valida se sostituiamo B con
(eq.1.11). 1 T T2 eff B
1.1.5 Tempi di rilassamento
Le interazioni magnetiche interne ad un sistema di nuclei determinano le modalità dei processi di rilassamento: questi ultimi sono stati già considerati nell’equazione di Bloch del paragrafo precedente mediante l’inserimento dei tempi di rilassamento e T1 T2.
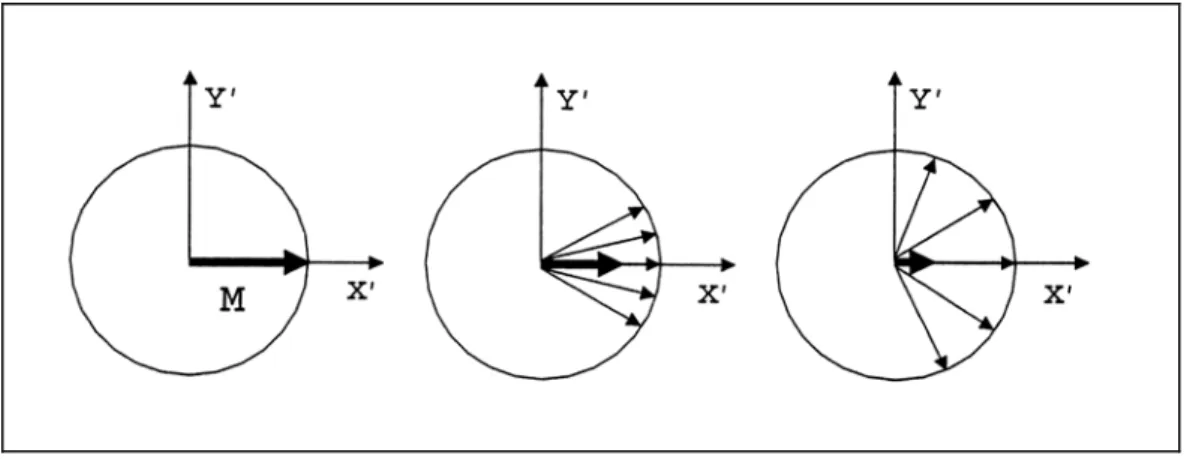
Il tempo , detto “tempo di rilassamento trasversale o spin-spin”, tiene conto delle interazioni tra spin nucleari vicini. A causa di tali interazioni gli spin che hanno una componente della magnetizzazione nel piano xy possiedono frequenze di risonanza leggermente differenti: ciò comporta un progressivo defasamento e quindi un annullamento della componente della magnetizzazione nel piano xy , tanto più veloce quanto maggiore è l’allargamento in frequenza. In un solido è dell’ordine di secondi; in una soluzione si hanno valori più elevati dovuti al moto delle molecole.
2
T
2
T 10-4
Figura 1.3: Defasamento degli spin e rilassamento trasversale della magnetizzazione M nel sistema ruotante.
Principi di NMR
Eventuali disomogeneità presenti nel campo magnetico statico portano ad un maggior defasamento, con conseguente riduzione di . Si introduce allora un “tempo di rilassamento efficace” , minore di , che tiene conto di tale effetto:
2 T ∗ 2 T T2 2 ∆B T 1 T 1 0 2 2 γ + = ∗ (1.14)
dove ∆B0 è la variazione di campo dovuta alle disomogeneità.
Il tempo , detto “tempo di rilassamento longitudinale o spin-reticolo”, rende invece conto degli scambi energetici che avvengono tra il sistema di spin e l’ambiente molecolare cui è associato. Tale interazione comporta una progressiva degenerazione della componente della magnetizzazione lungo l’asse z verso il valore di equilibrio .
1
T
0
M
Per i vari tempi di rilassamento introdotti si ha la seguente relazione: T2*< T2< T1 e in generale risulta T2<< . T1
MRI: principi fisici ed utilizzo
1.2 MRI : principi fisici e tecniche di utilizzo
Dopo la sua prima scoperta ad opera di Bloch e Purcell, l’ NMR fu utilizzata soprattutto per applicazioni chimico-fisiche (spettroscopia) e di fisica allo stato solido. Nel 1972 Lanterbur e Mansfield dimostrarono che la risonanza magnetica poteva essere impiegata anche per realizzare mappe bidimensionali della densità degli spin nucleari di un mezzo. Tale idea fu poi sviluppata da Ernst nel 1975: egli propose di codificare le informazioni spaziali mediante l’utilizzo di gradienti di campo magnetico e di decodificarle tramite la trasformata di Fourier del segnale registrato. Nasceva in questo modo l’NMR applicato all’imaging, cioè l’ MRI (Magnetic Resonance Imaging).
Le tecniche MRI consentono di ottenere immagini ad elevata risoluzione spaziale e con buoni rapporti segnale-rumore: questo grazie all’implementazione di opportune sequenze di segnali ed ai progressi tecnici raggiunti in campo di apparati NMR. Da quanto detto possiamo dedurre come l’ MRI abbia trovato larghissima diffusione e rilevanza in campo biomedico e clinico.
Diversamente da altre tecniche di imaging (come quella a raggi X), l’ MRI non è una tecnica in trasmissione ed il segnale che si registra è prodotto dal rilassamento degli spin nucleari in seguito ad una perturbazione esterna: il contrasto può essere dato dalla densità protonica o dai tempi di rilassamento , , , a seconda della particolare sequenza utilizzata. Le tecniche MRI risultano quindi una metodica di indagine multiparametrica che consente, rispetto alle tecniche tradizionali, studi dettagliati sui tessuti molli. Tutte queste proprietà, unite all’utilizzo di radiazioni non ionizzanti, rendono le tecniche MRI fondamentali per indagini non invasive ed in vivo.
1
T T2 *
2 T
In questo paragrafo saranno spiegati i principi di base di tutte le tecniche MRI e saranno descritte due sequenze base come la Spin-Echo e la Gradient-Echo.
MRI: principi fisici ed utilizzo
1.2.1 Il segnale FID
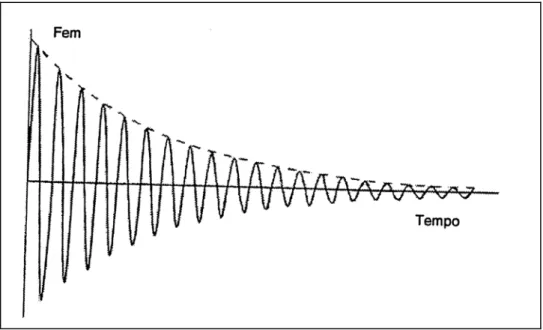
Il metodo utilizzato per ottenere informazioni utili relative ad un sistema di spin nucleari è quello di allontanarlo dalla posizione di equilibrio e di registrare opportuni segnali durante la fase di rilassamento. Per portare il sistema fuori dalla posizione di equilibrio si utilizzano impulsi a radiofrequenza (RF pulse) alla frequenza di risonanza del sistema. In funzione della durata e dell’intensità di tali impulsi la magnetizzazione del sistema può essere totalmente o parzialmente ribaltata nel piano xy (§ 1.1.3). Terminato l’impulso a radiofrequenza la magnetizzazione inizia un processo di rilassamento che tende a riportarla nella posizione di equilibrio, il tutto secondo le equazioni di Bloch (§ 1.1.4). La componente della magnetizzazione nel piano xy, rilassando al valore nullo, precede intorno al campo magnetico statico alla frequenza di risonanza. Tale moto di precessione smorzato genera, per induzione magnetica, una forza elettromotrice indotta in opportune bobine di ricezione. Il segnale registrato da tali bobine è di tipo oscillante smorzato e viene denominato FID (Free Induction Decay). Da adesso in poi con il termine “segnale” si considererà il FID (fig. 1.4) generato per induzione magnetica dal rilassamento della magnetizzazione nel piano xy (detta anche “magnetizzazione trasversale”).
Figura 1.4: Forza elettromotrice indotta (FEM) in una bobina, avente l’asse sul piano x y, dal moto di precessione smorzato della magnetizzazione trasversale (componente sul piano x y).
MRI: principi fisici ed utilizzo
1.2.2 Gradiente di campo magnetico statico
Un gradiente di campo magnetico statico è un campo magnetico addizionale, applicato nella stessa direzione di (coincidente con l’asse z) e la cui ampiezza varia linearmente con la posizione lungo una direzione scelta. Se quest’ultima fosse quella dell’asse x avremmo lungo tale asse un campo magnetico statico globale dato da:
0
B
Bz
( )
x =B0 +xGx (1.15) Otteniamo perciò una discriminazione spaziale lungo la direzione x.I gradienti di campo magnetico sono generati tramite opportune bobine attraversate da corrente e chiamate gradient coils : un apparato per MRI ha tre gradient coils in modo da generare gradienti lungo le tre direzioni x,y,z di un sistema di riferimento fisso, avente l’origine al centro del magnete principale che genera . E’importante ricordare che il campo magnetico globale ha sempre la direzione dell’asse z (quella di ), mentre il gradiente può essere diretto lungo uno dei tre assi, avendo le seguenti espressioni:
0 B 0 B x B G z x ∂ ∂ = ; y B G z y ∂ ∂ = ; z B G z z ∂ ∂ = (1.16)
Tipici valori per i gradienti di campo sono dell’ordine delle unità di mT, circa due ordini di grandezza inferiori rispetto a B0.
1.2.3 Codifica spaziale
In MRI, come in tutte le tecniche NMR, viene perturbato il sistema in esame rispetto alla condizione di equilibrio e, mediante un opportuno ricevitore, viene registrato il segnale
MRI: principi fisici ed utilizzo emesso durante la fase di ritorno all’equilibrio. Il primo problema che si pone è quello di codificare il segnale in modo tale che vi siano contenute tutte le informazioni spaziali necessarie alla ricostruzione di un’immagine.
Il primo passo da compiere a tale scopo è quello di codificare una slice di interesse, ossia una sezione del sistema in esame : tutto questo si realizza mediante l’applicazione di un gradiente di campo magnetico lungo l’asse z, direzione del campo magnetico statico . Operando in tal modo la frequenza di risonanza del sistema di spin nucleari in esame risulta: z G 0 B ωL
(
x,y,z) (
=γ B0 +Gzz)
(1.17) Applicando un’onda elettromagnetica in risonanza è possibile eccitare selettivamente solo gli spin della sezione alla quota desiderata. Lo spessore della sezione eccitata è legato all’intensità del gradiente ed alla larghezza di banda dell’impulso RF mediante la relazione: z G z G z RF γ ω ∆ = ∆ (1.18)Il gradiente viene detto, proprio per la sua funzione spiegata sopra, “slice selection gradient”.
z
G
Il passo successivo è quello di codificare il segnale per caratterizzare i diversi punti all’interno di una stessa sezione: ciò si ottiene mediante due procedure, che vengono dette “codifica di fase” e “codifica in frequenza”. Tali procedimenti si basano, rispettivamente, sull’applicazione di un gradiente di campo magnetico lungo l’asse x e di un gradiente lungo l’asse y.
x
G
y
G
Gli spin di una stessa slice , ribaltati sul piano xy tramite un impulso RF ed il procedimento di slice selection, al termine dell’applicazione di precedono tutti in fase ed alla stessa frequenza di risonanza intorno al campo (fig. 1.5).
z
G
0
MRI: principi fisici ed utilizzo
Figura 1.5: Configurazione degli spin adiacenti di una stessa slice dopo l’applicazione di un opportuno impulso RF e del procedimento di slice selection. Tali spin sono ribaltati sul piano x y e precedono tutti in fase e con la stessa frequenza di risonanza intorno al campo magnetico statico B0.
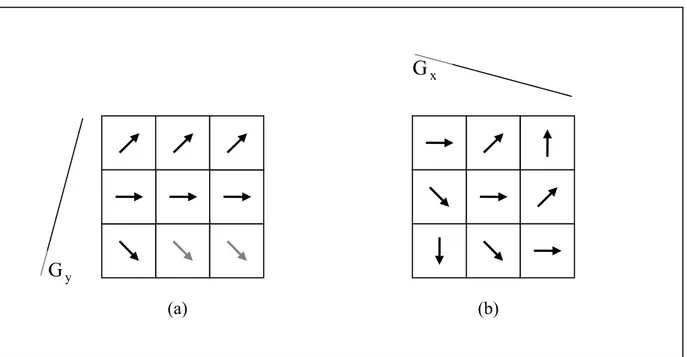
Durante la codifica di fase l’applicazione del gradiente modifica la frequenza di precessione degli spin .Terminata l’applicazione di , gli spin precedono nuovamente con la stessa frequenza ma con una differenza di fase lungo l’asse y (fig. 1.6 a).
y G y G x
G
yG
(a) (b)Figura 1.6: Configurazione degli spin precedenti in seguito alla codifica di fase (a) ed alla codifica in frequenza (b).
MRI: principi fisici ed utilizzo La differenza di fase, accumulata durante l’applicazione di Gy per un tempo TPE, risulta:
∆φ=γGyyTPE (1.19)
La codifica in frequenza si esegue applicando il gradiente durante la fase di registrazione del segnale. Gli spin precedono con diversa frequenza di risonanza e vengono ulteriormente sfasati lungo l’asse x (fig. 1.6 b). La frequenza di risonanza in funzione della posizione lungo tale asse risulta:
x
G
ω
( ) (
x =γ B0+Gxx)
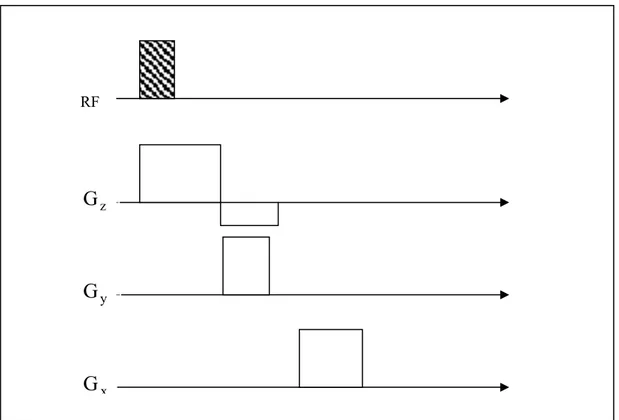
(1.20) In seguito alla codifica di fase ed alla codifica in frequenza il segnale registrato è dato dalla somma dei contributi delle singole magnetizzazioni elementari, ciascuna caratterizzata da una propria fase e da una propria frequenza in funzione della posizione.I passi necessari per eseguire la procedura di codifica spaziale sono riassunti nella seguente figura:
Figura 1.7: Passi successivi per la codifica del segnale FID.
RF z
G
yG
xG
MRI: principi fisici ed utilizzo
Nella pratica tale procedura viene ripetuta più volte con diversi valori del gradiente di codifica di fase: per risolvere tutte le possibili differenze di fase sono necessari più campionamenti del segnale con differenti codifiche di fase. L’analisi in frequenza degli spin viene ripetuta per ogni campionamento del segnale.
1.2.4 Decodifica spaziale: K space
In MRI la decodifica del segnale e la conseguente realizzazione e visualizzazione dell’immagine passano attraverso il formalismo del K space.
Il segnale registrato S è funzione del tempo e delle codifiche in fase ed in frequenza utilizzate:
S=S
(
t,Gx,Gy,TPE)
(1.21)dove TPE è il tempo di applicazione del gradiente di codifica Gy . Introducendo le seguenti grandezze:
kx =γGxt (1.22)
ky =γGyTPE (1.23)
mediante un cambiamento di coordinate otteniamo:
MRI: principi fisici ed utilizzo Il formalismo del K space prevede appunto la rappresentazione dei dati registrati nello spazio delle coppie (kx,ky).
Nella pratica si misura il segnale indotto lungo le due direzioni ortogonali x ed y, mediante due ricevitori posti lungo questi due assi. Si introduce allora la seguente notazione complessa:
So =Sx +iSy (1.25)
dove Sxe Sysono i due segnali registrati lungo le direzioni ortogonali x ed y.
Il K space relativo all’acquisizione di un’immagine è rappresentato da una matrice bidimensionale di numeri complessi nella quale il numero di righe è pari al numero di codifiche fase effettuate, mentre ogni riga contiene i campionamenti di (t) per la rispettiva codifica di fase. Ricordiamo infatti che il segnale non viene acquisito in modo continuo, ma è campionato ad intervalli di tempo
o
S
s
t
∆ , dove 1 ∆ è la banda dei ricevitori ts utilizzati.
Il K space è quindi uno spazio discreto che viene anche detto raw data, in quanto non rappresenta l’immagine ma l’insieme di dati che devono essere elaborati per ottenerla. Sommando tutti i contributi derivanti dalle singole magnetizzazioni elementari si ha:
So ∝
∫∫
ρ( )
x,y exp(
-i(
kxx+kyy)
)
dxdy (1.26) dove ρ rappresenta la densità di probabilità di magnetizzazione.Il K space consiste, perciò, nella rappresentazione dell’immagine nel dominio delle frequenze spaziali: le alte frequenze determinano la risoluzione spaziale, mentre le basse frequenze fanno riferimento all’intensità media dell’immagine. Ogni elemento del K space si riferisce all’immagine nel suo insieme e non ad un singolo punto.
Osservando la relazione (1.26) deduciamo che l’immagine è ottenuta dall’antitrasformata di Fourier del K space:
MRI: principi fisici ed utilizzo
Essendo il K space uno spazio discreto il processo di decodifica del segnale si basa quindi su un algoritmo matematico che prevede l’antitrasformata discreta di Fourier. Dalla relazione (1.26) si nota poi che il K space è la trasformata di Fourier di una funzione reale e quindi possiamo utilizzare la seguente proprietà:
So
( )
−k =S∗o(
k)
(1.28)Basandoci sulla relazione sopra possiamo allora acquisire soltanto metà del K space e ricostruire la parte mancante per simmetria. Tale metodica di acquisizione dei raw data viene detta half-NEX imaging: essa consente di ridurre il tempo di acquisizione, anche se il rapporto segnale-rumore dell’immagine risulta inferiore rispetto al caso in cui il K space venga acquisito per intero.
La relazione (1.26) può essere generalizzata in modo da considerare eventuali effetti prodotti da disomogeneità di varia natura, presenti nei sistemi reali:
So ∝
∫∫
ρ( )
x,y exp(
−i(
kxx+kyy)
)
W(
x,y,T1,T2)
H(
x,y,kx,ky)
dxdy (1.29)dove W
(
x,y,T1,T2)
e H(
x,y,kx,ky)
sono fattori di peso della densità protonica locale, con il primo che dipende dalla metodica di acquisizione dell’immagine dei raw data e dai tempi di rilassamento del sistema, mentre il secondo fa riferimento ad effetti dovuti a fattori esterni che influiscono sull’intensità dell’immagine (rilassamento del sistema con T , 2∗ distorsioni geometriche dovute a variazioni di suscettibilità magnetica, artefatti da movimento). Al variare dei fattori di peso è possibile avere immagini maggiormente pesate in ,T1 T2 o T2∗ .MRI: principi fisici ed utilizzo
1.2.5 Sequenze MRI: introduzione
In MRI con il termine “sequenza” si definisce l’insieme delle procedure che portano alla registrazione dei raw data. Come spiegato nel paragrafo precedente le caratteristiche fondamentali di ogni sequenza sono rappresentate dalle operazioni di slice selection, codifica di fase e codifica in frequenza del segnale: il tutto culmina poi nella conseguente registrazione del segnale stesso.
Le sequenze utilizzate in MRI si differenziano per il modo in cui viene eseguita la codifica del segnale e la registrazione del K space. In genere quest’ultimo viene completato per righe successive, nel senso che vengono acquisiti tutti i dati campionati per ogni rispettiva codifica di fase. La differenza temporale tra due punti consecutivi del K space lungo l’asse di codifica in frequenza (asse x) corrisponde al periodo di campionamento del segnale relativamente alla stessa codifica di fase ed è dell’ordine dei decimi di millisecondo; la differenza temporale tra due punti consecutivi del K space lungo l’asse di codifica in fase (asse y) viene detta TR (Repetition Time) e dipende dalla particolare sequenza, variando tra il decimo di secondo e qualche secondo.
Dalle equazioni (1.22) e (1.23) possiamo dedurre le spaziature e dei punti all’interno del K space:
x k ∆ ∆ky x x x FOV 1 t G k =γ ∆ = ∆ (1.30) y y y FOV 1 t G k =γ∆ y = ∆ (1.31)
dove coincide con il periodo di campionamento del segnale, è il tempo di applicazione del gradiente di codifica,
t
∆ ty
y
G
∆ è l’incremento di intensità di gradiente per ogni codifica. Rimangono da definire due nuove grandezze introdotte nelle formule sopra: il FOV (Field Of View) rappresenta il campo di vista dell’immagine e definisce le dimensioni della sezione geometrica dello spazio che verrà rappresentato sotto forma di immagine. I
MRI: principi fisici ed utilizzo pedici x e y del FOV fanno riferimento alle direzioni dei due assi x e y. In genere ∆t e sono fissati, mentre il FOV viene regolato agendo sui valori di e .
y t
x
G ∆Gy
La risoluzione spaziale dell’immagine, una volta definito il FOV, dipende dal numero dei campionamenti temporali per ogni codifica in frequenza e dal numero di codifiche di fase: x n ny
( )
x max( )
x min x x k k 1 n FOV x − = = ∆ (1.32)( )
( )
min max y y y y k k 1 n FOV y − = = ∆ (1.33)La risoluzione spaziale è dunque definita dopo aver scelto il FOV e la matrice di acquisizione (cioè e ). A questo punto, fissando lo spessore (eq. 1.18) della sezione scelta dell’immagine, risultano definite le dimensioni del voxel, vale a dire l’elemento minimo di volume della slice selezionata che contribuisce alla formazione del segnale.
x
n ny ∆z
1.2.6 Sequenza Spin–Echo
La sequenza Spin-Echo è una delle sequenze fondamentali in MRI: essa permette di ottenere immagini pesate in T1, T2 o densità protonica. La procedura su cui si basa
consiste nel completare una riga del K space per ogni successiva eccitazione del sistema di spin nucleari. I passi relativi ad ogni singola eccitazione e registrazione del segnale avvengono in un singolo TR .
MRI: principi fisici ed utilizzo
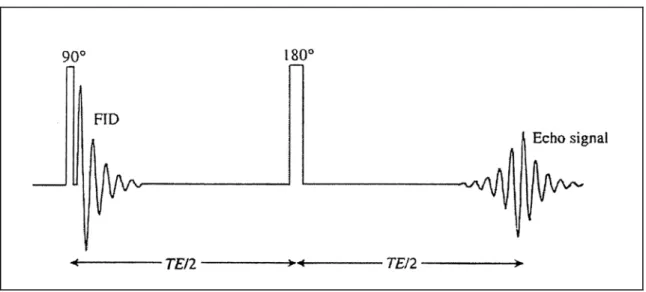
Figura 1.8: Sequenza Spin-Echo: il primo impulso a 90° ribalta completamente la magnetizzazione sul piano x y, mentre il successivo impulso a 180° rifusa gli spin e genera l’eco di segnale.
Un primo impulso a 90° ribalta completamente la magnetizzazione nel piano xy , ortogonale al campo magnetico statico . Si ha, quindi, un FID che decade rapidamente con tempo caratteristico in seguito al progressivo defasamento degli spin nucleari. Dopo un tempo t = TE/2 un impulso a 180° ribalta gli spin rispetto all’asse x’ del sistema ruotante (direzione lungo cui è applicato l’impulso elettromagnetico); in tal modo gli spin rifasano, generando un’eco di segnale al tempo t = TE (Echo Time). Tale eco non risulta affetto da fenomeni di disomogeneità di campo magnetico e la distanza temporale fra l’applicazione degli impulsi di eccitazione e la sua formazione ne consentono una più agevole registrazione. 0 B ∗ 2 T
MRI: principi fisici ed utilizzo
Figura 1.9: Rappresentazione della sequenza Spin-Echo nel sistema ruotante:all’ istante t=TE/2 si ha un rifasamento degli spin che provoca l’eco di segnale.
L’intensità del segnale S risulta dipendere da TR, TE, e secondo la relazione seguente:
1
T T2
S∝M
( )
TE ≅M0xy(
1-exp(
-TR/T1)
) (
exp-TE/T2)
(1.34) dove e sono rispettivamente la magnetizzazione al tempo di eco e quella successiva all’impulso a 90°. Variando opportunamente i parametri TR e TE si possono ottenere immagini pesate in T(
TEM
)
0xy
M
1, T2 o densità protonica. Con piccoli valori di TR e TE si
hanno immagini pesate in (eq. 1.34); a parità di TR, aumentando TE le immagini risultano maggiormente pesate in ; per grandi valori di TR e TE si ottengono, invece, immagini pesate in densità protonica.
1 T
2
T
Le sequenze Spin-Echo devono la loro diffusione alla relativa insensibilità alle disomogeneità di campo magnetico e, soprattutto, alla capacità di evidenziare con un alto contrasto tessuti con piccole differenze di e T1 T2. Esse hanno però gli svantaggi di lunghi
MRI: principi fisici ed utilizzo tempi di scansione (in particolare per immagini pesate in ), e quindi TR molto grandi, con in più un rapporto segnale-rumore non troppo elevato. Quest’ultimo problema si riscontra soprattutto in immagini pesate in , caratterizzate da piccoli TR: se TR è inferiore a è possibile solo un recupero parziale della magnetizzazione longitudinale parallela al campo magnetico statico e ciò comporta che l’intensità del segnale, proporzionale a tale magnetizzazione, decresca al diminuire di TR . Lunghi tempi di acquisizione possono comportare artefatti da movimento e disagi per il paziente.
2 T 1 T 1 T
1.2.7 Sequenza Gradient–Echo
La sequenza Gradient-Echo rappresenta un’evoluzione della sequenza Spin-Echo in
termini di riduzione dei tempi di acquisizione e di utilità clinica. Le caratteristiche di contrasto risultano molto differenti e variabili rispetto alle tradizionali Spin-Echo.
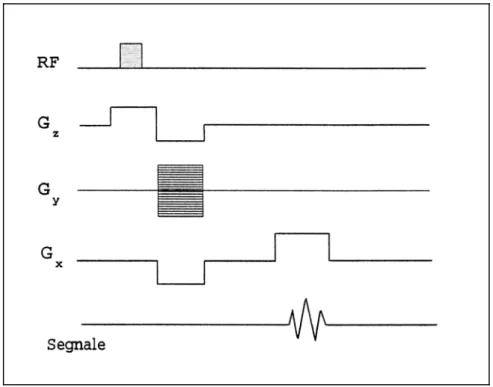
Figura 1.10: Sequenza Gradient-Echo: l’eco di segnale in questo caso è generato da un’inversione del gradiente di codifica in frequenza Gx.
MRI: principi fisici ed utilizzo
Nelle sequenze Gradient-Echo (fig. 1.10) per ottenere l’eco di segnale non si utilizza un impulso a 180°, ma un’inversione del gradiente di codifica in frequenza . L’applicazione di un iniziale gradiente di codifica a polarità invertita provoca, infatti, uno sfasamento degli
spin; questi ultimi, al momento della successiva applicazione del gradiente di codifica in
frequenza a polarità positiva, si ritrovano in fase per la registrazione del segnale (fig. 1.11).
x
G
Figura 1.11: Sequenza Gradient-Echo: gli spin rifasano completamente, dando origine all’eco di segnale, nell’istante di registrazione dei raw data.
Tale metodica di formazione dell’eco di segnale non permette di eliminare gli effetti di eventuali disomogeneità di campo magnetico; questo fatto rende le sequenze
Gradient-Echo più suscettibili ad artefatti rispetto alle Spin-Gradient-Echo. Si possono però ottenere immagini
pesate in T2∗ molto utili in esami clinici per evidenziare particolari forme di patologie.
Le sequenze Gradient-Echo sono ritenute sequenze veloci: infatti l’applicazione di un gradiente a polarità invertita risulta più rapida dell’invio di un segnale a radiofrequenza; inoltre non è necessario attendere il rifasamento degli spin dopo l’impulso a 180° come avviene nelle Spin-Echo. Tutto questo consente di ridurre notevolmente il tempo TR ed il tempo di acquisizione totale dell’immagine. Bassi valori di TR, però, implicano un recupero solo parziale della magnetizzazione longitudinale (§ 1.2.6). Per ovviare a questo problema si opera, all’inizio di ogni TR, un ribaltamento della magnetizzazione longitudinale di un
MRI: principi fisici ed utilizzo angolo (flip angle) minore di 90°: in tal modo parte della magnetizzazione longitudinale rimane sempre disponibile per le successive eccitazioni.
Il contrasto e la pesatura delle immagini realizzate con sequenze Gradient-Echo dipende dai valori di TE, TR, e flip angle utilizzati. Una maggior pesatura in si ottiene con flip
angle elevati (>60°) e TE brevi (<10 ms); utilizzando TE più lunghi e flip angle piccoli
(<20°) la dipendenza dal tempo di rilassamento diminuisce e si ha una maggior pesatura in . Attualmente esistono più di cinquanta varianti di sequenze Gradient-Echo che si suddividono in tre grandi gruppi, a seconda che la genesi del segnale dipenda dalla magnetizzazione longitudinale, da quella trasversale o da entrambe. Scegliendo in modo opportuno i parametri della sequenza si possono avere immagini pesate in T
1 T 1 T ∗ 2 T 1, T2, T e 2∗
densità protonica con un’ampia variazione di contrasto.
I vantaggi della sequenza Gradient-Echo consistono nella riduzione del tempo di acquisizione, nella maggior facilità di utilizzo dei gradienti rispetto ad impulsi a radiofrequenza e nella minore perdita di energia verso il paziente. A tutto questo si deve aggiungere la capacità di visualizzare le strutture vascolari con alto segnale: ciò si basa sul fatto che, per piccoli valori di TR, i tessuti stazionari risultano ipointensi per il mancato recupero della magnetizzazione longitudinale, al contrario dei vasi dove il flusso ematico apporta sangue con magnetizzazione longitudinale completa.
MRI: fast imaging
1.3 MRI: Fast Imaging
Negli ultimi anni sono state impiegate molte risorse nella ricerca di sequenze MRI “veloci”. Si entra perciò nel campo del fast imaging, in cui si cerca di limitare gli artefatti da movimenti fisiologici del paziente (respiro, peristalsi, flusso ematico) grazie ad una sostanziale riduzione dei tempi di acquisizione dell’immagine. In ambito di ricerca e studi funzionali le sequenze di fast imaging rappresentano un metodo primario di indagine, soprattutto per la loro applicazione cliniche riguardanti eventi dinamici (movimenti articolari, enhancement da mezzo di contrasto).
Per una sequenza Spin-Echo o Gradient-Echo il tempo di acquisizione, , di un’immagine risulta:
acq
T
Tacq = TR x NPCF x NEX (1.35)
dove NPCF è il numero dei passi della codifica di fase e NEX il numero di volte per cui l’intera sequenza di acquisizione viene ripetuta (sommando e mediando le immagini relative a differenti acquisizioni di una stessa slice si ottiene un’immagine con un rapporto segnale-rumore proporzionale a NEX ). Per diminuire il tempo totale di acquisizione si può agire su uno o più parametri presenti nella relazione (1.35).
La riduzione di TR è condizionata dal parziale recupero della magnetizzazione longitudinale (§ 1.2.6), che comporta una riduzione del segnale utile e del rapporto segnale-rumore dell’immagine (SNR). Tale problema può essere risolto mediante un opportuno compromesso fra i valori di TR e NEX, oppure operando con alte intensità di campo magnetico (in modo da aumentare il valore della magnetizzazione longitudinale).
Una riduzione di NEX comporta, insieme ad una diminuzione del tempo di acquisizione, una riduzione una riduzione di SNR, come specificato nella tabella seguente:
MRI: fast imaging ⎪ ⎪ ⎪ ⎩ ⎪ ⎪ ⎪ ⎨ ⎧ ∝ ∝ ∆ ∝ ∝ ∝ = BW 1 n 1 n 1 y x y x z FOV FOV NEX SNR , ,
Tabella 1.2: Dipendenza di SNR dal numero di acquisizioni (NEX), dal campo di vista dell’immagine (FOV), dallo spessore della slice (∆z), dalla larghezza di banda (BW) e dal numero di passi della codifica di fase (ny) ed in frequenza (nx).
Una singola acquisizione viene solitamente utilizzata con sistemi ad alto campo magnetico statico ( ); con una sola acquisizione, però, non vengono eliminati gli artefatti da respirazione e da flusso ematico, che richiedono un numero maggiore di acquisizioni.
Tesla 1,5 B0 ≥
Una riduzione di NCPF porta, infine, ad una minore risoluzione spaziale dell’immagine (§ 1.2.5).
Altre due tecniche per la riduzione di sono il fractional NEX ed il variable bandwidth. Nella prima si eseguono soltanto metà dei passi della codifica di fase, determinando i restanti per simmetria coniugata all’interno del K space ( § 1.2.4); essa porta come svantaggi una riduzione di SNR ed una maggior sensibilità ad eventuali artefatti. Nel
variable bandwidth un aumento della larghezza di banda di ricezione del segnale, legata
ad una riduzione del periodo di campionamento, consente di ridurre TE e TR; questo metodo porta, però, come svantaggio un minor filtraggio delle alte frequenze legate al rumore e ciò determina una diminuzione di SNR (tab. 1.2).
acq
T
In tutte le tecniche analizzate si osserva che una riduzione di porta, inevitabilmente, ad diminuzione di SNR o della risoluzione spaziale dell’immagine: è quindi necessario un compromesso fra tempi di acquisizione non troppo lunghi e SNR non troppo bassi.
acq
T
Esistono altre procedure e sequenze di fast imaging che non si basano sull’ottimizzazione dei parametri presenti nella relazione (1.35). Il principio su cui si fondano è quello di agire direttamente sui metodi di acquisizione dei raw data. Sequenze veloci molto utilizzate in tal
MRI: fast imaging senso sono la Fast Spin-Echo (FSE), la Fast Gradient-Echo (FGE) e l’ Echo Planar
Imaging (EPI).
1.3.1 Sequenza Fast Spin-Echo
La sequenza Fast Spin-Echo consente di ottenere immagini con lunghi TR e TE in un tempo fino a sedici volte inferiore rispetto ad una tradizionale Spin-Echo. Il principio basilare su cui si fonda la sequenza FSE è quello di riempire più righe del K space all’interno di un singolo TR (fig. 1.12).
Figura 1.12: Sequenza Fast Spin Echo.
In ogni TR si utilizzano ripetuti impulsi a 180° in modo da generare vari eco, ognuno sottoposto separatamente a differente codifica di fase e responsabile del riempimento di
MRI: fast imaging una riga del K space. Il numero di eco (in genere variabile tra 4 e 16) utilizzati in un singolo TR viene definito ETL (Echo Train Lenght), mentre ES (Echo Spacing) indica l’intervallo temporale tra due eco successivi. Il tempo di acquisizione di una singola immagine risulta:
ETL NEX x NPCF x TR Tacq= (1.36)
Il contrasto dell’immagine dipende dai valori di ETL, ES e TR . Grazie al continuo rifasamento degli spin operato dagli impulsi a 180°, la sequenza FSE risulta poco sensibile ad effetti dovuti a variazioni di suscettibilità magnetica.
1.3.2 Sequenza Fast Gradient-Echo
Le sequenze Fast Echo hanno caratteristiche di immagine simili alle
Gradient-Echo tradizionali: la differenza sostanziale è rappresentata da una maggiore velocità di
acquisizione, ottenuta grazie ad una rilevante diminuzione di TR e di TE. In questo modo è possibile ottenere immagini in meno di un secondo.
1.3.3 Sequenza Echo Planar Imaging
Le sequenze Echo Planar Imaging (EPI) costituiscono le sequenze più veloci disponibili in MRI, grazie alle quali possiamo ottenere immagini in tempi inferiori a 100 ms. Tali sequenze permettono di avere contrasti simili alle sequenze Spin-Echo e Gradient-Echo con una notevole diminuzione dei tempi di acquisizione.
Inizialmente applicate solo in studi di ricerca, le tecniche EPI sono state poi gradualmente inserite in campo clinico. Attualmente trovano il loro maggior impiego in ambito di imaging addominale, cardiaco, muscolo-scheletrico in 3D e angiografico con mezzo di contrasto. A livello di studio di ricerca, data la minima presenza di artefatti da movimento e l’alta
MRI: fast imaging risoluzione temporale, l’EPI risulta indispensabile per studi neuro-funzionali, sia di diffusione che di perfusione in vivo. Gli svantaggi delle tecniche EPI sono rappresentati da eventuali fenomeni di blurring (immagine mossa e sfuocata), artefatti da suscettibilità magnetica, distorsioni dell’immagine ed un minor valore di SNR rispetto alle altre sequenze di acquisizione finora considerate.
La caratteristica fondamentale della tecnica EPI è data dalla possibilità di poter completare il K space di un’immagine in pochi periodi TR (in modalità snapshot imaging, ad esempio, i raw data necessari alla formazione dell’immagine vengono acquisiti in un unico TR). Per ogni periodo TR, infatti, viene applicato un gradiente di codifica in frequenza rapidamente oscillante tra polarità positiva e negativa: ciò consente di ottenere la formazione di più eco, ognuno sottoposto a differente gradiente di codifica di fase (fig. 1.13).
MRI: fast imaging Naturalmente per ottenere gradienti come quelli richiesti nelle sequenze EPI sono necessari stringenti requisiti tecnici e di hardware: questo spiega il motivo per cui esse hanno trovato pieno sviluppo soltanto negli ultimi 10 anni e sui tomografi di ultima generazione.
Il rilassamento della magnetizzazione trasversale, con tempo caratteristico , genera una rapida riduzione del segnale negli echi successivi: questo fatto provoca fenomeni di
blurring dell’immagine, che si evidenziano principalmente lungo la direzione di codifica di
fase. Tale problema impone l’utilizzo di gradienti di codifica in frequenza rapidamente oscillanti, in modo da campionare i segnali degli echi prima di una loro rilevante attenuazione. Esprimendo in Hz la point spread function (PSF) legata agli effetti di blurring si ha: * 2 T * 2 T 1 PSF≅ (1.37)
mentre le dimensioni dei voxel nella direzione di codifica di fase (∆y) risultano:
ω ≅ ∆ T 1 y (1.38)
dove coincide con il tempo di applicazione globale del gradiente di codifica in frequenza (fig. 1.14).
ω
T
Figura 1.14: Sequenza EPI: coincide con il tempo totale di applicazione del gradiente di codifica in frequenza, mentre ESP rappresenta l’intervallo temporale tra il centro di un lobo del gradiente ed il successivo.
ω
T
x
MRI: fast imaging
La condizione di assenza di blurring si traduce in:
Tω <T2* (1.39)
Dalla relazione sopra si deduce che, in situazioni di interesse pratico, è necessario operare con valori di echo spacing molto bassi, inferiori a 500-700 µs.
La risoluzione spaziale dell’immagine è funzione della massima ampiezza dei gradienti applicati ( , ) e soprattutto del relativo slew rate, che rappresenta il rapporto fra l’ampiezza massima del gradiente ed il tempo di salita. Nella figura seguente è riportato l’andamento della risoluzione spaziale in funzione dell’ampiezza del gradiente di lettura per differenti valori di slew rate.
x
G Gy
Figura 1.15: Risoluzione spaziale in funzione dell’ampiezza massima del gradiente di lettura: l’andamento delle varie curve dipende dal valore dello slew rate del gradiente, mentre il valore di ESP è fissato e d uguale a 700 µs.
MRI: fast imaging
Notiamo che, a parità di gradiente applicato, la risoluzione spaziale aumenta al crescere dello slew rate; per bassi slew rate, invece, la risoluzione spaziale è praticamente indipendente dall’intensità del gradiente. Questo accade in quanto la risoluzione spaziale è proporzionale all’area individuata da ciascun lobo del gradiente di lettura (gradiente di codifica in frequenza), ma per bassi slew rate, dovendo verificarsi la condizione (1.39), il gradiente non ha il tempo sufficiente per raggiungere l’ampiezza massima o mantenerla prima dell’inversione.
Intensi gradienti di campo magnetico, rapidamente oscillanti, sono ottenuti mediante potenti amplificatori e bobine altamente efficienti e di bassa induttanza. Valori bassi di ESP impongono poi l’utilizzo di ricevitori con una notevole ampiezza di banda ( 100 KHz). ≅ La sequenza EPI è più suscettibile di artefatti rispetto ad altre sequenze: eventuali disomogeneità di campo magnetico statico, differenze di suscettibilità magnetica o variazioni di campo dovute ad eventuali correnti indotte possono portare problemi in tal senso. Tali artefatti si manifestano soprattutto come distorsioni dell’immagine o shift di alcune strutture lungo l’asse di codifica di fase (lo shift fa riferimento alla presenza nell’immagine di strutture che risultano traslate rispetto alla loro posizione effettiva). Per superare alcune di queste difficoltà si utilizzano magneti superconduttori, che assicurano un’elevata uniformità di campo magnetico e permettono di aumentare l’ SNR, che viene diminuito dalla necessità di operare con bassi ESP. Le correnti indotte vengono, inoltre, limitate riducendo geometricamente possibili concatenamenti di linee di flusso fra il magnete e le bobine schermando passivamente e/o attivamente queste ultime.