1 Introduzione
1.1 La memoria di riconoscimento
visivo
1.1.a Apprendimento e memoria: strutture coinvolte
L’apprendimento è il fattore principale che sta alla base del comportamento umano. Esso consiste nell’acquisizione e nell’utilizzo, da parte di un individuo, di conoscenze relative al mondo circostante, in modo da modificare il suo comportamento in maniera adattativa. Tutto questo è possibile grazie alla memoria, che è la facoltà di recepire e custodire queste conoscenze. Nonostante la genetica svolga un ruolo importante nel determinare certe predisposizioni cognitive che influiscono sul comportamento, è attraverso l’apprendimento però che si è diffusa la quasi totalità di quegli aspetti comportamentali, che hanno dato origine alle diverse culture nelle popolazioni umane. Apprendimento e memoria sono fenomeni chiave che sottostanno a tutte quelle capacità cognitive che ci definiscono come esseri umani. In questo contesto, le ricerche su memoria e apprendimento hanno un’importanza fondamentale sia per la comprensione dei comportamenti normali sia per la comprensione delle basi di quelle patologie in cui l’apprendiemnto e memoria viene a mancare come ad esempio la malattia di Alzheimer.
La memoria è un fenomeno che comprende stadi successivi. Gli studi effettuati in pazienti amnesici o sugli animali hanno permesso di formulare un modello riguardante alcune delle sue modalità di funzionamento. L’informazione afferente è trasformata in una traccia mnemonica custodita temporaneamente sottoforma di memoria a breve termine. In queste
condizioni questa traccia può persistere per poco tempo. L’informazione appresa tuttavia può essere consolidata in una traccia più persistente di memoria a lungo termine. Il modello si completa con un sistema deputato a ricercare le tracce e ad esprimerne l’informazione, quando una di queste si renda necessaria per compiti specifici.
Ma quali sono le componenti cerebrali coinvolte in questi processi?
Una cosa è evidente: le tracce di memoria relative ai diversi tipi di apprendimento non sono localizzate in un’unica struttura. Osservando che le lesioni corticali alterano l’apprendimento, in passato si riteneva che tutti i suoi processi erano legati solo alla corteccia. Poi è stato visto che gli animali sono capaci di imparare alcuni compiti anche se completamente decorticarti e che alcune forme semplici di apprendimento in certi riflessi si verificano anche dopo che il midollo spinale sia stato isolato chirurgicamente dalla massa cerebrale. Quindi molte, forse tutte le regioni del sistema nervoso, hanno le proprietà plastiche per custodire tracce di memoria. Se queste sono immagazzinate solo da neuroni particolari, questi sono probabilmente diffusi in tutto il sistema nervoso.
Nonostante ciò, l’apprendimento di alcuni compiti viene profondamente influenzato da lesioni a zone circoscritte. Anche se tutto il sistema nervoso possiede elementi capaci di attuare le forme più semplici di apprendimento, quando si passa a schemi di elaborazione più complessi, certe prerogative cominciano ad essere caratteristiche di strutture specializzate. Le prime informazioni sul ruolo di specifiche aree cerebrali in determinate forme di apprendimento e memoria sono state ottenute osservando i deficit di individui che riportavano una lesione localizzata o a cui era stata rimossa chirurgicamente una zona perché unico rimedio contro l’epilessia. Le prove più chiare provengono dagli studi sul cervelletto e sul lobo medio-temporale. Le zone coinvolte del lobo medio-temporale sono l’ippocampo e la corteccia rinale (corteccia entorinale e peririnale). Le persone che avevano subito un danno in corrispondenza di quella parte del lobo, erano impossibilitate a formare nuove tracce di memoria che rimanessero a lungo termine (amnesia anterograda). Potevano ricordare avvenimenti avvenuti molto tempo prima del danno subito, ma le memorie più recenti risultavano perse (amnesia retrograda con gradiente temporale). Inoltre, ogni nuova situazione percepita poteva essere memorizzata solo per pochi minuti. Le prime conclusioni affrettate degli osservatori sostenevano che tutte le forme di consolidamento richiedessero il coinvolgimento del lobo temporale. Successivamente, analisi più accurate portarono a risultati inaspettati. Gli individui che avevano subito una lesione al lobo temporale,
nonostante non fossero in grado di immagazzinare nuovi ricordi, erano capaci di apprendere informazioni che riguardavano compiti motori. Attraverso successive sedute di allenamento, riuscivano ad imparare e perfezionare sequenze motorie stereotipate, senza saper dire quando e come le avessero apprese. Là dove riuscivano gli individui lesionati al lobo temporale, fallivano invece quelli lesionati al cervelletto. Questi ultimi, d’altra parte, non avevano mai mostrato particolari difficoltà nel formare nuovi ricordi. Alla luce di queste evidenze è stato necessario introdurre un nuovo tipo di classificazione nei processi mnemonici, constatando che il sistema nervoso si serva di due sistemi di elaborazione, uno legato alla memoria esplicita e l’altro a quella implicita.
La memoria implicita, anche definita come memoria non dichiarativa, comprende tutte quelle forme di apprendimento che non necessitano di gradi elevati di consapevolezza e che sottostanno a tutti quei compiti che ormai siamo capaci di fare automaticamente. Tra questi abbiamo, per esempio le abilità procedurali e abitudinarie, che sono costituite da sequenze motorie stereotipate ed organizzate dal corpo striato. La memoria esplicita, chiamata anche dichiarativa, consente ad un individuo di immagazzinare e di recuperare consapevolmente tracce di memoria, che riguardano le informazioni sensoriali e le loro categorizzazioni. E’ la memoria esplicita che ci permette di pensare ad un determinato evento precedentemente vissuto, di associare suoni a visioni, di elaborare simboli e di costruire elementi di pensiero più complessi a partire da quelli più semplici. La memoria esplicita può essere distinta in memoria episodica e memoria semantica. La prima si occupa dell’immagazzinamento di tracce mnemoniche che riguardano luoghi e momenti specifici e che ricostruiscono il vissuto di singoli episodi; la seconda invece, servendosi di varie forme di categorizzazione, associa elementi appartenenti a diversi contesti episodici, per fornire alla mente le sue proprietà descrittive ed argomentative e per permetterle di concepire concetti astratti e simbolici. Se ogni minima forma di memoria semantica sia o meno esclusiva dell’uomo, e come si sia evoluta in rapporto al linguaggio articolato, sono tematiche su cui ci sono ancora aspre diatribe, ed occorrono ancora non poche evidenze sperimentali sulle strutture cerebrali coinvolte, per cominciare a fare luce sulla questione. Per ora il dato di fatto interessante è che lesioni del lobo medio-temporale e delle strutture diencefaliche, portano deficit sia alla componente semantica sia a quella episodica della memoria esplicita, ma non della memoria implicita. Gli stessi deficit, come abbiamo detto, causano anche la perdita di quelle formate pochi anni prima della lesione; senza però coinvolgere le tracce già
consolidate da più tempo. Ciò suggerisce quindi, che le zone lesionate non costituiscano la sede definitiva di custodia delle tracce di memoria a lungo termine, ma che siano zone coinvolte nei meccanismi di deposito e di permanenza temporanea. E’ presumibile quindi che le tracce mnemoniche siano gestite da strutture cerebrali differenti nei diversi processi di elaborazione che si svolgono durante l’apprendimento.
1.1.b Il riconoscimento come fenomeno di memoria episodica
Uno dei processi più caratteristici delle forme di apprendimento legate alla memoria esplicita è senza dubbio il riconoscimento visivo.
Il canale visivo fornisce una gamma di stimoli ad altissimo contenuto informativo, che lasciano amplia possibilità di formulare associazioni e di costruire tracce mnemoniche da immagazzinare attraverso i meccanismi di memoria esplicita. Tuttavia, perché questi processi abbiano un significato adattativo, è di fondamentale importanza che si sia evoluto un modello di elaborazione puntualmente capace di riconoscere nei nuovi stimoli, quelle stesse informazioni che precedentemente erano già state trattate e immagazzinate come tracce episodiche. Detto in altri termini, la memoria di riconoscimento visivo rappresenta indubbiamente uno degli aspetti principali della nostra capacità di ricordare. Siamo tutti abituati ad aver a che fare con questo tipo di memoria attraverso due tipi di esperienze diverse; una in cui percepiamo soltanto di aver già visto l’oggetto che abbiamo davanti, ed una in cui riusciamo a ricollegarci al ricordo di episodi specifici che lo riguardano.
Sono stati teorizzati due modelli per spiegare questi fenomeni: un modello considera le due esperienze come risultati quantitativamente differenti di un unico meccanismo, attraverso il quale si avrebbe come unico processo, il tentativo di collegare ciò che vediamo con qualcosa di già presente nel nostro bagaglio episodico. Secondo questo modello, l’esperienza di familiarità nei confronti di qualcosa che non si riesce a ritrovare in un contesto vissuto, si verificherebbe quando le strutture del lobo temporale si trovano a dover risalire a delle tracce mnemoniche che sono consolidate solo debolmente. Di conseguenza,
esso non riuscirebbe a ripresentare un’informazione completa sulla traccia episodica, ma solo un’informazione quantitativamente ridotta, che si manifesta come semplice familiarità. Secondo l’altro modello invece, il riconoscimento consisterebbe in due processi distinti qualitativamente e organizzati in due fasi distinte anche nel tempo: inizialmente, ci sarebbe un meccanismo che permette di identificare l’oggetto come elemento già familiare o meno e di questo compito se ne occuperebbe la corteccia peririnale. Nel caso di familiarità, successivamente, un altro meccanismo consentirebbe di risalire attraverso l’ippocampo a specifiche informazioni di tipo associativo, immagazzinate nelle esperienze precedenti. Questo modello propende verso l’ipotesi secondo la quale i processi di elaborazione delle tracce mnemoniche sarebbero svolti in successione da strutture differentemente specializzate. Per farsi un’idea più chiara sulla validità di questo modello, è necessario conoscere più a fondo cosa è stato osservato sperimentalmente sulla corteccia peririnale.
1.1.c L’importanza della corteccia peririnale
Tra le funzioni del lobo temporale, il ruolo della corteccia peririnale nella memoria di riconoscimento visivo, è stato una rivelazione di recente scoperta. Da tempo si sa che il lobo temporale è coinvolto nei processi di memoria episodica a lungo termine, ma il coinvolgimento delle singole componenti si sta cominciando a chiarire solo in questi ultimi anni. Nel 1957 Scoville e Minler studiarono l’amnesia di un paziente epilettico, a cui erano stati rimossi bilateralmente tessuti che comprendevano ippocampo, l’amigdala e parte della corteccia circostante. Di questo disturbo ho già parlato prima: è quello che ha permesso di collegare per la prima volta, l’attività del lobo temporale alla memoria esplicita a lungo termine. Il paziente riusciva a formare nuovi ricordi solo per pochi minuti e questo deficit coinvolgeva anche il riconoscimento visivo. Vedendolo come la componente principalmente menomata, Scoville e Minler attribuirono all’ippocampo tutti i processi riguardanti la memoria episodica. Nel 1978, Mishkin fece un esperimento con scimmie a cui aveva rimosso gli stessi tessuti cerebrali asportati vent’anni prima al paziente epilettico.
Queste scimmie furono sottoposte ad un test che valutava le loro capacità di riconoscimento quando uno stimolo visivo veniva ripetuto. I deficit osservati, erano concordi con quelli visti vent’anni prima da Scoville e Minler sull’uomo. Tuttavia Mishkin fece di più: provò a rimuovere gli stessi tessuti lasciando però intatto l’ippocampo. Nei test di riconoscimento, questi animali ottennero risultati migliori, rispetto a quelli che avevano subito una rimozione più ampia. Mishkin concluse che l’ippocampo era la componente principalmente coinvolta nel riconoscimento visivo, concordando con quanto suggerito precedentemente da Scoville e Minler.
Poi negli anni 90, la svolta: diversi ricercatori, tra cui lo stesso Mishkin, videro, sempre nelle scimmie, che tra le rimozioni delle componenti del lobo temporale, quella della corteccia peririnale dava il maggior impedimento nei test di riconoscimento visivo. Inoltre, una rimozione selettiva dell’ippocampo, che lasciava intatta la peririnale, non comportava nessun deficit negli stessi test.
L’errore fatto da Mishkin nel ’78, era stato quello di rimuovere l’ippocampo danneggiando anche tutta la corteccia rinale adiacente, falsando così le sue osservazioni.
Questa rivelazione ha spronato Mishkin e molti altri ricercatori che lavorano sul riconoscimento visivo, a focalizzare l’attenzione sulla corteccia rinale.
In questi ultimi anni le ricerche in questione, si sono orientate anche verso l’uso del ratto come modello sperimentale. Questo ha comportato degli svantaggi: il ratto è
filogeneticamente più distante dall’uomo, rispetto alla scimmia e tra i canali sensoriali del ratto quello visivo non è certamente il più sviluppato. Tuttavia, il ratto ha il grande
vantaggio di essere un animale che può essere mantenuto con costi relativamente bassi, di raggiungere l’età adulta in pochi mesi ed ha anche il vantaggio di essere una specie con strategia tendenzialmente R e quindi con prole numerosa. Tutti vantaggi che permettono la possibilità di fare più osservazioni, avere campioni sperimentali più numerosi e utilizzare più protocolli differenti.
Negli studi effettuati sulla memoria di riconoscimento visivo, il test comportamentale più usato coi ratti è l’Object Recognition Test (ORT). Questo test sfrutta la tendenza spontanea esplorativa degli animali di oggetti non familiari. Il test ha diverse varianti, ma
sostanzialmente consiste in una fase di familiarizzazione iniziale, in cui l’animale esplora due oggetti uguali e in una successiva fase di riconoscimento, in cui uno degli oggetti precedenti è sostituito con uno nuovo. La capacità di riconoscimento dell’animale, sarà
tanto più elevata quanto più è lungo il tempo di esplorazione dell’oggetto nuovo, rispetto al tempo di esplorazione dell’oggetto vecchio.
Gli esperimenti effettuati con l’ORT hanno più volte confermato che il riconoscimento visivo di un oggetto basato sulla familiarità, è impedito da lesioni che riguardano la corteccia rinale. Nella corteccia rinale, l’area che in particolare è stata sempre vista
coinvolta in questi deficit, è la corteccia peririnale. E’ stato riscontrato infatti, che anche se viene lesionata specificatamente la peririnale, i ratti presentano gli stessi deficit nel
riconoscere l’oggetto familiare nell’ORT. (A. Ennaceur et al. 1996, 1997 ; E.A. Murray e M. Mishkin, 1998 ; M. Meunier et al., 1993). Kesner, inoltre, ha dimostrato che questi disturbi non si presentano se le lesioni riguardano la corteccia entorinale (Kesner et al., 2001).
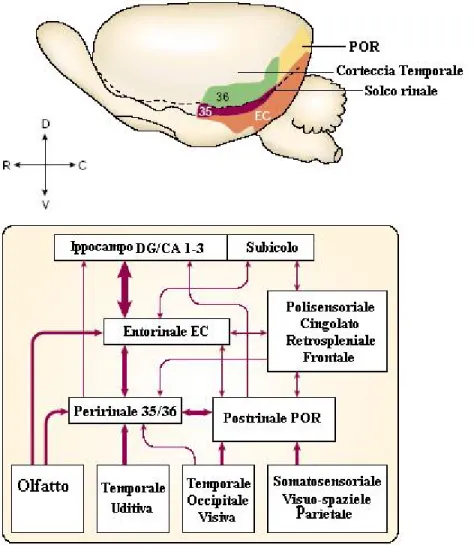
La corteccia peririnale costituisce l’area 35 e 36 di Brodmann.
Nelle scimmie si estende su entrambi i lati del solco rinale, per tutta la sua lunghezza. Nei roditori costituisce le zone laterali della sola parte caudale del solco.
Riceve informazioni da molte aree associative della corteccia, sia da quella visiva, olfattiva, uditiva e somatosensoriale, sia da aree di associazione polimodale come la corteccia
entorinale e la corteccia prefrontale. Le sue fibre efferenti raggiungono tutte queste zone associative, con proiezioni più consistenti verso la corteccia entorinale mentre altre fibre raggiungono l’ippocampo.
Tornando ai due modelli di elaborazione del riconoscimento visivo introdotti nel paragrafo precedente, quanto detto finora, tuttavia, non è sufficiente per propendere verso il modello che vede la corteccia peririnale svolgere il suo ruolo di familiarizzazione senza il
coinvolgimento dell’ippocampo. Bisogna volgere l’attenzione anche verso altri studi che hanno costatato che l’informazione spaziale di uno stimolo e quella riguardante la sua familiarità, sono esaminate in maniera dissociata rispettivamente dall’ippocampo e dalla corteccia peririnale. Bussey e collaboratori, per esempio, hanno osservato che ippocampo e corteccia peririnale, possono addirittura agire in maniera indipendente. Hanno dimostrato che lesioni applicate alla corteccia peririnale, non influiscono nella memoria spaziale mentre lesioni applicate all’ippocampo, non influiscono sulla memoria di riconoscimento degli oggetti. (Winters et al., 2004 ; Bussey et al., 1999 ; Ennaceur et al. 1996 ; Aggleton et
al. 1997 ; Ennaceur e Aggleton, 1997). L’ippocampo infatti, è coinvolto in fenomeni di
riconoscimento visivo solo se per tale riconoscimento l’animale deve anche memorizzare delle nozioni spaziali (Bussey e Aggleton, 2002). Questo non significa che ippocampo e corteccia peririnale siano del tutto indipendenti, ma solo che le connessioni presenti tra le due strutture, entrino in gioco dopo che è avvenuta un’analisi preliminare e separata, dell’informazione afferente, da parte delle due. E’ plausibile che successivamente, le due elaborazioni siano intergate per formare una contestualizzazione.
Registrazioni elettrofisiologiche effettuate dalla corteccia peririnale di scimmie sottoposte a test di memoria di riconoscimento visivo, hanno rivelato che alcuni neuroni diminuiscono la loro risposta quando viene riproposto uno stimolo visivo già presentato precedentemente (Brown et al., 1987 ; Xiang e Brown, 1998).
Questa riduzione porta anche informazioni su quanto recentemente e quanto spesso lo stimolo è stato riproposto e si presenta anche quando più stimoli devono essere appresi
simultaneamente. Le stesse registrazioni effettuate dall’ippocampo invece, hanno riportato riduzioni molto meno frequenti, con latenza più lunga e che non permangono per 24 ore. Nella peririnale e nella corteccia associativa adiacente, la riduzione delle risposte a stimoli riproposti è spontanea e si manifesta senza un addestramento particolare e senza che l’animale debba usare necessariamente l’informazione per fini comportamentali.
Queste risposte, hanno una latenza rispetto allo stimolo così breve, che lascia escludere che l’attività della peririnale dipenda da stimoli che provengono dall’ippocampo. I cambiamenti delle loro proprietà, non possono neanche essere riflessi passivi di alterazioni che si sono verificate nelle zone raggiunte precedentemente dal segnale visivo, dal momento che queste non persistono per più di pochi secondi. Sono state individuate tre proprietà nelle variazioni di risposta, che fanno pensare a tre tipologie diverse di neuroni coinvolti. Alcune cellule presentano una risposta ridotta, solo se uno stimolo è ripetuto entro pochi minuti, in questo modo definiscono solo quanto la ripetizione sia recente rispetto al primo stimolo. Altri neuroni riducono la loro risposta, solo se lo stimolo è già stato presentato varie volte nei giorni passati. Questi infatti, non danno risposte differenti ad uno stimolo ripetuto in breve tempo, ma si specializzano a segnalarne la familiarità. Poi ci sono cellule che indicano che uno stimolo è stato visto per la prima volta, o che almeno non è stato visto per alcune settimane; in questo caso la risposta è molto più debole quando lo stimolo è subito ripetuto e permane per un tempo minore quando questo diventa familiare.
Recenti osservazioni hanno cercato di capire in particolare quale ruolo avesse la corteccia peririnale all’interno del processo di acquisizione, consolidamento e recupero della traccia mnemonica, nella memoria di riconoscimento visivo. In questi esperimenti ad alcuni ratti sottoposti all’ORT, è stata iniettata un farmaco (lidocaina), bilateralmente nella corteccia peririnale, in modo da bloccarne il funzionamento. Se la lidocaina era iniettata in modo da far effetto solo durante la fase di familiarizzazione, o solo durante la fase di
riconoscimento, gli animali non riuscivano a distinguere l’oggetto nuovo da quello
familiare. Da questi risultati sembra che la corteccia peririnale abbia un ruolo attivo sia nei processi di acquisizione che in quelli di recupero della traccia. Per osservare gli effetti della peririnale sul consolidamento, la lidocaina è stata iniettata nel periodo compreso tra le due fasi e il test di riconoscimento è stato effettuato quando l’effetto del farmaco era concluso. Si è osservato che i ratti avevano dei deficit nell’ORT, se il blocco dell’attività elettrica della peririnale cominciava 20 minuti dopo la familiarizzazione ma non se cominciava più
di 40 minuti dopo (Winters e Bussey, 2005). I risultati che riguardano il periodo frapposto tra le due fasi quindi, suggeriscono che la peririnale si occupi anche del consolidamento. Il fatto che da 40 minuti in poi la lidocaina non procuri deficit, potrebbe voler dire che
nonostante la corteccia peririnale abbia un ruolo attivo durante il consolidamento, la traccia di memoria potrebbe essere velocemente trasferita in un’altra struttura e qui mantenuta. La peririnale in questo caso sarebbe richiamata in causa solo successivamente per il recupero. I risultati di tutti questi lavori, dimostrano che il modello che sembra avere più riscontro a livello sperimentale, è quello che vede il riconoscimento visivo come un fenomeno in cui ippocampo e corteccia peririnale possono avere alcuni ruoli ben distinti e dissociati. Ciò nel complesso porta a ritenere molto probabile che il lobo temporale sia una struttura formata da diverse componenti, che si possono occupare in maniera dissociata di diversi aspetti della memoria.
1.2 Plasticità sinaptica nella corteccia
peririnale
1.2.a Plasticità sinaptica e memoria: le prime evidenze
Abbiamo visto che la corteccia peririnale è una tappa necessaria per i segnali visivi, perché questi siano utilizzati dal cervello per elaborare i fenomeni di riconoscimento. Ciò lascia intendere che questa struttura, dopo aver ricevuto uno stimolo, abbia la capacità di riorganizzare le sue funzioni in modo da modificare le sue risposte, quando lo stesso stimolo si ripresenterà. In altre parole, i suoi neuroni hanno la capacità di formare tracce di memoria.
In che modo vengono immagazzinate queste tracce? E in cosa differiscono, nei loro meccanismi cellulari, i processi a breve e a lungo termine?
La risposta a questi quesiti rappresenta il passo successivo dello studio di un fenomeno cognitivo, di cui sono stati individuati soltanto i principali centri di elaborazione. Un meccanismo ipotizzato per la codificazione della memoria a breve termine, è la conservazione delle tracce mnemoniche sotto forma di attività nervosa persistente mantenuta da connessioni eccitatorie a feed-back fra i neuroni. Questa attività può divenire riverberante in un circuito neuronale chiuso, per un certo periodo di tempo. Nonostante questo modello sia plausibile, gli studi sulla memoria cellulare, compresa quella a lungo termine, rivelano che nella maggior parte dei casi, apprendimento e memoria modifichino la dinamicità e la struttura delle cellule nervose e delle loro connessioni. Per quel che riguarda la corteccia peririnale, abbiamo già visto che i neuroni rispondono alla ripresentazione di uno stimolo, determinando una riduzione della loro risposta postsinaptica. Questo suggerisce che anche qui, ci siano in gioco meccanismi di alterazione dell’efficacia sinaptica, meglio definiti come plasticità sinaptica.
I primi grossi passi avanti sullo studio della plasticità sinaptica, sono stati fatti solo in tempi relativamente recenti, dagli studi pionieristici di Erik Kandel. Egli è riuscito ad associare per la prima volta alcuni semplici fenomeni di apprendimento a determinate modificazioni nelle componenti cellulari del sistema nervoso. Precedentemente Alden Spencer e Richard Thompson, avevano studiato l’abitudine sui motoneuroni spinali del gatto coinvolti nel riflesso di flessione. Spencer e Thompson avevano già osservato come la conservazione a breve termine di tracce di memoria dipenda da modificazioni di efficacia della trasmissione sinaptica. A causa della complessità degli interneuroni nel midollo spinale, essi però non erano riusciti ad esaminare i fenomeni cellulari legati all’apprendimento. Kandel invece focalizzò i suoi studi sull’Aplysia californica, un organismo più semplice con un numero minore di cellule nervose.
Prese in esame l’abitudine e la sensibilizzazione nel riflesso di retrazione della branchia e del sifone. Un leggero stimolo tattile al sifone ne comporta una retrazione. In seguito, la ripetizione dello stesso stimolo non provoca più la risposta motoria. Kandel osservò come dopo il primo stimolo, i neuroni sensitivi facessero scaturire un consistente potenziale postsinaptico negli interneuroni e nei motoneuroni e come dopo successive ripetizioni questo potenziale diventasse progressivamente minore. Ciò era dovuto ad una riduzione nel rilascio di neurotrasmettitore da parte dei neuroni sensitivi, probabilmente dovuta all’inattivazione di canali calcio di tipo N. Kandel non riuscì ad esaminare il fenomeno più a fondo e tuttora non si sa ancora bene come avvenga la riduzione del rilascio di neurotrasmettitori; tuttavia risultati più soddisfacenti vennero dallo studio sulla sensitizzazione. In seguito ad un unico stimolo nocivo, indirizzato alla testa o alla coda, numerose sinapsi coinvolte nello stimolo di retrazione del sifone o delle branchie appaiono modificate. Lo stimolo sensibilizzante attiva un gruppo di interneuroni facilitanti che contraggono sinapsi asso-assoniche con le terminazioni dei neuroni sensitivi. Questo stimolo esalta la liberazione di neurotrasmettitore provocando un aumento dei livelli di AMPc. Molti di questi interneuroni facilitanti sono serotoninergici. La serotonina interagisce con recettori che attivano una proteina capace di legare il GTP; questa a sua volta attiva l’adenil-ciclasi che produce AMPc. Questo attiva una protein-chinasi AMPc-dipendente, che è responsabile di almeno tre fenomeni a breve termine. In primo luogo, fosforila una proteina, sensibile alla serotonina, che fa parte del canale K+. La fosforilazione di questo canale riduce una delle componenti della corrente ionica
responsabili della ripolarizzazione del potenziale d’azione prolungandone la durata. Ciò permette ad un canale Ca2+ di tipo N di rimanere attivo più a lungo e di esaltare la liberazione di neurotrasmettitore. In secondo luogo serotonina ed AMPc favoriscono la mobilitazione del neurotrasmettitore in modo indipendente dal calcio. In terzo luogo modificano un canale Ca2+ di tipo L che determina un ingresso di calcio che aumenta la quantità di vescicole disponibili. Nei fenomeni a lungo termine, la proteina AMPc-dipendente agisce sul nucleo determinando la fosforilazione di fattori proteici coinvolti nell’espressione genica. I prodotti codificati da questi geni, sono coinvolti nei fenomeni di plasticità a lungo termine riguardanti la persistenza dell’attivazione della protein-chinasi AMPc-dipendente e la formazione di nuove connessioni sinaptiche. Prima di questo studio le conclusioni sull’osservazione dell’immagazzinamento di tracce di memoria, si limitavano a costatare la presenza di sinapsi di tipo facilitatorio o inibitorio. Dopo il lavoro di Kandel, per la prima volta, un fenomeno di apprendimento era stato tradotto in determinati processi molecolari intraneuronali. Ricerche successive fatte da Daniel Alkon hanno confermato che la modulazione dei canali K+ sia un fattore critico nei processi di apprendimento anche nell’Hermissenda.
Il passo successivo consisteva ora nell’analizzare i processi intracellulari responsabili di fenomeni di apprendimento più complessi come il condizionamento classico. Nel condizionamento classico uno stimolo condizionato, debole ed inizialmente inefficace, diventa efficace nel provocare una risposta comportamentale dopo essere stato accoppiato ad uno stimolo forte ed efficace. In questo tipo di apprendimento le informazioni sulle proprietà di un singolo stimolo non sono sufficienti; c’è la necessità di associare le proprietà di almeno due stimoli, tenendo conto dell’ordine con cui si presentano e della loro distanza temporale. Nell’Aplysia la specificità temporale dell’accoppiamento degli stimoli dipende dalla convergenza dello stimolo condizionato e di quello incondizionato sui singoli neuroni sensitivi. Gli interneuroni facilitanti, che sono attivati dallo stimolo incondizionato, determinano una facilitazione presinaptica maggiore nei neuroni sensitivi, solo quando attivano questi ultimi immediatamente dopo che lo stimolo condizionato li abbia attivati, determinando una scarica di potenziali d’azione. Perciò la facilitazione viene amplificata se lo stimolo condizionato determina l’insorgenza di potenziali d’azione nei neuroni sensitivi subito prima dell’arrivo dello stimolo incondizionato. Questa forma di facilitazione
attività-dipendente non si verifica nel caso in cui lo stimolo condizionato segua quello incondizionato.
Quali sono le componenti cellulari legate a questo fenomeno attività-dipendente?
Tom Abrams ha osservato che i potenziali d’azione determinano l’ingresso di Ca2+ nei neuroni sensitivi. Si ritiene che questo calcio amplifichi l’attivazione dell’adenil-ciclasi da parte della serotonina e di altri neurotrasmettitori ad azione modulatoria agendo tramite calmodulina. Il coinvolgimento di questo sistema legato all’AMPc è stato riscontrato anche in studi fatti sulla Drosophila.
A questo punto sorge spontanea una domanda.
Che genere di meccanismi e componenti cellulari sono coinvolti nei fenomeni di memoria e apprendimento osservabili nei vertebrati, ed in particolare nei mammiferi?
Le prime osservazioni a riguardo, derivano da esperimenti di elettrofisiologia in vitro, fatti su fettine di ippocampo di ratto. L’ippocampo è la prima struttura individuata nel processo di immagazzinamento delle tracce di memoria dichiarativa ed ha tre vie eccitatorie principali. La via perforante decorre dal subiculum alle cellule dell’ilo e del giro dentato, da cui parte la via delle fibre muscoidi che raggiunge le cellule piramidali del campo CA3. Queste attraverso la via delle fibre collaterali di Schaeffer eccitano le cellule piramidali del campo CA1.
Timothy Bliss e Terye Lomo hanno dimostrato che l’applicazione di una breve scarica di stimoli ad alta frequenza ad una qualunque di queste vie afferenti, determina un aumento dell’ampiezza dei potenziali postsinaptici eccitatori nei neuroni bersaglio nell’ippocampo. Questo potenziamento può durare alcune ore e nell’animale intatto giorni e settimane. Questo fenomeno venne chiamato LTP (potenziamento a lungo termine). Studi successivi hanno dimostrato che l’LTP non è identico in tutte le sinapsi. Mentre nel campo CA1 l’LTP è strettamente dipendente dall’attivazione dei recettori glutammatergici ionotropici NMDA, quanto visto finora nel campo CA3 suggerisce che il fenomeno sia NMDA indipendente. Infatti, mentre nel campo CA3 l’LTP non ha caratteristiche associative, nel campo CA1, i recettori NMDA sono coinvolti in un meccanismo di induzione del potenziamento, che richiede l’attivazione contemporanea di più di una fibra. In questa zona, quando al livello della stessa regione dendritica di una cellula piramidale, arrivano contemporaneamente afferenze eccitatorie deboli e forti, quelle deboli vengono potenziate. Oltre all’alta frequenza, per l’LTP nel campo CA1, sono necessarie le caratteristiche cooperative e
associative di stimoli indirizzati su sinapsi specifiche. In questa regione dell’ippocampo l’induzione dell’LTP è di natura postsinaptica. Necessita di una ripetuta depolarizzazione del terminale postsinaptico contemporanea all’attività del neurone presinaptico. Ma perché è così indispensabile l’eccitamento contemporaneo delle cellule pre e postsinaptiche?
Gli assoni che provengono dal campo CA3 raggiungono le cellule piramidali del campo CA1 e usano come neurotrasmettitore il glutammato. In condizioni normali la trasmissione sinaptica è determinata dai recettori non-NMDA. I recettori NMDA per essere attivati hanno bisogno di una depolarizzazione della membrana che li sblocchi dal Mg2+. Generalmente vi sono più componenti presinaptiche convergenti sulla stessa cellula post sinaptica. Il livello di depolarizzazione che sblocca gli NMDA può essere raggiunto con la somma del contributo di terminazioni presinaptiche attive in contemporanea. In questo caso il glutammato attiva anche i recettori NMDA che oltre all’Na+ fanno entrare anche Ca2+. Gli NMDA si trovano concentrati in corrispondenza delle spine dendritiche, che sono zone specializzate per la recezione di segnali eccitatori. Questi compartimenti cellulari hanno una struttura ed una disposizione tale da permettere che l’afflusso di calcio rimanga confinato localmente in modo da influenzare solo le sinapsi attivate.
L’afflusso di calcio attiva due protein-chinasi Ca2+-dipendenti: la chinasi Ca2+/calmodulina-dipendente e la protein-chinasi C. L’induzione dell’LTP si avrebbe quindi attraverso vie di trasduzione di secondi messaggeri a livello postsinaptico. Secondo studi recenti, una delle conseguenze principali dell’attivazione di queste vie di trasduzione è un incremento del numero e/o dell’attività dei recettori glutammatergici AMPA. Inoltre è stato osservato che le stimolazioni che fanno insorgere l’LTP comportano anche un rimodellamento delle spine dendritiche e dei filopodi. Le modificazioni citoscheletriche che ne stanno alla base potrebbero essere legate alla comparsa dei nuovi recettori.
IL potenziamento che permane a lungo nel tempo, può anche essere determinato dall’aumento a livello presinaptico del rilascio di neurotrasmettitore. E’ stato visto, infatti, che l’induzione dell’LTP a singole cellule può coinvolgere successivamente intere popolazioni di neuroni. Non è quindi un fenomeno legato solo alla cellula che è stata depolarizzata, come invece ci si dovrebbe attendere se fosse un meccanismo esclusivamente postsinaptico. Se ne deduce che nel caso in cui l’induzione sia legata ad un fenomeno postsinaptico ed il mantenimento ad un coinvolgimento presinaptico, ci debba essere un’informazione retrograda che dall’elemento postsinaptico raggiunge quello
presinaptico. Si pensa che attraverso il Ca2+ si liberi un messaggero di plasticità retrograda. Questo fattore raggiungerebbe l’interno delle terminazioni presinaptiche coinvolte nell’attività, attivando uno o più secondi messaggeri che porterebbero ad un incremento del rilascio di neurotrasmettitore, mantenendo così il potenziamento nel tempo. Ci troviamo di fronte ad un fenomeno di plasticità attività-dipendente che differisce da quello visto precedentemente in Aplysia. In quel caso era stato visto che la facilitazione presinaptica è determinata attraverso interneuroni facilitanti. Nei neuroni del campo CA1 dell’ippocampo, invece, è l’elemento postsinaptico che fa da componente facilitante. Questo meccanismo potrebbe avere un vantaggio consistente. Il messaggero retrogrado potrebbe permettere un’amplificazione del segnale facilitante attivando anche terminazioni presinaptiche di altre fibre poste in parallelo.
L’osservazione dell’LTP, dall’ippocampo, si è rapidamente spostata anche verso altre strutture encefaliche, coinvolte nella memoria e nell’apprendimento. La cosa interessante, è che le forme di induzione dell’LTP viste nell’ippocampo, sono state ritrovate anche nelle strutture corticali. In più, sembra che le diverse proprietà del fenomeno, non siano solo legate al tessuto cerebrale preso in esame. Le sue proprietà dipendono anche dalle fibre afferenti stimolate e dalle locazioni di registrazione scelte, entro il tessuto stesso, proprio come era già stato visto nell’ippocampo. Sempre attraverso esperimenti eseguiti in vitro su tessuti prelevati dal ratto, l’LTP è stato studiato, per esempio, nella corteccia visiva ed anche qui, si presenta una situazione che suggerisce la compresenza di diverse forme di induzione del fenomeno al livello cellulare. Stimolando dalla sostanza bianca, sono state eseguite registrazioni extracellulari da differenti locazioni; negli strati II e III l’insorgenza del potenziamento dipende dagli NMDA e non sembra essere legata ai recettori glutammatergici metabotropici, nello strato VI la situazione si presenta invertita e nello strato V sia gli NMDA che i metabotropici, contribuiscono significativamente all’induzione (Wang e Daw, 2003). Nella corteccia entorinale, stimolando le fibre che provengono dall’ippocampo e registrando dagli strati V e VI si ottiene un LTP strettamente dipendente dagli NMDA (Solger et al., 2004), mentre stimolando e registrando dallo strato III il potenziamento risulta essere legato anche ai recettori non-NMDA (Yun et al., 2000). C’è da dire, tuttavia, che prima di osservare il ruolo dei diversi tipi di recettori, verrebbe inevitabilmente da chiedersi un’altra cosa.
Perché una stimolazione tetanica riesce ad indurre l’LTP? Cosa provoca esattamente, attraverso i recettori, una stimolazione ad alta frequenza, perché essi diano il via a tutto il processo?
La questione è ancora poco chiara. Tutto sembra dipendere dall’afflusso di calcio.
La situazione inoltre, è stata ulteriormente complicata dalla scoperta che una stimolazione a frequenza più bassa, intorno a pochi Hz, provoca un effetto a lungo termine completamente opposto. Questo fenomeno è noto come LTD (depressione a lungo termine) e consiste appunto in una riduzione della risposta postsinaptica, che persiste nel tempo.
Ciononostante, è stato visto che perchè una stimolazione a bassa frequenza provochi l’LTD, l’afflusso di Ca2+ nella terminazione post sinaptica, deve essere abbastanza ridotto, rispetto a quello richiesto per indurre l’LTP con l’alta frequenza. E’ plausibile, quindi, che le due modalità di stimolazione, comportino livelli di depolarizzazione differenti della membrana della terminazione postsinaptica e che questi livelli di depolarizzazione si traducano in un diverso flusso di Ca2+ nel citosol. Diverse concentrazioni di calcio
porterebbero in questo caso a diverse vie di trasduzione intracellulare. Anche l’LTD è stato osservato in diverse strutture cerebrali e con diverse proprietà di induzione a seconda delle locazioni di registrazione e stimolazione. Nell’ippocampo, l’LTD registrato dai neuroni del campo CA3 risulta essere NMDA-dipendente (K.A. Kosub, V.H. Do e B.E. Derrick 2005). E’ NMDA-dipendente anche quello che si osserva nella corteccia visiva, stimolando dalla sostanza bianca e registrando extracellularmente dallo strato III (A. Kirkwood and M.F. Bear, 1994) o stimolando dagli strati IV e V e registrando, sempre extracellularmente, dallo strato II o III (N. B. Sawtell, K.M. Huber, J. C. Roder e M. F. Bear 1999).
Tuttavia, proprio in corteccia visiva, diverse registrazioni omosinaptiche, hanno messo in evidenza anche un coinvolgimento dei recettori metabotropici (N. Kato 1993). Anche nella corteccia entorinale ci sono delle divergenze: stimolando le fibre afferenti provenienti dall’ippocampo, se si registra extracellularmente dagli strati II e III, si nota un LTD NMDA-dipendente, ma se si registra dagli strati V e VI, il depotenziamento è legato all’attività di canali Ca2+ voltaggio-dipendenti (J. Solger, C. Wozny, D. Manahan-Vaughan e J. Behr, 2004).
Nonostante ci sia ancora molto da chiarire, sui processi intracellulari responsabili dei fenomeni di plasticità sinaptica, le osservazioni riscontrate finora sull’LTP e l’LTD, lasciano pensare che l’attività funzionale generale delle strutture encefaliche, coinvolte in
memoria e apprendimento, dipenda da conformazioni di reti neurali, in cui, componenti che hanno ruoli differenti, probabilmente presentano anche meccanismi intracellulari differenti di plasticità.
E’ importante, innanzitutto, verificare che questi processi di memoria cellulare, siano strettamente correlati coi fenomeni cognitivi di memoria e apprendimento, osservati nei test comportamentali. Esperimenti effettuati da Richard Morris hanno dimostrato che molto probabilmente l’LTP dell’ippocampo è coinvolto nell’immagazzinamento della memoria spaziale nel ratto. Ha elaborato un compito mnemonico spaziale, in cui l’animale deve nuotare in una vasca riempita di liquido opaco e trovare una piattaforma situata sotto il pelo del liquido. L’animale viene messo in un punto a caso della vasca e deve trovare la piattaforma usando riferimenti spaziali presenti nella stanza. Se si somministra un bloccante dei recettori NMDA dell’ippocampo, il ratto non riesce a ritrovare la piattaforma sommersa, mentre non ha difficoltà se essa viene sollevata dall’acqua. Ciò dimostra che il blocco dei recettori NMDA non si ripercuote sulle sue capacità visive o motorie, ma elimina la possibilità di immagazzinare tracce di memoria spaziale. Visto il coinvolgimento dei recettori NMDA è molto probabile che l’LTP sia compreso tra i meccanismi responsabili di queste capacità mnemoniche.
1. 2.b LTP ed LTD nella corteccia peririnale
Partendo dall’Aplysia di Kandel, per arrivare all’ippocampo nei roditori, abbiamo visto a partire da quali meccanismi cellulari si sviluppino i fenomeni di memoria e apprendimento. Abbiamo anche visto come, nella corteccia peririnale, le informazioni che riguardano la familiarità di uno stimolo visivo, siano codificate, molto probabilmente, attraverso una variazione dell’intensità della risposta post sinaptica. La velocità di risposta di questi neuroni e la persistenza della variazione nel tempo, forniscono, alla peririnale, i requisiti adatti per costituire un efficiente sistema che elabori un riconoscimento degli stimoli visivi. A questo punto, considerando che è più che plausibile ritenere che questo sistema si basi su delle modificazioni dell’efficacia sinaptica, possiamo cominciare ad osservare se meccanismi cellulari analoghi a quelli trattati finora, siano stati visti anche nella corteccia peririnale.
Nella corteccia cerebrale, la quasi totalità delle sinapsi eccitatorie sono glutammatergiche, quindi come punto di partenza è stato ipotizzato che l’LTD e l’LTP potessero dipendere da una modulazione dei recettori per il glutammato. Diversi esperimenti di registrazione di potenziali di campo, con stimolazione degli strati II e III e registrazione dallo strato I, hanno dimostrato che anche qui, l’attivazione di questi recettori induce la comparsa dell’LTP o dell’LTD, a seconda del protocollo di stimolazione. Si riscontra un LTP del 25%, provocando una stimolazione ad alta frequenza con ritmo theta (quattro treni, uno ogni 15 secondi, ogni treno comprende dieci scariche di quattro stimoli a 100 Hz. Ciascuna delle dieci scariche è somministrata ogni 200 msec, il ritmo theta). Questo potenziamento, non si verifica durante l’applicazione dell’AP5 (antagonista dei recettori NMDA) e non risente dell’applicazione dell’MCPG (antagonista dei recettori metabotropici del gruppo I e II) (Z. Ziakopoulos, C.W. Tillett, M.W. Brown e Z.I. Bashir 1999). Questa dipendenza dai recettori NMDA, e la non influenza dei metabotropici, concorda con quanto visto in altre strutture cerebrali.
Abbiamo visto che l’LTP può anche avere proprietà associative, ed effettivamente sono stati eseguiti esperimenti per verificare se anche nella corteccia peririnale l’LTP avesse queste caratteristiche. Un esempio sono quelli di Bilkey. Bilkey ha effettuato registrazioni extracellulari dagli stati II e III, mentre due elettrodi stimolavano lateralmente. La LTP è
stata indotta con il ritmo theta come descritto precedentemente o con una stimolazione più debole, che si differenziava dalla prima per aver un solo treno anziché quattro. Per valutare l’associatività, il protocollo prevedeva inizialmente una stimolazione tetanica debole, da parte di un solo elettrodo, successivamente una stimolazione tetanica normale da parte dell’altro elettrodo e infine le due stimolazioni, debole e forte, in contemporanea, usando entrambi gli elettrodi. La scarica debole non ha portato potenziamenti, mentre quella normale ha determinato lo sviluppo di un LTP solo nel caso in cui la stimolazione tetanica sia stata prodotta sul lato entorinale. Nonostante ciò, le due stimolazioni tetaniche in simultanea, sono sempre riuscite a suscitare un fenomeno di potenziamento (D.K. Bilkey, 1996). Ne viene fuori che, così come nel campo CA1 dell’ippocampo, anche nella corteccia peririnale, l’LTP ha una forma NMDA dipendente, legata a specifiche vie di stimolazione e caratterizzata da proprietà associative.
Veniamo ora all’LTD. L’LTD è stato studiato di più nella corteccia peririnale, rispetto all’LTP, dopo che numerosi esperimenti di registrazione in vivo, hanno verificato, sia nei ratti che nelle scimmie, che i neuroni della peririnale rispondono ad uno stimolo familiare con una riduzione della risposta post sinaptica che permane nel tempo. Nella corteccia peririnale, in seguito ad una stimolazione a bassa frequenza (1 Hz per una durata di 900 stimoli) è stato riscontrato un LTD del 10% con una registrazione intracellulare. Per comprendere meglio il coinvolgimento dei recettori glutammatergici sono stati usati degli antagonisti selettivi. L’applicazione dell’AP5 ha comportato una riduzione del depotenziamento, mentre l’MCPG non ha avuto influenza sul fenomeno (Z. Ziakopoulos, C.W. Tillett, M.W. Brown e Z.I. Bashir 1999). Ciò suggerisce che l’LTD elettricamente indotta, nella corteccia peririnale, sia determinato da due componenti, una dipendente dai recettori NMDA ed una non dipendente e quanto visto dall’applicazione con l’MCPG tenderebbe ad escludere che i recettori metabotropici abbiano un ruolo nell’induzione dell’LTD nella corteccia peririnale. Tuttavia, è stato anche visto che gli mGluRI (recettori metabotropici per il glutammato del gruppo I, accoppiati all’idrolisi dell’inositolo fosfolipide) e gli mGluRII (recettori metabotropici per il glutammato del gruppo II, accoppiati all’AMPc) hanno un coinvolgimento sinergico con gli NMDA nell’induzione elettrica dell’LTD ( 1 Hz 200 stimoli), in particolari situazioni di depolarizzazione della membrana (K. Cho, N. Kemp, J. Noel, J.P. Aggleton, M.W. Brown e Z.I. Bashir 2000). Nei neuroni in cui il potenziale di membrana è bloccato a -70 mV, l’afflusso di calcio attraverso
gli NMDA è minimizzato, a causa del blocco di questi recettori determinato dall’Mg2+. L’attivazione degli mGluRII, infatti, determina la defosforilazione e la conseguente attivazione dei recettori mGluRI che fanno incrementare la concentrazione di calcio, probabilmente provocandone un rilascio dai compartimenti intracellulari. In queste condizioni, l’afflusso di Ca2+ mGluRI-dipendente, è necessario per l’induzione dell’LTD. Infatti, se gli mGluRII vengono bloccati con antagonisti specifici, il flusso di Ca2+ è ridotto e l’LTD non si verifica. Quando però il potenziale di membrana è bloccato a -40 mV, viene meno il blocco del magnesio e l’afflusso di calcio dagli NMDA risulta incrementato; in questo caso il blocco degli mGluRII non preclude l’LTD, poiché il Ca2+ che entra attraverso gli NMDA è sufficiente.
E’ difficile supporre che ruolo abbia questa dipendenza del fenomeno dalle oscillazioni del potenziale di membrana, specie quando questa è stata studiata in vitro e le due condizioni sono state provocate artificialmente. E’ comunque importante notare che nella maggior parte degli studi fatti in diverse strutture cerebrali, l’LTD indotto elettricamente dipende o esclusivamente dai recettori NMDA, o esclusivamente dai recettori glutammatergici metabotropici. Sono rare le altre situazioni in cui il fenomeno è legato ad una sinergia tra i due tipi; ciò può significare che questo meccanismo riguardi solo regioni particolarmente specializzate del sistema nervoso. Ci sono ulteriori coinvolgimenti dei recettori metabotropici nel fenomeno: l’applicazione di agonisti specifici per gli mGluRI e per gli mGluRII, determina l’insorgenza dell’LTD, anche senza che ci sia un’induzione elettrica (B. McCaffery, K. Cho, Z.A. Bortolotto, J.P. Aggleton, M.W. Brown, F. Conquett, G.L. Collingridge e Z.I. Bashir 1999). Questi recettori però, in condizioni normali, non hanno un ligando che li distingue dagli altri recettori per il glutammato, come nelle condizioni farmacologiche dell’esperimento descritto. Ne deriva un quadro altamente complesso, in cui il coinvolgimento dei recettori glutammatergici nei fenomeni di LTD, potrebbe essere strettamente condizionato dalla loro disposizione sulla membrana post sinaptica, in relazione con la diffusione e la quantità di glutammato, rilasciato nello spazio intersinaptico, che dipende invece dai diversi pattern di attività stimolatoria, che raggiungono la terminazione presinaptica.
Oltre a quella determinata da una stimolazione a bassa frequenza o dai recettori
glutammatergici metabotropici, i neuroni della corteccia peririnale sono sensibili ad un altro tipo di induzione dell’LTD. L’attivazione dei recettori colinergici provoca una depressione
della risposta sinaptica che permane nel tempo. Questa forma di LTD può essere indotta sperimentalmente attraverso l’uso di agonisti muscarinici ed il suo studio è particolarmente interessante, in quanto i neuroni eccitatori della corteccia peririnale ricevono una
stimolazione da parte delle fibre colinergiche; è stato più volte dimostrato, che la loro modulazione, svolge un ruolo cruciale nei fenomeni di riconoscimento visivo. La scopolamina, infatti, un antagonista a largo spettro dei recettori colinergici muscarinici, preclude il riconoscimento visivo nei ratti, nelle scimmie ed anche nell’uomo. Ratti a cui è stata somministrata la scopolamina a livello sistemico, prima di una fase di
familiarizzazione di un ORT, non presentano differenze di esplorazione tra l’oggetto nuovo e quello familiare e lo stesso risultato si ottiene anche se la scopolamina viene iniettata localmente nella corteccia peririnale. Se invece, la somministrazione avviene nel periodo che intercorre tra la familiarizzazione e il test di riconoscimento, l’animale esplora prevalentemente l’oggetto nuovo (E.C. Warburton, T. Koder, K. Cho, P.V. Massey, G. Duguit, G.R.I. Barker, J.P. Aggleton, Z.I. Bashir e M.W. Brown 2003). La modulazione colinergica, quindi, sembra avere un ruolo importante nei processi di acquisizione e di primo consolidamento della memoria visiva, piuttosto che su quelli di ulteriore
consolidamento e recupero delle informazioni mnemoniche NON TORNA. Sono state effettuate registrazioni elettrofisiologiche in vitro, sia intracellulari che extracellulari su fettine di ratto. Registrazioni intracellulari svolte su neuroni della peririnale, stimolando lateralmente, hanno dimostrato che la scopolamina blocca l’induzione di LTD ottenuto con stimolazione a bassa frequenza (1 Hz, 200 stimoli) sia bloccando il voltaggio a -70 mV che bloccandolo a -40 mV. Per quanto riguarda l’LTP invece, registrando extracellularmente, è stato visto che l’applicazione dell’antagonista colinergico, non ne preclude né l’induzione, né il mantenimento e ciò suggerisce che l’attività colinergica potrebbe influire
principalmente attraverso fenomeni di depressione a lungo termine (E.C. Warburton, T. Koder, K. Cho, P.V. Massey, G. Duguit, G.R.I. Barker, J.P. Aggleton, Z.I. Bashir e M.W. Brown 2003). Il nesso tra modulazione colinergica e plasticità sinaptica, è stato evidenziato anche attraverso l’uso di un agonista. Nelle registrazioni di field potentials, l’applicazione di un agonista colinergico, il carbacolo, provoca una depressione acuta e dose dipendente, del potenziale post sinaptico, dei neuroni eccitatori della peririnale. Successivamente, quando il carbacolo viene lavato, il potenziale non ritorna al valore base, ma si ferma ad un livello inferiore. Ad una concentrazione di carbacolo di 50 uM si raggiunge il
depotenziamento massimo che è circa del 20%. Questa forma di LTD rimane per un periodo di tempo di almeno un’ora dall’inizio del lavaggio (P.V. Massey, G. Bhabra, K. Cho, M.W. Brown e Z.I. Bashir 2001). Questo tipo di depotenziamento si verifica anche senza stimolazione elettrica o se col carbacolo si applica un bloccante dei recettori NMDA. Il blocco degli NMDA non influenza neanche la depressione acuta iniziale. Ciò dimostra come questo fenomeno sia indotto esclusivamente dal carbacolo e quindi come
l’attivazione dei recettori muscarinici sia sufficiente di per sé, per indurre questa forma di LTD. Un ulteriore conferma, deriva dal fatto che, se si perfonde anche la scopolamina insieme al carbacolo, non si vede né la depressione acuta iniziale, né il depotenziamento a lungo termine. Se si applica invece con la stessa procedura la mecamylammina, (un agonista dei recettori colinergici nicotinici) si nota che la sua presenza, non influenza in maniera significativa gli effetti del carbacolo. La cosa interessante, è che quando insieme al carbacolo si applica la pirenzepina, un antagonista selettivo del recettore colinergico M1, non si osserva l’LTD, ma si verifica comunque la depressione acuta iniziale. Tutto ciò suggerisce che la depressione acuta, sia mediata da recettori muscarinici non-M1, e che quella a lungo termine invece sia mediata dai recettori M1. I recettori M1 sono accoppiati alla fosfolipasi C. Ciò lascia pensare a due possibili conseguenze al livello intracellulare: l’aumento del ricambio di inositolo trifosfato e l’attivazione della protein-chinasi C. Mentre l’applicazione di un inibitore della PKC, non influenza l’LTD carbacolo-dipendente,
l’applicazione dell’acido cyclopiazonico riduce il depotenziamento massimo al 13% circa. L’acido cyclopiazonico, è un composto che esaurisce il calcio presente nei compartimenti intracellulari. Il rilascio di calcio da questi compartimenti, dipende dal turnover dell’IP3, che rientra proprio negli eventi di trasduzione del recettore M1.
Per valutare se la depressione indotta dal carbacolo riguardasse anche fenomeni di sintesi proteica, sono stati fatti esperimenti con un inibitore apposito, l’anisomicyna. Applicando questo inibitore dall’inizio dell’esperimento e mantenendolo fino a 30 minuti oltre l’inizio del lavaggio del carbacolo, si può osservare un depotenziamento massimo che non supera il 10% (P.V. Massey, G. Bhabra, K. Cho, M.W. Brown e Z.I. Bashir 2001). Questa differenza rispetto al controllo, comincia a manifestarsi soltanto dopo 40 minuti circa dall’inizio del lavaggio del carbacolo; questo concorda pienamente col fatto che i prodotti della sintesi proteica, richiedono tempo per essere disponibili e contribuire al fenomeno di
osservato nella corteccia peririnale, non trova una corrispondenza con quanto visto ad esempio in corteccia visiva. Qui il carbacolo, non riesce ad indurre l’LTD senza la
compresenza della stimolazione glutammatergica e neanche senza l’attivazione dei recettori NMDA (A. Kirkwood, C. Rozas, J. Kirkwood, F. Perez e M.F. Bear 1999). In corteccia visiva, probabilmente, l’attività colinergica ha un ruolo più marginale e richiede la
compartecipazione di altri meccanismi, per instaurare un depotenziamento a lungo termine. E’ stata avanzata l’ipotesi che il carbacolo, nella corteccia peririnale, possa determinare l’LTD, attivando recettori muscarinici prima silenti. Gli agonisti muscarinici, infatti, possono far passare i recettori ad una forma costitutivamente attiva (T.A. Spalding, E.S. Burstein, S.C. Henderson, K.R. Ducote e M.R. Brann 1998). L’LTD carbacolo-dipendente, una volta manifestato, può essere eliminato con la scopolamina o con la pirenzepina, anche molto tempo dopo l’inizio del lavaggio del carbacolo. Si può ipotizzare che l’LTD avvenga a causa di una prolungata attività dei recettori M1. Il carbacolo dopo aver attivato gli M1, vi resterebbe legato a lungo, anche dopo il lavaggio. E’ plausibile che uno degli effetti a lungo termine dell’LTD consista nell’attivazione di processi intracellulari che prolungano il legame tra carbacolo e recettori M1, mantenendoli sempre attivi e che solo gli antagonisti metabotropici avrebbero la possibilità di interrompere questo processo. Ci sono ancora pochi dati sperimentali però, sui meccanismi intracellulari coinvolti in questa forma di LTD. Recentemente è stato visto che l’LTD non si verifica con l’applicazione di un
inibitore della tirosin-fosfatasi e ciò suggerisce che uno dei passaggi obbligati sia proprio la defosforilazione della tirosina. Ci sono evidenze sperimentali che confermano che la
trasduzione del segnale dei recettori muscarinici attiva anche la protein-chinasi A, ma questo argomento verrà trattato in maniera più dettagliata in seguito.
Per cercare di inquadrare questo fenomeno anche dal punto di vista anatomico-funzionale, esperimenti condotti sulle scimmie hanno permesso di individuare che le principali
afferenze colinergiche che influenzano la peririnale nei fenomeni di riconoscimento visivo, provengono dal nucleo basale di Meynert (J. Turchi, R.C. Saunders e M. Mishkin, 2005). L’infusione localizzata dell’immunotossina ME20.4-SAP, ha prodotto in questi animali la distruzione delle afferenze colinergiche che raggiungono il solco rinale, per 6 settimane. In questo periodo, le scimmie sono state sottoposte agli stessi test comportamentali a cui erano state sottoposte quelle a cui era stata iniettata la scopolamina ed hanno manifestato gli stessi risultati caratterizzati dagli stessi deficit alla memoria di riconoscimento visivo.
L’infusione di questa immunotossina, oltre a bloccare l’attività colinergica, ha provocato anche la necrosi retrograda delle cellule di origine, localizzate appunto nel nucleo basale di Meynert. Il nucleo basale di Meynert ha ricche proiezioni che raggiungono la corteccia, l’ippocampo, l’amigdala, il bulbo olfattivo, il talamo ed il tronco dell’encefalo. Riceve proiezioni da molti nuclei, tra questi alcuni si trovano nell’ipotalamo, nell’amigdala e nel mesencefalo. Si pensa che il nucleo basale di Meynert abbia un ruolo fondamentale nell’integrazione delle funzioni sottocorticali. Forse ricerche future che allargheranno l’osservazione anche verso questo nucleo, permetteranno di capire se i deficit provocati dal blocco colinergico, che precludono il riconoscimento visivo, siano dovuti ad un’alterazione dei processi di memorizzazione o ad un effetto indiretto sulla memoria, derivante, per esempio, da un disturbo dell’attenzione o dello stato di veglia.
1. 2.c La cascata delle MAPK
Abbiamo visto quindi come gli studi su memoria e apprendimento abbiano fatto grossi passi avanti a livello molecolare basandosi su un approccio riduzionista che usa modelli animali più semplici di quello umano.
Ma come si può costruire un ponte di collegamento sull’enorme distanza tra le capacità cognitive umane ed il coinvolgimento di specifici meccanismi molecolari?
In questi ultimi anni alcuni gruppi di ricerca hanno messo a punto un nuovo approccio. Esso consiste nell’identificare le naturali mutazioni genetiche che comportano ritardo mentale e disturbi nell’apprendimento nell’uomo e nell’usarle come punto di partenza per cominciare a comprendere le basi molecolari delle capacità cognitive umane. Si prendono in considerazione i geni umani legati a questi disturbi e si usano topi transgenici per studiarli. Attraverso topi knock out si realizzano organismi in cui quel determinato gene viene messo fuori uso nel sistema che si vuole studiare. Così si possono individuare molte delle componenti cellulari e molecolari che stanno alla base di un disturbo cognitivo.
Questi studi hanno dimostrato l’importanza di una comune, anche se complessa, cascata di trasduzione cellulare coinvolta nella memoria e nell’apprendimento nell’uomo: la cascata della MAPK.
La cascata delle MAPK (protein chinasi attivata da fattori mitogeni) è studiata già da molto tempo, in quanto ha un ruolo vitale, nella risposta di molti tipi di cellule a fattori di crescita che ne controllano la mitosi e il differenziamento. In risposta a questi fattori, la cascata porta all’attivazione di ERK1 ed ERK2 (chinasi regolate da segnale extracellulare), che sono responsabili di numerosi meccanismi relativi ai processi di proliferazione e differenziamento. Per attivare le ERK, è necessario un incremento dell’attività di Ras, una proteina G. Poiché Ras esercita la sua funzione nella sua forma legante il GTP, la sua attività dipende da due tipologie di fattori regolatori: i RasGEF, cha catalizzano il suo ricambio di GDP con GTP, ed i RasGAP che promuovono l’idrolisi del GTP in GDP. Uno stimolo extracellulare può attivare Ras influenzando il bilancio di questi fattori di ricambio, in favore di quelli che riforniscono Ras del GTP. Ras-GTP determina l’attivazione della proteina chinasi Raf che fosforila e attiva l’enzima MEK (MAPK/ERK chinasi). Il ruolo di MEK è di fosforilare ed attivare ERK1 ed ERK2. I bersagli della fosforilazione delle ERK sono molteplici e includono fattori di trascrizione, canali di membrana, proteine citoscheletriche, enzimi regolatori ed altre chinasi.
L’attenzione dei neurobiologi, si è indirizzata su questa cascata quando è stato visto che le ERK, i loro regolatori e le loro molecole bersaglio, sono espresse anche in neuroni già differenziati definitivamente.
Che funzione ha la cascata delle MAPK, in cellule che non si replicano né si differenziano più?
La questione si è fatta ancora più intrigante, quando è stato visto che le ERK nei neuroni sono attivate in risposta a segnali eccitatori glutammatergici.
Ciò ha suggerito che le MAPK svolgano un ruolo determinante anche in alcuni meccanismi neuronali, e studi più mirati hanno costatato che queste sono coinvolte nei processi cellulari riguardanti la plasticità sinaptica (G.M. Thomas e R.L. Huganir, 2004).
Uno dei primi metodi attraverso il quale è emersa l’evidenza di questo coinvolgimento, è stato l’uso di inibitori specifici come il PD 98059 o l’U0126 (D. T. Dudley, L. Pang, S. J. Decker, A. J. Bridges e A. R. Saltiel, 1995) (D. R. Alessi, A. Cuenda, P. Cohen, D. T. Dudley e A.R. Saltiel, 1995). Queste molecole bloccano la cascata andando ad agire su
MEK, in modo da impedirne l’attivazione da parte di Raf. Le prime applicazioni sono state effettuate sull’ippocampo. E’ stato verificato che la somministrazione del PD 98059 blocca l’insorgenza dell’LTP ( J.D. English e J.D. Sweatt, 1997). Altri esperimenti hanno
dimostrato che la stimolazione ad alta frequenza tipica dell’LTP, determina l’attivazione delle ERK ( J.D. English e J.D. Sweatt, 1996).
Un altro studio importante ha dimostrato la necessità dell’attivazione delle ERK per l’LTP nella corteccia visiva (G. Di Cristo, N. Berardi, L. Cancedda, T. Pizzorusso, E. Putignano, G.M. Ratto e L. Maffei, 2001). Questa forma di plasticità sinaptica sarebbe legata alla ristrutturazione delle connessioni sinaptiche che si osserva nella deprivazione monoculare. Gli inibitori di MEK, hanno dinfatti impedito lo spostamento di dominanza oculare che si verifica quando un occhio viene privato degli stimoli visivi, durante il periodo critico di maggiore plasticità sinaptica. E’ stato messo in evidenza, inoltre, un legame tra l’attività delle ERK e la trasmissione dei recettori AMPA: l’espressione di una forma continuamente attiva di Ras, determina un incremento della risposta di questi recettori e promuove la plasticità sinaptica nell’ippocampo (J.J. Zhu, Y. Qin, M. Zhao, L. Van Aelst, e R. Malinow, 2002). Importante è da notare anche che l’aumento della trasmissione degli AMPA, indotto dalla protein chinasi II Ca2+ calmodulino-dipendente, è represso dal PD98059; ciò lascia dedurre che l’attivazione delle ERK sia richiesta per determinare l’inserzione di nuovi recettori sulla membrana cellulare. Sempre nell’ippocampo, il PD98059 blocca anche l’LTP NMDA-dipendente (C.A. Rongo, 2002) (J. Lisman, H. Schulman e H. Cline, 2002). L’importanza delle MAPK è stata anche vista nelle forme di plasticità sinaptica a lungo termine che comportano modificazioni strutturali oltre che dinamiche. Nell’ippocampo, per verificare il coinvolgimento delle ERK a lungo termine, sono stati osservati fenomeni di LTP per le quattro ore successive alla stimolazione tetanica (K. Rosenblum, M. Futter, K. Voss, M. Erent, P.A. Skehel, P. French, L. Obosi, M.W. Jones e T.V. P. Bliss, 2002). Sono stati fatti esperimenti in vitro su fettine di ippocampo di ratto ed alcune di queste, sono state perfuse col PD98059 quaranta minuti prima dell’induzione dell’LTP. Le fettine a cui era stato applicato l’inibitore, cominciavano a ridurre il potenziamento rispetto al controllo, già venti minuti dopo la stimolazione tetanica. Se invece il PD98059 veniva fatto perfondere due minuti dopo l’induzione tetanica, l’LTP si riduceva soltanto dopo 240 minuti.
Ciò conferma che le ERK siano coinvolte sia nei fenomeni di plasticità dell’LTP che fanno incrementare il potenziale postsinaptico poco dopo l’induzione, sia in quelli più tardivi che
addirittura si rendono evidenti solo quattro ore dopo. L’osservazione di cambiamenti strutturali legati alla plasticità a lungo termine, ha richiesto tecniche di imaging. In seguito a ripetute depolarizzazioni nei neuroni dell’ippocampo si nota la formazione di nuove spine dendridiche e filopodi, oltre che l’attivazione delle ERK (G.-Y. Wu, K. Deisseroth e R.W. Tsien, 2001). Anche se questa attivazione non è direttamente collegata col fenomeno di plasticità, esso si dimostra però indispensabile. La somministrazione di U0126, infatti, impedisce sia l’attivazione delle ERK, sia la crescita di nuove strutture. Uno studio complementare, ha messo in luce un incremento dell’attività delle ERK e del numero di spine dendridiche, successivamente all’attivazione dei recettori NMDA (M. Goldin e M. Segal, 2003). La crescita delle spine è bloccata dagli inibitori di MEK ed è dipendente dalla sintesi proteica. Non si sa ancora quali siano i ruoli specifici delle ERK, sembra comunque che la sua influenza si esplichi rapidamente nelle regioni somatiche, dendridiche e nel nucleo. Le ERK potrebbero fosforilare direttamente le proteine sinaptiche, controllare la traslocazione degli mRNA dei dendriti, e indurre la trascrizione di geni che sono necessari per la rimodellazione strutturale. Certe forme di potenziamento, in effetti, sono compromesse se la traslocazione delle ERK nel nucleo non avviene. (S. L. Patterson, et al. 2001). La traslocazione di ERK2 nel nucleo è stata inizialmente documentata nelle cellule non neuronali (S. Traverse, N. Gomez, H. Paterson, C. Marshall e P. Cohen, 1992) (P. Lenormand, et al. 1993), osservando che i bersagli di ERK2 sono principalmente fattori di trascrizione. E’ stato verificato inoltre che essa, non solo avviene anche nei neuroni, ma probabilmente le proteine nucleari sulle quali esplica la sua funzione, sono le stesse viste nelle cellule non neurali. In particolare risulta essere coinvolta in alcuni processi di apprendimento, l’azione di Elk1, un fattore di trascrizione la cui fosforilazione dipende proprio da ERK2. Nell’ippocampo di animali sottoposti a fear conditioning dipendente dal contesto ambientale, Elk1 è fosforilato in maniera sensibile all’inibitore di MEK (F. Sananbenesi, A. Fischer, C. Schrick, J. Spiess, e J. Radulovic 2002).
Tuttavia il fattore di trascrizione più studiato nei meccanismi biomolecolari legati all’apprendimento ed alla memoria è CREB (Proteina legante i CRE, i promotori che rispondono all’AMPc) (B.E. Lonze, e D.D. Ginty, 2002). La sua fosforilazione, determina un reclutamento di strutture coinvolte nella regolazione della trascrizione genica, che si sviluppa dai promotori CRE (A.J. Shaywitz e M.E. Greenberg, 1999). Alla fosforilazione di CREB può contribuire una chinasi nucleare, la CaMKIV (G.-Y. Wu, K. Deisseroth, e R.W.
Tsien, 2001), ma il mantenimento di questa fosforilazione nel tempo, è impedito dagli inibitori di MEK, quindi richiederebbe la cascata delle MAPK (G.E. Hardingham, F.J. Arnold e H. Bading, 2001). Tuttavia, ERK2 non può fosforilare CREB direttamente, esso è fosforilato da protein chinasi che si trovano più a valle della cascata: le RSK (J. Xing, J. M. Kornhauser, Z. Xia, E.A. Thiele e M.E. Greenberg, 1998) e le MSK (M. Deak, A.D.
Clifton, L.M. Lucocq, e D.R. Alessi, 1998). Fattori di trascrizione come Elk e CREB probabilmente regolano la trascrizione di diversi geni che sono espressi durante la plasticità sinaptica, determinando quindi i cambiamenti a lungo termine, legati a memoria e
apprendimento. Gli inibitori di MEK impediscono la trascrizione di geni contenenti CRE, che si verifica durante l’LTP nell’ippocampo (S. Impey, et al.1998). Oltre ai geni che contengono i CRE, ci possono essere anche altre sequenze geniche che per essere trascritte richiedono le MAPK. Sembra infatti che i promotori SRE siano riconosciuti da diversi fattori di trascrizione, tra i quali Elk.
Tutti questi fenomeni richiedono, come abbiamo visto, l’attivazione delle ERK.
E’ da escludere, tuttavia, che ci siano solo attività di espressione genica, tra i ruoli delle ERK; gli inibitori di MEK, infatti, determinano la riduzione dell’LTP nel giro di 20/30 minuti (J.C. Selcher, et al. 2003), ed è poco probabile che in un periodo così breve le ERK raggiungano il nucleo dai dendridi, si effettuino tutti i processi di trascrizione e traduzione e nuove proteine siano trasportate presso le sinapsi potenziate. E’ più probabile che le ERK, o altri fattori della cascata, siano anche coinvolti nella fosforilazione di proteine citoplasmatiche più vicine alle sinapsi.
Un possibile bersaglio delle ERK è il canale K+ voltaggio-dipendente (J. P. Adams, et al. 2000); nell’ippocampo può essere fosforilato in maniera ERK-dipendente (L.L. Yuan, J.P. Adams, M. Swank, J. D. Sweatt, e D. Johnston, 2002) e la sua fosforilazione aumenta durante l’LTP (A. Morozov, et al. 2003). Inoltre, è stato visto che le ERK possono avere anche un’attivazione a livello presinaptico e che ciò comporta la fosforilazione della sinapsina I.
Ma in cosa differiscono ERK1 ed ERK2?
Fino a poco tempo fa non si era riusciti ad osservare una specificità di ruoli distinti tra ERK1 ed ERK2. Solo recentemente è stato visto che le due chinasi hanno funzioni differenti. ERK2, innanzitutto, è il substrato preferenziale di MEK, infatti ERK1 risulta essere meno fosforilato. E’ venuto fuori anche che l’assenza di ERK1 non comporti
alterazioni nello sviluppo né differenze anatomiche e non modifichi neanche l’espressione e lo stato basale di fosforilazione di ERK2. Nonostante ciò, studi effettuati sul corpo striato poi, hanno messo in evidenza che in animali a cui manca ERK1, si manifesta un segnale di attivazione delle MAPK incrementato da un aumento dell’attività di ERK2. Colture
cellulari di fibroblasti, di neuroni dell’ippocampo, del corpo striato e della neocorteccia, hanno messo in evidenza che quando vengono attivate le MAPK, o attraverso i recettori glutammatergici o attraverso la depolarizzazione, nelle cellule non aventi ERK1 i livelli di fosforilazione di ERK2 sono più alti. L’utilizzo dell’U0126 preclude completamente la fosforilazione anche nelle cellule mutanti; ciò ha suggerito che l’assenza di ERK1 influisca in qualche modo sull’attività di MEK. E’ plausibile che ERK1 faccia parte di un
meccanismo modulatorio a feed back negativo, che si occupa di contenere l’attività di MEK e che quando ERK1 viene a mancare, ciò si traduca in un incremento dell’attività
foforilativa di MEK nei confronti di ERK2. L’ipotesi più accreditata finora è che la quantità di molecole di MEK sia tale per cui ERK1 ed ERK2 entrino in competizione per essere fosforilate, di conseguenza a cose normali una certa quantità di ERK2 non viene fosforilata. (C. Mazzucchelli, C. Vantaggiato, A. Ciamei, S. Fasano, P. Pakhotin, W. Krezel, H. Welzl, D. P. Wolfer, G. Page`s, O. Valverde, A. Marowsky, A. Porrazzo, P.C. Orban, R.
Maldonado, M.U. Ehrengruber, V. Cestari,
H. P. Lipp, P. F. Chapman, J. Pouysse´gur e R. Brambilla, 2002).
Gli stessi autori hanno fatto degli studi specifici anche per vedere cosa comporti l’assenza di ERK1 nell’espressione di due geni: c-fos e zif-268. Questi geni vengono subito espressi quando sono attivati fattori che si legano ai promotori CRE e SRE. Il risultato è che sia c-fos che zif-268 sono espressi maggiormente nelle cellule in cui manca ERK1 e questo incremento nell’espressione è maggiore nelle cellule striatali, rispetto a quelle corticali. Differenze si sono riscontrate anche nel test comportamentale legato al condizionamento classico, dove lo stimolo condizionato innocuo ne preannuncia uno nocivo. Nei topi mancanti del gene per ERK1 il consolidamento delle tracce di memoria rimane per periodi più lunghi rispetto a quanto avviene nei controlli. Non si notano invece differenze significative tra i due gruppi, sulle capacità di acquisizione delle informazioni da immagazzinare. Negli esperimenti di LTP fatti finora per valutare la plasticità sinaptica, però, la mancanza di ERK1 comporta un incremento di entità del fenomeno, solo nel corpo striato e nel nucleo dell’accumbens. Nell’amigdala non c’è differenza significativa tra i