Il processo di decapaggio acido degli
acciai
DECAPAGGIO
L’operazione di decapaggio è uno stadio importante del processo di fabbricazione dell’acciaio, effettuata tra la laminazione a caldo e la laminazione a freddo, in cui la superficie dell’acciaio viene messa a nudo per la prima volta. Lo scopo è infatti quello di eliminare gli ossidi che si formano nel raffreddamento successivo alla laminazione a caldo (scaglia), per permettere quindi i trattamenti a seguire, quale la laminazione a freddo, o il rivestimento galvanico, etc.
I problemi maggiormente rilevanti che possono provenire da un cattivo decapaggio sono:
− Problemi da eccessiva lubrificazione nella laminazione a freddo, per l’elevata rugosità e disomogeneità superficiale in seguito ed un sovradecapaggio (overpickling) , i quali porterebbero a loro volta cattive proprietà superficiali nella ricottura.
− Difetti puntuali di aderenza del rivestimento metallico dovuti alla presenza di residui di scaglia da un decapaggio incompleto (underpickling).
La buona riuscita del processo assicura una decalaminazione completa e allo stesso tempo conserva l’omogeneità della superficie metallica sottostante. Esso è influenzato dai parametri di decapaggio e dallo stesso laminato a caldo.
1.1 Eliminazione della scaglia e decapaggio
L’eliminazione della scaglia d’ossido che si trova sulle bobine d’acciaio provenienti dalla laminazione a caldo viene effettuata in due operazioni distinte:
− Un’azione meccanica (descaling) volta alla parziale rottura della scaglia superficiale, per facilitare l’azione della soluzione acida che effettua poi il decapaggio chimico.
Nel primo passo si sfruttano le differenti proprietà meccaniche dell’acciaio e degli ossidi per ottenere una fessurazione della scaglia che aderisce alla superficie. Essendo i coefficienti d’allungamento differenti, gli ossidi risultano più fragili a temperatura ambiente e si ottiene facilmente una microframmentazione di questo strato in seguito ad un’azione di trazione o flessionale quale può essere quella di una leggera laminazione.
A questo punto, una volta che si è ottenuta la discontinuità dello strato d’ossido il nastro d’acciaio può essere immesso nella linea di decapaggio.
Il decapaggio chimico si effettua sugli acciai dolci in bagni d’acido solforico o cloridrico concentrati e ad alta temperatura (100°C per H2SO4 e 85°C per HCl).
Il tempo di permanenza in vasca varia e si mantiene in genere al di sotto del minuto. Inoltre negli impianti è associato alla linea vera e propria un settore per la rigenerazione del liquor nella quale si elimina il ferro proveniente dalla soluzione dell’acciaio nelle vasche di decapaggio.
Le linee operanti in HCl sono di nuova generazione e stanno progressivamente sostituendo quelle ad acido solforico. L’acido cloridrico presenta complessivamente il grosso vantaggio di mantenere una produttività più elevata, legata principalmente all’ottenimento nel prodotto finito di una superficie più omogenea ed uniforme. Peraltro la rigenerazione dell’acido cloridrico consiste generalmente nell’effettuare una piroidrolisi del bagno dalla quale è generalmente recuperata la totalità dell’acido. Quindi in teoria le linee funzionanti in HCl potrebbero operare addirittura a circuito chiuso se non fosse per il reintegro delle perdite dovute all’evaporazione.
Al contrario nelle linee ad H2SO4 si opera un procedimento di rigenerazione
parziale nel quale avviene una precipitazione del ferro sotto forma di solfati e per ragioni stechiometriche non si ottiene un recupero totale dell’acido perché è consumata una mole di acido per mole di FeO.
In entrambi i casi è presente inoltre una valorizzazione dei sottoprodotti: i solfati di ferro sono utilizzati in agricoltura anche se con scarso successo; mentre gli ossidi di ferro nella forma di ematite, sottoprodotti del decapaggio cloridrico sono utilizzati in elettronica, ma il loro valore varia in base al tenore di inclusioni quali Al2O3 e SiO2.
1.2 Parametri del decapaggio acido
I parametri che governano l’andamento del decapaggio acido riguardano essenzialmente due aspetti:
− Caratteristiche del prodotto da decapare: natura dell’acciaio, composizione, struttura e spessore della scaglia. Tutto ciò dipende quasi interamente, come illustrato nel capitolo 3, dalle condizioni di lavorazione a monte (laminazione a caldo, avvolgimento, raffreddamento, stoccaggio,etc.)
− Le caratteristiche del bagno acido: natura dell’acido, concentrazione e temperatura del bagno.
1. 2.1 Effetti della tipologia dello strato d’ossido
Riferendoci a quanto verrà illustrato nel paragrafo 1.3 sulla natura e morfologia della scaglia che si forma sui laminati a caldo, analizziamo le caratteristiche degli ossidi nell’ottica di come influenzano la decapabilità del nastro:
− Struttura e morfologia: gli studi su ossidi sintetici di ferro puro, ottenuti in laboratorio [1,2] mostrano che quelli contenenti wüstite (FeO) si decapano meno velocemente degli ossidi bifasici, costituiti dalla decomposizione eutettoide in Fe + Fe3O4.
Per la stessa struttura poi è ugualmente importante la morfologia dell’ossido sotto forma di ripartizione del protossido FeO: una distribuzione fine ed omogenea, sotto forma di isole favorisce un decapaggio più rapido.
− Spessore della scaglia: per una data struttura, la durata del decapaggio aumenta con lo spessore dell’ossido. Allo stesso tempo però si trova che le scaglie di spessore elevato (≈20µm) sono generalmente meno aderenti e quindi più facilmente eliminabili.
− Fessurazione della scaglia: in ragione del meccanismo col quale avviene il decapaggio acido lo stato di frammentazione della scaglia gioca un
ruolo fondamentale nella durata dell’operazione : un buon grado di rottura favorisce un rapido decapaggio. Questa è infatti la ragione per la quale nelle linee vengono immessi solo nastri che hanno subito precedentemente un descaling.
In generale comunque l’effetto delle caratteristiche della scaglia è più marcato nei bagni ad acido solforico, poiché rispetto a queste il tempo di decapaggio in HCl è notevolmente ridotto.
Anche la composizione chimica dell’acciaio, in diversa misura, ha un ruolo rilevante. Elementi come il Silicio per esempio hanno un effetto nefasto per la formazione durante la laminazione a caldo di fasi solubili di Fe2SiO4.
Altri elementi quali il Rame o l’Arsenico possono diminuire leggermente la durata del processo, o aumentarla come per esempio il Boro. Comunque si tratta di influenze poco rilevanti nel trattamento degli acciai dolci rispetto alla composizione degli ossidi. Un effetto molto marcato invece è quello dato dal Fosforo, che accelera notevolmente l’insorgere di overpickling [3], tanto da rendere spesso necessaria per il suo trattamento industriale la riduzione della temperatura del bagno.
1. 2.2 Effetti delle caratteristiche del bagno
I parametri preponderanti nel decapaggio acido sono: temperatura, composizione e tenore di acido e di ferro della soluzione decapante.
− TEMPERATURA: quale che sia l’acido utilizzato la temperatura ha un’influenza determinante sulla durata del processo [3]. Ciò è legato essenzialmente alla solubilità dell’ossido nella soluzione acida. A titolo d’esempio in una linea ad acido solforico il nastro d’acciaio attraversa tre vasche nelle quali la temperatura cresce da 80 a 100°C, tenendo anche in considerazione la limitazione sul range di variabilità che è data dal rischio di precipitazione, con l’abbassarsi della T, del solfato di ferro monoidrato FeSO4·H2O, detto anche
con una temperatura media intorno ai 100°C per H2SO4 e 85°C per
HCl.
− CONCENTRAZIONE DELL’ACIDO: in soluzioni ad acido cloridrico il valore che minimizza la durata del processo si aggira intorno ai 180g/L per un tenore di ferro di ≈40g/L , mentre nei bagni di acido solforico tale concentrazione sale intorno ai 250g/L.
Al di sotto dei 150g/L la durata del processo aumenta notevolmente mentre al di là dei 300g/L si riscontra un fenomeno di impedimento della reazione all’interfaccia per la formazione di sali di ferro, descritti da Prigent [4], che rallentano il decapaggio.
− TENORE IN FERRO: la presenza di ioni Fe++ in soluzione tende ad aumentare la durata del processo, soprattutto nei bagni ad acido solforico, dove l’influenza sulla cinetica diventa particolarmente marcata già al di sopra dei 60-70g/L. Infatti industrialmente in queste linee si cerca di mantenere la concentrazione del ferro al di sotto dei 40g/L. Invece i bagni di HCl presentano anche da questo punto di vista una maggiore operabilità in quanto la solubilità del ferro è più elevata e l’effetto sfavorevole sulla reazione non appare rilevante al di sotto degli 80g/L, e rimane comunque più moderato rispetto al processo in H2SO4.
Per quanto riguarda le caratteristiche del bagno però ci sono altri due aspetti che rivestono una notevole importanza: la presenza degli inibitori di corrosione, aggiunti in concentrazione variabile alla soluzione decapante, di cui parleremo diffusamente in seguito; la presenza di impurezze provenienti dalla dissoluzione dell’acciaio, quali ioni PO43- , Mn2+ e Cr3+, che contribuiscono ad aumentare
leggermente la durata del processo.
Per tutte queste ragioni è di primaria importanza conoscere bene la chimica del bagno e poterla controllare durante il processo al fine di mantenere la regolarità e la qualità del decapaggio, e quindi migliorare la produttività della linea.
Per quanto riguardo la concentrazione di acido e ferro delle soluzioni esistono dei metodi, diretti e indiretti, sia chimici(titolazione, misura del pH) sia fisici (conducibilità, densitomentria, colorimetria) che possono essere usati e in parte adoperati in linea sull’impianto.
Più delicato è il discorso per quanto concerne il tenore in inibitore della soluzione decapante, per il quale non esiste un metodo di dosaggio diretto. Infatti si ricorre sovente ad una serie o combinazione di misure indirette quali la capacità protettiva dall’attacco dell’acido e la misura delle perdite di peso del metallo o del volume di idrogeno prodotto.
1.3 Caratteristiche della scaglia di ossido che si
forma sui laminati a caldo
Una descrizione dettagliata dei meccanismi di ossidazione ad alta temperatura degli acciai e delle varia tipologie di ossidi superficiali sarà fatta nel capitolo 2, per ora ci limitiamo a schematizzare le caratteristiche della scaglia che interessano la decapabilità dell’acciaio, le quali ovviamente dipendono dalla condizioni di lavorazione a monte, ossia dalla temperatura di laminazione e di avvolgimento.
Durante la laminazione a caldo si formano tre tipi di strati componenti la scaglia che non sono interamente rimossi dal decapaggio chimico [5]:
− Calamina primaria: Questa si forma sulla bramma nel riscaldamento in forno dalla reazione tra la superficie dell’acciaio con i gas di combustione, tra i quali l’eccesso d’aria, vapor d’acqua e CO2. Un elevato tempo di
permanenza nel forno di riscaldamento può contribuire ad uno spessore anomalo dello strato che non viene facilmente rimosso con gli spray di acqua in pressione che
precedono la sbozzatura. La calamina primaria non è continua e può essere ben dispersa lungo la superficie del nastro: è ben radicata ed estremamente difficile da eliminare completamente con decapaggio.
− Calamina secondaria: sono così classificati quei difetti costituiti dai residui di scaglia rimasti da un’incompleta rimozione nello sbozzatore e durante il lavaggio con acqua in pressione prima della finitura, ed è spesso chiamata jet scale.
− Calamina terziaria o Fleck Scale: Questa calamina è il risultato di un deterioramento del cilindro finitore (rottura dell’ossido superficiale del rullo negli stadi 1 e 2 ) dei laminati a caldo. Il deteriorarsi del cilindro è progressivo e ne consegue una scaglia in placche continue sulla superficie del nastro.
La calamina che si elimina nel decapaggio acido è quella secondaria, si forma in seguito alla laminazione sul rullo avvolgitore e durante il raffreddamento del rotolo; è la normale scaglia blu/grigia che ricopre l’intera superficie del nastro (chiamato appunto “nero”). Quest’ossido si produce quando il ferro nell’acciaio reagisce con l’ossigeno dell’aria. Lo spessore e la composizione chimica, la morfologia della scaglia sono influenzate dalla temperatura di laminazione, gli
860°C circa all’uscita dai cilindri finitori e intorno ai 650°C per l’avvolgimento, e anche dalla quantità d’ossigeno presente in superficie quando il nastro è caldo. I nastri avvolti ad alta temperatura.
Un avvolgimento a più alta temperatura porta uno spessore maggiore della scaglia ( ≈12 micron per 750°C mentre ≈6 micron per 570°C)[1], mentre la composizione della scaglia è largamente influenzata dalla successiva velocità di raffreddamento. Quanto più questo avviene rapidamente tanto più sarà la percentuale di wüstite presente. I tre tipi di ossido che compongono la scaglia si distinguono in base all’ossigeno proporzionale con cui si lega il ferro:
% Ferro % Ossigeno
Fe2O3 (ematite) 69.9 30.1
Fe3O4 (magnetite) 72.4 27.6
FeO (wüstite) 77.7 22.3
L’interfaccia metallo-scaglia si arricchisce degli elementi alliganti che segregano in superficie[1]. La loro affinità con l’ossigeno sarà poi quella che determina la forma in cui sono presenti questi elementi:cromo, alluminio, silicio, fosforo si trovano in forma ossidata mentre il rame, nickel, e arsenico no.
Solo il manganese forma ossidi che sono presenti in soluzione solida con quelli di ferro e passa in quantità notevoli nella scaglia.
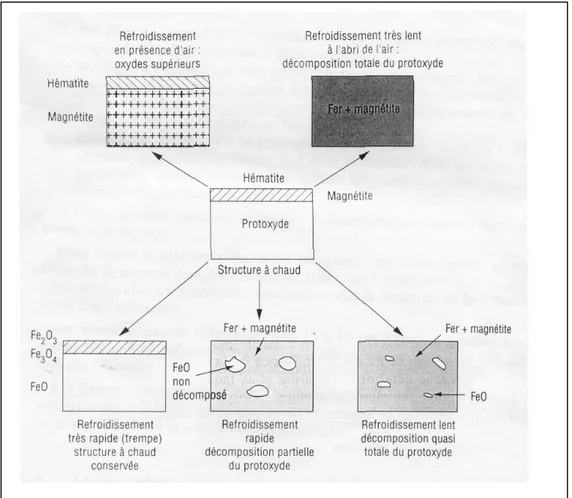
Gli ossidi risultano dalla reazione chimica che avviene a caldo tra l’acciaio e l’aria. Tuttavia il protossido è instabile a temperature inferiori ai 570°C e si decompone in ferro e magnetite secondo la seguente reazione:
4 FeO → Fe3O4 + Fe (decomposizione eutettoide)
L’entità della decomposizione del protossido è funzione della temperatura [6] , risulta minima a 570°C e massima a 480°C.
La struttura della scaglia è totalmente differente ad alta e bassa temperatura; la struttura finale che è quella che noi decapiamo, dipende conseguentemente dalle condizioni di raffreddamento del prodotto:
− Se il raffreddamento è lento la decomposizione eutettoide del protossido è totale;
− Se è molto lento, tale decomposizione è parziale e rimangono nella struttura delle isole di FeO ;
− Se è mo0lto rapido si conserva la struttura a caldo.
Peraltro se si effettua il raffreddamento in presenza d’aria (per esempio sui bordi del rotolo), si avrà un’ulteriore ossidazione del protossido e la calamina sarà allora composta unicamente da ossidi superiori.
Figura 1.1 Evoluzione della calamina in funzione delle differenti condizioni di raffreddamento
Pertanto è evidente che la struttura della scaglia è il risultato dell’insieme dei molteplici parametri legati alle condizioni di lavorazione a caldo, ma anche alle seguenti operazioni di avvolgimento e stoccaggio che possono portare modifiche di tale struttura.
Non è meno evidente inoltre che la struttura della scaglia non deve essere per nulla omogenea sulla totalità del nastro avvolto; infatti notiamo in generale disomogeneità nella larghezza e nella lunghezza del rotolo (testa-coda). Sui bordi sono presenti sempre ossidi superiori, e tutte queste differenze portano in genere notevoli variazioni nella decapabilità.
- Aderenza e fessurazione
Come si spiega nello studio del meccanismo con cui avviene il decapaggio acido, l’aderenza e lo stato di fessurazione della scaglia giocano un ruolo preponderante nella decapabilità, in quanto favoriscono la penetrazione dell’acido attraverso le calamine.
Lo stato finale di degradazione meccanica della scaglia presente sul nastro che entra nella linea di decapaggio può avere due origini[1]:
− I difetti di alta temperatura che sono essenzialmente di due tipi: le incrostazioni di ossido non completamente eliminati dalle operazioni di descaling intermedie durante la lavorazione a caldo, oppure parziali decoesioni interfacciali degli ossidi creati dal degasaggio.
− I difetti a bassa temperatura, che provengono dalle differenze tra i coefficienti di dilatazione termica di acciaio e ossidi e le relative proprietà meccaniche. Tali difetti influenzano la solidità della scaglaiu ma non la sua struttura.
A questa va aggiunta tutta le serie di frammentazioni meccaniche volontarie che precedono l’ingresso nelle vasche.
Per quanto riguarda l’aderenza della scaglia alle superficie di base del metallo va inoltre detto che non esistono test che la misurino precisamente, in quanto dalle prove meccaniche si ricava più facilmente un’indicazione di coerenza che di aderenza. Tuttavia troviamo che la scaglia di sottile spessore (da 5 a 10 µm) sono generalmente assai compatte e ben aderenti mentre nei grossi spessori si trovano più fessure.
Notiamo infine che le fessure corrispondono ad una cattiva coerenza ma buona aderenza dello strato d’ossido, mentre si ha il distacco della scaglia quando l’ossido è plastico e non aderente.
1.4 Il meccanismo del decapaggio acido
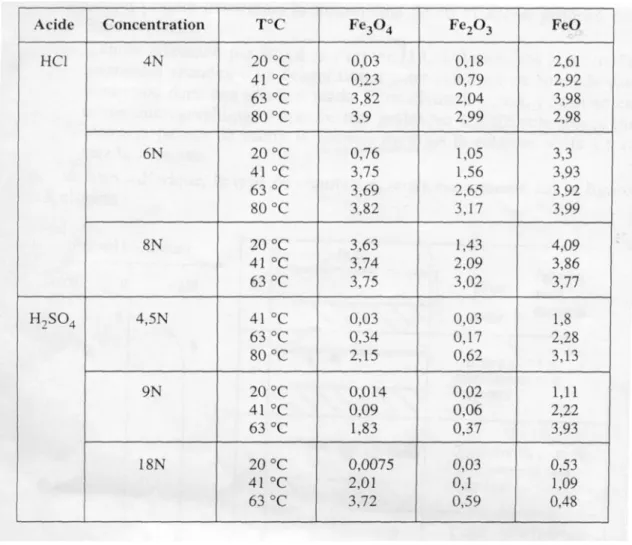
Di seguito sono riportati i dati di solubilità [1] dei differenti ossidi di ferro in soluzioni acide di HCl e H2SO4 a diverse concentrazioni e temperature.
Tabella 1.1 Solubilità degli ossidi di ferro
Naturalmente tale solubilità cresce in ogni caso all’aumentare della temperatura e al diminuire del pH della soluzione, tuttavia la soluzioni di HCl restano più efficienti a parità di condizioni.
Per altro da tali dati, ottenuti su un ossido industriale, si vede chiaramente che qualunque sia la natura dell’acido, non si avrebbe comunque totale dissoluzione degli ossidi nei primi 15 minuti d’immersione. Tutto ciò indica, riguardo la durata del decapaggio industriale che tale processo deve avvenire secondo un meccanismo più complesso della semplice dissoluzione chimica.
Fino ad oggi sono stati proposti diversi possibili meccanismi di avanzamento: − Engell [2] propose un meccanismo d’azione da parte dell’acido sulla
base sia di misure effettuate sulla durata della dissoluzione degli ossidi puri sia dell’osservazione del processo industriale.
In una soluzione di H2SO4 il meccanismo secondo Engell è il
seguente: l’acido s’infiltra nella scaglia attraverso le fessure presenti, e ciò porta alla formazione di una pila galvanica all’interfaccia acciaio-scaglia, e alla dissoluzione preferenziale del protossido. Ciò avviene finché non interviene il distacco dello strato di scaglia, ma questo prima che l’ossido in sé sia completamente passato in soluzione.
Questa ipotesi è al momento ancora abbastanza contestata in quanto nella realtà non si osserva sempre un attacco preferenziale dell’acido all’interfaccia. Un’alternativa valida ci è data dal meccanismo proposto da Baud e Ferrier.
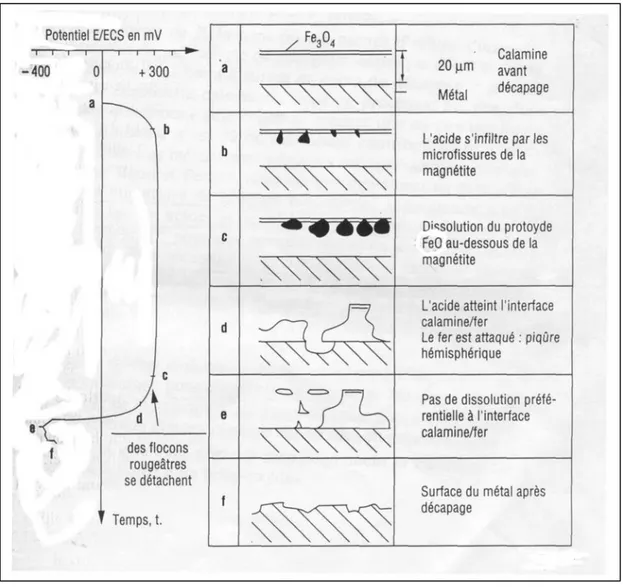
− Baud e Ferrier [7,8] condussero lo studio basandosi sull’andamento nel tempo del potenziale di corrosione di un campione di acciaio nero immerso in una soluzione decapante. Parallelamente effettuarono l’analisi micrografica della superficie del campione prelevandolo a diversi stadi del decapaggio, al fine di seguire il cammino della soluzione acida nello spessore della scaglia.
Nella figura seguente mostriamo i risultati ottenuti ancora in una soluzione di acido solforico:
Figura 1.2 Meccanismo di distacco della scaglia durante decapaggio acido
Il meccanismo proposto a riguardo di tali osservazioni presenterebbe tre tappe:
1. Una fase di iniziazione nella quale l’acido si infiltra nelle fessure dell’ossido superiore.
2. Una seconda fase di dissoluzione chimica del protossido FeO.
3. Successiva fase è la dissoluzione elettrochimica del protossido: essa inizia appena l’acido entra in contatto col metallo di base. A questo punto si ha la creazione di una pila elettrochimica acciaio/ossido/soluzione acida, dove l’acciaio si comporta da anodo. E’ in questa fase infatti che
osserviamo il passaggio in soluzione di una certa quantità dell’acciaio di base. E questo è sicuramente lo stadio più rapida del processo.
Quest’ultimo meccanismo è lo stesso quale che sia la struttura della scaglia (FeO decomposto o no) , solo la forma della curva del potenziale viene modificata in ragione del fatto che i nodi di ferro presenti nella scaglia impongono un potenziale negativo al campione. Allo stesso modo in acido cloridrico il meccanismo è identico ma non ovviamente il valore del potenziale durante il decapaggio.
− Uno studio più recente del fenomeno è quello effettuato da P.Prigent [4] che ha realizzato misure locali all’interfaccia scaglia-acciaio di come avviene il passaggio in soluzione del ferro. Il meccanismo che ne risulta è praticamente identico a quello di Baud e Ferrier ma mette particolarmente in evidenza un fenomeno supplementare di arresto della reazione in presenza di forti concentrazioni di acido. Ciò si manifesta anche in una forma differente della curva potenziale-tempo: per concentrazioni di acido superiori a 350 g/L la reazione di decapaggio si ferma alla prima fase di penetrazione dell’acido attraverso la scaglia. Questo blocco è da attribuire all’accumulo di ioni Fe++ all’interfaccia metallo-ossido, per la precipitazione di un solfato di ferro idrato che è ben poco solubile.
Quest’ultimo meccanismo nella sua completezza si accorda con quanto detto in precedenza sull’importanza della frammentazione della scaglia: facilitare l’accesso della soluzione alla superficie del metallo sottostante la scaglia rende più veloce l’ultimo stadio del processo e quindi la dissoluzione elettrochimica degli ossidi in presenza di ferro.
1.5 Lavaggio
L’operazione di lavaggio effettuata all’uscita dalle vasche di decapaggio ha lo scopo di bloccare la reazione chimica ed eliminare dalla superficie del nastro d’acciaio i residui dei sali che si formano durante il processo.
Tale operazione è di gran lunga più agevole sui nastri decapati in acido cloridrico per la migliore solubilità dei cloruri di ferro rispetto a quella dei solfati. La maniera più comune per effettuare il lavaggio è quella di utilizzare acqua demineralizzata con l’aggiunta eventuale di inibitori di corrosione per la protezione della superficie, i quali generalmente, essendo lievemente alcalini, possono anche neutralizzare eventuali residui di acidità sul laminato.
1.6 Stato della superficie in seguito a decapaggio
Questo fattore è di importanza fondamentale per l’utilizzo successivo del prodotto. Le caratteristiche della superficie dopo il decapaggio sono descritte da due aspetti: la rugosità superficiale e la composizione chimica della superficie.
− La rugosità superficiale assume particolare rilievo nel caso di un utilizzo diretto del laminato a caldo, per esempio nella lavorazione di imbutitura ma ancor di più per i problemi di lubrificazione nella laminazione a freddo. Tale rugosità è data dalla sovrapposizione di tre elementi: la rugosità presente al di sotto della scaglia, quella portata dell’operazione di descaling, e infine quella più importante conseguente all’attacco dell’acido al metallo (anodo) durante il processo di decapaggio.
− La composizione chimica della superficie dopo il decapaggio è altrettanto importante poiché non viene poi sostanzialmente modificata dalla laminazione a freddo,eccetto che per l’intervento di inquinanti esterni, quali residui d’olio di laminazione e particelle di ferro provenienti dall’abrasione del metallo, ed eventuali saponi. Tale superficie si ritrova all’ingresso della linea di ricottura o rivestimento dove essa si evolve in funzione delle condizioni operative di ricottura
(temperatura e tempo) e condiziona in parte lo stato finale della superficie del prodotto. Essa è caratterizzata da[9]:
− piccole quantità di impurezze provenienti dalle soluzioni di decapaggio e lavaggio (cloro, sodio e calcio);
− un film molto sottile di ossido di ferro proveniente da una riossidazione superficiale dell’acciaio all’aria;
− un arricchimento superficiale negli alliganti meno ossidabili dell’acciaio (rame, nickel, arsenico), come risultato di un fenomeno di retrodiffusione durante la formazione della calamina e da un processo di rideposizione elettrochimica nel bagno di decapaggio. Concludendo l’aspetto chimico delle superficie all’uscita dalla linea di decapaggio è funzione delle condizioni di laminazione a caldo e dei parametri operativi di processo: uso dell’inibitore, qualità del lavaggio, composizione del bagno e durata del trattamento…
E’ così possibile, grazie a diverse tecniche, identificare differenti stati della superficie di una lamiera alla fine del decapaggio [1]:
Un sottodecapaggio (underpickling) si caratterizza con la presenza di punti di scaglia localizzati, rilevabili per esempio con una microanalisi che conferma la presenza di ossidi in superficie.
Una lamiera ben decapata presenta una superficie dall’aspetto uniforme senza attacchi localizzati, con un arricchimento non apprezzabile in rame o nickel.
Se si prolunga il tempo di permanenza in vasca, si ritrova un arricchimento in rame e nickel della superficie, e un inizio di attacco al bordo di grano dell’acciaio per corrosione. Ciò non modifica la rugosità finchè non si supera il tempo di sicura protezione apportato dall’inibitore. Per una durata dell’immersione superiore a tale tempo, la lamiera si
trova in condizioni di sovradecapaggio (overpickling): la superficie presenta allora una forte rugosità, un arricchimento importante in Cu e Ni, e infine un notevole inizio di corrosione sul bordo di grano.
INIBITORI DI CORROSIONE
Gli inibitori di corrosione sono usati in numerosi processi industriali per la produzione dei laminati di acciaio, rivestiti e non. L’uso di questi inibitori nei bagni di decapaggio è utile sia a prevenire un’eccessiva dissoluzione del metallo sia il contemporaneo consumo di acido. L’azione protettiva dell’inibitore nella corrosione metallica è spesso associata ad un adsorbimento chimico o fisico che comporta una variazione ed un trasferimento delle cariche adsorbite da una fase all’altra. Inoltre l’uso degli inibitori nelle soluzioni di decapaggio prima della zincatura non comporta variazioni nelle proprietà del prodotto finito rivestito o conseguenze durante i successivi trattamenti superficiali[10].
Questi inibitori aumentano il tempo di permanenza nel bagno acido e scegliendo il giusto inibitore, la diffusione dell’idrogeno nel metallo, causa di infragilimento, può essere notevolmente ridotta. Inoltre, proteggendo la superficie dall’attacco dell’acido durante la rimozione della scaglia del laminato a caldo, si previene la formazione di microfessure dopo la laminazione a freddo. In termini di efficienza del processo produttivo, l’efficacia protettiva è notevole già a basse concentrazioni, e allo stesso tempo una minore dissoluzione di ferro e consumo di acido porta sicuramente un allungamento del tempo di utilizzo della soluzione adoperata[11].
2.1 Funzionamento degli inibitori
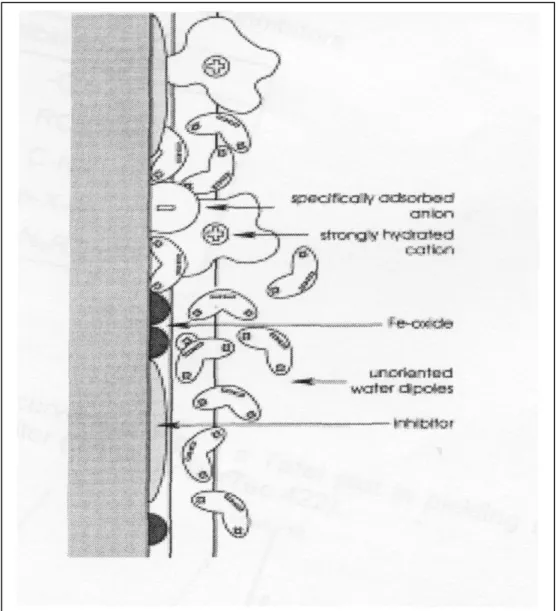
Gli inibitori usati nel bagno didecapaggio sono sostanze, organiche e inorganiche [12,13], attive all’interfaccia. Come risultato dell’interazione elettrostatica, rivestono la superficie del ferro con
uno strato monomolecolare e ciò
riduce l’attacco dell’acido (fig.5). Figura 2.1 Struttura molecolare di un inibitore organico
Figura 2.2 Azione filmante di un inibitore di corrosione
L’intensità di tale interazione dipende dalla polarizzazione della superficie metallica, dalla composizione dell’inibitore e dal mezzo decapante. La polarità dell’acciaio è diversa da quella dello strato d’ossido, che viene rivestito in maniera peggiore e quindi non c’è impedenza alla sua dissoluzione. L’inibitore può ridurre sia la dissoluzione del metallo nei centri attivi (protezione anodica) sia lo sviluppo d’idrogeno dovuto alla sua riduzione (protezione catodica).
2.2 Composizione chimica di inibitori organici
Gli inibitori organici presentano generalmente gruppi elettronici donatori che interagiscono con la superficie metallica (Tabella 2.1 ).
Tabella 2.1 principali inibitori organici
Un gran numero di composti organici sono usati come inibitori [14]: la loro efficacia è sistematicamente discussa sulla base del tipo di legame che le molecole attivano col metallo. Per essere efficace il composto organico deve essere adsorbito, ma il tipo di legame varia con la configurazione chimica della molecola. Nella maggior parte dei casi l’adsorbimento è di natura elettrostatica, chimica, e per delocalizzazione degli elettroni (legame π) [15]. Comunque ogni composto può utilizzare diversi meccanismi di adsorbimento.
L’interazione degli elettroni delocalizzati (interazione tra gli orbitali π) con la superficie metallica può risultare molto efficiente: passando da composti con singolo, doppio e infine triplo legame la potenzialità dell’inibizione migliora, ma negli ultimi casi tale efficacia può essere poi ridotta da fattori come l’ingombro sterico che a loro volta impediscono la capacità filmante[16].
Dalla struttura molecolare si vede che questi composti organici si prestano all’adsorbimento sulla superficie del metallo attraverso atomi di azoto, zolfo, gruppi –N=CH, anelli eterocicli e aromatici, ma non è facile classificarne
l’importanza senza prove sperimentali. Mentre ci si aspetta che la presenza dei gruppi OH aumenti la solubilità del composto organico nella soluzione acida e ne consenta così l’utilizzo in concentrazioni veramente basse (0.1÷1% vol) di inibitore.
La protezione da corrosione di lamine d’acciaio attraverso diversi composti è stata studiata attraverso test di laboratorio che hanno evidenziato come l’inibizione sia da attribuire ad un film protettivo che riveste la superficie del metallo tramite adsorbimento chimico [17]: l’attività protettiva del film cresce in un certo intervallo di tempo e si mantiene anche quando i provini, estratti dalla soluzione acida contenente inibitore, vengono immersi in acido fresco non inibito. Cio’ dimostra chiaramente che l’inibizione è dovuta alla formazione di un film stabile e insolubile sulla superficie dei provini attraverso un processo di chemiadsorbimento.
2.3 Inibizione del mezzo decapante
Quando una soluzione decapante è utilizzata senza aggiunta di inibitori, le superfici sono molto ruvide e possono presentare, specie nelle linee operanti ad acido solforico, fessure abbastanza profonde.
Industrialmente sono utilizzati diversi composti organici per le linee operanti in H2SO4 , mentre una speciale miscela di Esametilentetrammina (HTMA, C6H12N4
[100-97-0]) e Propinolo (C3H3OH [107-19-7]) è diffusamente utilizzata per
impianti che lavorano in bagni di HCl.
La soluzione decapante utilizzata dopo la laminazione a caldo oltre ad essere molto aggressiva (HCl o H2SO4 >150g/L) in termini di concentrazioni, opera
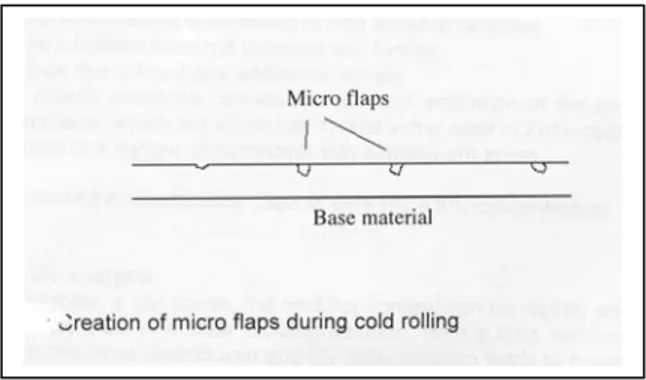
anche ad alte temperature (60-95°C) e per lunghi tempi d’immersione (>30s). Ciò comporterebbe, senza l’uso di inibitori, che la rimozione della scaglia, a partire dalle fessure provocate col decapaggio meccanico, avvenga in maniera non omogenea (specialmente sulle linee ad acido solforico), lasciando spazio ad un attacco molto localizzato della superficie metallica alla base dell’ossido, come mostrato in figura [11].
Figura 2.4 Attacco del metallo di base durante il decapaggio
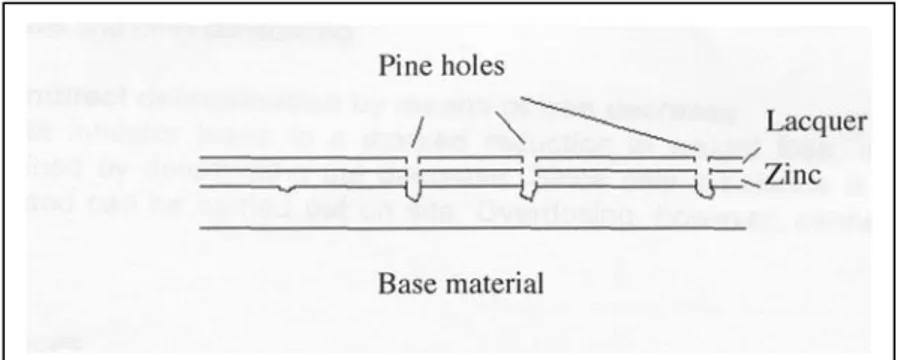
Col trattamento successivo di laminazione a freddo alcuni di questi pori si richiudono, mentre a seguito della zincatura alcune di queste flap possono riaprirsi e formare dei veri e propri buchi anche nel rivestimento
Figura 2.5 Creazione di microcavità in seguito a trattamento a caldo
Come è già stato evidenziato sopra, un inibitore riduce l’attacco dell’acido al materiale di base e non malcondiziona affatto la riuscita del decapaggio. Ciò riduce notevolmente la creazione di micro-flap.
L’efficacia degli inibitori è caratterizzata attraverso diverse tecniche sperimentali [10,18]:
Efficienza: Valutata in accordo col metodo delle perdite in peso, l’efficienza percentuale di inibizione di un prodotto viene definita come:
(Perdita in peso in acido senza inibitore)-(Perdita in peso con inibitore)x100 (Perdita in peso in acido senza in ibitore)
Velocità di rimozione della scaglia: Misurata attraverso la riduzione di spessore dei campioni nel tempo, in funzione delle diverse concentrazioni di inibitore.
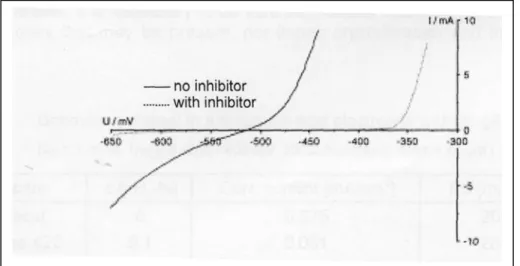
Potenziale di corrosione (Ecorr) e corrente di corrosione (Icorr): Gli
studi di polarizzazione potenziodinamica possono evidenziare l’influenza che questi composti hanno sui parametri cinetici di corrosione del bagno decapante, preso come riferimento. In presenza di inibitore i valori dei potenziali di corrosione slittano verso valori meno elettronegativi, e si ha una notevole diminuzione, in funzione della concentrazione usata, della corrente di corrosione.
Figura 2.6 Misura della corrente di corrosione
Figura 2.7 Curva di Tafel costruita in una soluzione inibita, T=25°C.
Misura dell’ idrogeno permeato: La misura dell’idrogeno permeato attraverso una superficie nota esposta all’azione dell’acido è direttamente proporzionale alla concentrazione di idrogeno sulla superficie del campione, quindi all’entità della reazione di corrosione che avviene. Tutti gli inibitori abbassano notevolmente il valore massimo della corrente di idrogeno permeata attraverso il campione Uno scostamento più o meno pronunciato tra i diversi inibitori e nelle diverse concentrazioni è da riferirsi proprio alla capacità filmante del prodotto: la disponibilità di più elettroni π si riflette in una maggiore superficie interessata dall’adsorbimento,una migliore protezione da corrosione, e quindi una minore esposizione alla permeazione dell’idrogeno.
Formazione degli ossidi ad alte
temperature
OSSIDAZIONE E SCAGLIA
Nel corso della loro trasformazione nello stabilimento siderurgico i prodotti sono sottoposti ad una evoluzione profonda della superficie, dal punto di vista microgeometrico come pure dal punto di vista fisico-chimico. Questa evoluzione risulta dalle numerose interazioni tra la superficie e il suo ambiente: atmosfere di forni di riscaldamento e di ricottura, cilindri di laminatoio, soluzioni di decapaggio, oli di lubrificazione…
Interazioni particolarmente interessanti, sono le reazioni metallo-gas ad alta temperatura: queste devono essere ben identificate in termini di meccanismi e in termini di cinetiche affinché, nella maggior parte dei casi, gli operatori possano predirne gli effetti e le conseguenze sulle operazioni a valle.
Quando l’atmosfera è ossidante per il ferro, il metallo reagisce con l’ambiente esterno per formare degli strati superficiali di ossidazione: le calamine. È necessario procedere in certe tappe ad una eliminazione della calamina, in particolare prima della laminazione a caldo delle bramme (descaling meccanico) e prima della laminazione a freddo (il decapaggio acido). L’ossidazione può anche causare la formazione di calamina aderente, difficile da togliere meccanicamente, che può dare dei difetti di superficie gravi; è più difficile quantificare quest’ultimo aspetto in termini di costi di gestione, ma è un difetto molto importante poiché condiziona la qualità di superficie del prodotto finito
3.1 Ossidazione
L’ossidazione corrisponde alla reazione di un metallo M, o di una lega, con un gas ossidante. Questo gas è spesso ricco di ossigeno (per esempio aria) ma può contenere, interamente o in parte, altre specie ossidanti o reattive allo stato gassoso: zolfo, specie solforate, gas carbonico, vapore d’acqua, etc. Il termine ossidazione può presentare una certa ambiguità poiché descrive in maniera più che generale la reazione elettrochimica seguente:
Seguendo le condizioni di ambiente la specie ionica può:
1) Passare nel mezzo elettrolitico a contatto del metallo, sotto forma solvatata, idratata se si tratta di un mezzo acquoso: è il caso della corrosione elettrochimica;
2) Far nascere (una o diverse) una nuova(e) fase(i) solida(e) che si forma(no) alla superficie del metallo; così, nel caso dell’ossigeno:
M + O2 → ossido(i) (2)
[solido 1 + gas → solido(i) 2]
è il caso della corrosione da parte dei gas che si manifesterà soprattutto alle temperature medie ed elevate. È principalmente là, e per tradizione, che si utilizza il termine ossidazione per descrivere il fenomeno corrispondente. Si tratta di una reazione eterogenea della quale bisogna studiare le condizioni termodinamiche di fattibilità per sapere se questo metallo M si ossida o no.
3.2 Gli ossidi di ferro
Indichiamo di seguito che il ferro può, secondo le condizioni, dare luogo a tre ossidi:
1) Ossido ferroso o protossido di ferro o ancora wüstite; il ferro γ è alla valenza due: Fe2+. Questo ossido non esiste, nelle condizioni normali, sotto forma stechiometrica e presenta anche un largo scarto alla stechiometria (Fe1-xO con x = 0,125 al massimo).
2) Fe3O4: magnetite o ossido spinello; il ferro γ è alle valenze due e tre (2Fe3+ e 1 Fe2+).
3) Fe2O3: ossido ferrico o sesquiossido di ferro o ancora ematite; il ferro γ è alla valenza tre: Fe3+.
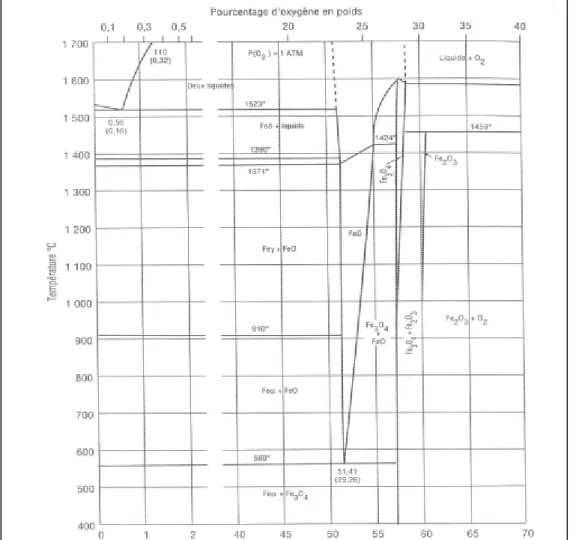
ossidi, allo stato solido. Il diagramma di equilibrio ferro-ossigeno corrispondente alla pressione atmosferica di ossigeno fornisce una prima risposta in funzione della temperatura
Diagramma di equilibrio Fe-O
3.3 Ossidazione degli acciai
Le strutture e le cinetiche di crescita vanno a dipendere dalla composizione dell’acciaio e dell’atmosfera. In rapporto a quella del ferro puro, l’ossidazione degli acciai si distingue dall’influenza degli elementi di lega: i fenomeni di ossidazione sono più complessi e le calamine formate sugli acciai sono in
generale, principalmente costituite dagli ossidi dell’elemento maggioritario. Così, una calamina sull’acciaio comprenderà sempre la wüstite o protossido di ferro (FeO), la magnetite (Fe3O4) e l’ematite (Fe2O3).
Nell’aria o nell’ossigeno puro, la calamina formata su del ferro puro è costituita da una successione di strati di ossidi di ferro:
- ad una temperatura inferiore a 570 °C: gli ossidi Fe3O4 e Fe2O3,
- ad una temperatura superiore a 570 °C: gli ossidi FeO, Fe3O4 e Fe2O3. Tuttavia la presenza degli elementi di lega conduce, nella maggior parte dei casi, a delle modificazioni della struttura e della cinetica di crescita degli strati di ossidazione. In più, si assiste all’alterazione del metallo situato sotto la calamina per ossidazione selettiva degli elementi contenuti nell’acciaio.
Le calamine formate durante le operazioni siderurgiche a caldo corrispondono il più sovente alla seconda situazione (T > 570 °C): è generalmente noto che le calamine sul ferro puro crescono per diffusione delle lacune di ferro nel FeO e Fe3O4 e per diffusione dell’ossigeno nel Fe2O3. Al meccanismo precedente bisogna in realtà aggiungere la diffusione del ferro in posizione interstiziale nel Fe2O3 e la diffusione dell’ossigeno nel Fe3O4 e Fe2O3 per il tramite delle dislocazioni, dei giunti di grani o delle microfessure.
Schema di ossido tipico
Figura 3.1 Stratificazione della scaglia superficiale
Le cinetiche di ossidazione possono essere rallentate dalle reazioni alle differenti interfacce: Fe/FeO, FeO/Fe3O4, Fe3O4/Fe2O3. I lavori di Païdassi hanno mostrato che tali reazioni di interfaccia non avevano alcuna azione limitativa e che nel caso di strati di ossidi aderenti al loro substrato, lo spessore di calamina formata ecal è legata alla temperatura T (Kelvin) e alla durata di ossidazione t (secondi) per una legge parabolica:
ecal = kp0 . exp [- Q/RT] . √t
dove Q è l’energia di attivazione (joules/mole), R la costante dei gas perfetti (8,3169 J.mole-1. K-1) e kp0 il termine pre-esponenziale della costante parabolica di ossidazione.
Questa relazione non si applica che al regime permanente, cioè: se il regime parabolico è raggiunto molto rapidamente (cosa che è realizzata per il ferro puro nell’aria, alcuni minuti a 1000°C secondo Païdassi) e se i tre strati di ossidi sono presenti e aderenti al loro substrato. Quest’ultimo punto assicura che le
proporzioni di ogni strato siano costanti ossia, tra 700 e 1250 °C: 95 % FeO, 4% Fe3O4, 1 % Fe2O3. Se tutte le condizioni sono rispettate allora l’equazione precedente diviene:
ecal (mm) = 24,6 . exp [- 84770/RT] . √t
Questa formula descrive abbastanza bene l’ossidazione degli acciai nelle atmosfere ricche in ossigeno (colata continua, laminazione a caldo), mentre non può essere applicata alle atmosfere di riscaldamento nei forni nella sua forma attuale.
Nel dominio di temperatura considerato sopra, si formano i tre ossidi, FeO, Fe3O4 e Fe2O3. Lo spessore ej di ogni strato successivo corrispondente a questi tre ossidi, varia con il tempo secondo una legge dello stesso tipo di quella dello strato globale:
ej = √kjt
In regime permanente, ad una data temperatura, lo spessore relativo dei tre strati è costante.
3.4 Effetto degli elementi di lega
La figura rappresenta in maniera schematica la microstruttura di una calamina sull’acciaio dopo riscaldamento. Si distinguono diverse zone, dell’atmosfera verso il metallo:
la parte esterna della calamina costituita dai tre ossidi di ferro citati precedentemente,
la zona mista, situata all’interfaccia metallo/calamina, costituita da una miscela di FeO e dei prodotti di reazione di FeO con gli ossidi di alcuni elementi di lega,
la zona di metallo alterata da diversi fenomeni (decarburazione, ossidazione interna, penetrazioni ai giunti di grani),
il metallo sano.
Figura 3.3 Microstruttura della calamina
Nel corso dell’ossidazione, gli elementi contenuti nell’acciaio sono espulsi all’interfaccia metallo/calamina. C’è competizione tra l’arricchimento all’interfaccia metallo/calamina provocata dall’ossidazione e omogeneizzazione per diffusione degli elementi verso il cuore del metallo.
3.5 Aspetti
cinetici
3.5.1 Decoesione all’interfaccia metallo calamina
La calamina può scollarsi dal substrato sotto l’effetto dei vincoli di crescita o degli shok meccanici. Possono allora presentarsi due situazioni:
- La calamina scende e l’ossidazione proseguirà più rapidamente perché si distribuirà su una superficie “fresca”, il calcolo sotto-stimerà allora gli spessori di calamina formata e di metallo consumato;
- La calamina staccata resta sulla bramma, la “discontinuità” formata gioca un ruolo di barriera alla diffusione degli ioni ferrosi, che ha come conseguenza da un punto di vista microstrutturale di fare crescere gli spessori di Fe3O4 e Fe2O3 a carico di FeO e di rallentare le cinetiche di ossidazione.
3.5.2 Calamina incompleta
Il modello richiede la presenza dei tre strati di ossidi; ciò è vero nell’aria e a fortiori nell’ossigeno puro dopo un periodo transitorio molto rapido. Nei forni di riscaldamento il potenziale di ossigeno è sufficientemente elevato per formare termodinamicamente i tre ossidi di ferro, tuttavia la formazione degli strati di ossidi superiori è funzione della cinetica di reazione. In effetti, è stato dimostrato che secondo il rapporto aria/gas, che fissa il potenziale di ossigeno, non si osservava la formazione di Fe3O4 per una miscela aria/gas stechiometrica quando il potenziale di ossigeno è sufficiente per formarlo. Ciò implica che in un forno di riscaldamento la struttura della calamina è funzione della sua cinetica di crescita.
D’altra parte, la presenza di CO2 e H2O modifica la plasticità della calamina e dunque la sua attitudine a scorrere per mantenere il contatto con il metallo di base. È comunemente ammesso nella letteratura che H2O e in misura minore CO2 aumentano la plasticità della calamina e dunque la sua attitudine ad adattare i vincoli di crescita. La presenza di questi gas porta alla formazione di
una porosità importante; tuttavia la presenza di porosità non riduce la diffusione degli ioni ferrosi.
3.6 Aderenza e proprietà meccaniche degli strati di
ossidi di ferro
Tra le proprietà degli strati di ossidi in generale, e di quelle degli ossidi di ferro in particolare, l’aderenza gioca un ruolo importante nella misura in cui essa condiziona il loro carattere protettivo.
Nel caso del ferro puro che l’aderenza decresca quando lo spessore della calamina cresce: si passa così da 100 a 16 kg/cm2 quando lo spessore varia da 90 a 325 mm. L’aderenza dipende dalla morfologia dell’interfaccia ferro-ossido di ferro.
In effetti, se questa appare spesso piana nella scala macroscopica, essa presenta spesso a più piccola scala di piccole irregolarità che dipendono particolarmente dalla purezza del metallo, dalla durezza e della temperatura di ossidazione. Queste si distinguono dalla loro ampiezza, la loro frequenza e la loro forma. Delle forme particolari di interfacce, e le loro conseguenze sull’aderenza, possono esistere anche tra gli strati di ossidi; così, l’ematite può presentare degli aghi che penetrano nella magnetite sotto-giacente.
Se l’aderenza è una caratteristica importante, in maniera più generale le proprietà meccaniche degli ossidi di ferro devono essere prese in considerazione anch’esse .
Figura 3.4 durezza degli ossidi di ferro
La figura mostra, a titolo di esempio, le durezze Vickers comparate del ferro e di FeO in funzione della temperatura. Alla temperatura ambiente le durezze degli ossidi di ferro e del ferro sono molto differenti; si constata che la durezza del ferro è inferiore a quella del FeO fino a circa 900 °C, temperatura a partire dalla quale queste durezze sono equivalenti. Per contro, la durezza della magnetite resta per ogni temperatura più elevata delle durezze precedenti. Gli ossidi FeO e Fe3O4 possono subire una deformazione plastica dalla temperatura ambiente e la oro plasticità aumenta evidentemente con la temperatura crescente. Sotto l’effetto di questa deformazione, il protossido di ferro fino a quando è mantenuto ad alta temperatura può ricristallizzare, a condizione di aver subito almeno una deformazione critica che cresce con la temperatura di deformazione.
3.7 Calamine formate nel corso della laminazione a
caldo
Le microstrutture delle calamine descritte sono state ottenute nel caso in cui i fenomeni di ossidazione sono molto accentuati. Nel corso della laminazione a caldo, lo spessore di calamina che si forma fra ogni passaggio di laminazione è
predetto con sufficientemente precisione dalla relazione di Païdassi, che permette così di stimare la perdita al fuoco causata dalla laminazione a caldo. L’effetto degli elementi di lega è in questo caso trascurabile sulle cinetiche di ossidazione. Tuttavia, i deboli eventuali arricchimenti in solubilità all’interfaccia metallo/calamina possono avere delle conseguenze sulle operazioni a valle e particolarmente il decapaggio.I fenomeni di ossidazione sul treno a nastri hanno delle applicazioni pratiche importanti sul processo di laminazione. In effetti, il contatto tra il nastro e il cilindro di laminazione è del tipo ossido/ossido con le conseguenze evidenti sull’attrito, la degradazione dei cilindri e la qualità della superficie del prodotto laminato.
Bisogna rimarcare che la presenza di calamina sul nastro è in alcune condizioni benefica. Per esempio, alle temperature elevata (1100 °C), che corrispondono alle temperature delle gabbie di sbozzo, la wüstite e l’acciaio hanno delle durezze comparabili e la wüstite gioca il ruolo di lubrificante.
3.8 Temperatura di avvolgimento
L’ultimo punto di interesse per la laminazione a caldo, concerne la modificazione della struttura della calamina nel corso del raffreddamento dopo avvolgimento. Nel corso del raffreddamento le spire esterne e i bordi sono soggette ad una leggera sovraossidazione del FeO e del Fe3O4.
L’evoluzione della struttura del FeO è dovuta alle proprietà di questo ossido già evocate: l’estensione del suo dominio di esistenza e il restringimento di quest’ultimo quando la temperatura decresce e soprattutto la sua instabilità sotto i 570°C. La prima proprietà dà luogo alla precipitazione di magnetite proeutettoide, la seconda porta alla decomposizione di FeO in Fe3O4 + Fe. Segnaliamo ugualmente la possibilità di formazione di un film di magnetite all’interfaccia metallo/calamina per decomposizione di FeO sotto i 570 °C. Si tratta in questo caso di un fenomeno interfacciale, contrariamente alla decomposizione in Fe3O4 + Fe che concerne la wüstite massiva.
Evoluzione dello spessore della calamina nel corso della laminazione a caldo
acciai
E’ importante notare che quando durante il decapaggio acido l’ossido si dissolve nella soluzione acida si forma cloruro ferroso e acqua, ma quando l’attacco dell’acido interessa il ferro metallico si forma idrogeno.
Reazioni dall’HCl con la scaglia:
Fe2O3 + Fe + 6HCl => 3FeCl2 + 3H2O
Fe3O4 + Fe + 8HCl => 4FeCl2 + 4H2O
FeO + 2HCl => FeCl2 + H2O
Reazione dell’HCl con l’acciaio:
Fe + 2HCl => 3FeCl2 + H2
La formazione di idrogeno atomico non è insignificante una volta iniziata la reazione. Infatti le reazioni con l’ossido alla temperatura del bagno sono molto veloci, inoltre l’attacco alla superficie metallica avviene quasi sempre contemporaneamente poiché di norma il laminato subisce la rottura meccanica della scaglia prima di effettuare il decapaggio chimico.
Durante la reazione col metallo la dissoluzione di 1 g di ferro porta la formazione di 400 ml di idrogeno atomico. La maggior parte di quest’idrogeno si ricombina e abbandona la soluzione in forma gassosa, ma una parte viene inevitabilmente assorbita dalla lamina e potrebbe portare difetti nel prodotto finito.
Da ciò si capisce l’ importanza sia di quantificare la quantità di idrogeno che, in relazione alla composizione della soluzione decapante, si produce sulle superficie dell’acciaio, sia stimare quanto quest’ultimo sia in grado di diffondere attraverso la lamina del particolare acciaio.
4.1 Solubilità e diffusione dell’idrogeno in membrane
metalliche
4.1.1 Diffusione allo stato solido
La diffusione è un fenomeno durante il quale si realizza il trasporto di materia attraverso altra materia, ciò avviene attraverso una serie di urti successivi tra le particelle vicine dovute in linea generale ad un aumento delle vibrazioni termiche degli atomi. Per questo motivo tale trasporto è analizzato con i metodi della termodinamica ed ha l’importante caratteristica di essere un processo irreversibile in quanto porta ad una aumento dell’entropia del sistema.
Nella maggior parte dei materiali solidi il processo è spontaneo (porta ad una diminuzione dell’energia libera) ma sempre attivato termicamente, dato che solo un significativo aumento delle vibrazioni termiche a cui è soggetto ciascun atomo permette che si possa avere un effettivo trasporto di materia all’interno del reticolo. Lo schema che mostra l’andamento del processo di diffusione allo stato solido è mostrato in figura 15 [20,21]:
Figura 4.1 Il flussi Jx che diffonde muove da una concentrazione iniziale Cs ad una minore
Jx rappresenta il flusso della specie che diffonde, la cui concentrazione passa
appunto da un valore iniziale Cs ad uno minore Cx e il profilo che si ottiene
lungo una distanza è sotto condizioni stazionarie. Infatti nel caso in esame sia i valori iniziali e finali delle concentrazioni, sia il gradiente di concentrazione dC/dx sono costanti. Tale proporzionalità è espressa dalla diffusività della specie diffondente, cioè dal suo coefficiente di diffusione D, che è in relazione col flusso secondo la nota prima legge di Fick:
dx dC D
J
x=− ⋅Nel caso più comune invece, non stazionario, la variazione del gradiente di concentrazione nel tempo è espressa dalla seconda legge di Fick:
⎟ ⎠ ⎞ ⎜ ⎝ ⎛ = dx dC D dx d dt dCx x
che nel caso in cui la diffusività D non dipende dalla concentrazione assume la forma semplificata 2 2 dx C d D dt dCx x =
La diffusività D è comunque sempre funzione della temperatura, secondo una legge di tipo Arrhenius, dalla quale emerge anche l’energia di attivazione Ed,
che rappresenta appunto la barriera energetica da superare per avere diffusione: ⎟ ⎠ ⎞ ⎜ ⎝ ⎛− ⋅ = RT E D D d exp 0
A questo punto è utile precisare che i valori dei parametri D ed Ed non sono
teorici, ma vanno ricavati sperimentalmente in quanto dipendono dal meccanismo con cui avviene la diffusione all’interno del reticolo. Infatti esistono diversi tipi di diffusione, per esempio se un atomo durante il suo movimento attraverso il reticolo di un materiale solido incontra un bordo di grano è logico attendersi che possa muoversi più facilmente lungo di esso, semplicemente perché l’energia di attivazione per la diffusione lungo i bordi di grano è minore di quella necessaria per la diffusione di volume. Ancora più avvantaggiata è la
diffusione superficiale nel caso particolare in cui esista una frattura lungo la direzione di diffusione.
Le energie di attivazione riguardo ognuna delle suddette forme di diffusione risultano essere in rapporto tra loro nel seguente ordine:
Ev >Eb >Es
Ev=Energia di attivazione per diffusione di volume;
Eb=Energia di attivazione per diffusione lungo il bordo di grano;
Es=Energia di attivazione per diffusione superficiale
.
Analogamente per i coefficienti di diffusione avremo: Ds >Db >Dv
Il meccanismo con cui avviene il trasferimento di materia all’interno del materiale solido non è quindi né unico né ben definito, ma legato ad una serie di circostanze riguardanti le condizioni di partenza del materiale.
Generalmente comunque dobbiamo considerare che nella diffusione di volume un generico atomo abbandona la sua posizione reticolare per occuparne una adiacente. Questo è il caso quindi dell’autodiffusione, per la quale sembra essere più accreditato il meccanismo attraverso vacanze. In questo caso le vacanze sono già presenti nel materiale e l’energia necessaria è solo quella richiesta dagli atomi della matrice, o da atomi e ioni costituzionali, per lasciare un gruppo di atomi a cui sono legati e spostarsi in una posizione vacante.
Diverso è il caso dei soluti interstiziali che sono abbastanza piccoli da muoversi con meccanismo interstiziale appunto. Ciò è possibile quindi col carbonio, l’azoto e in particolar modo con l’idrogeno che presenta una mobilità più marcata degli altri interstiziali nelle leghe metalliche e pertanto una notevole capacità di diffondere attraverso il materiale.
4.1.2 Comportamento dell’idrogeno nel Ferro puro
La mobilità dell’idrogeno nei metalli è molto elevata: sebbene presenti variazioni tra le diverse leghe, la diffusività dell’idrogeno presenta valori anche di diversi ordini di grandezza più elevati rispetto alle altre specie chimiche. E’ per questo motivo che il trasporto di idrogeno è così strettamente legato al fenomeno dell’ HE e alla cinetica della frattura.
Il ferro puro rappresenta il materiale di riferimento nello studio di tutti i modelli teorici e delle relative prove sperimentali di diffusione di H negli acciai reperibili in letteratura.
Ovviamente la solubilità dell’idrogeno nel ferro puro presenta notevoli variazioni in relazione alla temperatura e alla fase della matrice ferrosa; come indice di riferimento si può ricorrere alle formule empiriche proposte da Kubaschewski sia per la fase γ sia per la fase α [22]:
• Ferro-α : log(% )=−1.37−0.665 T H • Ferro-γ : log(% )=−1.411−0.46 T H
In entrambe le formule la temperatura è espressa in Kelvin.
Visivamente la dipendenza della concentrazione di idrogeno all’equilibrio dalla temperatura nelle diverse fasi è rappresentata nel grafico in figura 4.2 [23].
1
Figura 4.2 Solubilità dell’idrogeno nel ferro in funzione della temperatura e struttura.
4.2 Teoria della diffusione di idrogeno negli acciai
Il comportamento dell’idrogeno negli acciai si discosta notevolmente da quello osservato in una matrice di ferro puro.
Ciò è facilmente comprensibile se si tiene conto dell’elevato grado di imperfezioni che si riscontrano in una lega rispetto al caso del metallo puro. Infatti la diffusività, in quanto rappresenta nel nostro caso la capacità di un elemento di muoversi attraverso una matrice è fortemente influenzata da difetti come dislocazioni, vacanze, bordi di grano, inclusioni di atomi estranei, fasi secondarie, tutti elementi che comportano anomalie e distorsioni nel reticolo cristallino di partenza.
I primi a studiare l’influenza di tali difetti sul fenomeno della diffusione di idrogeno negli acciai furono Darken e Smith [24], i quali attribuirono a questi ostacoli il nome generico di trappole (Hydrogen traps).
Dal punto di vista matematico lo studio fu portato avanti da Mc Nabb e Foster [25], i quali proposero le prime relazioni capaci di spiegare l’intervento delle trappole nei meccanismi di diffusione all’interno del metallo.
Sulle equazioni di Mc Nabb e Foster è stato succesivamente costruito il modello che ancora oggi viene applicato, proposto da Oriani [26] basandosi sull’ipotesi dell’equilibrio locale. E’ un modello di carattere statistico che arriva a determinare un certo numero di parametri volti a spiegare il fenomeno dell’intrappolamento partendo dai risultati ottenuti dalle prove sperimentali di permeazione. Tali parametri sono appunto l’energia di intrappolamento, la densità dei siti di trappola e la concentrazione di idrogeno intrappolato. Questi devono essere riferiti ai valori che si avrebbero nel reticolo in assenza di trappole,indicati quindi col pedice L (lattice): reperibili in letterartura sono proprio, nel nostro caso di studio degli acciai,quelli relativi al ferro puro .
Nella ferrite i siti disponibili per l’idrogeno in posizione interstiziale sono due, il normale sito ottaedrico e quello tetraedrico, raggiungono un valore NL=5.23
*1023 siti/cm3 reperibile in letteratura. Quindi indicando con DL il coefficiente di
diffusione nel ferro puro possiamo esprimere secondo la legge di Fick il flusso a regime stazionario: dx dC D J L L − =
Per quanto riguarda gli acciai conviene comunque far riferimento ai dati effettivi ottenuti durante le prove di permeazione, quindi considereremo il coefficiente effettivo di diffusione Deff e la concentrazione totale di idrogeno (ossia la somma
delle concentrazioni di quello “intrappolato” e quello diffusibile).Quindi avremo:
L T eff C C C dx dC D J + = − =
Allo stazionario (condizione J=0) e anche durante la diffusione c’è equilibrio tra le trappole presenti nel materiale e l’idrogeno che diffonde. Le relazioni che esprimono quest’equilibrio furono trovate da Darken e Smith, i quali definirono una costante K (fisicamente è il rapporto ax/aL, tra l’attività dell’idrogeno nello specifica trappola e quella di riferimento nel reticolo).
(
)
⎥⎦⎤ ⎢ ⎣ ⎡ − = T T L n n n K 1 1dove nT e nL rappresentano rispettivamente le frazioni di trappole e siti
interstiziali disponibili occupati. Attraverso poche sostituzioni si arriva facilmente ad un’espressione che metta in relazione il coefficiente effettivo di diffusione ricavato sperimentalmente con la presenza di trappole nel metallo e il loro livello di occupazione: C dC D D N n C N n C L L eff T T T L L L = = =
(
)
L T(
T)
L L L L L T L eff n C C C KC N K N ND
D
D
⎥ = + − ⎦ ⎤ ⎢ ⎣ ⎡ + + = − 1 ( 1 1 2Nel caso in cui nT<<1 (bassa occupazione delle trappole) avremo:
T L L eff C C D D = poiché C CT ;
mentre nel caso in cui sia arrivi a saturazione (nT=1) avremo un comportamento
analogo a quello in assenza di trappole:
L
eff D
D = poiché C CL
Questa è la condizione in cui tutte le possibili posizioni per l’idrogeno offerte dalle trappole irreversibili sono state occupate, quindi l’idrogeno si trova nelle condizioni di diffusione reticolare.
4.2.1 Trappole
A questo punto è chiaramente necessaria una specificazione sulla natura e il comportamento delle trappole. Infatti, una volta accertato che queste consistono nei difetti presenti nel materiale, è altresì vero che esistono differenti classificazioni possibili, che le differenziano per un aspetto o per un altro.
La prima considerazione va fatta sull’interazione tra la particolare trappola e l’atomo di idrogeno. Infatti quando un atomo di idrogeno passa da un normale
sito di diffusione in una trappola, la probabilità di tornare in questo o in altro sito identico è diminuita. L’effettiva influenza su tale probabilità va analizzata in termini di “energia di salto”, legata alle posizioni iniziale e finale o legata alle distorsioni reticolari presenti. Quindi i difetti del reticolo che vanno a costituire le trappole vanno differentemente classificati in base al loro comportamento.
• Reversibilità e irreversibilità
Una classificazione utile invece, dal punto di vista concettuale e anche matematico, può essere fatta considerando gli effetti prodotti dalle trappole sulla permeabilità dell’ idrogeno nel metallo.
Infatti se consideriamo la solubilità come una caratteristica, misurabile, relativa al sistema idrogeno-acciaio, possiamo individuare una dipendenza precisa di questa proprietà fisica del materiale, dal numero di trappole che sono presenti e soprattutto dal tipo di comportamento, reversibile o irreversibile, che queste presentano nei confronti dell’atomo di idrogeno.
La reversibilità di una trappola esprime la probabilità che un atomo di idrogeno ha di uscirne, in condizioni ben definite di pressione e temperatura [27,28]. Chiaramente il discorso da fare è di tipo energetico: da una trappola attrattiva l’H può facilmente uscire perché deve compiere un piccolo salto energetico, quindi la probabilità che l’evento si verifichi è alta; al contrario l’atomo di idrogeno sarà energeticamente favorito a restare in una trappola fisica .
Quindi generalizzando, ci sono delle trappole che, in certe condizioni saranno irreversibili e conservano l’H, mentre altre si comportano in maniera completamente reversibile. Qui il ruolo giocato dalla temperatura è fondamentale: poiché questo parametro è legato direttamente all’energia vibrazionale dell’atomo esso incide anche sulla capacità che ha l’idrogeno di spostarsi dalla posizione che occupa nel reticolo compiendo un salto energetico. Maggiore sarà tale energia termica, più possibilità avrà l’idrogeno di uscire anche da una trappola irreversibile o comunque ci sarà sempre un valore di temperatura superato il quale l’energia di legame dei vari tipi di trappole, o dei normali siti, diventano paragonabili rispetto alla possibilità (e quindi probabilità) che l’atomo di idrogeno avrà di uscirne. Perciò ha senso parlare di
reversibilità e irreversibilità solo relativamente alla temperatura a cui analizziamo il campione, e comunque bisogna considerare che oltre un certo valore di T tutto l’idrogeno presente nell’acciaio diventa diffusibile.
A questo si riallaccia il concetto di saturazione delle trappole, fondamentale per quanto riguarda l’interpretazione dei risultati delle prove di permeazione attraverso le membrane metalliche.
Per la sua definizione una trappola reversibile ha, allo stazionario, una quantità di idrogeno intrappolata che è in equilibrio con l’H diffusibile nel materiale. Questo non vale invece per una trappola irreversibile, che presenta una concentrazione, allo stazionario, indipendente dalla concentrazione dell’H diffusibile, e che può essere satura se la quantità di idrogeno presente è sufficiente.
Le relazioni tra trappole reversibili e irreversibili e gli equilibri energetici che giocano nel fenomeno del trapping sono studiate attraverso i risultati sperimentali delle prove di permeazione e hanno un ruolo fondamentale nell’ infragilimneto da idrogeno negli acciai.
Infatti, richiamando il concetto di concentrazione critica, il valore dell’idrogeno intrappolato è determinante per l’innesco di una cricca. Abbiamo visto però che la quantità di idrogeno che una trappola è in grado di trattenere dipende dal tipo di trappola: una trappola reversibile è considerata una sorgente capace di rilasciare l’idrogeno in essa situato, mentre una irreversibile è come un pozzo, almeno sotto un limite di temperatura di circa 150°C.
Il ruolo quindi giocato dalle trappole reversibili dipende da un certo numero di parametri e soprattutto dal modo di trasporto dell’H attraverso il reticolo, e tutto ciò viene considerato nello studio del meccanismo di diffusione dell’idrogeno attraverso gli acciai [29].

![Figura 2.3 Efficienza di diversi inibitori in funzione della concentrazione di utilizzo [18]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7245967.80170/23.892.178.713.570.910/figura-efficienza-diversi-inibitori-funzione-concentrazione-utilizzo.webp)