3. L’unità filtrante del rene: il glomerulo
Il glomerulo renale consiste di un insieme compatto di capillari glomerulari tra loro
interconnessi, detto glomerulo o capillare glomerulare, circondato dalla capsula di
Bowman. La barriera di filtazione esistente a livello del corpuscolo renale e che
tutte le sostanze devono attraversare consiste di tre strati: l’endotelio del capillare
glomerulare, una membrana basale piuttosto spessa e un monostrato di cellule
epiteliali. L’endotelio dei capillari è perforato da numerose “ fenestrae” ed è una
struttura permeabile a qualsiasi soluto all’interno del sangue. La membrana basale
presente nella porzione intermedia è una struttura gelatinosa costituita da
glicoproteine e proteoglicani. Le cellule epiteliali disposte al di sopra della
membrana basale, dette podociti, fronteggiano lo spazio di Bowman (fig.2).
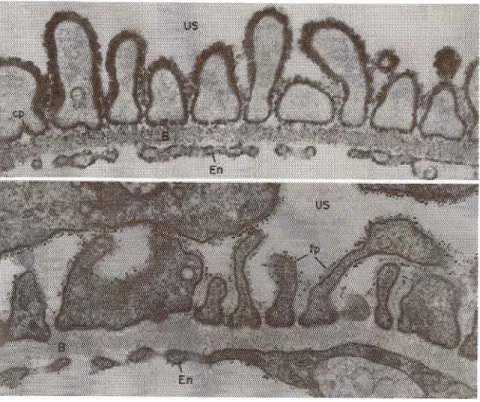
I podociti hanno una struttura tentacolare, detta pedicello o processo pediccellare; si
estende da ciascun braccio del podocita e si inoltra all’interno della membrana
basale. I pedicelli di vari podociti sono tra loro interdigitati. Gli spazi esistenti tra
pedicelli adiacenti costituiscono la struttura che il filtrato glomerulare, una volta
attraversato l’endotelio vasale e la membrana basale, deve attraversare per portarsi
Fig. 2 - Struttura del glomerulo. Immagini al microscopio elettronico della struttura del glomerulo. US: spazio di Bowman; B : membrana basale; En: endotelio; fp: processi pedicellari. Sono visibili l’epitelio fenestrato, la membrana basale ed i processi pedicellari.
I processi pedicellari sono rivestiti da uno spesso strato si sostanza extracellulare
che occlude parzialmente i diaframmi esistenti tra i pedicelli. Il significato
funzionale di questa disposizione anatomica è quello di permettere la filtrazione di
notevoli quantità di fluidi dai capillari verso lo spazio di Bowman.
3.1 Il poro glomerulare – caratteristiche strutturali e funzionali
3.1.1 Permeoselettività glomerulare
E’ fondamentale che il filtro rimanga integro affinché le proteine non oltrepassino
la barriera di filtrazione. Sono disponibili molti dati riguardo la struttura e la
biochimica di questo filtro [4, 5]. Una piccola molecola come l’inulina (5,2 KDa,
prima di raggiungere lo spazio di Bowman. La prima è rappresentata dalle fenestrae
dell’endotelio capillare (diametro 10 nm). La successiva è la membrana basale
(300-400 nm) che è suddivisa in tre strati: lamina rara interna, lamina densa e
lamina rara esterna. L’ultrastruttura di questa membrana basale è nota [6]. Fra la
lamina rara esterna e lo spazio di Bowman si interdigitano i processi pedicellari dei
podociti. Questi processi epiteliali sono parzialmente incastonati nella lamina rara
esterna. Tra un processo pedicellare e l’altro vi sono fessure di 30-60 nm velate da
una sottile membrana che possiede fessure di 4-14 nm di diametro attraverso le
quali passano le molecole per raggiungere lo spazio di Bowman [7].
3.1.2 Struttura della membrana glomerulare
In base alle dimensioni dei pori, la membrana basale è la prima barriera che si
oppone alla filtrazione delle proteine plasmatiche più grandi di 40-50 Å.
Comunque, la dimensione delle molecole non è l’unica caratteristica da considerare
ed inoltre, la membrana basale non è solo una barriera di filtrazione. Il contributo
dei processi pedicellari e dei loro diaframmi alla filtrazione non è del tutto chiaro.
La distanza tra i vari pedicelli è sufficiente a non impedire il passaggio delle
proteine; tuttavia sono rivestiti da sostanze che portano una carica netta negativa e
questo potrebbe essere d’ostacolo al passaggio delle proteine cariche
negativamente.
Infine, le proteine plasmatiche che raggiungono le cellule epiteliali possono essere
rimosse da queste cellule per pinocitosi. Effettivamente, un rivestimento epiteliale
integro sembra essere necessario per ostacolare il movimento delle proteine
completamente chiaro. La perdita di questo rivestimento consente il passaggio di
queste molecole attraverso la membrana basale. Quindi è stato proposto che la
funzione integra di tutti gli elementi strutturali della parete capillare glomerulare sia
fondamentale per impedire l’insorgere della proteinuria [4].
3.1.3 Ruolo della dimensione e della configurazione delle molecole
La dimensione, configurazione e deformabilità sono determinanti critici per il
trasporto di macromolecole attraverso la parete capillare glomerulare [4]. Agli
estremi, piccole molecole come l’inulina vengono liberamente filtrate mentre le
grandi molecole come le globuline (es. la gamma-globulina, raggio 61 Å) sono
virtualmente escluse dal filtrato glomerulare. Fra questi due estremi, la clearance
frazionale ha una proporzionalità inversa rispetto all’effettivo raggio delle
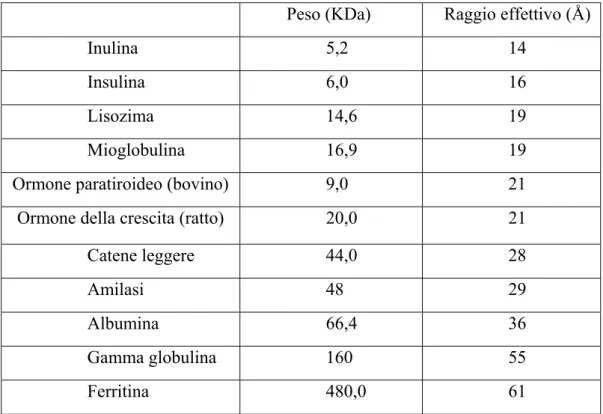
Nella seguente tabella sono riportati il peso molecolare ed il raggio effettivo di
alcune proteine.
Peso (KDa) Raggio effettivo (Å)
Inulina 5,2 14
Insulina 6,0 16
Lisozima 14,6 19
Mioglobulina 16,9 19
Ormone paratiroideo (bovino) 9,0 21
Ormone della crescita (ratto) 20,0 21
Catene leggere 44,0 28
Amilasi 48 29
Albumina 66,4 36
Gamma globulina 160 55
Ferritina 480,0 61
Tab. 1 Peso molecolare e raggio effettivo d’inulina e di alcune proteine
La permeabilità glomerulare è stata cimentata con destrani neutri. Questo polimero
è inerte e non viene eccessivamente secreto né riassorbito, possiede un raggio
effettivo minore di 18 Å ed è liberamente filtrato. La clearance della maggior parte
dei destrani neutri decresce, seppur non linearmente col crescere delle dimensioni
Clear a nce fr azionata (C d / C in )
Raggio effettivo del soluto (Å)
Fig. 3 – Clearance frazionata dei destrani neutri e solfati. La clearance frazionata dei destrani è da considerare in rapporto a quella dell’inulina, che è massima, per cui in ordinate abbiamo numeri cardinali e non “misure”.
fino ad una dimensione di 42 Å; destrani di questa dimensione e più grandi non
vengono filtrati [9]. Altri risultati da esperimenti di questo tipo indicano che il
limite dei pori è di 40-50 Å di raggio.
3.1.4 Influenza della carica nel trasporto delle macromolecole
L’osservazione che la maggior parte dell’albumina non passa attraverso la barriera
di filtrazione suggerisce che ci siano altre caratteristiche, oltre alla dimensione, ad
entrare in gioco nella barriera di filtrazione glomerulare. La carica è un elemento
fondamentale. Attraverso l’utilizzo di traccianti e di speciali coloranti policationici
come il ferro colloidale, l’alcian blue, il rosso di rutenio e il lisozima si dimostra
che alcuni siti all’interno della barriera di filtrazione possiedono cariche negative
[10-12]. In effetti, ci sono evidenze convincenti circa l’importanza di queste cariche
sulle proprietà di trasporto della barriera di filtrazione. Tutti gli strati della barriera
dell’endotelio sono ricoperte di acido sialico ed eparan solfato poliglicano, un forte
polianione [4]. Quest’ultimo è anche una componente integrale della membrana
basale ed è responsabile della carica elettrica negativa di questa struttura [10-13]. In
un modello di nefropatia membranosa, una minor carica effettiva dell’eparan
solfato determina una maggiore permeabilità glomerulare [14]. Anche i pedicelli
sono rivestiti di glicosialoproteine [15-17]. La più abbondante, la podocalixina, è
stata caratterizzata; sembra che anche questa proteina contribuisca a conferire la
carica negativa che mantiene l’integrità dei pedicelli e dei loro diaframmi [18, 19].
L’importanza delle cariche negative a vari livelli della parete capillare glomerulare
nell’ostacolare il passaggio delle proteine è stato studiato con destrani anionici e
cationici. In confronto alla frazione di escrezione del destrano neutro, l’escrezione
di vari tipi di destrano dalla dimensione comparabile è considerevolmente inferiore
per il destrano anionico (destran solfato) e considerevolmente maggiore per il
destrano cationico (dietilamminoetil destrano) [20-21]. Questa relazione è valida
per raggi effettivi compresi tra 18 e 40 Å mentre oltre questo intervallo l’effetto
della carica sulla clearance tende a scomparire [4]. Non è chiaro se l’aumento di
clearance per le specie cationiche sia solo dovuto alla carica. Per esempio,
l’infusione di esadimetrina, un policatione, comporta l’escrezione di grosse
molecole sottintendendo un aumento della dimensione funzionale dei pori [22].
3.1.5 Effetti emodinamici
I cambiamenti emodinamici possono influenzare direttamente il trasporto delle
proteine attraverso la barriera glomerulare. Un flusso normale o aumentato
macromolecole. In queste condizioni non passano attraverso le finestrae né
l’albumina né le IgG [23]. Invece, se il flusso si riduce, la clearance dell’albumina
e dei destrani ad alto peso molecolare aumenta molto [24-26]. Durante questa fase
l’albumina raggiunge lo spazio di Bowman [23, 27, 28]. Il meccanismo che porta a
questo aumento di permeabilità non è del tutto chiaro. Un ridotto flusso altera anche
l’equilibrio ormonale locale. Alti livelli di angiotensina causano un aumento del
flusso attraverso grandi pori non selettivi e quindi proteinuria [29]. Anche gli
eicosanoidi possono influenzare la permeabilità della barriera glomerulare
direttamente o tramite l’alterazione dell’emodinamica glomerulare [30].
Qualunque sia il meccanismo, cambiamenti nel flusso possono influenzare la
capacità di filtrazione glomerulare.
3.2 Un modello matematico che simula la selettività della filtrazione del poro glomerulare
W. M. Deen e collaboratori [31] ci suggeriscono un modello di poro glomerulare
che giustifica la selettività delle molecole da filtrare. Questo modello evidenzia tre
parametri fondamentali: due di questi riguardano le molecole da filtrare e sono la
distribuzione di carica di esse e la loro relativa idrofilicità; il terzo parametro
riguarda i pori ed in particolare la loro forma e dimensione globale. Più
precisamente, essi hanno sviluppato un modello dapprima isoporoso, ovvero con i
pori tutti della stessa grandezza ed uniformità di carica e in un secondo momento ad
eteroporo, cioè dove i pori presentano sia una forma e una grandezza eterogenea che
una diversa distribuzione delle cariche negative esposte verso il lume di ogni poro.
Lo scopo fondamentale di questo modello è quello di spiegare la selettività della
filtrante che come molecola da filtrare il destrano, un polisaccaride della famiglia
delle cellulose, per cui esso non presenta cariche ma è un poli-olo, cioè presenta più
gruppi OH con funzione alcolica. Nella funzione filtrante essi fungono da setaccio
molecolare nelle diverse colonne cromatografiche di cui gli stessi autori fanno uso.
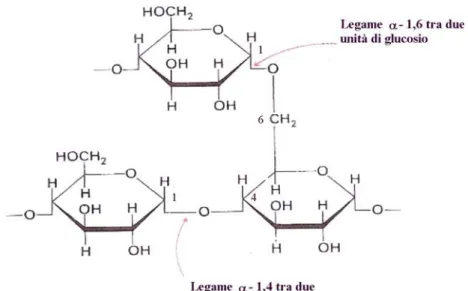
Inoltre, i vari tipi di destrani sono polisaccaridi con funzioni di deposito che si estraggono da alcuni lieviti e dai batteri [32] che contengono solamente unità di α-glucosio i cui residui sono legati insieme, quasi esclusivamente, da legami
glicosidici α-1,6 e presentano poche ramificazioni di tipo α-1,2 , α-1,3 o α-1,4 a seconda della specie.
La formula chimica generale del destrano è [C6H10O5]n , dove n è il numero di unità
di α−D-glucosio che si ripetono nei vari tipi di questi polisaccaridi; i loro pesi molecolari relativi (Mr) variano da 1,5 KDa ad oltre 500 KDa, a seconda del numero
dei residui di glucosio e dalla quantità di ramificazioni che compongono i destrani.
Gli autori hanno impiegato destrani neutri, aventi un raggio compreso tra 26 e 58 Å,
come molecole da filtrare; inoltre viene impiegato come molecola da filtrare il
destrano-40 che ha un peso molecolare intorno a 40 KDa [31]; preparano, per
simulare la filtrazione glomerulare, colonne cromatografiche con Sephacryl S-300 e
il destrano blue (Blue Dextran, PM ~ 2000 KDa) come sostanza filtrante; il
Sephacryl, in generale è una resina composta da una miscela di destrani e
acrylamide. Significa che i vari destrani, come molecole da filtrare, sono stati sintetizzati per successiva polimerizzazione dell’α-glucosio in modo variabile a seconda della dimensione della molecola che volevano ottenere, tenendo presente
che i destrani di più ampio raggio (55-60 Å ) presentano un maggior numero di
Fig. 4. Struttura base del destrano. I legami rappresentati dalle frecce rosse sono quelli comuni a tutti i tipi di destrani e quelli maggiormente presenti.
Nella figura 4 il destrano presenta il legame glicosidico α-1,6 e una ramificazione di tipo α-1,4; gli altri tipi di destrani presentano tutti una serie di legami glicosidici α-1,6 lineari, ramificazioni α-1,4 in minor numero dei legami lineari α-1,6 e inoltre ramificazioni o di tipo α-1,2 o di tipo α-1,3 , a seconda della grandezza e della lunghezza delle catene glicosidiche che compongono i vari tipi di destrani [31].
Nello spiegare questo modello, essi adottano tecniche di clearance dei destrani
differenti e il modello che inizialmente rappresentava meglio la selettività della
grandezza dei pori glomerulari sembrava essere quello che idealizza la barriera di
filtrazione come una membrana isoporosa, cioè fatta da pori tutti uguali e a forma
cilindrica, aventi un raggio di 50Å e assumono che le molecole che devono essere
filtrate siano tutte uguali. Questo approccio sembra essere utile per capire i dati di
nefropatici e anche negli organismi umani con minimi cambiamenti di nefropatia
[31].
Si osservava che la clearance frazionata dei destrani (clearance dei destrani relativa
a quella dell’inulina), nei pazienti proteinurici gravi, tendeva ad aumentare per i
destrani più grandi di 45 Å di raggio e spesso diminuiva per quelli più piccoli, se
confrontati con quelli negli individui sia affetti da una grave glomerulopatia che
non [33]. In fisiologia, si definisce la clearance come volume del plasma che il rene
è capace di depurare completamente nell’unità di tempo; solitamente la clearance ci
dà un’idea di quanto i reni siano efficienti e come valore di riferimento si usa la
clearance dell’inulina, che in termini assoluti corrisponde alla GFR; l’inulina è un
polisaccaride complesso simile al destrano ma ha, generalmente, una massa e una
dimensione più piccola; viene presa come riferimento in questo modello di
filtrazione ma anche nella fisiologia renale classica in quanto essa viene
completamente filtrata e la sua clearance viene, perciò, considerata del 100%.
Questo ha suggerito che il selettivo aumento di clearance nella filtrazione con
destrani più grandi potrebbe essere spiegata dalla necessità di un secondo tipo di
modello e quindi di pori, relativamente pochi in quantità ma di più grande misura:
si tratterebbe, quindi, della necessità di un modello ad eteroporo che possa spiegare
3.2.1 Modello ad isoporo
Nel modello ad isoporo il glomerulo viene rappresentato come un numero di
capillari uguali, in parallelo all’uniformità della circonferenza o delle proprietà di
permeabilità che possiedono nella loro lunghezza [31].
In questo modello vengono effettuate delle equazioni differenziali di bilanciamento
di massa per la determinazione delle varie concentrazioni e delle distribuzioni del
flusso lungo il capillare il quale viene mediato e usato nella predizione dell’intera
composizione del filtrato. Sia le variazioni in concentrazione radiale all’interno di
un capillare che la diffusione assiale si assume siano trascurabili. In queste
condizioni di lavoro, le equazioni di conservazione dello stato stazionario per
volume, proteine plasmatiche, macromolecole test (destrani) sono date
rispettivamente da:
1) dQ/dy = -SJv
2) d(QCP)/dy = 0
3) d(QCi)/dy = -SJi ,
dove:
S è l’area superficiale del capillare; Q è la velocità di flusso plasmatico; Jv rappresenta il flusso del volume;
CP è la concentrazione delle proteine totali;
Ci e Ji sono rispettivamente la concentrazione del soluto i e il volume del flusso del
soluto i (destrano);
Le equazioni differenziali sopra scritte danno un’idea delle variazioni a livello
glomerulare della velocità del flusso plasmatico, della concentrazione delle proteine
totali e di quella del soluto i (destrano); si deve notare che lungo il capillare la
velocità del flusso plasmatico diminuisce in relazione all’area superficiale del
capillare moltiplicata scalarmente per il flusso del volume, il cui prodotto dà come
risultato il valore di un flusso; così pure diminuisce la velocità del flusso plasmatico
moltiplicata scalarmente per la concentrazione del soluto i (destrano). Questo è
evidente dalle equazioni 1) e 3) mentre l’equazione 2) dice che la variazione della
velocità del flusso plasmatico moltiplicata scalarmente per la concentrazione delle
proteine totali non varia (derivata pari a zero) lungo il cammino di un qualsiasi
capillare glomerulare [31]. I parametri presi in considerazione nelle equazioni
differenziali 1-3, insieme al parametro QA (velocità del flusso plasmatico afferente)
servono per far vedere l’andamento del volume del flusso (Jv) nel plasma lungo un
Fig. 5. Variazione teorica del flusso del volume ( Jv ) lungo il capillare (y); sono riportati due
valori della velocità del flusso plasmatico afferente ( QA ); per “esatto” e “approssimato” si intende
calcolato precisamente (esatto) oppure facendo nei calcoli molte approssimazioni, talvolta non proprio trascurabili.
L’approssimazione usata per la concentrazione lungo il capillare di una
macromolecola campione è basata sul fatto che il grado al quale Ci(y) aumenta è
strettamente correlato al flusso del volume che invece diminuisce lungo il capillare
in modo inversamente proporzionale.
Il confronto tra i valori di Ci(y)/CiA calcolati usando le equazioni “approssimate” e
quelli ottenuti da soluzioni numeriche di equazioni “esatte” di bilancio di massa e di
Fig. 6. Variazione teorica della concentrazione plasmatica del soluto i (Ci ) lungo la posizione
del capillare (y). La concentrazione del soluto i è espressa in funzione di quella del medesimo ma afferente, ovvero il capillare che entra nel complesso glomerulare; il soluto i ha un raggio ri= 30 Å
mentre il poro si assume di raggio r0 = 50 Å.
Il rapporto tra la concentrazione media del soluto i nello Spazio di Bowman e quella
del plasma afferente (CiA), basata su un particolare poro di raggio r0 è chiamata
θi(r0) ed è data da: θi(r0) = 1/CiA ( ∫0 1 Ji dy / ∫ 0 1 Jv dy) , dove:
Ji è il volume del flusso del soluto i (destrano),
Jv è il flusso del volume,
L’equazione sopra scritta si risolve secondo un ben preciso modello matematico
supponendo anche che, secondo il modello dell’isoporo, la posizione normalizzata
lungo i capillari (y) sia compresa tra 0 e 1.
Il rapporto dei due integrali dà come risultato un numero ma i singoli integrali si
possono calcolare come aree dei grafici delle figure 5 e 6 sopra riportate.
E’ stato usato il modello ad isoporo con ri = 30 Å e r0 = 50 Å e con altri dati per un
singolo nefrone, come in figura 5. Alla più bassa velocità di flusso, il calcolo
approssimato sovrastima un po’ Ci(y) ma in entrambi i casi la concordanza è
ragionevole.
3.2.2 Modello ad eteroporo
Viene esteso il modello dell’isoporo ad uno eteroporoso nel tentativo di spiegare
meglio le proprietà funzionali della barriera di filtrazione glomerulare perché
veniva osservato che per destrani neutri con raggio compreso tra 45 e 50 Å si aveva
un aumento della loro clearance e diminuiva per i destrani inferiori ai 45 Å di
raggio.
Per estendere il modello presentato sopra e comprendere una distribuzione di raggi
di poro, distribuzioni di probabilità di g(r) e di Ω (r) sono definite come seguono:
g(r) dr = frazione del numero totale dei pori aventi raggio tra r e (r + dr) ;
Ω(r) dr = frazione del volume del filtrato che passa attraverso i pori di raggio compreso tra r ed (r + dr).
E’ stato assunto che queste funzioni di distribuzione siano indipendenti da y; cioè,
qualsiasi posizione lungo il capillare. Così che, la derivazione può essere la più
generale possibile; saranno ammessi, così, tutti i valori dei raggi dei pori
da 0 a . Ecco perché l’equazione seguente contiene un integrale semiaperto,
ovvero dove l’estremo inferiore (minimo) è 0 e quello superiore (massimo) è
∞
∞
.Per calcolare il rapporto tra la concentrazione del filtrato e quella plasmatica per il
soluto i si utilizza la seguente espressione :
θi =
∫
0 ∞Ω(r) θi(r) dr
θi rappresenta la clearance frazionata del soluto i , calcolata o misurata;
Ω (r) dr è la frazione del volume del filtrato che passa attraverso i pori di raggio compreso tra r e (r + dr);
θi(r) rappresenta la clearance frazionata del soluto i calcolata per un poro di
raggio r.
L’integrando dell’equazione sopra scritta θi(r) indica la clearance frazionata che dovrebbe essere predetta per il soluto i nel caso di un modello ad isoporo
assumendo r0 = r. Pertanto, l’equazione indica che i contributi delle grandezze
individuali dei pori al globale valore di θi può essere valutato in accordo con il
volume della frazione filtrata ( Ω (r)) che passa attraverso ciascun poro [31].
Anche se non vengono rappresentati grafici di flussi del volume lungo un capillare
né della concentrazione del destrano nel plasma lungo la posizione del capillare,
relativi a questo modello ad eteroporo, risulta evidente che i grafici precedenti (figg.
5 e 6) fittano bene una situazione reale per cui la conclusione è che il tentativo di
3.3 Modello ad isoporo v/s osservazioni cliniche
Attraverso uno studio matematico, che simula la selettività della filtrazione
glomerulare , è stato concluso che il modello ad isoporo può rappresentare meglio
la situazione reale quando le molecole interessate alla filtrazione sono tutte uguali
di dimensione e di distribuzione di carica.
Alcuni clinici come Myers e collaboratori [33] hanno dimostrato che in alcune
malattie renali come la nefropatia diabetica il modello che simula meglio la
selettività della filtrazione glomerulare era quello ad eteroporo. Sono stati fatti
esperimenti andando a misurare parametri come la GFR, la Kf (coefficiente di
ultrafiltrazione) e l’ERPF (flusso effettivo del plasma renale), l’espressione dei
quali ha confermato che il modello eteroporoso è quello ideale per la suddetta
nefropatia. Una cosa simile è stata verificata per le nefropatie Microalbuminuria
[34] e per la epidemica [35].
Nella seguente tabelle vengono riportati i dati delle varie nefropatie e le
Autori Patologie Osservazione
Myers et al.[33] nessuna isoporo
Myers et al.[33] nefropatia diabetica eteroporo
Marre et al. [34] microalbuminuria eteroporo
Ala-Houhala et al. [35] Nefropatia epidemica, Glomerulopatia membranosa
eteroporo
Tab.2 - Modelli a confronto delle relative patologie.
Dai dati esposti nella tabella si può concludere che il modello matematico ad
isoporo ritenuto valido da Deen e collaboratori [31] è valido solo nel caso in cui i
pazienti siano sani e nell’ipotesi che i pori glomerulari siano attraversati da una
serie di proteine normali e non varianti. Nel caso di patologie renali di varia natura,
il modello isoporoso perde la propria validità e il modello che rappresenta meglio le
4.
L’unità del riassorbimento renale: il tubulo
Il tubulo è la parte del nefrone che si diparte dal corpuscolo renale, nelle sue varie
porzioni, è costituito da un monostrato cellulare disposto su una membrana basale.
La parte tubulare del nefrone è costituita da una regione corticale più esterna e una
regione midollare più interna; parte tubulare importante per il riassorbimento di
acqua e soluti sono il tubulo prossimale e l’ansa di Henle.
Le caratteristiche istologiche ed immunocitochimiche di queste cellule variano da
segmento a segmento nell’ambito del tubulo. Una caratteristica comune è la
presenza di giunzioni “tight” tra cellule adiacenti, che permettono un legame fisico
delle cellule tra loro.
4.1 Caratteristiche strutturali e funzionali del tubulo
Una volta avvenuta la filtrazione glomerulare, l’ultrafiltrato passa nel sistema
tubulare dove viene modificato attraverso due processi, il riassorbimento e la
secrezione [4]. Il primo significa rimuovere (in parte o totalmente) una sostanza
che è stata filtrata; secrezione invece, significa aggiungere sostanza al filtrato. La
suddivisione in segmenti del nefrone è basata su differenti caratteristiche di
permeabilità e di trasporto che si traducono in importanti differenze funzionali. In
generale, il tubulo prossimale e l’ansa di Henle, come detto, riassorbono acqua e
soluti mentre i tubuli collettori variano la loro azione a seconda della dieta. Ci
possono essere anche significative differenze all’interno di ciascun segmento,
soprattutto nel tubulo prossimale e nel dotto collettore corticale.
Negli individui sani, la quota di proteine escrete nelle urine delle 24 ore varia da 40
norma. Le proteine che si trovano nelle urine sono un misto fra proteine
plasmatiche che superano la barriera di filtrazione e proteine non plasmatiche che
derivano dai tubuli e dalla parte terminale del tratto urinario.
4.2 Handling renale delle proteine
4.2.1 Proteine urinarie non di origine plasmatica
La principale proteina che si trova nelle urine di un individuo sano e che non è di
origine plasmatica è la uromodulina o proteina Tamm-Horsfall [36, 37]. Si tratta di
una grossa glicoproteina dal P.M. di 7000 KDa che viene escreta in quantità che va
da 20 a 100 mg /die [38, 39]. L’escrezione di questa proteina aumenta di poco nei
pazienti nefropatici [40]. Studi in vitro indicano che l’aggiunta di albumina alla
Tamm-Horsfall portano alla precipitazione di quest’ultima [40]; questo suggerisce
che l’aumento di escrezione dell’albumina potrebbe portare alla precipitazione della
proteina Tamm-Horsfall all’interno dei tubuli con la conseguente formazione dei
cilindri.
La struttura e la funzione di questa insolita glicoproteina è stata estensivamente
riconsiderata. Oltre questa, nelle urine sono presenti anche altre proteine di origine
non plasmatica [36]. Probabilmente queste proteine prendono origine dalla parte
terminale del tratto urinario e dalla prostata. L’endotelina, un vasocostrittore,
potrebbe essere utile come marker, non specifico, della compromissione renale
4.2.2 Proteine plasmatiche di grandi dimensioni
Proteine come le globulina (P.M. 160 KDa, raggio 55 Å) non possono oltrepassare
la membrana basale. Cambiamenti di flusso plasmatico non determinano una loro
presenza nello spazio urinario.
4.2.3 Proteine a basso peso molecolare
Le proteine a basso peso molecolare (<25 KDa o 23 Å) sono così piccole che la loro
carica non influenza molto la loro filtrazione. Sono estensivamente filtrate dai
glomeruli, riassorbite dai tubuli e successivamente degradate dal tubulo prossimale.
Proteine a basso peso molecolare biologicamente importanti e “trattate” dal rene
sono enzimi (lisozima e ribonucleasi), immunoglobuline (catene leggere e β-microglobulina), prodotti della degradazione del fibrin-fibrinogeno e ormoni
(insulina, GH, ormone paratiroideo). La concentrazione tubulare di queste proteine
va dal 50% al 90% della loro concentrazione plasmatica.
Nonostante la grande quantità di proteine a basso peso molecolare che vengono
filtrate, nelle urine ne compare solo una piccola quantità. Le proteine vengono
riassorbite nel tubulo prossimale e idrolizzate in aminoacidi dal sistema lisosomiale
vacuolare. Una piccola quantità di queste proteine viene riassorbita intatta [42, 43].
La capacità tubulare per alcune di queste proteine a basso peso molecolare è
significativamente più alta della quantità filtrata. Per esempio, quando ad un rene
isolato di ratto viene dato lisozima purificato, questo enzima non compare nelle
urine finché non si arriva ad una concentrazione pari a tre volte quella normale [43].
influisce tra il 30% e l’80% sulla clearance metabolica delle proteine a basso peso
molecolare [43].
Le catene leggere subiscono un trattamento simile. I monomeri (P.M. 22 KDa)
vengono liberamente filtrati e successivamente degradati dai tubuli e solo una
modesta quantità di queste proteine compare nelle urine. Invece, dei dimeri (P.M.
44 KDa, raggio 28 Å) ne viene filtrato circa il 10% . La perossidasi del rafano è una
molecola neutra e viene usata come tracciante; ha un peso molecolare simile a
quello delle catene leggere e subisce un trattamento simile ad esse [10, 44].
4.2.4 Albumina
L’albumina, con un peso molecolare di circa 66,4 KDa ed un raggio di 36 Å, merita
una considerazione a parte. A cose normali non può passare nello spazio urinario
per la selettività della barriera di filtrazione. In determinate condizioni, come un
ridotto flusso sanguigno, l’albumina può essere presente nelle urine dimostrando
che la selettività per dimensione, da sola, non è sufficiente ad impedirne la
filtrazione. Piuttosto, sembra che la carica negativa delle varie strutture della
barriera di filtrazione sia il determinante maggiore nell’impedirne la filtrazione.
Fra queste strutture, la più importante nell’impedire che l’albumina oltrepassi la
barriera di filtrazione è la carica negativa della membrana basale [ 8, 9, 44 - 46].
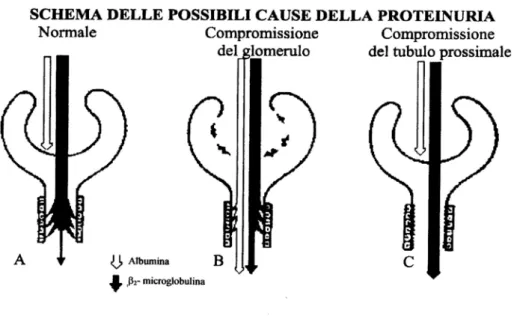
4.2.5 Proteinuria glomerulare
La proteinuria glomerulare è dovuta ad un aumento della permeoselettività della
barriera di filtrazione glomerulare alle proteine plasmatiche. Quindi, la caratteristica
metodi per rilevare la presenza di albumina nelle urine. L’albuminuria può essere
un fenomeno transitorio anche negli individui sani mentre un’albuminuria
persistente è indice di danno renale. Effettivamente l’albuminuria si riscontra nella
maggior parte delle malattie renali. Se il danno principale avviene a livello del
glomerulo o del compartimento tubulointerstiziale, l’albumina arriva ad essere il
60-90% delle proteine urinarie [47, 48]. Se si ha danno renale aumenta la filtrazione
dell’albumina e quindi la sua proteolisi lisosomiale alveolare a livello dei tubuli.
L’escrezione di proteine a basso peso molecolare rimane normalmente basso [49, 50].
Quanto sopra esposto al riguardo dell’insorgere della proteinuria, viene
rappresentato
Fig. 7 - Handling renale delle proteine. Normale: una piccola porzione di albumina viene filtrata, gran parte viene riassorbita ed una piccola parte viene escreta. Patologico: una grande porzione di albumina viene filtrata, nella fase di riassorbimento tubulare le molecole deformi vengono proteolizzate ed una parte viene escreta.
4.2.6 Ruolo dell’Handling tubulare delle proteine
Nonostante che la barriera capillare glomerulare sia relativamente impermeabile
all’albumina, traccianti isotopici e studi di micropuntura dimostrano chiaramente
che una piccola quantità di albumina passa attraverso il glomerulo [51-54]. La
concentrazione media dell’albumina nel tubulo prossimale è 0,6 mg /dl con valori
che in molti campioni sono inferiori a 0,1 mg /dl [53, 55, 56]. Studi sugli umani
danno risultati simili. L’infusione di lisina in soggetti sani inibisce completamente il
riassorbimento di albumina e questo comporta l’escrezione di 500-600 mg /die di
albumina [40]. Questa quantità corrisponde ad un filtrato di 0,3 mg /dl. Il
riassorbimento di albumina filtrata sembra essere limitato al tubulo prossimale [41,
57- 59], ma una piccola quantità di albumina riassorbita dai tubuli torna in circolo
integra [41, 60]. Il sistema vacuolare lisosomiale è responsabile del suo
riassorbimento e della sua degradazione [42]. Dopo somministrazione intravenosa o
iniezione intratubulare di albumina marcata, i vacuoli delle cellule che si trovano
sulla superficie apicale del tubulo prossimale contengono la forma isotopica [41,
59, 60].
Questi vacuoli si muovono all’interno delle cellule e si fondono con i lisosomi che
contengono enzimi proteolitici [60-62]. Questi enzimi che si trovano all’interno
5.
Albumina serica umana (HSA)
L’albumina è una proteina plasmatica presente in assoluto in quantità maggiore
rispetto alle altre ed è quella anche che detiene il primato per quanto riguarda gli
studi su di essa e sulle numerose funzioni che svolge nel siero e a livello renale.
L’HSA viene sintetizzata a livello epatico in quantità che varia da 9 a 12 g al giorno
come prealbumina. A livello del lume del reticolo endoplasmatico la prealbumina
subisce una prima modifica in quanto viene tagliato il peptide segnale composto da
18 residui aminoacidici. La seconda modifica della molecola avviene a livello
dell’apparato del Golgi, con la rimozione del propeptide all’estremità N-terminale,
costituito da 6 residui: precisamente la sequenza del propeptide è
Arg-Gly-Val-Phe-Arg-Arg. Il risultato finale di queste due modifiche che avengono in due
compartimenti distinti della cellula è quello di una molecola matura e pronta a
passare nel circolo sanguigno, costituita da 585 residui aminoacidici. La vita media
dell’albumina matura è di circa 19 giorni. L’insulina, la tiroxina e il cortisolo
interagendo con le cellule epatiche possono influenzare la sua sintesi. La forma
proteica di proalbumina è caratterizzata da una mobilità elettroforetica minore a
causa della dimensione che è maggiore e della minor capacità di legare lo ione Ni2+
5.1 Struttura dell’ albumina
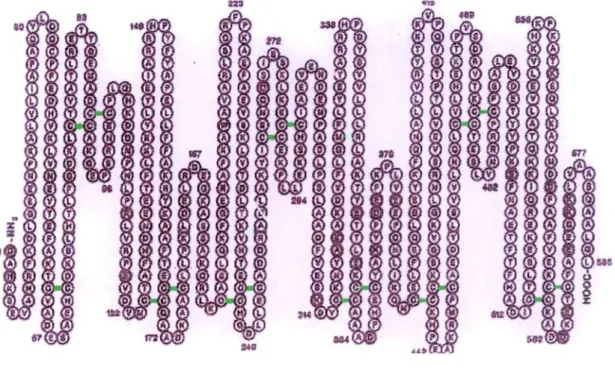
5.1.1 Struttura primaria e secondaria
Il gene che codifica per questa proteina si trova sul cromosoma 4q11-22, si estende
per circa 17000 nucleotidi ed è diviso in 15 esoni, l’ultimo dei quali non viene
tradotto e 14 introni tra un esone e l’altro [63]. Il suo peso molecolare teorico è
circa 66,5 KDa. La composizione aminoacidica dell’albumina umana è la seguente:
essa è composta da 36 Asp, 60 Glu, per un totale di 96 residui strettamente acidi,
che danno alla molecola, ciascuno, una carica netta negativa a pH fisiologico. Gli
aminoacidi basici, che conferiscono a pH fisiologico una carica netta positiva sono
solo la Lys (58) e l’Arg (24), per un totale di 82 residui strettamente basici [64],
mentre l’His, pur essendo considerato un aminoacido basico, ha il pK della sua
catena laterale inferiore al pH fisiologico che giustificaca la carica netta media
dell’albumina, che varia da -12 a -18. Un unico residuo di Trp compare in posizione
214.
L’albumina si organizza in una struttura secondaria fatta di un totale di 28 α-eliche tenute insieme da loops, in motivi ripetuti loop-link-loop e dalla presenza di 17
ponti disolfuro che essa fa grazie alla presenza di 34 residui di Cys ossidati tra loro
in coppie di cistina; inoltre l’albumina possiede un residuo di Cys libero ridotto in
posizione 34, che non fa nessun ponte disolfuro; i ponti disolfuro rendono la
molecola stabile nella sua struttura nativa sotto diverse condizioni di pH, forza
Fig. 8. Rappresentazione schematica classica del motivo loop-link-loop dei domini II e III dell’HSA. In questa figura viene messo in evidenza il motivo loop-link-loop che si ripete in tutta la struttura dell’albumina, mostrando come le eliche sono tenute insieme dai ponti disolfuro. Questo schema di organizzazione vale per un classico dominio dell’albumina ma non per il primo per l’assenza del ponte disolfuro tra h1 e h3.
Nella figura precedente è mostrato solamente lo schema di come le eliche
dell’albumina sono organizzate, evidenziando i motivi loop-link-loop e la posizione
dei ponti disolfuro, tenendo presente che all’interno del dominio 1 non c’è la
presenza del ponte disolfuro tra le α-eliche h1 e h3, a causa della presenza del residuo di Cys 34 che è l’unico residuo di Cys nella forma ridotta. La figura
seguente, invece dà solo un’idea della struttura primaria (sequenza aminoacidica) e
secondaria dell’albumina e fa vedere la posizione di tutti i ponti disolfuro ma la
figura non rende molto bene l’idea delle eliche e dei motivi ad esse connesse,
Fig. 9. Sequenza aminoacidica, organizzazione dei ponti disolfuro nell’HSA. In questa figura è possibile osservare l’interazione tra le varie cisterne (in verde) che si trovano lungo la sequenza.
Tutti i ponti disolfuro sono posizionati in una serie ripetuta di 9 Loop-Link-Loop. I
9 doppi loop formati dai ponti disolfuro possono essere raggruppati in tre domini
omologhi, ognuno dei quali ha tre loop, di cui due più lunghi e uno più corto [65].
5.1.2 Struttura terziaria
L’albumina possiede un livello massimo di organizzazione di struttura terziaria in
quanto è costituita da un’unica catena polipeptidica. Essa è convenzionalmente
suddivisa in 3 domini, ciascuno dei quali è, a sua volta, suddiviso in 2 sotto-domini.
La numerazione dei tre domini omologhi è I, II e III per i domini 1, 2 e 3
rispettivamente: l’I è quello N-terminale e il III è quello C-terminale. All’interno di
ogni dominio i primi due loop (1-2, 4-5, 7-8) appartengono ai sotto-domini IA, IIA
I B, II B e III B. In totale, l’albumina è costituita da 28 α-eliche con un numero di residui che varia da 5 a 31 aminoacidi. Ciascun dominio è formato da 10 α-eliche principali, di cui 6 eliche antiparallele appartengono al sotto-dominio A e 4 eliche
antiparallele appartengono al sotto-dominio B. Le eliche sono nominate e
contraddistinte con la lettera “h”, per cui le eliche h1-h6 appartengono al
sotto-dominio A e le eliche h7-h10 appartengono al sotto-sotto-dominio B.
I ponti disolfuro per dominio sono 6 (4 nel sotto-dominio A e 2 nel sotto-dominio
B), ad eccezione del dominio I, in cui la Cys 34 che appartiene al sotto-dominio I A
non fa ponte S-S ed è l’unico residuo di Cys delle totali 35 che non fa ponte S-S.
Come evidenziato nella la figura 8, la serie classica dei ponti S-S è la seguente: un
ponte tra h1 e h3, un altro tra h3 e h4, un altro tra h4 e h5 e infine, nel
sotto-dominio A, uno tra h5 e h6; mentre nel sotto-sotto-dominio B i 2 ponti disolfuro sono
situati tra h7 e h9 e tra h9 e h10. Tra il sotto-dominio A e quello B relativo ai 3
domini c’è una sequenza aminoacidica più o meno lunga dello stesso numero di
residui che separa i domini: la sequenza Lys 106→Glu 119 separa i
sotto-domini I A-I B; la sequenza Glu 292→Val 315 separa i sotto-sotto-domini II A-II B ed
infine la sequenza Glu 492→Ala 511 separa i sotto-domini III A-III B. Anche i 3
domini hanno più o meno tutti la stessa lunghezza a livello di sequenza
aminoacidica: i residui 1-199 sono nel dominio 1, i residui 200-391 sono nel
secondo dominio e i rimanenti appartengono al terzo dominio. La seguente figura
mette in risalto la struttura tridimensionale dell’albumina, tramite un modello
molecolare che rappresenta la molecola secondo “Homology modeling”, ovvero
viene raffigurata la proteina sapendo la sequenza aminoacidica la quale, essendo
modello che possa, con buona probabilità, assomigliare alla vera forma
dell’albumina stessa, allo stato nativo. Come si può notare, a colore diverso
corrisponde un sotto-dominio diverso e non solo, ma i colori di intensità simili
stanno a significare l’appartenenza dei residui allo stesso dominio.
Fig. 10. Rappresentazione schematica della struttura tridimensionale dell’albumina. A colore diverso corrisponde sotto-dominio diverso: con il blu, in basso, è rappresentato il sotto-dominio IA, il celeste, subito al di sopra, rappresenta il sotto-dominio IB, il verde rappresenta il sotto-dominio IIA, il giallo rappresenta il sotto-dominio IIB, l’arancione rappresenta il sotto-dominio IIIA ed infine con il rosso viene rappresentato il sotto-dominio IIIB. E’ da notare il loop molto lungo di colore verdastro che unisce i sotto-domini IIA e IIB, come quello arancione, in alto, che è il loop che unisce sotto-domini IIIA e IIIB.
5.2 Funzioni, proprietà di legame e stress ossidativi
5.2.1 Funzioni
L’HSA svolge una miriade di funzioni che sicuramente dimenticarne qualcuna sarà
quasi normale. Essa è un trasportatore di acidi grassi, mantiene la pressione
detossifica i tessuti legando metaboliti pericolosi come la bilirubina, un catabolita
dell’eme; inoltre l’albumina fa da serbatoio del NO (monossido di azoto), un
importante e potente vasodilatatore, trasporta gli ormoni steroidei e l’ormone
tiroideo, interagisce con alcuni farmaci tra cui le penicilline, lega alcuni ioni come
Cu2+, Ni2+, Zn2+e Ca2+, quest’ultimo fondamentale nel controllo della contrazione
muscolare; l’HSA è una riserva e un trasportatore di aminoacidi, ha un potere
anticoagulante, mantiene la permeabilità delle membrane ed è il più grande sistema
antiossidante a disposizione dell’organismo. Molto probabilmente le funzioni che
svolge questa proteina così fondamentale non sono tutte e le altre saranno definite
da studi ancora più profondi e sofisticati su tale proteina.
5.2.2 Proprietà di legame e di trasporto
La molteplicità delle funzioni svolte dall’albumina risiedono nella sua grande
plasticità che le conferisce la possibilità dei cambiamenti conformazionali in
relazione ai valori di pH e alle variazioni dei valori di pK dei gruppi ionizzati. La
sua struttura terziaria è mantenuta grazie ai 17 ponti disolfuro dati
dall’accoppiamento delle 34 Cys che permettono anche il tipico ripiegamento di
tale proteina. Dei 3 domini che costituiscono l’albumina, il II e il III sono quelli
maggiormente coinvolti nei legami tra l’albumina e le varie sostanze coinvolte
nell’interazione con essa. Esempi sono gli acidi grassi, la bilirubina, i farmaci; i
composti che reagiscono a livello del primo dominio sono veramente pochi: un
esempio chiave è la reazione alternativa, del NO con il residuo libero di cisteina
(Cys 34), all’interazione degli ioni Ca2+ e Cu2+ con residui istidinici. Per rendere
sia inorganici come il NO, Au+, Ag2+, Cu2+, Ni2+, Co2+, che organici come
l’aspirina, il colesterolo, altri steroidi in generale in un sito, la walfarina, la
bilirubina, le prostaglandine in un altro sito, la cosa migliore da fare è rappresentarli
in due figure distinte. Una figura mette in risalto i principali siti di legame
dell’albumina (fig. 11), l’altra mette in risalto i principali siti di legame degli acidi
grassi con l’albumina, mostrando le differenti conformazioni a confronto tra
l’albumina libera e legata agli acidi grassi.
Fig. 11. Principali siti di legame dell’albumina. In questa figura viene rappresentata la struttura terziaria tridimensionale dell’albumina con i relativi principali siti di legame di essa, tenendo presente che il blu è il sotto-dominio ammino-terminale, IA e il colore rosso, a sinistra, rappresenta il sotto-dominio carbossi-terminale, IIIB.
La figura 12, invece, rappresenta la struttura tridimensionale dell’HSA,
focalizzando esclusivamente i siti specifici per gli acidi grassi, importanti metaboliti
dell’albumina libera confrontata con quella di essa quando sono legate le molecole
di un particolare acido grasso, il miristato.
72 Å 90 Å
Fig. 12. Legame dell’albumina con gli acidi grassi. Conformazioni dell’albumina a confronto: a sinistra l’albumina è in una conformazione nativa quando non è impegnata nel legame con gli acidi grassi; inoltre i vari domini e sotto-domini sono tutti numerati e colorati diversamente. A destra, viene rappresentata la conformazione dell’albumina legata a sei molecole (numerate da 1 a 6) di miristato: si nota la netta diversità di conformazione dell’HSA quando essa è libera e quando, invece, è impegnata nel legame con gli acidi grassi.
E’ stato visto che l’HSA è in grado di legare con affinità piuttosto alte sia molecole
organiche che ioni o molecole inorganiche: questa sua grande capacità di legame la
rende fondamentale dal punto di vista fisiologico, in quanto essa risulta una grande
trasportatrice di sostanze verso il loro sito d’azione o escrezione e inoltre ne modula
l’attività. Attualmente sono stati compiuti numerosi studi sui possibili legami
dell’albumina con coloranti, farmaci, acidi grassi, bilirubina, ormoni (figg. 11 e 12)
e si è confermato il significato fisiologico dell’albumina come molecola
trasportatrice, modulatrice di metaboliti e di farmaci oltre ad una funzione
cattura e la relativa eliminazione dei radicali come ●OH e ●NO2 . Analizzando la
struttura dal punto di vista dei siti di legami specifici per ciascuna molecola
possiamo dire che il sito per l’anticoagulante walfarina è nel dominio 2
sotto-dominio A (II A), quello per la diazepamina è nel sotto-dominio 3, sotto-sotto-dominio A (III
A). Questi due sotto-domini si interfacciano e quando interagiscono con un ligando
si osserva una perturbazione reciproca. Esiste una selettività di tipo enantiomerica
per quanto riguarda la walfarina e sembra che l’albumina abbia una netta affinità
maggiore per l’enantiomero S piuttosto che per l’R. Il sito III A interagisce con
l’ibuprofene, digitossina, triptofano (Trp, W) e con derivati steroidei ed è quindi di
particolare interesse farmacologico poiché ha un’alta affinità anche per piccole
molecole anioniche aromatiche che spesso rappresentano agenti farmacologici. Trp
214, Lys 199 e Tyr 411 sono coinvolti nel legame e sono localizzati all’interno
delle tasche idrofobiche dei sotto-domini II A e III A.
La principale funzione dell’albumina è però quella di trasportare gli acidi grassi:
l’HSA cristallizzata col miristato rivela la presenza di 6 siti di legame per gli acidi
grassi e che in seguito al loro legame subisce un significativo cambiamento
conformazionale. Studi più recenti hanno dimostrato che i siti disponibili per gli
acidi grassi sono 7: tali siti sono specifici sia per acidi grassi saturi di media
lunghezza che per quelli a lunga catena (da C10 a C18). L’albumina però può
legare anche acidi grassi insaturi come l’acido oleico (C18:1), l’acido linoleico