1. Introduzione
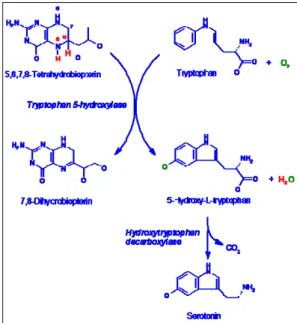
La serotonina (5-idrossitriptamina, 5-HT) è un’amina biogena a basso peso molecolare che appartiene ad un gruppo di composti aromatici, detti indoli, che presentano un anello a cinque atomi contenente azoto, condensato con un anello benzenico. La biosintesi della serotonina prevede come prima tappa l’idrossilazione del triptofano in posizione 5 per formare il 5-idrossi-triptofano (5-HTP) da parte della triptofano idrossilasi (TPH). Questa tappa è la prima del processo ed è quella che regola la biosintesi. Sono note due isoforme di questo enzima con diversa distribuzione nell’organismo: la TPH1 è localizzata prevalentemente nei tessuti periferici, nei fotorecettori dell’occhio e nella ghiandola pineale dove la sintesi di serotonina è funzionalmente correlata alla produzione di melatonina (Green and Besharse, 1994; Walther et al., 2003 ). La TPH2, contrariamente è presente esclusivamente nei neuroni serotoninergici del sistema nervoso centrale (SNC) (Walther et al., 2003; Patel et al., 2004). Il 5-HTP viene decarbossilato dalla 5-idrossi-triptofano-decarbossilasi a 5-HT.
La 5-HT viene poi catabolizzata ad acido 5-idrossi-indolacetico (5-HIAA) per l’azione delle monoaminossidasi a (MAOa) (figura 1).
Tutte le azioni che la serotonina svolge nell’organismo sono mediate da una famiglia di recettori specifici di cui sono note almeno venti forme diverse (Hoyer et al., 1994).
Nel sistema nervoso centrale dei vertebrati la maggior parte dei neuroni che producono serotonina sono localizzati in una ristretta zona dell’encefalo, tra mesencefalo e rombencefalo dove sono raggruppati in nuclei noti come nuclei del raphe; esiste inoltre una piccola popolazione di questi neuroni anche a livello del nucleo dorsomediale ipotalamico.
Nei mammiferi, i nuclei del raphe (denominati B1-B9), compaiono a stadi molto precoci dello sviluppo e sono stati suddivisi in due gruppi in base alla posizione che assumono lungo l’asse rostro-caudale del tronco dell’encefalo (Lidov and Molliver, 1982; Wallace and Lauder, 1983); il gruppo rostrale comprende i nuclei B6-B9 (raphe dorsale, caudale, ventrolaterale), mentre quello caudale comprende i nuclei B1-B5 (raphe magnus, obscurus, pallidus).
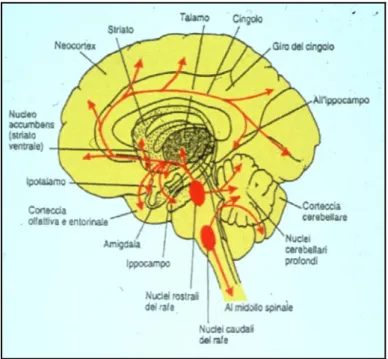
Nonostante il numero totale dei neuroni serotoninergici sia molto ridotto, il sistema che formano si sviluppa in un’ampia innervazione a tutte le aree dell’encefalo e al midollo spinale. I nuclei del raphe rostrale producono delle proiezioni assonali che, principalmente, attraverso il fascicolo prosencefalico mediale, raggiungono numerose strutture mesencefaliche e prosencefaliche come la corteccia cerebrale, l’ippocampo, il diencefalo, i nuclei della base e il cervelletto. Gran parte di queste fibre però non costituisce un contatto sinaptico diretto con i neuroni bersaglio ma, piuttosto, rilascia 5-HT nell’ambiente extracellulare. I nuclei del raphe caudale invece proiettano al midollo spinale dove raggiungono i neuroni pregangliari simpatici, nella colonna intermedio laterale, i motoneuroni somatici e più tardivamente innervano le fibre delle corna dorsali (figura 2).
La serotonina è sintetizzata anche nei fotorecettori della retina, nella ghiandola pineale, e a livello periferico nelle cellule enterocromaffini dell’intestino, nei corpi neuroepiteliali dei polmoni e nelle cellule parafollicolari della tiroide (Gaspar et al., 2003).
Inoltre esistono altri tipi cellulari che, grazie ad una transiente o meno espressione di un trasportatore serotoninergico, possono contenere serotonina senza produrla. Per esempio nei mammiferi, molto precocemente nello sviluppo,
ne è stata riscontrata la presenza a livello del cuore, del mesenchima craniale (Lauder et al., 1988; Shuey et al., 1992) e della notocorda (Wallace, 1982); si suppone però che la serotonina riscontrata in questi distretti sia di origine materna in quanto negli embrioni non sono ancora comparsi i neuroni che la producono.
Più tardivamente nell’embriogenesi, quando i neuroni serotoninergici sono differenziati, si può riscontrare la presenza di 5-HT nel talamo, nella corteccia limbica, nell’ipotalamo, nella retina e nel nucleo olivare superiore (Lebrand et al., 1996, Cases et al., 1998; Upton et al., 1999). Tra le fibre che contengono serotonina senza essere in grado di produrla meritano particolare attenzione quelle che innervano la corteccia sensoriale (D’Amato et al., 1987); infatti queste fibre non originano dai nuclei del raphe ma sono assoni talamo-corticali che contengono 5-HT e che molto probabilmente la internalizzano mediante il trasportatore e la rilasciano usandola come neurotrasmettitore “in prestito” (Lebrand et al., 1996).
Infine nell’organismo adulto si può riscontrare la presenza di serotonina anche nelle piastrine, che la ricaptano dal circolo sanguigno e la rilasciano quando sono attivate.
Figura 2: Rappresentazione schematica delle proiezioni assonali dei neuroni serotoninergici dei nuclei
Il sistema serotoninergico dei vertebrati ha una vastissima distribuzione nel sistema nervoso centrale e influenza quasi tutte le funzioni fisiologiche dei mammiferi, dalla regolazione del sistema cardiovascolare (Myata et al., 2000; Nebigil et al., 2000; Thorin et al., 1990), della respirazione, del sistema gastrointestinale (Kato et al., 1999) alla termoregolazione e molte altre. Inoltre è coinvolto nel mantenimento del ritmo circadiano e nel controllo dell’appetito, dell’aggressività, del comportamento sessuale, dell’umore, dell’apprendimento e della memoria.
Un’alterata regolazione della trasmissione serotoninergica incide su numerosi aspetti comportamentali e può risultare alla base di patologie neuropsichiatriche come ad esempio la schizofrenia, l’ansia, lo stress, la depressione, i disordini alimentari. Per questo motivo, molte sostanze che modulano il sistema serotoninergico sono la base di trattamenti farmacologici per queste malattie.
Inoltre stanno emergendo evidenze di un coinvolgimento di questo neurotrasmetitore in patologie come la sindrome di Down, l’autismo, il morbo di Alzheimer e l’epilessia (Sodhi and Sanders-Bush, 2004).
Le connessioni neuronali del SNC presentano un’enorme plasticità e vengono riarrangiate in base agli stimoli che i neuroni ricevono dall’ambiente che li circonda e questo le rende suscettibili anche a fattori come lo stress, la malnutrizione, i farmaci e gli ormoni. Negli ultimi anni stanno emergendo sempre più elementi che sostengono l’ipotesi che la 5-HT, prima di agire come un neurotrasmettitore importante per l’encefalo adulto, agisca come fattore chiave nella modulazione della plasticità sinaptica e dello sviluppo, sia del sistema nervoso centrale che di altri tessuti.
1.1. Ruolo della serotonina nello sviluppo
embrionale
La serotonina ha un ruolo filogeneticamente antico nella trasmissione neurale e numerosi studi suggeriscono l'idea che i neurotrasmettitori svolgano durante lo sviluppo embrionale un ruolo diverso da quello svolto nel sistema nervoso maturo: essi funzionerebbero come segnali di regolazione nei processi di differenziamento e/o di morfogenesi (Turlejsky, 1996).
E' stato infatti dimostrato che molti neurotrasmettitori sono presenti in stadi molto precoci dell'embriogenesi sia dei vertebrati che degli invertebrati, prima ancora del differenziamento del sistema nervoso. Nonostante il preciso ruolo svolto dai neurotrasmettitori nello sviluppo precoce non sia ancora noto, esistono evidenze a favore di un loro coinvolgimento nel controllo delle divisioni cellulari, nei movimenti morfogenetici durante la segmentazione e la gastrulazione, nella chiusura del tubo neurale e come segnali differenziativi per neuroni bersaglio durante la neurogenesi precoce (Lauder et al., 1993; Buznikov et al., 2001; Nguyen et al., 2001)
Il primo dato a favore di questa ipotesi è che tra i sistemi monoaminergici, quello serotoninergico è il primo a comparire nell’embriogenesi precoce a cui si aggiunge il fatto che proprio in questa fase la 5-HT raggiunge i suoi più elevati livelli di concentrazione (Hamon and Bourgoin, 1979).
Molti fattori di crescita che influenzano lo sviluppo del sistema serotoninergico sono anche importanti negli eventi di plasticità sinaptica. Tra questi, quello più studiato è il fattore di crescita astrogliale, S100β, i cui livelli sono aumentati dalla 5-HT, a prova del fatto che i neuroni serotoninergici possono regolare la loro stessa crescita oltre a quella dei loro “targets” (Whitaker-Amitia, 2001).
Il sistema serotoninergico è anche in grado di autoregolare il proprio differenziamento attraverso l’attivazione del recettore 5-HT1A, del “brain-derived
neurotrophic factor” (BDNF) e il suo recettore trkB (Sodhi and Sanders-Bush, 2004).
Il rilascio di 5-HT dai terminali sinaptici può influenzare i processi di neurogenesi (Lauder and Krebs, 1976), di apoptosi, di rifinimento dendritico, di migrazione cellulare, e plasticità sinaptica (Chubakov et al., 1986; Lauder, 1990). La combinazione di questi eventi dà origine alle sofisticate organizzazioni dell’ippocampo e delle mappe della corteccia somatosensitiva.
Più tardivamente nello sviluppo, invece, la 5-HT regola la crescita dendritica, la formazione delle spine dendritiche e le arborizzazioni (Faber and Haring, 1999).
Il ruolo della serotonina nello sviluppo è stato studiato con approcci diversi. Uno di questi è l’inibizione della sintesi di 5-HT somministrando paraclorofenilalanina (PCPA), un composto che agisce bloccando la triptofano idrossilasi. In seguito a questo trattamento si osserva un aumento delle sintasi dell’ossido nitrico nel corpo calloso, nello striato e nell’ippocampo che mette in evidenza l’esistenza di una stretta relazione tra il sistema serotoninergico e quello nitrergico durante lo sviluppo (Ramos et al., 2002). Questo dato risulta interessante alla luce del fatto che anche per l’ossido nitrico è stato ipotizzato un ruolo nella regolazione della plasticità sinaptica. Inoltre da questi studi emerge che la corretta densità di spine dendritiche dell’ippocampo e del raphe dipende strettamente dalle proiezioni serotoninergiche in queste aree (Alves et al. 2002).
E’ stato ipotizzato che parte dell’azione di questa amina nella plasticità neuronale si esplichi attraverso il controllo dell’espressione di molecole di adesione cellulare quali le PSA-NCAM, che negli organismi presi in considerazione risultano notevolmente ridotte (Brezun and Daszuta, 1999).
In ratti a cui la PCPA viene somministrata subito dopo la nascita, mediante iniezione nella regione lombare, è possibile osservare come la deplezione di 5-HT influisca sulla maturazione dei neuroni motori; infatti questi animali riportano disfunzioni posturali probabilmente dovute ad un arresto dello sviluppo di questi motoneuroni (Pflieger et al., 2002).
Un altro approccio sperimentale molto utilizzato è la generazione di topi “knock-out” (KO) per alcuni dei geni coinvolti nello sviluppo e/o nella funzionalità del sistema serotoninergico. Dallo studio del topo “knock-out” per la
monoaminoossidasi A (Maoa), l’enzima responsabile della degradazione della 5-HT, sono emersi molti dati interessanti. Innazitutto l’inattivazione di questo enzima porta ad un aumento, pari a nove volte, dei livelli di serotonina nell’encefalo durante la prima settimana dopo la nascita. In questo periodo si riscontra un forte accumulo di serotonina in tutti i neuroni che esprimono in modo transiente il trasportatore serotoninergico (SERT). La corteccia somatosensoriale di questi topi non presenta più la sua tipica divisione in colonne, che sono la base morfologica delle mappe corticali, a dimostrazione del fatto che l’aumento di 5-HT compromette la corretta aggregazione e segregazione delle fibre talamocorticali (Cases et al., 1996, 1998). Simili effetti si ritrovano nel sistema visivo dove viene alterata la normale segregazione degli assoni retinici (Upton et al., 1999). Altre alterazioni riscontrate in questo modello riguardano il controllo locomotorio e respiratorio nei neonati (Bou-Flores et al., 2000).
Il topo “Knock-out” per la triptofano idrossilasi non ha dato il fenotipo atteso in quanto, in questo modello, la sintesi di serotonina nell’encefalo rimane invariata mentre si riduce fino a quasi scomparire nell’intestino e nel sangue. Inoltre il topo non presenta differenze comportamentali rispetto ai controlli. Questo topo perciò non può essere usato come modello per lo studio del ruolo e dello sviluppo del sistema serotoninergico nel sistema nervoso centrale. Il motivo di ciò è stato poi spiegato quando nel 2003 è stata clonata la seconda isoforma di questo enzima (Walther et al., 2003), la Tph2, espressa nei neuroni serotoninergici del sistema nervoso centrale.
Per la triptofano idrossilasi 2 non esiste attualmente il topo “Knock-out” ma sono stati identificati dei topi con un polimorfismo di un singolo nucleotide (SNP) nel gene che codifica questo enzima (Zhang et al., 2005). I topi omozigoti per questa mutazione presentano una riduzione del 50%-70% del tasso di sintesi di serotonina nei neuroni che proiettano a corteccia e striato e una riduzione del 40% della quantità di 5-HT nei tessuti che la reinternalizzano, rispetto ai controlli. Inoltre, questi topi, si comportano diversamente dai controlli e rispondono agli antidepressivi (Lucki et al., 2001). Questi studi sono l’evidenza diretta del ruolo fondamentale che ha la Tph2 nel controllo del sistema serotoninergico nell’encefalo.
Nel corso di uno studio svolto su individui affetti da depressione maggiore unipolare, in un gruppo di pazienti sono state riscontrate delle mutazioni nucleotidiche nella sequenza codificante della Tph2 che in omozigosi portano alla perdita di gran parte dell’attività proteina. Inoltre tra questi pazienti, la maggior parte aveva, nella storia familiare, casi di malattie mentali o di abuso di droghe o alcool o di suicidi o soffriva di ansia generalizzata e tutti rispondevano male ai trattamenti con farmaci SSRIs (Zhang et al., 2005).
Il gene Pet-1 codifica per un fattore di trascrizione chiave per il differenziamento dei neuroni serotoninergici. Il topo “Knock-out” per Pet-1 presenta una drastica riduzione dei neuroni serotoninergici (Hendricks et al., 2003). Nonostante ciò, la citoarchitettonica dei nuclei delle varie regioni dell’encefalo non risulta diversa da quella dei controlli. Questo topo tuttavia, nei test comportamentali, presenta i parametri tesi a misurare i livelli di ansia e aggressività più alti rispetto ai controlli. Perciò il programma trascrizionale dipendente dal gene Pet-1 sembra essere responsabile dell’accoppiamento del differenziamento dei neuroni serotoninergici durante lo sviluppo dell’encefalo con la regolazione 5-HT-mediata di comportamenti legati all’ansia e all’aggressività dell’adulto.
Altri studi condotti sul topo mostrano un coinvolgimento della serotonina materna nella migrazione delle cellule delle creste neurali facciali (Yavarone et al., 1993; Moiseiwitsch and Lauder, 1995), nella morfogenesi delle strutture craniofacciali (Shuey et al., 1992, 1993; Bhasin et al., 2004) e nella proliferazione delle cellule del miocardio (Nebigil and Maroteaux, 2001). Infatti, embrioni in coltura trattati con antagonisti serotoninergici riportano uno sviluppo embrionale anormale caratterizzato da una deficienza del mesenchima della testa, da archi mandibolari ipoplastici, da occhi e tubo neurale anormali, e da difetti cardiovascolari che includono la mancanza di trabecole e la riduzione dello spessore della parete ventricolare (Choi et al., 1997).
In conclusione, tutti i dati che sono noti sino ad oggi dimostrano come il sistema serotoninergico sia sicuramente coinvolto in processi di formazione dei circuiti neuronali e di sinaptogenesi. Rimangono ancora da chiarire, però, sia il ruolo di questo sistema nello sviluppo precoce, cioè in processi quali la
proliferazione e il differenziamento, sia i meccanismi cellulari che sono alla base di questa sua azione.
1.2. Il trasportatore serotoninergico: SERT
Uno dei meccanismi più efficaci per controllare la distribuzione spaziale e temporale della serotonina nell’ambiente extracellulare è la modulazione del suo “re-uptake”, mediato da SERT, il trasportatore specifico per la serotonina. In questo modo è possibile limitare l’azione della 5-HT sui suoi recettori, prevenendone la desensitizzazione, come accade sia a livello di CNS che a livello periferico.
Il cDNA del trasportatore è stato clonato e sequenziato nel cervello di ratto (Blakely et al., 1991), nel topo (Chang et al., 1996), nelle cellule di carcinoma placentare (Ramamoorthy et al., 1993), nel cervello umano e nelle piastrine (Lesh et al., 1993). Appartiene alla famiglia dei trasportatori di neurotrasmettitori, Na+/Cl- dipendenti, che comprende i trasportatori per
noradrenalina, dopamina, 5-HT, GABA, glicina e taurina.
SERT è un proteina integrale di membrana, di circa 600 aminoacidi (il numero varia nelle diverse specie di vertebrati ), con 12 domini transmembrana ed entrambi i terminali, carbossilico e amminico, citoplasmatici. Nella famiglia dei trasportatori i domini transmembranali 1, 2, 4, 8, mostrano un alto grado di identità della sequenza aminoacidica e ciò fa supporre che siano regioni importanti per la funzione di trasporto. Nella sequenza di 5-HTT, a livello del dominio idrofilico extracellulare tra i domini transmembrana 3 e 4, sono presenti due siti canonici di glicosilazione “N-linked” (Blakely et al., 1991); questo suggerisce l’eventualità che la proteina sia oggetto di modificazioni post-traduzionali. Studi condotti su h5-HTT hanno messo in risalto anche la presenza di sei siti di fosforilazione: tre per la proteina chinasi A (PKA) (Ramamoorthy et
al., 1993) e tre per la proteina chinasi C (PKC) (Lesh et al., 1993). La PKA, quando è attivata dal cAMP, porta ad un aumento del “re-uptake” della 5-HT, mentre l’attivazione della PKC porta ad una riduzione dello stesso. Ciò è evidenza del fatto che il trasportatore è controllato da due sistemi opposti, quello del cAMP e quello del PIP2, tramite la regolazione di due chinasi.
Recentemente sono state identificate altre proteine che interagiscono con la sequenza al terminale amminico di SERT e che sono state chiamate “proteine che legano il trasportatore serotoninergico” (STBP). Tra queste ricordiamo ad esempio STBP-1, di cui non è ancora nota la funzione e STBP-13 che è una proteina coinvolta nella regolazione della dinamica dei microtubuli; ciò sarebbe in accordo con l’ipotesi dell’esistenza di un’associazione tra i trasportatori delle ammine biogene e le proteine del citoscheletro (Beckman et al.; 1998). Infine è stata identificata STBP-14 che è una forma tronca della famiglia delle proteine 14-3-3; è stato visto, in cellule in coltura, che, se viene fatta sovraesprimere la sua forma completa, si ottiene una riduzione del “re-uptake” di 5-HT (Haase et al.,2001).
Inoltre SERT presenta dei siti di legame per gli antidepressivi, triciclici (imipramina) e non (SSRIs come paroxetina e fluoxetina), e per sostanze psicostimolanti come cocaina, fenfluoramina e metamfetamina. (figura 3).
Il trasportatore, nell’organismo adulto, è localizzato nei polmoni, nell’intestino, nella milza, nei plessi enterico e mienterico, nella corteccia frontale, nell’ippocampo, nello striato e nel rombencefalo (Chang et al., 1996; Hoffman et al., 1991; Ramamoorthy et al., 1993; Hansson et al., 1998; Lesch et al., 1993); proprio nella parte posteriore dell’encefalo, in corrispondenza dei nuclei del raphe, raggiunge i livelli di espressione maggiori.
A livello embrionale, è stata dimostrata un’ espressione transiente di SERT anche in altre zone dell’organismo a vari stadi di sviluppo (Hansson et al., 1998). Nei mammiferi placentati è stata osservata la presenza di RNA messaggero del trasportatore già a partire da stadi in cui non è ancora prodotta serotonina endogena; questo supporta l’ipotesi che nelle primissime fasi dello sviluppo la 5-HT materna svolga un ruolo importante. Il primo distretto in cui compare è il sistema cardiovascolare a cui seguono il tratto gastrointestinale, la pelle, la lingua, il fegato, il tessuto adiposo bruno, il connettivo, il sistema nervoso periferico (nella catena dei gangli del sistema simpatici e nei gangli delle radici delle corna dorsali), la midollare del surrene, il sistema respiratorio, i primordi dei denti, l’orecchio interno, la tiroide. Nel sistema nervoso centrale si ritrova in modo transiente nella retina, nel sistema limbico, nel nucleo cocleare, nel nucleo genicolato mediale e nel nucleo genicolato laterale e nella la ghiandola pituitaria (Hansson et al., 1998).
Il fatto che SERT sia espresso in modo transiente in tutti questi distretti, durante lo sviluppo, riflette l’importanza della serotonina durante l’embriogenesi e conferma il ruolo del trasportatore come mediatore degli effetti di questo neurotrasmettitore nei processi di differenziamento, sinaptogenesi e plasticità neuronale.
Il topo “knock-out” per il trasportatore presenta dei difetti della segregazione delle fibre talamocorticali e retiniche, a ulteriore conferma che un eccesso di serotonina porta a dei cambiamenti dello sviluppo. Il fenotipo del topo KO per SERT presenta anche una forte riduzione della concentrazione della serotonina nell’encefalo e del numero dei neuroni serotoninergici del nucleo dorsale del raphe, e di conseguenza una riduzione di quattro volte dell’attività elettrica (firing) di questi neuroni. Mostra inoltre un aumento dei comportamenti legati ad ansia e depressione anche se ciò sembra un paradosso se si considera
che proprio l’inibizione del trasportatore è alla base della maggior parte delle cure antidepressive (Bengel et al., 1998; Lesch et al., 2003).
E’ interessante notare nei topi KO per il trasportatore serotoninergico una riduzione del tasso dell’ apoptosi dei neuroni a livello telencefalico (Persico et al., 2003).
1.3. I recettori della serotonina
La grande varietà di funzioni in cui abbiamo visto essere implicata la serotonina si riflette nella complessità farmacologica dei suoi recettori; infatti finora sono stati clonati quindici geni che codificano per recettori serotoninergici che danno origine a venti forme diverse mediante processi di “splicing” alternativi o di mRNA “editing”. Tutti questi recettori sono stati classificati, in base alle caratteristiche farmacologiche, strutturali e trasduzionali, in sette famiglie (Hoyer et al., 1994). Le classi 5-HT1, 5-HT2, 5-HT4, 5-HT5, 5-HT6 e 5-HT7 sono tutte accoppiate a proteine G; di queste, 5-HT1 è accoppiata a Gi , 5-HT2 a Gq,
5-HT4/6/7 a Gs e 5-HT5 ancora non è noto. La classe 5-HT3, invece, è un recettore
canale ionico.
Tra tutti questi recettori quelli per cui è noto un coinvolgimento nello sviluppo embrionale sono i recettori 5-HT1A, 5-HT1B, 5-HT2A, 5-HT2B e 5-HT2C. Il recettore 5-HT1A, clonato nei mammiferi (Raymond et al., 2001) e in Xenopus laevis (Marracci et al., 1997), è espresso precocemente nella vita embrionale ed è localizzato principalmente nei nuclei del raphe, nell’ippocampo e nell’occhio ma si ritrova transientemente anche nei motoneuroni spinali e nel cervelletto (Hilliori et al., 1994; Miquel et al., 1994). Studi in vivo mostrano che il suo ruolo si esplica soprattutto nel controllo della neurogenesi nell’adulto e della maturazione dendritica dell’ippocampo. Se attivato, infatti, stimola neurogenesi nel giro
dentato e nella zona subventricolare, aree che sono sede di produzione di neuroblasti a lunga vita (Brezun et al., 2000; Gould, 1999; Santarelli et al., 2003). Inoltre è stato visto che una deplezione postnatale di 5-HT riduce la lunghezza dei dendriti e il numero delle spine dendritiche dei neuroni ippocampali e questo effetto dipende dal recettore 5-HT1A. Per questo recettore sono state generate tre linee di topi “knock-out” (Parks et al., 1998; Ramboz et al., 1998; Heisler e al., 1998). Tutte e tre le linee mostrano un aumento dei comportamenti legati all’ansia ma una diminuzione di quelli legati alla depressione. Questa situazione può essere spiegata perché l’assenza del recettore, provocando un aumento della trasmissione serotoninergica, ha un effetto antidepressivo ma ansiogeno (Blier & de Montigny, 1994; Griebel, 1995). Da questi studi emerge che la serotonina è necessaria perché i topi adulti abbiano un normale comportamento legato all’ansia e che questo suo ruolo è mediato dal recettore 5-HT1A (Gross et al., 2002).
Il recettore 5-HT1B ha un profilo di espressione precoce e dinamico; è localizzato nei nuclei del raphe, nel nucleo striato, nel cervelletto, e nelle cellule gangliari della retina (Boschert et al., 1994). Inoltre, transientemente lo si ritrova nei nuclei sensoriali talamici nel periodo immediatamente dopo la nascita. In tutti questi neuroni, il recettore è sempre espresso sui terminali assonali presinaptici dove modula il rilascio di glutammato (Laurent et al., 2002).
Studi effettuati sul topo “knock-out” per Maoa e per SERT mettono in evidenza che i difetti di segregazione assonale tipici in questi due modelli sono recuperabili mediante l’inattivazione di questo recettore. Ciò dimostra che il recettore 5-HT1B è in grado di influenzare selettivamente lo sviluppo degli assoni dei neuroni talamici (Salichon et al., 2001; Rebsam et al., 2002; Upton et al., 2002). Questo recettore agisce attraverso l’inibizione della produzione di AMP ciclico e dell’entrata di calcio nei terminali assonici (Raymond et al., 2001).
Il recettore 5-HT2A è espresso tardivamente nello sviluppo e per questo motivo si pensa sia implicato in processi di maturazione e differenziamento neuronale (Azmitia, 2001). Il topo “Knock-out” per questo recettore però, non presenta sostanziali anomalie a livello del sistema nervoso centrale. Sembra invece che siano riconducibili ad una sua eccessiva attivazione le disfunzioni motorie che si notano nel topo privo di Maoa perché si possono recuperare
somministrando un suo antagonista (Bou-Flores, et al., 2000). Il recettore 5-HT2A è coinvolto nella modulazione dell’espressione del “brain-derived neurotrophic factor” (BDNF) nella neocorteccia e nell’ippocampo attraverso cui influenza i processi tardivi dello sviluppo di queste aree (Vaidya et al., 1997).
Il recettore 5-HT2B e il suo ruolo nello sviluppo saranno discussi nel paragrafo successivo.
Il cDNA del recettore 5-HT2C è stato clonato nei mammiferi (Raymond et al., 2001) e in Xenopus laevis (De lucchini et al., 2003). Nei gatti neonati, ha un’espressione che rispecchia la caratteristica struttura colonnare del IV strato della corteccia visiva durante il periodo critico per la formazione della dominanza oculare. La sua deplezione provoca l’alterazione della formazione della dominanza oculare. Questo supporta l’ipotesi che questo recettore sia implicato nello sviluppo sinaptico della corteccia visiva (Wang et al., 1997; Kojic et al., 1997). Inoltre i topi che mancano di 5-HT2C riportano dei deficit nel potenziamento a lungo termine dell’ippocampo, a ulteriore conferma del suo ruolo nella plasticità sinaptica (Edagawa, 2001).
1.4. Il recettore 5-HT2B
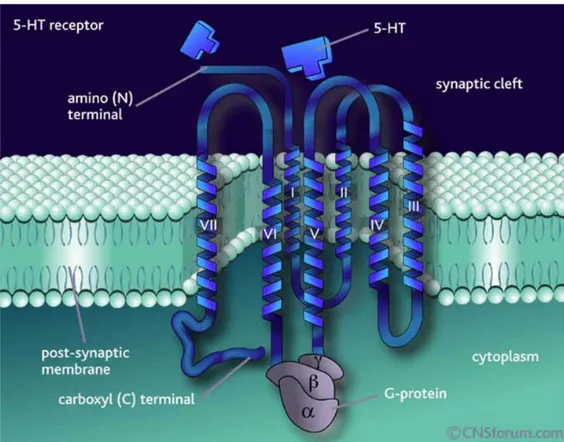
Il cDNA del recettore 5-HT2B è stato clonato nel ratto e nel topo (Foguet et al., 1992a, 1992b), nell’uomo (Kursar et al., 1994) e in Xenopus laevis (De Lucchini et al., 2003). Nella struttura è molto simile a tutti i recettori accoppiati a proteine G; è una proteina integrale di membrana, di 450-500 aminoacidi (il numero varia a seconda delle specie considerate) e con sette domini idrofobici transmenbrana, connessi da tre domini idrofilici intracellulari e tre extracellulari. Il terminale amminico della sequenza è orientato verso lo spazio extracellulare mentre il terminale carbossilico verso quello intracellulare. Lungo i domini
extracellulari sono presenti dei siti canonici di glicosilazione, segno di possibili modificazioni post-traduzionali, e dei residui di cisteina che permettono la formazione di ponti disolfuro e conseguenti modificazioni conformazionali della proteina. A livello dei domini intracellulari, invece, si trovano dei siti per l’interazione con proteine Gq/11 e altre proteine regolatorie, e dei siti di
fosforilazione, bersaglio per diverse serina/treonina chinasi. Inoltre a livello del terminale carbossilico c’è un motivo molto conservato chiamato S/TXV che interagisce con il dominio PDZ delle proteine che lo contengono; questo dominio è coinvolto nelle vie di trasduzione del segnale attivate da cNOS (sintasi dell’ossido nitrico costitutiva) e iNOS (sintasi dell’ossido nitrico inducibile) (Raymond et al., 2001). Sempre a questo terminale sono presenti dei siti di palmitolazione e fosforilazione che sono indispensabili per l’internalizzazione del recettore (Parker et al., 2003) (figura 4).
Figura 4: modello tridimensionale di un recettore serotoninergico accoppiato a proteine G. E’ una proteina
integrale di membrana, con sette domini idrofobioci transmembrana e ha l’estremità amminica nel versante extracellulare e quella carbossilica nel versante citosolico.
Nell’uomo, l’RNA messaggero di 5-HT2B è espresso abbondantemente nel fegato e nel rene e a livelli più bassi nel pancreas nella milza, nel cervelletto, nell’ipotalamo dorsale, nel setto laterale e nell’amigdala mediale (Bonhaus et al., 1995; Duxon et al., 1997).
Studi effettuati sul topo hanno messo in risalto la presenza dell’RNA messaggero per questo recettore durante l’embriogenesi precoce anche nelle cellule delle creste neurali, nel tubo neurale, nel cuore, nell’intestino, nei somiti, nelle vescicole ottiche e otiche, negli archi faringei e nel mesenchima craniofacciale (Choi et al.,1997).
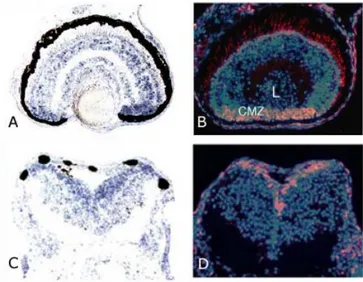
Inoltre studi condotti in Xenopus laevis hanno messo in evidenza che l’RNA messaggero di X5-HT2B, durante lo sviluppo, è presente nei precursori neuronali in proliferazione del tubo neurale e della retina (De Lucchini et al., 2003) (figura 5).
Figura 5: in A e C, espressione dell’mRNA di 5-HT2B negli strati nucleare interno ed esterno e nella zona del
margine ciliare della retina e nel tubo neurale di embrioni di Xenopus. In B e D, localizzazione dei precursori neuronali in proliferazione della retina e del tubo neurale di embrioni di Xenopus, mediante un saggio per l’incorporazione della BrdU. Dal confronto delle quattro immagini emerge che l’espressione dell’mRNA di
X5-HT2B è più forte in corrispondenza delle zone in proliferazione. Da: De Lucchini et al., 2003.
La sua espressione così precoce nell’embriogenesi lo rende un ottimo candidato per la mediazione degli effetti morfogenetici serotonina-dipendenti.
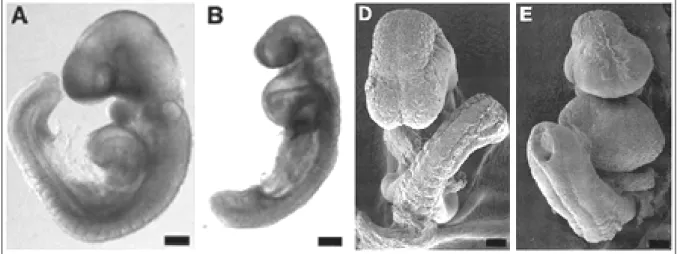
Le prime evidenze, in vivo, del ruolo di questo recettore nello sviluppo giungono da uno studio fatto su embrioni di topo trattati con la ritanserina,
antagonista dei recettori 5-HT2. uesti embrioni mostrano un forte ritardo della crescita, un’anomalia della piega cefalica, prosencefalo e rombencefalo sottosviluppati, archi faringei ipoplastici, difetti del numero e della forma dei somiti, della chiusura e della forma del tubo neurale e malformazioni cardiache tra cui edema pericardico e assenza delle trabecole miocardiche. Gli embrioni trattati presentano anche un aumento del numero delle cellule delle creste neurali craniali che vanno in apoptosi. Da questo studio è emersa l’ipotesi che il recettore 5-HT2B possa avere un ruolo importante nei processi di migrazione, proliferazione cellulare e sopravvivenza delle cellule delle creste neurali e nella migrazione e/o nell’inibizione del differenziamento cellulare delle cellule del miocardio (Choi et al., 1997) (figura 6).
Figura 6: In A e D, embrioni di topo “wild type” a 9 giorni di gestazione, in visione laterale (A) e frontale (D).
In B e E, embrioni di topo, trattati per 24 ore con ritanserina, a 9 giorni di gestazione. Dal confronto emergono il forte ritardo dello sviluppo e le gravi alterazioni a carico delle regioni cefaliche e del cuore dei topi trattati rispetto ai controlli. Da: Choi et al., 1997.
Il fenotipo dei topi trattati con ritanserina è paragonabile a quello di topi trattati con acido retinoico, fattore che regola negativamente la proliferazione e la migrazione delle cellule creste neurali. Questa osservazione, aggiunta alla presenza di un sito di legame per l’acido retinoico nella sequenza del promotore di 5-HT2B, aveva fatto ipotizzare che l’acido retinoico regolasse negativamente il recettore 5-HT2B ma uno studio condotto sul topo smentisce questa ipotesi
suggerendo che più che avere un’azione diretta l’uno sull’altro, i due fattori agiscano su elementi comuni (Bhasin et al., 2004).
Il topo “knock-out” per 5-HT2B ha un fenotipo letale, con diversi gradi di penetranza, embrionale o neonatale, causato da malformazioni cardiache. I topi che sopravvivono alla nascita mostrano dilatazione cardiaca con una penetranza del 100% e un’anomalia nell’organizzazione miofibrillare e nelle giunzioni cellulari cardiache. Non risulta però, che questo organismo abbia grosse alterazioni morfologiche a livello del sistema nervoso centrale; ciò probabilmente per un meccanismo di compensazione che entra in gioco per ovviare alla mancanza del recettore. Il fenotipo di questo topo sembra dovuto a difetti della proliferazione e della crescita delle cellule miocardiche nello sviluppo. Ciò supporta l’ipotesi che la serotonina, attraverso il suo recettore 2B agisca come fattore mitogenico sui cardiomiociti. Il confronto di questi topi con quelli “knock-out” per ErbB2, recettore tirosina chinasico di una neuroregulina, suggerisce che i due recettori 5-HT2B e ErbB2 sfruttino la medesima via di trasduzione del segnale durante lo sviluppo del cuore ( Nebigil and Maroteaux, 2001).
Gli stessi autori che hanno studiato il topo “knock-out” per 5-HT2B hanno proseguito le ricerche su cardiomiociti in coltura dimostrando che in condizioni di stress, la serotonina protegge le cellule da morte apoptotica e che questo effetto è mediato dal recettore 5-HT2B. il meccanismo attraverso cui si esplica l’effetto citoprotettivo di 5-HT2B sarà discusso più avanti (Nebigil et al., 2003).
Un altro approccio per lo studio del ruolo di 5-HT2B è stato quello di costruire un topo transgenico che sovraesprimesse questo gene. Questi topi mostrano ipertrofia cardiaca, dovuta ad un aumento sia del numero che della crescita dei cardiomiociti, accompagnata da proliferazione e attività enzimatica mitocondriale anormali (Nebigil et al., 2003). Non sono ancora del tutto chiari però i meccanismi che sono coinvolti in questi modelli sperimentali.
Recentemente, nell’uomo è stata trovata una forma tronca, al terminale carbossilico, del recettore che porta alla perdita dell’accoppiamento con proteine Gq/11, in favore di quello con proteine G13 ed alla riduzione dell’attivazione della
sintesi dell’ossido nitrico. Questa forma tronca, trasfettata in cellule in coltura, produce un aumento della proliferazione cellulare e difetti nell’internalizzazione del recettore, che dimostrano l’importanza della presenza dei domini PDZ e dei
siti di palmitolazione per il corretto funzionamento del recettore 5-HT2B (Deraet et al.,2004).
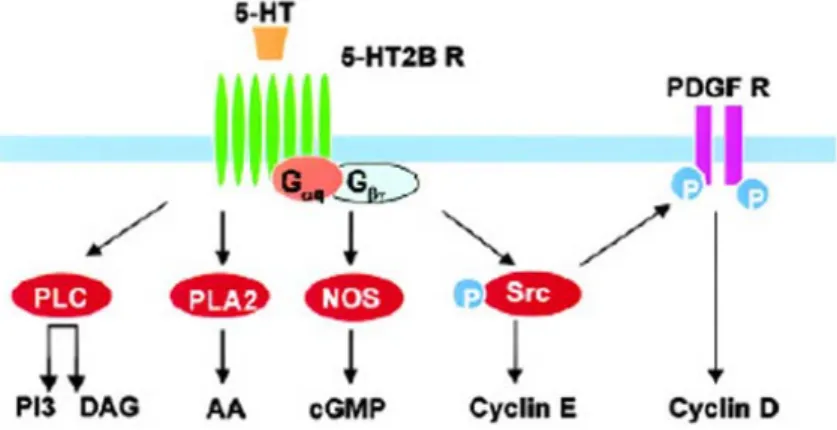
L’azione del recettore 5-HT2B si esplica attraverso diverse cascate di trasduzione che sono state studiate mediante esperimenti in vitro.
Questo, come tutti i recettori della serotonina di tipo 2 è accoppiato, sia ad una proteina Gq/11 che attiva la fosfolipasi Cβ (PLCβ) e porta alla produzione di IP3
e diacilglicerolo (DAG), sia ad un’altra proteina G che attiva la fosfolipasi A2 (PLA2), che a sua volta stimola la produzione di acido arachidonico (AA) (Raymond et al., 2001).
Il recettore 5-HT2B inoltre, può stimolare la progressione del ciclo cellulare attraverso due vie indipendenti e parallele che portano all’attivazione dei complessi chinasici ciclina D1/cdk4 e ciclina E/cdk2. L’attivazione della ciclina D1 sembra coinvolgere la transattivazione della via di trasduzione del segnale del recettore chinasico del fattore di crescita derivato dalle piastrine (PDGF); la ciclina E, invece non richiede l’intervento di questo recettore. A monte di entrambe queste vie si ritrova un elemento comune che è la chinasi Src (Nebigil et al.,2000b; Raymond et al., 2001).
Il recettore 5-HT2B è in grado di stimolare la produzione intracellulare di cGMP attraverso l’attivazione delle sintasi dell’ossido nitrico costitutiva e inducibile (cNOS e iNOS). L’interazione con questi due enzimi avviene a livello dei domini PDZ presenti al terminale carbossilico del recettore. Dato che solo la via di iNOS coinvolge l’attivazione di una proteina G13 si pensa che anche in questo
caso il recettore possa agire attraverso due vie parallele (Manivet et al., 2000) (figura 7).
Figura 7: schema delle principali vie di trasduzione del segnale attivate dal legame della serotonina al
Questo recettore interviene anche nella regolazione del rilascio di Ca2+
dalle riserve intracellulari sia attraverso il coinvolgimento dei recettori rianodinici (Ullmer et al., 1996) sia attraverso una via IP3- dipendente che porta all’apertura
di un canale Cl-, Ca2+ -dipendente (Foguet et al., 1992; Parekh et al., 1993).
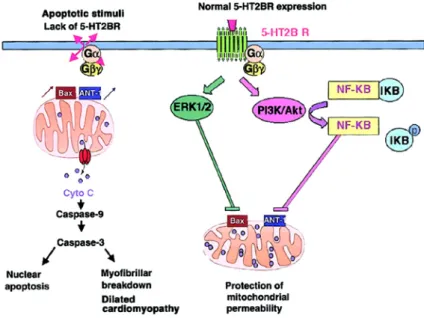
Recentemente, è stata scoperta un’altra via di azione del recettore 5-HT2B, che ho già citato in questo paragrafo; quella antiapoptotica. E’ stato visto come l’accoppiamento di 5-HT2B con una proteina Gq porti all’attivazione, in caso
di stress, sia della via di ERK1/ERK2 (extracellular signal-regulatedkinase), che di quella di PI3K/Akt (fosfaditilinositolo 3 chinasi), che rispettivamente inibiscono, indipendentemente, Bax e ANT-1, fattori proapoptotici; ciò impedisce il rilascio del citocromo c dal mitocondrio e, di conseguenza, l’attivazione della caspasi 9 e l’entrata in apoptosi della cellula. La via PI3/Akt oltre ad inibire il rilascio di ANT-1, stimola la degradazione di IкB-α e permette la traslocazione nel nucleo del fattore di trascrizione NF-кB (figura 8).
Figura 8: schema della via antiapoptotica attivata dal legame della serotonina al recettore. Da: Nebigil
1.5. Sviluppo del sistema nervoso centrale e
dell’occhio
Nei vertebrati il sistema nervoso centrale si sviluppa lungo la linea mediana dorsale dell’asse antero-posteriore dell’embrione a partire dalla chiusura del tubo neurale, una struttura di origine ectodermica situata dorsalmente alla notocorda. Il processo tramite il quale si forma il tubo neurale è chiamato neurulazione ed è caratterizzato dal cambiamento morfologico di alcune cellule dell’ectoderma dorsale che si allungano e sollevano formando la piastra neurale. La parte anteriore della piastra corrisponde alla regione presuntiva del cervello, mentre quella più posteriore alla regione presuntiva del midollo spinale. Durante la neurulazione, la piastra si piega ventralmente lungo la linea mediana e comincia a chiudersi dorsalmente per dare origine al tubo neurale. Quando il tubo neurale è chiuso, nella sua parte più anteriore, primordio del futuro cervello, si formano tre vescicole da cui si origineranno il prosencefalo, il mesencefalo e il rombencefalo.
Lo studio dello sviluppo del sistema nervoso centrale è molto complesso ma la retina nervosa dei vertebrati, formata da un numero limitato di tipi cellulari neuronali finemente organizzati in una disposizione laminare, si offre come eccellente sistema modello per studi di sviluppo.
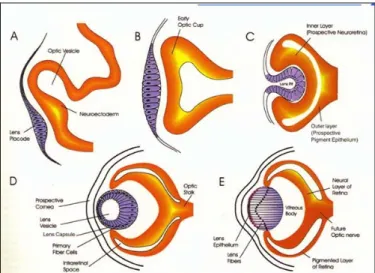
Lo sviluppo dell’occhio inizia durante la gastrulazione, quando l’interazione tra endoderma in involuzione, mesoderma e ectoderma cefalico, induce la formazione del cristallino da parte dell’ectoderma cefalico in corrispondenza delle vescicole ottiche. Le vescicole ottiche si originano come due estroflessioni delle pareti laterali del diencefalo, a cui rimangono attaccate attraverso i peduncoli ottici. Dopo aver preso contatto con il placode del cristallino, la vescicola si invagina formando il calice ottico, costituito da due strati, che si differenziano diversamente: lo strato esterno forma la retina pigmentata, mentre lo strato interno forma la retina nervosa (figura 9).
Figura 9: schema dello sviluppo dell’occhio nei vertebrati
Istologicamente la retina adulta risulta suddivisa in strati distinti. Lo strato più esterno è formato da cellule epiteliali pigmentate, disposte in un singolo strato a ridosso della membrana di Brunch che la separa dalla coroide. Lo strato successivo è formato dai processi dei coni e dei bastoncelli, separati da una sottile membrana eosinofila, detta membrana limitante esterna, dai loro corpi cellulari che invece danno origine allo strato nucleare esterno (External Nuclear Layer). Le brevi connessioni sinaptiche tra le cellule fotorecettrici e i neuroni di integrazione sono comprese nello strato plessiforme esterno, seguito dallo strato nucleare interno (Innear Nuclear Layer) che è costituito dai corpi cellulari dei neuroni di integrazione che sono di tre tipi: cellule bipolari, amacrine e orizzontali. Gli assoni di questi neuroni formano lo strato plessiforme interno e contraggono sinapsi, nello strato delle gangliari, con i dendriti delle cellule gangliari, i cui assoni formano il nervo ottico (figura 10).
Il primordio della retina precoce è un epitelio neurale pseudostratificato che costituisce un “pool” di progenitori cellulari multipotenti in proliferazione da cui derivano tutti i tipi neuronali (eccetto gli astrociti). Una delle teorie più recenti sulla multipotenzialità dei progenitori propone che queste cellule attraversino degli stati di competenza in cui sarebbero più o meno suscettibili a essere specificati per un determinato destino.
Figura 10: (A) la retina è localizzata nella regione posteriore dell’occhio ed è connessa all’encefalo dal nervo
ottico. (B) La retina matura è composta da 7 tipi cellulari principali, organizzati 3 strati cellulari (outer nuclear layer (ONL), innear nuclear layer (INL), ganglion cell layer (GCL) e due strati di fibre ( outer plexiform layer (OPL) e innear plexiform layer (IPL)). Da: Donovan and Dyer, 2005.
I neuroni postmitotici che escono dal ciclo cellulare si portano subito nella loro posizione laminare definitiva dando alla retina in formazione una struttura polarizzata. Le due caratteristiche principali del processo di retinogenesi sono: il fatto che ogni tipo cellulare è generato in un arco di tempo ben determinato e con un ordine cronologico estremamente conservato tra i vertebrati, e il fatto che il numero di cellule prodotte varia a seconda del tipo. Nel topo è stato visto che i tipi cellulari prodotti per primi, cioè cellule gangliari, coni e cellule orizzontali, sono in numero relativamente piccolo. Invece, i tipi cellulari prodotti più tardivamente, cioè cellule amacrine, bastoncelli, cellule bipolari e cellule della glia di Muller, sono in numero maggiore (Levine and Green, 2004; Yang, 2004; Donovan and Dyer, 2005).
In pesci e anfibi, il pool di progenitori multipotenti, non si estingue nella retina adulta ma rimane per tutta la vita in una zona periferica chiamata zona marginale ciliare (CMZ). La CMZ non solo costituisce un pool perenne di progenitori ma riassume nella sua organizzazione spaziale tutta la storia differenziativa dei neuroni retinici: dai progenitori multipotenti nella parte più periferica a precursori postmitotici non ancora completamente differenziati nella parte più vicina ai neuroni maturi della retina.
1.6. Xenopus laevis come sistema modello
Figura 11: schema dei principali stadi di sviluppo di Xenopus laevis. Da Wolpert et al.,1998.
Fin dalla fine dell’ottocento, per diversi motivi sperimentali molti degli studi volti a capire i meccanismi alla base dello sviluppo embrionale dei vertebrati sono stati svolti negli anfibi. La scelta di queste specie animali come modello sperimentale si è basata sul fatto che le modalità di sviluppo di tutti i vertebrati sono alquanto simili e perciò i meccanismi di base dell’embriogenesi degli anfibi sono validi per tutti i vertebrati, dai pesci all’uomo. Come sistema modello è stato scelto nel nostro laboratorio l’anuro africano Xenopus laevis. Questo anfibio costituisce un modello di elezione per gli studi sullo sviluppo perché, in qualsiasi periodo dell’anno, la femmina può essere indotta, mediante iniezione dell’ormone
umano gonadotropina corionica, a deporre nell’ambiente esterno 1000/1500 uova, che possono essere fecondate con facilità in vitro. Le grandi dimensioni delle uova degli anfibi, circa 1mm di diametro, le rendono particolarmente adatte alla manipolazione sperimentale. Un’altra caratteristica di questo anfibio è rappresentata dalla rapidità con cui si sviluppano gli embrioni.
Grazie alle caratteristiche che ho elencato è possibile effettuare sugli embrioni, sin dagli stadi più precoci dello sviluppo, sia trattamenti farmacologici, sia esperimenti di perdita e guadagno di funzione mediante la tecnica della microiniezione in embrioni allo stadio di due o quattro cellule .
Per fare esperimenti di guadagno di funzione si microinietta l’ mRNA del gene di interesse, sovraesprimendolo, mentre per gli esperimenti di perdita di funzione si microiniettano o oligonucleotidi antisenso modificati (morpholino) o mRNA antisenso o mRNA codificanti per proteine mutate o delete.
Inoltre, insieme ai costrutti di interesse è possibile microiniettare il trascritto di un gene reporter come EGFP o βgalattosidasi che permette di visualizzare la zona iniettata.
1.7. Scopo della tesi
Oltre al ruolo vitale che la serotonina svolge come neurotrasmettitore nell’organismo adulto, essa agisce anche come segnale di regolazione in processi di morfogenesi e differenziamento nello sviluppo embrionale sia del sistema nervoso che di altri tessuti. Nonostante esistano studi che evidenziano il coinvolgimento del sistema serotoninergico nell’embriogenesi, restano ancora in gran parte sconosciuti sia il ruolo della serotonina in processi molto precoci quali la proliferazione, il differenziamento e la migrazione cellulare sia i meccanismi molecolari che sono alla base di queste funzioni. Il mio progetto di tesi si è inserito in questa tematica ed ha lo scopo di contribuire al chiarimento del ruolo della serotonina durante lo sviluppo del sistema nervoso di Xenopus laevis.
In particolare ho effettuato uno studio funzionale del recettore serotoninergico 5-HT2B espresso, durante lo sviluppo, nell’occhio e nel sistema nervoso di Xenopus per valutare gli effetti mediati dall’interazione 5HT/5-HT2B in questi distretti.
Inoltre, allo scopo di poter modulare l’omeostasi della serotonina durante l’embriogenesi di Xenopus, come lavoro preliminare ho caratterizzato due geni implicati nella funzionalità del sistema serotoninergico quali Tph e 5-HTT, che codificano rispettivamente per l’enzima limitante della biosintesi della 5-HT e per la proteina responsabile del “re-uptake” della 5-HT. L’identificazione e lo studio dell’espressione di questi due geni ci permetterà di effettuare studi funzionali mirati a modulare la sintesi o il “re-uptake” della serotonina durante lo sviluppo embrionale.