SEZIONE I
Introduzione
1. TTV
1.1 LA SCOPERTA DEL VIRUS
Nel corso di questi ultimi decenni, si è assistito ad un graduale avanzamento delle tecniche di indagine diagnostica e di biologia molecolare, che ha permesso di caratterizzare dal punto di vista eziologico gran parte delle epatopie di origine fino ad allora ignara. Tuttavia, ancora oggi, permane un considerevole numero di pazienti affetti da patologia epatica criptogenetica. Ciò ha spinto molti studi ad essere orientati verso la ricerca di nuovi agenti patogeni implicati nel danno epatico. Uno di questi , condotto nel 1997 ad opera di Nishizawa e collaboratori (Nishizawa et al., 1997), consisteva nell’identificazione di un nuovo agente virale nel siero di un paziente con epatite post-trasfusionale non-A non-E. Tale agente virale fu nominato TT (TTV) dalle iniziali del paziente in esame. La tecnica che ha reso possibile l’identificazione del nuovo virus è stata l’analisi di
rappresentazione differenziale (RDA), tecnica sviluppata da Lisitsyn
nel 1993 (Lisitsyn et Wigler, 1993) che consente di evidenziare sequenze di DNA selettivamente espresse nei tessuti patologici quando confrontate con sequenze derivanti dai tessuti sani degli stessi soggetti. Nel caso specifico di TTV il materiale genetico fu estratto dal siero al momento in cui il paziente mostrava un picco nei livelli di transaminasi (ALT), e successivamente confrontato con il
Introduzione
DNA dello stesso individuo al momento in cui i livelli di ALT risultavano normali. L’analisi delle sequenze esclusive, individuate nel paziente al momento del picco, furono successivamente soggette ad analisi e paragonate con quelle disponibili in banca dati. Tale procedura ha condotto all’isolamento di un clone di circa 500 nucleotidi, denominato N22, che non presentava omologia con alcuna delle sequenze fino ad allora note e per questo fu considerato il prototipo di un nuovo virus a DNA monocatenario lineare. Studi condotti da Okamoto e collaboratori (Okamoto et al., 1998b) hanno portato alla caratterizzazione, mediante metodiche quali clonaggio e sequenziamento, di un genoma virale, apparentemente completo, di 3.739 nucleotidi (nt), definito TA278. in realtà era stato sequenziato il 90% del genoma totale. Le piccole dimensioni del virione, alcune peculiarità della sequenza nucleotidica e la mancanza di envelope, fecero pensare di inserire provvisoriamente il virus nella famiglia Parvoviridae. Tuttavia, nel 1999, Miyata e collaboratori, evidenziando nell’isolato TA278 l’assenza delle strutture palindromiche terminali caratteristiche dei parvovirus, identificarono una nuova regione di 113 nucleotidi ricca in guanina e citosina (GC) e, mediante metodica di PCR inversa, riuscirono a dimostrare la natura circolare del genoma virale. Questa scoperta, insieme ad alcune proprietà strutturali e molecolari che il virus mostrava condividere con i membri della famiglia Circoviridae, in particolare con il virus dell’anemia del pollo (CAV), spinsero alla
Introduzione
convinzione che TTV rappresentasse il primo circovirus dell’uomo (Miyata et al., 1999).
La famiglia Circoviridae difatti comprende agenti patogeni molto diffusi negli animali ma non comprende alcun altro virus dell’uomo. Successivamente sono state isolate numerose specie virali con caratteristiche strutturali e genomiche simili a TTV, ma con variabilità genetica elevata: tra questi gli isolati PMV (Hallet et al., 2000), SANBAN (Hijikata et al., 1999) e YONBAN (Yakahashi et al., 2000a) presentanti meno del 50% di omologia con il prototipo TA278. Questo quadro di specie virali altamente eterogenee dal punto di vista genetico divenne ulteriormente più complesso grazie alla scoperta di un altro gruppo di virus con proprietà intermedie tra TTV e CAV (Takahashi et al., 2000b), denominato inizialmente TLMV (TTV-Like-Mini-Virus), a sottolineare le dimensioni più piccole del genoma che risultava 2,9 Kb, contro le 3,8 Kb caratteristiche di TTV. Negli anni che seguirono la scoperta del virus, sono stati compiuti molti studi allo scopo di definire le sue proprietà molecolari e determinare il reale potenziale patogeno. L’iniziale isolamento di TTV nel siero di un paziente con epatite criptogenetica ha fatto pensare al virus come diretto induttore di malattie legate al fegato, ma studi successivi volti a verificare questa ipotesi hanno spesso fornito risultati discordanti.
Introduzione
Ulteriori studi hanno preso in considerazione la possibilità che TTV potesse essere implicato in patologie extraepatiche,senza tuttavia giungere ad una conclusione certa. L’alta prevalenza di TTV nella popolazione generale ha persino suggerito che il virus potesse rappresentare un semplice commensale dell’uomo assolutamente apatogeno (Griffiths, 1999; Mushahwar, 2000). Tuttavia, nell’attesa di indagini più complete che possano associare TTV a patologie magari sviluppatesi in minima parte nei soggetti infettati, è opportuno considerarlo un virus “orfano”, attualmente non associato ad alcuna malattia.
Introduzione
1.2 TASSONOMIA E NOMENCLATURA
Nel corso degli anni la classificazione di TTV ha subito numerose modifiche, ed ancora oggi l’inquadramento tassonomico del virus non è chiaro.
Date le ridotte dimensioni della particella virale, l’assenza di envelope, e la presenza di un genoma a DNA lineare a singolo filamento, TTV è stato inizialmente associato alla famiglia Parvoviridae (Okamoto et al., 1998b). La successiva scoperta della regione ricca in GC, che dimostrava la circolarità del genoma (Miyata et al., 1999) ed altre peculiarità strutturali e molecolari del virus, hanno portato a sostenere la possibile appartenenza del virus alla famiglia Circoviridae. I membri di tale famiglia sono difatti caratterizzati dalla presenza di un genoma circolare a singolo filamento di DNA, presentano un capside icosaedrico probabilmente costituito da un’unica proteina strutturale e sono privi di envelope (Todd et al., 1990). I circovirus animali noti all’interno di questa famiglia sono tre: il circovirus porcino (PCV), il virus della malattia del becco e delle penne dei pappagalli (BFDV), ed il virus dell’anemia del pollo (CAV). In realtà tali agenti virali mostrano tra di loro e con TTV notevoli differenze, in particolare a livello della sequenza nucleotidica e quello che sembra avvicinarsi maggiormente a TTV è CAV. Il genoma che li costituisce è difatti paragonabile sia per le dimensioni (3.200 nucleotidi circa per CAV e 3.800 nucleotidi circa per TTV), sia per quanto riguarda la suddivisione del genoma in
Introduzione
quanto possiedono una regione codificante avente almeno 3 cornici di lettura aperte (Open Reading Frame, ORF) parzialmente sovrapposte (Iwata et al., 1998) ed una regione non tradotta UTR (Untranslated Region) ricca in GC con notevole omologia tra i due agenti virali (Miyata et al., 1999). Nonostante tali omologie, molteplici caratteristiche di TTV rimangono al momento uniche, tanto che Mushahwar e collaboratori ipotizzarono di considerare il virus come il solo rappresentante di una nuova famiglia indicata con il nome di
Circinoviridae (Mashahwar et al., 1999). In conseguenza alla scoperta
del TT-like mini virus (TLMV), virus con caratteristiche intermedie tra TTV e CAV, è stato proposto di classificare i tre virus all’interno di una nuova famiglia detta Paracircoviridae (Takahashi et al., 2000b). Nell’attesa di una classificazione definitiva dal Comitato Internazionale di Tassonomia dei Virus (CITV) è stato istituito un gruppo di studio che ha proposto di inserire TTV e TLMV in un nuovo genere “floating” chiamato Anellovirus (dal latino “anello”). Anche gli acronimi di TTV e TLMV sono stati modificati: TorqueTeno Virus (dal latino “catena sottile”) per TTV e TorqueTeno Mini Virus (TTMV) per TLMV (Hino, 2002; Todd et al., 2002). Nel genere Anellovirus sono stati inseriti tutti i ceppi di TTV e TTMV accomunati da caratteristiche affini ma dotati di differenti gradi di divergenza genetica. Il numero di virus simili a TTV sembra destinato a crescere. Studi recenti, difatti, condotti da Jones e collaboratori, identificando nel plasma di due pazienti con sindromi
Introduzione
d’infezione acuta ad eziologia sconosciuta due nuove sequenze virali, giunsero a considerazioni interessanti. Dal confronto in banca dati e dalle analisi filogenetiche è emersa una somiglianza con i virus del gruppo TT nonostante la presenza di notevoli divergenze genetiche. Le nuove sequenze virali sono risultate essere caratterizzate da dimensioni rispettivamente di 2.249 nt e di 2.635 nt, collocandosi perciò tra TTV e TTMV. I due nuovi agenti virali sono stati, quindi, classificati nel genere Anellovirus in quanto possiedono un genoma circolare a singolo filamento con polarità negativa e presentano, come TTV e TTMV, una regione genomica codificante, costituita da più ORF parzialmente sovrapposte, ed una regione non tradotta UTR. I nomi attribuiti a tali virus sono Small Anellovirus 1 (SAV1) e Small
Anellovirus 2 (SAV2). I due SAV presentano tra loro un’omologia del
54% e con TTV e TTMV un’omologia del 32% e 35% rispettivamente. Date le loro dimensioni, la loro organizzazione genomica e la distanza filogenetica rispetto agli altri anellovirus, è stato proposto che SAV1 e SAV2 rappresentino un terzo distinto gruppo del genere Anellovirus (Jones et al., 2005). A seguito della scoperta del prototipo TA278 utilizzato per classificare TTV e i virus ad esso correlati sono emerse molteplici diverse proposte, spesso influenzate dalla regione genomica esaminata per le analisi filogenetiche. Infatti i primi studi sono stati condotti sulla base della regione N22 dell’ORF1 scelta come bersaglio per l’amplificazione: tali analisi hanno permesso
Introduzione
l’identificazione di 23 genotipi che sono stati inizialmente riuniti in quattro principali raggruppamenti filogenetici (Okamoto et al., 1999; Biagini et al., 1999).
Tuttavia la breve regione N22 si è in seguito rivelata poco adatta per studiare tali relazioni e rilevare la completa varietà di specie di TTV esistenti. Analisi di sequenza condotte successivamente sulla regione non tradotta (Untranslated Region UTR) e sul genoma tutto, hanno condotto all’identificazione di più di 40 genotipi e 70 sottotipi. Peng e collaboratori, nel 2002, proposero una nuova classificazione per tutti gli isolati fino ad allora identificati (72): tali isolati venivano suddivisi in 5 principali genogruppi, identificati con i numeri da 1 a 5, sulla base di divergenze nucleotidiche almeno del 50% (Peng et al., 2002; figura I.2A). Il criterio di classificazione prevedeva anche la distinzione in genotipi, contraddistinti da numeri arabi, presentanti divergenze nucleotidiche maggiori del 30% e in sottotipi, identificati da lettere minuscole, per isolati con divergenza compresa tra il 15% ed il 29%. In base a questa classificazione il genogruppo 1 è rappresentato dal prototipo TTV (isolato TA278) di genotipo 1 ed include altri cinque genotipi aggiuntivi, dal 2 al 6 (Okamoto et al., 1999).
Il genogruppo 2 comprende gli isolati TTV di genotipo 7, 8, 22, 23 e persino il 17, che è rappresentato dall’isolato PMV (Hallett et al., 2000). Il genogruppo 3, la cui classificazione risulta piuttosto complessa per gli innumerevoli isolati che comprende, è composto dai
Introduzione
genotipi dal 9 al 16 (l’isolato prototipo è il SANBAN), dai genotipi 18,19 (SENV-F) e 20 (SENV-G) e da altri sette genotipi di SENV, da A ad H. Gli ultimi due genogruppi, il 4 e il 5, comprendono rispettivamente, nove genotipi (l’isolato prototipo è YONBAN) e quattro nuovi isolati il cui prototipo è JT33 (Peng et al., 2002). Per quanto riguarda TTMV, che mostra un grado notevolmente elevato di eterogeneità genetica, probabilmente addirittura superiore a quella presentata da TTV, ad oggi risulta distinto in 4 genogruppi, separati da distanze genetiche superiori al 40% (Biagini et al., 2001b; Gallian et al., 2002).
Studi recenti, condotti da Jelcic e collaboratori, effettuati sulla base di un’analisi filogenetica che ha permesso di confrontare le sequenze di 24 nuovi isolati con quelle di 79 isolati già presenti in banca dati, hanno condotto alla proposta di inserire i ceppi di TTV in una nuova famiglia denominata Anelloviridae (Jelcic et al., 2004). Il CITV per il momento non si è ancora pronunciato sulla proposta sovracitata. Secondo questa nuova classificazione, il genogruppo 1 verrebbe trasformato nel genere α e i genogruppi 3 e 4 nei generi γ e δ rispettivamente, mentre i genogruppi 2 e 5 sarebbero raggruppati nel genere β. Sulla base di questo nuovo criterio di classificazione, gruppi di TTV che mostrano un’identità di sequenza inferiore al 50% rappresentano generi separati, all’interno dei quali gli isolati hanno tra loro un’omologia di sequenza compresa tra il 50% e 60%. La specie viene definita come un gruppo di isolati di TTV che mostrano tra loro
Introduzione
un’identità di sequenza superiore al 60%. Si parla invece di tipi e sottotipi virali nel caso in cui l’identità di sequenza supera il 90% e il 96% rispettivamente; infine gli isolati che tra loro omologie pari al 96% vengono definiti come varianti di un unico sottotipo (figura I.1B; figura I.2).
Introduzione
Figura I.1. Relazioni filogenetiche tra i vari isolati di TTV. In (A) i
gruppi definiti da Peng e collaboratori (2002); in (B) i generi definiti da Jelcic e collaboratori (2004).
A
B
A
Introduzione
Figura I.2: Classificazione genetica degli isolati di TTV in base alla
proposta di Jelcic. E’ riportata sull’asse delle ascisse la distribuzione di frequenza delle percentuali d’identità derivanti dal confronto delle sequenze nucleotidiche di 103 isolati di TTV (3200 nt) (Jelcic et al., 2004).
Introduzione
1.3 LA PARTICELLA VIRALE
Le informazioni riguardanti le proprietà chimicho-fisiche e le caratteristiche morfologiche della particella virale sono generalmente riferite al genotipo 1 di TTV, che è stato il primo ad essere individuato e dunque ad essere studiato più dettagliatamente. Tuttavia, le attuali conoscenze sul virus, indurrebbero ad escludere differenze morfologiche significative tra i vari genotipi.
Sfortunatamente non è stato ancora scoperto un sistema di coltura cellulare in vitro capace di supportare la replicazione di TTV, per cui le informazioni circa le caratteristiche strutturali del virus derivano, per lo più, da studi condotti con particelle virali purificate da plasma o da feci. Gli studi di Itoh e collaboratori hanno portato alla visualizzazione della particella virale al microscopio elettronico, dopo incubazione di sovranatante fecale, contenente TTV di genotipo 1, con le γ-globuline purificate da plasma umano contenente anticorpi specifici per il medesimo genotipo (figura I.3, Itoh et al., 2000). TTV è apparso di forma sferica con capside a probabile simmetria icosaedrica e privo di pericapside. Il diametro del virus è risultato compreso tra 30-32 nm, come già precedentemente determinato tramite l’uso di filtri di policarbonato a porosità decrescente (Mushahwar et al., 1999). La resistenza ai detergenti come il Tween 80 (Okamoto et al., 1998a), ai solventi e al calore secco (62°C per 96 h) hanno confermato l’assenza di un involucro lipidico esterno. Tale assenza è stata ulteriormente
Introduzione
confermata dalla scoperta di TTV nella bile di soggetti infetti (Ukita et al., 1999) in cui, per la presenza di acidi biliari, si possono rilevare soltanto virus privi di envelope. TTV, dunque, risulta essere molto stabile e resistente come i membri della famiglia Circoviridae (Simmonds et al., 1998; Takayama et al., 1999a; Yokozaki et al., 1999b). Alcuni lavori riportano l’esistenza nel sangue di particelle virali formanti complessi con immunoglobuline (Itoh et al., 2000); per il resto non siamo a conoscenza di altre forme circolanti del virione.
Le proteine di TTV non sono state ancora ben caratterizzate, tuttavia, data l’ analogia con CAV, si ritiene che il capside icosaedrico sia costituito da molte unità di un’unica proteina strutturale; inoltre, ad oggi, non sono stati identificati né carboidrati né lipidi virali.
Figura I.3. Visualizzazione al microscopio elettronico di particelle di
TTV, in forma di aggregati in seguito ad incubazione di sovranatante fecali con γ–globuline umane specifiche per il genotipo 1a (Itoh et al., 2000).
Introduzione
1.4 ORGANIZZAZIONE DEL GENOMA E
PROTEINE CODIFICATE
Le prime informazioni che hanno permesso la caratterizzazione del genoma di TTV sono state ottenute sottoponendo l’acido nucleico, estratto da plasma, all’azione di differenti enzimi: la sensibilità alla Dnasi I ed alla nucleasi Mung-bean e la resistenza alla Rnasi A ed all’enzima di restrizione NdeI ne hanno dimostrato la natura a singolo filamento di DNA (Okamoto et al., 1998b; Mushahwar et al., 1999). Attraverso esperimenti di ibridazione con molecole di RNA a polarità positiva e successiva digestione è stato possibile dimostrare che il DNA virale presenta una polarità negativa (Mushahwar et al., 1999). Ulteriori informazioni circa l’ organizzazione genomica derivano dall’analisi delle sequenze. L’amplificazione della molecola nella sua totale lunghezza, circa 3,8 Kb, è stata ottenuta mediante tecniche di clonaggio e PCR inversa condotta a partire dalla regione N22 (Mushahwar et al., 1999).
Il sequenziamento del 90% del genoma aveva fatto inizialmente ipotizzare che il DNA del virus fosse lineare (Okamoto et al., 1998b), supposizione successivamente smentita dall’ identificazione di una regione di circa 100 nucleotidi ricca in GC (Miyata et al., 1999): il genoma di TTV è quindi costituito da un singolo filamento di DNA circolare chiuso.
Introduzione
L’analisi filogenetiche di tutte le sequenze complete (o quasi) di TTV e TTMV ha rilevato una notevole somiglianza tra i due gruppi di virus nell’organizzazione genomica anche se l’ampiezza della loro sequenza nucleotidica differisce di circa 1 Kb. Le differenze nelle dimensioni del genoma fra i virus del gruppo TTV sono risultate invece più modeste (Kamahora et al., 2000; Okamoto et al., 2000; Muljono et al., 2001). Le informazioni riferite allla struttura del genoma di TTV si basano essenzialmente sull’analisi delle sequenze dei diversi isolati e sul relativo confronto coi virus meglio caratterizzati della famiglia
Circoviridae. Il genoma è per due terzi (2,6 Kb) costituito da una
regione codificante ORF e per un terzo da una regione UTR non tradotta ma ricca di elementi regolatori (Kamada et al., 2004; Suzuki et al., 2004; figura I.4). Sul filamento complementare al genoma, la regione espressa comprende da due a sei ORF in parte sovrapposte, potenzialmente codificanti con cornici di lettura diverse. Il gene ORF1 di TTV, interposto tra i nucleotidi 589 e 2.898 sul ceppo TA278, codifica per un prodotto proteico di circa 770 aminoacidi, (675 in TTMV), considerato l'equivalente della proteina capsidica di CAV denominata VP-1. La proteina tradotta dall'ORF1 di TTV, non solo svolge probabili funzioni strutturali, ma potrebbe anche essere coinvolta nel processo di replicazione: nelle proteine sovracitate è stato infatti identificato un tratto di circa 100 aminoacidi molto ricco in arginina il quale, data la sua natura idrofilica, potrebbe assumere un
Introduzione
ruolo nel mediare l’interazione con il DNA (Shoya et al., 1998; Vihinene-Ranta et al., 1997); tale dominio si ritrova anche nella regione aminoterminale di VP1 di CAV (Okamoto et al., 1998b).
Inoltre, all’estremità C-terminale del gene ORF1, sono stati individuati due motivi aminoacidici caratteristici delle proteine Rep replicasi utilizzate da virus a DNA che compiono il meccanismo a cerchio rotante. Queste proteine sono caratterizzate dalla presenza di almeno quattro motivi aminoacidici risultanti essere molto conservati tra i circovirus animali e vegetali. Inoltre, nella porzione centrale del gene ORF1, TTV presenta tre regioni ipervariabili definite HVR-1, HVR-2 e HVR-3 (Hight variable region) e potenziali siti di glicosilazione che, variabili in numero e in localizzazione nei diversi isolati, potrebbero modificare le proprietà biologiche ed antigeniche della proteina (Hijikata et al., 1999). Il gene ORF2, compreso tra i nucleotidi 353 e 712 del ceppo TA278, sembra codificare per una proteina strutturale di circa 120 aminoacidi in TTV (100 in TTMV), probabilmente coinvolta nella replicazione virale. A tale scopo è stata dimostrata un’omologia di sequenza tra questa proteina, in particolare quella codificata dall’isolato SANBAN, e la proteina VP-2 di CAV che ha una doppia funzione di fosfatasi, tirosin- e serin/treonina fosfatasi ed è coinvolta nei meccanismi di trasmissione intracellulare dei segnali durante la replicazione virale (Peters et al., 2002). Dall’analisi della sequenza di molti isolati di TTV, il gene ORF-2 risulta spesso costituito da due
Introduzione
ORF di piccole dimensioni, denominate a e b, di cui la prima appare molto conservata fra i diversi genotipi e le cui capacità codificanti non sono ancora conosciute ( Tanaka et al., 2000b; Kakkola et al., 2002).
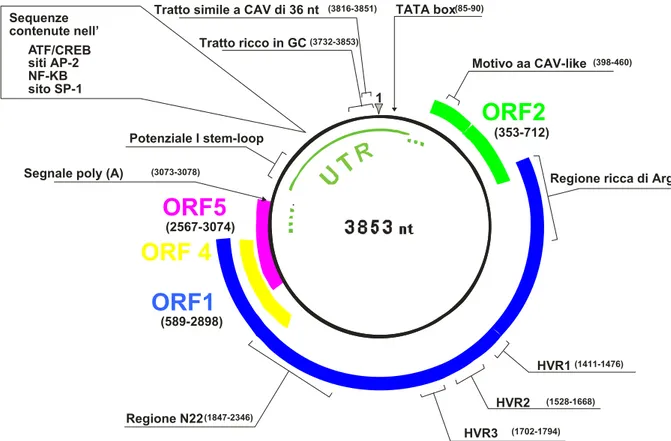
Figura I.4: Organizzazione genomica di TTV. E’ mostrato il DNA a
polarità negativa come presente nel virione. Le posizioni si riferiscono all’isolato TA278.
1
TATA box (85-90)
Regione ricca di Arg Motivo aa CAV-like (398-460)
HVR1 (1411-1476)
HVR2 (1528-1668)
HVR3 (1702-1794)
Segnale poly (A) (3073-3078)
Tratto ricco in GC (3732-3853)
Tratto simile a CAV di 36 nt (3816-3851)
Potenziale l stem-loop
ORF1
Regione N22 (1847-2346)ORF5
Sequenze contenute nell’ A NF-KB sito SP-1 TF/CREB siti AP-2ORF2
(2567-3074) (589-2898) (353-712)ORF 4
Introduzione
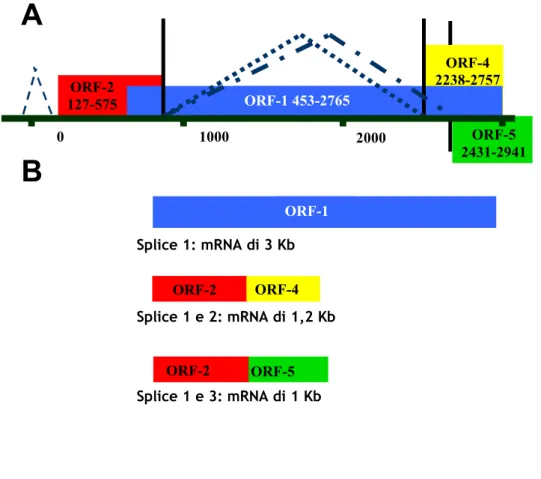
Esperimenti di trasfezione di cellule COS1 con un vettore contenente un costrutto del genoma linearizzato di TTV (genotipo 1), hanno dimostrato la presenza di altre ORF e condotto all’identificazione di tre distinti mRNA di 3,0, 1,2 e 1,0 Kb (Kamahora et al., 2000); i tre mRNA, che presentano polarità antigenomica ed hanno il sito di poliadenilazione al 3’ e il sito cap al 5’, sono stati ritrovati anche in cellule del midollo osseo infettate da TTV (Okamoto et al., 2000d; 2001). Il meccanismo di splicing ipotizzato per produrre gli mRNA mediante l’utilizzo di diversi schemi di lettura, agirebbe sulle regioni ORF conosciute ma anche su ORF minori di nuova identificazione, dette ORF4 e ORF5, localizzate in prossimità della porzione C-terminale dell’ORF1 e ad essa sovrapposte.
Dall’analisi dei potenziali siti di splicing, è emerso che il messaggero più lungo conterrebbe per intero il gene ORF1, mentre i due mRNA più corti risulterebbero dalla combinazione dell’ORF2 con l’ORF4 e l’ORF5 (figura I.5).I prodotti proteici derivanti dall’ORF3 (o ORF2-4) e dalla ORF2-5 potrebbero essere coinvolti nella replicazione del virus o nei meccanismi di controllo e di regolazione nella trascrizione virale. In particolare l’ORF-3 sembra codificare per due proteine (p38 e p41) dotate di un differente grado di fosforilazione e per questo simili alla proteina NS5A del virus dell’epatite C (HCV; Asabe et al., 2001). Inoltre, in uno studio condotto da Kooistra e collaboratori, basato sulla considerazione che alcune sequenze nucleotidiche di TTV
Introduzione
presentavano similitudini con il gene dell’apoptina di CAV, è stato dimostrato che l’ORF3 codifica anche per una proteina di 105 aa che assume ruolo di induzione apoptotica di linee cellulari derivate da carcinoma epatocellulare umano (Kooistra et al., 2004). Possono essere dedotte altre ORF dalla sequenza nucleotidica di alcuni isolati di TTV, ma il loro significato funzionale resta al momento ignaro (Yokayama et al., 2002). Recenti esperimenti di trasfezione, in cui sono stati introdotti costrutti del genotipo 6 di TTV in cellule di rene umano immortalizzate (cellule 293), hanno evidenziato, mediante metodica di Western blotting, l’espressione di almeno 6 proteine, derivate da 3 distinti mRNA con differenti strategie di traduzione a partire da 2 diversi codoni d’inizio, O1AUG (nt 581) e O2AUG (nt 354). Questi ultimi, ottenuti con splicing alternativi, assumevano dimensioni pressochè identiche (2,8, 1,2, e 1,0 kb) agli mRNA precedentemente identificati in vitro nelle cellule COS1 e nel midollo osseo. E’ stato inoltre possibile , sfruttando adeguati sistemi di marcatura, stabilire la localizzazione sub-cellulare delle 6 proteine: sono stati osservati tre
patterns di espressione secondo cui due proteine derivanti dall’ORF1
ed ORF2 risultavano avere una localizzazione principalmente citoplasmatica, due proteine (ORF2/2 ed ORF 2/3) erano situate esclusivamente nel nucleo, mentre altre due (ORF1/1 ed ORF1/2) erano interposte tra citoplasma e nucleo. Le proteine ORF1 ed ORF2, in base a questo studio, sarebbero tradotte dall’mRNA di 2,8 kb
Introduzione
partendo, rispettivamente, dalle triplette d’inizio O1AUG e O2AUG; le proteine ORF2/2 ed ORF2/3 deriverebbero invece dallo splicing degli mRNA rispettivamente di 1,2 e 1,0 kb partendo da O2AUG; anche ORF1/1 ed ORF1/2 risultano derivare dagli stessi RNA messaggeri di 1,2 e 1,0 kb ma utilizzando O1AUG come codone d’inizio traduzione (Qiu et al., 2005).
Introduzione
Figura I.5: In A lo schema del trascritto primario con indicate le regioni
codificanti e i tre possibili splicing. In B lo schema dei tre trascritti secondari ottenuti dopo lo splicing.
ORF-1 Splice 1: mRNA di 3 Kb ORF-2 ORF-4 ORF-5 ORF-2 Splice 1 e 2: mRNA di 1,2 Kb Splice 1 e 3: mRNA di 1 Kb 0 1000 2000 ORF-2 127-575 ORF-1 453-2765 ORF-5 2431-2941 ORF-4 2238-2757
A
B
Introduzione
La regione non codificante UTR, lunga circa 1,2 Kb, comprende un tratto di circa un centinaio di nucleotidi, con il 90% di basi nucleotidiche costituito da guanina e citosina. Al suo interno è presente anche una sequenza di 36 nucleotidi, caratterizzata da un alto grado di omologia con la stessa regione di CAV (Miyata et al., 1999). Alcuni tratti della UTR risultano estremamente conservati tra tutti i ceppi di TTV al punto da essere utilizzati come bersaglio per lo sviluppo di metodiche di amplificazione capaci di individuare i diversi genotipi del virus; tali regioni così conservate svolgono probabilmente funzioni di grande importanza per la vitalità virale. A questo proposito è stato dimostrato che in tutta la regione UTR, e soprattutto nel tratto ricco in GC, è possibile avere la formazione di complesse strutture secondarie caratterizzate da tipici motivi ad ansa associati a funzioni regolatorie (Hijikata et al., 1999; Miyata et al., 1999; Mushahwar et al., 1999). Attraverso saggi di espressione in vitro (Noteborn et al., 1994), nella regione UTR di CAV sono state evidenziate, in aggiunta al sito di poliadenilazione a valle di VP-1 e al sito di trascrizione TATA BOX a monte di VP-2, una serie di sequenze ripetute invertite che costituiscono elementi di attivazione della trascrizione, ed altre regioni di legame per specifici fattori di trascrizione capaci di stimolare la proliferazione cellulare (SP-1, NF-Kb, AP-2). Questi motivi sono stati ritrovati anche nell’UTR di TTV, compresa una regione palindromica,
Introduzione
posizionata a valle del sito di poliadenilazione, altamente conservata tra i diversi isolati del virus (fino al 90%).
Esperimenti di mutagenesi hanno messo in evidenza la presenza di alcuni elementi regolatori negativi e positivi (figura I.6) con probabile attività cellulo-specifica (Suzuki et al., 2004). Studi recenti hanno inoltre identificato la localizzazione del sito di inizio trascrizione dei 3 RNA messaggeri osservati, che risulta porsi 113 nt a valle rispetto al promotore basale, costituito dalla TATA BOX (Kamada et al., 2004).
Figura I.6: Promotori ed enhancer di TTV in relazione alla struttura
terziaria dell’UTR. Siti conservati per il legame dei fattori di trascrizione: cerchio vuoto, CREB; cerchio pieno. E2F; quadrato vuoto c-Ets, quadrato pieno, USF; esagono SP1; le posizioni sono indicate rispetto al sito di inizio trascrizione (+1 nt). Modificata da Kamada et al., 2004.
Introduzione
1.5 ETEROGENEITÀ GENETICA
TTV e TTMV, a differenza della maggior parte dei virus a DNA, mostrano una straordinaria eterogeneità genetica: l’identificazione delle numerose specie virali altamente divergenti ma correlate a TTV e la rapidità con cui ultimamente vengono isolati nuovi ceppi virali del gruppo TT ne rappresentano una chiara testimonianza.
Tale variabilità genetica riguarda principalmente la regione genomica codificante di TTV, ed è massima nella zona centrale della ORF1 (si osserva soltanto il 32% di omologia fra l’isolato SANBAN e il prototipo TA278) dove sono stati identificati almeno tre segmenti ipervariabili. Queste regioni, definite HVR-1, HVR-2 e HVR-3 codificanti rispettivamente per 22, 47 e 31 amminoacidi nel caso del genotipo 1, mostrano codoni multipli di inserzione o delezione ed una diversità genetica a livello amminoacidico che supera il 70% (Erker et al., 1999; Hijikata et al., 1999; Takahashi et al., 1998b). In uno studio condotto da Nishizawa e collaboratori nel quale è stata analizzata, in un periodo compreso tra tre e otto anni, la sequenza dei prodotti di PCR dedotti dall’ORF1 di due soggetti, è stato osservato che le regioni HVR mostrano un grado maggiore di variabilità in soggetti con infezione cronica e che la stessa diviene particolarmente pronunciata durante la fase acuta dell’infezione. Ciò suggerisce un probabile coinvolgimento di queste regioni nei meccanismi utilizzati dal virus per sfuggire alla risposta immunitaria. Si ritiene inoltre che le HVR siano coinvolte nella
Introduzione
formazione della quasispecie di TTV, come del resto si verifica con l’HVR di HCV e la V3 di HIV (Nishizawa et al., 1999).
Tuttavia, non è stata riscontrata per tutti gli isolati di TTV la medesima variabilità all’interno delle HVR: in un periodo di osservazione compreso tra tre e otto anni le sequenze degli isolati di genotipi 12 e 13 non hanno mostrato rilevanti variazioni (Ukita et al., 2000).
Un altro meccanismo ipotizzato al fine di spiegare l’elevata eterogeneità di TTV è rappresentato dall’utilizzo preferenziale, da parte del virus, di polimerasi cellulari con scarsa capacità di “correzione di bozze” durante il processo replicativo. Sebbene tale ipotesi non sia stata ancora dimostrata, sembra essere avvalorata dall’alta frequenza con cui si verificano le sostituzioni nucleotidiche in alcune regioni del genoma (7,3 x 10-4 per sito per anno nelle HVRs di SENV), risultante simile a quella di virus ad RNA, cioè circa 10 volte maggiore di quella di altri virus a DNA, quali il virus dell’epatite B (HBV; Umemura et al., 2001b).
Un’ulteriore ipotesi avanzata per spiegare l’alto grado di eterogeneità genetica è la possibilità che tra i diversi isolati o addirittura all’interno di uno stesso ceppo virale, avvengano eventi multipli di ricombinazione (Worobey, 2000; Biagini et al., 2001b; Manni et al., 2002). Difatti sono stati identificati 19 siti di ricombinazione omologa, di cui 13 appartenenti alla regione UTR (Worobey, 2000; Biagini et al., 2001b): regione che, dunque, potrebbe avere un importante ruolo
Introduzione
nell’amplificazione dell’eterogeneità genetica (Erker et al., 1999; Hijikata et al., 1999). La ricombinazione potrebbe essere facilitata non soltanto dalle caratteristiche genomiche, ma anche dalla presenza di differenti isolati virali di TTV che spesso circolano contemporaneamente nel sangue o infettano lo stesso distretto corporeo dell’ospite (Worobey, 2000; Niel et al., 2000; White et al., 2000). Anche per TTMV è stata dimostrata la contemporanea presenza di ben 15 diversi isolati nel sangue di un soggetto immunocompromesso (Vasconcelos et al., 2002).
Tuttavia, come emerge da un recente lavoro, non vi è ancora concordanza di opinioni circa l’ipotesi della ricombinazione come causa primaria della spiccata eterogeneità genetica di TTV e TTMV (Jelcic et al., 2004).
Secondo alcuni autori, è sorta l’ipotesi che gli eventi di ricombinazione potrebbero coinvolgere, seppure con frequenza minore, virus animali correlati: molti ceppi simili a quelli identificati nell’uomo sono stati isolati anche in primati non umani ed in altre specie animali, quali cavalli, maiali, capre e galline (Leary et al., 1999; Gibbs et Weiller, 1999; Martelli et al., 2006). Nonostante non sia ancora noto quale importanza possa assumere, ai fini epidemiologici, la presenza di genomi TTV-simili in questi animali, è possibile ipotizzare che questi ospiti mediante il passaggio interspecie possano contribuire all’evoluzione genetica del virus.
Introduzione
Infine il fatto che TTV sia considerato un virus antico, presente nella popolazione umana da migliaia di anni, può giustificare il grado di variabilità genetica che potrebbe essere andata accumulandosi nel corso di lunghi periodi (Hijikata et al., 1999; Prescott et al., 1999).
Introduzione
1.6 REPLICAZIONE
Le modalità assunte dai componenti della famiglia del genere
Anellovirus per replicare il proprio genoma, al momento rimangono
tutte da chiarire; è possibile solo formulare delle ipotesi basandosi sulle analogie condivise dai virus sovracitati con alcuni membri della famiglia Circoviridae ed in particolare con CAV e il circovirus porcino di tipo 2 (PCV-2). Il fatto che nel genoma dei circovirus animali siano assenti sequenze codificanti per DNA polimerasi o per retrotrascrittasi, suggerisce che la loro replicazione è strettamente dipendente da enzimi di origine cellulare. Inoltre, la mancanza di sequenze in grado di alterare il ciclo cellulare della cellula ospite (Todd et al., 2001) e la capacità dei circovirus di propagarsi nelle cellule linfoidi attivate, spingono a supporre che il loro meccanismo replicativi dipenda dallo stato di attivazione della cellula, e in particolare da proteine prodotte durante la fase S del ciclo cellulare (Fields et al., 1996). Anche per TTV è stata dimostrata la necessità di una replicazione in cellule in attiva divisione come quelle del fegato, del midollo osseo, (Okamoto et al., 2000d; Okamoto e Mayumi, 2001) e del sistema linfoide stimolate (Maggi et al., 2001; Mariscal et al., 2001); ciò induce a supporre che il processo replicativo avvenga, almeno in parte, nel nucleo mentre le modalità di assemblaggio del virione non sono al momento conosciute. Inoltre, considerando l’elevata eterogeneità genetica che contraddistingue i virus del gruppo TT (Umemura et al., 2001b), è
Introduzione
probabile che la funzione di replicasi sia compiuta da polimerasi di origine cellulare con scarsa attività di “correzione di bozze”. Resta ancora da chiarire anche la modalità con cui TTV viene rilasciato dalla cellula ospite anche se, comunque, la mancanza di un involucro lipoproteico porta ad ipotizzare che la liberazione dei virioni maturi avvenga per lisi cellulare.
Per la replicazione del genoma di TTV, in virtù delle similarità con i circovirus e in analogia ai virus vegetali e batterici con DNA monocatenario circolare, è stato proposto un meccanismo a cerchio rotante che porterebbe alla formazione di un intermedio replicativo a doppio filamento circolare. Tale ipotesi è rafforzata dall’esistenza di alcuni motivi amminoacidici tipici delle proteine Rep individuati all’interno della regione ORF1 del virus; queste proteine vengono utilizzate dai virus a DNA che si replicano mediante il meccanismo suddetto (Erker et al., 1999); a favorire tale ipotesi è stato il ritrovamento nelle cellule del fegato e del midollo osseo dell’intermedio replicativo di TTV a doppio filamento di DNA (Okamoto et al., 2000d).Tuttavia, la mancanza della sequenza nonanucleotidica indispensabile per le iniziali interazioni durante la replicazione a cerchio rotante, fa dubitare circa il reale utilizzo di TTV di questo modello replicativo (Erker et al., 1999).
Inoltre è stata sottoposta ad indagine l’eventuale capacità di TTV di replicarsi attraverso un intermedio ad RNA (come si verifica per il virus
Introduzione
dell’epatite B, HBV), ma non avendo trovato nel suo genoma alcun motivo codificante per una retrotrascrittasi virale, si ritiene che tale possibilità sia piuttosto improbabile (Nishizawa et al., 1999).
Il ritrovamento del genoma di TTV in un considerevole numero di campioni diversi, ha evidenziato la capacità da parte del virus di infettare una vasta gamma di tipi cellulari; ciò induce a ipotizzare che i recettori utilizzati da TTV durante la fase di riconoscimento cellulare siano probabilmente molecole localizzate a livello di diversi tipi di tessuti, nonostante non sia escluso l’uso di specifici corecettori da parte dei differenti genogruppi e/o genotipi virali. In questa prospettiva è importante sottolineare la presenza di porzioni di genoma ipervaribili (HVR) distribuite nella parte centrale della regione codificante ORF1, porzioni che potrebbero indirizzare il tropismo cellulare di TTV (Takahashi et al., 2002).
Introduzione
1.7 METODI PER LA RIVELAZIONE
DIAGNOSTICA DI TTV
A causa della mancanza di sistemi di coltivazione e metodi sierologici, le tecniche di laboratorio utilizzate per l’identificazione di TTV e TTMV sono sostanzialmente basate sulla ricerca e l’amplificazione molecolare degli acidi nucleici virali. La notevole eterogeneità genetica che caratterizza tali virus, ha reso critica la scelta della regione genomica soggetta ad amplificazione. La regione che è stata inizialmente utilizzata come bersaglio dell’amplificazione è la porzione N22 del gene ORF1 (PCR N22); tuttavia tale regione, non essendo conservata fra tutti gli isolati di TTV, si è rivelata adatta soltanto per l’identificazione dei genotipi dall’1 al 6 (Muljiono et al., 2001). Le conoscenze sempre più approfondite del genoma hanno successivamente permesso l’identificazione di un tratto dell’acido nucleico virale molto più conservato tra tutti gli isolati di TTV; questo tratto appartenente alla regione UTR ha permesso di amplificare con buona sensibilità tutti i genotipi noti di TTV (PCR UTR, o universale) (Okamoto e Mayumi, 2001). Gli isolati virali, una volta identificati e quantificati con metodica di Real-Time PCR, possono essere successivamente caratterizzati mediante PCR genogruppo-specifiche dedotte da differenti regioni genomiche (Maggi et al., 2001c).
Anche per identificare l’infezione da TTMV le metodiche a disposizione si basano sull’amplificazione di una porzione dell’UTR
Introduzione
(Biagini et al., 2001a). L’utilizzo della PCR UTR ha incrementato notevolmente la percentuale dei soggetti risultati positivi per TTV: si è passati difatti dal 23 al 92% nello studio di Takahashi (Takahashi et al., 1998a), dal 9 al 50% nello studio di Irving (Irving et al., 1999) e dal 20 al 95% in quello di Itoh (Itoh et al., 1999b). Nonostante ciò, un quadro definitivo sull’effettiva prevalenza della diffusione di TTV si potrà avere soltanto con lo sviluppo di test sierologici che permettono l’identificazione di forme pregresse d’infezione. Nei pochi studi effettuati, sono stati eseguiti saggi di immunoblotting o di immunoprecipitazione combinata alla PCR; come antigeni sono state utilizzate particelle virali intere o frammenti della proteina ORF1 o ORF2 espressi in batteri. Attraverso un saggio di immunoprecipitazione, nel siero di alcuni pazienti è stato possibile rilevare IgG umane dirette contro il virus e quantificare la percentuale di TTV immunocomplessato; inoltre, utilizzando come antigene il genoma di TTV estratto da campioni fecali sono state rilevate anche le IgM (Nishizawa et al., 1999; Tsuda et al., 1999; Handa et al., 2000; Ott et al., 2000). Tali metodiche, però, non hanno fornito risultati riproducibili, come mostrato dai valori di prevalenza estremamente variabili emersi nei diversi studi (dal 10% al 98% dei soggetti sani sono risultati positivi per anticorpi anti-TTV di tipo G; Handa et al., 2000; Ott et al., 2000; Tsuda et al., 2001; Kakkola et al., 2002).
Introduzione
Probabilmente il tipo di antigene utilizzato è capace di influenzare notevolmente la prestazione del saggio sierologico.
La messa a punto di metodi sierologici sensibili e specifici consentirebbe di individuare tutti quei soggetti che già in precedenza sono venuti a contatto con il virus e che al momento dell’indagine sono risultati negativi per TTV; la risoluzione spontanea dell’infezione da TTV appare difatti un evento possibile (Koboyashi et al., 1999; Matsumoto et al., 1999; Nishizawa et al., 1997).
Introduzione
1.8 EPIDEMIOLOGIA
L’aspetto indubbiamente più interessante dell’epidemiologia di TTV è la sua ampia distribuzione in tutte le popolazioni del mondo indipendentemente dall’area geografica, dall’origine etnica e dallo sviluppo socio-economico.
I primi studi di prevalenza, in cui era stata utilizzata la regione ORF1 come bersaglio di amplificazione nelle reazioni di PCR, avevano segnalato una discreta diffusione del virus, sebbene con distinte percentuali di positività per TTV a seconda dell’area geografica considerata (Niel et al.,1999). Nei paesi industrializzati, Stati Uniti e Nord Europa, la frequenza di TTV risultava piuttosto bassa. Al contrario, nelle popolazioni africane e sud americane si evidenziarono percentuali di positività assai elevate, mentre in Asia il virus era mediamente prevalente. Furono, inoltre, riscontrati livelli di viremia particolarmente elevati in popolazioni isolate, ovvero limitatamente in contatto con le restanti regioni del mondo (Prescott e Simmonds, 1998). In tutti questi studi non fu rilevata alcuna associazione della prevalenza di TTV con lo status clinico dei soggetti, né con altre caratteristiche della popolazione analizzata.
In conseguenza all’introduzione della PCR universale è stata dimostrata una diffusione del virus ancora più sorprendente di quanto ritenuto precedentemente; TTV è stato infatti ritrovato in circa 2/3 della popolazione mondiale, con variazioni, nella maggior parte dei casi,
Introduzione
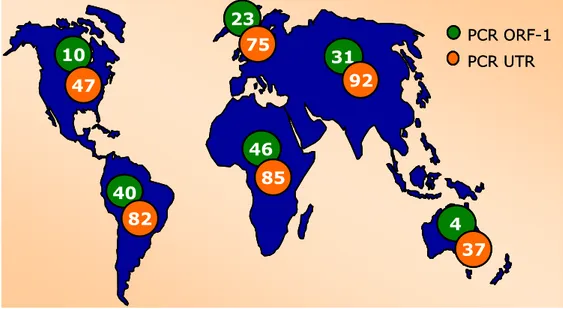
non significative tra le differenti aree geografiche (Biagini et al., 2000; Biagini et al., 2001a; Mastubara et al., 2001; Niel e Lampe, 2001). In base a questi studi TTV è risultato particolarmente diffuso in Asia con una prevalenza che supera il 90%, al contrario è risultato essere meno diffuso (circa 40%) in Nord America e in Oceania (figura I.7).
Figura I.7: Prevalenza di TTV nella popolazione. Le percentuali
indicate si riferiscono ai dati ottenuti amplificando regioni dell’ORF1 (verde) e dell’UTR (rosso), da Bendinelli et al., 2001.
40 46 85 31 23 10 PCR ORF-1PCR UTR 92 82 75 4 37 47 40 40 46 46 85 85 31 31 23 23 10 10 PCR ORF-1PCR UTR 92 92 82 82 75 75 4 4 37 37 47 47
Introduzione
Tuttavia, è opportuno precisare che l’uso della PCR permette di rilevare solo le forme attive dell’infezione, sia acute che croniche, ma non è in grado di evidenziare i casi di infezione pregressa: è dunque ipotizzabile che le percentuali di prevalenza siano ancora più elevate di quelle attualmente registrate. L’isolamento di sequenze di TTV in diversi tessuti anche in assenza di viremia, confermerebbe tale ipotesi (Maggi et al., 2001c; Pollicino et al., 2002).
I dati disponibili per TTMV mostrano similarità con quelli ottenuti per TTV (Biagini et al., 2000; 2001a). La distribuzione di entrambi i gruppi di virus non appare essere influenzata dal sesso dei soggetti esaminati, mentre, secondo alcuni autori, sembra che la frequenza degli individui TTV positivi aumenti con l’età (Oguchi et al., 1999; Yamada-Osaki et al., 1998); sebbene già nella prima infanzia sia stato possibile evidenziare un‘ampia diffusione del virus (Davidson et al., 1999; Hsieh et al., 1999; Vasconcelos et al., 2002; Maggi et al., 2003a), i livelli di prevalenza tendono ad aumentare nel tempo raggiungendo l’apice nell’età adulta (Chen et al., 1999; Davidson et al., 1999; Hsieh et al., 1999; Maggi et al., 1999).
L’alta prevalenza di TTV e TTMV nella popolazione mondiale presuppone che tali virus possano diffondersi attraverso molteplici vie di trasmissione. L’elevata percentuale di positività osservata in numerosi studi fra i soggetti esposti a sangue o agli emoderivati (emofiliaci, emodializzati, politransfusi, talassemici, e
Introduzione
tossicodipendenti) ha dimostrato quanto TTV e TTMV possono essere facilmente trasmessi attraverso la via parenterale. Il ritrovamento di sequenze virali in campioni di feci di soggetti viremici ha inoltre suggerito che tali virus possono essere trasmessi anche per mezzo della via oro-fecale. L’identificazione del genoma di TTV in neonati ha fatto supporre l’esistenza di una via di trasmissione materna-fetale del virus, anche se inizialmente questa ipotesi fosse stata smentita (Okamura et al., 1999; Hsieh et al., 1999; Yokazaki et al., 1999a). Al contrario il ritrovamento di TTV in oltre il 50% dei campioni di sangue cordale esaminati ha confermato questa ipotesi, suggerendo peraltro che le madri infettate dal virione possano trasmettere l’infezione al figlio attraverso la placenta (Morrica et al., 2000); il genoma del virus è stato inoltre ritrovato in campioni di latte materno: ciò spiega l’esistenza di neonati positivi con madri negative e di bambini che presentano isolati virali differenti da quelli identificati nel sangue materno (Davidson et al., 1999).
La trasmissione del virus per via sessuale non è stata ancora chiarita ma, in alcuni studi, TTV e TTMV sono stati isolati dalle secrezioni vaginali, dal fluido spermatico e dalla saliva di alcuni soggetti (Gerner et al., 2000; Kazi et al., 2000; Inami et al., 2000; Liu et al., 2000; Martinez et al., 2000; Matsubara et al., 2000; Matsubara et al., 2001; Schroter et al., 2000; Stark et al., 2000; Biagini et al., 2001a; Chan et al., 2001; Fornai et al., 2001; Krekulova et al., 2001; Pirovano et al.,
Introduzione
2002a). I risultati di un recente studio condotto su bambini di età inferiore ai due anni affetti da malattie respiratorie acute hanno indicato il tratto respiratorio come probabile sede di replicazione di TTV, e proposto la via aerea come un’ulteriore via di trasmissione del virus. I titoli virali determinati nelle secrezioni e nelle cellule nasali dei bambini esaminati risultavano infatti significativamente più alti se posti a confronto con i livelli osservati nei corrispondenti campioni di plasma (Maggi et al., 2003a). In precedenza erano già state identificate sequenze di TTV a livello dell’epitelio respiratorio, nei polmoni, nelle tonsille e nelle adenoidi, a sostegno dell’ipotesi dell’esistenza di una via di trasmissione aerea del virus (Pollicino et al., 2002).
Sequenze molto simili a quelle di TTV sono risultate assai frequenti in varie specie animali di allevamento e da compagnia come gatti e cani: tali ospiti potrebbero rappresentare dei serbatoi naturali di persistenza del virus, nonché possibili fonti di trasmissione interspecie dell’infezione (Leary et al., 1999; Okamoto et al., 2002).
Studi di prevalenza dei diversi genotipi di TTV e TTMV hanno evidenziato una più ampia diffusione di alcuni genotipi rispetto ad altri, come emerge da un lavoro recentemente pubblicato in cui i genotipi 1 e 3 sono stati ritrovati con maggior frequenza nella popolazione generale rispetto al 4 e 5, mentre il genogruppo 2 sembra essere quello più raro (Maggi et al., 2005). Altri lavori hanno invece evidenziato un certo grado di variabilità nella distribuzione geografica
Introduzione
dei vari isolati (Gallian et al., 2000; Mikuni et al., 2002) ad esempio, il genotipo 1 ed alcuni genotipi di SENV sono risultati più diffusi in Asia piuttosto che nei paesi occidentali con il 10% dei donatori giapponesi positivi per SENV-D e SENV-H rispetto al 2-3% dei donatori positivi statunitensi e italiani (Shibata et al., 2001; Umemura et al., 2001a). È stata inoltre dimostrata una differente prevalenza di alcuni genotipi di TTV fra paesi del medesimo continente: l’infezione con i genotipi 22 e 23 appare frequente in Indonesia, ma praticamente assente in Giappone (Muljono et al., 2001).
Resta ancora da chiarire se i diversi genotipi vengano trasmessi con diversa efficienza; in funzione di ciò, in un recente studio sono stati identificati genotipi di TTV appartenenti al genogruppo 2 in soggetti HIV e HBV positivi, ma non in donatori di sangue (Devalle e Niel 2004); inoltre studi compiuti da Pirovano e collaboratori hanno evidenziato una maggiore prevalenza di SENV-A e SENV-B in soggetti tossicodipendenti piuttosto che in individui infettati mediante modalità sessuale (Pirovano et al., 2002b).
Introduzione
1.9 INTERAZIONI CON L’OSPITE INFETTATO
Le conoscenze sulla storia naturale di TTV sono piuttosto scarse. I numerosi studi condotti su TTV hanno dimostrato che una volta acquisita l’infezione, il virus persiste per anni nel sangue della maggior parte dei soggetti infetti, (per almeno 22 anni in uno studio; Matsumoto et al., 1999) suggerendo che la cronicizzazione del virus è l’evenienza più comune. Diversi lavori in letteratura hanno infatti evidenziato che più dell’80% degli individui infettati diviene portatore cronico del virus (Takayama et al., 1999b; Ali et al., 2002; Lefrère et al., 1999; Matsumoto et al., 1999). I meccanismi implicati nella persistenza sono attualmente sconosciuti, tuttavia sembra da escludere che il virus rimanga latente nella cellula ospite in forma episomiale o integrata, fenomeno che risulta possibile per altri virus a DNA (Tanaka et al., 2000a; Yu et al., 2002). La persistenza di TTV potrebbe essere facilitata dalla mancata capacità del sistema immunitario dell’organismo ospite di controllare l’infezione. Gli anticorpi anti-TTV, sebbene siano prodotti durante l’infezione virale, non sembrano in grado, almeno nella maggior parte dei casi, né di eradicare l’infezione né di prevenire le superinfezioni; infatti, le infezioni miste con isolati eterologhi di TTV rappresentano un evento assai frequente, con percentuali del 65% rilevate nei bambini di età inferiore ai sette anni, e addirittura del 90% in soggetti adulti sani (Ukita et al., 2000; Saback et al., 2002; Maggi et al., 2005).
Introduzione
La risposta umorale si manifesta con la rapida comparsa (dopo circa 10-12 settimane dall’infezione), di IgM rilevabili nel sangue solo per 5-11 settimane, seguita da una più lenta produzione di IgG (intorno alla 15°-17° settimana) che solitamente persistono per anni (Tsuda et al., 2001). La capacità di questi anticorpi di neutralizzare il virus resta ancora da dimostrare; dati contrastanti sono stati ottenuti soprattutto per le IgG, la cui presenza correla con la scomparsa o l’assenza della viremia plasmatica, mentre in altri casi non sembra aver prodotto alcun effetto sulla persistenza del virus. Studi condotti da Tsuda e collaboratori hanno infatti evidenziato come la comparsa di immunocomplessi TTV-IgG sia seguita da una riduzione del titolo virale (Tsuda et al., 1999). Al contrario, Nishizawa e collaboratori hanno dimostrato che, in pazienti cronicamente infetti, la maggior parte di TTV circola complessato ad IgG (Nishizawa et al., 1999). L’importanza della risposta cellulo-mediata nel controllo dell’infezione da TTV è un aspetto ancora da chiarire; si ritiene comunque che le cellule del sistema immunitario possano assumere un ruolo essenziale sia nella persistenza che nella disseminazione virale ai vari tessuti. Un evento precoce dell’infezione da TTV è la comparsa del virus nel sangue, come più volte osservato in soggetti trasfusi ed anche in scimpanzè infettati sperimentalmente. La viremia, in tutti questi casi, diveniva dimostrabile dopo 5-8 settimane dall’esposizione e spesso restava evidenziabile per tutto il periodo di osservazione (Mushahwar
Introduzione
et al., 1999; Tawara et al., 2001). I livelli plasmatici del virus nella fase cronica dell’infezione sono paragonabili a quelli di altri virus persistenti, come HCV, HBV e HIV e subiscono un’oscillazione tra 103 e 108 copie per ml di plasma (Pistello et al., 2001) mostrando ampie
fluttuazioni nel tempo in alcuni soggetti ed una relativa stabilità in altri (Ball et al., 1999; Matsumoto et al., 1999). La cinetica del virus è stata studiata in un gruppo di pazienti HCV positivi cronicamente infettati da TTV misurando gli effetti dell’interferone (IFN) sulla viremia (Maggi et al., 2001c). Applicando un modello matematico simile a quello utilizzato per gli studi su HIV e HCV, è stato stimato che l’emivita di TTV nel plasma sia di circa 6 ore, che ogni giorno vengano prodotti almeno 1010 virioni e che più del 90% del virus plasmatico subisca un turnover giornaliero (Maggi et al., 2001c; tabella I.1).
Tabella I.1: Dinamica della viremia plasmatica di TTV confrontata
con quelle di altri virus persistenti.
Virus Emivita del
virione
N° minimo di virioni prodotti al
giorno
Referenza
HBV 1,2 giorni > 1,7 x 10 13 Whalley et al. 2001
HCV 2,7 ore > 1,3 x 10 12 Neumann et al. 1998
HIV < 1 ora > 9,8 x 10 9 Ramratnam et al. 1999
Introduzione
Anche se la cronicizzazione dell’infezione da TTV è l’evento più probabile, in letteratura non mancano neppure casi in cui l’infezione sembra risolversi spontaneamente, talvolta anche dopo anni o mesi dal contagio (Lefrère et al., 1999; Matsumoto et al., 1999; Yuki et al., 1999). In realtà la scomparsa della viremia osservata in questi casi potrebbe non significare la completa eradicazione del virus; a conferma di ciò sono state infatti isolate sequenze di TTV in diversi tessuti anche in assenza di viremia (Maggi et al., 2001c; Pollicino et al., 2002). L’apparente risoluzione dell’infezione potrebbe dipendere da una ridotta immissione in circolo del virus dovuta a fasi di latenza, da una modificazione delle sequenze virali che non permettono più la rilevazione del DNA, o semplicemente da un aumento della sua eliminazione. L’andamento dell’infezione da TTV potrebbe inoltre differire a seconda del genotipo infettante; a tal proposito, in uno studio condotto da Otho e collaboratori è stata osservata la risoluzione spontanea dell’infezione in circa il 20% dei bambini infettati da TTV, ma con diverse percentuali a seconda del genotipo virale coinvolto nell’infezione (Otho et al., 2002). Un ulteriore studio ha evidenziato la scomparsa della viremia nel 77% di soggetti tossicodipendenti infettati con l’isolato SENV (Wilson et al., 2001). Tuttavia, prima di poter affermare con certezza che i genotipi di TTV possiedano una differente capacità di persistenza, sono necessari ulteriori studi in tale direzione. Il genoma di TTV è stato identificato in numerosi fluidi
Introduzione
biologici tra cui bile, saliva, lacrime, seme, secrezioni vaginali, fluido duodenale, liquido sinoviale e fluido cerebrospinale (Deng et al., 2000; Biagini et al., 2001a; Tapiri et al., 2001; Maggi et al., 2001a; Fornai et al., 2001; Nakagawa et al., 2000; Inmai et al., 2000), ad indicare che il virus è diffuso in tutto l’organismo. Inoltre, sono stati ritrovati intermedi replicativi e trascritti virali in molti tessuti (polmone, milza, pancreas, rene, linfonodi, muscolo scheletrico e tiroide; Okamoto et al., 2001) a dimostrazione della capacità del virus di replicarsi in molteplici tessuti infettati (Okamoto et al., 2001) e non solo nelle cellule epatiche o in quelle del midollo osseo, come supposto precedentemente (Okamoto et al., 1998b; Okamoto et al., 2000b; Okamoto et al., 2000d; Kikuchi et al., 2000; Lopez-Alcorocho et al., 2000; Rodriguez-Inigo et al., 2000; Comar et al., 2002). Questi risultati hanno fornito importanti indicazioni, ma l’assenza di sistemi di coltivazione idonei per TTV, non ha ancora permesso l’identificazione di tipi cellulari in grado di supportarne la replicazione. Tuttavia, recenti studi in vitro hanno dimostrato che TTV è capace di infettare i linfo-monociti, ma la sua replicazione avviene solo quando questi ultimi sono opportunamente stimolati. Questo suggerisce che la capacità di replicazione di TTV dipenda dallo stato di attivazione della cellula ospite, come del resto accade per molti altri virus a DNA (Maggi et al., 2001b; Mariscal et al., 2002).
Introduzione
Non è ancora noto se esista una sottopopolazione linfocitaria nella quale il virus si replichi e/o persista in modo preferenziale, ma in alcuni lavori sono state rilevate quantità di virus maggiori a livello dei granulociti e dei linfociti CD19+ (Lopez-Alcorocho et al., 2000;
Takahashi et al., 2002; Yu et al., 2002; Zhong et al., 2002). Anche in tal caso è ipotizzabile che diversi genotipi di TTV abbiano un tropismo cellulare preferenziale, come suggerito dalla discordanza tra le sequenze identificate nei tessuti di un singolo paziente e quelle presenti in circolo (Okamoto et al., 2000c). Contrariamente, il recente ritrovamento di 24 isolati del virus nella milza di un paziente affetto da tumore sembra smentire le ipotesi precedenti (Jelcic et al., 2004). Infine, Moen e collaboratori hanno indagato la possibilità che TTV e TTMV assumano un ruolo come agenti immunomodulanti, similmente a quanto dimostrato per i circovirus animali. Per far luce su tale ipotesi sono stati arruolati tre gruppi di pazienti soggetti a trattamenti immunosoppressivi differenti: i risultati ottenuti, hanno evidenziato cambiamenti nei titoli di TTV in base alle variazioni delle risposte di difesa fisiologiche dell’organismo ospite (Moen et al., 2002b). In altri lavori, a supporto di quanto emerso negli studi condotti da Moen, è stata osservata una riduzione della viremia basale in seguito a trapianti di midollo osseo o a trattamenti mielosoppressivi (Kanda et al., 1999b).
Introduzione
1.10 ASSOCIAZIONE CON LA MALATTIA
Dalla scoperta di TTV ad oggi sono stati svolti numerosissimi studi allo scopo di cercare di far luce sulla reale capacità patogenetica del nuovo virus. Sebbene i risultati di molti lavori lascino aperta la possibilità che l’infezione da TTV e TTMV possa assumere un qualche significato clinico, non si è ancora giunti ad una conclusione certa che definisca tale argomento (Naoumov, 2000).
Sulla base dell’alta prevalenza di TTV e TTMV nella popolazione sana, della loro ubiquitarietà nell’ospite infettato e dell’esistenza di diverse vie di trasmissione, alcuni autori si sono affrettati a ritenerli semplici commensali apotogeni dell’uomo (Griffiths, 1999; Mushahwar, 2000). Poiché TTV è stato inizialmente identificato in pazienti presentanti forme di epatite non-A non-E (Nishizawa et al., 1997), è stato proposto che il virus fosse la causa di epatiti croniche o acute ad eziologia sconosciuta. Tuttavia, studi successivi hanno sollevato seri dubbi circa tale potenzialità patogenetica del virus, in quanto la presenza di TTV è stata dimostrata non soltanto in pazienti con epatiti criptogenetiche ma anche in soggetti privi di alterazioni epatiche o addirittura senza alcuna manifestazione patologica (Berg et al., 1999; Colombatto et al., 1999; He et al., 1999; Kanda et al.,1999; Nakano et al., 1999; Toniutto et al., 1999; Viazov et al., 1998). Inoltre, scimpanzè naturalmente o sperimentalmente infettati con TTV o con virus ad esso correlati non mostravano evidenze biochimiche od
Introduzione
istologiche di danno epatico (Mushahwar et al., 1999; Verschoor et al., 1999). Non è stata neppure dimostrata alcuna correlazione tra l’acquisizione dell’infezione da TTV e la progressione dell’epatite e/o l’entità del danno epatico in studi condotti su pazienti trasfusi e/o coinfettati con il virus dell’epatite B (HBV) o il virus dell’epatite C (HCV) (Giménez-Barcons et al., 1999; Irving et al., 1999; Lefrère et al., 1999; Matsumoto et al., 1999; Oguchi et al., 1999; Berg et al., 1999; Gad et al., 2000; Kao et al., 2000). I risultati emersi da tutti questi studi hanno quindi portato ad escludere un ruolo primario dei virus del gruppo TT nella patologia epatica (Matsumoto et al., 1999; Kao et al., 2000; Shang et al., 2000; Ali et al., 2002). Tuttavia in letteratura sono presenti anche alcuni studi in cui è stata rilevata una possibile associazione tra danno epatico e TTV, come dimostrato dalle sporadiche correlazioni fra viremia ed andamento delle transaminasi in alcuni soggetti (Cleavinger et al., 2000; Forns et al., 1999; Fujiwara et al., 1998; Ikeda et al., 1999; Itoh et al., 1999a; Jiang et al., 1999; Kanda et al., 1999b; Lefrère et al., 1999; Luo et al., 1999; Naoumov et al., 1998).
Inoltre, in studi condotti su pazienti con epatite fulminante, è stata osservata una mortalità del 100% in soggetti TTV positivi e del 50% in quelli negativi (Tanaka et al., 1999): pertanto non è da escludere un coinvolgimento occasionale di TTV nell’aggravamento di quadri patologici a carico del fegato.
Introduzione
In recenti lavori, data la presenza e la capacità replicativa di TTV e TTMV in molti tessuti differenti da quello epatico, è stata valutata l’associazione di tali virus con altri tipi di patologia. A tal proposito è emersa un’interessante relazione tra l’infezione da TTMV e gravi patologie dell’apparato renale (Gallian et al., 2002); è stato inoltre evidenziato, in un esperimento condotto in vitro, un possibile ruolo di TTV nel generare alterazioni in cellule renali simili a quelle osservate nella sindrome nefrosica (Yokoyama et al., 2002). In questo lavoro topi transgenici per varie porzioni dell’ORF1 presentavano segni patologici solo a livello del rene, tanto più gravi quanto maggiore era l’espressione del transgene, a conferma che il danno renale era indotto dalla proteina codificata. Un ulteriore studio, condotto su un gruppo di pazienti sottoposti a trapianto renale, ha sottolineato la persistenza di isolati del genogruppo 1 in questo organo (Szladek et al., 2003).
Al contrario, non è stata rilevata alcuna relazione tra TTV ed anemia aplastica, crioglobulinemia, lupus eritematoso, psoriasi (Kikuchi et al., 2000; Cacoub et al., 2003; Maggi et al., 1999) e neppure con la presenza di infezione da Helicobacter pilori (Toyoda et al., 2000). Parziali correlazioni sono invece state dimostrate in pazienti affetti da diabete, fibrosi polmonare idiomatica, artrite reumatoide ed in emodializzati con bassi livelli di emoglobina e scarsa risposta al trattamento con eritropoietina (Gallian et al., 1999; Bando et al., 2001;
Introduzione
Boysen et al., 2003; Hirata et al., 1998). Inoltre, sono stati evidenziati alti titoli di TTV in bambini con broncopolmonite (BP) piuttosto che in quelli affetti da forme meno gravi di malattie respiratorie acute (MRA), suggerendo un possibile ruolo di TTV come cofattore nella patologia di alcune affezioni a livello di vie aeree (Maggi et al., 2003a).
Di recente, considerando l’omologia che TTV mostra con alcuni circovirus animali, è stata presa in esame l’ipotesi che il virus interagisca con il sistema immunitario dell’organismo ospite (Bendinelli et al., 2001; Simmonds, 2002). A conferma di questo, sono emerse interessanti correlazioni tra TTV e patologie del sistema linfoide: studi condotti da Shibayama e collaboratori hanno evidenziato livelli notevolmente elevati del virus in pazienti immunocompromessi (affetti da AIDS o da altre sindromi intercorrenti), suggerendo un possibile ruolo del sistema immunitario nel controllo della replicazione di TTV; pertanto, i titoli del virus, aumenterebbero in risposta ad un progressivo indebolimento della risposta immunitaria (Shibayama et al., 2002; Simmonds, 2002). Quanto appena sostenuto, è stato anche confermato dall’incremento della viremia di TTV rilevata in pazienti sottoposti a trapianto epatico o a terapia con farmaci immunosoppressivi (Shang et al., 2000), oltre che da una inversa correlazione fra i livelli quantitativi del virus ed il numero dei linfociti CD4+ in pazienti HIV positivi (Christensen et al., 2000; Shibayama et al., 2001; Touinssi et al., 2001). Tuttavia, non è stato osservato un
Introduzione
aumento dei livelli di TTV in pazienti HIV positivi; ciò induce a supporre che in seguito alla deplezione HIV-indotta dei linfociti CD4+, vengano prodotti, solo occasionalmente, fattori necessari per l’incremento del titolo di TTV (Moen et al., 2002a); comunque l’effettivo contributo di TTV nella progressione dell’HIV rimane ancora oggi da chiarire. Le similarità con i circovirus animali hanno inoltre suggerito l’eventualità che alcune delle complicanze ematologiche rilevate in pazienti immunocompromessi, come la neutropenia, la trombocitopenia, e l’anemia possano in qualche misura dipendere dall’incremento dei livelli di TTV nel midollo osseo (Kikuchi et al., 2000; Tokita et al., 2001c; Simmonds, 2002).
Una relazione tra TTV ed alterazioni del sistema immunitario è emersa da uno studio condotto su bambini affetti da MRA, in cui è stata osservata una correlazione tra i titoli del virus ed i livelli di alcune sottopopolazioni linfocitarie circolanti (in particolare con i linfociti T CD3+ e CD4+ e con i linfociti B CD19+; Maggi et al., 2003b). L’alta variabilità genetica che caratterizza i virus del gruppo TTV e TTMV ha fatto pensare anche alla possibilità che i diversi genotipi assumano un differente ruolo in relazione a determinate patologie, come del resto si riscontra per alcuni membri della famiglia Circoviridae: il circovirus porcino (PCV), ad esempio, provoca una grave sindrome da deperimento con immunodepressione nel maiale, ma tale potenzialità patogenetica è attribuibile solo al PCV di tipo 2.
Introduzione
Gli studi condotti allo scopo di chiarire questo importante aspetto hanno fornito interessanti risultati: è emersa, difatti, una correlazione tra il genotipo 1 di TTV e i livelli di transaminasi in soggetti con patologie epatiche e in più, tale genotipo, risultava particolarmente frequente in pazienti con epatite fulminante o con aggravamento delle condizioni cliniche (Okamura et al., 2000; Shibata et al., 2000; Moriyama et al., 2001; Tokita et al., 2001a; 2001b; 2001c; Tokita et al., 2002). Inoltre è stato dimostrato, in uno studio condotto da Umemura e collaboratori, come due genotipi di SENV (SENV-D e SENV-H) fossero maggiormente presenti nel siero di pazienti affetti da epatite post-transfusionale non-A non-G piuttosto che in soggetti sani (Umemura et al., 2001a). Tuttavia, studi successivi hanno riportato risultati contrastanti (Kao et al., 2002; Mikuni et al., 2002; Yoshida et al., 2002).
Introduzione
1.11 SENSIBILITÀ AI FARMACI ANTIVIRALI
Le conoscenze odierne circa la sensibilità di TTV ai farmaci antivirali derivano da ricerche compiute su pazienti coinfettati da altri agenti virali, in particolare da HCV; di conseguenza quasi tutte le osservazioni riguardano il comportamento della viremia di TTV in corso di terapia con interferone (IFN). Le risposte ottenute per TTV sono risultate paragonabili a quelle per HCV. La terapia con IFN induce, in circa il 50% dei pazienti, una scomparsa della viremia plasmatica di TTV, già ben evidente dopo una o due settimane di somministrazione e persistente per tutta la durata del trattamento (Kao et al., 2000; Dai et al., 2002). Nel restante 50% si registrano alcuni casi in cui la terapia con IFN non mostra significativi effetti sui livelli della viremia, mentre in altri casi il titolo virale varia in modo considerevole durante il periodo di osservazione, per poi tornare, al termine del trattamento, ai livelli basali (Akahane et al., 1999; Berg et al., 1999; Chayama et al., 1999; Maggi et al., 1999). Tuttavia non è escluso che in molti casi la ricomparsa di TTV alla fine del trattamento possa essere dovuta ad una nuova infezione (Ali et al., 2002). Vi sono scarsi elementi per definire quali parametri siano responsabili dei diversi tipi di risposta osservati. Nonostante ciò, la presenza di bassi livelli di viremia pre-trattamento di isolati di TTV filogeneticamente distanti dal prototipo TA278 si sono rivelati parametri predittivi di una più efficace risposta all’IFN (Akhane et al., 1999; Chayama et al.,
Introduzione
1999). La combinazione di IFN con ribavirina mostra, allo stesso modo di quanto osservato per HCV, una maggiore efficacia nell’indurre una risposta a lungo termine verso TTV (Berg et al., 1999). Non è oggigiorno noto se esistano differenze nella suscettibilità all’IFN fra i differenti genotipi di TTV. Tuttavia, isolati di SENV sono risultati particolarmente sensibili all’azione dell’IFN: il 60-80% dei soggetti infettati mostrava difatti la scomparsa del virus circolante dopo trattamento farmacologico (Umemura et al., 2002; Wong et al., 2002). Contrariamente a quanto osservato con l’IFN, la terapia antiretrovirale in pazienti HIV positivi non ha alcun effetto sulla viremia da TTV, né la presenza del virus sembra alterare l’efficacia dei farmaci antiretrovirali (Watanabe et al., 2000; Kawanaka et al., 2002).