Capitolo 2
ANATOMIA DELLA COLONNA VERTEBRALE E DEL
MIDOLLO SPINALE
2.1 ASPETTI ANATOMO-FUNZIONALI DELLA COLONNA VERTEBRALE
La colonna vertebrale rappresenta il punto di repere per l'anestesia epidurale e subaracnoidea, riveste quindi notevole importanza la conoscenza anatomica e funzionale di questa struttura.
Figura 2.1. Apparato scheletro di un cane
La colonna vertebrale o rachide è una struttura solida ma nel contempo flessibile, si compone di numerose ossa brevi e impari che prendono il nome di vertebre, queste sono attraversate, in tutta la loro estensione, dal canale vertebrale o rachidiano che racchiude le meningi, il midollo spinale e tutte le strutture a esso correlate. Il rachide sostiene nella sua estremità craniale la testa, mentre la sua estremità caudale rappresenta un tratto libero ed assottigliato, da attacco alle coste nella regione toracica e alla cintura pelvica a livello del bacino, funge, inoltre, da sostengo allo scheletro appendicolare. Le azioni meccaniche che esercitano sulla colonna vertebrale variano secondo i tratti considerati e le connessioni presenti, per questo le vertebre che la costituiscono, presentano tra loro differenze morfologiche che corrispondono a specializzazioni funzionali, da ciò ne consegue che in base ai
caratteri, connessioni e costituenti, il rachide si può dividere in cinque regioni: cervicale, toracica, lombare, sacrale, caudale (o coccigea).
In una vertebra tipo si distinguono le seguenti porzioni:
− il corpo vertebrale
− l'arco vertebrale
− i processi vertebrali
Figura 2.2. Vertebra toracica e lombare anatomia
Il corpo vertebrale rappresenta il componente principale di ogni vertebra, ha una forma quasi cilindrica e possiede una superficie articolare convessa (estremità craniale) e una superficie articolare concava (estremità caudale). Entrambe queste estremità sono rivestite da un esile strato di cartilagine ialina che corrisponde alla porzione non ossificata dei corpi vertebrali. Tali superfici articolari collegano i corpi delle vertebre adiacenti per mezzo di un disco intervertebrale. La faccia dorsale di ogni corpo vertebrale è attraversata da solchi longitudinali, da fori nutritizi per i vasi sanguigni e da una cresta legamentosa. La faccia ventrale comprende la cresta ventrale, variamente sviluppata nei diversi tratti della colonna vertebrale.
L'arco vertebrale, definito anche arco neurale, si estende sopra la faccia dorsale del corpo vertebrale e delimita ventralmente uno spazio definito foro vertebrale. I singoli fori vertebrali sono allineati in modo tale da formare un canale vertebrale che accoglie il midollo spinale, i suoi rivestimenti, le radici dei nervi spinali, vasi sanguigni, legamenti, tessuto adiposo e tessuto connettivo lasso. Gli archi vertebrali presentano, in entrambi i lati sia cranialmente che caudalmente, un'incisura vertebrale per lato, rispettivamente craniale e caudale, che forma insieme all'incisura della vertebra contigua il foro intervertebrale. Attraverso questi fori emergono i nervi del midollo spinale. Gli archi vertebrali risultano separati dagli spazi interarcuali, che
in alcuni segmenti acquistano una particolare importanza per i riferimenti clinici che li contraddistinguono.
I principali spazi interarcuali sono:
− spazio occipito-atlandoideo
− spazio atlanto-epistrofico
− spazio lombo-sacrale
Questi spazi rivestono un particolare significato clinico per il prelievo di liquor cerebrospinale, inoculazione di anestetici o mezzi di contrasto.
I processi vertebrali (o apofisi) servono per l'inserzione di muscoli e legamenti e contribuiscono a collegare le vertebre tramite articolazioni.
Nelle vertebre si distinguono i seguenti processi:
− un processo spinoso sull'arco vertebrale in posizione mediana − due processi trasversi lateralmente alla base dell'arco vertebrale
− quattro processi articolari rispettivamente due craniali e due caudali in
corrispondenza del processo spinoso
− due processi mamillari solo nelle vertebre toraciche e lombari, tra i processi
trasversi e quelli articolari craniali
− due processi accessori soltanto in corrispondenza delle ultime vertebre
toraciche (carnivori e maiale) e a livello di tutte le vertebre lombari (carnivori) tra i processi trasversi e quelli articolari caudali.
2.2 ARTICOLAZIONI INTERVERTEBRALI
Le articolazioni del rachide possono essere distinti nel modo seguente:
• Articolazioni del rachide
- l'articolazione atlanto-ocipitale (tra l'occipitale e la prima vertebra cervicale) - l'articolazione atlanto-epistrofea (tra la prima e la seconda vertebra cervicale) - le altre articolazioni intervertebrali (tra l'ultima vertebra lombare e l'osso sacro) In questa sede verranno descritte le articolazioni intervertebrali.
Le articolazioni intervertebrali diverse da quella ocipitale ed atlanto-epistrofea, sono decisamente meno mobili ma, in considerazione del fatto che si
ripetono per tutta l'estensione del rachide, permettono ampie possibilità di movimento che sono fondamentali nella locomozione. Le strutture anatomiche comprese tra due vertebre adiacenti costituiscono il “segmento motorio che rappresenta un'unità morfo-funzionale costituita da:
− articolazioni degli archi vertebrali
− articolazioni tra corpi vertebrali
− dischi intervertebrali fibrocartilaginei
− legamenti
Le articolazioni che si instaurano tra i processi articolari craniali e caudali degli archi vertebrali, articolazioni tra gli archi vertebrali, sono delle articolazioni sinoviali o
diartrosi.
Le articolazioni tra i corpi vertebrali invece, avvengono mediante l'interposizione di un disco fibrocartilagineo detto disco intervertebrale, per questo tali articolazioni possono essere definite delle sinfisi. I dischi intervertebrali risultano interposti tra l'estremità craniale (testa) di una vertebra e l'estremità caudale (fossa) della vertebra precedente.
Ogni disco intervertebrale è formato da un nucleo polposo centrale, circondato da uno spesso anello di cartilagine fibrosa. Esternamente l'anello fibroso è rivestito da uno strato di tessuto connettivo fibroso. I dischi intervertebrali negli animali di giovanissima età perdono i vasi sanguigni e pertanto successivamente il loro nutrimento è affidato esclusivamente a processi di diffusione. Le superfici craniale e caudale di ogni disco intervertebrale risultano intimamente connesse alle superfici articolari dei corpi vertebrali, grazie alla presenza di una complessa disposizione delle fibre collagene che compongono la fibrocartilagine dell'anello fibroso, “stratificazione lamellare”. Questa disposizione delle fibre collagene conferisce al disco intervertebrale una notevole resistenza alle forze di torsione e compressione che intervengono durante la locomozione distribuendo le pressioni omogeneamente in tutte le direzioni, “funzione a cuscinetto d'acqua”(König & Liebich, 2006).
2.3 LEGAMENTI DEL RACHIDE
Figura 2.3. Rappresentazione schematica dei legamenti lunghi e brevi del rachide
I legamenti del rachide possono essere distinti in legamenti brevi, che si estendono da una vertebra ad un'altra adiacente, e legamenti lunghi, che vanno da una vertebra ad un'altra non adiacente collegando porzioni molto più ampie del rachide.
Tra i legamenti brevi si ricordano i seguenti:
− legamenti interarcuali
− legamenti interspinosi
− legamenti intertrasversari
I legamenti interarcuali, si estendono sugli spazi interarcuali sotto forma di lamine elastiche, tali legamenti conferiscono elasticità e solidità al rachide e coadiuvano l'azione dei muscoli rachidiani. I legamenti interspinosi, si estendono tra i processi spinosi di due vertebre adiacenti; nel cavallo tali legamenti sono elastici nel tratto cervicale, nel bovino essi sono elastici nel tratto coccigeo, nei carnivori tali legamenti sono ben sviluppati nel tratto toracico ed in quello lombare. I legamenti interspinosi svolgono il compito di impedire una eccessiva flessione del rachide. I legamenti intertrasversari, si estendono tra i processi trasversi di due vertebre adiacenti: tali legamenti sono ben sviluppati nel tratto lombare e vengono tesi durante la deviazione laterale del rachide ed i suoi movimenti rotatori.
vengono classificati come:
− legamento longitudinale dorsale
− legamento longitudinale ventrale
− legamento sopraspinoso
− legamento nucale
Il legamento longitudinale dorsale è adagiato nel pavimento del canale rachidiano, sulla superficie dorsale dei corpi vertebrali e si estende dal processo odontoideo dell'epistrofeo fino all'osso sacro, inserendosi sulle creste legamentose dei corpi vertebrali e sui dischi intervertebrali. Il legamento longitudinale ventrale è ben sviluppato dell'ottava vertebra toracica fino all'osso sacro, inserendosi sulla cresta ventrale dei corpi vertebrali e sui dischi intervertebrali. Il legamento sopraspinoso si estende per tutta l'estensione del rachide ad eccezione del tratto cervicale e si inserisce sulla sommità dei processi spinosi. Si oppone ad un eccessiva flessione del rachide. Il legamento nucale, si porta dalle prime vertebre toraciche all'occipitale o all'epistrofeo a seconda delle specie (König &Liebich, 2006).
2.4 MENINGI
All'interno del canale vertebrale, il midollo spinale è circondato da tre membrane specializzate: le meningi, comprendenti la dura madre, o pachimeninge per la sua robustezza, aracnoide e pia madre chiamate entrambe anche leptomeningi per la loro natura più sottile e la comune origine embriologica. L'associazione tra le componenti cellulare e fibrillare delle meningi dà origine ad una complessa struttura che può essere considerata a tutti gli effetti un organo a sé stante; queste componenti sono morfologicamente e fisiologicamente implicate nella protezione meccanica, immunologica e termica dell'encefalo e del midollo spinale.
Le meningi, in particolare la dura madre, provvedono alla protezione meccanica del midollo spinale, grazie alla flessibilità della loro ultrastruttura e alla presenza di numerose fibre elastiche.
Figura 2.4. Anatomia spazio extradurale e intradurale
La dura madre è costituita da diversi strati di fibre collagene, consta di due lamine le quali sono bene identificabili nel neonato umano, tuttavia nell'adulto, la lamina esterna non può essere identificata come uno strato separato dal periostio del canale vertebrale. Le due lamine della dura madre risultano separate ma non identificabili a livello del canale vertebrale, dove solamente la lamina interna, circonda il midollo spinale conferendo, assieme al tessuto adiposo ed ai plessi venosi vertebrali interni un supporto flessibile tale da consentirgli un movimento armonioso con le strutture scheletriche. Lo spazio epidurale è lo spazio compreso tra dura madre e colonna vertebrale ma in realtà è uno spazio intradurale poiché viene a trovarsi tra le due lamine della dura madre(Groem & Ponssen, 1991). A livello dello spazio
lombosacrale e tra l'ultima vertebra sacrale e la prima coccigea, lo spazio epidurale è
sufficientemente ampio da consentire l'inoculazione di anestetici (anestesia
epidurale). La dura madre accompagna i nervi spinali formando una guaina che si
estende fino ai fori intervertebrali, dove si fonde con il margine di tali aperture.
L'aracnoide è una membrana delicata, non vascolarizzata, in stretto contatto con la lamina interna della dura madre, dalla quale è separata da uno spazio virtuale: lo
spazio subdurale. La porzione spinale dell'aracnoide viene attraversata, in entrambi i
lati, da numerosi piccoli legamenti triangolari che, nell'insieme, formano il legamento denticolato; essi si inseriscono, in alternanza con l'emergenza delle radici
dei nervi spinali, tra pia madre e il tubo durale, contribuendo in tal modo alla sospensione del midollo spinale. La faccia interna dell'aracnoide aderisce alla pia madre mediante trabecole e filamenti, da questa trama che nell'insieme assume l'aspetto di una ragnatela deriva il nome di questa meninge. Lo spazio presente al di sotto dell'aracnoide contiene liquido cerebrospinale e prende il nome di spazio subaracnoideo.
La pia madre si compone in effetti di due lamine strettamente unite, una esterna e l'altra interna. La lamina esterna, ancora denominata “lamina epipiale” si compone di una densa rete di trabeccole formate da fibre collagene accompagnate da fibrociti e unite a quelle dell'aracnoide. Nelle maglie di questa rete si distribuiscono i rami terminali dei vasi sanguigni, che assumono una disposizione plessiforme e dai quali partono le arteriole e le venule che penetrano parallelamente nel tessuto nervoso. Assai aderente al tessuto nervoso, penetra fino al fondo dei solchi ed in particolare della fessura ventrale; si prolunga inoltre sulle radici dei nervi spinali, che inguaina sotto il loro rivestimento aracnoideo. Da ciascun lato, la pia madre invia, verso la dura madre delle espansioni che contribuiscono a fissare il midollo spinale al suo fodero meningeo: i legamenti denticolati.
La lamina interna, talvolta denominata “intima della pia madre”, aderisce fortemente al tessuto nervoso che ricopre. Si compone di una delicata rete di fibre elastiche e collagene, presenta fibroblasti e macrofagi, la sua finalità principale è quella di nutrire il parenchima nervoso grazie alla miriade di vasi in essa contenuti. La pia madre costituisce l'ultima barriera protettiva del parenchima nervoso, tuttavia è altamente permeabile e permette il passaggio di anestetici locali, composti morfino-simili ed altre molecole (Barone & Bartolami, 2006).
2.5 ANATOMIA DEL MIDOLLO SPINALE
Il midollo spinale è la parte del sistema nervoso centrale che risiede nella colonna vertebrale ma ne occupa completamente solo la parte centrale, rimanendo separato dal medesimo per l'interposizione dello spazio perimidollare che contiene le meningi
spinali ed, esternamente a queste, il tessuto adiposo peridurale nel quale decorrono
abbondanti vasi sanguiferi, sopratutto venosi (Cattaneo, 1989).
Figura 2.5. Schema anatomici del midollo spinale e delle meningi
Il midollo spinale origina dallo sviluppo delle due lamine laterali del primitivo tubo neurale ed ha aspetto di un cordone cilindrico lungo il quale si localizzano due “rigonfiamenti”, cervico-toracico e lombo-sacrale, corrispondenti all'emergenza delle radici dei nervi destinati agli arti anteriori e posteriori.
Nelle fasi precoci dello sviluppo il midollo occupa l'intera lunghezza del canale vertebrale. A seguito della crescita continua e progressiva della colonna vertebrale il midollo subisce una diminuzione del volume relativo, questo processo è noto come
ascensus medullae. L'apice caudale del midollo spinale si assottiglia nel cono midollare e si continua come un filo (filum terminale). A seguito dell'ascesa del
midollo, i segmenti spinali sono posizionati più rostralmente rispetto alle loro vertebre corrispondenti. Il fascio composto dalle radici lombari, sacrali e coccigea che circondano il filum terminale, caudalmente al midollo, è noto come cauda
equina (Nieuwenhuys & Voogd, 2008). In direzione rostrale il midollo spinale si
continua senza una precisa delimitazione nel midollo allungato. Lunghezza e diametro del midollo spinale sono oltre che specie-specifiche anche correlate alla mole dei singoli soggetti; inoltre, il calibro del midollo spinale non è uniforme lungo tutto il suo percorso, poiché, a livello dell'emergenza delle radici dei nervi spinali destinati agli arti vi è un incremento del volume della sostanza grigia a cui consegue un aumento di calibro del midollo spinale. Le radici dei nervi destinati agli arti toracici emergono a livello delle ultime vertebre cervicali e in via accessoria dalla prima o prime due vertebre toraciche. In questa porzione del midollo spinale quindi è possibile rilevare un aumento del diametro midollare che prende il nome di
intumescenza cervicale (C6 Cane e Gatto, C4 nell'Uomo). Per gli stessi motivi, a
livello degli ultimi segmenti lombari (L4 in Cane, Gatto e Uomo) e primi segmenti sacrali, si evidenzia un'altra intumescenza midollare, chiamata intumescenza
lombare. Il peso del midollo spinale non è direttamente correlato al peso corporeo di
ciascun animale; è molto variabile ed è relativamente più elevato nelle specie di piccole dimensioni. Il midollo spinale si presenta di colore lattescente, piuttosto consistente, ma nel contempo, elastico; appare di forma più o meno cilindrica, anche se si sviluppa più in larghezza che in altezza, sopratutto a livello delle intumescenze sopracitate. Considerandone le caratteristiche generali, in ogni suo segmento il midollo spinale presenta una faccia dorsale e una ventrale e due margini laterali, simmetrici. La faccia dorsale, a livello mediano, è caratterizzata dalla presenza del solco mediano dorsale e, da ciascun lato, essa dà impianto alle radici dei nervi spinali, lungo una linea longitudinale a livello della quale è possibile riscontrare, un solco laterale dorsale, più o meno visibile a seconda del tratto considerato.
2.6 VASCOLARIZZAZIONE DEL MIDOLLO SPINALE
Nella regione cervicale il midollo spinale viene irrorato da arterie segmentali provenienti dalle arterie vertebrali, mentre nelle regioni più caudali la vascolarizzazione è affidata ai vasi segmentali delle arterie intercostali e delle arterie lombari. I vasi penetrano nel canale vertebrale attraverso i fori intervertebrali e si suddividono in un ramo dorsale ed un ramo ventrale, che penetrano nel midollo spinale insieme alle radici dei nervi spinali e si collegano reciprocamente per mezzo
di anastomosi; si vengono a formare così tre arterie dirette in senso longitudinale. L'arteria spinale ventrale, decorre in prossimità della fessura mediana ventrale, mentre le due arterie più sottili attraversano il solco dorsale laterale, che si trova in corrispondenza dei punti di emergenza delle radici dorsali. Sulla superficie del midollo spinale si originano plessi vascolari, che provvedono all'irrorazione delle porzioni profonde. La sostanza grigia possiede una vascolarizzazione notevolmente più ricca rispetto alla sostanza bianca. Le vene spinali formano un reticolo simile a quello delle arterie. Anche vene effluenti decorrono insieme alle radici spinali. Esse sboccano nel sistema dei seni epidurali. Questi plessi venosi epidurali decorrono su entrambi i lati lungo i corpi vertebrali e si collegano tra loro a livello dei singoli segmenti, formando una sorta di scala a pioli. Queste vene possiedono una sottile parete, sono prive di valvole quindi il sangue può circolare in ogni direzione e sono collegate con i plessi venosi collocati esternamente alla colonna vertebrale. Questi ultimi possiedono valvole e sboccano in base alla loro posizione nella vena vertebrale, nella vena cava craniale, nella vena azigos o nella vena cava caudale ( König & Liebich, 2006).
Figura 2.6. Vascolarizzazione del midollo spinale
2.7 MIDOLLO SPINALE: CONFORMAZIONE INTERNA
Disposizione generale
Il midollo spinale è una struttura caratterizzata da simmetria bilaterale, che viene suddivisa in superficie da incisure più o meno profonde. Dorsalmente si distinguono un solco mediano dorsale poco profondo e il suo prolungamento in profondità, il
setto mediano dorsale. Ventralmente si insinua la profonda fessura mediana ventrale. In corrispondenza dei punti di ingresso delle radici nervose dorsali su
entrambi i lati si trova dorso-lateralmente un solco dorsale laterale. I punti in cui escono le radici nervose ventrali sono provvisti soltanto di un solco poco profondo.
Sostanza grigia
In sezione trasversale la sostanza grigia del midollo spinale presenta una forma ad H o a farfalla. Questa caratteristica forma è riconducibile ad una coppia speculare di
corna dorsali poco sviluppate ed una coppia speculare di corna ventrali di regola
più sviluppate. Le corna dorsale e ventrale di ogni lato sono reciprocamente collegate da una porzione intermedia laterale o, nel tratto toracolombare, da un corno laterale. Nel tratto cervicale si osserva inoltre una formazione reticolare costituita da cellule nervose disperse. Da un punto di vista tridimensionale, le corna dorsali, ventrali e laterali formano fasci disposti in colonne, che vengono denominate in base alla loro collocazione. Si distinguono infatti le seguenti colonne:
• Colonna dorsale (corno dorsale)
• Colonna laterale (corno laterale)
• Colonna ventrale (corno ventrale)
Nella colonna grigia dorsale si trovano prevalentemente neuroni afferenti somatici e viscerali, che si raggruppano per formare dei nuclei. Queste cellule nervose si collegano con le cellule radicolari sensitive dei gangli spinali situati nelle radici dorsali. Nella porzione toracolombare del corno laterale sono localizzati i neuroni coinvolti nelle funzioni motorie viscerali. Nella porzione intermedia si trovano le regioni nucleari del nucleo simpatico (nucleo intermedio laterale). Nella porzione sacrale del corno laterale si accumulano cellule nervose che si aggregano a formare il nucleo parasimpatico (nucleo intermedio mediale) e che stabiliscono collegamenti con il corno ventrale. La colonna grigia ventrale contiene in prevalenza i neuroni coinvolti nelle funzioni somatomotorie, consentite dalla presenza di un nucleo, chiamato nucleo motorio. Da un punto di vista funzionale, le cellule nervose della sostanza grigia vengono suddivise in cellule radicolari ed in cellule interne. I neuriti delle cellule radicolari emergono dal midollo spinale attraverso il corno ventrale sotto forma di fila radicularia e si aggregano per formare la radice ventrale del nervo spinale. Le cellule interne provvedono al coordinamento all'interno della
sostanza grigia e possono collegare direttamente cellule nervose dello stesso lato (cellule intercalari) oppure, attraverso commessure, cellule nervose dei due lati (cellule commessurali). I loro neuriti penetrano in parte anche nella sostanza bianca per stabilire contatti tra le varie porzioni del midollo spinale o tra midollo spinale ed encefalo. In questo contesto si distinguono i neuroni associativi , che collegano altre cellule nervose in direzione ascendente o discendente, e cellule cordonali (o funicolari), che conducono gli impulsi in direzione dell'encefalo.
Sostanza bianca
La sostanza bianca ricopre esternamente la sostanza grigia e contiene prevalentemente fibre nervose mieliniche ascendenti e discendenti. Nel midollo spinale le guaine mieliniche di queste fibre nervose vengono formate da cellule gliali dell'oligodendroglia, che, nel loro insieme, forniscono l'aspetto bianco a questa porzione del midollo spinale.
La sostanza bianca viene suddivisa in fasci che si distinguono sia per la loro localizzazione che per la loro funzione. Innanzitutto si distinguono fasci principali (funicoli), riconoscibili macroscopicamente, e fasci secondari (fascicoli), visibili microscopicamente. Nelle diverse specie animali questi comprendono varie vie nervose (tratti), che possono essere studiate anche da un punto di vista neurofisiologico. I fasci principali possono essere suddivisi in:
• Funicolo dorsale
• Funicolo laterale
• Funicolo ventrale
Il funicolo dorsale viene delimitato dal solco mediano dorsale, che si continua con un setto gliale fino alla sostanza grigia, e dalla linea di origine delle radici dorsali dei nervi spinali. Il funicolo laterale è collocato tra le radici dorsali e quelle ventrali dei nervi spinali. Il funicolo ventrale invece è quello situato tra le radici ventrali dei nervi spinali e la fessura mediana ventrale. Ventralmente tra due metà del midollo spinale è collocata la commessura bianca. Nel funicolo dorsale decorrono in prevalenza vie ascendenti, che trasmettono all'encefalo gli impulsi relativi alla sensibilità superficiale e profonda. I funicoli ventrale e laterale comprendono invece sia vie ascendenti (sensitive) che discendenti (motorie). Nelle immediate vicinanze
della sostanza grigia si trovano inoltre l'apparato proprio del midollo spinale. Le sue fibre stabiliscono collegamenti tra i vari distretti midollari (fasci propiospinali o fondamentali). I fasci propiospinali contengono assoni di neuroni localizzati interamente nel midollo spinale: tali assoni sia ascendenti che discendenti, mediano nel loro insieme la coordinazione intersegmentale dei vari neuromeri spinali (Standring, 2008). Le vie ascendenti e discendenti del midollo spinale non possono essere distinte né microscopicamente né macroscopicamente e la loro localizzazione è stata determinata sulla base di particolari casi clinici e grazie alla sperimentazione animale.
Da un punto di vista clinico è importante sapere che nel funicolo dorsale decorrono soltanto vie sensitive ascendenti, mentre nei funicoli laterale e ventrale si trovano vie motorie sia ascendenti che discendenti.
2.8 VIE DI CONDUZIONE DEL SISTEMA NERVOSO CENTRALE
Le vie ascendenti e discendenti del sistema nervoso centrale non sono visibili macroscopicamente. Il loro decorso è stato ricostruito in base a determinate patologie, ad interventi di neurofisiologia sperimentale e mediante l'impiego di tracciati assonali.
Vie ascendenti (vie della sensibilità somatica)
Le vie ascendenti trasmettono all'encefalo le percezioni sensitive, tatto, pressione, calore, dolore, vibrazioni e stato delle articolazioni e dei muscoli. I recettori raccolgono queste “sensazioni” e le trasmettono sotto forma di potenziali d'azione ai centri superiori dove vengono elaborate dal midollo spinale e dal tronco cerebrale per poter modulare le risposte che altrimenti sarebbero stereotipate (König & Liebich, 2006).
Figura 2.7. Principali fasci di fibre del midollo spinale
Le cellule radicolari (neuroni sostanza grigia) di queste vie si trovano nei gangli
spinali delle radici dorsali dei nervi spinali o nel ganglio del nervo trigemino (V).
In questo gruppo di vie si distinguono i seguenti due sistemi:
1. Lemnisco mediale e laterale
2. Sistema extralemniscale
Vie del sistema lemniscale
Il lemnisco mediale comprende le principali vie ascendenti dell'encefalo e viene suddiviso in lemnisco spinale, che trasferisce sensazioni che viaggiano lungo il midollo spinale e provengono dal tronco e dagli arti ed in lemnisco trigeminale, per le fibre sensitive provenienti da quasi tutta la testa. Le vie ascendenti decorrono nei funicoli dorsali del midollo spinale. Le fibre provenienti dal plesso lombosacrale e dalle porzioni caudali del tronco sono collocate in sede maggiormente mediale (fascio gracile), quelle provenienti dalle porzioni craniali del tronco e dal plesso brachiale, d'altra parte, si trovano in sede maggiormente laterale (fascicolo cuneato). Le fibre terminano rispettivamente nel nucleo gracile e nel nucleo cuneato del midollo allungato. Dopo la formazione di sinapsi, le fibre dei neuroni secondari
decussano e si portano come lemnisco mediale su aree nucleari del talamo. In tale sede queste vengono nuovamente commutate e vengono proiettate nelle aree somatosensoriali della corteccia. Al lemnisco mediale si associano anche le fibre sensitive del nucleo trigemino, che decussano nel ponte. Il lemnisco laterale appartiene alla via acustica. Una parte delle fibre dei nuclei cocleari decussa e si porta al versante controlaterale e, successivamente, alla corteccia uditiva del lobo temporale.
Vie del sistema extralemniscale
Le vie del sistema extralemniscale decorrono nei funicoli laterali e ventrali della sostanza bianca del midollo spinale. Dalle cellule radicolari dei gangli spinali gli stimoli raggiungono il corno dorsale del midollo spinale, dove vengono commutati su vari interneuroni prima di raggiungere la sostanza bianca. Tali fibre terminano nel talamo, da dove vengono proiettate sulla corteccia cerebrale. Rispetto alle fibre del lemnisco mediale, queste fibre sono caratterizzate da una conduzione più lenta e da una localizzazione meno precisa della percezione del dolore. Le informazioni delle vie propriocettive non vengono percepite in maniera conscia, provengono dai muscoli, dai tendini e dai fusi neuromuscolari e vengono inviate al cervelletto. A partire da neuroni del corno dorsale, tali fibre decorrono nel tratto spino-cerebellare dorsale e ventrale.
Una parte considerevole delle vie ascendenti è costituita dalle vie che trasmettono le sensazioni dolorifiche, tattili, pressorie e termiche. Le afferenze originano dai gangli spinali, si inseriscono nel midollo spinale a livello delle radici dorsali e si dirigono controlateralmente, incrociandosi a livello della commessura bianca. Tali fibre poi risalgono il midollo spinale, andando a costituire i fasci spinotalamici laterale e ventrale. Il primo è responsabile della trasmissione delle stimolazioni termiche e dolorifiche, mentre il secondo di quelle tattili e pressorie; entrambi terminano a livello dei nuclei ventro-caudali talamici, da dove poi gli impulsi vengono convogliati alla corteccia somatoestesica parietale. Negli animali esiste anche un altro sistema implicato nella trasmissione degli stimoli nocicettivi: il sistema cervicale laterale; questo viene attivato da sensazioni tattili, vibratorie e propriocettive e le sue fibre percorrono ipsilateralmente il tratto spinocervicale del funicolo laterale lungo tutto il midollo spinale, fino a raggiungere il nucleo cervicale
laterale. Quest’ultimo si trova nella porzione più dorsale del funicolo laterale dei primi quattro segmenti cervicali e le sue proiezioni si portano controlateralmente a livello della commessura bianca ventrale, andando così a unirsi con il lemnisco mediale controlaterale, per poi proseguire con esso e terminare nel nucleo ventrale caudo-laterale del talamo (segmento spino-cervico-talamico).
Negli animali domestici, un’altra importante via di trasmissione degli stimoli algici è quella che avviene lungo i tratti intersegmentali del midollo spinali, infatti, i tratti di Lissauer, negli animali, presentano estensioni intermetameriche della fibra sensitiva che si portano cranialmente o caudalmente, contraendo sinapsi con la sostanza grigia di metameri più a valle o più a monte. Queste fibre contattano nel corno dorsale la sostanza gelatinosa di Rolando e poi, spesso, decussano attraversando il fascicolo proprio che è situato in profondità e a stretto contatto con la sostanza grigia. Questa via trasmette sensazioni dolorifiche profonde originatesi a livello dei recettori tendinei e articolari.
Vie discendenti (motorie somatiche )
Le vie discendenti trasportano stimoli efferenti, integrati dalle strutture encefaliche superiori, che vengono trasmessi ai motoneuroni delle corna ventrali o ai neuroni vegetativi del corno intermedio laterale. La contrazione della muscolatura striata volontaria viene regolata da due popolazioni di neuroni motori, o motoneuroni, del sistema nervoso centrale:
• Motoneuroni Inferiori
• Motoneuroni Superiori
Vengono definite motoneuroni inferiori la totalità delle cellule radicolari motorie della colonna ventrale (corno ventrale) della sostanza grigia del midollo spinale e quelle dei nuclei motori dell'encefalo. Tali neuroni possono essere coinvolti in riflessi semplici, sebbene la loro attività sia influenzata generalmente da neuroni superiori. I motoneuroni superiori si trovano in prevalenza nell'area motoria del neopallio, ma anche nel nucleo rosso del mesencefalo e nella formazione reticolare.
Le vie motorie decorrono in due sistemi discendenti, la via piramidale e la via
extrapiramidale.
Sebbene queste due vie siano strettamente collegate tra loro, quella piramidale provvede sopratutto ai movimenti precisi, mentre la via extrapiramidale controlla i
movimenti più grossolani ed i movimenti che si ripetono ritmicamente nella locomozione(König & Liebich, 2006 ).
Via piramidale
Negli animali superiori la via piramidale è più sviluppata rispetto a quanto si osserva negli animali inferiori. Nella nostra specie, una lesione a livello di questa via provoca una paralisi permanente della muscolatura volontaria del versante controlaterale. Nei mammiferi domestici, invece, si manifesta soltanto un disturbo a livello della postura controlaterale e l'animale si riprende, almeno parzialmente, in tempi brevi (König & Liebich, 2006) .
Il sistema Piramidale è filogeneticamente di più recente acquisizione da parte del sistema nervoso, perciò non deve sorprendere che la sua più alta espressione fisiologica si rinvenga nei primati. Per questo i deficit clinici che derivano da lesioni del sistema, producono, come prevedibile, una incapacità funzionale molto maggiore nell'Uomo che negli animali (es cane, gatto) (Jenkins, 1989). Le fibre della via piramidale prendono la loro origine dalle cellule gigantopiramidali di Betz dell'area motoria del neopallio. Esse attraversano la capsula interna lateralmente al talamo e raggiungono ventralmente i peduncoli cerebrali e, caudalmente a questi, il ponte. Le fibre della via piramidale determinano a livello del midollo allungato la presenza delle piramidi. Nella via piramidale decorrono tre gruppi di fibre: le fibre
cortico-spinali appena nominate, che rappresentano le fibre più lunghe del corpo e si portano
dalla corteccia cerebrale al midollo spinale, le fibre cortico-bulbari, che si portano ai nuclei dei nervi cranici controlaterali, e le fibre cortico-pontine, che raggiungono i nuclei del ponte. Alcune delle fibrecortico-spinali si incrociano nel midollo allungato per raggiungere il versante controlaterale, mentre alte decussano soltanto poco prima dell'organo bersaglio. Nei mammiferi domestici la via piramidale presenta differenze specie-specifiche. Nel gatto e nel cane essa raggiunge tutti i livelli del midollo spinale. Nel cavallo, al contrario, la via piramidale sembra terminare già alla fine del tratto cervicale del midollo spinale. Anche la componente di fibre che decussano nel midollo allungato varia. Nel gatto e nel cane la decussazione coinvolge quasi tutte le fibre, mentre nel cavallo soltanto il 50% delle fibre si incrociano.
Vie extrapiramidali
Oltre alla via piramidale, le funzioni motorie vengono regolate anche da fibre provenienti da altre regioni della corteccia e da aree subcorticali, e che nell'insieme costituiscono il sistema o via extrapiramidale. A differenza della via piramidale, il sistema extrapiramidale è formato da percorsi polisinaptici. Le aree nucleari del sistema extrapiramidale sono il corpo striato, il globo pallido, il nucleo subtalamico, il nucleo rosso e la sostanza nera. A tali nuclei si collegano altri centri motori di integrazione, come il cervelletto, i nuclei talamici, la formazione reticolare ed i nuclei vestibolari.
Il sistema motorio extrapiramidale influenza movimenti volontari, regolando l'equilibrio e la postura corporea mediante movimenti muscolari involontari. In assenza di tali azioni l'animale non sarebbe in grado di compiere movimenti coordinati. Numerosi processi retroattivi del sistema extrapiramidale provvedono ad equilibrare gli impulsi eccitatori ed inibitori di altre vie nervose. Tutti i processi che si svolgono nel sistema extrapiramidale vengono controllati dal cervelletto, infatti esistono vie cerebellari che terminano nel nucleo rosso e nei nuclei talamici. Rispetto al sistema piramidale quello extrapiramidale è molto più diffuso e più difficile da definire per quanto riguarda gli specifici particolari anatomici, le funzioni e gli effetti delle lesioni di qualsiasi sua parte e/o connessioni(König & Liebich, 2006) .
La via extrapiramidale regola automatismi che non richiedono la partecipazione continua della volontà e raggiungono il loro massimo sviluppo negli animali, a seconda dell’origine, è possibile distinguere almeno 4 fasci principali:
• Il fascio rubrospinale, che prende origine nel nucleo rosso e che, a livello midollare, decorre ventralmente al fascio corticospinale laterale, con cui prende sinapsi con gli α-motoneuroni; è responsabile dei movimenti collettivi altamente coordinati.
• Il fascio tetto-spinale, che origina dai collicoli rostrali, incrocia a livello della decussazione tegmentale dorsale e discende nel midollo spinale lungo la fessura mediana ventrale, fino ai primi quattro metameri cervicali; regola i movimenti posturali riflessi di occhi, testa e corpo e condiziona i riflessi di difesa e fuga e l’orientamento.
• Il fascio vestibolo-spinale, che si suddivide in mediale e laterale; il primo origina principalmente dal nucleo vestibolare mediale e, in parte, decussa,
per poi discendere il midollo lungo la fessura ventrale fino a metà del segmento toracico. Il secondo origina dal nucleo vestibolare laterale e decorre ipsilateralmente nel margine ventrale del cordone ventrale per tutta l’estensione del midollo spinale. Regola l’equilibrio e l’attività dei muscoli estensori e flessori degli arti.
• Il fascio reticolospinale pontino (ventrale) e bulbare (laterale), che fanno parte del sistema reticolare; il primo prende origine dalla sostanza reticolare pontina caudale e discende il midollo ipsilateralmente fino a livello sacrale, esercitando un’azione facilitatoria sui motoneuroni dei muscoli estensori. Il secondo origina dalla sostanza reticolare del midollo allungato e decorre a livello del cordone ventrale del midollo spinale, decussando solo in piccola parte (Jenkins, 1989) .
2.9 IL SISTEMA NERVOSO AUTONOMO
Il sistema nervoso autonomo (SNA) è quella parte del SN che regola funzioni involontarie che non sono sotto il controllo cosciente. I neuroni del SNA innervano i muscoli lisci dei visceri, il muscolo cardiaco, i vasi sanguigni e le ghiandole del corpo. Il SNA presenta una parte centrale formata da neuroni contenuti nel nevrasse e una periferica costituita dai nervi e dai gangli periferici che contengono i neuroni postgangliari che innervano gli organi effettori.
Il SNA viene suddiviso in una componente simpatica e una parasimpatica. Tale suddivisione risponde a criteri anatomici, biochimici e funzionali. Dal punto di vista anatomico, i corpi cellulari dei neuroni pregangliari (fibra mielinizzata) del SNA sono contenuti in tre regioni del tronco encefalico e in due regioni del midollo spinale. Dai segmenti toracici e dai primi lombari origina l'efferenza toracolombare simpatica del SNA. Dai nuclei del III (oculomotore), VII (facciale), IX (glossofaringeo), X (vago), XI (accessorio) nervo cranico e dai segmenti sacrali 2,3,4, originano, rispettivamente, l'efferenza craniale e sacrale parasimpatica del SNA (Colucci, et al;2011). Il corpo cellulare di un neurone pregangliare, localizzato nel contesto del sistema nervoso centrale (SNC), instaura una sinapsi giunzionale con il corpo cellulare del neurone postgangliare (fibra non mielinizzata) che si trova al di fuori del SNC in una struttura definita ganglio del SNA. L'assone di queste cellule si dirige perifericamente e va ad innervare un organo effettore.
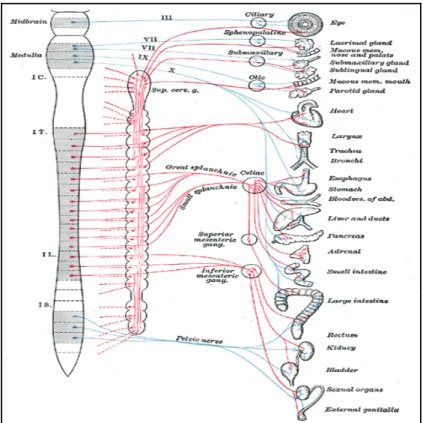
Figura 2.8. Rappresentazione schematica del sistema nervoso autonomo
La giunzione fra terminale assonico postgangliare e cellula effettrice viene definita giunzione o sinapsi neurone-effettoriale. Molti visceri od organi sono innervati sia da fibre parasimpatiche sia da fibre simpatiche che producono effetti antitetici sulla stessa struttura innervata. Ad esempio fibre parasimpatiche del vago determinano riduzione della frequenza cardiaca mentre i nervi cardiaci simpatici incrementano la frequenza cardiaca. Tali reciproche interferenze consentono diversi gradi di variazioni qualitative e quantitative della funzione dell'organo, a seconda delle relative necessità dell'organismo. L'informazione fra nervo e nervo e fra nervo ed organo effettore viene trasmessa mediante un processo chiamato trasmissione neurormonale. Questo processo comporta la liberazione di una sostanza chimica (neurotrasmettitore) da parte di un terminale assonico e questa interagisce con siti recettoriali specifici a carico della cellula raggiunta dal terminale stesso. La conseguente attivazione del recettore promuove la caratteristica risposta fisiologica della cellula effettrice. Il neurotrasmettitore che opera a livello di gangli (sia
parasimpatici sia simpatici) e di giunzione neuroeffettoriale parasimpatica è sempre l'acetilcolina (ACh). La noradrenalina è il trasmettitore liberato in quasi tutte le giunzioni neuroeffettoriali simpatiche e viene considerato il neurotrasmettitore del simpatico, anche se in alcune giunzioni neuroeffettoriali come le ghiandole sudoripare dell'uomo, il trasmettitore è l'ACh. I nervi che liberano dal loro terminale l'ACh vengono chiamati colinergici mentre quelli che liberano noradrenalina vengono chiamati adrenergici (Adams, 1999).
Sistema nervoso simpatico
Il sistema nervoso simpatico viene anche sinonimicamente definito come sezione efferente toraco-lombare del SNA in quanto l'origine delle sue vie efferenti è contenuta in tale sezione del midollo spinale. Gli assoni dei neuroni pregangliari originano infatti da corpi cellulari localizzati nelle colonne intermediolaterali della sezione toracolombare del midollo spinale. Si tratta di fibre mieliniche che escono dal midollo spinale nel contesto delle radici nervose ventrali (anteriori) generando fasci (rami comunicanti bianchi) prima di penetrare nella catena di gangli paravertebrale del simpatico. I rami comunicanti grigi sono invece fasci di fibre postgangliari amieliniche che fuoriescono dalla catena gangliare paravertebrale per rientrare nella radice dei nervi spinali distribuendosi poi alle strutture di cui sono tributari (ghiandole sudoripare, vasi sanguigni, follicoli piliferi) negli arti e nel tronco dell'organismo. I gangli paravertebrali sono disposti come una catena bilaterale in corrispondenza della faccia ventrale della colonna vertebrale e sono fra loro, in ciascuna delle due catene, interconnessi mediante fibre nervose che li collegano in una vera e propria catena estesa fra le regioni cervicale e sacrale.
Il simpatico è il sistema dell’emergenza e in genere in tali situazioni, l’animale necessita di una buona stimolazione dei recettori visivi e ciò giustifica la midriasi, la ventilazione polmonare aumenta e la necessità di avere le vie aeree pervie, da qui la broncodilatazione. L’aumentata richiesta di ossigeno da parte dei tessuti impegnati in tali situazioni comporta un aumento dell’attività cardiaca in termini sia di frequenza sia di inotropia, mentre la vasocostrizione periferica contribuisce all’incremento della pressione ematica, favorendo gli organi, come il cuore stesso e i muscoli scheletrici, in cui l’aumento di attività comporta una vasodilatazione. Nelle condizioni di lotta o
fuga l’attività del canale alimentare e quella delle vie urinarie vengono meno, da cui l’inibizione della muscolatura parietale e la stimolazione di quella degli sfinteri; infine, la glicogenolisi epatica e la lipolisi nel tessuto adiposo hanno l’effetto di mettere a disposizione dei tessuti energia di pronto utilizzo. È da ricordare, però, che il sistema simpatico non viene attivato solo in situazioni di emergenza, ma è sempre in funzione.
Sistema nervoso parasimpatico
Mentre l'attivazione del sistema simpatico comporta consumo di energia, il sistema parasimpatico opera sopratutto per produrre o risparmiare energia biologica. L'attività parasimpatica è stata anche definita come un complesso di processi del “vivi e lascia vivere”. I neuroni pregangliari di tale sistema sono situati in sede cranica e in corrispondenza della sostanza grigia intermedia dei primi tre metameri sacrali.
La sezione efferente del parasimpatico origina dal mesencefalo, dal bulbo e dalla sezione del midollo spinale. La componente parasimpatica del sistema nervoso autonomo è quindi spesso definita anche con il termine anatomico di sezione efferente cranio-sacrale.
Il nervo Vago è il X paio di nervi cranici ed è considerato il tronco nervoso parasimpatico più importante. Esso ha origine dal midollo allungato e invia fibre efferenti a tutti i visceri toracici e addominali dalla regione faringea caudale alle porzioni craniali del grosso colon.
La porzione sacrale del parasimpatico è costituita da fibre che originano dalla sezione sacrale del midollo spinale. Queste fibre formano i nervi pelvici e terminano in cellule gangliari situate nel colon, nella vescica e negli organi sessuali. I gangli parasimpatici sono sempre situati molto più perifericamente di quelli simpatici e di solito sono strettamente connessi con le strutture innervate. In molti casi il ganglio parasimpatico è addirittura posto all'interno dell'organo innervato e di conseguenza le fibre postgangliari parasimpatiche sono normalmente molto corte. Lo stimolo parasimpatico è settoriale e può controllare singolarmente sistemi efferenti particolari (Adams, 1999).
2.10 MECCANISMI DI TRASMISSIONE DEL SEGNALE
Le unità funzionali del tessuto nervoso sono i neuroni. Essi sono in grado di esibire la proprietà tipica del sistema nervoso di generare un potenziale d'azione in seguito a eccitazione elettrica e di propagarlo lungo i loro prolungamenti senza significativo decremento. Ogni neurone invia informazioni ad altri neuroni o cellule efferenti mediante un prolungamento del proprio corpo cellulare (soma o pirenoforo) di vario diametro e lunghezza, più o meno arborizzato, chiamato assone, e riceve informazioni da altri neuroni o cellule degli organi di senso mediante un diverso gruppo di prolungamenti citoplasmatici, detti dendriti. I neuroni pertanto sono cellule polarizzate “costruite” per essere inserite in un circuito (Colucci D’Amato et al., 2011). La funzione delle cellule nervose richiede che gli impulsi possano essere trasferiti ad altri elementi nervosi o agli organi bersaglio. Ciò si realizza attraverso strutture di contatto altamente specializzate, le sinapsi. Si distinguono diversi tipi di sinapsi in rapporto al punto in cui si stabiliscono i contatti. Le sinapsi
assodendritiche interessano la terminazione assonica e l'area dendritica; le assosomatiche, l'assone ed il pirenoforo; le assoassoniche, due cilindrassi (Pelagalli
& Botte, 1980). La maggior parte dei neuroni contengono un neurotrasmettitore classico e almeno un'altra sostanza con funzioni di neuromodulatore. Questi ultimi sono costituiti da piccoli neuropeptidi come angiotensina II, bradichinina, colecistochinina (CCK), encefalina, sostanza P ecc. La funzione principale dei neuromodulatori è quella di facilitare o deprimere le risposte del neurone post-sinaptico con effetti anche a lungo termine. A differenza dei neurotrasmettitori “classici”, i neuromodulatori vengono rilasciati ed interagiscono con i rispettivi recettori anche al di fuori del vallo sinaptico. I neurotrasmettitori “classici” sono sintetizzati nel citoplasma e accumulati nelle vescicole sinaptiche. Queste si aggrappano alla membrana sinaptica mediante specifiche proteine di ancoraggio e fondono con la membrana quando giunge il potenziale d'azione che determina un aumento locale della concentrazione di calcio.
Da un punto di vista anestesiologico, è importante conoscere la fisiologia di base delle cellule nervose, per poter meglio comprendere la funzione degli anestetici stessi. Il neurone a riposo presenta un potenziale negativo determinato dalla presenza, tra i compartimenti intra- ed extracellulare, di un gradiente di
concentrazione ionica. Il gradiente di concentrazione è determinato dai movimenti passivi di Na+e K+, legati in particolare a una maggiore permeabilità della membrana
per il K+. Il valore del potenziale a riposo è uguale al potenziale di equilibrio di tale
ione (EK pari a -80 mV) e si discosta solo in minima parte per la presenza di una
ridotta permeabilità di membrana agli ioni Na+e Cl-. Pertanto, il potenziale di riposo
risulta essere regolato dalla diversa permeabilità della membrana agli ioni, dagli anioni proteici intrappolati all’interno della cellula e dalla pompa Na+-K+,
ATPasi-dipendente. Quest’ultima trasporta attivamente ioni Na+ all’esterno della cellula e
ioni K+ all’interno della cellula, contro gradiente di concentrazione, convogliando
così gli ioni carichi positivamente all’esterno della cellula e annullando l’effetto della permeabilità di membrana degli ioni Na+. Quest’ultima viene ostacolata anche dal
diametro dei canali presenti a livello della membrana, i quali permettono il passaggio degli ioni K+ e Cl-, ma non quello degli ioni Na+. La diffusione del potassio,
dall’esterno all’interno, e quella del cloro, in senso opposto, rendono possibile la separazione delle cariche tra l’interno e l’esterno della cellula, determinando così una differenza di potenziale tra i due lati della membrana, mantenuta dal corretto funzionamento della pompa Na+/K+. D'altro canto per conducibilità si intende una
transitoria modificazione della permeabilità ionica e del potenziale transmembranario in seguito all’insorgenza di uno stimolo; affinché questo possa determinare l’instaurarsi di un potenziale d’azione, è necessario che sia sufficientemente intenso da portare il potenziale transmembranario a un livello critico che prende il nome di “potenziale soglia”. Una volta raggiunto tale grado di depolarizzazione si osserva un repentino aumento della permeabilità agli ioni Na+ e un loro conseguente ingresso,
secondo gradiente di concentrazione, dall’esterno all’interno della cellula; tale evento, quindi, andrà a incrementare le cariche positive intracellulari determinando così una depolarizzazione della cellula stessa. Tale modificazione della conduttanza agli ioni sodio viene seguita da un incremento graduale della permeabilità allo ione potassio. Tale evento determina un ingresso di ioni K+, secondo gradiente di
concentrazione, e una conseguente ripolarizzazione della membrana. Pertanto, la trasmissione del potenziale d’azione dipende da una serie di eventi concatenati caratterizzati dalla modificazione della permeabilità di membrana ai vari ioni; infatti, a un’iniziale depolarizzazione segue un’inversione del potenziale transmembrana e, infine, una ripolarizzazione che ripristina il potenziale di riposo di membrana. Gli
ioni si muovono attraverso la membrana tramite canali specifici; dapprima viene coinvolto il canale del sodio voltaggio-dipendente, che viene attivato e inattivato molto rapidamente, mentre il secondo canale che viene coinvolto nel meccanismo di trasmissione dell’impulso è quello del potassio voltaggio-dipendente, che a differenza del precedente, viene attivato lentamente e non va incontro a inattivazione. Da un punto di vista anestesiologico riveste una particolare importanza il canale del sodio, poiché è l’oggetto del meccanismo di azione degli anestetici locali; questi, dopo aver penetrato la membrana lipoproteica, si legano a un sito recettoriale presente a livello del canale del sodio, ostacolando così il flusso ionico. Da ciò ne deriva un rallentamento della velocità di depolarizzazione, che non permette il raggiungimento del potenziale soglia e la propagazione dell’impulso.