1. INTRODUZIONE
1.1 LE PIANTE MEDICINALI IN ITALIA
Nel termine comunemente noto di “Piante officinali”, indicate anche con l’acronimo MAP (Medicinal and Aromatical Plant), è compreso un numero molto elevato di specie di largo impiego nel settore farmacologico, cosmetico, liquoristico e alimentare per le prerogative dei loro principi attivi. In realtà, è stato acquisito il significato tradizionale dal termine “officina” derivante dall’antico laboratorio artigianale dove nel passato si estraevano le droghe vegetali, di largo impiego nella medicina popolare. Di conseguenza, è frequente l’uso alternativo di termini differenti come “piante medicinali”, “piante aromatiche”, “piante da essenze”, secondo le varie possibilità d’impiego. (Marzi, 1999)
Le piante officinali destinate al consumo diretto o all’industria di trasformazione stanno assumendo sempre più importanza; negli ultimi 20 anni il mercato è incrementato a tassi crescenti, nonostante la forte competitività esercitata soprattutto in termini di prezzo dal prodotto importato da paesi extracomunitari.
I dati ISAFA nel biennio 1999-2000 sottolineano i relativi incrementi che queste colture hanno avuto nel nostro paese. Dall’indagine è risultato che nel 1999 la superficie investita a piante officinali superava i 3.000 ettari ; le colture sono maggiormente diffuse nel nord e nel centro, in particolar modo in Toscana e in Piemonte. Nel sud, ad eccezione del bergamotto coltivato in Calabria, sono presenti molte specie aromatiche e la liquirizia ancora raccolte allo stato spontaneo. Secondo i dati disponibili è possibile affermare che la produzione di piante officinali in Italia è molto frammentata: a fronte di un elevato numero di specie coltivate (più di 100) sono poche quelle che hanno aree di coltivazione ampie. Fra queste è possibile ricordare bergamotto, camomilla comune, frassino da manna, iperico, lavanda e lavandino, liquirizia e menta piperita (tab. 1).
Dallo studio condotto dall’ISAFA emerge quindi un deciso aumento della produzione nell’arco dell’ultimo decennio, ma anche una forte disorganizzazione delle imprese, una minima parte delle quali lavora su contratto, poche delle quali aderiscono a cooperative o consorzi attrezzati per la prima lavorazione, trasformazione o commercializzazione delle piante officinali e dei prodotti da essi derivati (Vender, 2001; Marzi, 1999).
Comunque, in confronto ad altri paesi della Comunità Europea, la situazione italiana appare del tutto modesta (tab. 2): in linea di massima è possibile ascrivere a queste specie il ruolo di colture “nicchia” nelle diverse realtà regionali (Marzi, 1999).
SPECIE SUPERFICIE COLTIVATA (ha) Bergamotto 1.500 Camomilla comune 171 Frassino da manna 200 Iperico 156 Lavanda e Lavandino 133 Liquirizia 146 Menta piperita 239
Tab. 1: Principali specie officinali coltivate in Italia, ripartite in base alla superficie investita (Vender, 2001)
STATO ETTARI ADIBITI A COLTIVAZIONE ORDINE DI IMPORTANZA PRINCIPALI COLTURE IN
Italia 1.022 (esclusi i 1.000 ha di bergamotto e i 250 ha di frassino da manna) Menta, camomilla, lavanda, lavandino
Francia 25.000 Lavandino, lavanda, papavero
Spagna 18.000 Lavanda e lavandino, papavero, anice verde, menta, carvi, salvia
Olanda 1.500 Papavero, carvi, digitale
Germania 4.800 Carvi, camomilla, maggiorana, finocchio, coriandolo Grecia 1.500 Zafferano, aneto, menta, papavero, carvi, senape
Austria 2.000 Papavero, carvi, senape
Gran Bretagna 4.000 varie
1.2 LE BIOTECNOLOGIE APPLICATE ALLE SPECIE OFFICINALI
L’Organizzazione Mondiale della Sanità ha stimato che più dell’80% della popolazione dei paesi in via di sviluppo affida la cura di malattia all’utilizzo di erbe medicinali, e che nei paesi sviluppati il loro consumo è in forte crescita. Approssimativamente due terzi delle 50000 specie di piante medicinali in uso sono raccolte allo stato spontaneo, ridimensionando così anche la proporzione di quelle coltivate in pieno campo, che non supera il 10% delle specie utilizzate (Canter et al, 2005).E’ noto che la quantità di piante selvatiche va sempre più riducendosi sia per una loro indiscriminata raccolta sia perché in questi ultimi tempi sono notevolmente aumentate le estinzioni “innaturali”, perciò stiamo assistendo sempre più velocemente a fenomeni di erosione genetica e scomparsa della biodiversità .
L’interesse per la coltivazione delle piante officinali, in alternativa alla raccolta di quelle spontanee, nasce inoltre dalla necessità di garantire al mercato un approvvigionamento costante sia dal punto di vista quantitativo che qualitativo (Falcone, 1990).
I problemi riscontrati a livello qualitativo e superabili con l’uso di sistemi biotecnologici (micropropagazione, colture cellulari in sospensione) sono ad esempio l’elevata eterogeneità del prodotto ottenuto, inadatto soprattutto ad un rifornimento continuo e non più indice di garanzia di migliore qualità per le produzioni titolate.
I benefici effetti medicinali delle piante provengono tipicamente dalla combinazione dei prodotti del metabolismo secondario dei vegetali. Inizialmente, i metaboliti secondari erano visti come un punto di arrivo nelle vie metaboliche e la definizione che ne veniva data era quella di composti chimici che non hanno un ruolo nel metabolismo primario.
Negli ultimi 50 anni invece la ricerca ha mostrato il loro ruolo centrale nell’ecofisiologia della pianta: in special modo queste molecole eterogenee dal punto di vista chimico hanno compiti come la difesa contro erbivori, attacchi patogeni, possono fungere da sostanze allelopatiche e attrattive verso pronubi o organismi simbionti. Inoltre i metaboliti secondari hanno anche un’azione protettiva contro stress abiotici come quelli associati a shock termici e idrici, esposizione agli UV, cambiamenti nutritivi. Infine recenti lavori indicano un possibile ruolo nelle piante come PGR, modulatori di espressione genica e nella cascata di segnale (Briskin, 2000).
Tali principi attivi sono classificati in base ai loro percorsi biosintetici, in tre grandi famiglie molecolari: alcaloidi, isoprenoidi (Terpeni e Steroidi) e composti fenolici. I metaboliti secondari, a differenza di quelli primari che devono essere mantenuti stabili sia per concentrazione che per struttura chimica per assicurare l’integrità strutturale e funzionale
delle cellule, hanno un “elevato grado di libertà” per quanto riguarda struttura e concentrazione
(
Maffei, 1999 e Collin, 2001). Ad esempio, il contenuto in flavonoidi nelle piante, oltre che dal genotipo, dipende strettamente dalle condizioni ambientali, soprattutto dalla radiazione luminosa; è noto, ad esempio, che in molte specie le radiazioni UV inducono significativi incrementi nel contenuto fogliare di flavonoidi (Lercari et al, 1997). L’impiego di sistemi di coltura artificiale, quali l’idroponica, la coltura in vitro e la microponica (coltura in vitro di tipo autotrofo) presenta numerosi vantaggi rispetto alle colture in campo; innanzitutto , potendo disporre di una fornitura costante nel tempo, vengono superati il problema della stagionalità della produzione di metaboliti secondari, quello della variabilità dovuta alle condizioni meteorologiche e quello della specificità di produzione legata all’area geografica di crescita della pianta. In secondo luogo si esclude la presenza sia sulle piante che in eventuali estratti di sostanze tossiche quali erbicidi, pesticidi, o altri inquinanti ambientali, giacché la coltura avviene in sterilità.Questa tecnologia inoltre semplifica il problema della raccolta, trasporto e stoccaggio del prodotto in quanto l’estrazione può essere effettuata appena la coltura ha raggiunto condizioni adeguate. Infine, permette la salvaguardia dell’ambiente in quanto il naturale equilibrio biologico non viene modificato a causa di una raccolta intensiva di piante a crescita lenta (Minghetti, 2003).
1.2.1 Sistemi di coltivazione in vitro
I sistemi di coltivazione in vitro rappresentano uno strumento essenziale per l’opportunità di sfruttare cellule, tessuti, organi o interi organismi coltivandoli e manipolandoli geneticamente per ottenerne i composti desiderati (Ramachandra Rao et al, 2002); gli aspetti principali sono elencati in figura 2.
Fig. 1. Linee guida per la produzione di metaboliti secondari da colture di organi vegetali (Bourgaud et al., 2001)
Lo sviluppo di protocolli di micropropagazione per un buon numero di piante medicinali è il primo passo per selezionare e moltiplicare piante altamente produttive per un dato composto, la crioconservazione è un’altra area di fondamentale importanza per la conservazione della qualità del materiale ottenuto. La coltura di cellule vegetali permette la produzione su larga scala di numerosi metaboliti secondari. Le trasformazioni genetiche permettono l’attivazione di vie metaboliche secondarie o la produzione ex-novo di molecole. La sinergia di tutti questi aspetti è la vera potenzialità della coltivazione in vitro.
• Moltiplicazione di plantule in vitro
La rigenerazione in vitro si presenta come primo e fondamentale passaggio per ottenere un numero indefinito di cloni di una stessa pianta prescelta.
Il mezzo di coltura ed il tipo di espianto variano secondo la strategia di rigenerazione che si intende seguire.
La produzione di biomassa in vitro può essere ottenuta attraverso la coltura intensiva di piantine complete, di embrioni somatici, di tessuti particolari (radici, hairy roots)
(
Biomassa differenziata)o attraverso la produzione di callo su substrato solido e di colture e sospensioni cellulari in substrato liquido (Biomassa indifferenziata).
La micropropagazione è definita come propagazione “true-to-type”(letteralmente: fedele alla tipologia) di genotipi selezionati mediante tecniche di propagazione in vitro (Debergh et Maene, 1981). La propagazione delle piante in vitro avviene, in funzione della specie e delle condizioni di coltura, mediante quattro metodi fondamentali:
1. proliferazione di gemme ascellari (coltura di germogli) 2. coltura di segmenti nodali
3. formazione di germogli avventizi mediante organogenesi 4. embriogenesi non zigotica
Originariamente, Murashige (1974) aveva illustrato i tre stadi per effettuare con successo la micropropagazione; tuttavia i problemi connessi con l’impianto della coltura asettica indussero Debergh e Maene (1981) ad includere un ulteriore stadio, detto “stadio 0”, che illustrava specifiche tecniche colturali volte a mantenere la sanità della pianta madre e ridurre la percentuale di contaminazione degli espianti nella fase di impianto della coltura asettica.
Stadio 0: Selezione e preparazione della pianta madre. Prima dell’impianto della coltura, particolare attenzione dev’essere posta nella selezione e nel mantenimento delle piante madri utilizzate come fonte di espianti. La sterilità è necessaria soprattutto per espianti provenienti da piante cresciute in pieno campo, spesso contaminate dai più svariati microrganismi. Oltre a contaminanti esterni spesso si verificano anche contaminazioni interne che possono essere espresse anche dopo anni di sub-coltura, e ciò a causa di batteri o funghi endofitici.
I metodi di sterilizzazione più frequenti si avvalgono quindi di ipoclorito di calcio o sodio (in percentuali variabili dal 5 al 15 %), alcol etilico (dal 50 al 95%), cloruro di mercurio (0.01-0.1%). Spesso l’uso di alcol etilico rappresenta una forma preliminare di sterilizzazione mentre l’ipoclorito di sodio o calcio sono alternativi all’uso di cloruro di mercurio. Le sterilizzazioni hanno durate variabili secondo lo stato di contaminazione del materiale vegetale, variando dai 10 ai 25 minuti e seguite da lavaggi in acqua sterile. L’assenza di contaminazioni è fondamentale per la prosecuzione di sub-colture, anche se sembra che alcune specie che in natura sviluppano simbiosi tramite micorizze, hanno una naturale tendenza a sviluppare contaminazioni anche in vitro senza effetti negativi sul tasso di crescita e/o di proliferazione. L’efficacia della medesima sterilizzazione è sensibilmente variabile, nel caso di semine in vitro, anche in relazione al lotto di semi utilizzato all’interno della stessa specie.
Stadio 1: impianto della coltura asettica. L’obiettivo di questo stadio è iniziare e stabilizzare una coltura di meristemi terminali o laterali priva di patogeni. Gli espianti primari prelevati dalle piante madri sono sottoposti a sterilizzazione della superficie esterna.
Una buona norma per iniziare lo schema di micropropagazione è quella di evitare di adoprare gemme formate de novo a causa della probabilità di ottenere delle plantule con caratteristiche diverse da quelle di partenza, dovute a segregazione e sviluppo di tessuti chimerici.
Uno dei problemi che si riscontra maggiormente in questo stadio è quello dell’imbrunimento, fenomeno causato dal rilascio e alla successiva ossidazione di polifenoli dovuto ai tagli e al sezionamento degli espianti; questo può portare anche a morte prematura degli espianti. Le procedure applicate per ridurre l’imbrunimento dei tessuti includono: l’uso di mezzi di coltura liquidi associato a frequenti trasferimenti; l’aggiunta di antiossidanti come acido ascorbico o di polivinilpirrolidone; l’allevamento in condizioni di luminosità ridotta o completa oscurità.
Ovviamente non esiste un mezzo universale per l’impianto della coltura asettica di qualunque specie; tuttavia, i mezzi maggiormente usati rappresentano modificazioni della formulazione di base del mezzo di Murashige e Skoog (1962). Le citochinine e le auxine sono aggiunte frequentemente ai mezzi di coltura utilizzati nello stadio 1 per favorire la sopravvivenza degli espianti e lo sviluppo dei germogli (M. Kane, 2003). Espianti di maggiori dimensioni generalmente non richiedono l’aggiunta di auxine nello stadio 1, inoltre la rapida formazione di radici avventizie, successivamente alla loro messa a coltura, garantisce spesso una fonte di citochinine endogene.
Stadio 2: proliferazione. Questo stadio è caratterizzato da numerosi cicli di sub-culture in modo da fornire apici per ulteriori proliferazioni. Il numero di subculture dipende dalla specie, anche se bisogna tener conto dell’eventualità di ottenere tipi “off-type”, in particolar modo se l’organogenesi è preceduta da una fase intermedia con la formazione di callo. La proliferazione di germogli normalmente aumenta all’aumentare della concentrazione delle citochinine, tuttavia i germogli prodotti sono spesso di dimensioni ridotte e manifestano fenomeni di vitrescenza. Stadio 3: pre-trapianto (radicazione). Questo stadio consiste nel preparare i germogli o i gruppi di germogli ottenuti nello stadio 2 alla fase di trasferimento nel suolo. Il processo può includere: 1) allungamento dei germogli prima della radicazione; 2) radicazione dei germogli singoli o di gruppi di germogli; 3) soddisfacimento mediante trattamento a
f
reddo o altri trattamenti della dormienza degli organi di riserva; 4) “preindurimento” delle colture per aumentarne la sopravvivenza. Tuttavia spesso si cerca di far avvenire la radicazione in vivo in quanto l’apparato radicale formatosi in vitro ha una morfologia diversa e più delicata del normale apparato, risultando quindi inadatto alla sopravvivenza nel terreno.Stadio 4: trasferimento all’ambiente esterno. Trasferimento delle plantule dai contenitori alle serre di climatizzazione e ristabilire una loro crescita attiva. Ciò implica acclimatizzare o preparare le piante a condizioni di umidità relativa significativamente inferiori e di intensità luminosa superiori. Le difficoltà che le piante micropropagate pongono al
momento del trapianto
sono principalmente da
ascrivere a due cause: 1) il sistema eterotrofo di nutrizione e 2) il basso livello di autoregolazione idrica.Fra gli scopi di questa tesi vi è anche quello di sviluppare sistemi che aiutino a superare tali problemi.
• Organogenesi
L’organogenesi (la capacità dei tessuti vegetali di formare organi ex novo) rappresenta la base della propagazione asessuale delle piante a partire da tessuti somatici poiché le cellule vegetali hanno la caratteristica di essere totipotenti (cioè hanno la capacità di potersi dedifferenziare dal loro stato strutturale e funzionale e così differenziarsi in tutte le cellule di un organismo adulto per poter quindi rigenerare una pianta intera completa in tutti i suoi tessuti ed identica alla pianta di
partenza).
Dalla letteratura scientifica emergono due processi di sviluppo in grado di condurre all’organogenesi:
Organogenesi indiretta: partendo dall’espianto primario, per arrivare ad avere cellule meristemoidi e poi i primordi, si passa da una fase di callo (cellule dedifferenziate totipotenti);
Organogenesi diretta: le cellule dell’espianto agiscono come i precursori diretti del primordio senza passare dalla fase di callo (Schwarz et al.,2003).
Le cellule dallo stato di dedifferenziazione, prima di poter essere indotte alla produzione di primordi, devono divenire competenti; ovvero devono acquisire la capacità di rispondere allo stimolo organogenetico. Questa tappa di solito viene raggiunta con l’aggiunta nel mezzo di coltura di fitoregolatori di crescita. Una volta avuta la produzione dei primordi si dice che il tessuto è “determinato”.
Cellule isolate da organi o tessuti di una pianta possono essere indotte a crescere e moltiplicarsi secondo un processo di organogenesi diretta o indiretta se poste in un terreno di coltura in determinate condizioni nutrizionali, ambientali e ormonali (Rossi et al., 2004).
Si possono infatti ottenere:
La rigenerazione diretta di un germoglio a partire da poche cellule somatiche, le quali dopo alcune divisioni intraprendono il percorso della organogenesi producendo un germoglio. Da questo, con la formazione di radici, avrà origine una plantula geneticamente identica alla pianta madre;
La formazione di un callo, in seguito ad una proliferazione cellulare non organizzata, che può perpetuarsi tal quale o, in seguito a specifici stimoli ormonali, può
intraprendere un percorso organogenetico che porta alla produzione di germogli e radici;
L’induzione di una popolazione cellulare con capacità embriogenetiche, in grado di portare alla formazione di un embrione somatico del tutto simile a quello zigotico.
• Embriogenesi somatica
L’embriogenesi somatica è un processo attraverso il quale gruppi di cellule o tessuti portano alla formazione di embrioni, per l’appunto detti somatici, che assomigliano agli embrioni zigotici dei semi, mantenendo infatti la capacità di svilupparsi in plantula se posti in un mezzo di coltura opportuno.
Quindi la rigenerazione di intere piante tramite embriogenesi somatica a partire da singole cellule, indotte a produrre un embrione e poi a svilupparsi in pianta adulta, offre notevoli vantaggi rispetto alla micropropagazione classica tramite organogenesi (Bajaj, 1991), questo grazie al tasso di moltiplicazione maggiore e ai minori costi sostenuti per plantula. Gli embrioni somatici possono infatti essere indotti a proliferare in sospensione in una coltura adeguata e, quando sub-colturati settimanalmente, arrrivano a produrre una grande quantità di embrioni molto rapidamente.
Gli embrioni somatici maturano anche in poche settimane se trasferiti in regimi di maturazione adeguati, in alcuni casi arrivando a ottenere in pochi mesi piante pronte al trasferimento nel suolo. L’embriogenesi somatica applicata alle piante medicinali è relativamente recente, i primi studi risalgono ai primi anni novanta; in generale è stato notato che la diminuzione della concentrazione dei regolatori di crescita ha promosso lo sviluppo di embrioni e la loro germinazione (Rout et al, 2000).
• Colture di protoplasti
Nella rigenerazione in vitro sono stati fatti notevoli progressi anche nella coltura di protoplasti (Bajaj, 1987). Un protoplasto è una cellula vegetale sprovvista di parete cellulare, l’eliminazione della parete può avvenire in diversi modi e secondo diverse tecniche. L’isolamento di un protoplasto permette di rigenerare una pianta dalla singola cellula, oppure, quando è necessario, di ibridare due specie che sono sessualmente incompatibili; l’eliminazione della parete e quindi la fusione dei protoplasti permette di aggirare tale problema. I protoplasti sono utilizzati anche in ingegneria genetica nelle operazioni di trasformazione, in quanto la mancanza della parete cellulare facilita notevolmente l’inserzione del frammento di DNA per lo meno all’interno della cellula.
Esistono innumerevoli protocolli di isolamento e duplicazione dei protoplasti, in generale di difficile applicazione soprattutto perché l’efficacia dipende dalla specie presa in considerazione, dall’età della pianta, dalle condizioni di crescita. Alcune piante medicinali sono state rigenerate da colture di protoplasti, che permettono di ottenere un grande numero di individui, ma che possono anche essere una ricca sorgente di variabilità genetica e variazione somaclonale. Le colture di protoplasti sono state testate
c
on successo per la produzione di alcaloidi (Bajaj, 1988); tra le piante medicinali sono state ottenute linee cellulari da callo derivato da protoplasto con alto contenuto di sciconina; le cellule derivavano da cellule di Lithospermum erythrorhizon (Fujita et al., 1985; Kumar, 1992)
• Colture di tessuti trasformati
La manipolazione diretta di sequenze di DNA per alterare l’espressione genica nelle piante medicinali è un’area della ricerca in forte espansione, soprattutto nell’ambito dell’alterazione delle vie biosintetiche per la produzione di metaboliti secondari, per la produzione di principi attivi ad attività terapeutica, componenti alimentari e pesticidi.
Il ruolo della trasformazione genetica più che insistere sulla creazione di piante OGM con caratteristiche produttive e qualitative migliorate, sembra però spingersi verso il miglioramento genetico delle colture cellulari e la coltura di hairy roots (Canter et al, 2005).
I metodi di trasformazione possono essere indiretti, cioè si avvalgono dell’uso di vettori (batteri, virus) od essere diretti nel trasferimento del DNA. Tra i metodi indiretti c’è l’uso del T-DNA del plasmide Ti dell’Agrobacterium tumefascens o del plasmide Ri dell’A. rhizogenes per l’induzione di hairy roots. Tale batterio ha infatti la capacità di indurre radici avventizie (letteralmente “radici pelose”) a un grande numero di piante ospiti, una volta integrato il T-DNA proveniente dal plasmide RI dell’A. rhizogenes; i geni rol (o locus root) presenti nel T-DNA incrementano la sensibilità alle auxine piuttosto che codificare per la sua biosintesi. Questo permette alle cellule trasformate, insieme ad altri co-fattori, la formazione delle hairy roots (figura 2).
Figura 2: Hairy roots di S. wagneriana
L’interesse per tali radici nasce dal fatto che queste hanno la capacità di accrescersi molto rapidamente senza l’aggiunta di auxine di sintesi, spesso non necessitano neanche di incubazione alla luce, e, grazie alla loro stabilità genetica, hanno un livello di produzione metabolica piuttosto
stabile
(Ramachandra Rao et al, 2002). Grazie alle hairy roots indotte dall’ A. rhizogenes, molte piante che difficilmente radicano in vitro hanno la possibilità di essere prima di tutto micropropagate, con i vantaggi già citati della rigenerazione in vitro. L’uso di questo batterio ha però avuto un ruolo determinante per quelle piante medicinali la cui coltura cellulare non era possibile o non dava risultati soddisfacenti, ma che tramite l’induzione di radici avventizie è stato possibile stimolare il rilascio di metaboliti secondari in appositi bioreattori (Ramachandra Rao, 2002).Finora, colture di radici trasformate “hairy roots” sono state ottenute da più di 100 specie diverse. I prodotti ritrovati in colture di radici trasformate comprendono alcaloidi (alcaloidi indolici, isochinolinici, pirrolizidinici, chinolinici, quinolizidinici, tropanici, ecc), terpenoidi (monoterpeni, sesquiterpeni, diterpeni, triterpeni, steroidi, cardenolidi), flavonoidi, composti fenolici (cumarine, tannini), antrachinoni, chinoni, lignani, proteine, ecc. (Ruffoni, 2007)
• Colture di biomassa vebetale
Le colture cellulari vegetali sono definite anche “fabbriche chimiche di metaboliti secondari” (Ramachandra Rao, 2002) e rappresentano a oggi una valida, e per molti aspetti già comprovata, alternativa alla coltivazione di piante medicinali provenienti o meno dal vitro. L’idea centrale, che muove questo modo di ottenere metaboliti secondari preziosi per le case farmaceutiche, è quella
della dispendiosità in termini di tempo, denaro e rese finali effettive che la normale coltivazione di piante medicinali in campo comporta per talune specie.
La coltura cellulare è possibile grazie al fatto che le cellule vegetali sono totipotenti dal punto di vista biosintetico, cioè mantengono completa l’informazione genetica e sono quindi in grado di produrre quel range di principi attivi che si trovano nella pianta madre.
La coltura in sospensione inizia solitamente da callo friabile (tessuto disorganizzato costituito da una massa di cellule parenchimatiche in attiva divisione) ottenuto da tessuti differenziati che si sdifferenziano su idonei substrati colturali e in opportune condizioni ambientali. Le cellule vengono mantenute in tale stato grazie all’utilizzo di fitoregolatori nel substrato di crescita. Infatti, con la somministrazione di auxine si stimola la crescita cellulare attraverso l’induzione della sintesi dell’enzima cellulasi che determina l’elasticità delle pareti cellulari e quindi favorisce la distensione e l’accrescimento cellulare; mentre con le citochinine si stimola la moltiplicazione cellulare attraverso un’azione a livello ribosomiale con l’incremento della sintesi dell’RNA e con l’induzione della sintesi di proteine specifiche.
L’induzione del callo dipenderà dal tipo di espianto, dalla scelta del substrato e dalle condizioni di coltura .
Una volta indotto, per ottenere un’alta resa di metaboliti, è necessario trasferirlo in un substrato liquido in agitazione (colture in sospensione), di solito dispensato prima in beute da laboratorio sistemate
su
piattaforme a movimento orbitale e poi in reattori. I modelli di bioreattore vanno da semplici recipienti che possono o meno funzionare anche da agitatori, fino a complessi sistemi asettici, regolati e integrati a vari livelli dagli input che giungono dall'unità centrale di un computer. Di base i bioreattori sono quindi di due tipi: (Ruffoni, 2007)1° tipo: contenitori non asettici (es. per la fabbricazione della birra, per lo smaltimento delle acque reflue)
2° tipo: contenitori asettici (es. produzione di metabolici secondari, antibiotici, vitamine e polisaccaridi).
In generale, i vantaggi dell’utilizzo delle colture cellulari per la produzione di composti di rilevanza farmaceutica sono:
Indipendenza dalle variazioni geografiche e stagionali nonché da tutti i fattori ambientali
È offerto un sistema di produzione definitivo, che assicura un continuo approvvigionamento di prodotti uniformi e di alta qualità
È possibile produrre nuovi composti che non sono normalmente presenti nelle pianti madri
Le cellule vegetali possono operare biotrasformazioni stereo- e regiospecifiche per la produzioni di nuovi composti a partire da precursori di scarso valore. (Ramachandra Rao, 2002).
1.3
ATTIVITÀ FOTOSINTETICA NELLE PIANTE IN VIVO E IN
VITRO
1.3.1 Fotosintesi di piante C3 in vivo
La fotosintesi è quel processo biochimico mediante il quale gli organismi che contengono clorofilla (piante, alcuni protozoi e batteri) producono glucosio a partire da acqua e anidride carbonica (CO2) in presenza di energia solare (per questa ragione le piante si dicono organismi
fotoautotrofi). Il glucosio ottenuto è il combustibile per la sintesi di molecole ad alto contenuto energetico (es. ATP)
necessarie ai processi metabolici dei viventi. La fotosintesi produce come sottoprodotto l’ossigeno che, liberato in atmosfera, viene utilizzato nei processi respiratori.
Gli eventi della fotosintesi possono essere divisi in due serie di reazioni. Durante la prima parte, avvengono le reazioni dipendenti dalla luce (fase luminosa) dove l’energia della luce del sole è assorbita e convertita in energia chimica che è immagazzinata in ATP e NADPH. Nel corso della seconda parte, avvengono le reazioni indipendenti dalla luce (fase oscura),dove vi è produzione di glucosio a spese dell’energia chimica precedentemente accumulata.
Fase luminosa: L’energia luminosa viene catturata dalle molecole di pigmento presenti nel fotosistema II e viene trasferita ad una particolare molecola di clorofilla, il centro di reazione, dove avviene la scissione di una molecola di acqua (fotolisi): l’ossigeno viene liberato in atmosfera e l’idrogeno viene utilizzato per formare NADPH. Il flusso di elettroni eccitati passa attraverso due catene di trasporto dal fotosistema II all’I e fornisce energia per la produzione di ATP.
Fase oscura: Il carbonio della CO2 viene ridotto a glucosio nel corso di un ciclo di reazioni (ciclo di Calvin) nel quale sono coinvolti l’ATP e il NADPH prodotti nella fase luminosa. L’enzima principale che catalizza la prima reazione del ciclo è la ribulosio-1,5-difosfato carbossilasi. (Rubisco). La parte di glucosio che non viene utilizzata subito come fonte energetica può essere convertita in altri composti organici come i lipidi, immagazzinata come amido o trasformata in cellulosa.
La fotosintesi nelle cellule eucariotiche avviene in un organello citoplasmatico a ciò deputato, il cloroplasto, situato nelle cellule del mesofillo della foglia: è qui che vi si trovano tutti i pigmentI attivi nel processo.
La maggior parte del meccanismo fotosintetico del cloroplasto (che comprende i pigmenti che assorbono la luce, una catena di trasportatori di elettroni e un apparato in grado di sintetizzare ATP) è situato in un sistema di membrane interne chiamate tilacoidi (disposti in pile dette grana, che contengono il sistema di traduzione dell’energia) e fisicamente separato dalle membrane esterne da una matrice chiamata stroma (Taiz e Zeiger, 2002).
Le membrane tilacoidali contengono molecole di clorofilla a e clorofilla b (differenti nello spettro di assorbimento della luce) disposte a formare rispettivamente il fotosistema I e il fotosistema II. Questi due sistemi lavorano in serie: il primo tende ad ossidare il citocromo (proteine ferriche che fungono da intermedi nel trasporto fotosintetico di elettroni) e il secondo a ridurlo.
LE CLOROFILLE
I pigmenti sono molecole che contengono un cromoforo, ovvero un gruppo chimico in grado di assorbire luce di una particolare lunghezza d’onda nello spettro del visibile.
Le foglie delle piante sono verdi dal momento che contengono grandi quantità del pigmento clorofilla, che assorbe nel blu e nel rosso, lasciando così che la lunghezza d’onda intermedia del verde venga riflessa ai nostri occhi.
Ciascuna molecola è costituita da due parti principali: un anello porfirinico (a sua volta costituito da quattro anelli pirrolici più piccoli con un atomo di magnesio coordinato al centro della molecola) che funziona nell’assorbimento della luce ed una catena idrofobica di fitolo (derivata dal ripetersi di un’unità isoprenoide) che mantiene la clorofilla immersa nella membrana tilacoidale e che le attribuisce il carattere lipidico. La presenza di legami doppi e semplici lungo la parte esterna dell’anello agisce dislocando gli elettroni che formano una nuvola attorno ad esso. Sistemi coniugati di questo tipo assorbono la luce e l’assorbimento provoca una redistribuzione della densità elettronica della molecola, che a sua volta favorisce la perdita di un elettrone su un accettore appropriato. (Fig. 3A)
Le clorofille nei vegetali sono composte dalla clorofilla a (maggiore pigmento) e dalla clorofilla b tra loro in rapporto approssimativo di 3:1. Tuttavia, le condizioni ambientali e di crescita possono modificare questo rapporto, ad esempio piante esposte alla luce presentano un rapporto chl a : chl b = 3-4; mentre le piante esposte all’ombra presentano valori intorno a 2.5-2.9 (H. K. Lichtenthaler, 1987).
Clorofilla a: è la principale dei vegetali ed è caratterizzata da un gruppo metile in C3 (anello II); il colore è verde smeraldo, è presente in tutti gli organismi fotosintetici che producono ossigeno, ma è assente in alcuni batteri sulfurei;
Clorofilla b: differisce dalla chl a solo per un gruppo aldeidico in C3 (anello II); il colore è verde-pisello, è presente in tutte le piante superiori e nelle alghe verdi (Alpi, 2000).
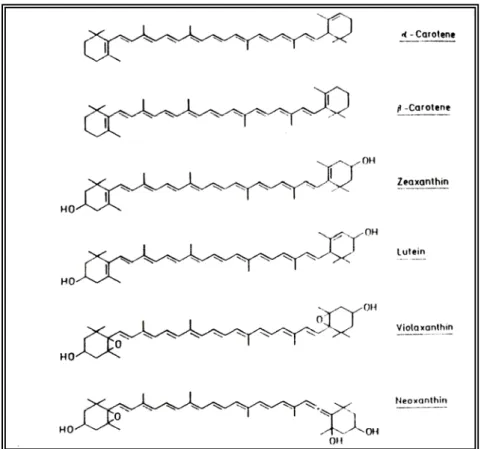
I CAROTENOIDI E LE XANTOFILLE
I carotenoidi, tra cui il β-carotene, sono i più importanti pigmenti accessori nella fotosintesi. Assorbono la luce di lunghezze d’onda del blu e del verde e conferiscono le colorazioni gialle, arancio e rosse di organi come foglie, fiori e frutti. La loro funzione principale è quella di
Figura 3: A) Formula di struttura delle clorofille: Clorofilla (a) X = CH3, Clorofilla (b) X = CHO; B) Formula di struttura dei principali carotenoidi contenuti nei cloroplasti delle piantesuperiori (da H. K. Lichtenthaler, 1987)
assicurare l’assorbimento della luce in ambiti spettrali non adeguatamente coperti dalle clorofille, alle quali poi in parte trasmettono l’eccitazione (Alpi, 2000), ma un’altra funzione degna di nota è quella di proteggere l’apparato fotosintetico dal danno provocato dalle specie reattive dell’ossigeno (fotossidazioni)
I carotenoidi sono molecole costituite da una lunga catena di atomi di carbonio (costituita da 35-40 atomi) provviste di 9 o più doppi legami coniugati e spesso terminanti in un anello (Fig. 3 B). Le xantofille, sono carotenoidi contenenti atomi di ossigeno e danno la tipica colorazione bianco-giallastra alle foglie cresciute al buio. Appartengono a questa classe importanti pigmenti come la luteina, violaxantina e la zeaxantina. La composizione in percentuale dei carotenoidi varia in base alle condizioni ambientali e ai fattori di stress, all’interno di determinati ranges: β-carotene 25-40%, luteina 40-57%, violaxantina 9-20% e neoxantina 5-13% (H. K. Lichtenthaler, 1987).
Il tipico colore dei carotenoidi, che spazia dal giallo pallido all'arancione fino al rosso acceso, è una diretta conseguenza della struttura molecolare di questi composti. Le catene polimeriche che li compongono sono infatti caratterizzate dalla presenza di doppi legami, che interagiscono tra di loro permettendo agli elettroni degli atomi interessati di muoversi più liberamente; all'aumentare dei doppi legami nella catena, aumenta anche la libertà di movimento degli elettroni. Questo fatto fa sì che lo spettro della luce assorbita da queste molecole diminuisca. Come conseguenza di ciò, aumenta la lunghezza d'onda della luce riflessa, ed essa appare perciò di un colore tendente al rosso.
I carotenoidi possiedono molte proprietà fisiologiche tra cui una buona attività antiossidante sia nelle piante che nell’uomo. Gli animali, compreso l’uomo, sono incapaci di sintetizzare i carotenoidi, e devono necessariamente implementarli tramite la dieta e poi modificarli in composti
a loro utili. Di particolare importanza per l’uomo è la trasformazione degli α, β e γ- caroteni, soprattutto del β-carotene, in vitamina A (molecola indispensabile per il nostro organismo), a livello della mucosa intestinale; ragion per cui questi pigmenti sono importanti nella funzione nutrizionali come precursori di vitamina A (provitamine) (Bruni e Nicoletti, 2003).
1.3.2 Capacità fotosintetiche
in vitro:
La crescita e lo sviluppo delle colture da tessuto vegetale è intimamente connesso al microambiente nel vaso di coltura. Generalmente le plantule messe in coltura sono fatte crescere in vasetti a chiusura ermetica, principalmente per prevenire contaminazioni microbiche; inoltre questo fa sì che all’interno del vaso vi sia un’alta percentuale di umidità relativa, un basso tasso di scambi gassosi con l’esterno, un basso flusso fotonico fotosintetico (PPF) (circa 50 µmol m-2 s-1 )
e una temperatura dell’aria costante (20-25°C).
I
n aggiunta, i carboidrati necessari al mantenimento della pianta sono aggiunti dall’esterno, generalmente sottoforma di saccarosio nel mezzo di coltura.Quando lo zucchero diviene indispensabile come fonte di carbonio o di energia, allora si parla di colture eterotrofe, come nel caso delle convenzionali colture in vitro. Se invece la fonte di carbonio per la crescita è rappresentata dalla CO2 presente nell’aria (in alcuni casi “arricchita”
appositamente) o da entrambi, le colture prendono rispettivamente il nome di foto-autotrofiche e mixotrofiche (Kozai, 1991).
1.3.3 Colture
in vitro fotoautotrofiche
Per molto tempo si pensava che la maggior parte delle piante cresciute in vitro non avessero capacità sufficiente per fare fotosintesi e quindi che la loro crescita fosse toalmente dipendente dall’assorbimento dello zucchero apportato nel mezzo di coltura. Tuttavia evidenze sperimentali suggeriscono che numerosi espianti contenenti clorofilla mostrano attività fotosintetiche relativamente elevate, poiché la CO2 interna decresce rapidamente con il tempo durante il fotoperiodo, e possono crescere più velocemente in condizioni foto-autotrofiche piuttosto che etero- o mixotrofiche, a patto che le condizioni ambientali della coltura possano consentire la fotosintesi, cioè che si mantengano valori elevati di intensità di PPF e di CO2interni (Kozai,
1990). Simili risultati sono stati trovati da Cournac e collaboratori (1991) su plantule di Solanum tuberosum coltivate in vitro in varie condizioni di aerazione, aggiunta di saccarosio nel mezzo e arricchimento di CO2: anche in questo caso le plantule mostravano attività fotosintetica e un
buon sviluppo in condizioni di crescita mixotrofiche e foto-autotrofiche, portandole ad uno stadio di sviluppo e morfologia molto simile alle piante cresciute in campo.
Le misure di CO2 rilevate nei convenzionali vasi a chiusura ermetica (a ridotti scambi gassosi)
contenenti piante diverse, hanno mostrato che la concentrazione di CO2 decresce nettamente a
70 –80 ppm già due ore dopo l’inizio del fotoperiodo (Fujiwara et al, 1987) mostrando un assorbimento diretto di CO2 da parte delle colture. Anche in vasetti con maggiori scambi gassosi la concentrazione di CO2 all’interno diminuiva a 100-200 ppm durante il fotoperiodo (Fujiwara et
al, 1987; Kozai et al, 1988). D’altra parte, la concentrazione di CO2 all’interno del vaso di coltura
aumentava nel tempo durante il fotoperiodo raggiungendo 5000-10000 ppm o più (De profit et al, 1985; Fujiwara et al, 1987). Questi studi mostrano chiaramente che le plantule coltivate in vitro hanno capacità fotosintetica, sebbene la loro attività di fotosintesi non sia molto alta a causa della bassa concentrazione di anidride carbonica nello spazio di testa del vaso, una bassa densità di flusso fotonico fotosintetico (PPFD) e dall’alta concentrazione zuccherina nel mezzo ( Kozai, 1991). Infatti, è risaputo che le piante C3 non riescono a sviluppare un bilancio del carbonio
positivo quando la concentrazione di CO2 e il flusso fotonico fotosintetico sono più bassi della
CO2 e del punto di compensazione del PPFD rispettivamente. Quindi le plantule cresciute in vitro sono forzate a sviluppare un metabolismo etero-mixotrofico assorbendo lo zucchero dal mezzo.
Un ulteriore beneficio osservato in piante di Limonium cresciute in condizione di autotrofia (mezzo in assenza di saccarosio e in condizioni di arricchimento di CO2) riguarda l’assenza di
vitrescenza che invece si riscontra spesso in plantule cresciute in normali condizioni eterotrofiche (Lian, 2002).
1.3.3.1 Misure del grado netto di fotosintesi in situ per colture in vitro
La stima del tasso netto di fotosintesi (NPR) viene generalmente condotta usando piccole camere di assimilazione dotate di sistemi di ventilazione forzata: il NPR in questo caso sarà dato dal prodotto del flusso di aria per la differenza di anidride carbonica all’interno e all’esterno del vaso. In questi casi è chiaro che dobbiamo creare un ambiente adatto per poter effettuare tali misure: bisognerà costruire una camera sterile dove le plantule saranno sottoposte ai flussi di aria e sarà necessario, a questo scopo, regolare con flussimetri e sensori l’entrata e l’uscita dell’aria dalla camera. Queste particolari condizioni possono determinare un ambiente particolare nella camera di assimilazione e lo stato fisiologico delle plantule potrebbe essere molto diverso da quelle in situ o in vitro.
Fujiwara et al (1987) hanno dimostrato che esiste la possibilità di misurare in situ il NPR, usando un modello in cui sono immessi i dati dell’andamento diurno della CO2 all’interno e all’esterno del contenitore. Dall’elaborazione di questo modello, Kozai e Iwanami (1988) hanno descritto il grado netto di fotosintesi per unità di coltura con la seguente formula:
(CO2in- CO2out)*E*V*K
dove: (CO2in – CO2out) (µl/l, µmol/mol, ppm) è la variazione di CO2 nel contenitore rispetto alla
CO2 esterna; E è il valore riferito al numero di scambi di aria in un’ora, dove si presuppone che
ad ogni scambio di aria la CO2 interna sia completamente rinnovata; V (l o ml) il volume del
contenitore; K (1,82*10-6 µg/l6 oppure 41*103µmol/l) è un fattore di conversione da volume a
grammi per la CO2 secondo la formula PV=nRT a 25°C.
1.3.3.2 Controllo ambientale nelle colture di tessuti vegetali
Dato che gli espianti/plantule hanno capacità di crescere in vitro fotoautotroficamente, appare ovvio che le condizioni ambientali all’interno devono essere regolate in modo da promuovere la loro attività fotosintetica. Nelle prossime pagine focalizzeremo l’attenzione sui fattori chiave da
considerare nelle colture di tessuti vegetali fotoautotrofiche, i quali sono stati abbondantemente trattati da Kozai e collaboratori.
Negli ultimi venti anni il concetto di controllo ambientale nella micropropagazione ha assunto un’importanza primaria. Numerose ricerche suggeriscono che la manipolazione dei fattori ambientali in vitro possa essere un potente mezzo per controllare parametri quali crescita, sviluppo e morfogenesi delle piante, così come un ridotto consumo di energia, costo del lavoro e uso dei nutrienti.
Il meccanismo dei cambiamenti ambientali in un vaso di coltura può essere paragonato a quello dei cambiamenti ambientali che avvengono in serra. Infatti il rapporto tra l’ambiente interno ed esterno al vaso di coltura e la piante nel vaso di coltura è simile a quello riscontrato tra la pianta in campo e l’ambiente interno alla serra. Eccellenti modelli sono stati elaborati per predire come i cambiamenti ambientali nella serra siano influenzati dall’ambiente esterno, così come dalle caratteristiche fisiche e biologiche della coltura (Takakura 1993). Gli stessi principi, con alcune modifiche, possono essere applicati per analizzare i cambiamenti ambientali all’interno del vaso di coltura (Kozai & Smith, 1995; tabella 3)
Tabella 3: caratteristiche generali dell’ambiente in vitro nella micropropagazione convenzionale
• ventilazione dei vasi e arricchimento di CO
2:
E’ stato dimostrato che la ventilazione dei vasetti utilizzati per le colture in vitro è un metodo comune per aumentare la concentrazione di CO2 nello spazio di testa e, a sua volta, supportare
l’attività fotosintetica degli espianti/plantule. In più, rimovendo alcuni componenti gassose (ad esempio l’etilene) dal vaso, può essere aumentata e migliorata la crescita e lo sviluppo delle piante cresciute in tale ambiente.
Condizioni variabili Tassi variabili
ambiente aereo flussi di materia e energia
alta umidità relativa basso tasso di traspirazione bassa concentrazione di CO2 alla luce basso tasso fotosintetico alta concentrazione CO2 al buio alto tasso di traspirazione alta concentrazione di etilene scambi di aria ridotti
mezzo di coltura (radici) mezzo di coltura (radici)
alta concentrazione di zucchero basso tasso di assorbimernto degli zuccheri alta concentrazione di Sali minerali basso tasso di assorbimento di Sali minerali bassa concentrazione di O2 disciolta basso tasso di assorbimento di acqua
bassa densità di microrganismi basso tasso di assorbimento di altri componenti alta concentrazione di fitoregolatori
La proprietà di scambio d’aria naturale del vaso di coltura è molto ben espressa dal parametro numero di scambi per ora (Fujiwara e Kozai, 1995). Il numero di scambi gassosi (E) è un parametro fisico proprio di ogni singolo tipo di vaso e che rimane costante nel tempo se la velocità del flusso di aria intorno al vaso non varia (Ibaraki et al., 1992). Il tasso di scambio gassoso tra la camera di crescita e il vaso di coltura cambia a seconda dei differenti tipi di contenitori nonché dalla forma e dal tipo di chiusura degli stessi. E è normalmente molto basso nei normali vasi a chiusura ermetica a causa dei materiali sigillanti usati; tuttavia ciò non vuol dire che non vi siano degli scambi fra lo spazio della superficie di contatto del vaso, il coperchio, i materiali sigillanti e l’atmosfera esterna. Per esempio, E= 0.18/h in contenitori chiusi con tappi di alluminio e 0,6/h o 1,5/h per le normali provette con tappo di plastica o schiuma di silicone, rispettivamente (Kozai, 1991).
Essendo la CO2 la sola fonte di carbonio nei sistemi fotoautotrofici, è richiesta una distribuzione
abbastanza omogenea della concentrazione di tale gas e della velocità della corrente d’aria nello spazio di testa del vaso di coltura per permettere una crescita uniforme degli espianti.
Vi sono tre sistemi di base di ventilazione che sono stati impiegati nelle colture vegetali.
La ventilazione naturale consiste nella diffusione delle componenti gassose attraverso le membrane permeabili attaccate o sul tappo o sulla parete laterale dei vasetti. Attualmente, molti tipi di questi film permeabili sono disponibili in commercio, ad esempio le membrane filtranti Millipore, lamine trasparenti in polipropilene, membrane di Teflon e chiusure Suncap (Zobayed et al., 2000). Per apportare anidride carbonica all’interno del vaso di coltura, si può ad esempio mettere all’interno della camera di crescita un serbatoio di tale gas. La forza motrice della ventilazione naturale è la differenza di pressione d’aria fra interno e esterno del vaso e/o la velocità della corrente d’aria che lo circonda. In condizioni stagnanti tale forza è dovuta ad una parziale differenza di pressione dei gas (Kubota, 2001). Il tasso di diffusione attraverso il film permeabile è proporzionale alla differenza di concentrazione di CO2 all’interno e all’esterno del
vaso e alla conduttanza gassosa della stessa membrana (Zobayed et al, 2000). In sistemi di ventilazione naturale (quindi per diffusione) la concentrazione di CO2 e altri gas nello spazio di
testa del vaso sono correlati con numerosi fattori quali l’attività metabolica delle plantule, la loro taglia e l’area fogliare, il numero di scambi gassosi (E) e l’ambiente della camera di crescita. Perciò, la concentrazione gassosa all’interno del vaso in condizioni di ventilazione naturale non è facilmente predicibile e soprattutto è difficile da controllare; in più risulta difficile il suo costante monitoraggio (Kozai and Kubota, 2001).
Per superare tali problemi numerosi autori hanno proposto un sistema di ventilazione forzata come metodo per ottimizzare la coltura. Il sistema di ventilazione forzata richiede l’uso di pompe d’aria o compressori che spingano l’aria o alcuni gas direttamente all’interno del vaso di coltura.
La composizione gassosa dell’aria che vi entra , il tasso di ventilazione e la velocità della corrente d’aria nel vaso possono essere manipolati abbastanza facilmente e accuratamente usando delle apposite valvole o una pompa d’aria dotata di invertitore. (Buddendorf-Joosten and Woltering, 1996). Recenti progressi nello sviluppo di colture vegetali fotoautotrofiche indicano che l’utilizzo di contenitori più grandi con sistemi di ventilazione forzata per la propagazioni commerciali su larga scala può: 1) ridurre in maniera significativa i costi di produzione grazie alla riduzione del costo del lavoro di circa la metà, 2) aumentare lo qualità degli espianti da acclimatizzare e la sopravvivenza ex vitro; 3) diminuire il tempo di subcultura e 4) semplificare il processo di propagazione (Zobayed et al, 2004). Zobayed e collaboratori (2004) hanno messo a punto un sistema Per migliorare la crescita fotoautotrofia di Eucalyptus; gli aspetti da considerare quando contenitori di maggior capacità sono scelti per la coltura delle plantule sono l’uniformità della distribuzione di CO2 e la sterilizzazione dei vasetti.
Infine è stato sviluppato un terzo e alternativo metodo di ventilazione forzata, basato sui principi della naturale ventilazione in ambienti umidi: questo sistema, chiamato “Convective throughflow”, è stato sviluppato da Armstrong e collaboratori (1997). In questo sistema si ha una corrente di aria sterile umidificata all’interno del vaso di coltura che dipende dal mantenimento di un gradiente di vapore attraverso membrane con micropori.
L’uso di questo sistema di ventilazione permette una rimozione efficiente dell’etilene e un indiretto arricchimento di CO2 nello spazio di testa il quale può migliorare la crescita e lo sviluppo di numerose specie di piante. (Zobayed et al, 2002).
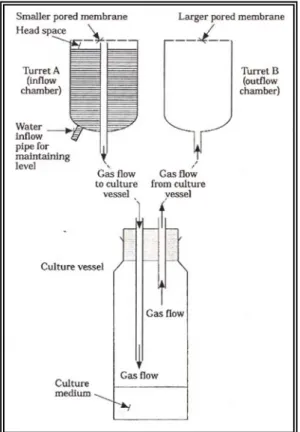
Figura 5: Sistema e parametri correlati all’arricchimento di CO2 nel vaso di coltura.
1.3.4 Fotoautotrofia in vitro come metodo alternativo alla micropropagazione
convenzionale.
Il ruolo del saccarosio nei mezzi nutritivi non è ancora ben chiarito e sembra comunque che, a parte la presenza di alte concentrazioni di CO2 ed elevate intensità di luce che sviluppano
autotrofia, la fonte di carboidrati sia comunque benefica per la crescita delle plantule in vitro. Tuttavia, l’uso di metodi alternativi alla classica micropropagazione può facilitare alcune fasi della propagazione in vitro altrimenti difficoltose o poco redditizie.
Riassumendo si può dire che l’uso di nuovi contenitori, di sistemi che permettono maggiori scambi gassosi e di soluzioni nutritive più idonee ha portato ai seguenti risultati (Kozai, 1991): 1) La crescita di plantule in vitro può essere promossa incrementando la concentrazione di CO2
nei vasi fino a 350 ppm o più durante il fotoperiodo, con un flusso fotonico fotosintetico (PPF) intorno ai 100-200 µmol m-2 sec-1.
2) L’indice di crescita di plantule coltivate in vitro su un mezzo privo di saccarosio arricchite con CO2 e con elevata PPF è più alto che in plantule cresciute con saccarosio sotto bassa intensità luminosa e senza arricchimento di CO2.
3) Regolatori di crescita esogeni, vitamine ed altre sostanze organiche possono non essere necessarie per plantule che sviluppano autotrofia, e che quindi producono da sole le sostanze necessarie per crescere.
4) Le mutazioni sono ridotte in plantule che crescono senza fitoregolatori e senza saccarosio. 5) Le plantule cresciute in condizioni autotrofiche sopravvivono meglio dopo il trapianto in
vivo.
6) La perdita di plantule dovuta a inquinamento batterico o fungino è ridotta se nei substrati non sono presenti zuccheri.
7) Contenitori più grandi possono essere usati se la perdita dovuta a inquinamenti è ridotta; con l’uso di questi è possibile robotizzare in futuro il trasferimento delle plantule.
8) Con l’uso di contenitori più grandi è facile controllare l’umidità della coltura con conseguente aumento della resistenza allo stress idrico delle plantule ex vitro.
9) I sali minerali usati per colture autotrofiche possono essere sostituiti con quelli usati comunemente per le colture idroponiche.
10) La temperatura può essere abbassata durante il periodo di oscurità per promuovere la crescita autotrofia.
Il costo di produzione delle plantule in vitro viene quindi considerevolmente ridotto per i seguenti motivi: incremento della crescita, eliminazione degli zuccheri, prevenzione delle contaminazioni, uso di equipaggiamenti automatizzati, riduzione delle mutazioni indesiderate, eliminazione dei regolatori di crescita, riduzione delle concentrazioni saline, maggiore efficienza nel controllo dei parametri ambientali, aumento della sopravvivenza durante la fase di acclimatazione.