Capitolo
1
Panoramica sull’Idrogeno
L’idrogeno, la cui etimologia ha il significato di “generatore di acqua”, `e co-nosciuto fin dal XVI secolo, quando Paracelso per primo descrisse un gas infiammabile prodotto per reazione dell’acido solforico con il ferro.
Il nome Idrogeno, tuttavia fu coniato da Lavoisier nel 1783, a seguito di os-servazioni sulla combustione di questo gas, che per l’appunto, aveva come prodotto di reazione la semplice acqua pura.
Molto raro `e l’idrogeno allo stato elementare sul nostro pianeta in quanto l’attrazione gravitazionale terrestre, minore di quella delle stelle e dei grandi pianeti, `e insufficiente a trattenere molecole come quelle dell’idrogeno, 14,4 volte pi`u leggere di quelle dell’aria. Si trova libero, per`o, nelle emanazioni vulcaniche, nelle sorgenti petrolifere, nelle fumarole e nell’atmosfera ad un’al-tezza superiore ai cento chilometri. Particolarmente abbondante `e, invece, allo stato combinato: con l’ossigeno `e presente nell’acqua di cui costituisce l’11.2% in peso; combinato con carbonio, ossigeno ed alcuni altri elementi `e uno dei principali costituenti del mondo vegetale ed animale, l’organismo umano ne contiene circa il 10% del suo peso. Nel solo campo della chimica
11
organica sono noti milioni di composti contenenti idrogeno che vanno dal me-tano, alle gigantesche proteine dei carboidrati, contenenti un enorme numero di atomi di idrogeno.
L’idrogeno appartiene al primo gruppo della tavola periodica; in natura `e presente quasi esclusivamente l’isotopo di numero di massa 1, mentre quello di massa 2 (il deuterio), `e presente in misura di circa 1 parte su 5900. Inoltre, `e il pi`u semplice di tutti gli elementi e il suo atomo si pu`o visualizzare come un denso nucleo centrale con un solo elettrone orbitante in una “nuvola di probabilit`a”. In condizioni normali esso si presenta sempre legato ad un altro atomo di idrogeno, a formare la molecola biatomica:
H2
`
E il pi`u leggero dei gas ed ha densit`a, rispetto all’aria (a 0◦C e 1.01 bar), di
0.069; la sua densit`a, in condizioni normali di pressione temperatura `e 0.08989 kg/m3
. La sua solubilit`a in acqua `e molto bassa e decresce con l’aumentare della temperatura. Al contrario degli altri gas, si riscalda nell’espansione e ci`o pu`o provocare fenomeni di autoaccensione a contatto dell’ossigeno dell’a-ria.
Nei programmi spaziali della NASA, l’idrogeno e l’ossigeno liquidi, vengono combinati per ottenere il combustibile necessario per lo space shuttle ed altri razzi. Le celle a combustibile a bordo inoltre, sempre combinando idrogeno ed ossigeno, producono gran parte dell’energia elettrica richiesta. L’unico materiale scaricato dalle celle `e acqua pura, utilizzata dall’equipaggio per dissetarsi (National Renewable Energy Laboratory, 1995).
I settore dei trasporti, negli ultimi tempi, sta volgendo il proprio interesse verso questo combustibile; alcune grandi societ`a come la BMW ed Opel
12 stanno proponendo i primi prototipi di automobile e mezzi di trasporto cit-tadino ad idrogeno.
Mentre i settori suddetti sono gi`a avviati od in via di sviluppo, il settore della produzione di energia elettrica mediante l’idrogeno, non gode della stessa tendenza; infatti le centrali elettriche che sfruttano questo elemento, si ba-sano fondamentalmente sulle celle a combustibile, le quali, pur presentando notevoli vantaggi (come la modularit`a, e le ridotte dimensioni) presentano ancora problemi irrisolti che costringono questa tipologia di impianto, a ri-manere confinata nell’ambito delle centrali di piccola potenza.
L’interesse nei confronti dell’idrogeno risale ai primi anni del 1970, quando la prima crisi petrolifera suscit`o in molti paesi industrializzati il timore di una profonda ed estesa crisi energetica. Allo stato attuale, ci`o che spinge verso la direzione delle energie rinnovabili ed all’utilizzo di questo combustibile, `e la consapevolezza della limitatezza delle scorte di combustibili fossili, ancora presenti nel nostro pianeta, che, con i consumi attuali, si stimano essere di-sponibili per un periodo non superiore ai 30 o 40 anni.
Attualmente, grandi societ`a di produzione di energia elettrica (tra le quali ENEL), stanno valutando le potenzialit`a offerte dall’idrogeno, mediante tec-niche di miscelazione con altri gas utilizzati nelle attuali centrali turbogas o a ciclo combinato, con risultati promettenti. In definitiva, si pu`o gi`a da ora affermare, che l’idrogeno si stia affermando prepotentemente nella conce-zione di un nuovo mondo; basti considerare il notevole contributo all’abbat-timento dei gas inquinanti, che l’utilizzo dell’idrogeno pu`o apportare soprat-tutto riguardo alla trazione stradale (sopratsoprat-tutto nei centri ad alta densit`a di popolazione).
13 1.1. La combustione
1.1
La combustione
L’idrogeno `e a temperatura ambiente un gas incolore, inodore e pratica-mente insolubile in acqua. Dopo l’elio `e il gas pi`u difficile a liquefarsi. E’ un ottimo conduttore del calore (`e noto, infatti, il suo utilizzo come refrigerante nei turboalternatori) e viene facilmente assorbito da taluni metalli. Le ca-ratteristiche fondamentali, si possono riassumere nella seguente tabella:
Parametro Unit`a Valore
Simbolo - H
Peso Molecolare kg/kmole 2.01588
Densit`a (cond.Norm.) kg/m3
0.0899 Densit`a come liquido kg/m3
70.80
Temperatura di Ebollizione K (◦C) 20.268 (-252.78)
Temperatura Critica K 32.94
Pressione Critica bar 12.84
Densit`a Critica kg/m3
31.40
Calore Specifico kJ/(kg K) 14.89
Potere calorifico Superiore MJ/kg 141.90 Potere calorifico Inferiore MJ/kg 119.90
Tabella 1 - Propriet`a fondamentali dell’Idrogeno Fonte: Wikipedia
1.1. La combustione 14
http://en.wikipedia.org/wiki/Main_Page
Tra i vari parametri indicati, quello maggiormente interessante per i nostri scopi, `e il potere calorifico; esso rappresenta il contenuto di energia termica sviluppabile dalla combustione completa dell’unit`a di massa, ed `e in assoluto il pi`u alto valore fra tutti i combustibili conosciuti.
Attualmente, come precedentemente accennato, l’impiego dell’idrogeno come combustibile, trova un limitato campo di applicazione:
• nei programmi spaziali della NASA
• nel settore dei trasporti
• in piccole o medie centrali, che sfruttano la tecnologia delle celle a combustibile per produrre energia elettrica.
La combustione dell’idrogeno, utilizzando l’ossigeno come comburente, segue la celeberrima equazione stechiometrica:
2H2+ O2 = 2H2O
dalla quale si evince che l’unico prodotto di reazione sia l’acqua pura. Tuttavia bisogna sottolineare il fatto che normalmente il comburente utiliz-zato non sia costituito da ossigeno puro, bens`ı da aria, la cui composizione `e la seguente [1]:
15 1.1. La combustione
Composizione Standard Aria Secca
Gas % Volume % Massa ppmv Simbolo Chimico
Azoto 78.09 75.47 780840 N2 Ossigeno 20.95 23.20 209460 O2 Argon 0.93 1.28 9340 Ar Anidride Carbonica 0.036 0.056 360 CO2 Neon 0.0018 0.0012 18.21 Ne Elio 0.0005 0.00007 5.24 He Krypton 0.0001 0.0003 1.14 Kr Idrogeno 0.00005 trascurabile 0.50 H2 Xenon 8.7 × 10−6 0.00004 0.087 Xe
Tabella 2 - Fonte: UIG - (http://www.uigi.com/)
La presenza, in aria, di altre sostanze oltre all’ossigeno, produce una mole notevole di inconvenienti per la combustione, di cui la causa principale `e la presenza dell’azoto.
Infatti la reazione di combustione produce insieme al vapore acqueo, una certa quantit`a di ossidi di azoto1
, fortemente dipendente dalla temperatura di fiamma.
Per attenuare l’emissione dei NOx, vengono utilizzate,nei moderni combu-stori, varie strategie di combustione, fortemente dipendenti dalla tipologia di combustibile; e soltanto nei casi estremi si ricorre a degli apparati aggiun-tivi denominati DeNOx, che provvedono all’abbattimento della percentuale
1
Sostanze tossiche per l’uomo, e dannose per l’ozono, genericamente indicate con la sigla NOx
1.1. La combustione 16
di ossidi emessi in atmosfera, tramite delle reazioni chimiche2
.
Uno dei fattori pi`u importanti che caratterizzano ed influenzano il com-portamento della combustione all’interno dei combustori, `e la temperatura di fiamma.
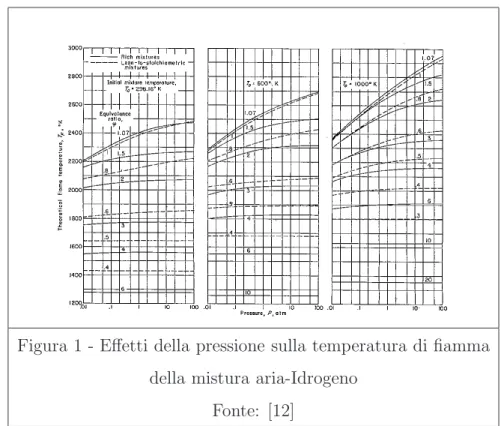
Nel caso dell’idrogeno, considerando l’ossigeno come comburente, si possono raggiungere ed anche superare temperature di fiamma dell’ordine 3000◦C.
Test eseguiti dalla NASA3
testimoniano la dipendenza di tali temperature dalla tipologia di combustione (Adiabatica o Refrigerata), dalla pressione e temperatura di iniezione in camera di combustione.
2
Nei DeNOx Catalitici le reazioni chimiche avvengono tra gli ossidi di azoto e l’am-moniaca che viene iniettata insieme ad essi, a temperature dell’ordine dei 350-450◦C, in presenza di opportuni catalizzatori.
3
17 1.2. Pregi e difetti
Figura 1 - Effetti della pressione sulla temperatura di fiamma della mistura aria-Idrogeno
Fonte: [12]
Da ci`o si intuisce come, per tal genere di combustibile, siano indispensabili tecniche di refrigerazione e di controllo della fiamma opportune, e materiali idonei alla sopportazione di tali sollecitazioni termiche.
1.2
Pregi e difetti
L’idrogeno presenta una lunga lista di vantaggi che lo rendono affascinante, sotto il profilo energetico, ma anche molti svantaggi che ne frenano lo sviluppo su scala globale. Soltanto lo sviluppo e la ricerca di nuove tecnologie, pu`o fare pendere l’ago della bilancia verso i pregi di questa sostanza. Vediamo alcune caratteristiche; l’idrogeno:
• pu`o essere prodotto utilizzando svariate metodologie, e tipologie di energia primaria4
. 4
1.2. Pregi e difetti 18
• Pu`o costituire la soluzione al problema dell’accumulo di energia elet-trica.
• Elimina radicalmente i problemi legati alla aleatoriet`a ed intermittenza delle fonti rinnovabili come l’eolico ed il solare.
• Presenta il pi`u alto valore del potere calorifico, e ci`o implica che a parit`a di potenza termica generata, `e necessaria una quantit`a ponderale di combustibile, inferiore. Combustibile p.c.s. a 25◦C p.c.i. a 25◦C [MJ/kg] [MJ/kg] Idrogeno 141.9 120 Metano 55.6 50.1 Gas d’altoforno 2.9 2.75
Gas Naturale (Malossa) 53.6 46.6
Propano 50.4 46.4
Carbone (*) 32.1 30.3
Biomasse (Legna) 13.8 10.7
Olio Combustibile (*) 44 41.3
Alcol Etilico 29.7 26.8
p.c.s.=potere calorifico superiore p.c.i.=potere calorifico inferiore
(*) valore medio, considerando varie tipologie. Fonte: [1]
Tabella 3 - Poteri Calorifici
• Non genera, dalla combustione, gas serra, come invece avviene con la totalit`a dei combustibili fossili (idrocarburi)
19 1.2. Pregi e difetti al contempo:
• presenta un alto grado in infiammabilit`a, implicando un notevole di-spendio di risorse legate alla sicurezza nel trasporto e stoccaggio. • Sia in forma gassosa che liquida, ha una densit`a bassa, e ci`o
com-porta un maggiore volume occupato, a parit`a di massa, rispetto ad altri combustibili (Olio combustibile, Gas naturale), ci`o comporta ulteriori problemi di trasporto e stoccaggio.
Combustibile p.c.s. p.c.i. Densit`a h M J m3 n i h M J m3 n i h kg m3 n i Idrogeno 12.77 10.8 0.090 Metano 39.83 35.89 0.717 m3
n= Normal Metro Cubo: 1 atm , 0◦C
• A causa delle elevate temperature di fiamma, se viene utilizzata aria comburente, genera quantit`a di ossidi di azoto superiori rispetto ad altri combustibili.
• Il processo di liquefazione `e oneroso; occorre molta energia e mezzi pi`u sofisticati rispetto ad altri gas.
• a contatto con alcuni metalli, si lega a formare gli idruri. Tale feno-meno pu`o risultare vantaggioso se posto sotto l’ottica dello stoccaggio di tale combustibile, ma anche estremamente negativo considerando i danni che pu`o produrre alle parti meccaniche (Turbine, Compressori ecc.) di un impianto utilizzatore; gli idruri, infatti, presentano scarse propriet`a meccaniche (estrema fragilit`a, basso modulo di Young ecc.)
1.3. Usi Attuali 20
1.3
Usi Attuali
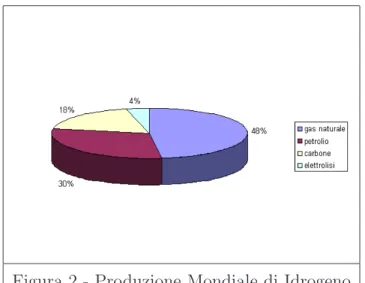
Ogni anno nel mondo si producono circa 500 miliardi di metri cubi di idrogeno per uso industriale, di cui il 99% `e prodotto partendo da combustibili fossili, mentre solo l’1% da fonti rinnovabili.
In particolare il 48% deriva dal gas naturale, il 30% da petrolio, il 18% dalla gassificazione del carbone, ed il rimanente 4% dall’elettrolisi dell’acqua:
Figura 2 - Produzione Mondiale di Idrogeno Fonte: National Hydrogen Association
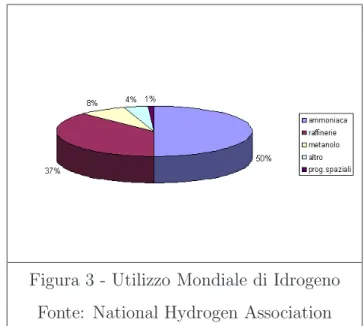
Circa il 50% dell’idrogeno prodotto `e usato per la produzione di Am-moniaca che a sua volta trova il suo maggiore utilizzo nella produzione di fertilizzanti. Il 37% `e utilizzato nelle raffinerie petrolifere, al fine di rimuo-vere le impurit`a presenti nei combustibili, l’8% `e utilizzato per la sintesi del metanolo, il 4% in altre applicazioni di natura chimica e metallurgica, ed il rimanente 1% `e usato nei programmi spaziali:
21 1.3. Usi Attuali
Figura 3 - Utilizzo Mondiale di Idrogeno Fonte: National Hydrogen Association
Allo stato attuale, l’idrogeno `e principalmente prodotto in centrali situate in prossimit`a degli impianti industriali che lo utilizzano, in questo modo si attenuano notevolmente i problemi legati al trasporto e stoccaggio. Tuttavia le tecnologie nel campo del trasporto hanno subito negli ultimi anni un note-vole miglioramento, soprattutto sotto il profilo della sicurezza; attualmente il trasporto dell’idrogeno pu`o avvenire su strada, su rotaia per via navale, ma sono in continuo sviluppo anche tecniche di trasporto continuo (idroge-nodotti5
).
Da tutto ci`o si evince che l’idrogeno rappresenta allo stato attuale un settore maturo e pronto a manifestarsi come valida alternativa ai combustibili fos-sili; tuttavia esiste la continua necessit`a di migliorare, attraverso la ricerca, e sviluppare ulteriormente le varie tecnologie al fine di rendere competitivi i costi, sia di realizzazione che di gestione ed al contempo garantire sempre un alto grado di sicurezza.
Per quanto riguarda l’idrogeno come combustibile, per fini energetici, esis-tono numerosi progetti, sia a livello nazionale che internazionale, che gi`a da
5
1.4. Panoramica sui consumi Energetici 22
molto tempo (1990-2002) si occupano dello sviluppo di strategie di diffu-sione dell’idrogeno su scala globale; le nazioni che maggiormente si occupano di questo settore sono: Giappone (WE-NET Project); Germania, USA (US Hydrogen Program), Canada (CNHP) e Russia. Anche l’Unione Europea, nel suo sesto programma-quadro “Sustainable Energy System” per il 2006 prevede un rilancio dell’economia dell’idrogeno (EU Work Programme 6.1).
1.4
Panoramica sui consumi Energetici
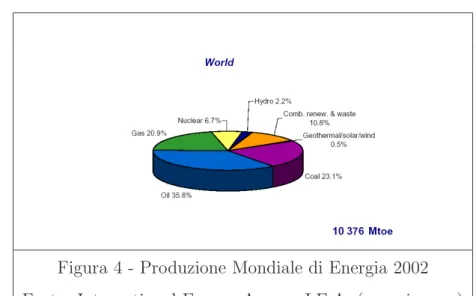
Se si analizzano gli scenari odierni per quanto riguarda la produzione ed il consumo di energia, spicca incontrastato il netto predominio dei combustibili fossili come fonte primaria di energia; considerando il bilancio energetico mondiale del 2002 (fonte: I.E.A), che ha registrato un consumo totale6
di 10·376 Mtep, si ha la seguente suddivisione di fonti:
• Petrolio (Oil)=35.8%
• Metano e Gas Naturale=20.9%
• Carbone (Coal)=23.1% • Biomasse ed R.S.U.=10.8% • Nucleare=6.7% • Idrico=2.2% • Geotermale,Solare,Eolico=0.5% 6
23 1.4. Panoramica sui consumi Energetici
Figura 4 - Produzione Mondiale di Energia 2002 Fonte: International Energy Agency I.E.A. (www.iea.org) anche lo scenario europeo non differisce molto da quello mondiale:
Figura 5 - Produzione di Energia U.E. 2002
Fonte: International Energy Agency I.E.A. (www.iea.org)
E’ evidente che “l’inerzia” del sistema energetico mondiale, basato sul petrolio, risulta ancora imponente; nonostante i numerosi programmi di svi-luppo ed incentivazione delle fonti rinnovabili. Da ci`o, `e prevedibile che un ulteriore sviluppo nella produzione dell’Idrogeno, debba passare forza-tamente attraverso l’utilizzo degli idrocarburi (steam reforming), a scapito dell’utilizzo di fonti rinnovabili (eolico, solare) sfruttando l’elettrolisi.