UNIVERSITÀ DEGLI STUDI DI GENOVA
Scuola di Scienze Matematiche, Fisiche e Naturali
Tesi di Laurea Magistrale
in Scienza e Ingegneria dei Materiali
Protocollo di riciclo e riuso di elettrodi di
batterie agli ioni di litio
Relatori
Prof. Paolo Piccardo
Dott. Francesco Soggia
Candidato
Giorgia Rebagliati
Correlatore
Dott. Marco Smerieri
INDICE
1. Introduzione
5
1.1 Batteria agli ioni di litio - stato dell’arte
6
1.1.1 Funzionamento di una batteria agli ioni di litio
6
1.1.2 Catodo
8
1.1.3 Anodo
11
1.1.4 Membrana ed elettrolita
12
1.2 Batterie esauste
13
1.3 Riciclo delle batterie agli ioni di litio – stato dell’arte
14
1.3.1 Processi pirometallurgici
16
1.3.2 Processi idrometallurgici
17
1.3.3 Processi alternativi
18
1.3.4 Scopo del lavoro di tesi
19
1.3.5 Reinnesto del catodo e batterie green
19
2. Materiali, metodi e protocollo di lavoro
22
2.1 Caso studio pacco batterie
22
2.2 Smaltimento della batteria
24
2.3 Estrazione del litio
29
2.3.1 Comportamento degli acidi liscivianti e parametri fisici
31
2.4 Polveri e reinnesto del litio nel catodo
36
2.5 Preparazione degli elettrodi alternativi
37
2.6 Assemblaggio e test su celle personalizzate
38
2.6.1 Protocollo di testing
40
3. Risultati
42
3.1 Calcolo quantità di litio
42
3.2 Calcolo distribuzione del litio in una batteria
43
3.3 Caratterizzazione batterie - Immagini SEM
44
3.4 Analisi dati
50
3.4.1 Approfondimento dei dati ottenuti
58
3.5 Misure XPS
60
3.6 Reinnesto
61
3.6.1 XRD catodo e anodo
61
3.6.2 XRD polveri reinnestate e immagini
64
3.7.1 Batterie commerciali YLL
73
3.7.2 Batterie personalizzate
77
3.7.2.1 Cella 1
77
3.7.2.2 Cella 2
78
3.7.2.3 Cella 3
79
4. Conclusioni
83
4.1 Protocollo di riciclo e reinnesto del catodo
83
4.2 Risultati delle custom cells
85
Capitolo 1
Introduzione
Le principali tecnologie di produzione energetica, come le celle fotovoltaiche o le turbine eoliche, possono generare energia in maniera sostenibile e pulita, ma hanno limiti di utilizzo dettati dalla loro stessa natura, in quanto lavorano a periodo intermittente e non conservano l’energia generata. La ricerca ha permesso di far fronte all'esigenza di accumulare energia in modo efficiente e di poterla trasportare ed utilizzare on demand con la minima perdita. In questo le batterie a ioni di litio hanno contribuito in modo considerevole affiancandosi alle batterie al piombo affidabili ma caratterizzate da una minore densità di potenza. La ricerca nel settore iniziò durante la crisi petrolifera degli anni 70’, grazie a Michael Stanley Whittingham che esplorò tecniche alternative per ottenere sistemi di produzione energetica senza l’utilizzo di combustibile fossile, sviluppando una batteria funzionante avente litio metallico e solfuro di titanio come elettrodi [1], quest’ultima non trovò grande utilizzo ma fornì le basi per i lavori successivi. Nello stesso periodo, Jurgen Otto Besenhard studiò l’intercalazione reversibile in grafite e ossidi catodici [2] e più tardi Samar Basu dimostrò l’intercalazione elettrochimica del litio nella grafite [3], implementando il sistema. Le celle della batteria costruite in quel momento, tuttavia, si deteriorano rapidamente ad ogni ricarica. Rachid Yazami affrontò questo problema nei primi anni '80 attraverso la ricerca sull'intercalazione elettrochimica reversibile del litio in grafite [4]. La svolta definitiva si ottenne con John Bannister Goodenough, il quale sviluppa il lavoro di Whittingham con catodi innovativi, leggeri e ad alta densità di energia basati su ossidi di litio cobalto (LixCoO2) [5,6] e infine con Akira Yoshino, che sostituisce definitivamente il litio metallico con gli ioni di litio [7], elevando la batteria in termini di sicurezza e praticità. Dal 1991 in poi inizia il vero e proprio sviluppo commerciale.
Tutto ciò ha permesso una vasta gamma di forme e dimensioni delle batterie, rendendole adattabili negli spazi nei dispostivi, inoltre sono più leggere delle equivalenti fabbricate con altri componenti chimici e non subiscono effetto memoria.
Sin da subito hanno dimostrato di immagazzinare una grande quantità di energia, possedere carica e scarica, bassa manutenzione e lunga vita, ma difettano di una minore densità di potenza, non potendo quindi erogare un’alta quantità di energia in breve tempo (Figura 1.1). Tuttavia, possono svolgere un ruolo molto più importante nella nostra società moderna, in particolare come componente chiave nello sviluppo della sostenibilità energetica. In combinazione con la rete elettrica, le batterie agli ioni di litio potrebbero supportare l'integrazione di energia fotovoltaica ed eolica, fornendo capacità di stoccaggio e servizi ausiliari. Pertanto, con una piccola impronta di carbonio può diventare la base per i veicoli elettrici, in cui le batterie agli ioni di litio sono la tecnologia legata al processo produttivo preferita. Esse hanno anche un enorme potenziale per l'uso in sistemi di alimentazione off-grid (senza collegamenti a reti elettriche principali) specialmente in combinazione con i sistemi solari domestici, per fornire un accesso più semplice all'elettricità nelle regioni in via di sviluppo [8].
Figura 1.1 - Confronto di energia e potenza specifica per differenti tecnologie di stoccaggio di
energia elettrica. Acronimi: SMES (stoccaggio di energia magnetica superconduttiva), VRB (batterie redox al vanadio), TES (stoccaggio di energia termica) [8]
1.1 Batterie agli ioni di litio – stato dell’arte
1.1.1 Funzionamento batteria agli ioni di litio e termodinamica
Una cella di una batteria agli ioni litio è formata da due elettrodi, un anodo (il polo negativo) e un catodo (il polo positivo), separati da una membrana semipermeabile che li isola elettricamente e collegati ionicamente da una soluzione elettrolitica (figura 1.2); il sistema è racchiuso e isolato dall’esterno da un involucro metallico, collegato con l’anodo, mentre la testa è collegata a un piccolo collettore con il catodo.
Il funzionamento si basa sulla intercalazione degli ioni di litio nelle fasi di carica e di scarica, ovvero il loro inserimento reversibile nelle strutture dei due elettrodi: durante la fase di carica gli ioni Li+ sono sottratti dalla struttura del materiale attivo del catodo, attraversano l’elettrolita e la membrana e si collocano nella struttura del materiale attivo dell’anodo, dove vengono ridotti. Durante la scarica avviene il processo inverso, creando un flusso di ioni Li+ che ritorna nel materiale attivo del catodo. La neutralità di carica del sistema viene mantenuta da un numero equivalente di elettroni che si sposta in maniera opposta agli ioni, lungo il circuito esterno costituito dai collettori e produce la corrente in scarica.
La reazione completa di intercalazione e deintercalazione è una reazione di ossidoriduzione; se prendiamo come catodo LiCoO2 e consideriamo la reazione di scarica otteniamo:
Al catodo: 2LixCoO2 + Li+ + e- → 2LiCoO2 All’anodo: LiC6 → Li+ + e- + 6C
Dopo la prima carica di una batteria, intercalando gli ioni di litio nella struttura dell’anodo, la delitiazione del carbonio durante le scariche successive non è mai completa al 100%. Questo è analogo nel catodo per i cicli successivi, dove non si riesce a delitiare completamente il litio dalla sua struttura.
Figura 1.2 – Schema di una batteria agli ioni di litio [9]
Durante il ciclo continuo di carica e scarica la batteria perde parte della sua capacità, la quale non può più essere recuperata. La causa principale è la formazione della SEI (interfase ad elettrolita solido), uno strato passivante che si forma sulla superficie degli elettrodi (in particolar modo all’interfaccia anodo-membrana). Questa interfase è costituita dai prodotti di decomposizione organici ed inorganici dell’elettrolita, formati attraverso le reazioni con l’elettrodo a causa della perdita di elettroni, e rimuove ioni Li+ dal sistema. Dal punto di vista termodinamico la sua formazione si verifica quando il potenziale redox degli elettrodi utilizzati si trova al di fuori della finestra elettrochimica dell'elettrolita [10], ovvero nel processo di carica (figura 1.3). Quando l'orbitale molecolare non occupato più basso (LUMO) dell'elettrolita è superiore all'energia di Fermi dell'anodo, l'elettrolita è stabile nella batteria; in caso contrario, l'elettrolita può essere ridotto.
In generale la SEI permette il trasporto di Li+ e blocca gli elettroni in modo da prevenire una ulteriore degradazione dell’elettrolita e garantire il continuo delle reazioni elettrochimiche. Ma la sua crescita va controllata, poiché se lo spessore diventa troppo elevato il Li+ non passa e si accumula, portando alla formazione di dendriti di Li metallico e al cortocircuito della batteria.
Figura 1.3 – Diagramma di energia schematico di un elettrolita a circuito aperto [10]. ΦA e ΦC
sono le funzioni lavoro di anodo e catodo; Eg è la finestra di stabilità elettrochimica
dell’elettrolita; 𝜇A e 𝜇C sono i potenziali di ossidoriduzione (chimici) di anodo e catodo.
1.1.2 Catodo
Il catodo è formato da un sottile foglio di alluminio di spessore compreso tra i 15 e i 20 um con la funzione di collettore di elettroni. Per questo motivo è ricoperto da un sottile strato protettivo e conduttore di grafite su cui viene applicato il prodotto attivo del catodo. Per il processo di rivestimento viene preparata una miscela di materiale attivo, binder polimerico, additivi conduttori e solvente. Il binder è necessario per garantire una buona coesione delle particelle attive e una sufficiente adesione al collettore e solitamente viene usato il polivinildenfluoruro (PVDF), il quale forma strutture simili al capello che mantiene efficacemente insieme il rivestimento (figura 1.4).
Il PVDF non è solubile in acqua, solitamente si usa N-metil pirrolidone (NMP) come solvente, il quale viene eliminato completamente tramite evaporazione avendo l'accortezza di mantenere la continuità dello strato.
Il carbon black viene utilizzato come additivo conduttore e la quantità inserita dei due elementi solitamente è un segreto di tipo commerciale, variando dall’1 al 5% per il nero di carbone e dal 2 all’8% di PVDF. La loro quantità è stabilita dalla loro funzione: nelle celle a risparmio energetico è ridotta al minimo, poiché gli additivi non immagazzinano energia, mentre nelle celle ottimizzate in termini di potenza, un buon contatto e conducibilità sono più importanti e la quantità di additivi può quindi essere maggiore.
Un buon catodo deve mantenere e rispettare determinati parametri [11] che sono solo in parte soddisfatti dai materiali attualmente in uso per cui si cerca di usare quelli che rappresentano il miglior compromesso:
Deve contenere ioni che si riducono/ossidano rapidamente, come i metalli di transizione;
Deve reagire con il litio in maniera reversibile e con alta energia libera, di conseguenza la reazione di intercalazione non deve far variare la struttura ospitante quando il litio si inserisce;
La reazione con il litio deve essere molto veloce, sia nella rimozione sia nell’inserzione, in modo da massimizzare la densità di potenza;
Deve avere alta capacità, intercalando uno o più ioni Li+ per metallo di transizione e alto potenziale, così da accumulare molta energia;
Deve essere un buon conduttore per aggiungere o rimuovere velocemente ioni durante la reazione elettrochimica, consentendo a quest’ultima di avvenire in tutti i punti di contatto tra il materiale attivo catodico e l'elettrolita piuttosto che nei punti di contatto ternario tra il materiale attivo catodico, l'elettrolita e il carbon black;
Deve essere stabile e non degradarsi; Deve avere un costo adeguato;
Deve avere un basso impatto ambientale.
A seconda dell’impiego della batteria si hanno numerosi materiali catodici attivi: Ossido di litio cobalto (LCO)
Ossido di litio nichel-cobalto-manganese (NCM) Ossido di litio nichel-cobalto-alluminio (NCA) Ossido di manganese litio (LMO)
Ossido di litio ferro (LFO)
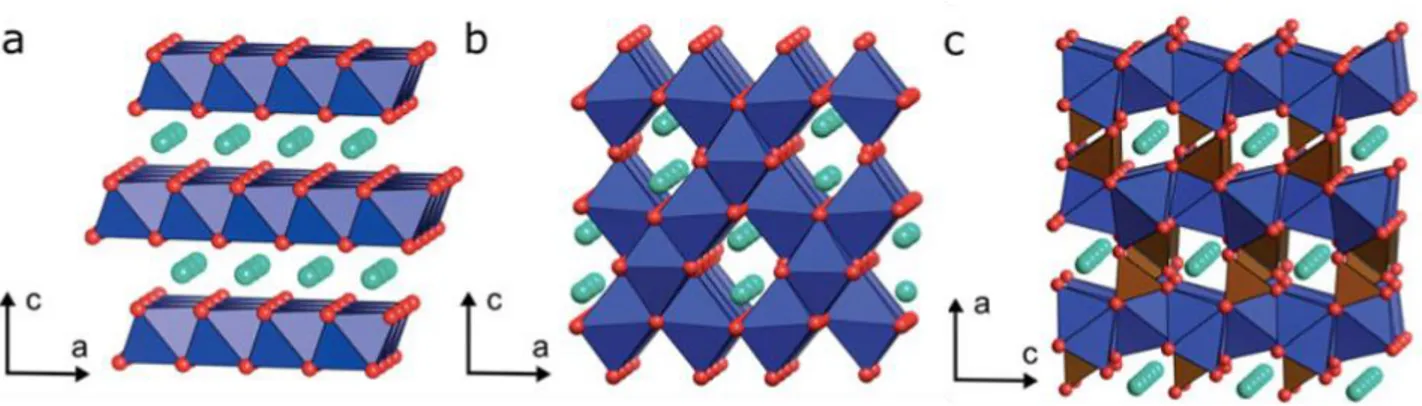
L’ossido di litio cobalto (LCO o LiCoO2) è stato usato come materiale catodico nelle batterie agli ioni di litio per applicazioni portatili sin dall’introduzione della prima batteria commerciale sviluppata dalla Sony nel 1991 [12]. Presenta simmetria esagonale (figura 1.5a) e quando lo ione Li+ è intercalato dalla struttura si va a formare la coppia redox Co4+/Co3+, dando origine a un potenziale di circa 4.0V e un’alta capacità specifica teorica di 274 mAh/g. È ancora
comunemente utilizzato nonostante l’alto costo e la scarsità del cobalto, poiché è facile e relativamente economico da sintetizzare, possiede un’alta efficienza coulombica ( > 92%) [13] durante i primi cicli e nei successivi, alta capacità volumetrica teorica, bassa autoscarica e alto potenziale di scarica [14]. La limitazione è l’instabilità strutturale, cosicché il potenziale di carica è limitato a 4.2V, solo metà del litio è intercalabile e la massima capacità scende a circa 160 mAh/g. Inoltre, possiede bassa stabilità strutturale e termica, infatti se viene sovracaricata ulteriormente la cella si riscalda e rilascia ossigeno, il quale combinandosi con l’elettrolita reagisce violentemente e causa fiamme ed esplosioni [15,16].
La ricerca ha portato a sostituire parzialmente il Co con Mn e Ni, per ottenere LiNi1-x-yCoxMnyO2 (NCM). Qui Mn3+ viene ossidato a Mn4+, mentre il Ni3+ viene ridotto a Ni2+, stabilizzando così la struttura senza partecipare ai processi di carica e scarica. In generale ciascun metallo di transizione porta i suoi vantaggi e svantaggi, nello specifico il Co contribuisce alla stabilità strutturale e alla conducibilità elettrica, mentre il Mn alla stabilità chimica, oltre ad essere più abbondante come risorsa e non dannoso per l’ambiente. Le proprietà del Ni sono comprese tra questi due elementi, per cui si utilizza in alternativa al Co per diminuirne il contenuto, cosicchè la capacità aumenta mentre il costo diminuisce [17]. A seconda del gradiente di concentrazione si ottengono risultati differenti: se si ha un alto contenuto in Ni (es. NCM 811) aumentano la densità di energia e potenza, siccome la quantità di Li estratta è maggiore, oppure se abbiamo pari quantità dei metalli di transizione (es. NCM 523) aumentiamo la sicurezza e la durata del ciclo di vita della batteria [18].
Figura 1.5 – Strutture cristalline di (a) LiMO2 stratificato (M = Co, Ni, Mn ecc.), (b) spinello
LiMn2O4 e (c) olivina LiFeO4. Gli ottaedri dei metalli di transizione, MO6, sono rappresentati in
blu, mentre i tetraedri polianioni , XO4, sono rappresentati in marrone. Gli ioni Li+ sono mostrati
in azzurro [19]
Se al posto del Mn sostituiamo l’Al otteniamo LiNi1-x-yCoxAlyO2 (NCA). L'uso dell'alluminio in sostituzione del manganese permette un aumento dei seguenti parametri: la stabilità termica della struttura, la stabilità ciclica, l’energia specifica, la densità energetica e la potenza erogata, Per questo motivo vengono utilizzate per le auto elettriche (es. Tesla, Mercedes) [8], sebbene sia ad alto costo e presenti problemi legati alla sicurezza, per una crescita aggressiva della SEI ad alti potenziale e temperatura.
L’ossido di manganese litio (LiMn2O4 o LMO) cristallizza nella struttura a spinello (figura 1.5b) e passa dallo stato Mn3+ allo stato ossidato Mn4+, determinando un potenziale di lavoro di 4.1V. LMO e i sui derivati presentano basso costo, alta energia, alta potenza e sono sicuri e poco tossici per l’assenza di cobalto. Il problema riguarda la sua bassa capacità specifica (120 mAh/g) e il suo ciclo di vita, più breve rispetto alle altre batterie a causa della degradazione sia per alta temperatura (sopra i 55°C) sia per instabilità della struttura con l’elettrolita, che tende a decomporsi formando acido fluoridrico, tossico e dannoso per l'intera batteria [11].
L’ossido di litio ferro fosfato (LiFePO4 o LFP) cristallizza nella struttura tipica dell’olivina (figura 1.5c) ed è molto utilizzato poiché il Fe è una risorsa abbondante in natura, è a costo relativamente basso e ha bassa tossicità. Possiede alta stabilità ciclica, alta densità di energia e alta densità di potenza, ma i suoi problemi sono la scarsa conducibilità elettrica e lenta mobilità del litio nella struttura [11], il basso voltaggio e la bassa densità di energia, oltre a una degradazione del materiale sopra i 50°C analoghi ai precedenti.
Tabella 1.1 – Composti catodici di intercalazione [20]
1.1.3 Anodo
L’anodo è formato da un collettore di rame, un foglio dallo spessore di 15-20 𝜇m, sul quale è applicata, come nel catodo, la miscela di materiale attivo e inattivo. Precedentemente il materiale anodico era costituito da litio metallico, avente la capacità specifica più alta in assoluto. Il problema risiedeva, durante i ripetuti cicli nella batteria, nella riduzione degli ioni Li+ a Li metallico, con la formazione di cristalli dendritici di litio all'interfaccia tra membrana e anodo con sviluppo ad essa ortogonale. La loro crescita può causare cortocircuiti, avviare una reazione termica e innescare fiamme.
Tipicamente l’anodo che si utilizza maggiormente è il carbonio sotto forma di grafite. Essa è composta da fogli di grafene, arrangiamenti planari di esagoni C6 uniti per i vertici, organizzati con disposizione AB (grafite esagonale) o ABC (grafite romboedrica). Questa struttura riesce ad intercalare gli ioni Li+ tra i piani (figura 1.6a), che si riorganizzano con disposizione AA e formano una struttura 2D meccanicamente stabile, in questo modo è possibile depositare fino a 1 atomo di Li per 6 atomi di C. [11]
Il carbonio ha proprietà vantaggiose, quali basso costo, alta capacità volumetrica, alta diffusività del Li e basso cambiamento di volume durante litiazione/delitiazione, che gli conferiscono alta densità di potenza e lungo ciclo di vita [20].
Un anodo innovativo è stato sviluppato dall’azienda Battrion©, in cui la grafite viene compressa ed orientata, in questo modo aumentano la densità di potenza e la capacità specifica, mentre diminuisce l’impedenza della batteria. Il materiale attivo risulta solubile in acqua, poiché come binder polimerico viene usata la gomma stirene butadiene (SBR).
Figura 1.6 – Struttura cristallina di (a) grafite e (b) spinello LTO [20]
Un’alternativa al carbonio è l’ossido di litio e titanio (Li4Ti5O12 o LTO, figura 1.6b), il cui vantaggio è la variazione quasi nulla del suo volume (0.2%) durante litiazione/delitiazione e un elevato potenziale di equilibrio (1.55V). Ciò permette la formazione di una SEI più stabile ma non impedisce alla struttura di reagire con l’elettrolita organico, causando gassificazione. Viene utilizzato per applicazioni che necessitano di maggiore stabilità termica e alta potenza [21].
1.1.4 Membrana ed elettrolita
La membrana funge da separatore tra anodo e catodo per evitare il contatto elettrico ovvero che vi sia un cortocircuito tra i due elettrodi, mentre permette il passaggio degli ioni Li+ lungo la cella, siccome la sua struttura è microporosa. La maggior parte delle membrane è di materiale polimerico, come polietilene (PE), polipropilene (PP), miscele PP/PE e polietilene ad alta densità (HDPE). Negli ultimi anni si stanno sperimentando separatori ceramici per maggiori bagnabilità superficiale e resistenza ad alte temperature, consentendo di aumentare la sicurezza della cella.
La membrana deve essere chimicamente inerte rispetto all’elettrolita contenuto nella soluzione in cui sono immersi anodo e catodo. L'elettrolita svolge una funzione fondamentale che consiste nel facilitare la migrazione degli ioni Li+ all’interno della cella. La miscela è composta da un
solvente, ovvero un gruppo di idrocarburi (etilen carbonato, dimetil carbonato, propilen carbonato, etil metil carbonato… ) e un sale dissolto e dissociato nel solvente e contente ioni Li+, solitamente viene utilizzato esafluorofosfato di litio (LiPF6) siccome l’anione PF6- è inerte verso agenti riducenti forti e altamente solubile in solventi organici (figura 1.7).
La miscela permette di definire la finestra di stabilità dell’elettrolita (figura 1.3), determina perciò il potenziale della cella e stabilisce quali possibili prodotti si formano per reazione con l’anodo che andranno a formare la SEI [10]. La chiave è raggiungere la stabilità chimica delle specie ridotte e i solventi EC formano specie instabili, soggetti ad attacchi radicali e causano una crescita della SEI continua. Per questo vengono aggiunti additivi come vinilen carbonato e fluoroetilen carbonato che portano a specie polimeriche stabili, con risultato una crescita più controllata e una struttura più compatta della SEI. [22].
Figura 1.7 – Potenziali di riduzione di comuni solventi, additivi e sali [10].
1.2 Batterie esauste
Le batterie agli ioni di litio si esauriscono naturalmente quando la delitiazione al catodo non è più possibile e non vi è trasferimento all’anodo. Vi sono però casi in cui una batteria si esaurisce dopo un numero di cicli limitato o in maniera repentina, solitamente a causa di un difetto. Questo può avvenire per:
degradazione dell’elettrolita, non è più in grado di trasportare gli ioni all’interno della cella
formazione di dendriti di Li metallico
Negli ultimi due casi non è più possibile recuperare i materiali attivi per la rigenerazione, occorre quindi verificare che la loro struttura cristallina non sia variata prima di riciclare e inserire il materiale all’interno di una nuova batteria.
1.3 Riciclo delle batterie agli ioni di litio – stato dell’arte
Ogni anno la produzione di batterie a ioni di litio aumenta rapidamente e in tutto il mondo ha raggiunto $7.8 miliardi nel 2016, mentre il valore di mercato del 2020 si stimerà essere attorno ai $50 miliardi. In futuro diventeranno la prima scelta per le auto elettriche, perché rispetto ad altre batterie sono più avanzate in termini di densità di energia e tensione per cella, punti cruciali per veicoli sia ibridi che elettrici [23].
Il riciclaggio delle batterie esauste ha suscitato molto interesse a causa dell’elevata domanda di metalli relativamente rari, come Li e Co (soggetti ad una possibile carenza nei prossimi decenni) e dell’accumulo di rifiuti solidi tossici, che si stima saranno essere circa 11 milioni di tonnellate nel 2030 e impatteranno fortemente sull’ambiente e la nostra salute, soprattutto nei paesi in via di sviluppo dove non esistono leggi per il riciclo.
Fortunatamente, la competizione sulle risorse sta abbassando i costi per le materie prime e la società Bloomberg New Energy Finance prevede la diminuzione del costo di una batteria dai 109$/kWh nel 2025 fino ai 73$/kWh nel 2030 [24].
Tabella 1.2 - Costi dei materiali per una batteria agli ioni di litio [25]
Tutto ciò porta alla necessità di un protocollo di recupero e riciclo per le batterie a fine vita che vada a recuperare più materiale possibile e che preveda soprattutto processi a basso impatto ambientale.
Recentemente in Europa sono stati realizzati diversi processi in impianti industriali di piccola scala [25] e la regolazione del riciclo è attiva dal 2006 tramite la Batteries Directive (2006/66/EG) [26]: essa prevede che tutte le batterie collezionate e identificate devono essere trattate e riciclate secondo lo stato dell’arte e che il minimo di efficienza di riciclo sia uguale o superiore al 50%.
I due principali percorsi di processo sono il pirometallurgico e l’idrometallurgico. In alcuni impianti si procede con un processo che è il risultato della combinazione dei due. Possiamo classificare entrambi i processi come chimici che devono essere preceduti da pretrattamenti fisici:
separazione meccanica, si basa su proprietà differenti come densità, conducibilità o proprietà magnetiche [30,31] per separare e concentrare gli oggetti metallici;
processi termici (fino a 150°C) per eliminare additivi organici, utili alla produzione di acciai, leghe di ferro o di altri metalli, gli svantaggi sono possibili ossidazioni di questi ultimi o inquinamento di gas tossici;
processi meccanochimici, sfruttano la macinazione per esporre aree di superficie maggiori e perciò recuperano in modo più efficace litio e cobalto in processi idrometallurgici;
processi di dissoluzione, per indebolire l’adesione del binder polimerico (solitamente PVDF o PTFE) che mantiene i materiali attivi sui collettori di corrente tramite solventi organici.
Proprio nell’ultimo punto, secondo i processi chimici che si vanno ad applicare nella catena di riciclo (tipicamente gli idrometallurgici) si possono riscontrare difficoltà nel rimuovere il collettore di alluminio dal catodo. Vi sono altri metodi per la separazione, tra cui riscaldamento ad alte temperature per degradare il binder [32], agitazione di pezzi più piccoli in una soluzione acida a 80°-90°C [33] e frantumazione ed ultrasuoni [34]. Purtroppo, questi non garantiscono
l’integrità dei fogli di alluminio, rendendoli inutilizzabili in quanto vengono frantumati, dissolti oppure ossidati sulla superficie.
Tra i solventi che si utilizzano nella dissoluzione il N-metil pirrolidone (NMP) è uno dei più efficaci, sebbene il solvente sia costoso e notoriamente nocivo [35]. Altri come Bankole, Gong e Lei [36] utilizzano dimetilsolfossido (DMSO) a temperature di 60°C, poiché ha un impatto sull'ambiente e sulla salute decisamente meno importante rispetto al precedente.
Figura 1.9 - Scheda NMP – Sigma Aldrich
1.3.1 Processi pirometallurgici
Sono i più diffusi e consistono in operazioni ad alte temperature in formaci per fondere e raffinare metalli, tramite reazioni con gas o agenti riducenti per dividerli dal materiale grezzo. In questo modo si possono recuperare sotto forma di leghe i seguenti metalli: cobalto, manganese, alluminio, nichel, ferro… [25, 27,28]. Per recuperare il litio, occorre combinare il processo con il lavaggio tramite acidi, quindi un processo idrometallurgico, mentre per quanto riguarda gli altri materiali come le plastiche, i solventi organici e la grafite si consumano e forniscono calore durante la combustione [28].
Le alte temperature consumano anche il binder polimerico che fissa il materiale attivo ai collettori, per cui è possibile recuperare singolarmente i fogli di alluminio e rame [27,29]. I problemi intrinseci di questi processi sono molteplici:
se il calore prodotto dai processi di combustione e chimici non viene convertito in altra forma di energia (es. tramite termovalorizzatore) si ha una spesa energetica troppo elevata
l’emissione di gas tossici prodotti dai solventi della batteria
la perdita di materiali, come il litio, che possono essere recuperati se si combinano altri metodi di recupero.
1.3.2 Processi idrometallurgici
Sono processi semplici ed efficienti per estrarre tutti i metalli disponibili e il numero delle tecniche utilizzate mira alla dissoluzione e all’estrazione di materiali da un ambiente acquoso. Tra i più comuni troviamo la lisciviazione acida, la precipitazione chimica, l’estrazione con solvente e la separazione elettrochimica.
Il primo è il metodo più utilizzato e consiste nell’estrarre uno o più soluti da un solido attraverso l‘applicazione di un solvente liquido: entrambe le fasi entrano in stretto contatto e i soluti diffondono dalla fase solida a quella liquida, portando ad una separazione dei componenti originali del solido. Il meccanismo su cui si basa è chiamato nucleo restringente o shrinking-core [37] ma, a differenza del modello classico in cui la particella si consuma e diminuisce le sue dimensioni, in questo caso i nuclei interni delle particelle si restringono nel tempo mentre la dimensione della particella rimane invariata. In particolare, la velocità di lisciviazione è limitata alla velocità della fase più lenta e nel modello si distinguono 3 fasi che avvengono simultaneamente [38] :
1. diffusione delle molecole di lisciviante all'interno del film liquido che circonda la particella
2. diffusione delle molecole attraverso lo strato di particelle solide più esterne fino alla superficie del nucleo interno
3. reazione chimica delle molecole sulla superficie del nucleo interno, dove gli ioni di litio e cobalto dissolvono nella soluzione
Se assumiamo che la reazione sia del primo ordine, la massa del nucleo lisciviato per unità di tempo viene descritta da questa equazione:
−
𝑑𝑚𝑑𝑡 = kSC (1.1)
dove k è la costante chimica di reazione, S è l’area superficiale del nucleo e C la concentrazione di agente lisciviante. Poiché l’acido viene consumato, una diminuzione della sua concentrazione
è correlata positivamente con il consumo di reagenti. Pertanto, se assumiamo che l'efficienza di lisciviazione sia X, la massa del nucleo è m e la massa iniziale è m0, allora:
X= (m0 – m)/m0 (1.2)
Abbiamo un numero elevato di esempi in letteratura ma i parametri che vengono presi generalmente in considerazione sono gli effetti della temperatura, la concentrazione degli acidi, il tempo e la concentrazione di agenti riducenti.
Siccome dobbiamo estrarre degli ioni metallici solitamente temperature più alte (inferiori ai 100°C) facilitano la lisciviazione, essendo la dissoluzione del catodo un processo endotermico [39] e variando di conseguenza i tempi di reazione. Gli acidi impiegati sono sia inorganici, tipicamente solforico, cloridrico e fosforico, sia organici con citrico, malico o loro combinazioni. A questi si aggiungono agenti riducenti, tipicamente il perossido di idrogeno, per andare a ridurre gli ioni metallici (es. Co3+ a Co2+) e portarne in numero maggiore in soluzione; inoltre distrugge precipitati complessi ed accelera la lisciviazione poiché la sua decomposizione favorisce rilascio di energia che supera una resistenza parziale della reazione [34]. Altri metodi utilizzano anche acido ascorbico [40], l’uva turca o i residui del tè [35], i quali se mescolati con acido citrico raggiungono un’efficienza simile all’acido cloridrico sommato a perossido di idrogeno: nonostante siano acidi più deboli degli inorganici e più costosi perché maggiormente selettivi (chelanti) per la lisciviazione, sono poco impattanti per l’ambiente per la loro biodegradabilità, la non emissione di gas tossici e ritardata corrosione nei macchinari, per la riciclabilità e il riutilizzo, gli acidi organici stanno diventando assoluti protagonisti in queste tecniche [23].
1.3.3 Processi alternativi
Un’altra opzione può essere rappresentata dai processi biometallurgici, a causa dell’alta efficienza e i bassi costi (pochi requisiti industriali), in cui gli acidi organici ed inorganici usati per la lisciviazione vengono prodotti da microrganismi che svolgono un processo di bio-ossidazione (formazione di minerali). Confrontato agli altri due processi, gli svantaggi includono una bassa cinetica di reazione, l’efficienza di lisciviazione non sempre elevata e i batteri non semplici da coltivare [28,30].
Gli altri metodi sono efficaci per la separazione e il recupero di vari materiali: la precipitazione è utile per recuperare metalli preziosi come il cobalto, selezionando adeguati agenti precipitanti [42] e ottenendo sali come prodotti finali (ossidi, ossalati, carbonati) [32,34,35,40,41]; l’estrazione con solvente è efficace per ottenere metalli puri ma utilizza solventi molto costosi e quindi svantaggioso per un piano industriale; l’elettrolisi favorisce il recupero di metalli di elevata purezza ma tende a consumare troppa elettricità a seconda delle condizioni operative.
1.3.4 Scopo del lavoro di tesi
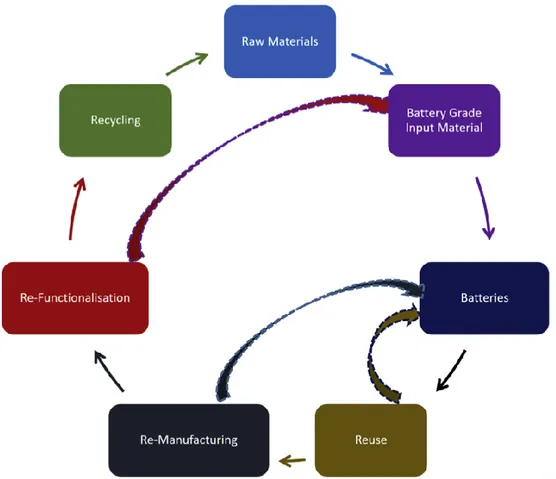
I processi sopra descritti prevedono di estrarre i materiali e ciascuno ha dei vantaggi e degli svantaggi ma nessuno porta al recupero di tutti i materiali. In particolare, si ha che alcune parti non vengono prese in esame per il riciclo e la maggior parte se non la totalità degli elementi recuperati sono rimessi sul mercato delle materie prime senza una specifica indicazione di riuso per processi di produzione o immagazzinamento dell'energia. Per questo motivo il presente lavoro di tesi si inserisce in una linea di ricerca dove il recupero della maggior parte dei materiali che costituiscono la batteria è uno degli obiettivi principali. Il secondo obiettivo, che ricopre uguale importanza, riguarda invece la possibilità di reinserire i materiali estratti nel ciclo produttivo di una batteria in modo da valorizzare il prodotto e ridurre i costi di approvvigionamento delle materie prime previsto dal la produzione di nuove batterie. Il processo diventa così coerente con le recenti linee guida internazionali sull'economia circolare e il riuso in alternativa al riciclo
Lo studio da cui partiamo è quello eseguito da Deepak Pant e Tenzin Dolker nel 2017, dove viene impiegato come agente lisciviante il succo di Citrus pseudolimon Tanaka (limone della collina o galgal), un agrume diffuso in India contenente un mix di acidi (citrico, malico e ascorbico) e flavonoidi che agiscono da agenti riducenti [41]. Se applicato in maniera massiva, il difetto consisterebbe in una coltivazione eccessiva della pianta per ottenere la quantità di succo necessaria ad un recupero efficace del litio.
1.3.5 Reinnesto del catodo e batterie green
La lisciviazione a questo punto diventa fondamentale per l’estrazione del Li, poiché occorre recuperare gli ioni che si trasferiscono tra catodo e anodo ma non modificare quella che è la struttura cristallina del catodo, che deve rimanere pressoché intatto; ciò può essere verificato attraverso il datasheet delle batterie, in cui la capacità è descritta in funzione del litio attivo presente nella cella, sia attraverso analisi più specifiche come diffrazione di raggi X o XPS. Se il metodo risulta efficace, un materiale non recuperabile come il catodo (sia proveniente da batterie in buono stato sia trattato con il protocollo di riciclo) ed elementi come il litio possono essere inseriti nuovamente nella catena di produzione delle batterie, entrando a fare parte dell’economia circolare.
Figura 1.10 - Analisi del ciclo di vita (Life cycle assestment o LCA) di una batteria agli ioni di
litio
Ma il processo può essere ulteriormente ottimizzato: per renderlo valorizzabile e innovativo, si ricorre alla frantumazione del catodo e ad un possibile reinnesto del litio attraverso la stessa soluzione derivante dal trattamento. Lasciato evaporare il solvente e depositati i sali e gli ioni di litio sul catodo, viene macinato in polveri e sinterizzato per ottenere un nuovo materiale attivo che si avvicini o sia uguale alla composizione del materiale di partenza. In questo modo non viene scartato nessun liquido potenzialmente nocivo nell’ambiente, il litio recuperato viene reinnestato e il procedimento acquisisce un’impronta sempre più ecologica.
La maggior parte dei catodi che compongono le batterie agli ioni di litio sono composti da binder dispersi in solventi generalmente tossici (es. NMP), per questo motivo come ultimo lavoro si è testata la produzione di elettrodi alternativi con l’esclusione di questi solventi, utilizzando carbossimetilcellulosa (CMC) come binder. Negli ultimi anni è stato studiato da solo o combinato con altri polimeri a causa dei suoi fattori, tra cui l’assenza di fluoro, la processabilità (impasto a base di acqua/etanolo), la sintesi (legante naturale, niente processo chimico), la sostenibilità (si ottiene da risorse rinnovabili), la facilità di smaltimento (riciclabile tramite lavaggio acquoso)[47]. Nella figura sottostante vengono evidenziati i principali vantaggi dell'acqua rispetto all'NMP per ogni passaggio industriale, dalla miscelazione iniziale dell'impasto, al suo rivestimento sul collettore di corrente, all'essiccazione dello strato dell'elettrodo e, infine, al recupero del solvente.
Figura 1.11 - Descrizione schematica semplificata di un generico processo di produzione di
Capitolo 2
Materiali, metodi e protocollo di lavoro
2.1 Caso studio pacco batterie
Durante il lavoro è stato analizzato un pacco batteria non funzionante di una bicicletta, in cui sono stati rimossi prima di tutti gli strati protettivi, costituiti da un involucro in plastica e due strati di nastro adesivo.
Figura 2.1 – Pacco batterie
Il passo successivo è stato la rimozione delle singole batterie dal pacco, eseguita rompendo i punti di saldatura dei connettori per un totale di 182 batterie di tipologia 18650 YLL, dove 18 e 65 corrispondono rispettivamente al diametro e all'altezza del cilindro che rappresenta volumetricamente la batteria, mentre YLL è un codice interno della casa produttrice per identificare il tipo di catodo e la densità di energia contenuta nel cilindro. Sono state numerate partendo da quella in alto a sinistra nel lato collegato al cavo nero e finendo con quella in basso a destra nell’altro lato.
L’obiettivo è quello di dividerle in base alla differenza di potenziale tra quelle in stato ottimale, quelle da rigenerare e ultime da destinare al riciclo. Per la classificazione le singole batterie sono state misurate con un voltmetro e ritenute ottimali quelle con differenza di potenziale superiori a 2.7V. Sono state selezionate tre batterie ottimali, n°43, n°52 e n°180, per essere testate e caratterizzate dal punto di vista elettrochimico. Un’altra batteria (la n° 123) è stata
scaricata e disassemblata per eseguire una caratterizzazione morfologica e chimica degli elettrodi.
Lo strumento usato per caratterizzare le celle dal punto di vista elettrochimico è il potenziostato Biologic VSP accoppiato al software EC-Lab e dotato del portabatterie BH-1i (figura 2.2). Per le caratterizzazioni morfologiche e chimiche è stato utilizzato un SEM ZEISS Evo dotato di EDS x-act Oxford Instruments.
Figura 2.2 – Portabatterie BH-1i con una batteria YLL
In assenza di una scheda tecnica relativa a questo modello di batteria, a causa della scelta strategica del produttore, si è proceduto con una strategia di reverse engineering e sono stati effettuati dei test preliminari per verificare la loro capacità, per fare questo dopo un processo di recupero della batteria si è applicato il ciclo BCD (determinazione della capacità della batteria) inclusa nella sezione di testing del software EC-Lab, fornito dalla società Biologic a corredo dello strumento VSP per la gestione delle batterie. Questa tecnica permette la determinazione della capacità reale di una batteria sia dopo la formazione della SEI sia dopo un suo utilizzo nel tempo; è un dato importante perché, oltre a dare un'indicazione essenziale sullo stato di salute della batteria, fornisce informazioni utili al potenziostato per l'applicazione delle successive procedure di analisi elettrochimica.
Qui vengono elencati i parametri utilizzati per le misure:
Is1 = 300mA come corrente di carica e scarica, poiché queste batterie hanno solitamente una capacità di 3Ah, per cui una corrente a C/10 dovrebbe essere abbastanza lenta da garantire l’accuratezza del test
t1 = 12h per imporre un limite di tempo all’esperimento, dato che l’esperimento deve essere controllato dalla differenza di potenziale agli elettrodi e il tempo di carica/scarica con la corrente data si arresta in un massimo di 10 ore
Em1 = 4.2V, Em2 = 2.7V; questi due parametri indicano al sistema quando interrompere i processi di carica, ovvero quando la differenza di potenziale supera il valore Em1 e quando interrompere i processi di scarica, cioè quando la differenza di potenziale scende sotto il valore Em2
dt1 = 20s, rappresenta l’intervallo di tempo nell’acquisizione dei dati, quindi un punto ogni 20 secondi, sono sufficienti in quanto la differenza di potenziale tra gli elettrodi cambia lentamente con la bassa corrente impostata
mantenere Em1 per tm = 1h, impostando il BCD in questo modo si segnala al sistema che deve eseguire una parte a tensione costante (CV) del processo di carica, questo viene fatto poiché le batterie sono tipicamente caricate con una corrente costante (CC) fino a quando tende a diminuire via via che la differenza di potenziale è sempre più stabile raggiungendo la soglia imposta in fase di programmazione, usualmente fissata tra il 2% e il 10% della corrente utilizzata in fase di carica CC; in questo modo si garantisce il raggiungimento di una carica della batteria pressoché completo
|I|<Im, con Im = 30mA, in questo modo il sistema interrompe la parte dell’esperimento a
CV quando la corrente che scorre nel sistema è inferiore al 10% della corrente di carica Range di differenza di potenziale E = 0-5V
Range di corrente I = 1A, data la corrente imposta tra 100mA e 1°
Riposo per tR = 20min, in questo intervallo di tempo lo strumento misura la differenza di potenziale tra gli elettrodi senza perturbarlo ed è utile per osservare se il sistema è in equilibrio
Stessi parametri per la fase di scarica
In ultimo è stato eseguito un ciclo galvanostatico a potenziale limitato (GCPL), una funzione che permette di impostare un numero scelto di cicli di carica e scarica per studiare il comportamento del sistema sul ciclo; in questo caso 8 cicli a C/6 (400mA di corrente).
2.2 Smantellamento della batteria
Per ottenere un processo di riciclo ottimizzato della batteria è necessario sviluppare una procedura chiara e sicura, in maniera tale da smantellare efficacemente le batterie, salvaguardando il maggior numero dei materiali e riutilizzando quelli che si presentano ancora in buono stato.
Il processo messo a punto prevede consigli e risultati riportati in letteratura: il passo fondamentale è la stabilizzazione della cella, ovvero scaricare la cella in uno stato di carica (SOC) noto, il quale dipende dall’obiettivo del processo di disassemblaggio. Un processo più sicuro prevede una scarica totale della batteria fino a 0V, prevenendo eventuali riscaldamenti, ma ciò può cambiare la chimica della cella. Se tutto il litio viene spostato al catodo, vi è il rischio che il rame del collettore reagisca e si dissolva nell’elettrolita, questo a causa dell’alto potenziale dell’anodo a 0V e l’ossidazione del rame. Per questa ragione, l’esatto potenziale di scarica a SOC= 0% varia con la resistenza interna e la chimica della cella, tra i 2.5V – 3V. Una volta raggiunto il valore, la cella torna lentamente al potenziale a circuito aperto; per non danneggiare la batteria può essere utile l’impiego di soluzioni acquose di sali [46].
Una volta scaricata la batteria viene aperta in sicurezza solitamente in camera a guanti in atmosfera inerte (Argon), a causa della possibile fuoriuscita di idrocarburi o composti gassosi tossici prodotti durante il funzionamento della pila, poi disassemblata manualmente, tagliando l’involucro con un disco ceramico (nel nostro caso l’attrezzo Combitool Ferm® dotato di disco da taglio Dremel® Heavy Duty n. 420) e ponendo attenzione a non danneggiare gli strati interni alla batteria più esterni.
Figura 2.3 – Struttura interna (a) ed esterna (b) di una batteria cilindrica [8]
Figura 2.4 - Apertura della batteria
Figura 2.5 - Rimozione di una testa (a) e dell’opposta (b),
insieme al collettore di corrente
Figura 2.6 - Taglio dell’involucro e rimozione
Figura 2.7 - Involucro e aspo
Analisi Risultato Materiale
Involucro XRF Fe60 – Ni42 Acciaio Invar 42
Aspo SEM Fe69, Cr19.63, Ni9.05,
Mn1,27, Si0,92
Acciaio Inox
Rimosso l’involucro, si procede alla separazione di anodo, catodo e membrana che si trovano arrotolati uno sopra l’altro e solitamente avvolti attorno ad un aspo. Questa operazione è molto delicata, siccome è possibile che la grafite depositata sul foglio di rame si stacchi o rimanga attaccata alla membrana se sottoposta a sollecitazioni, portando alla perdita di materiale attivo, è importante procedere con cautela e organizzare un sistema di raccolta delle cadute di lavorazione in modo da recuperare tutto il materiale anodico. Ciò non succede generalmente con il catodo, poiché il materiale attivo è legato in maniera più salda al suo collettore ed è meno fragile. I componenti separati vengono inseriti in contenitori distinti.
Figura 2.8 - Membrana su cui poggiano il catodo (a) e l’anodo (b)
Figura 2.9 - Anodo con collettore di rame (a) e rimanente sulla membrana (b)
Figura 2.10 - Catodo su collettore di alluminio
2.3 Estrazione del litio
Ottenuta la separazione di anodo, catodo e membrana, nella prima fase i tre componenti sono stati fustellati in maniera da lavorare su dischi di dimensioni uguali, utilizzando una fustellatrice EL-Cut di EL-CELL® da 18 mm e prestando molta attenzione a non sollecitare eccessivamente l’anodo per evitare la perdita di grafite.
a)
Figura 2.11 – Fustellatrice e campione fustellato di un catodo
Per avere un’analisi precisa dei campioni e determinare la quantità assoluta di litio presente in ciascuno di essi, si sono ricavati anodo, catodo e membrana da una batteria completamente scarica (portata a un potenziale di scarica sotto i 2V). I campioni raccolti sono stati fatti reagire in una soluzione di acido nitrico concentrato facendo uso di un digestore a microonde per massimizzare l'efficacia del processo di estrazione. La soluzione così ottenuta è stata analizzata tramite spettroscopia AES con Ion Coupled Plasma (ICP) come fonte di eccitazione
Si è proceduto con la preparazione di campioni fustellati (al fine di avere sempre la stessa quantità di materiale di partenza) da sottoporre a lisciviazione con diverse combinazioni di acidi organici come indicato in letteratura [41]. Gli acidi organici scelti hanno la funzione anche di agire da chelanti e complessanti principalmente per il Litio: ac. citrico, ac. ossalico, ac. malico, ac. ascorbico. La concentrazione di questi acidi è stata fissata a 0,5M e diverse miscele sono state preparate per trovare la combinazione che offre la massima estrazione del litio. La lisciviazione viene assistita da un bagno ad ultrasuoni per un tempo che varia tra i 5 e 15 minuti oppure non viene utilizzato.
Le soluzioni, una volta terminato il trattamento, sono lasciate a riposo per un massimo di 4 giorni e filtrate tramite pompa ad acqua al fine di rimuovere eventuali residui di collettori, grafite ed ossidi; ciò è stato fatto per ridurre al massimo possibili interferenze in fase di analisi ICP-AES per determinare la quantità di litio presente.
Figura 2.13 - Filtri contenenti resti di catodo e collettore
Stabilite le miscele più efficaci per ottenere il litio tramite le analisi, la seconda fase di estrazione del litio è stata eseguita non più su campioni fustellati ma su batterie intere, per verificare e ottenere risultati significativi a livello quantitativo.
2.3.1 Comportamento degli acidi liscivianti e parametri fisici
Solitamente quasi tutti gli acidi organici vengono prodotti da microorganisimi, in particolare tre dei quattro utilizzati (escluso l’acido ascorbico) possono essere prodotti dalla muffa nera (Aspergillus Niger) [48]. Come descritto nell’introduzione, nonostante siano più deboli degli acidi inorganici, gli organici sono termicamente stabili e a minore impatto ambientale. Di fatto, rivestono un ruolo importante nella dissoluzione di metalli tramite meccanismo di acidolisi (attacco degli ioni idrogeno e spostamento in soluzione) e complessolisi (composti organici stabilizzano gli ioni metallici con forme chelanti o complessanti). L'effetto degli acidi organici può essere compreso dai loro valori Ka (costanti di dissociazione acida) che sono indicatori del grado di ionizzazione, in particolare gli acidi organici possono essere monoprotici, diprotici e triprotici.
Gli acidi organici utilizzati, presi separatamente in altri esperimenti, presentano un’alta percentuale di lisciviazione del litio, in particolare è stato aggiunto l’acido ossalico perché presenta anch’esso alta estrazione, ma bassa per il cobalto che non deve dissolvere.
L’acido citrico è prodotto da processi di fermentazione e dissocia in 3 fasi, rendendolo uno degli agenti chelanti più efficaci, proprio perché la lisciviazione del litio è favorita dalla presenza di ioni H+ in soluzione.
C6H8O7 C6H7O7- + H+ (pKa1 = 3.09) C6H7O7- C6H6O72- + H+ (pKa2 = 4.75) C6H6O72- C6H5O73- + H+ (pKa3 = 6.40) n[C6H7O7-] + Mn+ M[C6H7O7]n
n[C6H6O72-] + 2Mn+ M2[C6H6O7]n Complessi metallici citrici n[C6H5O73-] + 3Mn+ M3[C6H5O7]n
L’acido ossalico è un acido comune che dissolve facilmente in acqua e viene usato in idrometallurgia per minerali come bauxite, argilla e caolino come agente lisciviante oppure come precipitante.
C2H2O4 C2HO4- + H+ (pKa1 = 1.25) C2HO4- C2O42- + H+ (pKa2 = 4.14)
n[C2HO4-] + Mn+ M[C2HO4]n complessi metallici n[C2O42-] + 2Mn+ M2[C2O4]n ossalici
L’acido malico si trova prevalentemente nella frutta (soprattutto le mele) e possiede due forme di isomeri, L (prodotto naturalmente) e D.
C4H6O5 C4H5O5- + H+ (pKa1 = 3.40) C4H5O5- C4H4O52- + H+ (pKa2 = 5.11)
L’acido ascorbico è conosciuto come vitamina C, funziona da antiossidante nel metabolismo umano e si ricava solitamente dal glucosio.
C6H8O6 C6H7O6- + H+ (pKa1 = 4.17) C6H7O6- C6H6O62- + H+ (pKa2 = 11.57)
Nelle miscele non si è utilizzato il perossido di idrogeno (H2O2) come agente riducente perché se aggiunto in piccole percentuali (1-2% v/v) aumenta l’efficienza di lisciviazione sia del litio sia del cobalto, rischiando di danneggiare irreversibilmente la struttura del catodo. Al suo posto è già presente l’acido ascorbico che funziona sia come agente lisciviante sia come debole riducente che può incrementare senza eccedere l’estrazione.
Durante gli esperimenti vengono testati l’utilità e l’impatto degli ultrasuoni, i quali sono conosciuti per aumentare il recupero di litio e cobalto durante la lisciviazione, grazie all’uso di bolle di cavitazione formatesi per cambiamenti di pressione, quando è più elevata le bolle esplodono, favoriscono energia al sistema e alla superficie del solido migliorando la diffusione del liquido.
L’acqua utilizzata dentro la macchina per ultrasuoni è stata 25°C.
Figura 2.14 - Possibile interazione tra su una batteria LCO (LiCoO2) e acido citrico in presenza
Figura 2.15 - Complessi metallici formati da (a) acido citrico, (b) acido ossalico,
(c) acido malico, (d) acido ascorbico [49]
(a
(b
(c
Con gli obiettivi di determinare quale agente lisciviante è più efficace e di capire l’impatto degli ultrasuoni nella lisciviazione, i campioni fustellati sono stati inseriti in 20 ml di soluzioni 0.5M contenenti ciascuna un acido differente, eseguendo prima un test senza ultrasuoni, un secondo test immersi in ultrasuoni per un tempo di 15 min.
Con il secondo set di campioni ottenuti da una seconda batteria è stata diminuita la durata degli ultrasuoni fino a un tempo di 5min e gli acidi a disposizione vengono mescolati secondo queste combinazioni :
20ml acido citrico 0.5M 20ml acido ossalico 0.5M
10ml acido citrico 0.5M + 10ml acido ossalico 0.5M 10ml acido citrico 0.5M + 10ml acido ascorbico 0.5M 10ml acido citrico 0.5M + 10ml acido malico 0.5M 10ml acido ossalico 0.5M + 10ml acido ascorbico 0.5M 10ml acido ossalico 0.5M + 10ml acido malico 0.5M
10ml acido citrico 0.5M + 10ml acido ossalico 0.5M + 10ml acido ascorbico 0.5M 10ml acido citrico 0.5M + 10ml acido ossalico 0.5M + 10ml acido malico 0.5M 10ml acido citrico 0.5M + 10ml acido ascorbico 0.5M + 10ml acido malico 0.5M 10ml acido ossalico 0.5M + 10ml acido ascorbico 0.5M + 10ml acido malico 0.5M
Infine, considerando i risultati è stata analizzata una terza batteria, in particolare nove campioni di anodo e membrana, tramite analisi ICP-AES ottico: tre sono stati trattati in acido nitrico previa digestione assistita da microonde (in modo da ottenere la quantità di litio in esso contenuto), tre con 40 ml di acido citrico e tre con 10 ml di ogni acido (citrico, ossalico, malico, ascorbico); non sono stati applicati gli ultrasuoni ma lasciati agire gli acidi liscivianti per 5 giorni.
Per ogni tipo di batteria utilizzata è stata eseguita un’analisi al microscopio elettronico per determinare il tipo di catodo, NCM o NCA e le loro composizioni.
Nella seconda fase invece si è lavorato sull’intera batteria, prendendo come componente principale il catodo, per eseguire un trattamento e formare polveri per reinnestare il litio e, se possibile, formare un catodo nuovo. Considerati i dati della prima fase sono state preselezionate due terne, oltre al solo acido citrico che è già conosciuto per le sue buone qualità di lisciviante. Anche qui viene fatta un’analisi con acido nitrico per quantificare il litio presente in una singola batteria, successivamente viene estratto con soluzioni sia ad alte temperature sia a temperatura ambiente. Si è deciso di non usare le terne che vanno a danneggiare il collettore.
2.4 Polveri e reinnesto del litio nel catodo
Per verificare che il metodo di estrazione utilizzato non vada a intaccare il catodo e che recuperi il litio residuo nell’anodo, è stata fatta un’estrazione con acido citrico, ossalico e malico 0.5M 90ml su una batteria 18650E. Lasciata agire la soluzione separatamente su metà anodo da una parte e su metà catodo dall’altra, i materiali attivi vengono separati dai collettori, operazione difficile in quanto i collettori dopo l’estrazione diventano abbastanza fragili e occorre fare attenzione, soprattutto con l’alluminio. Successivamente si procede ad un lavaggio con acqua deionizzata e dopo aver fatto evaporare il tutto, i frammenti vengono polverizzati separatamente in un mortaio d’agata. Per rimuovere il binder polimerico entrambe le polveri sono state trattate e filtrate con 10ml di NMP su carta da filtro. Lo stesso procedimento di polverizzazione e lavaggio viene fatto con le altre due metà di anodo e catodo non trattate con l’estrazione per confrontarle ai raggi X e capire come agiscono gli agenti liscivianti.
Un procedimento simile viene fatto su una seconda batteria della stessa tipologia, in cui il Li viene estratto da tutto il catodo con una soluzione di acido citrico 0.5M 90ml, mentre per l’anodo e la membrana è stata usata la terna di acido citrico, ossalico e malico 0.5M 90ml. Una volta ottenuta la soluzione e separati i frammenti di materiale attivo dal collettore di alluminio, il catodo e le due soluzioni vengono messe in un contenitore e fatti evaporare in un forno a 60°C in modo da eliminare l’acqua, in questo modo tutto il litio estratto si deposita sul catodo. Il procedimento seguente che si va ad applicare è una sintesi allo stato solido: il composto viene polverizzato in un mortaio d’agata e successivamente viene prima calcinato a medie temperature (intorno ai 400°-600°C), rimacinato e poi sinterizzato ad alte temperature (tra i 700° e 800°C) in un contenitore ceramico di allumina con copertura in zirconia, per ottenere micro e nano particelle quanto più omogenee in composizione e non assorbire ulteriore alluminio. La scelta dei tempi e della temperatura determina la struttura e la forma delle particelle, deve essere idonea a trasportare gli ioni di litio nella batteria e soprattutto recuperare il Li perso.
In letteratura sono stati trovati pochi esempi per la tipologia NCA: il primo ciclo è stato eseguito a 450°C di calcinazione per 6h e 800°C di sinterizzazione per 12h [50], il secondo ciclo è stato eseguito a 540°C di calcinazione per 12h e 720°C di sinterizzazione per 28h [51]. Per raggiungere le temperature stabilite i tempi di salita e discesa del forno sono stati fissati a 5°C/min.
Ogni tipo di polvere ottenuta è stata osservata al microscopio stereoscopico Leica WILD M8 e acquisita l’immagine con il software AxioVs40 tramite strumento ZEISS AxioCam MRc5.
2.5 Preparazione degli elettrodi alternativi
Prendendo suggerimento dal metodo usato per la realizzazione di anodi alternativi [45], è stato possibile sviluppare le fasi per produrre elettrodi alternativi su scala di laboratorio, applicando le metodologie ricavate dalla letteratura ai materiali ed ai macchinari a disposizione, producendo un catodo con solvente acquoso. La procedura sviluppata è la seguente:
prelevare 20g di materiale, nello specifico 17g di NCM, 2g di Super C65 (carbon black) e 1g CMC, in modo da avere un quantitativo di materiale sufficiente da essere mescolato
mescolare in un becher il materiale utilizzando il mixer IKA® NANOSTAR 7.5 a 100rpm e aggiungere 5ml di acqua ogni 5 min
formatasi tende a risalire le pareti del becher, per cui si rende necessario continuare a mescolare manualmente ed aggiungere acqua finché la consistenza del materiale è nuovamente idonea all’uso del mixer
mescolare aumentando a 360rpm e aggiungere acqua quanto basta per avere la giusta fluidità della mistura
Come collettore è stato usato un foglio di alluminio ECC-01-0034-A/X (di EL-CELL®), spesso 15𝜇m e dotato di uno strato di carbonio di pochi 𝜇m, migliorando l’aderenza fisica ed elettrica del materiale attivo che si va a depositare. Il foglio di alluminio si dispone su un piano riscaldante del macchinario (ELCOMETER® 4340). Lo spessore è stato fissato a 250𝜇m. Per far evaporare il solvente e asciugare l’elettrodo si è riscaldato il piano a 50°C per 30 min e successivamente a 110°C per altri 30 min.
Il processo di stesura si è ripetuto anche per elettrodi anodici con una miscela precedente di grafite, carbon black C65, CMC ed SBR, con collettore di rame e grafite [45] ad uno spessore rispettivamente di 250𝜇m e 150𝜇m.
Per arrivare ad uno spessore regolare di un comune elettrodo (circa 80𝜇m), viene impiegato un laminatoio a freddo MTITM (modello MSK-HRP-MR100DC), dotato di due rulli che ad ogni passaggio riducono lo spessore del foglio: secondo le istruzioni fornite, occorrono 10 passaggi nel laminatoio per ridurlo di circa 0.01mm.
Fig. 2.17 - Laminatoio per gli elettrodi
2.6 Assemblaggio e test su celle personalizzate
Le celle sono state assemblate dentro a una camera a guanti MBRAUN LABstar usando la cella di test PAT-Cell combinata con la base di collegamento PAT-Stand-1, seguendo il manuale disponibile sul sito web di EL-CELL.
Fig. 2.18 - Cella singola e tester PAT-Cell
La cella è composta di 8 parti (fig. 2.19):
1. Il tappo a vite (che comprende una molla a disco e una molla a compressione) 2. Un anello di tenuta (guarnizione)
3. Il pistone superiore
4. L’elettrodo superiore (l’anodo) come elettrodo di lavoro
5. Una guaina isolante (che contiene il separatore e il disco di litio di riferimento) 6. L’elettrodo inferiore (il catodo) come controelettrodo
7. Il pistone inferiore 8. La base della cella
Le celle sono state montate secondo il protocollo fornito da EL-CELL; come materiali sono stati impiegati, oltre agli elettrodi prodotti in laboratorio, un anodo di grafite standard della CUSTOMCELLS® per verificare il funzionamento del catodo autoprodotto e come separatori una fibra di vetro borosilicato ECC1-00-0210-O/X. Come elettrolita è stato usato LiPF6 1M con EC/DMC. Per le misure elettrochimiche di caratterizzazione delle celle, è stato impiegato il potenziostato BioLogic VSP con il software EcLab®.
2.6.1 Protocollo di testing
Per testare le nuove celle si parte sempre dalla formazione della SEI, la quale prevede 5 cicli di carica e scarica molto lenti in modo da formare una SEI compatta e di buona qualità. Questa procedura è suggerita da CUSTOMCELLS®:
Due cicli a C/10 Due cicli a C/5 Un ciclo a C
dove C/n indica che gli interi processi di carica e scarica impiegano n ore per essere completati. La cella viene caricata e scaricata ai potenziali di cut-off (3 V per la scarica e 4,2 V per la carica) e poi viene tenuta forzatamente a quel potenziale dallo strumento fino a quando la corrente è inferiore a 1/10 di quella che è usata per caricare/scaricare la cella. Questo viene fatto tipicamente solo durante la carica, per garantire che la quantità di litio immagazzinata nell'anodo non sia influenzata dalle perdite incontrate durante la carica (a causa della resistenza relativa all'elettrolita, gli elettrodi, ai processi di trasferimento della carica, la SEI e i processi di diffusione).
Dopo la formazione della SEI, se la batteria ha una buona capacità e stabilità, si procede al ciclo galvanico a potenziale limitato (GCPL). In particolare, è stato usato il GCPL4 con i seguenti parametri:
Is = 200𝜇A, rappresenta la corrente di carica e scarica, molto bassa poiché la capacità di questo tipo di celle non è elevata
Em1 = 4,2V ; Em2 = 3V, differenze di potenziale a cui interrompere i processi di carica e scarica
dt1 = 10s, intervallo di tempo per l’acquisizione dei dati
ts = 6h, un parametro che impone il limite di tempo all’esperimento, in maniera che sia controllato esclusivamente dalla differenza di potenziale agli elettrodi
|I|< Im con Im = 50𝜇A, in questo modo il sistema interrompe la misurazione quando la corrente che attraversa il sistema scende sotto il valore del 10% della corrente di carica
Range di differenza di potenziale E = 0-5V
Range di corrente I = 1mA, poiché le correnti imposte sono tra 100𝜇A e 1mA
Riposo per tR = 30min, per far misurare correttamente allo strumento la differenza di potenziale ai due elettrodi senza perturbare il sistema e osservarlo all’equilibrio
Capitolo 3
Risultati e discussioni
In questo capitolo viene valutata l’efficacia dei metodi utilizzati.
3.1 Calcolo teorico del litio
Il calcolo è basato sul fatto che la capacità di una batteria agli ioni di litio è data dalla quantità di litio attivo presente nella cella. A partire dal calcolo della quantità di corrente fornita da 1 mole di elettroni, si può determinare il contenuto di litio.
La carica di una mole di litio è data dalla costante di Faraday,
F = 96485,3365 C/mol (3.1) 1 mole di Li corrisponde a 1 mole di elettroni ed è in grado di fornire una corrente pari alla costante di Faraday, si riesce a calcolare qual è la capacità di 1g di Li:
n(Li) = 1g(Li)/MM(Li) (3.2) e
1mol(Li) : 96485,3365C = n(Li)[mol] : x(C) (3.3) Quindi si ha:
x(C)= n(Li)[mol] ∗ 96485,3365C (3.4) La capacità teorica di 1g di litio è
C = x(C)/3,6 = 3861mAh/g (3.5) Infatti:
1C = 1/96485 F = 1/3,6 mAh (3.6) Dal datasheet della batteria fornito da Panasonic si ricava che la capacità di una 18650E è 2250 mAh, si possono quindi calcolare i grammi di litio attivo presenti:
3.2 Calcolo distribuzione del litio in una batteria
Per misurare la quantità di litio, in tutte le analisi ICP-AES (standard interno 291,139) sono state valutate tre lunghezze d’onda di Li (460.289 – 610.365 – 670.783). Dalle analisi preliminari effettuate sui campioni fustellati di una batteria LGBMJ trattati con acido nitrico si ottiene:
Peso (g) Concentrazione di Li (ppm)
Anodo 0,0555 42
Catodo 0,0895 485
Membrana 0,0300 14,2
Tabella 3.1 – Concentrazione di litio in campioni fustellati
La quantità assoluta di litio presente nei componenti, considerando la loro massa, è pari a: Catodo : 485 mg/L * 0,01 L = 4,85 mg 4,85 mg/0,0895 g = 51,19 mg/g Anodo: 42 mg/L * 0,01 L = 0,42 mg 0,42 mg/0,0555 g = 7,57 mg/g Membrana: 14.2 mg/L * 0,01 L = 0,142 mg 0,142 mg/0,0300 g = 4,73 mg/g Dai calcoli effettuati si evidenzia come la maggior parte del litio si trovi all’interno del catodo quando la batteria è completamente scarica, in accordo con la teoria siccome il litio passa dall’anodo al catodo mentre il sistema si scarica. Di conseguenza in una batteria che non sia stata scaricata completamente (ovvero che non sia stata portata a un potenziale di carica inferiore a 3V) la quantità di litio all’anodo sarà maggiore, mentre la quantità presente nella membrana deriva dall’intrappolamento degli ioni durante le molteplici fasi di carica e scarica. In particolare, si può notare come, nella parte a contatto con il catodo, la membrana sia più scura in quanto vi è un coating ceramico di Al2O3.Questo serve ad aumentare la stabilità termica del separatore e mitigare la formazione di dendriti di litio nella cella, prevenendo la foratura della membrana e cortocircuiti interni [52]. La sua presenza è verificata in uno spettro XPS fatto sulla membrana nel paragrafo 3.6 (fig. 3.12), in particolare lo spettro verde.
Da queste considerazioni otteniamo che il litio è presente maggiormente nei due elettrodi, perciò le analisi successive saranno incentrate solo su catodo ed anodo in modo da trovare il solvente migliore per l’estrazione del litio.
3.3 Caratterizzazione batterie – immagini SEM
Sono state osservate al microscopio elettronico a scansione le varie batterie utilizzate nell’estrazione, sia per quanto riguarda la superficie sia per lo spessore degli elettrodi in cross section, successivamente si è svolta un’analisi elementare quantitativa EDSX con una microsonda per determinare la composizione atomica dei catodi e per ultimo si è osservata la membrana. Non è stato possibile misurare la quantità di litio presente nei campioni siccome le impostazioni predefinite dell’EDSX non permettono di rilevarlo, questo perché il Li genera raggi X a bassa energia e bassa densità che sono altamente assorbiti dalla finestra di berillio sul rivelatore.
La prima batteria utilizzata è stata una batteria LGBMJ:
Figura 3.1 – Analisi immagine della superficie della batteria LGBMJ
Dalle analisi il catodo è risultato essere di tipologia NCA ed il rapporto fra i tre elementi è: 25,9 + 5,1 + 1 = 32 100%
25,9: x(Ni) = 32:100 x(Ni) = 80,9% 5,1: x(Co) = 32:100 x(Co) = 15,9% 1: x(Al) = 32:100 x(Al) = 3,1%
Il rapporto tra i metalli risultante è Ni0.81Co0.16Al0.03, il quale è simile al classico catodo LiNi0.8Co0.15Al0.05O2 come da letteratura [16].
Figura 3.2 - Catodo a bassa performance (sinistra) ed esaurita (destra)
Le immagini superiori delle due superfici sono a ingrandimento 500X, mentre quelle inferiori sono 5000X. La prima batteria mostra basse performance, mentre la seconda è
completamente non funzionante. La taglia delle particelle va da un minimo di 7 𝜇m diametro fino a un massimo di 14 𝜇m, con una grandezza media di 11 𝜇m.
La seconda batteria analizzata è la 18655 YLL estratta dal pacco batterie:
![Tabella 1.1 – Composti catodici di intercalazione [20]](https://thumb-eu.123doks.com/thumbv2/123dokorg/2748305.730/11.892.92.806.470.701/tabella-composti-catodici-intercalazione.webp)
![Figura 1.6 – Struttura cristallina di (a) grafite e (b) spinello LTO [20]](https://thumb-eu.123doks.com/thumbv2/123dokorg/2748305.730/12.892.119.802.333.614/figura-struttura-cristallina-grafite-b-spinello-lto.webp)
![Figura 1.8 – Mappa mondiale che mostra le riserve di Li, Co, Ni, Mn e grafite [8]](https://thumb-eu.123doks.com/thumbv2/123dokorg/2748305.730/14.892.111.771.636.1008/figura-mappa-mondiale-mostra-riserve-co-ni-grafite.webp)
![Tabella 1.2 - Costi dei materiali per una batteria agli ioni di litio [25]](https://thumb-eu.123doks.com/thumbv2/123dokorg/2748305.730/15.892.98.797.117.312/tabella-costi-materiali-batteria-ioni-litio.webp)