INTRODUZIONE
La Leishmaniosi è una malattia protozoaria che rappresenta attualmente una tematica di notevole interesse, sia in riferimento alle problematiche di sanità animale che comporta, sia in relazione al carattere zoonosico dell’infezione.
La prima segnalazione di una lesione cutanea ascrivibile a Leishmania risale molto probabilmente già al 1885 quando Cunningham osservò su sezioni di tessuto dei corpi di 12,6 μm × 8,8 μm contenenti delle formazioni che l’Autore interpretò come spore di Mycetozoa. Fu però Leishman, un patologo londinese, a descrivere per primo agli inizi del 900 una forma parassitaria da Leishmania nell’uomo. Nel 1903 a Calcutta, durante la necroscopia di un giovane soldato morto per dissenteria, osservò una milza megalica e congesta la cui polpa conteneva una notevole quantità di formazioni ovoidali e rotondeggianti di 2-3 µm di diametro. Tre anni dopo, a Londra, esaminando un ratto morto che era stato precedentemente infettato da Tripanosomi africani, notò la somiglianza dei tripanosomi degenerati del ratto con i “ corpiccioli” osservati in precedenza. Nello stesso anno Donovan, esaminando strisci di biopsia splenica di un bambino indiano sofferente di febbri irregolari, osservò corpi che non ritenne essere né artefatti né tripanosomi degenerati.
Laveran e Mesnil, analizzando i vetrini inviati da Donovan, conclusero che i corpi osservati fossero parassiti degli eritrociti e ne proposero il nome di
Piroplasma donovani (Laveran e Mesnil). Ross, osservando gli stessi
vetrini, criticò le osservazioni dei due precedenti Autori affermando che i parassiti erano sovrapposti ai globuli rossi e ricordavano forme involute
dei tripanosomi. Ross descrisse quindi il parassita e ne propose l’appartenenza ad un nuovo genere di nome Leishmania, classe Sporozoa. Successivamente il parassita osservato fu definito Leishmania donovani (Ross, 1903) La prima segnalazione di Leishmaniosi canina risale al 1908 (Nicolle e Comte); il primo a sospettare i flebotomi come agenti vettori del parassita fu Pressat nel 1905; il primo caso di Leishmaniosi felina è stato descritto nel 1912 in Algeria.
EZIOLOGIA
L’agente causale della Leishmaniosi è rappresentato da un protozoo appartenente al genere Leishmania. Questo protozoo è ospite endocellulare obbligato del sistema reticolo istiocitario del cane e di altri mammiferi, tra cui gatti, volpi, cavalli, ratti e uomo, con un ciclo vitale che coinvolge due ospiti, uno vertebrato, che svolge il ruolo di serbatoio della malattia, e l’altro, vettore ciclico, rappresentato da femmine ematofaghe di ditteri appartenente al genere Phlebotomus o Lutzomyia, che ha il ruolo di vettore biologico attivo.
Nelle forme antroponotiche, non presenti in Italia, l’ ospite serbatoio è l’uomo, per cui l’insetto trasmette il parassita da un uomo all’altro; nelle forme zoonotiche, invece, il serbatoio naturale è un animale da cui il flebotomo assume il parassita per trasmetterlo poi ad altri animali o all’uomo.
L’unica specie di Leishmania presente in Italia è Leishmania infantum (conosciuta anche come L. chagasi in Sud America), responsabile sia della forma viscerale zoonotica (LVZ) che di quella cutanea (LC). In questo caso il serbatoio naturale più importane del parassita è il cane domestico: il flebotomo punge un cane infetto ed assume il parassita che trasmette in seguito ad altri cani, infettandoli. Va specificato comunque che i flebotomi, oltre al cane, effettuano il pasto di sangue pungendo, e quindi infettando, anche altri animali, uomo compreso. I serbatoi possono pertanto essere rappresentati anche da mammiferi selvatici o domestici, principalmente volpi e gatti, che, a differenza del cane, che solitamente sviluppa una malattia generalizzata e fatale (Dedet. 2002), sono caratterizzati da un maggiore resistenza alla leishmaniosi, presentando
forme di infezione di gravità moderata, o anche del tutto asintomatiche, che possono persistere per molti anni contribuendo alla diffusione della leishmaniosi stessa.
CLASSIFICAZIONE
Le varie specie di Leishmania non sono distinguibili morfologicamente e causano lesioni che evolvono in forma differente, per cui la tassonomia riveste una notevole importanza medica.
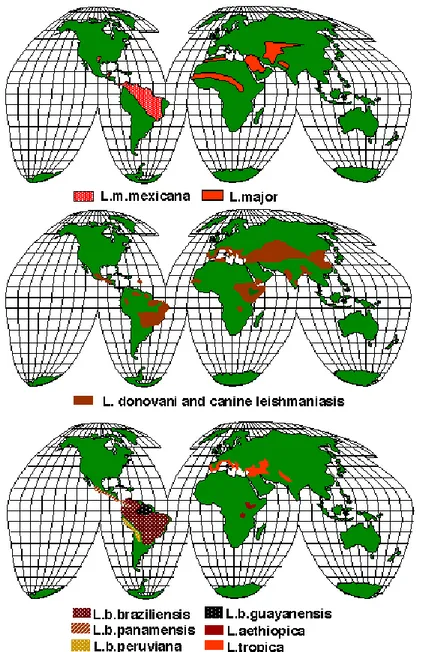
Le Leishmanie appartengono al regno dei Protisti, sottoregno Protozoa, phylum Sarcomastigophora, sub phylum Mastigophora, classe Zoomastigophora, ordine Kinetoplastida, sottordine Trypanosomatinae, famiglia Trypanosomatidae, genere Leishmania. Il genere Leishmania è a sua volta suddiviso in due sottogeneri, Leishmania parassiti del Vecchio Mondo e Viannia parassiti del Nuovo Mondo, nei quali troviamo classificate diverse specie.
Attualmente è da ritenersi valida la classificazione del genere Leishmania elaborata dall’OMS nel 1990. Sulla base della distribuzione geografica, delle peculiarità di organo tropismo, dell’azione patogena nei confronti delle specie animali ospiti e soprattutto mediante l’utilizzo di tecniche biomolecolari, le diverse specie di Leishmania sono state classificate in raggruppamenti (complex):
Genere: Leishmania Sottogenere: Leishmania
Sottogenere: Viannia Complex: Leishmania donovani
Complex: Leishmania braziliesis Specie: L. archibaldi Specie: L. brazilienis L. chagasi L. peruviana L.donovani L. infantum
Complex: Leishmania panamensis Complex: Leishmania tropica
Specie: L. guyanensis Specie: L. Killicki L. panamensis L. tropica
Complex: Leishmania major
Specie: L. major
Complex: Leishmania aethiopica
Specie: L. aethiopica
Complex: Leishmania mexicana
Specie: L. amazoniensis L.ganhani L. mexicana L. venezuelensis
L’analisi immunoenzimatica ed elettroforetica ha permesso di stabilire che nel bacino del Mediterraneo, ed anche in Italia, il ceppo responsabile della leishmaniosi umana e canina è rappresentato dalla L. infantum ed, in particolare, dalle varianti enzimatiche (zimodemi ¹) Montpellier 1 (MON 1) e Montpellier 72 (MON 72) (Gaskin et al., 2002; de Freitas et al., 2006). Quest’ultima variante è stata isolata soprattutto nell’area vesuviana.
¹ lo zimodema coprenda gli isolati del parassita che mostrano la stessa mobilità elettroforetica per un numero definito di enzimi esaminati (Gramiccia et al., 2004). La tecnica consiste in un elettroforesi su gel sul quale vengono esaminati i promastigoti ottenuti in coltura ed opportunamente trattati. Le bande elettroforetiche, rilevate mediante opportune colorazioni, vengono confrontate con quelle di ceppi standard di riferimento forniti dall’ OMS (Gramiccia et al., 1997)
MORFOLOGIA
Le Leishmanie sono microrganismi dixeni, che necessitano cioè, per l’espletamento del loro ciclo biologico, di un vettore ciclico, rappresentato da un insetto ematofago, e di un ospite vertebrato, e dimorfi in quanto, a seconda della fase del ciclo biologico (in cui si trovano), possono assumere due diversi stadi morfologici principali.
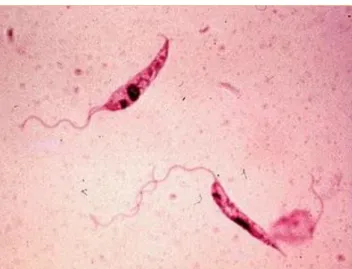
Nell’ospite vertebrato il protozoo è presente nelle cellule del sistema reticolo endoteliale sottoforma di amastigote (Fig.1-2). E’ caratterizzato dall’avere un corpicciolo rotondo, globoso o ovalare, privo di flagello, delle dimensioni di 2-5 μm di diametro, con un grosso nucleo sferico a localizzazione eccentrica e contrapposto al
kinetoplasto, una formazione bastoncellare del mitocondrio contenente
DNA extranucleare (kDNA). In prossimità del kinetoplasto vi è un corpo basale puntiforme, il blefaroplasto, da cui si diparte il rizoplasto, abbozzo del flagello che non emerge dalla cellula. Intorno ad esso troviamo un manicotto citoplasmatico ricoperto da plasmalemma che costituisce una tasca flagellare aperta verso l’esterno dove avvengono i fenomeni di scambio citoplasmatici (Euzeby., 1994). Kinetoplasto e blefaroplasto costituiscono l’apparato neutomotore del flagello.
Figura 1: amastigoti di Leishmania spp.in un macrofago (Verin R.)
Figura 2: amastigote di Leishmania spp.(dal sito
Nelle femmine del dittero vettore e nei terreni di coltura la leishmanie assumono la forma di promastigote e paramastigote.
Figura 3: promastigote di Leishmania spp.(R.L. Jacobson 1996)
Il promastigote (Fig.3-4) morfologicamente si presenta come un elemento dal corpo stretto e lungo fino a 20 µm, con
protoplasma granuloso, nucleo grande centrale, kinetoplasto bastoncellare (ubicato in posizione antinucleare sub terminale o terminale) e blefaroplasto prossimo a questo, puntiforme. E’ munito di un lungo e robusto flagello che si diparte dal blefaroplasto e presto si rende cranialmente libero, emergendo dalla tasca flagellare con una porzione pressochè lunga
quanto l’intero corpo. Il flagello serve sia per la propulsione che per l’adesione alle cellule dell’epitelio intestinale del flebotomo.
Il paramastigote, che è la forma virulenta che si rinviene nel faringe, nel piloro e nell’ileo dei flebotomi infestati, si differenzia dai promastigoti perché è munito di un kinetoplasto in genere ubicato non anteriormente ma allo stesso livello del nucleo, o poco posteriormente ad esso.
Figura 4: promastigote di Leishmania spp.(dal sito leishmania.org)
CICLO BIOLOGICO
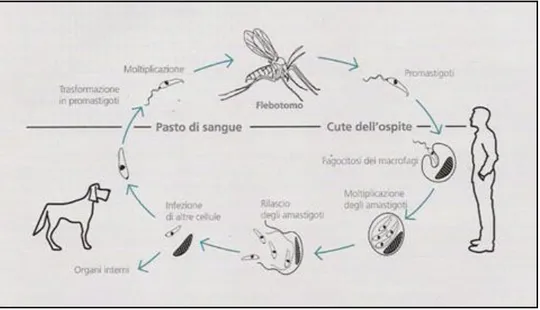
Figura 5: ciclo biologico (dal sito www.ospedale veterinario.com)
Nell’ospite vertebrato il parassita viene inoculato nel derma da femmine ematofaghe del flebotomo vettore, sottoforma di promastigote metaciclico. Nel mammifero i promastigoti vengono fagocitati dalle cellule del sistema reticolo endoteliale; ciò è favorito da due fattori:
1. Dall’ adesione del promastigote alla membrana del macrofago, mediata da molecole di superficie del protozoo quali lipofosfoglicani (LPG) e la glicoproteina gp63;
2. Dall’attivazione del complemento con il conseguente legame tra il promastigote e la frazione C3 del complemento stesso, innescante l’endocitosi (Euzeby, 1994).
Nel macrofago, dall’unione del fagosoma con il lisososma, si forma il fagolisosoma, all’interno del quale le leishmanie sopravvivono grazie a peculiari meccanismi difensivi, si trasformano in amastigoti e replicano, per scissione binaria, sino a determinare la rottura del vacuolo e quindi
della cellula. Tutto ciò richiama altri macrofaghi che fagocitano gli amastigoti neoformati e fanno si che diffondano a tutto l’organismo, compreso il sistema nervoso centrale (Ferrer., 2002).
Nel serbatoio è caratteristica la massiva localizzazione dei macrofagi parassitati nel derma e/o dei monociti infetti nel sangue periferico. Ciò permette la trasmissione del protozoo all’ospite invertebrato quando la femmina di flebotomo, compiendo il pasto di sangue, ingerisce le cellule parassitate dalle forme amastigote della leishmania.
Dopo che il flebotomo ha ingerito sangue infetto da un ospite vertebrato contente macrofagi parassitati, sono necessarie 24-36 ore affinché gli amastigoti siano liberati e si trasformino in promastigoti.
Contemporaneamente, durante la prima ora successiva al pasto, l’insetto inizia a formare una membrana peritrofica con il fine di digerire il sangue. La membrana peritrofica possiede caratteristiche chimiche proprie per ciascuna specie di flebotomo, ciò spiega la specificità tra il tipo di flebotomo e la specie di Leishmania trasmessa.
Le molecole di superficie della Leishmania (gp63, LPG) sopportano l’azione degli enzimi che l’insetto produce per digerire il pasto di sangue (Davies et
al., 1990). Il promastigote, invece, riesce a digerire l’emoglobina grazie
all’azione proteolitica della gp63 ed inoltre sintetizza enzimi chitinolitici per liberarsi dalla membrana peritrofica, abbandonare lo stomaco del vettore, e localizzarsi nel punto più vantaggioso per la sua successiva trasmissione. Liberatosi dalla membrana peritrofica, il promastigote inserisce il suo flagello tra le microvillosità dell’intestino medio, toracico e del cardias del flebotomo, e grazie alla concentrazione di zuccheri dell’LPG a livello della punta del flagello, si unisce alla lectina del tubo digerente. La specificità tra il flebotomo e la Leishmania viene determinata dalla
struttura dell’LPG (soprattutto dai residui di β-galattosio) e quindi dalla possibilità di aderire alle lectine. I promastigoti riescono in tal modo ad avanzare lungo il tubo digerente del flebotomo e, raggiunta la capacità infettante nell’arco di 10 giorni, si localizzano a livello di proventricolo e ipofaringe, invadendo l’apparato succhiatore e le ghiandole salivari del flebotomo, pronti ad essere inoculati al successivo pasto di sangue (Killick-Kendrick and Molyneaux, 1981).
PATOGENESI
Per la sopravvivenza del parassita nell’organismo ospite sono fondamentali Il passaggio alla forma amastigote e la sua capacità di sopravvivere e moltiplicarsi nel macrofago, che dipende dalla riposta immunitaria dell’ospite, e dalla capacità del parassita di regolarla. Al contrario, il successo della resistenza dell’ospite è in funzione dell’attività dei macrofagi stimolati dalle citochine prodotte da cellule Th1 (Corazza & Sgorbini, 2007[a]).
La risposta immunitaria elaborata dall’ospite può essere sia di tipo cellulo-mediato che umorale, ed è proprio la predominanza di una delle due che determina rispettivamente la resistenza o la sensibilità all’infezione.
Se l’animale sviluppa maggiormente l’immunità cellulo-mediata, caratterizzata dalla risposta Th1 prevalente, i macrofagi attivati sono in grado di eliminare il parassita; la risposta cellulo-mediata viene stimolata dall’azione dei Th1 promuovendo la produzione di interleuchina 2 (IL2), interferon gamma (IFN- γ ) e tumour necrosis factor (TNF).
Nel caso invece di predominanza della risposta umorale, risposta Th2, gli animali risultano sensibili all’infezione. I linfociti T helper 2, infatti, stimolano, attraverso la produzione di specifiche interleuchine (IL–4, IL-5, IL-6 e IL-10) ed il fattore di stimolazione BSF-1 (B cell stimulation factors), la proliferazione dei linfociti B e la produzione di anticorpi. Le sostanze prodotte dai Th2 richiamano, nel sito di partenza dell’infezione, macrofagi immaturi. I parassiti all’interno dei macrofagi provocano una continua sollecitazione delle cellule immunocompetenti che comporta uno squilibrio del sistema immunitario, con iperfunzione della risposta
umorale (Pizzirani, 1989). La risposta umorale in corso di leishmaniosi, quindi, non è protettiva, gli anticorpi specifici prodotti sono privi di azione neutralizzante e risultano dannosi nel corso della patologia.
Nella patogenesi di questa malattia è coinvolta non solo la risposta immunitaria dell’ospite ma anche la capacità del parassita di proteggersi dalle aggressioni del sistema immunitario del vertebrato; questa è possibile grazie a meccanismi di inibizione delle capacità litiche del macrofago e di modulazione della risposta immunitaria dell’ospite, inibendo la produzione di IL-2, IFN- γ e spostando la risposta immunitaria verso la forma umorale, quindi non protettiva, precedentemente descritta (Corazza e Sgorbini, 2007[b]).
Quindi, in assenza di un’efficace risposta immunitaria, il parassita può essere disseminato dal sito primario cutaneo d’infezione (in cui avviene la prima moltiplicazione di leishmania) attraverso la via ematica e linfatica, infettando i macrofagi di midollo osseo, linfonodi, fegato, milza, reni, tratto gastro-enterico, cute. (Reis et al., 2006; Strauss-Ayali et al., 2007). La presenza di leishmania in differenti tessuti ed organi determina reazioni che producono lesioni e segni caratteristici della malattia. Comunque le lesioni che caratterizzano la gravità della malattia sono provocate per la maggior parte dall’eccessiva risposta umorale che determina la produzione di elevate concentrazioni di γ-globuline e conseguente formazione di un elevato numero di immunocomplessi che si vanno a depositare a livello organico (Alvar et al., 2004)
IL VETTORE
Le Leishmanie sono trasmesse dalla puntura di ditteri ematofagi (pappatacei ²) dei generi Phlebotomus nel Vecchio Mondo e Lutzomya (“mosquito palha”) nelle Americhe. Almeno una trentina di specie sono possibili vettori. Da studi effettuati sul territorio italiano da Maroli et al. (1994), il flebotomo più diffuso
risulta essere il P. perniciosus (Fig.6), una specie antropofila e zoofila, che risulta presente in ambiente domestico (prevalenza 65,6%), ma che è reperibile anche in ambienti silvestri distanti dalle abitazioni (prevalenza 21,8%). Tale diffusione rende questo insetto una delle specie
di flebotomi più interessanti dal punto di vista epidemiologico in quanto in grado di diffondere la Leishmaniaosi da un focolaio all’altro.
In Italia questa specie è vettore provato ³ sia delle forme viscerali che cutanee di leishmaniosi.
I flebotomi sono insetti di piccole dimensioni, lunghi dai 2 ai 4 mm; sono generalmente di color sabbia, hanno il corpo dall’aspetto gibboso, ricoperto da una fitta peluria.
² dapappare in silenzio perché, a differenza delle zanzare, hanno un volo silenzioso
³ una specie di flebotomo viene dichiarata vettore provato di una malattia solo quando è stato verificato che: la sua distribuzione coincide con quella della malattia trasmessa, è stata dimostrata la sua antropofilia e zoofilia, è stato trovato infetto, in natura, con lo stesso parassita che causa la malattia nell’uomo e nell’animale, è stato provato sperimentalmente che è in grado di trasmettere il parassita.
Figura 6 Phlebotomus perniciosus (Dr.Maroli)
Sono attivi dal crepuscolo e di notte durante la stagione estiva, quando cala la temperatura e aumenta l’umidità (killick-Kendrick, 1999).
Il Phlebotomus perniciosus, storicamente presente con elevata densità nelle regioni della costa tirrenica e ionica, è stato negli ultimi anni rinvenuto anche in focolai dell’Emilia Romagna, Veneto, Valle d’Aosta, Piemonte e Lombardia. (Capelli et al. 2004). E’ reperibile sia nelle aree urbane, perturbane e rurali, che in ambienti domestici, peridomestici e selvatici; si nutre infatti su qualsiasi mammifero disponibile (Pozio et al., 1985; Buongiorno et al., 2002) ed è molto resistente alle condizioni ambientali non favorevoli. Inoltre preferisce l’habitat costiero rispetto alle zone interne, come dimostrato da Maroli et al. (1980) in provincia di Grosseto, con un’elevata percentuale di flebotomi catturati sul Monte Agentario rispetto alla zona interna di Baccinello.
Il periodo di attività dei flebotomi va, in genere, da Giugno ad Ottobre. Il comportamento stagionale può comunque essere influenzato dalle condizioni climatiche, in particolare dal livello di precipitazioni atmosferiche. Nel 2003, in una zona collinare della provincia di Roma, è stato notato, ad esempio un prolungamento della stagione di attività rispetto all’anno precedente; fatto relazionabile alla moderata piovosità registrata in questa zona rispetto a quanto verificatesi nel 2002 (Rossi e
coll., 2008).
Un’analoga situazione è stata segnalata anche in Campania dove si è registrato un periodo di attività dei flebotomi di 2,5 mesi nel 2002, anno caratterizzato da abbondanti precipitazioni atmosferiche, e di 5 mesi nel 2003 e 2004 in cui la piovosità registrata è stata quella tipica dell’area bioclimatica in questione (Oliva et al., 2006)
EPIDEMIOLOGIA
Nel 1990 l’ OMS riportò i casi di leishmaniosi umana nel mondo nel numero di 12 milioni circa, con un incremento intorno a 400.00 – 120.000 di nuovi casi ogni anno, in particolare nei paesi di fascia equatoriale e subequatoriale (Fig.7).
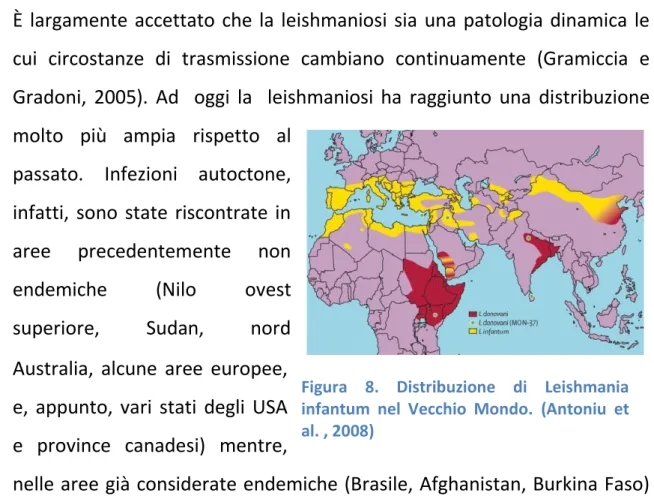
È largamente accettato che la leishmaniosi sia una patologia dinamica le cui circostanze di trasmissione cambiano continuamente (Gramiccia e Gradoni, 2005). Ad oggi la leishmaniosi ha raggiunto una distribuzione molto più ampia rispetto al
passato. Infezioni autoctone, infatti, sono state riscontrate in aree precedentemente non
endemiche (Nilo ovest
superiore, Sudan, nord Australia, alcune aree europee, e, appunto, vari stati degli USA e province canadesi) mentre,
nelle aree già considerate endemiche (Brasile, Afghanistan, Burkina Faso) si è riscontrato un aumento del numero di casi (Desjeux, 2004)(Fig.8). Fattori di rischio per la diffusione di questa patologia parassitaria sono quelli correlati allo sviluppo, come le migrazioni, l’urbanizzazione, la deforestazione, nuova distribuzione dell’irrigazione, ma elevata importanza hanno anche fattori “individuali” come infezioni da HIV, malnutrizione e predisposizioni genetiche, che facilitano l’evoluzione dallo stato di infezione a quello di malattia (Desjeux, 2001; Desjeux, 2004). La diffusione della malattia risulta quindi influenzata da molti fattori quali:
Ambiente per densità dei flebotomi nelle aree endemiche, altitudine e caratteristiche geologiche del terreno.
Clima per temperatura e tasso di umidità.
Condizioni socio-sanitarie come malnutrizione, incidenza nella popolazione umana di soggetti affetti da immunodeficienza
Figura 8. Distribuzione di Leishmania infantum nel Vecchio Mondo. (Antoniu et al. , 2008)
Spostamenti di persone come nel caso dei flussi turistici che, nelle aree endemiche, portano a contatto con il parassita soggetti il cui sistema immunitario non ha mai conosciuto tale patogeno, e quindi assolutamente sprovvisti di una qualsivoglia difesa immunitaria.
Mancanza di presidi immunizzanti, ossia vaccini, efficaci . In Italia i casi ufficiali di leishmaniosi umana, nei 5 anni che vanno dal 1994 al 1999, sono stati circa 700, valore probabilmente sottostimato, di cui ben 150 diagnosticati in pazienti HIV positivi. La maggior parte dei soggetti colpiti proviene da regioni endemiche centro meridionali, nelle quali il cane rappresenta il principale serbatoio di infezione.
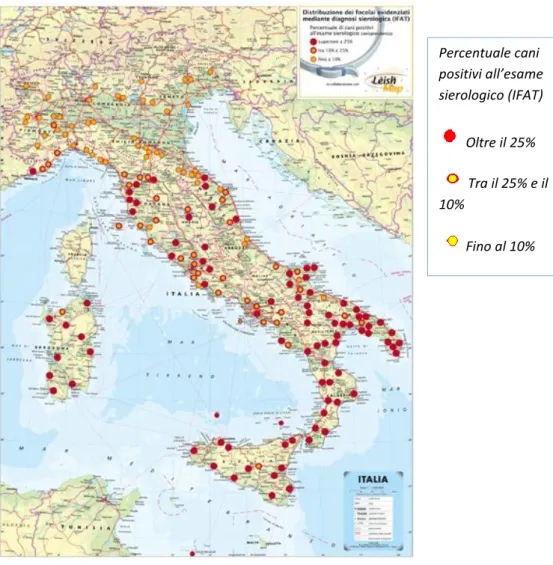
Nel nostro Paese la leishmaniosi è diffusa in tutta la costa tirrenica, ionica ed adriatica fin sopra al Gargano; focolai importanti si riscontrano in tutte le isole maggiori e minori (Pozio et al., 1985). In pratica, oltre due terzi del territorio costiero, dal livello del mare a 4-600 metri di altitudine, rappresentano un sito potenziale di trasmissione. Tuttavia, grazie alla peculiare biologia dei vettori, la malattia non appare diffusa uniformemente sul territorio, ma distribuita a micro-focolai (a macchia di leopardo)(Fig.9)
Figura 9: Leishmaniosi in Italia aggiornata al 2008 .Da Leishmap
Recentemente si è assistito alla comparsa della leishmaniosi anche in aree in cui la malattia non era presente.
Studi epidemiologici hanno dimostrato come la malattia, in funzione anche delle caratteristiche ambientali e climatiche, che a loro volta condizionano la sopravvivenza e riproduzione degli insetti vettori, sia in continua espansione dalle aree cosiddette endemiche a quelle che fino a pochi anni fa potevano essere ancora considerate “Leishmania-free”.Fino a pochi anni fa, infatti, risultavano indenni tutte le regioni del Nord con segnalazione di casi solamente in cani che avevano soggiornato precedentemente in zone infette; purtroppo questo non è più vero dal
Percentuale cani positivi all’esame sierologico (IFAT) Oltre il 25% Tra il 25% e il 10% Fino al 10%
momento che focolai autoctoni sono stati di recente descritti anche in Emilia-Romagna e Piemonte, altri probabili in Trentino e Lombardia. (Favati et al., 2000 , Natale, 2004; Ferroglio et al., 2005; Maroli et al.,2008) e nel Veneto (Piccoli et al., 1999).
In Toscana la leishmaniosi è stata accuratamente studiata solo negli ultimi trent'anni..Le provincie in cui si registra la maggiore sieroprevalenza sono
quella di Grosseto, in particolar modo Monte Argentario e Castiglione della Pescaia; la provincia di Livorno, soprattutto l’Isola del’Elba, e quella di Firenze La provincia di Pisa sembrava essere indenne fino al 1990, ma
già nel 1996 studi epidemiologici avevano evidenziato una sieroprevalenza del 38.8% (Mancianti et al., 1996).
Abbastanza recentemente è stata rilevata la presenza di anticorpi anti leishmania in gatti viventi in aree endemiche per la leishmaniosi canina. Indagini sierologiche condotte in focolai delle regioni Toscana e Liguria, hanno evidenziato una prevalenza dello 0,9%, con titoli anticorpali bassi (Mancianti, 2004). Analoghe indagini sieroepidemiologiche condotte in Sicilia hanno evidenziato sieroprevalenze comprese tra lo 0% e il 68% (Pennisi et al., 1998; Pennisi et al., 2000). Inoltre, nel corso di uno studio eseguito in Abruzzo, è stata rilevata una prevalenza del 12,5% (Boari et al., 2005).
Studi epidemiologici nella popolazione felina, basati sulla ricerca di anticorpi anti leishmania e sulla ricerca di DNA del parassita tramite PCR in campioni si sangue, sono stati condotti anche in Spagna, Portogallo, Israele e Grecia .
In Spagna Ayllon et al.hanno effettuato uno studio su un totale di 233 gatti portati all’ospedale veterinario universitario di Madrid da settembre del
2005 a giugno 2006. I campioni di sangue con edta raccolti dai gatti sono stati testati per Leishmania infantum utilizzando l’immunofluorescenza indiretta (IFAT), per la ricerca di anticorpi anti-leishmania con un cut off di 1:100 e la PCR, per evidenziare la presenza di Dna del parassita. I risultati hanno evidenziato una sieroprevalenza del 1,29% (3/233) considerando il valore di cut off, mentre ad una diluizione inferiore a 1:50 sono stati trovati altri 7 soggetti reattivi, portando così la sieroprevalenza individuata al 4,29%. Solamente 1 soggetto è risultato positivo per il DNA di leishmania alla PCR.
Sempre in Spagna, dal Febbraio 2003 al dicembre 2004, Martin-Sanchez et al. in varie cliniche veterinarie del Sud della Spagna, hanno testato un totale di 183 gatti col fine di valutare la situazione epidemiologica della leishmaniosi felina ed un’eventuale correlazione tra questa e le patologie virali causa di immunosoppressione tipiche del gatto. Dallo studio è emerso che Il 60% dei gatti testati presentava un titolo anticorpale ≥ 1:10, mentre solo il 6,1% un titolo ≥ 160. Il 25% inoltre è risultato positivo alla PCR per il DNA di Leishmania. Tra questi la più alta percentuale di positività (31,6%) è stata osservata nei soggetti con un titolo anticorpale =20, in contrapposizione alla bassa percentuale di positività alla PCR in soggetti con un titolo ≥ 1:160 (Martìn-Sánchez et al., 2007)
Analoghi studi sono stati effettuati in Portogallo da Maia e altri, dove nel 34% dei gatti oggetto di studio, tutti asintomatici, è stata riscontrata la presenza di DNA di Leishmania infantum, con una sieropositività del 17,4% (Maia et al., 2008).
In Israele, in aree in cui è endemica nel cane e nell’uomo, è stato effettuato uno studio sieroepidemiologico da Nasereddin e collaboratori per determinare la diffusione della leishmaniosi, nella popolazione felina,
per valutare se il gatto possa essere considerato soltanto un ospite occasionale, oppure se rivesta un ruolo significativo dal punto di vista epidemiologico.
Il gruppo oggetto di studio era costituito da 104 gatti, 41 maschi e 65 femmine di un’età compresa tra gli uno e i tre anni, tutti proveniente dall’area di Gerusalemme. La maggior parte dei soggetti esaminati (94%) erano asintomatici ad eccezione di una piccola percentuale in cui erano state evidenziate ulcere cutanee (2% circa) e alterazioni oculari(3%).
La sieroprevalenza ottenuta sottoponendo i sieri a test ELISA è stata del 6,7%, avendo trovati positivi i sieri di 7 dei 104 gatti esaminati (Nasereddin
et al., 2008).
Anche in Grecia Diakou, Papadopulos e Lazarides. nel 2008 hanno condotto studi per valutare la sieroprevalenza di leishmania spp.nei gatti come primo approccio per misurare l’infezione in questa specie animale. A tale scopo sono stati prelevati campioni di siero da 284 gatti di età adulta provenienti dalla regione di Salonicco nel nord della Grecia. I campioni di siero sono stati esaminati tramite ELISA per la presenza di Ig G anti –Leishmania spp.Il 3,87% dei gatti esaminati sono risultati positivi Questi dati indicano che anche il gatto, anche se caratterizzato da una maggiore resistenza all’infezione rispetto al cane, entra nel ciclo di
Leishmania, soprattutto nelle zone in cui tale parassitosi è a carattere
SERBATOIO E SPECIE RECETTIVE
In Italia L. infantum è stata isolata da cani, volpi, uomini, ratti, gatti (Gramiccia et al., 1985; Poli et al., 2002)e, solo in Sicilia, furetto (Brianti et
al., 2004).
Il cane è il principale serbatoio di leishmaniosi, in esso il parassita alberga sia a livello viscerale che cutaneo e la malattia ha un decorso cronico. I soggetti che si trovano in stadio avanzato dell’infezione risultano particolarmente infettanti per il vettore, ma anche i soggetti infetti, clinicamente sani (oltre il 50% dei cani leishmaniotici) albergano il parassita negli istiociti cutanei, fungendo così da serbatoio.
La volpe, come suggerito da un’indagine sieroepidemiologica condotta nella provincia di Imperia, in cui su 50 volpi esaminate il 18% era risultato positivo alla leishmania, può svolgere un ruolo importante nella diffusione dell’infezione, introducendola in zone in cui era assente in precedenza (Mancianti et al., 1994), con un’importanza maggiore nelle zone rurali dove, in relazione alle abitudini peridomestiche della stessa, può verificarsi uno stretto contatto tra cani, volpi e flebotomi; al contrario, in ambiente selvatico, non sembra in grado né di diffondere l’infezione, né di mantenere un ciclo di trasmissione (Courtenay et al., 2001).
Il ratto è stato ritrovato infetto in diversi paesi, Italia, ex Jugoslavia, Spagna (Gramiccia, 1997) ma dal punto di vista epidemiologico non sembra rivestire un ruolo attivo nella diffusione della malattia in quanto è un ospite poco attraente per il vettore, trasmette solo quando presenta
sintomatologia, cioè in occasione di una caduta delle difese immunitarie, ed ha vita breve. (killick-Kendrick, 2002).
Per quanto riguarda il gatto, diversi Autori hanno evidenziato sieropositività mettendo in evidenza sia soggetti sintomatici che asintomatici (Pennisi et al., 2003; Brianti et al., 2004; Mancianti, 2004) Attualmente è indubbio il ruolo epidemiologico del gatto.
Se consideriamo la definizione di serbatoio come l’ animale che garantisce la sopravvivenza dell’agente eziologico e la sua successiva trasmissione, unitamente a quanto affermato da Bray (1982), secondo il quale, un buon serbatoio dovrebbe essere:
in stretto contatto con l’uomo e con i flebotomi;
sensibile all’agente patogeno;
disponibile per il vettore in quantità sufficiente ed in uno stato suscettibile per causare l’infezione;
rappresentare la fonte principale per il pasto del flebotomo e condividere con questo lo stesso habitat;
caratterizzato dal presentare un’evoluzione cronica della malattia per permettere all’animale di sopravvivere fino alla successiva stagione di trasmissione
si può affermare che il gatto abbia un ruolo epidemiologico di serbatoio soprattutto nelle aree in cui la leishmaniosi è endemica essendo anche stata documentata la possibilità di infezione dei flebotomi che si alimentano su di esso. (xenodiagnosi)(Maroli et al., 2007).
E’ stato postulato inoltre che gravi virosi feline (da FIV, FeLV, FIPV), che possono essere concomitanti all’infezione da Leishmania, rappresentino fattori di stress che potrebbero favorire il manifestarsi della malattia. La
sporadicità dei casi clinici felini, anche in aree endemiche per Leishmania in cui si registra un’elevata sieroprevalenza di anticorpi anti- Fiv, suggerirebbe una resistenza su base genetica del gatto nei confronti del parassita (Mancianti, 2004). D’altro canto la scarsa specificità dei sintomi con cui la leishmaniosi si manifesta nel gatto, in cui determina dei quadri clinici sovrapponibili ad altre patologie, potrebbe essere la causa di una sottostima dei casi realmente presenti.
Forme di Leishmaniosi circoscritta, per lo più cutanea, sono state occasionalmente riscontrate anche in diversi animali non carnivori, con particolare riguardo per il cavallo. In questa specie sono state riportate infezioni più gravi sostenute da L. braziliensis, con forme cutanee ulcerate, o nodulari ed in un caso lesioni oculari (Mazza, 1927) particolarmente in Argentina, Venezuela e Brasile. Le infezioni, trattate o no, possono regredire o quanto meno non generalizzare (Ramos Vara et al., 1996). Più recentemente in Europa sono state segnalati quattro casi di infezione equina (malattia): in tutti i casi l’agente biologico è risultato L. infantum
(Koehler et al., 2002; Solano Gallego et al., 2003; Rolão N., 2005). I noduli
erano localizzati a testa, muso, ascelle ed inguine, probabilmente a livello del sito di inoculazione da parte del vettore, e presentavano un aspetto nodulare/granulomatoso. In tutti gli animali i segni cutanei sono scomparsi nel giro di pochi mesi, senza alcuna terapia specifica. Il cavallo presenta una notevole resistenza con scarsa risposta umorale ed efficace risposta cellulomediata, quindi può essere considerato più un ospite accidentale che non un serbatoio di infezione.
LEISHMANIOSI FELINA
La leishmaniosi felina è una manifestazione clinica relativamente rara. La prima segnalazione risale al 1912, quando Sergent et al.(1912) trovarono il primo gatto infetto; da allora più di quaranta casi sono riportati nella letteratura scientifica mondiale, ma soltanto recentemente si è sviluppato un maggior interesse nei confronti di questa patologia nel gatto.
Soprattutto nelle prime segnalazioni la specie di leishmania in causa non era stata identificata ed erano spesso state assegnate eziologie arbitrarie sulla base di quello che si riteneva essere l’agente eziologico presente in una certa area geografica (Mancianti, 2004). E’ a partire dagli anni ottanta che sono stati descritti i primi casi in cui spesso è stata eseguita la tipizzazione dell’agente eziologico. Craig et al.(1986) e Barnes e coll. (1993) nel Texas, descrissero rispettivamente un gatto con lesioni a livello del padiglione auricolare ed un caso di leishmaniosi cutanea diffusa recidivante, in un gatto con localizzazioni al muso. In entrambi i casi l’agente eziologico risultò essere L. mexicana. In seguito Passos et al. (1996) identificarono Leishmania (Viannia) braziliensis responsabile di una forma cutanea in un gatto in Brasile. In Europa la prima segnalazione di leishmaniosi felina con tipizzazione dell’agente eziologico è di Ozon et al. (1998) che osservarono un animale affetto da forma disseminata, sostenuta da L. infantum MON-1.
Casi di leishmaniosi felina sono stati descritti da vari autori in ogni parte del mondo (Fig.10)
CASI DI LEISHMANIOSI FELINA RIPORTATI IN LETTERATURA: 1912 Sergent, in Algeria
1927 Mazza (dato citato da Brumpt nel1936) 1933 Ondovilla in Spagna
1940 Mello , nello stato di Para ( Brasile) 1991 Bonfante-garrido et al., in Venezuela 1994 Costa-Durão et al., in Portogallo 1996 Laurelle-Magalon e Toga, in Francia 1986 Craig et al., in Texas
1996 Passos et al., nella regione di Belo Horizonte (Brasile) 1993 Barnes et al., in Texas
1998 Ozon et al., nel Sud della Francia 1999 Hervás in Spagna
2002 Poli et al., in Italia*
2003 Schubach et al., a Rio de Janeiro (Brasile) 2004 Mancianti et al., in Italia
2004 de Souza et al.,Mato Grosso do Sul State (Brasile) 2004 Savani et al., nello stato di Sãn Paulo (Brasile) 2005 Leiva et al.,Barcellona (Spagna)**
2005 Rüfenacht et al., in Svizzera
2006 da Silva et al., Rio de Janeiro (Brasile)* 2009 Marcos et al. Portogallo *
* Leishmaniosi viscerale
**leishmaniosi viscerale ed oculare
SINTOMATOLOGIA
Nel gatto si riscontrano con maggiore frequenza forme di leishmaniosi cutanea, anche se forme di leishmaniosi viscerale non sono infrequenti. I sintomi non sono specifici e sono facilmente confondibili con altre patologie, comunemente ritrovate nel gatto, quali cryptococcosi e sporotricosi. Ciò, unitamente al fatto che la leishmaniosi è sempre stata considerata una patologia tipica del cane, è stato ed è sicuramente causa di una sottostima dell’ effettivo numero di casi di leishmaniosi felina.
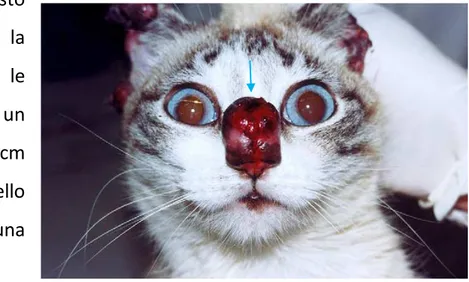
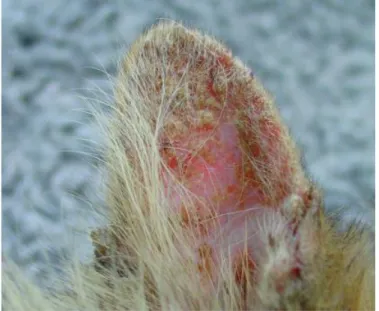
Nei soggetti sintomatici sono state evidenziate lesione a carico dell’apparato tegumentario, localizzate principalmente a naso, labbra, occhi, orecchie ed estremità distali degli altri, soprattutto nella regione digitale.
Sono riportate lesioni nodulari, tendenti ad ulcerarsi, localizzate a livello del naso. In questo
caso (Fig.11) la lesione aveva le dimensioni di un nodulo di circa 2 cm di diametro a livello del naso con una notevole
ulcerazione.(de Souza
et al., 2005)
Figura 11: lesione nodulare singola di 2 cm di diametro sul naso.(de Souza et al., 2005)
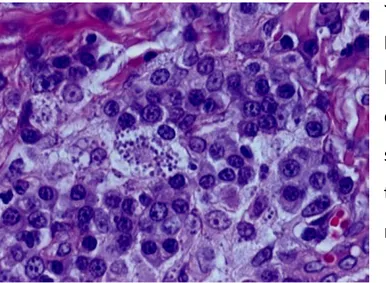
Lo striscio effettuato con il materiale prelevato dalla lesione aveva messo in evidenza la presenza di numerosi amastigoti sia intracellulari, all’interno delle cellule macrofagiche, che. extracellulari (Fig.12)
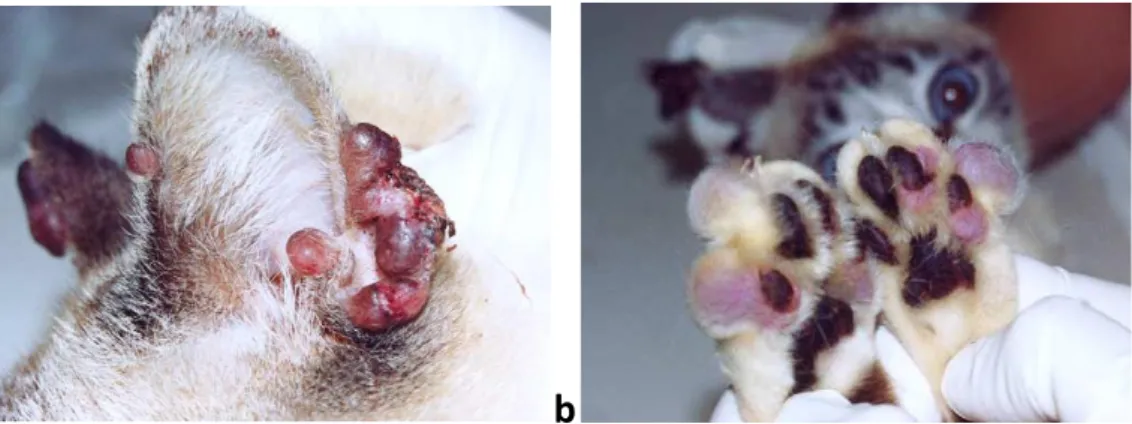
Lo stesso soggetto presentava inoltre lesioni, rappresentate da formazioni nodulari di diverse dimensioni, localizzate a livello del padiglione auricolare (Fig.13a) e della regione digitale di entrambi gli arti posteriori (Fig13b).
a b
Figura 13 : gatto con leishmaniosi cutanea: numerosi nuduli di diverse dimensioni ai padiglioni auricolari(a) e alle regioni digitali degli arti posteriori(b)-
Nonostante le lesioni fossero abbastanza diffuse e di una certa gravità, le condizioni generali del soggetto non erano però compromesse. Il gatto presentava infatti un buono stato di nutrizione e non era stato rilevato alcun segno di patologia sistemica. I valori biochimici ematici, urea, creatinina, glucosio, alanina-amino-transferasi (ALT) e fosfatasi alcalina(AP), erano nella norma. Anche gli esami ematologici di routine non avevano evidenziato nulla, se non una lieve leucocitosi neutrofila.
Figura 12: amastigoti nello striscio(1000x)(de Souza et al.,2005)
In gatti affetti da forma cutanea di leishmaniosi, sono state evidenziate anche altre lesioni, localizzate sempre a livello della regione nasale.
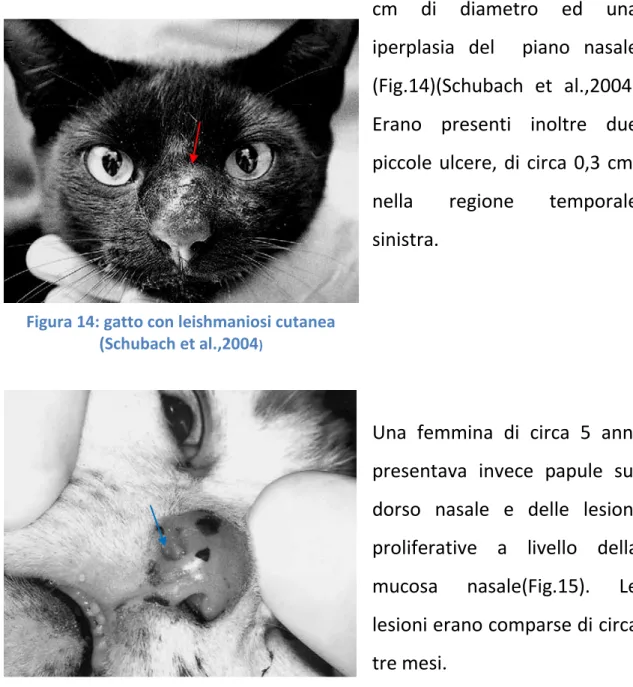
In un soggetto di 4 anni di età è stata evidenziata un’ulcera cutanea di 0,5 cm di diametro ed una iperplasia del piano nasale (Fig.14)(Schubach et al.,2004) Erano presenti inoltre due piccole ulcere, di circa 0,3 cm, nella regione temporale sinistra.
Una femmina di circa 5 anni presentava invece papule sul dorso nasale e delle lesioni proliferative a livello della mucosa nasale(Fig.15). Le lesioni erano comparse di circa tre mesi.
Anche in questi casi gli esami biochimici ed ematologici erano nella norma, eccetto che per una il riscontro di eosinofilia (2870 cell/mm³) e neutrofilia (13530 cell/mm³) in uno dei due soggetti (Schubach et al., 2004)
Figura 14: gatto con leishmaniosi cutanea (Schubach et al.,2004)
Figura 15: lesione proliferativa nella mucosa nasale (Schubach et al., 2004)
In una femmina di gatto europeo di circa 9 anni, FIV/FeLV negativa, sono state evidenziate delle lesioni cutanee localizzate sempre al naso (Fig.16) ed al padiglione auricolare (Fig.17)
A livello del naso il gatto presentava papule, croste, depigmentazione ed eritema.
Figura 16: lesione papulo-crostosa sul naso di un gatto affetto da leishmaniosi(Rufenacht,2005)
Sulla faccia interna del padiglione auricolare, che si presentava eritematoso, erano presenti invece delle lesioni che consistevano in
pustole e croste diffuse. Sul collo presentava inoltre delle aree alopeciche piuttosto estese. Non erano stati messi in evidenza altri rilievi anormali (Rufenacht
et al., 2005)
Figura 17: pustole e croste nella parte interna della pinna auricolre(Rufenacht,2005)
Queste lesioni cutanee ricorrevano ormai da tre anni e le terapie impostate dai vari veterinari che lo avevano visitato erano stati inefficaci. Il gatto era stato trattato con griseofulvina, itraconazolo, ketaconazolo, selomectina, lufenuron, cefalexina e prednisolone. Solamente la
somministrazione orale di prednisolone aveva determinato un leggero miglioramento, ma le lesioni si erano ripresentate pochi giorni dopo la sospensione del cortisonico.
A parte i segni cutanei, all’esame clinico non era stata rilevata nessun altra anormalità. Le analisi ematologiche avevano evidenziato una moderata iperglobulinemia (52 g/l) con la frazione della gamma-globuline nella norma (17,7 g/l), come nel 43 % circa dei gatti affetti da leishmaniosi (Pennisi, 2002), leucopenia (5,8 x 109/l) e linfopenia (0,8 x 109/l).
L’esame citologico del materiale prelevato da una pustola sul collo dell’animale, aveva messo in evidenza numerosi neutrofili, cheratinociti nucleati in assenza di batteri. Il quadro citologico era indicativo di penfigo foliaceo.
L’analisi istopatologia delle biopsie effettuate dalle varie lesione cutanee presenti sul collo dell’animale, aveva evidenziato la presenza di pustole intraepidermiche con numerosi neutrofili ed un infiltrato linfocitario perivascolare.
L’ELISA effettuata campione di sangue per la ricerca di anticorpi-antileishmania era risultata positiva.
La PCR effettuata su campione di tessuto prelevato da una lesione cutanea era risultata positiva per DNA di Leishmania.
I risultati degli esami istologici e parassitologici hanno portato alla diagnosi di Leishmaniosi associata a pemfigo fogliaceo, per cui la terapia impostata prevedeva la somministrazione di 10mg/kg di allopurinolo per os due volte al giorno, associate alla somministrazione di prednisolone alla dose di 1 mg/kg ogni tre giorni.
Dopo 10 settimane di terapia il gatto presentava una totale risoluzione delle lesione cutanee. Fu pertanto decisa la riduzione della
somministrazione del prednisolone ad una sola volta alla settimana e la sospensione della terapia con allopurinolo.
A distanza di due anni il gatto continuava a stare bene e non aveva più presentato recidiva delle lesioni cutanee.
Un’altra sede di localizzazione delle lesione sono le porzioni distali degli arti, dove si possono avere lesioni nodulari - ulcerative o aree alopeciche più o meno estese.
Un gatto di 6 anni era stato condotto alla visita veterinaria per la presenza di una lesione nodulare ulcerata a livello della regione tarsale sinistra. Secondo quanto riferito dal proprietario una simile lesione, a livello toracico, si
era risolta
spontaneamente. Dopo un
trattamento con
medicazioni topiche e terapia antibiotica sistemica con amoxicillina ed ac. Clavulanico, senza alcun miglioramento, era stata effettuata l’escissione chirurgica della lesione sottoposta quindi ad esame istopatologico, che aveva permesso di evidenziare una diffusa infiltrazione granulomatosa del derma con numerosi macrofagi e plasmacellule ed alcuni granulociti neutrofili. All’interno dei macrofagi erano inoltre stati evidenziati numerosi amastigoti di Leishmania (Fig. 18)
Figura 18: Sezione del nodulo (ematossilina -eosina)
A livello dell’epidermide sovrastante erano invece state rilevate ipercheratosi, acantosi e ulcerazione.
La PCR eseguita su campione di tessuto cutanee prelevato dalla lesione per evidenziare DNA di Leishmania era risultata positiva.
Dopo l’asportazione chirurgica del nodulo si sono presentate due nuove lesioni, sempre di natura nodulare -ulcerativa, una a livello della superficie plantare del tarso, ed una a livello del metatarso, sempre della zampa sinistra (le dimensioni erano circa di 2x1-5x1 cm).
Le condizioni generali di salute del gatto erano però buone, all’esame dei linfonodi esplorabili non risultava linfoadenomegalia, ed il profilo ematochimico non aveva evidenziato nulla di anormale ad eccezione di una marcata iperglobulinemia (76,1 g/l con valori di riferimento tra 30-38 g/l) ed una lieve ipoalbuminemia (25,6 g/l con valori di riferimento tra 30 e 40 g/l). Il soggetto era inoltre FIV e FeLV negativo.
Sulla base della diagnosi parassitologica e visto il ripresentarsi delle lesioni, era stata decisa una terapia a base di allopurinolo alla dose di 10 mg/kg per os due volte al giorno.
Alla successiva visita di controllo le lesioni erano peggiorate, ma l’esame istopoatologico aveva evidenziato questa volta un’infiammazione ulcerativa cronica, in assenza di promastigoti di leishmania.
Era stato pertanto deciso di ridurre il dosaggio di allopurinolo a 5 mg/kg e di associarlo alla somministrazione di cefalexina (20 mg/kg per os due volte al giorno per 10 giorni).
Dopo soli tre mesi il gatto aveva presentato completa remissione dei sintomi, con normalizzazione dei valori delle proteine sieriche e
diminuzione del titolo anticorpale, valutato con test ELISA, che si è totalmente negativizzato nei mesi successivi. (Rufenacht et al., 2005)
Altre lesioni che si possono riscontrare in gatti affetti da leishmaniosi si hanno a carico degli occhi, in particolare della mucosa congiuntivale.
In un gatto domestico, femmina di circa 6 anni, condotto alla visita clinica
presso uno studio
veterinario della
provincia di Imperia,
perché presentava
anoressia e letargia, è stato evidenziato, durante l’esame obiettivo particolare, un nodulo ulcerato, di circa 2 cm di diametro, a livello della rima palpebrale dell’occhio sinistro(Fig.19).
L’esame istologico delle lesioni nodulari osservate a livello della palpebra ha evidenziato una dermatite piogranulomatosa diffusa, superfciale e profonda, che si estendeva dall’area sottoepidermica della pelle verso la mucosa congiuntivale e che mostrava un estesa ulcerazione, fino al muscolo orbicolare (Fig.20)(Poli et al., 2002)
Figura 19: nodulo ulcerato di 2 cm nella rima palpebrale sinistra di un gatto affetto da
Figura 20: dermatite pio granulomatosa (Poli et al., 2002)
L’infiltrato cellulare consisteva in un aggregato di macrofagi, linfociti ed alcune plasmacellule. Numerosi amastigoti di Leishmania sono stati messi in evidenza a livello intracellulare in quasi tutti i
macrofagi, sia nel derma superficiale che profondo (Fig.21)
All’esame clinico erano stati inoltre rilevati segni sistemici quali: una notevole perdita di peso, disoressia , una severa stomatite ulcerativa (Fig.22), una linfadenopatia generalizzata e splenomegalia. All’esame emocromocitometrico era stata evidenziata una lieve leucocitosi neutrofila con 31,1 globuli bianchi (WBCs)/µl, mentre eritrociti (RBCs), piastrine e concentrazione emoglobinica rientravano
Figura 22:Stomatite ulcerativa (Poli et al.,2002)
Figura 21:amastigoti nei macrofagi del derma superficiale e profondo(Poli et al., 2002)
nei normali valori di riferimento. Il profilo biochimico ematico (Azoto ematico, urea, creatininemia, glucosio, GPT, ALT, AP e colesterolo) era risultato nella norma. L’elettroforesi delle proteine del siero aveva evidenziato un aumento della concentrazione di globuline a 2,84g/dl (pari al 37,5%) con una concetrazione di potreine totali di 7,59g/dl e un rapporto albumine/globuline di 0,54. Il gatto inoltre era risultato positivo sia al virus dell’immunodeficienza felina (FIV), che al virus della leucemia felina (FeLV)(Poli et al., 2002)
Anche se più raramente rispetto alle forme cutanee, sono infatti descritte in letteratura forme di leishmaniosi viscerale nel gatto. In questi casi si i sintomi riportati sono prevalentemente linfoadenomegalia, anemia, febbre, leucopenia, vomito, diarrea, anoressia e ittero(Hervas et al., 1999; Pennisi et al 2002), ipergammaglobulinemia (Ozon et al 1999; Hervas et al 1999, Pennisi 2002; Poli 2002), proteinuria ed insufficienza renale (Pennisi 2002), associate spesso anche a stomatiti, generalmente piuttosto severe, lesioni oftalmiche e co-infezioni con il virus della leucemia e dell’immunodeficienza felina .Sembra probabile che sia proprio la presenza di confezioni con i virus della FIV e della FeLV a permettere la disseminazione del parassita fino a localizzazioni viscerali (Solano-Gallego et al., 2007)
In gatto femmina di 13 anni di età, proveniente dalla provincia di Imperia, il motivo della visita clinica era stata l’insorgenza di numerose lesioni nodulari su occhi, labbra,
muso e zampe
anteriori(Fig.23;Fig.24)
Figura 23:lesioni nodulare su palpebre, labbra e mento(mancianti et al., 2004)
Figura 24:lesioni sulla porzione laterale dell'arto anteriore destro(Mancianti et al., 2004)
L’esame istopatologico delle lesione aveva evidenziato la presenza di leishmanie, l’IFAT un titolo anticorale di 1/160 e la PCR su sangue aveva dato risultato positivo per DNA di Leishmania infantum(Fig.25), mentre gli
esami collaterali erano nella norma.
Figura 25:Analisi elettroferetica dei prodotti ottenuti dall'amplificazione del DNA(PCR)(Mancianti et al., 2004)
In particolare l’elettroferesi delle preteine sieriche aveva evidenziato dei valori nella norma per Albumina, alfa-1, alfa-2, beta -1, beta -2, gamma ,
rapporto A/G e proteine totali (Fig. 26)
Il soggetto fu pertanto sottoposto ad una terapia a base di Glucamtim®alla dose di 5mg/kg /die e di Nizoral® 10mg/kg per tre cicli della durata di un mese, a cui seguì un rapido miglioramento delle lesioni cutanee(Fig.27; fig.28), diminuzione del titolo anticorpale a 1/40 , ed esito negativo della PCR per DNA di leishmania su campione di sangue.
Dopo due mesi però il soggetto aveva presentato una recidiva con la comparsa di un linfonodo palpabile a livello inguinale ed uno sottocutaneo sul dorso. Fu deciso pertanto di sottoporlo ad un nuovo protocollo terapeutico portando il dosaggio del Glucantim® dai 5 mg/kg iniziali a 50 mg/kg/die, sempre in associazione al Nizoral®, per due cicli fino a
Figura 28: particolare delle lesioni sul mento dopo terapia (Mancianti et al., 2004)
Figura 27: lesioni cutanee in remissione dopo terapia (Mancianti et al.,2004)
regressione dei segni clinici. La terapia fu però interrotta a causa di alterazione dei valori epatici.
Dopo alcuni mesi dalla sospensione della terapia si era avuta la comparsa di nuove lesione nodulari.-proliferative(escrescenze) sulla zona del mento, di conseguenza fu ripeso il trattamento precedentemente interrotto. A distanza di un anno il gatto, a causa di una grave insufficienza renale, fu sottoposto ad eutanasia.
In un altro gatto proveninte dalla provincia di Grosseto erano state evidenziate delle lesioni nodulari sul muso e sulle palpebre.(Fig.29)
Figura 29:lesioni su muso e palpebra e particolare del nodulo palpebrale.
Il soggetto nel complesso era in un buono state di salute e, ad eccezione delle lesioni motivo della visita, non presentava nessun altro rilievo clinico anormale.
Il gatto fu sottoposto ad esami parassitologi: L’IFAT evidenziò un titolo anticorpale di 1/80, mentre la PCR effettuata su campione di sangue era
risultata positiva per DNA di Leishmania infantum.Gli esami collaterali erano invece risultati nella norma(Fig.30)
Figura 30: elettroforesi proteine sieriche (Dott.Franceschi)
Date le notevole dimensioni del nodulo localizzato sulla palpebra dell’occhio sinistro, ne fu decisa l’asportazione chirurgica (Fig.31).
L’esame istopatologico delle lesioni aveva permesso di evidenziare numerose leishmanie (Fig. 32)
Oltre al naso e agli occhi molte lesioni si trovano localizzate alle labbra come si può notare in questo gatto, affetto da leishmaniosi diffusa, proveniente dalla provincia di Lucca. Si possono notare delle lesioni
nodulari con tendenza all’ulcerazione localizzate a livello delle labbra(Fig.33). ed un’area alopecica a livello del mento. Lo stesso gatto presentava ampie
e simmetriche lesioni ulcerative che si estendevano dalla porzione mediale del padiglione auricolare alla regione temporale (Fig.34). Anche in questo caso dall’osservazione al microscopio dello striscio ottenuto con il materiale prelevato dalle lesioni è stato possibile evidenziare la presenza di numerosi
amastigoti di
leishmania all’interno dei macrofagi.
Figura 33: lesioni nodulari –ulcerative alle labbra.
Figura 34: estesa ulcera cutanea a livello della regione auricolare in un gatto affetto da leishmaniosi
Un sintomo frequente nella leishmaniosi felina è la presenza di un stomatite ulcerativa associata spesso all’iperplasia del tessuto linfoide retro faringeo(Fig.35).
Figura 35: stomatite ulcerativa
Nel gatto si sono osservate anche delle forme di leishmaniosi cutanea disseminata. In questi casi le lesioni cutanee si estendevano a tutto il corpo sottoforma di aree alopeciche e di focolai di dermatite seborroica ulcero-crostosa maleodorante. Spesso le lesioni sono risultate complicate da sovrainfezioni batteriche e da lieviti come evidenziato dall’osservazione dei preparati istologici ottenuti da biopsie cutanee che avevano messo in evidenza una paracheratosi/ipercheratosi con numerose colonie batteriche di cocchi ( Ozon et al., 1998).
DIAGNOSI
I segni clinici con cui si manifesta la leishmaniosi non sono patognomonici e nel gatto si possono avere quadri clinici sovrapponibili a diverse patologie altrettanto frequenti nelle aree endemiche; in particolar modo è necessaria una diagnosi differenziale per tutte le patologie a carattere nodulare, o erosivo– ulcerativo, o prevalentemente facciali (Tabella1), di origine batterica, micotica o neoplastica.
Malattie nodulari Malattie erosive e ulcerative Malattie prevalentemente facciali LEISHAMNIOSI ACTINOMICOSI BOTRIOMICOSI NOCARDIOSI LEBBRA FELINA DERMATOFITOSI CRIPTOCOCCOSI FEOIFOMICOSI PITIOSI SPOROTRICOSI BLASTOMICOSI COCCIDIOMICOSI ISTOPLASMOSI PAPILLOMATOSI VIRALE PANNICOLITE NODULARE STERILE GRANULOMA EOSINOFILICO DERMATITE PIOTRAUMATICA CANDIDOSI INFEZIONI DA CALICIVIRUS FELINO VIRUS DELLA RINOTRACHEITE FELINA LEISHMANIOSIPENFIGO VULGARE VASCULITE CUTANEA ERITEMA MULTIFORME ENECROLISI EPIDERMICA TOSSICA REAZIONE CUTANEA DA FARMACO EPIDERMOLISI BOLLOSA PLACCA EOSINOFILICA FELINA ULCERA INDOLENTE IPERSENSIBILITA’ ALLA PUNTURA DI ZANZARA LEISHMANIOSI PENFIGO FOLIACEO PENFIGO ERITEMATOSO LUPUS ERITEMATOSO DISCOIDE ACNE FELINA DERMATITE FACCIALE DEL GATTO PERSIANO
ULCERA INDOLENTE
DERMATOSI SOLARE FELINA
TABELLA 1:(Medleau :Dermatologia del cane e del gatto )
Nell’approccio clinico diagnostico gli esami di laboratorio hanno un ruolo fondamentale in modo particolare gli esami specifici che permettono di valutare la presenza del protozoo nell’organismo animale. Gli esami aspecifici sono utili, invece, al fine di valutare le alterazioni indirettamente attribuibili alla malattia, per il monitoraggio di un eventuale terapia e ai fini prognostici.
ESAMI SPECIFICI
SIEROLOGIA
Gli esami sierologici sono metodi indiretti che evidenziano la presenza del parassita tramite l’individuazione degli anticorpi specifici. Per la diagnosi sierologica di leishmaniosi nel gatto vengono utilizzate principalmente l’IFAT e l’ELISA.
Enzyme-linked immunosorbent assay (ELISA)
L’ELISA è un test immunoenzimatico che si basa sull’impiego di un estratto proteico crudo di parassiti in coltura come antigene specifico. Il test si effettua ponendo il siero in esame a contatto con l’antigene, adsorbito al fondo dei pozzetti di piastre per esami immunoenzimatici. Dopo incubazione a 37 °C per 30 minuti ed eliminazione dell’eccesso di antigene, viene aggiunta l’antiglobulina specifica coniugata con perossidasi o con altro enzima analogo. La reazione colorimetrica che si sviluppa, facendo reagire l’enzima con il suo substrato, dopo accurati lavaggi, può essere quantificata mediante lettura allo spettofotometro. L’utilizzo di antigeni totali permette di rilevare agevolmente titoli anticorpali elevati, ma in presenza di titoli bassi o borderline, propri ad esempio delle fasi latente o asintomatiche dell’infezioni, che frequentemente si riscontrano nei gatti, mostra evidenti carenze (Talmi-Frank et al., 2006).
Immunofluorescenza indiretta (IFAT)
E’ il test sierologico più utilizzato per la diagnosi di leishmaniosi. Il test si esegue facendo reagire il siero del soggetto in esame , opportunamente diluito per raddoppio, con l’antigene di Leishmania fissato sui vetrini, a 37 °C per circa 30 minuti. Dopo un lavaggio si aggiunge l’antiglobulina specifica coniugata con un fluorocromo (isotiocianato di fluoresceina o perossidasi) , a cui segue un’ altra incubazione a 37 °C, altri lavaggi ed il montaggio su vetrini con glicerina. La lettura dei campioni viene effettuata al microscopio a fluorescenza. L’IFAT ha una specificità del 100% per titoli superiori a 1/160 ed una sensibilità compresa tra il 98,4% ed il 99,5% (Mancianti, 2001), anche se tali valori diminuiscono su campioni con titoli bassi. I maggiori limiti di questa metodica sono soprattutto una certa soggettività di lettura e una scarsa affidabilità per titoli bassi che possono portare all’individuazione di falsi positivi o falsi negativi, questi ultimi abbastanza frequenti nei gatti.
In generale possiamo affermare che:
un titolo sierologico ≥1/160 indica sempre infezione in atto
titoli compresi tra 40 e 80, in assenza di sintomi, devono essere considerati dubbi
si può avere malattia anche con sierologia negativa (Mancianti, 2001).
In caso di sierologia positiva in soggetti asintomatici, ci possiamo trovare di fronte ad uno stato passeggero, trattandosi verosimilmente di animali che sono entrati in contatto con il parassita, che hanno prodotto anticorpi e che quindi hanno la possibilità di un evoluzione o verso la guarigione spontanea, o verso la malattia conclamata. L’assenza di anticorpi rilevabili
con le tecniche sierologiche classiche potrebbe invece essere dovuta ad una predominanza di una risposta immunitaria cellulo-mediata efficace, o all’azione delle cellule NK o ancora all’esistenza di ceppi parassitari epidermotropi che, per la loro localizzazione cutanea, non stimolerebbero efficacemente la produzione anticorpale (Lamothe, 2002)
ESAMI MICROSCOPICI CITOLOGICI
Gli esami microscopi citologici, sono metodiche dirette effettuate su campioni bioptici, colorati col metodo MGG(May-Grünwald-Giemsa) o con un metodo rapido basato sul Wright, come il Diff-Quick®( Pizzirani e Saponetto) che permettono di evidenziare gli amastigoti di leishmania. Questi esami sono piuttosto facili da eseguire e, anche se caratterizzati da una sensibilità inferiore rispetto ad altre tecniche, sia dirette che indirette, hanno una specificità elevatissima; la stretta aderenza ai criteri morfologici permette, infatti, di ottenere agevolmente una specificità del 100%. La rilevazione degli amastigoti nei campioni può quindi essere considerata una metodica molto accurata per la diagnosi dell’infezione da Leishmania sia nel cane (Saridomichelakis et al., 2005) che nel gatto. Citologicamente gli amastigoti, che nei preparati appaiono rotondi od ovali, con diametro di 2-5µm, con nucleo eccentrico, cinetoplasto che assume una colorazione basofila più intensa del nucleo ed una membrana cellulare visibile, possono essere osservati sia in sede intracitoplasmatica, all’interno di macrofagi ed altre cellule ad attività fagocitica, che extracitoplasmatica (Paltrinieri et al., 2007).
Citologia cutanea e dermica
I preparati citologici vengono ottenuti dalle lesioni cutanee per impressione o raschiamento. Talvolta è stata proprio l’osservazione di forme amastigote di leishmania in preparati ottenuti da lesioni cutanee ad eziologia ignota che ha permesso la diagnosi eziologica di leishmaniosi, anche quando questa patologia non era stata inclusa nelle possibili diagnosi differenziali. La presenza, quindi, di amastigoti di leishmania consente di emettere inequivocabilmente diagnosi di infezione, anche se la lesione osservata e da cui è stato effettuato il prelievo, può anche non essere causate dai parassiti, soprattutto quando non sono numerosi;si può avere infatti accumulo macrofagi parassitati o anche la presenza di amastigoti in cellule non fagocitarie, in lesioni cutanee ad esempio di natura neoplastica (Albanese et al., 2002; Ferroglio, 2007).
PCR
La Polymerase Chain Reaction - reazione a catena della polimerasi - è una metodica specifica indiretta che permette l’amplificazione di sequenze specifiche del DNA di Leishmania .E’ una tecnica molto specifica e, soprattutto, molto sensibile quando viene utilizzata per l’amplificazione di sequenze genomiche “multicopia”, cioè presenti in numero molto elevato in ogni singolo parassita, come il DNA dei minicircoli del cinetoplasto. E’ quindi in grado di identificare piccolissime quantità di DNA presente nel materiale biologico in esame (Paltrinieri et al., 2007).
La PCR può essere considerata come una versione semplificata del processo di replicazione del DNA che si verifica durante la divisione cellulare. Fondamentalmente la PCR si divide in tre fasi: 1) denaturazione termica del DNA target, 2) appaiamento (annealing) dei primer oligonucleotidici sintetici, che sono sequenze di basi complementari alla
sequenza target contenute nel DNA di Leishmania, 3) estensione dei
primer appaiati da parte di una TAQ-polimerasi. Queste fasi vengono
ripetute per un certo numero di cicli, in ognuno dei quali si ha approssimativamente la duplicazione dei prodotti molecolari. Il fattore di amplificazione è dato dall’equazione 𝑥(1 + 𝐸)𝑛, dove è 𝑥 è il numero di target iniziali, 𝐸 è l’efficienza dell’amplificazione ed 𝑛 è il numero di cicli della PCR. La sensibilità della PCR è correlata al numero delle molecole
target , alla complessità di quelle non target ed al numero di cicli. In
genere la reazione è in grado di eseguire l’amplificazione a partire da una singola molecola bersaglio; in questi casi la singola molecola target è inserita in un tampone apposito, cioè in un ambiente a bassa complessità. I prodotti della PCR vengono poi analizzati mediante elettroforesi. Il metodo comunemente utilizzato è l’elettroforesi su gel di agarosio a cui viene addizionato uno speciale colorante il bromuro di etidio, che è un chelante del DNA, in modo da consentire la visualizzazione delle bande di migrazione alla successiva osservazione alla luce ultravioletta.
La PCR per la sua straordinaria sensibilità è utile in senso diagnostico puro, come prima diagnosi e può essere utilizzata su campioni di midollo osseo, linfonodi, cute, congiuntiva, buffy coat, sangue periferico, ordine questo considerato decrescente in termini di sensibilità da Paltrieri e coll. (2007). La PCR è in grado di rilevare la presenza di DNA parassitario e non quella dei parassiti intatti.
ESAMI ASPECIFICI
Gli esami aspecifici, in particolare l’esame emocromocitometrico, il profilo biochimico ematico e l’elettroforesi delle proteine sieriche sono importanti per valutare lo stato generale del soggetto, fornendo indicazioni sullo stato della patologia e sugli effetti di un eventuale terapia.
Nel gatto le forme viscerali di leishmaniosi non sono frequenti e gli esami collaterali spesso sono nella norma. In forme esclusivamente cutanee si possono riscontrare all’esame emocromocitometrico neutrofilia (Poli et al., 2002) o eosinofilia. In casi di diffusione sistemica della malattia, si può invece avere anemia, leucopenia (Pennisi et al., 2002) e linfopenia , soprattutto in soggetti FIV e FeLV positivi e, per quanto riguarda l’elettroforesi delle proteine sieriche, iperglobiulinemia e ipoalbunemia (Poli et al., 2002; Pennisi et al., 2002). Può esser utile eseguire anche un esame delle urine per valutare un eventuale presenza di proteinuria indice di insufficienza renale (Pennisi et al., 2002).
PARTE SPERIMENTALE
SCOPI
Lo scopo fondamentale della presente ricerca è stato quello di condurre un indagine parassitologica per rilevare la presenza di DNA di leishmania, o di anticorpi specifici diretti verso questo protozoo, nella popolazione felina vivente in zone endemiche della Toscana, e valutare se il gatto possa essere o meno considerato un serbatoio di infezione.
MATERIALI E METODI
SOGGETTI E CAMPIONAMENTO
Sono stati esaminati i campioni di sangue e i tamponi congiuntivali prelevati da un totale di 60 gatti provenienti principalmente da tre zone endemiche per leishmania, rispettivamente a nord, centro e a sud della Toscana. I gatti erano originari infatti della provincia di Lucca (Lido di Camaiore, Massarosa e Forte dei Marmi), di Siena (San Gimignano), e della provincia di Grosseto (Castiglione della Pescaia, Grosseto, Follonica, Roccastrada e Civitella-Paganico). I gatti oggetto della presente ricerca provengono sia da cliniche veterinarie private, che dal servizio veterinario della ASL 9 di Grosseto.
Il gruppo in esame (Tabella 2) è risultato costituito pertanto da un insieme eterogeneo di soggetti per età, sesso, provenienza e stato di salute: vi erano compresi infatti sia gatti appartenenti a colonie feline di strada, per lo più giovani, portati alla ASL per essere sottoposti ad interventi di castrazione/sterilizzazione, previsti dal programma per il controllo del randagismo, che gatti domestici. Questi ultimi, a loro volta, comprendenti sia animali giovani la maggior parte dei quali erano portati in clinica per