INDICE
INTRODUZIONE ... pag. 2
SCOPO DELLA TESI ... pag. 26
MATERIALI E METODI ... pag. 26
RISULTATI ... pag. 30
DISCUSSIONE ... pag. 54
CONCLUSIONI ... pag. 67
INTRODUZIONE
1. Cancro del retto
Il carcinoma del retto, considerato dal punto di vista epidemiologico sempre in associazione al tumore del colon per le loro caratteristiche simili quali i fattori di rischio e la patogenesi, è un tumore molto frequente nella popolazione, concentrandosi soprattutto nelle età più anziane.
A livello mondiale, una stima del 2008 riporta la comparsa di 1.234.000 nuovi casi di carcinoma colon-rettale, con una leggera prevalenza maschile 1. Sempre nel 2008 le morti dovute a carcinoma del colon-retto sono state circa 608.000 (8% di tutte le morti tumorali), facendo di questo tumore la quarta causa più frequente di morte per cancro. 1
Per quanto riguarda i dati italiani si fa riferimento al volume “I numeri del cancro in Italia 2013” elaborato grazie alla collaborazione tra l’Associazione italiana registri tumori (AIRTUM) e l’Associazione Italiana di Oncologia Medica (AIOM). Prendendo in considerazione l’intera popolazione, uomini e donne, il tumore del colon-retto rappresenta la patologia oncologica più frequente, attestandosi al 14% sul totale dei tumori, esclusi i carcinomi della cute. Tra i maschi si trova al terzo posto, preceduto dal tumore della prostata e del polmone, nelle femmine al secondo posto, preceduto dal tumore della mammella. Negli ultimi decenni l’aumento dei fattori di rischio, delle diagnosi precoci e dell’età media della popolazione ha portato a una progressiva crescita dell’incidenza di questo tumore.2
Nel 2013 sono state stimate 55.000 nuove diagnosi di carcinoma colon-rettale, mentre considerando solo i carcinomi rettali la stima si abbassa a 15.700 (9.500 fra gli uomini e 6.200 fra le donne).2
I dati riguardanti la prevalenza indicano che sono quasi 300.000 i pazienti con pregressa diagnosi di carcinoma di colon-retto (tra cui il 51% sono maschi) anche se il 16% di questi si trova in verità ad ormai oltre 15 anni dalla diagnosi.2
Tra le cause di morte tumorale stimate in Italia, il carcinoma del colon-retto si attesta al secondo posto (11% del totale) dopo il carcinoma del polmone, con oltre 20.000 decessi stimati nel 2013. La mortalità è in moderato calo, sia per gli uomini che per le donne e possiamo in fine definire la prognosi per questi tipo di tumore sostanzialmente buona.2
I fattori di rischio per lo sviluppo del carcinoma del colon-retto sono principalmente legati allo stile di vita e alla familiarità. Tra i primi spiccano fattori quali il consumo di carni rosse, il sovrappeso, la ridotta attività fisica, il fumo e l’eccesso di alcol.3 Altri fattori di rischio sono rappresentati dalle malattie infiammatorie intestinali e dalla familiarità.4 Infatti la probabilità di sviluppare questo tumore aumenta per le persone con familiari di primo grado affetti da carcinoma colon-rettale, soprattutto per quelli con più parenti affetti o con parenti nei quali il tumore è comparso in età precoce.4 Infine bisogna ricordare le cosiddette forme ereditarie, quali la poliposi adenomatosa familiare (FAP) e il cancro colorettale ereditario non poliposico (HNPCC o sindrome di Lynch), che sono determinate da aberrazioni genetiche note ma sono responsabili solo di meno del 5% di tutti i carcinomi colon-rettali.4
Per il cancro colon-rettale esiste un programma di screening indirizzato a uomini e donne dai 50 ai 69 anni di età.2 Consiste nel test di ricerca del sangue occulto nelle feci e successiva colonscopia nei casi risultati positivi, con ripetizione regolare ogni 2 anni.2 Lo screening può consentire il riscontro di precursori (adenomi) prima della trasformazione in carcinoma e la diagnosi di carcinomi in stadio iniziale con conseguente riduzione della mortalità.2
Nel campo chirurgico, a differenza di quelle epidemiologico, esistono importanti diversità tra tumori colici e rettali. La chirurgia del retto, infatti, è molto più complessa da un punto di vista tecnico e vi è anche un maggior rischio di sviluppare complicanze o recidive tumorali. La sede del retto all’interno del bacino rende chiaro come sia più difficile accedere a questa parte di intestino, soprattutto nel maschio dove il bacino è più stretto e negli obesi per la abbondante presenza di adipe. La contiguità del retto con l’apparato sfinteriale dell’ano inoltre rende molto difficile eseguire interventi che siano radicali e adeguati oncologicamente e allo stesso tempo
che permettano il salvataggio dello sfintere e della funzione fecale. Infine è importante ricordare il peculiare rivestimento peritoneale del retto: esso ricopre, in parte, solo il terzo rettale prossimale, ovvero la porzione che dista più di 10 cm dal margine anale. Il retto distale (ovvero la porzione che arriva fino a 5 cm dal margine anale) e il retto medio (la porzione compresa tra le due precedenti) sono invece circondati dal mesoretto, struttura anatomica cellulo-adiposa che avvolge il retto a 270°. La faccia anteriore rimane scoperta dal mesoretto e confina con il trigono vescicale, la prostata, i dotti deferenti e le vescichette seminali, nell’uomo, con la parete posteriore della vagina, nella donna. La mancanza di rivestimento peritoneale a questo livello porta a un alto tasso di complicanze, in confronto a quelle che si hanno dopo un intervento sul retto intraperitoneale o sul colon.
Per questo nelle linee guida si enfatizza l’importanza del chirurgo come fattore prognostico. “Il volume operatorio del singolo chirurgo e dell’equipe in cui lavora è un fattore collegato non solo alla mortalità chirurgica ed alla percentuale di complicanze peri-operatorie, ma anche alla prognosi a distanza del paziente”.5 Nel trattare la diagnosi e la stadiazione del cancro del retto si sono prese in considerazione le linee guida per i tumori del colon retto redatte dall’AIOM nel 2013. Queste indicano che la pancolonscopia è considerata l’esame più importante nella diagnosi, avendo un’altissima sensibilità e specificità, permettendo la valutazione delle rimanenti parti del colon e l’eventuale tatuaggio in china della lesione. In alternativa alla colonscopia, ad esempio in caso di stenosi serrata che renda impossibile l’esame endoscopico, si può impiegare la rettosigmoidoscopia associata al clisma con doppio contrasto. La colonscopia virtuale può sostituire il clisma opaco nello studio del colon ma non può ancora essere proposta come metodica di screening. Nei tumori del retto è inoltre fondamentale l’esecuzione dell’esplorazione rettale con la quale è possibile valutare clinicamente neoplasie fino a 6-7 cm dal margine anale. Nelle neoformazioni rettali devono sempre essere valutati la distanza del tumore dal margine anale o dall’apparato sfinteriale, l’estensione longitudinale e circonferenziale, il grado di fissità. Inoltre, sempre a riguardo dei soli carcinomi rettali, la diagnosi istologica su reperto bioptico o su polipo asportato è obbligatoria.5
Anche per quanto riguarda la stadiazione, la situazione è diversa a seconda che il tumore sia colico o rettale. Nel primo caso è difficile che la conoscenza preoperatoria dello stadio di malattia (parametri T e N) modifichi l’approccio terapeutico, mentre per il retto una stadiazione accurata è d’obbligo, soprattutto quando si tratta della porzione infraperitoneale.5
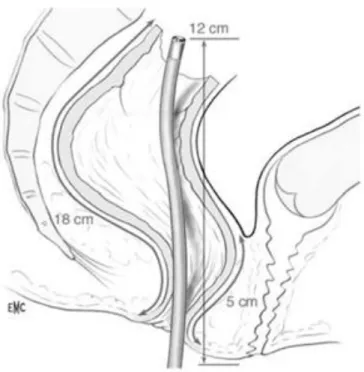
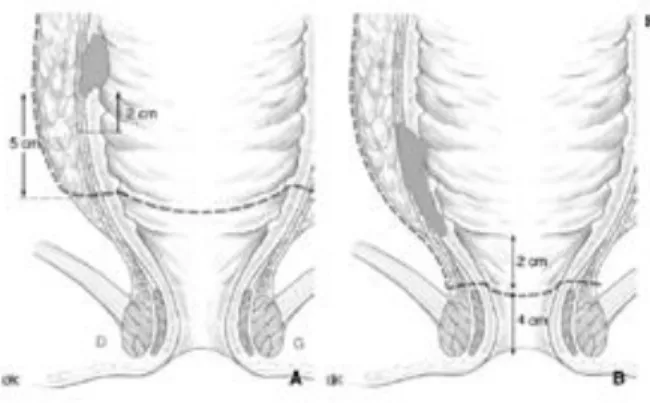
Per questo è indicata una RMN preoperatoria che permetta di individuare con precisione il tumore e la sua collocazione rispetto alla riflessione peritoneale, situata generalmente a 11-12 cm, e alla rima anale. La misura più importante da valutare è la distanza tra il polo inferiore del tumore e il margine anale, più accurata se eseguita con strumento endoscopico rigido, ad esempio con l’ecoendoscopia. Gli strumenti endoscopici flessibili possono sovrastimare questa distanza a causa delle curvature del retto (Figura 1).
Figura 1: differenza tra strumento endoscopico flessibile (a sinistra) e rigido (a destra) nella misurazione della distanza del tumore rettale dal margine anale.
Nel caso di tumori del terzo medio e inferiore del retto deve essere sempre valutata la penetrazione parietale e l’eventuale coinvolgimento della fascia mesorettale. Per
lesioni iniziali T1-T2 è sufficiente un’ecografia transrettale e una TAC pelvica, mentre lesioni localmente avanzate T3-T4 necessitano di una RMN pelvica. Per valutare la situazione linfonodale, l’esame più indicato è la RMN o, in mancanza di questa, l’ecoendoscopia. Per concludere, la stadiazione si deve valutare l’eventuale presenza di metastasi, soprattutto epatiche e polmonari. Le prime si ricercano con l’ecografia epatica o preferibilmente con una TAC addome, le seconde vanno escluse con una TAC torace, indispensabile nei tumori del retto medio e inferiore a differenza di quelli del retto infraperitoneale o del colon, dove è sufficiente eseguire una Rx torace. La scintigrafia ossea e la PET non vengono eseguite di routine ma solo in presenza di particolari indicazioni. Per quanto riguarda i marcatori tumorali vi è indicazione nel preoperatorio alla misurazione del CEA dato il suo ruolo prognostico e il suo possibile uso nel follow-up.5
In base a tutte le informazioni raccolte nella fase preoperatoria, con particolare attenzione alla stadiazione tumorale, un gruppo multidisciplinare, composto solitamente da chirurghi, oncologi, radiologi e patologi pianifica lo schema terapeutico.5
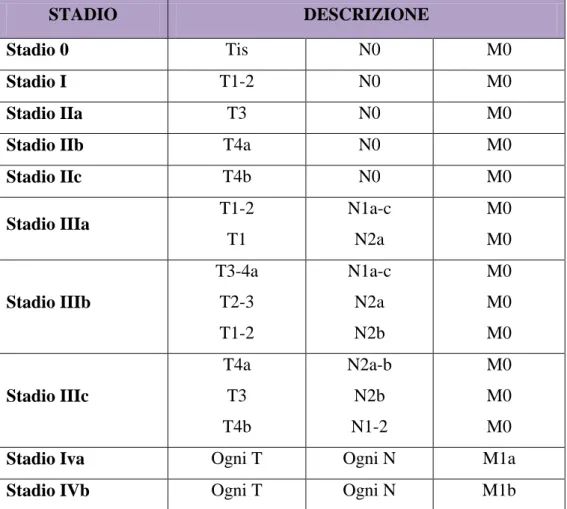
Per la stadiazione del tumore, essendo ormai desueta la precedente di Dukes modificata da Astler-Coller, si fa sempre riferimento alla classificazione TNM-UICC del 2009 (Tabella 1):
CLASSE DESCRIZIONE TX Tumore primitivo non definibile
T0 Tumore primitivo non evidenziabile
Tis Carcinoma in situ: intraepiteliale o invasione della lamina propria
T1 Tumore che invade la sottomucosa T2 Tumore che invade la muscolare propria
T3
Tumore con invasione attraverso la muscolare propria nella sottosierosa o nei tessuti pericolici e perirettali non ricoperti da peritoneo
T4
Tumore che invade direttamente altri organi o strutture e/o perfora peritoneo parietale T4a: tumore che perfora peritoneo viscerale T4b: tumore che invade direttamente altri organi NX Linfonodi regionali non valutabili
N0 Non metastasi nei linfonodi regionali
N1
Metastasi in 1-3 linfonodi regionali N1a: metastasi in 1 linfonodo N1b: metastasi in 2-3 linfonodi
N1c: depositi tumorali satelliti nella sottosierosa o nei tessuti non peritonealizzati pericolici e perirettali senza evidenza di metastasi linfonodali regionali
N2
Metastasi in 4 o più linfonodi regionali N2a: metastasi in 4-6 linfonodi regionali N2b: metastasi in 7 o più linfonodi regionali MX Metastasi a distanza non accertabili
M0 Assenza di metastasi a distanza
M1
Metastasi a distanza
M1a: metastasi confinate ad un organo (fegato, polmone, ovaio, linfonodi extraregionali)
M1b: metastasi in più di un organo o nel peritoneo Tabella 1: classificazione TNM-UICC del 2009. Caratteristiche dei parametri T, N e M.
Sempre riferendosi alla classificazione TNM-UICC, la Tabella 2 riassume gli stadi tumorali, grazie ai quali i pazienti vengono classificati.
STADIO DESCRIZIONE
Stadio 0 Tis N0 M0
Stadio I T1-2 N0 M0
Stadio IIa T3 N0 M0
Stadio IIb T4a N0 M0
Stadio IIc T4b N0 M0 Stadio IIIa T1-2 T1 N1a-c N2a M0 M0 Stadio IIIb T3-4a T2-3 T1-2 N1a-c N2a N2b M0 M0 M0 Stadio IIIc T4a T3 T4b N2a-b N2b N1-2 M0 M0 M0
Stadio Iva Ogni T Ogni N M1a
Stadio IVb Ogni T Ogni N M1b
Tabella 2: classificazione TNM-UICC del 2009. Suddivisione in stadi.
Inoltre si parla di cTNM quando ci si riferisce alla classificazione clinica e di pTNM quando si fa riferimento a quella patologica. Il prefisso “y” indica tumori rettali classificati dopo trattamento neoadiuvante e il prefisso “r” indica tumori recidivanti dopo un intervallo libero da malattia.
La terapia del cancro rettale si basa principalmente sulla chirurgia (vedi dopo) in associazione spesso a un trattamento chemioterapico, radioterapico o ad entrambi, usati per cercare di ovviare al problema delle recidive, che nel caso del retto sono relativamente frequenti.
Le linee guida più recenti suggeriscono di intraprendere una terapia neoadiuvante in caso di tumori T3-T4, N0 o ogni T, N1-2. Di solito la terapia in questi casi si basa
sulla combinazione di chemioterapia (5-FU o capecitabina) e radioterapia. In seguito, se il referto istologico del pezzo operatorio di questi pazienti conferma la stadiazione preoperatoria, si prosegue con un trattamento adiuvante chemioterapico (5-FU ± leucovorina o capecitabina ± oxaliplatino o FOLFOX). Se invece l’istologico indica che il tumore ha una stadiazione minore, il trattamento adiuvante non è necessario. Per i tumori che alla stadiazione preoperatoria si presentano come T1, N0 o T1-2, N0 si consiglia invece di effettuare, come primo trattamento, l’intervento chirurgico. In questi casi si valuterà in seguito, in base al referto istologico post-operatorio, la necessità o meno di sottoporre il paziente a trattamento adiuvante. Se infatti la stadiazione preoperatoria fosse stata errata e dopo l’intervento ci si trova davanti a un carcinoma T3, N0 o T1-3, N1-2 bisognerà intraprendere un trattamento con 5-FU ± leucovorina o capecitabina ± oxaliplatino o FOLFOX associato a radioterapia.6 Una considerazione a parte va fatta per quei tumori che si presentano con metastasi sincrone al momento dell’intervento. Un tumore ogni T, ogni N, M1 con metastasi resecabili sincrone, va trattato primariamente con chemioradioterapia, cui segue l’intervento chirurgico di resezione rettale e contemporaneamente di resezione delle metastasi epatiche (intervento sincrono). Molto spesso dopo l’intervento si procede ad alcuni cicli di terapia adiuvante. Abbiamo infine due casi estremi: i pazienti con tumori ogni T, ogni N, M1 con metastasi sincrone non resecabili e i pazienti in cui l’intervento è controindicato per cause mediche. In questi casi se il tumore è asintomatico si intraprende una chemioterapia disegnata a posta per i pazienti con malattia avanzata o metastatica, se il tumore è legato alla comparsa di sintomi si procede con trattamenti palliativi, ad esempio la chemioterapia, la resezione chirurgica non radicale, la creazione di una colostomia, il posizionamento di uno stent.6
Già da anni, molti studi hanno concluso che la chemioradioterapia neoadiuvante nel trattamento del carcinoma rettale avanzato non solo permette, in alcuni casi, di diminuire la stadiazione tumorale così da poter effettuare un intervento conservativo con salvataggio dello sfintere, ma conferisce anche un miglior controllo locale e una minore tossicità rispetto al trattamento adiuvante.7
Il materiale prelevato durante l’intervento chirurgico viene esaminato dall’anatomopatologo dopo fissazione in formalina e dopo colorazione della superficie mesorettale con inchiostro di china (Figura 2).
Figura 2: sezioni di intestino retto fissate in formalina; superficie mesorettale tinta con inchiostro di china.
L’anatomopatologo scrive un referto comprendente dei criteri diagnostici minimi da riportare obbligatoriamente. Tra questi troviamo l’istotipo, il grado di differenziazione, il budding tumorale, i margini di resezione (distale e prossimale), il numero di linfonodi esaminati e il numero di quelli metastatici, oltre a una serie di altri parametri. Il chirurgo deve asportare almeno 12 linfonodi durante l’intervento per avere una stadiazione linfonodale affidabile. È inoltre necessario indicare l’integrità o meno della fascia mesorettale e la distanza del margine di resezione radiale. Con quest’ultimo si indica il margine di tessuto sano compreso fra qualsiasi struttura neoplastica (tumore primitivo o linfonodo) presente nel mesoretto ed il margine di resezione mesorettale stesso. La presenza di neoplasia entro 1 mm da questo margine è correlata a un aumento del rischio di recidiva locale e ad una minor sopravvivenza globale.5
Il grado istologico della lesione viene indicato con G1 se il tumore è ben differenziato, G2 se moderatamente differenziato e G3 infine se scarsamente differenziato.
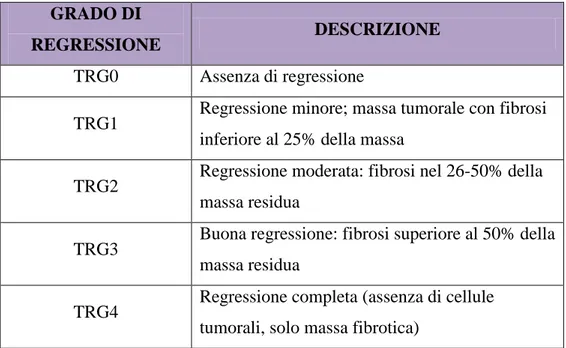
Nei pazienti trattati con terapia neoadiuvante deve essere riportato anche il grado di regressione tumorale (TRG).5
Per quanto riguarda la regressione tumorale viene solitamente usata la classificazione di Dworack (Tabella 3):
GRADO DI
REGRESSIONE DESCRIZIONE
TRG0 Assenza di regressione
TRG1 Regressione minore; massa tumorale con fibrosi inferiore al 25% della massa
TRG2 Regressione moderata: fibrosi nel 26-50% della massa residua
TRG3 Buona regressione: fibrosi superiore al 50% della massa residua
TRG4 Regressione completa (assenza di cellule tumorali, solo massa fibrotica)
Tabella 3: classificazione del grado di regressione tumorale, in pazienti sottoposti a trattamento neoadiuvante.
Per quanto riguarda invece la valutazione dei margini chirurgici, si parla di R0 quando questi sono liberi da cellule tumorali, indicando quindi una rimozione dell’intera massa tumorale, R1 quando i margini sono microscopicamente infiltrati, R2 quando non è stato possibile asportare l’intero tumore e ne è rimasta una parte in sede visibile anche ad occhio nudo (o ad esempio quando non sono stati rimossi tutti i linfonodi visibilmente metastatici).
Infine il referto istologico deve indicare il cosiddetto grado di Quirke, che valuta da un punto di vista macroscopico l’escissione del mesoretto: completa, parzialmente completa, incompleta (Grado 1, 2 , 3 di Quirke).5
Il follow-up post-operatorio dovrebbe essere guidato dal rischio di ricorrenza e dallo stato del paziente ed è importante soprattutto nei primi 2-4 anni dopo la terapia, quando il rischio di ricorrenza è maggiore (95% delle recidive avviene entro i primi 5 anni).8 I pazienti che più beneficiano di una sorveglianza post-operatoria sono quelli in stadio II o III. La società americana di oncologia clinica (ASCO) nel 2013 ha redatto una serie di linee guida che devono indirizzare il follow-up. Anamnesi, esame fisico e misurazione del CEA dovrebbero essere eseguiti ogni 3-6 mesi per 5 anni. Una TAC torace, addome e pelvica viene raccomandata una volta all’anno per 3 anni, mentre la PET non è raccomandata per la sorveglianza oncologica. Una colonscopia dovrebbe essere eseguita a circa un anno dall’intervento e in base al responso si decide quando programmare le successive, generalmente una ogni 5 anni se la prima è risultata negativa. Se il paziente non era stato sottoposto a una colonscopia completa prima dell’intervento, questa deve essere eseguita il prima possibile nel follow-up, dopo l’eventuale chemioterapia adiuvante, e non necessariamente dopo un anno.8
2. Trattamento chirurgico del cancro del retto
Gli obiettivi della terapia chirurgica consistono nel controllo del tumore primario, nel mantenimento o ricostituzione della continuità intestinale con una normale continenza anale, nel preservare la funziona vescicale e sessuale e infine nel minimizzare la morbidità e la mortalità associate alla chirurgia.9
Prima dell’intervento occorre effettuare una preparazione intestinale, una profilassi per evitare trombosi venose profonde e embolia polmonare (di solito si usa eparina a basso peso molecolare) e una profilassi antibiotica di breve durata (di solito si impiega una cefalosporina di I o II generazione, somministrata in dose unica subito prima dell’intervento). Inoltre se il paziente è anche solo potenzialmente candidato ad una stomia deve essere segnata la sua futura sede a livello cutaneo.5
Le tecniche chirurgiche spaziano da procedure locali a resezioni rettali complesse. Le procedure locali comprendono la polipectomia, l’escissione locale, la folgorazione e
l’ irradiazione endocavitaria. Le prime due sono preferite perché permettono l’esame istologico del campione, in questo modo se i margini sono infiltrati o si scopre una stadiazione più elevata del parametro T rispetto a quella sospettata clinicamente, si può adottare un trattamento più avanzato (chirurgia radicale o chemioradioterapia) per migliorare il controllo locale sulla lesione. La polipectomia con ansa diatermica è spesso eseguita durante una colonscopia se viene trovato un polipo rettale di aspetto benigno. Se il polipo rettale è maggiore di 1 cm o appare ulcerato o sembra un adenoma villoso più probabilmente si tratterà di un carcinoma infiltrante. In questo caso è bene associare alla polipectomia il tatuaggio della lesione, in modo da indicare la sede per un eventuale successivo intervento di resezione rettale. La polipectomia eseguita con tecnica piecemeal (a piccoli frammenti) andrebbe evitata. Se all’esame istologico si trova infiltrazione nei 2 mm di margine o se il tumore si estende nella sottomucosa è indicata l’escissione locale, la chirurgia resettiva o la chemioradioterapia. L’escissione locale consiste in una resezione a tutto spessore con 1 cm di margine libero. Normalmente viene eseguita con tecnica transanale sotto visione diretta, per lesioni entro 10 cm dal margine anale, o tramite microchirurgia endoscopica (TEM), per lesioni più prossimali.9
In elezione, l’escissione locale va ritenuta un trattamento adeguato se ricorrono alcune condizioni quali dimensioni della lesione non superiori a 3 cm, carcinoma in situ o in stadio T1 confinato agli strati iniziali della sottomucosa, assenza di invasione linfatica e vascolare, distanza dal margine anale idonea a rendere l’escissione possibile, ecc.5
La folgorazione o elettrocoagulazione del polipo comporta la distruzione del tumore tramite un elettrodo inserito nella parete della lesione ed è usata principalmente come terapia palliativa. L’irradiazione endocavitaria comporta l’uso di alte dosi di radiazioni emesse da uno speciale proctoscopio.9
La chirurgia resettiva del retto, come quella del colon, deve portare all’exeresi del segmento sede del tumore con adeguati margini liberi da malattia e all’asportazione completa delle rispettive stazioni linfonodali regionali. Per i carcinomi del retto medio e basso ci sono poi ulteriori accorgimenti da rispettare: l’escissione totale del mesoretto (TME) fino al piano degli elevatori, che rappresenta oggi il gold standard
della chirurgia, la conservazione dell’innervazione autonoma (nerve-sparing technique) e spesso il confezionamento di un’ileostomia o colostomia di protezione. Essendo una chirurgia complessa, il volume operatorio del singolo chirurgo e dell’equipe in cui lavora è un fattore collegato alla mortalità ma anche alla percentuale di complicanze peri-operatorie e alla prognosi dei pazienti.5
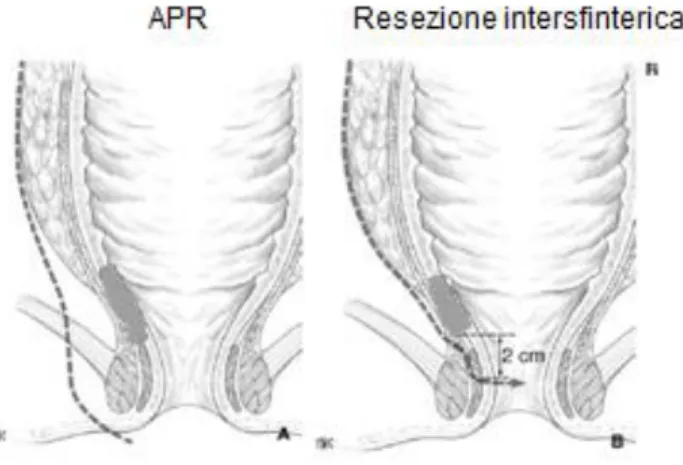
Le opzioni chirurgiche resettive sono principalmente due: la resezione anteriore del retto (RAR) e la resezione del retto per via addomino-perineale secondo Miles (APR). Per la prima metà del XX secolo il trattamento di scelta per la maggior parte dei pazienti con carcinoma rettale è stato l’intervento di Miles, ovvero un intervento demolitivo con rimozione degli sfinteri, che porta ad una colostomia permanente. In seguito lo sviluppo delle cure perioperatorie, dell’anestesia e della tecnica chirurgica, l’introduzione di suturatrici meccaniche affidabili e una miglior conoscenza della diffusione del tumore rettale ha portato ad uno spostamento verso la resezione anteriore del retto associata alla creazione di un’anastomosi colo-rettale o colo-anale, permettendo così il salvataggio dello sfintere (Figura 3).
Figura 3: differenza tra l’amputazione addomino-perineale (a sinistra) e la resezione anteriore del retto con salvataggio degli sfinteri (a destra).
Verso la fine del XX secolo il successo della terapia multimodale ha portato all’attuale combinazione di chemioradioterapia e intervento chirurgico che frequentemente permettono procedure non demolitive anche per tumori rettali distali. Ad oggi l’intervento di Miles viene praticato nei casi in cui non si può ottenere un margine distale indenne con una RAR, quando è infiltrato lo sfintere anale o quando il funzionamento dello sfintere è compromesso. Nonostante i miglioramenti terapeutici sviluppati negli anni, la recidiva locale e i problemi funzionali dopo l’intervento continuano a essere una causa importante di morbidità e mortalità dopo la resezione radicale.9
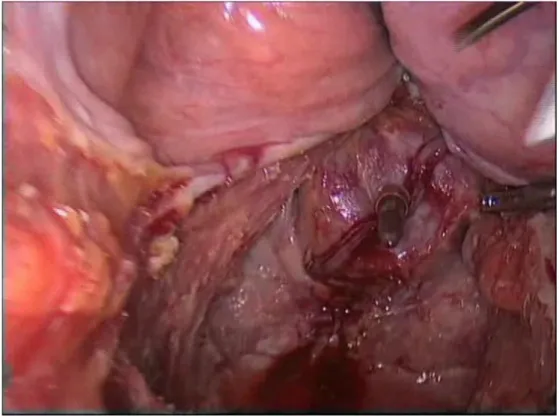
La resezione anteriore del retto (RAR) è l’intervento maggiormente eseguito. Viene classificata a seconda della sede dell’anastomosi ricostituente in alta, bassa o ultra-bassa. I primi passi dell’operazione sono comuni a tutte le resezioni anteriori. Dopo aver guadagnato l’accesso alla cavità addominale e dopo aver esaminato gli organi visibili, si spostano le anse del piccolo intestino nei quadranti destri dell’addome. Il retto-sigma viene tirato verso destra e viene inciso il piano avascolare presente tra il peritoneo e il lato sinistro del sigma. Vengono in seguito identificati e preservati grazie a una delicata dissezione l’uretere sinistro e i vasi gonadici. Viene poi separato il mesosigma dal tessuto retroperitoneale; il peritoneo viene inciso verso l’alto fino alla flessura splenica e la mobilizzazione si estende prossimalmente fino alla parte sinistra del colon trasverso. A questo punto il colon-sigma viene spostato verso sinistra per permettere la visione dell’aorta e dell’arteria mesenterica inferiore. Quest’ultima viene normalmente legata alla sua origine dall’aorta, mentre la vena mesenterica inferiore viene legata in un secondo momento in prossimità della sua emergenza da sotto il pancreas. Dopo la mobilizzazione il retto-sigma viene portato anteriormente per poter accedere al piano posteriore, avascolare, del retto, dove comincia la dissezione. Bisogna stare attenti in questa fase a preservare i nervi ipogastrici per mantenere una normale funzione urinaria e sessuale dopo l’intervento. Posteriormente, la dissezione segue la fascia perirettale fino al piano degli elevatori (Figura 4), da qui si procede in direzione laterale facendo attenzione a non ledere la fascia endopelvica. I nervi erigendi vengono identificati e preservati, a livello della parete pelvica laterale.
Figura 4: dissezione posteriore di retto e mesoretto, eseguita seguendo la fascia perirettale.
L’ultima parte della dissezione è quella anterolaterale: viene aperta la sacca peritoneale, incisa la fascia di Denonviller e il retto viene separato dalla vagina, nella donna, dalle vescichette seminali e dalla prostata, nell’uomo. Si è così eseguita l’escissione mesorettale completa (TME: total mesorectal excision), fase che sembra ad oggi la più importante dal punto di vista delle recidive.9 In verità l’escissione mesorettale deve essere completa se si tratta di tumori del retto distale e medio, mentre può essere anche parziale (PME: partial mesorectal excision) per tumori del terzo prossimale.5 In questo ultimo caso il mesoretto deve essere asportato almeno fino a 5 cm distalmente alla neoplasia5 (Figura 5). Terminata l’escissione del mesoretto, si può procedere alla resezione rettale tramite suturatrice lineare, facendo attenzione a lasciare 2 cm di margine libero da neoplasia, sia prossimalmente che distalmente (Figura 6). In verità nel caso in cui sia stato fatto un trattamento neoadiuvante, il margine libero distale, quello a livello rettale, può anche ridursi a 1 cm. 9
Figura 5: escissione mesorettale parziale (PME) a sinistra, escissione mesorettale completa (TME) a destra.
Rimane come ultimo passo la creazione di un’anastomosi che nella maggior parte dei casi è di tipo termino-terminale, sebbene ne esistano altre tipologie, ad esempio quella termino-laterale (tecnica di Baker). Le anastomosi colorettali basse o coloanali portano più facilmente a risultati subottimali, ad esempio i pazienti riferiscono urgenza o maggior frequenza della defecazione o vera e propria incontinenza. Per cercare di ovviare a questi problemi sono state sviluppate nuove tecniche tese ad aumentare la capacità del serbatoio rettale.9
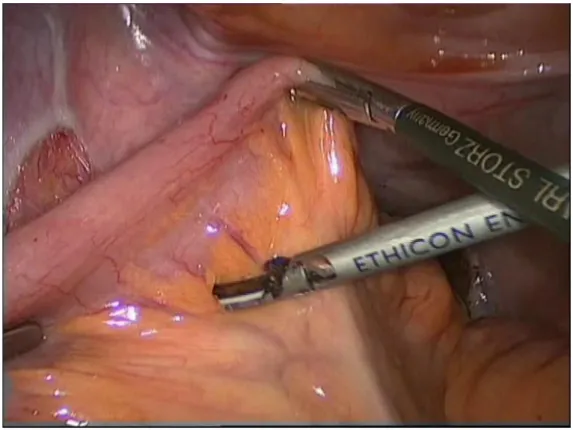
L’anastomosi colorettale viene normalmente eseguita grazie ad una suturatrice meccanica circolare transanale: dopo aver posizionato la testina della suturatrice nel moncone colico prossimale, tramite una borsa di tabacco, si congiunge questa allo stelo della suturatrice, condotto attraverso il moncone rettale, e si pratica l’anastomosi (Figura 7). Più raramente si realizza un’anastomosi meccanica senza confezionamento di una borsa di tabacco o un’anastomosi manuale. Infine, se si desidera aumentare la capacità rettale, si ha anche la possibilità di eseguire una coloplastica o di creare una neoampolla a J (detta J-pouch) utilizzando il colon prossimale.9
Figura 7: stelo della suturatrice meccanica transanale, condotto attraverso il moncone rettale, a cui si congiungerà la testina già fissata a livello colico.
Per diminuire l’incidenza di complicazioni anastomotiche post-chirurgiche, ad esempio la deiscenza dell’anastomosi, molti chirurghi preferiscono eseguire di routine anche una diversione fecale temporanea, di solito tramite un’ileostomia su bacchetta (Figura 8). I casi maggiormente a rischio di sviluppare complicazioni del sito chirurgico sono quelli in cui la sede tumorale è a livello del terzo medio o inferiore del retto, dove non si trova più il rivestimento peritoneale. Altri fattori di rischio per lo sviluppo di una deiescenza o altre complicanze includono pregressa radioterapia, immunosoppressione, insufficienza vascolare e diabete.9
Figura 8: creazione di un’ileostomia su bacchetta. Viene creata una fessura nel mesentere dell’ansa scelta per la stomia, dove verrà fatto passare un laccio che servirà per trascinare l’ansa al livello della cute.
La resezione, o amputazione, addomino-perineale (APR) consiste nella rimozione in blocco del retto e dell’ano, compreso quindi tutto l’apparato sfinteriale, insieme al circostante mesentere, al mesoretto e ai tessuti molli perineali. Associata all’APR vi è sempre la creazione di una colostomia terminale permanente. L’operazione si divide in due fasi: quella addominale e quella perineale, che possono essere eseguite
contemporaneamente o, più spesso, sequenzialmente. Nella fase addominale le operazioni da eseguire sono identiche a quelle viste nella prima fase della resezione anteriore del retto (mobilizzazione del colon, legatura dell’arteria mesenterica inferiore, TME con preservazione dei nervi, valutazione dei margini di sezione e sezione prossimale del retto). Nella fase perineale, con paziente in posizione ginecologica, si espone il perineo grazie a dei divaricatori e poi si procede alla chiusura dell’ano grazie ad una borsa di tabacco, per diminuire il rischio di fuoriuscita delle feci. Un altro modo per raggiungere questo obiettivo è praticare inizialmente un’incisione ellittica attorno all’ano e poi avvicinare i margini di cute perineali con suture o pinze Kocher. L’incisione perineale viene poi approfondita all’interno della fossa ischio-anale grazie ad un elettrobisturi e deve includere gli sfinteri esterni. Il legamento ano-coccigeo viene interrotto. La dissezione dei tessuti molli perineali comincia posteriormente per poi portarsi lateralmente e in avanti. Quando si è creata un’ampia apertura, la parte prossimale del moncone rettale viene fatta passare tra il coccige e l’ano e viene eversa. Questo aiuta il chirurgo a sviluppare il piano di dissezione anteriore. Una volta completata la dissezione, il campione viene ispezionato e mandato all’anatomopatologo. Si procede così alla chiusura in vari strati dell’incisione perineale. A questo punto si inserisce una terza fase, di nuovo addominale, in cui viene fatta l’emostasi, l’irrigazione della pelvi e viene posizionato un drenaggio pelvico. La colostomia terminale permanente, che rappresenta la principale differenza tra questo tipo di intervento e la resezione anteriore del retto, viene creata di solito prima della dissezione perineale. La sede della colostomia è generalmente rappresentata dal quadrante inferiore sinistro dell’addome.9
Esistono ulteriori tecniche chirurgiche per il carcinoma rettale, molto meno utilizzate, tra cui ad esempio l’intervento secondo Hartmann. In questa procedura il retto distale, dopo la sezione, viene affondato e viene praticata una colostomia terminale temporanea. In un secondo momento, se possibile, si procederà al confezionamento dell’anastomosi e alla chiusura della colostomia. Questa procedura può essere scelta se la probabilità di recidiva locale è alta (ad esempio per un carcinoma associato a perforazione) o se il paziente presenta disfunzione sfinteriale
già prima dell’intervento, per evitare di eseguire un’amputazione addomino-perineale.9
Le complicanze post-operatorie più comuni dopo un intervento di resezione rettale, sia esso open o laparoscopico, sono rappresentate dall’infezione della ferita, dalla deiscenza dell’anastomosi e dalla sepsi pelvica; la mortalità si attesta al 2%.10 I dati riguardanti l’eventuale incontinenza fecale dopo l’intervento sono generalmente scarsi e non esiste un test universale per valutare questa condizione.10
3. Chirurgia laparoscopia applicata al cancro del retto
La chirurgia resettiva rettale ha subito un’evoluzione negli ultimi anni, nei quali si è cercato sempre di più di procedere con approccio mini-invasivo. Tra le varie tecniche mini invasive l’approccio laparoscopico è di certo il più usato.
La laparoscopia ha cominciato a svilupparsi a partire dal campo ginecologico, per poi diffondere rapidamente anche nella chirurgia dell’apparato digerente, a partire dalla prima colecistectomia laparoscopica, effettuata nel 1987.
Da quel momento la laparoscopia è diventata la metodica più utilizzata nel trattamento delle patologie della colecisti. La prima resezione colica laparoscopica è stata eseguita nel 199111 ma in confronto all’uso della laparoscopia per le patologie della colecisti, l’utilizzo per il carcinoma colorettale si è sviluppato molto più lentamente. Le principali spiegazioni di questo fenomeno sono legate ai dubbi che avevano molti chirurghi riguardo il risultato oncologico dell’intervento, oltre che alla difficoltà maggiore della procedura, rispetto a una colecistectomia, e infine molte preoccupazioni nacquero in seguito alla comparsa di recidive tumorali a livello della porta di entrata dei trocars.12
Queste preoccupazioni furono accantonate, soprattutto a riguardo delle resezioni coliche, dopo i risultati ottenuti dai maggiori studi comparativi e randomizzati che evidenziarono l’assenza di differenze tra tecnica open e laparoscopica per quanto riguardava i margini di resezione, il numero di linfonodi asportati, il tasso di recidiva
e la sopravvivenza a medio e lungo termine. La recidiva a livello delle porte di entrata dei trocars fu dimostrato essere un evento raro, da non considerarsi come svantaggio dell’approccio laparoscopico.13
Rispetto alla chirurgia sul colon, gli interventi di resezione rettale presentano però delle difficoltà e degli accorgimenti aggiuntivi, che hanno fatto nascere maggiori dubbi nella comunità chirurgica. Per questo, sebbene ormai la resezione laparoscopica del colon è universalmente accettata, il trattamento laparoscopico del carcinoma rettale ha ancora un ruolo controverso.
Un’escissione mesorettale totale (TME) in laparoscopia è una procedura tecnicamente impegnativa, soprattutto se associata ad un’anastomosi rettale bassa, con l’eventuale rischio di aumentare il tasso di deiscenza anastomotica. Inoltre molti chirurghi hanno ancora dubbi sull’adeguatezza oncologica di una TME laparoscopica, anche dovuti ad una mancanza per molti anni nella letteratura di dati significativi.14
I vantaggi della laparoscopia rispetto alla tecnica open sono evidenti, come in tutti i casi in cui si effettua una chirurgia mini-invasiva: minor dolore post-operatorio, più breve ileo post-operatorio, minore ospedalizzazione, migliore qualità di vita a breve termine e infine un migliore risultato estetico.
La resezione anteriore laparoscopica del retto segue gli stessi principi della resezione con approccio laparotomico ma richiede delle piccole differenze tecniche. L’esplorazione della cavità addominale alla ricerca di lesioni metastatiche, soprattutto epatiche e peritoneali, rimane il primo passo dell’intervento, seguito dalla valutazione del tumore primitivo, che può risultare più difficile rispetto all’intervento open per mancanza dell’informazione tattile (per questo spesso si richiede il tatuaggio della lesione).15 L’intervento prosegue in maniera identica all’intervento laparotomico; nel momento in cui si deve effettuare la resezione il segmento intestinale coinvolto viene portato al di fuori della cavità addominale tramite un’incisione a livello pubico, rivestita da materiale di protezione per evitare la contaminazione.15
Stesse cose possono essere dette a riguardo dell’intervento di Miles, in cui però non viene fatta l’incisione di servizio per sezionare il retto ma viene esteriorizzato in fossa iliaca sinistra il moncone prossimale colico a creare una colostomia. Il tempo perineale procede senza differenze rispetto all’intervento open.
La conversione da una procedura laparoscopica ad una open è una necessità che a volte diventa inevitabile, spesso per cause non legate al tumore quali la presenza di adesioni molto rappresentate, ad esempio per pregressi interventi sull’addome, che rendono le manovre impossibili.15
Nel caso del tumore rettale, inoltre si aggiunge la difficoltà che si ha nell’eseguire laparoscopicamente un’escissione mesorettale completa, dimostrato dal fatto che la curva di apprendimento per questo tipo di intervento è molto lenta. Come riportato in letteratura, il tasso di conversione raggiunge infatti il 38%, mostrando che questo gruppo di pazienti è clinicamente rilevante.16
Le ragioni che portano ad una conversione sono quindi varie. Volendo elencarle, le più frequenti sono: le dimensioni tumorali, la difficoltosa dissezione pelvica per presenza di una pelvi stretta (maschi) o dovuta agli effetti della radioterapia, le adesioni, l’obesità, le complicanze intraoperatorie, ecc.16
Nella comunità chirurgica sono nate delle preoccupazioni a riguardo delle conseguenze di queste conversioni intraoperatorie. È stato ipotizzato che un intervento iniziato in laparoscopia e poi convertito a tecnica a cielo aperto possa portare non solo ad un peggior decorso post-operatorio ma anche ad un peggior risultato oncologico a lungo termine. A riguardo di questo, i dati rimangono ancora discordanti.16
4. Chirurgia sincrona all’intervento per cancro rettale
In alcuni casi durante un intervento di resezione rettale, che sia resezione anteriore o amputazione addomino-perineale, si decide di intraprendere anche altri interventi in
sedi diverse. Più frequentemente si tratta di interventi sul fegato per presenza, a questo livello, di metastasi originate dal carcinoma rettale primitivo. Altre volte la chirurgia sincrona include interventi sull’utero e gli annessi, ad esempio se questi sono stati infiltrati da neoplasia (rimozione en bloc della massa tumorale). Abbiamo poi tutti quei casi in cui l’ulteriore chirurgia, fatta sincronicamente a quella rettale, non ha nessun collegamento con la patologia oncologica ma si è resa necessaria per altri motivi, ad esempio colecistectomie, appendicectomie, ernioplastiche, ecc.
Bisogna infine menzionare la possibilità di creare un danno a qualche struttura addominale durante l’intervento sul retto, ad esempio una soluzione di continuo su un’ansa del tenue che ovviamente necessiterà di una riparazione. Questa può essere considerata un esempio di chirurgia sincrona.
A riguardo della chirurgia epatica per le metastasi da carcinoma rettale è ancora in atto una discussione, in particolar modo centrata sul tempismo chirurgico. Essendo circa il 20% i pazienti che presentano metastasi epatiche sincrone alla diagnosi, e il 30-40% i pazienti che le sviluppano nel follow-up, è facile capire come il problema della gestione di questi casi sia clinicamente significativo.17 Storicamente questi pazienti venivano sottoposti ad un primo intervento di resezione rettale, a cui seguiva la terapia sistemica chemioradioterapica di circa 6 mesi. L’intervento sul fegato veniva preso in considerazione solo in un secondo momento al fine di selezionare meglio i pazienti da indirizzare verso questo trattamento potenzialmente rischioso. Recenti evidenze suggeriscono invece che la resezione simultanea di retto e metastasi epatiche sia l’opzione migliore perché evita di aspettare i 6 mesi o più di terapia adiuvante durante i quali le metastasi epatiche potrebbero ad esempio trasformarsi da resecabili a non resecabili.17 La questione però è ancora materia di dibattito.
5. Ileostomia di protezione
Abbiamo visto che nelle resezioni anteriori del retto si associa molto frequentemente la creazione di un'ileostomia, generalmente su bacchetta. Infatti, la deiescenza dell’anastomosi è una delle complicazioni più significative della resezione rettale per carcinoma e l’ileostomia escludente viene usata proprio per ridurre la morbidità
legata a queste complicanze. Nonostante ciò bisogna ricordare che il confezionamento dell’ileostomia a sua volta non è privo di complicanze.
La più comune sembra essere la disidratazione dovuta a eccessive perdite dalla stomia, che rappresenta una delle cause più frequenti di rientro in ospedale dopo la dimissione. Altra complicanza frequente è la diminuzione della filtrazione glomerulare, associata a rialzi della creatininemia, che può portare fino allo sviluppo di insufficienza renale acuta prerenale. Complicanze che possono essere associate alla necessità di un secondo intervento chirurgico sono rappresentate dall’occlusione o subocclusione intestinale, dalla necrosi, dal prolasso e dalla retrazione della stomia. Complicanza invece meno rilevante clinicamente ma molto fastidiosa per il paziente è la comparsa di irritazione cutanea vicino alla stomia. Questi pazienti con ileostomia inoltre sono a rischio di sviluppare complicanze associate al reintervento che porterà alla chiusura della stomia. Per finire bisogna menzionare quei pazienti in cui la chiusura dell’ileostomia non si riesce a mettere in pratica, facendo sì che la stomia diventi permanente.18
É importante anche ricordare che esistono molti altri tipi di stomia, ad esempio la colostomia terminale, che viene fatta in caso di amputazione addomino-perineale o nell’intervento di Hartmann.
SCOPO DELLA TESI
L’obiettivo che questa tesi si pone è di valutare la gestione e la qualità del trattamento di pazienti con diagnosi di cancro del retto che vengono presi in carico da un’unità chirurgica ad alto volume di interventi rettali. Andando ad analizzare in particolar modo i dati riguardanti le complicanze post-chirurgiche, le conversioni da tecnica laparoscopica a tecnica a cielo aperto e le recidive tumorali, si vuole delineare un quadro generale che faccia luce sul percorso che intraprendono i suddetti pazienti e permetta di valutarne anche la qualità.
MATERIALI E METODI
1. Selezione dei pazienti
Abbiamo selezionato retrospettivamente una serie consecutiva di 105 pazienti, su cui si è intervenuti chirurgicamente per cancro rettale, a partire da gennaio 2010 fino a dicembre 2011, nell’U.O. Chirurgia generale colon rettale dell’Azienda Ospedaliero Universitaria pisana, diretta dal Prof. Piero Buccianti.
Nella fase di selezione dei pazienti non si è dato peso né al tipo di intervento chirurgico, né alla stadiazione tumorale, né ad altre caratteristiche del paziente. La presenza di un carcinoma rettale e l’aver intrapreso un percorso terapeutico, comprendente un intervento chirurgico, all’interno della nostra unità sono quindi considerabili come gli unici criteri di inclusione di questo studio.
2. Raccolta dati
Dei pazienti selezionati, abbiamo raccolto i dati presenti nelle cartelle cliniche, nei registri operatori, all’interno del sistema informatico radiologico (RIS) e, per quanto riguarda il follow-up, ci siamo messi in contatto con l’U.O. Oncologia dell’Azienda
Ospedaliero Universitaria Pisana che ci ha permesso di raccogliere le informazioni all’interno delle proprie cartelle cliniche. I pazienti che non hanno svolto il follow-up o l’hanno svolto presso altre strutture ospedaliere sono stati invece contattati telefonicamente.
I dati raccolti sono numerosi e sono stati così raggruppati:
Anagrafici: Nome e cognome; Sesso; Data di nascita; Luogo di nascita. Anamnestici:
Manifestazione iniziale della malattia (o ricerca del sangue occulto risultata positiva)
Sunto della storia clinica;
Pregressi interventi sull’addome;
Condizioni associate.
Riguardanti la diagnosi e stadiazione del tumore:
Risultati della visita chirurgica (esplorazione digito-rettale);
Risultati degli esami strumentali (colonscopia, clisma opaco, ecografia transrettale, RMN pelvi, TC total body, PET, ecografia epatica, Rx torace, ecc.);
Risultati della biopsia;
Stadiazione clinica;
Valutazione del gruppo multidisciplinare (GOM);
Riguardanti l’intervento chirurgico svolto:
Operatore e data;
Durata;
Sede tumorale;
Intervento programmato e intervento eseguito;
Descrizione sommaria;
Metodi di identificazione intraoperatoria della lesione;
Tipo di anastomosi effettuata ed eventuale metodo di verifica della sua tenuta;
Eventuale creazione di un’ileostomia;
Eventuale causa della conversione da tecnica laparoscopica a quella a cielo aperto;
Escissione mesorettale completa (TME) o parziale (PME). Riguardanti il decorso post-operatorio:
Funzionamento dell’eventuale ileostomia;
Eventuali complicanze e loro gestione;
Eventuale reintervento chirurgico nel post-operatorio;
Durata del ricovero;
Eventuali complicanze dopo la dimissione;
Eventuale chiusura dell’ileostomia. Riguardanti il referto istologico:
Tipo istologico;
Grado istologico;
Stato dei linfonodi;
Margini chirurgici (prossimale, distale e radiale);
Grado di Quirke (valutazione dell’escissione mesorettale);
Gradi di regressione tumorale (TRG) secondo Dworack;
Riguardanti il follow-up:
Eventuale terapia adiuvante;
Andamento dei markers tumorali;
Risultati degli esami strumentali eseguiti;
Eventuale comparsa di recidive locali o sistemiche e loro gestione;
Status del paziente (vivente libera da malattia, vivente con malattia, deceduto).
Tutti i dati raccolti sono stati inseriti in un database ed elaborati utilizzando la statistica descrittiva.
RISULTATI
L’unità operativa in esame, nel periodo compreso tra il 2001 e il 2011, ha effettuato 279 interventi chirurgici per cancro del retto (Grafico 1)
Grafico 1: interventi chirurgici per cancro al retto effettuati tra il 2001 e il 2011. “tot”= totale; “Lap”= intervento laparoscopico; “Open”= intervento a cielo aperto; “RAR”= resezione anteriore del retto; “APR”=
amputazione addomino-perineale; “Hart”: resezione secondo Hartmann; “TME”: escissione mesorettale completa; “PME”= escissione mesorettale parziale.
Come si evince, il numero di interventi chirurgici sul retto è aumentato molto col passare degli anni, da 1 paziente operato nel 2001 fino a 64 pazienti operati nel 2011. Per avere un’idea più chiara dell’attività chirurgica svolta, raggruppiamo le varie tipologie di intervento: 0 10 20 30 40 50 60 70 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011
tot LapRAR+TME LapRAR+PME
LapAPR LapHart OpenRAR+TME
Grafico 2: confronto tra l’andamento nel tempo dell’approccio laparoscopico e di quello a cielo aperto. Grafico 3: confronto tra l’andamento nel tempo delle resezioni anteriori del retto e delle amputazioni addomino-perineali.
Nel Grafico 2 vediamo che gli interventi laparoscopici sono aumentati in misura progressivamente maggiore rispetto a quelli a cielo aperto, presumibilmente in rapporto all’aumentata esperienza dell’unità operativa e al richiamo maggiore di pazienti che questa ha comportato. La tecnica laparoscopica ha avuto un picco di frequenza negli ultimi due anni mentre la tecnica a cielo aperto si attesta su numeri bassi. In totale gli interventi sono stati svolti per il 78% in laparoscopia e per il 22% in laparotomia.
Nel Grafico 3, invece, possiamo vedere come la resezione anteriore del retto sia sempre stato l’intervento maggiormente effettuato, con un picco di frequenza, anche in questo caso, negli ultimi anni.
L’oggetto del nostro studio sono i 105 pazienti selezionati, operati tra gennaio 2010 e dicembre 2011, di cui 62 sono maschi e 43 sono femmine.
La maggioranza dei pazienti appartiene ad una fascia di età che va dai 60 agli 80 anni, con il 62% dei casi contenuti in questo intervallo. La media è di 67 anni; il paziente più giovane è stato operato a 33 anni, mentre il più anziano a 88 anni (Grafico 4). 0 10 20 30 40 50 60 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 interventi laparoscopici interventi a cielo aperto
0 10 20 30 40 50 60 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 RAR APR
Grafico 4: età, al momento dell’intervento, dei pazienti operati per cancro al retto tra il 2010 e il 2011.
La prima manifestazione clinica, ovvero il motivo per cui il paziente si è rivolto al medico ed è stato poi indirizzato verso i vari esami strumentali, è risultata, nella maggior parte dei pazienti, la presenza di sangue nelle feci, seguita dalle alterazioni delle abitudini alvine (i pazienti riferiscono di alternare da tempo periodi di stipsi a periodi di diarrea) mentre lo screening, ottenuto tramite la ricerca di sangue occulto nelle feci (RSO) o con tecnica endoscopica, è risultato solo al terzo posto (12% del totale) (Grafico 5). 3 6 17 32 33 14 0 5 10 15 20 25 30 35
30-39 anni 40-49 anni 50-59 anni 60-69 anni 70-79 anni 80-89 anni
NUME RO D I P A ZIE NTI
Grafico 5: manifestazione clinica iniziale del cancro rettale e relativo numero di pazienti.
La metà dei pazienti di questo campione (49%) aveva già subito interventi chirurgici addominali (Tabella 4).
PREGRESSI INTERVENTI SULL’ADDOME NUMERO DI PAZIENTI
Appendicectomia 12
Colecistectomia 10
Intervento per ernia inguinale, ombelicale o
epigastrica (complicata o meno) 10
Laparocele 2
Interventi sull’utero e/o sugli annessi 11
Interventi sullo stomaco e/o sul duodeno 4
Intervento sul retto e/o sul colon 2
Parto cesareo 6
Altri (duodenocefalopancreasectomia,
splenectomia, ecc.) 6
Tabella 4: tipologie di interventi chirurgici sull’addome e relativo numero di pazienti che vi si sono sottoposti, prima dell’intervento per cancro del retto.
1 1 3 4 5 9 29 57 13 0 10 20 30 40 50 60 Fistola retto-vaginale Iperpiressia Sub occlusione Dolore anale o addominale Tenesmo Anemizzazione Alterazioni dell’alvo (stipsi/diarrea) Rettorragia Screening (RSO+ o endoscopia)
NUMERO DI PAZIENTI
Manifestazione iniziale della malattia
Gli interventi maggiormente riscontrati all’anamnesi sono stati la colecistectomia, gli interventi di ernioplastica (essenzialmente inguinale), l’appendicectomia e gli interventi sull’utero e/o sugli annessi uterini.
L’8% dei pazienti (n=8) era già stato trattato per un cancro del retto mentre il restante 92% è stato trattato per la prima volta. Tra gli 8 pazienti già trattati, in 3 casi possiamo parlare di recidiva tumorale, in 4 casi si parla di intervento in due tempi e infine abbiamo 1 caso in cui si sospettava una recidiva, seguente a pregressa resezione anteriore del retto, invece il referto istologico non ha trovato tracce di neoplasia.
I 3 casi di recidiva si sono presentati in seguito a: Una pregressa escissione locale;
Una pregressa TEM (microchirurgia endoscopica transanale);
Una pregressa colectomia totale (in paziente con diagnosi di poliposi adenomatosa familiare).
I casi classificabili come intervento in due tempi sono quelli in cui c’è stato un primo intervento locale, poi il referto istologico ha indicato la presenza di un adenocarcinoma infiltrante e si è dovuto agire in un secondo momento con una chirurgia resettiva più radicale. In 2 casi era già stata fatta un’asportazione locale del polipo e negli altri 2 casi era già stata fatta una TEM.
La terapia neoadiuvante è stata effettuata in oltre la metà dei pazienti (n=56, 53%); di questi, 52 hanno fatto radiochemioterapia, mentre 4 solo trattamento chemioterapico. I restanti 49 pazienti sono stati indirizzati direttamente all’intervento chirurgico. Tra questo secondo gruppo di pazienti, troviamo 36 casi in cui il tumore presentava una bassa stadiazione (T1-T2, N0) e non necessitava quindi di terapia neoadiuvante e 13 casi in cui, pur trovandosi davanti ad un tumore di stadiazione maggiore, si è comunque deciso di intraprendere primariamente un trattamento chirurgico resettivo. Il motivo di questa scelta è stato, in 11 casi, la presenza di controindicazioni al trattamento preoperatorio e in 2 casi la presenza di un tumore sintomatico (subocclusione) che richiedeva una terapia chirurgica immediata.
Tra i 36 pazienti che non hanno eseguito trattamento neoadiuvante, perché il carcinoma presentava un basso stadio alla stadiazione clinica, in 24 casi la bassa stadiazione è stata confermata anche all’esame istologico post-operatorio, nei restanti 12, invece, l’esame istologico ha indicato uno stadio tumorale maggiore.
Tra gli 11 pazienti che avevano controindicazioni alla radiochemioterapia, 7 di essi avevano controindicazioni solo nell’effettuarla prima di un intervento chirurgico e difatti sono stati sottoposti in seguito a trattamento adiuvante; gli altri 4 avevano controindicazioni assolute.
I pazienti su cui si è intervenuti chirurgicamente senza una diagnosi istologica di malignità sono 12 (11%). In 9 casi l’esame istologico successivo all’intervento ha evidenziato la presenza di un adenocarcinoma, negli altri 3 casi invece la diagnosi è stata di displasia di varia gravità, come quella preoperatoria.
La durata dell’intervento chirurgico, calcolata dal momento in cui si fa la prima incisione sull’addome al momento in cui viene dato l’ultimo punto di sutura alla fine dell’intervento, è compresa, nella maggior parte dei casi (64%), tra i 200 e i 350 minuti. La media è di 280 minuti e la durata più frequentemente riscontrata, quindi la moda, è di 200 minuti. L’intervento più breve è stato di 135 minuti mentre il più lungo di 500 minuti (Grafico 6)
Grafico 6: durata degli interventi chirurgici e relativo numero di pazienti.
La sede del tumore rettale è risultata: distale, definita come la porzione che fa seguito al canale anale e arriva fino a 5 cm compresi dal margine anale, nel 28% dei casi (n=29); media, definita come la parte che va dalla fine del retto distale a 10 cm compresi di distanza dal margine anale nel 34% (n=36); prossimale, definita come la parte che va dalla fine del retto medio fino al sigma, nel 38% dei casi (n=40). (Grafico 7).
Grafico 7: Percentuali dei vari tipi di carcinoma rettale in base alla sede. 1 3 10 7 20 19 28 15 2 0 5 10 15 20 25 30 ≥ 500 minuti 450-499 minuti 400-449 minuti 350-399 minuti 300-349 minuti 250-299 minuti 200-249 minuti 150-199 minuti 100-149 minuti NUMERO DI PAZIENTI
Durata dell'intervento
38% 34% 28%SEDE DEL CARCINOMA
RETTO ALTO RETTO MEDIO RETTO BASSO
Come visto, la sede del tumore rettale è determinata in base alla distanza in centimetri dal margine anale. Poiché il retto ha un decorso tortuoso, la misurazione più precisa si ottiene con il rettoscopio rigido.
Per i carcinomi distali, in particolare, la distanza dal margine anale è molto importante perché condiziona il tipo di intervento chirurgico da svolgere. Purtroppo il dato riguardante questa distanza in centimetri in quasi la metà dei casi non è stato recuperabile. (Tabella 5).
DISTANZA DAL MARGINE ANALE NUMERO DI PAZIENTI
≤ 2 cm 4
2 – 4 cm 4
≥ 4 cm 8
ND 13
Tabella 5: distanza in centimetri dal margine anale dei carcinomi localizzati nel terzo inferiore del retto. (ND: non disponibile).
L’intervento chirurgico effettuato è stato una resezione anteriore in 86 casi (82%), un’amputazione addomino-perineale in 18 casi (17%) e in un unico caso un intervento secondo Hartmann (1%).
Gli interventi a cielo aperto sono stati 17 (16% del totale), gli interventi laparoscopici sono stati 74 (71%) quelli svolti interamente in laparoscopia, 14 (13%) quelli in cui l’approccio iniziale è stato laparoscopico e poi è stato necessario convertire l’intervento verso una laparotomia. (Tabella 6).
INTERVENTO Laparoscopico A cielo aperto Convertito TOTALE
RAR
TME PME TME PME TME PME
86
54 6 11 3 12 /
APR 13 3 2 18
Sec. Hartmann 1 / / 1
TOTALE 74 17 14 105
Tabella 6: confronto tra tipologia di approccio chirurgico (laparoscopico, a cielo aperto, convertito) e tipologia di intervento effettuato (RAR, APR, Hartmann).
Appare chiaro che la resezione anteriore del retto laparoscopica è l’intervento più frequentemente effettuato, mentre l’amputazione addomino-perineale laparotomica è quella eseguita meno di frequente. La resezione rettale secondo Hartmann viene effettuata solo in casi eccezionali.
Per le resezioni anteriori è stato indicato anche il grado di escissione mesorettale: completa (TME) in 77 pazienti (90% di tutte le RAR) e parziale (PME) negli altri 9 (10% di tutte le RAR).
Gli interventi possono essere raggruppati in base alla sede tumorale (Tabella 7). SEDE DEL CARCINOMA INTERVENTO NUMERO DI PAZIENTI TOTALE ILEOSTOMIA RETTO ALTO (RAR e un intervento di Hartmann) Laparoscopico TME 26 32 40 33/40 PME 6
A cielo aperto TME 3 6 PME 3 Convertito TME 2 2 PME / RETTO MEDIO (RAR) Laparoscopico TME 22 22 36 36/36 PME /
A cielo aperto TME 6 6 PME / Convertito TME 8 8 PME / RETTO BASSO RAR Laparoscopico TME 7 7 11 29 11/11 PME /
A cielo aperto TME 2 2 PME / Convertito TME 2 2 PME / APR Laparoscopico 13 13 18 / A cielo aperto 3 3 Convertito 2 2
Tabella 7: Tipologia di intervento e di approccio chirurgico usata in base alla sede del tumore rettale. Nell’ultima colonna sono indicati i pazienti in cui è stata creata un’ileostomia.
Da questa tabella possiamo vedere come le amputazioni addomino-perineali vengano effettuate solo in caso di carcinomi rettali bassi. L’escissione mesorettale parziale è stata effettuata solo per alcuni carcinomi del terzo prossimale del retto. L’approccio laparoscopico è il più frequente, indipendentemente dalla sede.
L’ilestomia è stata fatta in 80 degli 86 pazienti sottoposti a RAR (quindi nel 93%); solo una è stata creata per necessità, tutte le altre erano state programmate già prima dell’intervento. Nei restanti 6 pazienti, la sede intraperitoneale del tumore ha permesso di evitare il confezionamento di un’ileostomia escludente a protezione dell’anastomosi. Solo in 1 di questi 6 pazienti si è dovuto confezionare l’ileostomia per necessità in un secondo momento (II giornata post-operatoria).
La verifica della tenuta dell’anastomosi, tra questi 86 casi, è stata fatta solo in 7 pazienti (8% del totale) con il metodo idropneumatico. In 1 di questi la verifica dimostra una piccola perdita del bordo laterale destro dell’anastomosi che viene suturata. I 7 pazienti in cui è stata fatta la verifica dell’anastomosi rappresentano i casi in cui l’ileostomia di protezione non era stata programmata prima dell’intervento. Il paziente in cui l’ileostomia è stata creata per necessità durante l’intervento è infatti l’unico paziente in cui, alla verifica dell’anastomosi, si è dimostrata la presenza di una piccola perdita
Nelle resezioni anteriori le anastmosi effettuate sono state di tre tipi: Colo-rettale termino-terminale: 75 pazienti (87%);
Colo-rettale termino-laterale: 5 pazienti (6%);
Colo-anale: 6 pazienti (7%), di cui 3 per un carcinoma distale e 3 per un carcinoma medio.
Durante l’intervento chirurgico per identificare la lesione sono stati usati vari metodi (questo dato è disponibile solo in 59 dei 105 casi studiati):
Visione diretta: 43 pazienti; Tatuaggio in china: 11 pazienti; Strumento endoscopico: 5 pazienti.
La conversione da intervento laparoscopico ad intervento a cielo aperto abbiamo visto che ha interessato 14 pazienti. Questo significa che tra tutti gli interventi cominciati in laparoscopia (88 casi) il 16% è stato terminato con tecnica a cielo aperto.
Le cause di questa conversione, che è stata sempre di necessità nella nostra casistica, sono elencate nella Tabella 8.
CAUSE DELLA CONVERSIONE
Difficoltà anatomiche (4 casi)
Pelvi stretta e adipe molto rappresentato; Scavo pelvico inaccessibile;
Difficoltosa mobilizzazione laparoscopica;
Difficoltosa apposizione della suturatrice meccanica nel canale anale;
Ostacoli tecnici (6 casi)
Difficoltosa mobilizzazione per presenza di molte aderenze viscero-viscerali e viscero-parietali nella pelvi (pregressi interventi: isteroannessiectomia);
Difficoltosa mobilizzazione del tenue, che non rende possibile la visualizzazione dell’arteria e vena mesenterica (pregressi
interventi: colecistectomia);
Difficoltà tecniche (pregressi interventi: appendicectomia); Difficoltosa liberazione del retto dalla prostata per presenza della
neoplasia;
Dissezione difficoltosa del mesoretto (2)
Eventi
intraoperatori inattesi (4 casi)
Necessità di intervenire su le multiple stenosi ileali presenti; Necessità di chiudere la piccola soluzione di continuo che si è
creata sul tenue durante la lisi delle abbondanti aderenze (pregressi interventi: nefrectomia);
Necessità di intervenire su un nodulo scoperto a livello digiunale; Necessità di rimuovere per via colotomica un polipo del colon
trasverso;
Tabella 8: numero e cause delle conversioni da intervento laparoscopico ad intervento laparotomico.
Ci sono stati dei casi in cui l’intervento è stato convertito a causa delle caratteristiche anatomiche del paziente, che rendevano molto difficili le manovre laparoscopiche, quindi si tratta di complicanze potenzialmente prevedibili anche da prima dell’intervento. Per quanto riguarda gli ostacoli tecnici, anche questi a volte
prevedibili, vediamo che in 3 dei 6 casi il paziente aveva già subito interventi sulla cavità addominale. Infine abbiamo i 4 casi in cui la conversione si è resa necessaria per eventi inattesi e non prevedibili prima dell’intervento.
Tra i pazienti con pregressi interventi addominali in cui è stata necessaria una conversione intraoperatoria, solo in un caso la chirurgia pregressa aveva interessato una zona contigua a quella rettale (isteroannessiectomia) e poteva essere quindi considerata come fattore di rischio di una conversione. Negli altri casi, gli interventi effettuati precedentemente erano stati a carico di strutture lontane dal retto (colecistectomia, appendicectomia, nefrectomia) e quindi difficilmente considerabili come potenziali fattori di rischio.
Oltre alle 14 conversioni, abbiamo altri due casi in cui l’intervento si è concluso in maniera diversa da quello che si era programmato. Si tratta di due pazienti con cancro del retto distale in cui si era previsto di poter effettuare una resezione anteriore con creazione di un’anastomosi ma durante l’intervento si è reso necessario effettuare un’amputazione addomino-perineale a causa di una maggiore estensione tumorale rispetto al previsto.
In 31 pazienti, contemporaneamente all’intervento rettale, si è effettuata una chirurgia accessoria, a carico di altri distretti (Tabella 9).
INTERVENTI SINCRONI A
QUELLO RETTALE
CAUSE
Legate al cancro rettale
CAUSE Non legate al cancro
rettale
T O T
Interventi sul fegato
Resezione di lesioni ripetitive
9
Drenaggio di ascesso
per colecistite acuta 1 11 Biopsia su lesione
sospetta 1
Colecistectomia /
Patologia sintomatica o meno della colecisti, non neoplastica 8 8 Resezione di un’ansa del tenue / Presenza di un GIST 1 3 Presenza di un tratto colpito da malattia di Chron 1 Creazione di una sol. di continuo su un’ansa durante l’intervento 1 Ernioplastica / Ernie inguinali, ombelicali o epigastriche 4 4 Asportazione di milza accessoria / Presenza di milza accessoria 3 3 Asportazione colotomica di un polipo / Presenza di un polipo (adenoma) 3 3
Resezione del colon
trasverso / Presenza di una fistola 1 1
Interventi sull’utero e/o annessi Isteroannessiectomia per infiltrazione neoplastica 1 Asportazione di un fibroma uterino 1 2 Linfoadenectomia
iliaca, della fossa otturatoria, aortica. Infiltrazione neoplastica 2 / 1 Altro / Surrenectomia, asportazione di tumefazione cervicale, ecc. 8 8 TOT 13 32 45