A
AllmmaaMMaatteerrSSttuuddiioorruumm––UUnniivveerrssiittààddiiBBoollooggnnaa
Università degli Studi di Perugia (sede consorziata)
DOTTORATO DI RICERCA IN
SCIENZE E BIOTECNOLOGIE DEGLI ALIMENTI
Ciclo XXIV
Settore Concorsuale di afferenza: 07/F1 Settore Scientifico disciplinare: AGR/15
TITOLO TESI
INDIVIDUAZIONE E CARATTERIZZAZIONE DEI
PRODOTTI DI DEGRADAZIONE OSSIDATIVA DEI
SECOIRIDOIDI CONTENUTI NELL’OLIO VERGINE DI
OLIVA MEDIANTE TECNICHE ANALITICHE
INNOVATIVE
Presentata da: Dott.ssa Ilona Di Maio
Coordinatore Dottorato Relatore
1 INTRODUZIONE 3
1.1 L’olio d’oliva: composizione chimica 4
1.2 I composti fenolici dell’oliva e dell’olio 5
1.2.1 Trasformazione dei composti fenolici 12
1.3 Proprietà biologiche dei polifenoli dell’olio vergine di oliva 16
1.3.1 Proprietà sensoriali 16
1.3.2 Proprietà salutistiche 17
1.3.3 Attività antiossidante 21
1.4 Analisi quali-quantitativa delle sostanze fenoliche dell’olio vergine di
oliva 26
1.4.1 Analisi qualitativa dei prodotti di ossidazione delle sostanze fenoliche 29
1.5 Applicazione della spettrometria di massa in campo alimentare e
biochimico 31
2 SCOPO DELLA TESI 36
3 MATERIALI E METODI 37
3.1 Campioni 37
3.2 Reagenti 37
3.3 Reazione di ossidazione di Fenton (Fe2+/H2O2) 38
3.4 Reazione di ossidazione enzimatica 38
3.6 Analisi HPLC-DAD-ESI-MS 40
3.6.1 Analisi Ultra High Definition (UHD) Accurate–Mass Q–TOF LC/MS 41
4 RISULTATI E DISCUSSIONE 42
4.1 p-HPEA (1) 42
4.1.1 Reazione di ossidazione enzimatica 42
4.1.2 Reazione di ossidazione di Fenton (Fe2+/H2O2) 48
4.2 3,4-DHPEA (2) 49
4.2.1 Reazione di ossidazione enzimatica 49
4.2.2 Reazione di ossidazione di Fenton (Fe2+/H2O2) 51
4.3 3,4-DHPEA-EDA (1a) 57
4.3.1 Reazione di ossidazione enzimatica 57
4.3.2 Reazione di ossidazione di Fenton (Fe2+/H2O2) 61
4.4 Olio vergine di oliva 62
4.4.1 Prodotti di ossidazione dell’olio vergine di oliva durante il processo di
autossidazione 62
5 CONCLUSIONI 77
1 INTRODUZIONE
Un po’ di storia…
L’origine della coltivazione dell’ulivo, pianta tipica del Mediterraneo, si colloca nella notte dei tempi. Ricerche archeologiche datano V millennio a.C. le prime piante in Israele; è infatti, nella Genesi la testimonianza più antica dell’esistenza dell’ulivo.
Molto più tardi (V secolo a.C.), Grecia, Turchia, Siria e Palestina fecero dell’olio d’oliva la fonte primaria della loro civiltà e della loro ricchezza. E’ proprio con la colonizzazione greca dell’Italia Meridionale, a partire dall’VIII sec. a.C., che la coltivazione dell’ulivo viene introdotta in quella che era la Magna Grecia.
Saranno poi i Romani a diffondere in tutto il loro Impero la coltivazione dell’ulivo il cui prodotto finirà per assicurare un ruolo sempre più sostanziale nell’economia generale dell’Impero.
Ancora oggi il nostro paese rientra tra le tre più importanti nazioni al mondo per la produzione di olio d’oliva (Alonso-Salces et al., 2010).
I gusti e i sapori degli oli italiani sono molto diversi e hanno una notevole peculiarità a seconda della regione di provenienza, dall’Italia settentrionale con un olio dal gusto abbastanza pronunciato e fruttato, all’Italia meridionale con un olio dal gusto e sapore pieno e deciso.
Ciò che contraddistingue la qualità dell’olio d’oliva sono sicuramente gli aspetti organolettici e sensoriali facilmente percepibili dal consumatore: l’olio per essere giudicato di qualità deve soddisfare certe esigenze; esigenze sicuramente nutrizionali, ma che abbracciano anche l’aspetto edonistico e culturale. La qualità nutrizionale risponde al requisito attualmente auspicato a diversi livelli “mangiare bene per stare bene”. L’olio infatti, possiede una composizione in macro e microelementi ottimale per la fisiologia umana per la presenza di principi attivi salutistici in particolare caroteni, tocoli e sostanze fenoliche che per le loro
caratteristiche di antiossidanti naturali rivestono un ruolo fondamentale nella nostra dieta (Owen et al., 2000; Servili et al., 2009).
1.1 L’olio d’oliva: composizione chimica
La gran parte della composizione chimica dell’olio vergine d’oliva è data dalla frazione saponificabile dei gliceridi che rappresenta più del 98% del suo peso totale. La restante parte della composizione è data dalla frazione cosi detta dei costituenti minori, che rappresenta con le sue 230 sostanze chimiche tra alcoli alifatici e triterpenici, steroli, idrocarburi, composti volatili e sostanze antiossidanti, il 2% in peso dell’olio. I maggiori composti antiossidanti dell’olio vergine di oliva sono i carotenoidi e i polifenoli che includono fenoli lipofili ed idrofili (Boskou, 1996; Shahidi, 1996).
Tra i carotenoidi maggiore importanza rivestono il β-carotene e la luteina, per quanto riguarda i fenoli lipofili, gli oli estratti dalle olive contengono quasi esclusivamente tocoferoli, in particolare l’α-tocoferolo, che oltre a svolgere la sua attività di antiossidante, possiede proprietà vitaminiche (Cortesi et al., 1997).
La concentrazione dei tocoferoli nell’olio dipende principalmente dallo stato di maturazione del frutto al momento della raccolta. E’ stato, infatti, evidenziato come quanto più la maturazione è avanzata, tanto minore è la concentrazione dei tocoferoli nell’olio d’oliva (García et al., 1996). A differenza dei tocoferoli, che sono contenuti anche in altri oli vegetali, alcuni fenoli idrofili sono caratteristici dell’olio vergine di oliva, e gli conferiscono peculiari proprietà sensoriali e salutistiche che lo rendono un prodotto unico (Boskou, 1996; Shahidi, 1996).
1.2 I composti fenolici dell’oliva e dell’olio
L’olio vergine di oliva contiene specifiche classi di fenoli idrofili tra cui acidi e alcoli fenolici, idrossi–isocromani, flavonoidi, secoiridoidi e lignani (Tabella 1).
Tabella 1. Composti fenolici presenti nell’olio vergine di oliva.
Gli acidi fenolici rappresentati da acido caffeico, vanillico, siringico, p-cumarico, o-cumarico, protocatetico, sinapico, p-idrossibenzoico e gallico, sono il primo gruppo di composti fenolici trovati nell’olio vergine di oliva (Montedoro et al., 1992a; Tsimidou et al., 1996; Servili et al., 2004) (Fig.1).
Acidi fenolici e derivati Alcoli Fenolici
(3,4-Diidrossifenil)etanolo (3,4 DHPEA) Acido Vanillico (p-Idrossifenil)etanolo (p-HPEA) Acido Siringico (3,4-Diidrossifenil)etanolo-Glucoside Acido p-Cumarico
Acido p-Cumarico Lignani Flavonoidi
Acido Gallico
Acido Caffeico (+)-1-Acetossipinoresinolo Apigenina
Acido Protocatechico (+)-Pinoresinolo Luteolina
Acido p-Idrossibenzoico Acido Ferulico
Acido Cinnammico
4-(acetossietil)-1,2-diidrossibenzene Acido Benzoico
Derivati dei Secoiridoidi
Forma dialdeidica dell' acido decarbossimetil elenolico legato al 3,4-DHPEA ( 3,4 DHPEA-EDA) Forma dialdeidica dell'acido decarbossimetil elenolico legato al p-HPEA (p-HPEA-EDA) Oleuropeina Aglicone (3,4 DHPEA-EA)
Ligustroside Aglicone
Oleuropeina Aglicone (3,4 DHPEA-EA) p-HPEA-Derivati
Forma dialdeidica dell'oleuropeina aglicone Forma dialdeidica del ligustroside aglicone
Figura 1. Struttura chimica dei principali acidi fenolici: acido benzoico [I], acido p-idrossibenzoico [II], acido vanillico [III], acido protocatechico [IV], acido siringico [V], acido gallico [VI], acido cinnamico [VII], acido p-cumarico [VIII], acido o-cumarico [IX], acido caffeico [X], acido ferulico [XI].
Alla classe degli alcoli fenolici appartengono l’idrossitirosolo (3,4-diidrossifenil)etanolo detto anche 3,4-DHPEA e il tirosolo (p-idrossifenil)etanolo detto anche p-HPEA (Montedoro et al., 1992a). Gli acidi fenolici insieme agli alcoli, agli idrossi-isocromani e ai flavonoidi (apigenina, luteolina) sono contenuti in minore quantità nell’olio vergine di oliva rispetto ai secoiridoidi e ai lignani (Bianco et al., 2001).
I lignani includono (+)-1-acetossipinoresinolo e (+)-pinoresilnolo (Owen et al., 2000; Brenes et al., 2000a; Servili et al., 2009) (Fig. 2). Questi composti sono contenuti nella polpa di oliva e nella porzione legnosa del seme, vengono trasferiti nell’olio durante il processo di estrazione meccanica. La loro concentrazione nell’olio è fortemente influenzata dalle condizioni agronomiche di coltivazione degli ulivi, mentre a differenza dei secoiridoidi non risente dei parametri tecnologici di estrazione (Servili et al., 2004).
Figura 2. Struttura chimica dei lignani presenti nell’olio vergine di oliva: I (+)-1-acetossipinoresinolo II (+)-1-pinoresinolo (Owen et al., 2000).
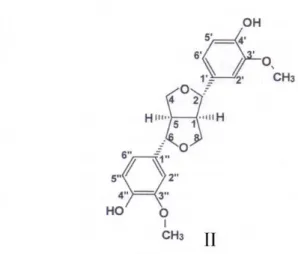
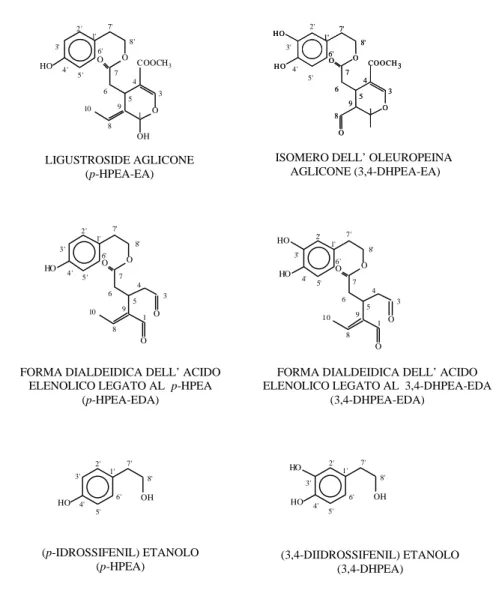
I secoiridoidi sono i composti prevalenti dell’olio vergine d’oliva, sono infatti contenuti in maggiore quantità nell’olio, dove ritroviamo in particolare, la forma dialdeidica dell’acido decarbossimetil elenolico legato all’ idrossitirosolo o al tirosolo (3,4-DHPEA-EDA o p-HPEA-EDA), un isomero dell’oleuropeina aglicone (3,4-DHPEA-EA) e il ligustroside aglicone (p-HPEA-EA) (Montedoro et al.,
1992a; Montedoro et al., 1992b; Montedoro et al., 1993; Angerosa et al., 1996; Owen et al., 2000) (Fig. 3).
Figura 3. Struttura chimica dei secoiridoidi derivati e dei fenil-alcoli presenti nell’olio vergine di oliva (Servili et al., 2009).
Queste sostanze sono derivati agliconici dei secoiridoidi glucosidi contenuti nel frutto dell’oliva, si originano durante il processo di estrazione meccanica dell’olio a
LIGUSTROSIDE AGLICONE (p-HPEA-EA) O 8' 7' 1' 2' 3' 4' 5' 6' 7 6 5 4 3 1 9 8 10 O HO O O O 8' 7' 1' 2' 3' 4' 5' 6' 7 6 5 4 3 1 9 8 10 O HO O O HO 8' 7' 1' 2' 3' 4' 5' 6' HO HO OH 8' 7' 1' 2' 3' 4' 5' 6' HO OH
ISOMERO DELL’ OLEUROPEINA AGLICONE (3,4-DHPEA-EA) O 8' 7' 1' 2' 3' 4' 5' 6' 7 6 5 4 3 1 9 8 10 COOCH3 O O OH HO O 8' 7' 1' 2' 6' 7 6 5 4 3 1 9 8 COOCH3 HO O O O H O O 8' 7' 1' 6' 7 6 5 4 3 1 9 8 COOCH3 HO O O O H O 3' 4' 5'
FORMA DIALDEIDICA DELL’ ACIDO ELENOLICO LEGATO AL p-HPEA
(p-HPEA-EDA)
FORMA DIALDEIDICA DELL’ ACIDO ELENOLICO LEGATO AL 3,4-DHPEA-EDA
(3,4-DHPEA-EDA)
(p-IDROSSIFENIL) ETANOLO (p-HPEA)
(3,4-DIIDROSSIFENIL) ETANOLO (3,4-DHPEA)
partire dall’oleuropeina, demetil oleuropeina e dal ligustroside per idrolisi catalizzata dalle β-glucosidasi endogene (Montedoro et al., 2002).
La drupa infatti, contiene alte concentrazioni di composti fenolici che possono raggiungere valori compresi tra 1 e 3% del peso fresco della polpa (Garrido Fernández et al., 1997). Come riportato nella tabella 2, le classi più importanti di fenoli idrofili presenti nella drupa sono acidi fenolici, in particolare i derivati dell’acido benzoico a struttura C6-C1 e dell’acido cinnamico a struttura C6-C3 (Garrido Fernández et al., 1997), alcoli fenolici, flavonoidi e secoiridoidi. Il 3,4-DHPEA e il p-HPEA sono i fenil alcoli più abbondanti (Addis, 1986; Haigh,1986); la loro concentrazione è generalmente bassa nell’olio fresco e tende ad aumentare durante la fase di stoccaggio (Montedoro et al., 1992a) per effetto dell’idrolisi a carico dei secoiridoidi quali 3,4-DHPEA-EDA, p-HPEA-EDA e 3,4-DHPEA-EA.
Tabella 2. Principali classi di composti fenolici idrofili del frutto
Antociani Flavonoidi
Cianidina-3-glucoside Quercetina-3-rutinoside
Cianidina-3-rutinoside
Cianidina-3-caffeilglucoside Flavoni
Cianidina-3-caffeilrutinoside Luteolina-7-glucoside Delfinidina 3-ramnosioglucoside-7-xilosio Luteolina-5-glucoside Apigenina-7-glucoside
Acidi Fenolici
Acido clorogenico Alcoli Fenolici
Acido caffeico (3,4-Diidrossifenil)etanolo (3,4 DHPEA)
Acido p -idrossibenzoico p-(Idrossifenil)etanolo (p-HPEA)
Acido protocatechico
Acido vanillico Secoiridoidi
Acido siringico Oleuropeina
Acido p-cumarico Demetioleuropeina
Ligustroside
Acido ferulico Nüzhenide
Acido sinapico Acido benzoico
Acido cinnammico Derivati dell' Acido Idrossicinnamico
Acido gallico Verbascoside
Acido o-cumarico Antociani Flavonoidi Cianidina-3-glucoside Quercetina-3-rutinoside Cianidina-3-rutinoside Cianidina-3-caffeilglucoside Flavoni Cianidina-3-caffeilrutinoside Luteolina-7-glucoside Delfinidina 3-ramnosioglucoside-7-xilosio Luteolina-5-glucoside Apigenina-7-glucoside
Acidi Fenolici
Acido clorogenico Alcoli Fenolici
Acido caffeico (3,4-Diidrossifenil)etanolo (3,4 DHPEA)
Acido p -idrossibenzoico p-(Idrossifenil)etanolo (p-HPEA)
Acido protocatechico
Acido vanillico Secoiridoidi
Acido siringico Oleuropeina
Acido p-cumarico Demetioleuropeina
Ligustroside
Acido ferulico Nüzhenide
Acido sinapico Acido benzoico
Acido cinnammico Derivati dell' Acido Idrossicinnamico
Acido gallico Verbascoside
I flavonoidi includono flavoni glucosidi come la luteolina 7-glucoside e la rutina, e gli antociani come la cianidina e la delfinidina glucoside (Servili et al., 2006). Mentre i flavonoidi, gli alcoli e gli acidi fenolici si possono ritrovare in diverse famiglie botaniche i secoiridoidi, al contrario, sono esclusivi delle specie appartenenti alla famiglia delle Oleaceae.
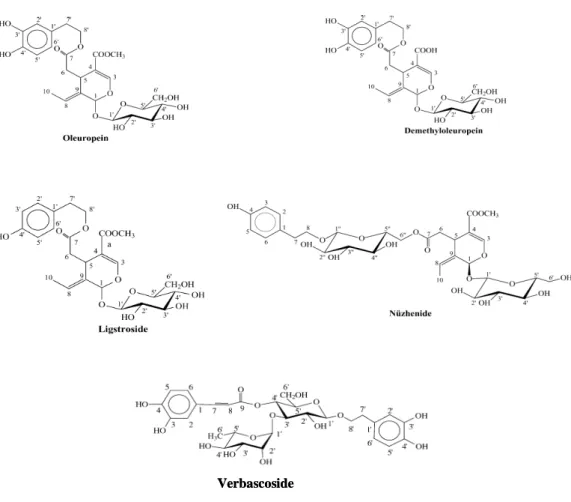
I composti fenolici classificati come secoiridoidi sono caratterizzati dalla presenza, nella loro struttura molecolare, dell’acido elenolico o di suoi derivati (Garrido Fernández et al., 1997). L’oleuropeina, la demetiloleuropeina, il ligustroside e il nüzhenide sono i secoiridoidi più abbondanti della drupa. (Gariboldi et al., 1986; Garrido Fernández et al., 1997). Panizzi et al. (1960) hanno assegnato la struttura chimica all’oleuropeina, la demetiloleuropeina è stata isolata e caratterizzata per la prima volta da Ragazzi et al. (1973), mentre il ligustroside da Kubo e Matsumoto (1984) (Fig. 4). L’oleuropeina, il ligustroside aglicone e le loro forme dialdeidiche sono stati identificati anche come fenoli idrofili minori dell’olio vergine di oliva (Perri et al., 1999; Owen et al., 2000; Rovellini et al., 2002). Il frutto, tra i composti fenolici principali, contiene anche il verbascoside, un derivato dell’acido idrossicinnamico che contiene il 3,4-DHPEA nella sua struttura molecolare (Servili et al., 1999a), assegnata da Andary et al. (1982) e confermata da Servili et al. (1999b) (Fig. 1). Ryan et al. (1999) hanno identificato nel frutto dell’oliva diverse forme isomeriche del verbascoside. L’oleuropeina, la demetiloleuropeina e il verbascoside sono contenuti principalmente nella polpa, ma si ritrovano anche nelle altre parti costitutive del frutto, buccia e seme, mentre il nüzhenide, caratterizzato da Servili et al. (1999b) (Fig. 4) è stato ritrovato solo nel seme. Diversi derivati agliconici dell’ oleuropeina e della demetiloleuropeina, come la forma dialdeidica dell’acido decarbossimetil elenolico legata al 3,4-DHPEA (3,4-DHPEA-EDA) e un isomero dell’oleuropeina aglicone (3,4-DHPEA-EA) sono stati identificati nella polpa delle olive anche se in quantità decisamente ridotte rispetto ai più abbondanti secoiridoidi glucosidi (oleuropeina e demetiloleuropeina) (Servili et al., 1999b; Romani et al., 1999; Ryan et al., 2003).
Figura 4. Struttura chimica dei secoiridoidi del frutto
La concentrazione delle sostanze fenoliche è largamente influenzata dalle condizioni agronomiche e tecnologiche di produzione dell’olio vergine di oliva. In particolare varietà, stadio di maturazione, origine geografica delle olive e pratiche di irrigazione degli ulivi, sono i principali aspetti agronomici che possono modifcare la composizione in secoiridoidi dell’olio vergine di oliva. Le fasi critiche del processo di estrazione meccanica dell’olio invece, sono la frangitura, la gramolatura e la separazione che causano una grande variazione della concentrazione dei secoiridoidi dell’olio vergine di oliva (Servili et al., 2004; Servili et al., 2007a; Servili et al., 2007b).
Verbascoside Verbascoside
La presenza delle sostanze fenoliche idrofile nell’olio vergine di oliva è un aspetto fondamentale della sua qualità che è strettamente correlata con numerose e specifiche funzioni di questi composti. Alcune sostanze fenoliche dell’olio hanno un’elevata incidenza sulla sua resistenza all’ossidazione e quindi sua shelf-life (Servili et al., 2006). I risultati sperimentali ottenuti hanno evidenziato che la stabilità dell’olio all’ossidazione è legata ai derivati dell’oleuropeina e della demetiloleuropeina, mentre l’incidenza di altri componenti quali i tocoferoli, i lignani e i derivati del ligustroside risulta, in questo contesto, marginale (Servili et al., 2009).
1.2.1 Trasformazione dei composti fenolici
La presenza dei fenoli idrofili nell’olio vergine di oliva è strettamente legata all’attività di diversi enzimi endogeni del frutto; perciò la loro concentrazione nell’olio oltre che ad essere influenzata da diversi fattori agronomici quali cultivar, maturazione del frutto, condizioni pedo-climatiche di produzione, e pratiche di irrigazione (Uceda et al., 1999; Tovar et al., 2001; Garcia-Gonzalez et al., 2010) dipende fortemente dalle condizioni di estrazione. La frangitura e la gramolatura sono due punti critici del processo di estrazione meccanica dell’olio vergine di oliva (Servili et al. 2004).
I secoiridoidi agliconi quali il 3,4-DHPEA-EDA, il p-HPEA-EDA, il p-HPEA-EA e il 3,4-DHPEA-EA si originano durante la fase di frangitura per idrolisi dell’oleuropeina, della demetiloleuropeina e del ligustroside; la reazione è catalizzata dalle β-glucosidasi endogene, in accordo con il meccanismo riportato in figura 5 (Lo Scalzo et al., 1993; Uccella et al., 1999).
Figura 5. Biogenesi dei secoiridoidi agliconi. (I) R = H: ligstroside; R = OH: oleuropeina; (II) R= H: p-HPEA-EA; (III) R= OH: 3,4-DHPEA-EA; (IV) R = H: dialdehydic form of ligstroside aglycon; R = OH: dialdehydic form of oleuropein aglycon; (V) R = H: p-HPEA-EDA; R = OH: 3,4-DHPEA-EDA.
Durante la fase di gramolatura la concentrazione del DHPEA-EDA, del 3,4-DHPEA-EA e degli alcoli fenolici diminuisce nelle paste e negli oli con l’aumentare del tempo e della temperatura di processo (Bianco et al., 2001; Angerosa et al., 2001; Di Giovacchino et al., 2002; Servili et al., 2004). Nel corso della gramolatura i secoiridoidi vanno incontro a processi di ossidazione enzimatica per l’attivazione di alcuni enzimi endogeni (Servili et al., 2007b) quali polifenolossidasi e perossidasi.
L’ossidazione dei fenoli ad opera della perossidasi avviene attraverso la formazione di radicali fenossi che dopo riarrangiamento e reazioni di accoppiamento con diversi substrati presenti nella matrice alimentare porta alla formazione di dimeri, oligomeri e polimeri (Ward et al., 2001).
Studi effettuati sull’acido ferulico hanno dimostrato che dopo l’ossidazione iniziale le successive reazioni di accoppiamento sembrerebbero essere determinate dalla chimica dei radicali fenossi dell’acido ferulico, indipendentemente dall’enzima (Ward et al., 2001).
Durante la fase di stoccaggio invece, può instaurarsi il processo di autossidazione non enzimatico a causa della presenza dell’ossigeno, dell’esposizione alla luce e della temperatura (Cilliers e Singleton, 1991).
Sempre durante questa fase si possono instaurare anche fenomeni idrolitici di natura non enzimatica che provocando la rottura del legame estereo nella molecola dei secoiridoidi agliconi porterebbero alla formazione di tirosolo e idrossitirosolo libero. Nel tempo infatti, si ha una diminuzione della concentrazione di questi secoiridoidi e un aumento della concentrazione di tirosolo e idrossitirosolo liberi (Brenes et al. 2001; Psomiadou et al., 2002; Lavelli et al., 2006). Risultati sperimentali in tal senso hanno messo in evidenza che la concentrazione di questi fenoli semplici mostra nel tempo un andamento a campana; inoltre, il loro aumento nell’olio vergine di oliva è molto meno marcato rispetto alla diminuzione del contenuto in secoiridoidi, questo indicherebbe che nel tempo si instaurano a carico
delle sostanze fenoliche sia processi di degradazione idrolitica che ossidativa (Lavelli et al., 2006; Di Maio et al., 2011).
Come riportato da Di Maio et al. (2011) l’ossidazione non enzimatica dell’idrossitirosolo porta alla formazione del corrispondente o-chinone che essendo altamente instabile va incontro a reazioni di dimerizzazione e di polimerizzazione. Una volta che il chinone si è formato la reazione procede alla stessa maniera sia che il chinone è stato prodotto enzimaticamente, come nel caso della poliifenolossidasi, che non enzimaticamente.
Le reazioni di dimerizzazione e di polimerizzazione coinvolgono anche le sostanze fenoliche; in letteratura l’accoppiamento ossidativo di o- e p-diidrossifenoli con conseguente formazione di prodotti di addizione in diverse posizioni dell’ anello benzenico è ben documentato (Cilliers et al., 1991; Ward et al., 2001; Antolovich et al. 2004).
In uno studio condotto da Tazaki et al. (2001) è stato dimostrato che l’accoppiamento ossidativo tra i radicali fenossi dell’acido caffeico preso come sistema modello e l’o-chinone avviene in maniera random.
In figura 6 è riportato uno schema del possibile meccanismo dell’accoppiamento ossidativo tra l’idrossitirosolo e il suo chinone. Secondo lo studio condotto da Vogna et al. (2003) l’ossidazione dell’idrossitirosolo catalizzata dall’enzima tirosinasi porterebbe alla formazione di due regioisomeri.
I fenomeni di degradazione ossidativa sia di natura enzimatica che non enzimatica hanno effetti negativi sulle proprietà sensoriali e salutistiche dell’olio vergine di oliva, nonché sulla sua shel-life (Servili et al., 2004).
Figura 6. Possibile meccanismo di formazione del dimero della reazione di ossidazione enzimatica del 3,4 DHPEA. R1 = H, R2 = -CH2CH2OH; R1 = -CH2CH2OH, R2 = H. (Vogna et al., 2003).
1.3 Proprietà biologiche dei polifenoli dell’olio vergine di oliva
Lo spiccato interesse verso gli antiossidanti dell’olio vergine di oliva deriva dal loro coinvolgimento in importanti attività biologiche che trovano riscontro sia a livello clinico che nutrizionale (Cornwell et al., 2008). A questo si aggiunge l’importante azione protettiva nei confronti dell’alimento in quanto, ritardando i processi di natura ossidativi, hanno un benefico effetto sulla shelf-life.
1.3.1 Proprietà sensoriali
Le proprietà organolettiche dell’olio vergine di oliva sono fortemente influenzate dalla sua composizione fenolica. Queste sostanze sono responsabili delle note di amaro e di pungenza dell’olio vergine di oliva (Kiritsakis, 1998; Garcìa et al. 2001).
OH OH OH O OH O tirosinasi O2 OH O OH OH OH R1 R2 OH O OH R1 R2 O O O O R1 R2 O O OH O O R1 R2 O OH O OH OH OH O OH O tirosinasi O2 OH O OH OH OH R1 R2 OH O OH R1 R2 O O O O R1 R2 O O OH O O R1 R2 O OH O
Negli ultimi 10 anni diversi autori hanno studiato l’impatto sensoriale dei derivati dei secoiridoidi dell’olio vergine di oliva.
I derivati dell’oleuropeina e della demetiloleuropeina come il 3,4-DHPEA-EDA e il 3,4-DHPEA-EA sono i principali responsabili della nota di amaro dell’olio vergine di oliva (Kiritsakis, 1998; Garcìa et al. 2001).
Tovar et al. (2001) hanno evidenziato una forte correlazione tra le note gustative di amaro e di pungente e il p-HPEA-EDA.
Studi condotti da Gutiérrez-Rosales et al. (2003) hanno confermato che il 3,4-DHPEA-EDA, il 3,4-DHPEA-EA e il p-HPEA-EDA sono i composti maggiormente correlabili al gusto amaro dell’olio vergine di oliva.
Andrewes et al. (2003) hanno studiato la nota sensoriale di pungenza. Dopo aver isolato dall’olio vergine di oliva i derivati dei secoiridoidi hanno dimostrato che le
frazioni contenenti p-HPEA-EDA producono una forte sensazione di
bruciore/pungenza al contrario delle frazioni contenenti 3,4-DHPEA-EDA, dove questa sensazione è leggera e percepibile maggiormente sulla lingua. Quindi questi autori hanno concluso che il p-HPEA-EDA è il composto in assoluto più responsabile della nota gustativa di bruciore/pungenza; questo risultato è stato confermato da Beauchamp et al. (2005).
1.3.2 Proprietà salutistiche
L’olio vergine di oliva è il componente imprescindibile della dieta Mediterranea, con la sua composizione chimica contribuisce al fabbisogno giornaliero di acidi grassi essenziali e vitamina E; nonché all’apporto di specifici antiossidanti responsabili degli effetti benefici dell’olio vergine di oliva nel contrastare alcuni disturbi cronico-degenerativi come le malattie infiammatorie, cardiovascolari e il cancro (Mangas-Cruz et al.2004).
Gli antiossidanti, oltre a preservare la shelf-life dell’olio vergine di oliva e a conferirgli resistenza ai trattamenti termici, esercitano, una volta assorbiti dall’organismo, un effetto protettivo inibendo l’azione dei radicali liberi dell’ossigeno (ROS) (Viola, 2006). Queste specie altamente reattive sono i responsabili del cosiddetto “stress ossidativo” che sembra essere alla base delle malattie croniche e dell’invecchiamento. Le ROS causando l’ossidazione di lipoproteine a bassa densità (LDL) contribuiscono alla formazione di lesioni aterosclerotiche (Berliner et al., 1995) oltre che a possibili mutazioni del DNA, che sono all’origine della carcinogenesi (Nakae et al., 1997). Le ROS sono responsabili inoltre, di danni alla mucosa del colon in malattie infiammatorie dell’intestino, di coliti ulcerose e del morbo Crohn a causa del loro accumulo sulla parete dell’epitelio (Orlando, 2002). La produzione dei ROS è collegata anche alla modulazione della ciclossigenasi (COX-2) responsabile di processi infiammatori e del cancro (Rocca e Fitzgerald, 2002).
Lo stress ossidativo è responsabile dell’invecchiamento; infatti, nel tessuto corticale dei topi è stato dimostrato un aumento dell’attività dell’enzima superossido dismutasi con l’età (O’Donnel et al., 1998). Un’indagine condotta sempre sui topi ha evidenziato che le mutazioni del DNA aumentano con l’età (Giovannelli et al. 2003) e lo stress ossidativo sembra essere correlato con le malattie neuro-degenerative come il morbo di Parkinson (Jenner et al., 1996).
In questo contesto l’apporto da fonte esogena, attraverso la dieta, di antiossidanti diventa necessario. Recenti studi epidemiologici hanno dimostrato una chiara associazione tra il consumo di olio vergine di oliva e la riduzione del rischio di cancro al seno (Martin-Moreno et al., 1994; Trichopoulou et al., 1995; La Vecchia et al., 1995), alla prostata (Hodge et al., 2004), al pancreas (Soler et al., 1998), al polmone (Fortes et al., 2003), alla laringe (Bosetti et al., 2002), all’esofago (Bosetti et al., 2003), all’ovaio (Bosetti et al., 2002) e al colon (Stoneham et al., 2000). Evidenze sperimentali hanno riscontrato che l’attività antitumorale dell’olio vergine di oliva, in aggiunta agli altri effetti benefici per la salute umana, è maggiormente
attribuibile all’elevato contenuto in sostanze fenoliche, le quali possiedono forte potere antiossidante (Vissers et al., 2004). In particolare è stato dimostrato che il 3,4-DHPEA è in grado di inibire l’aggregazione delle piastrine (Petroni et al., 1995), di interferire con il metabolismo degli eicosanoidi, riducendo la produzione del leucotriene B4 nei leucociti attraverso l’inibizione dell’enzima 5-lipossigenasi (Petroni et al., 1997) e di inibire l’ossidazione in vitro (Grignaffini et al., 1994) e in vivo (Wiseman et al., 1996) delle lipoproteine a bassa densità. Studi sperimentali hanno inoltre evidenziato che il 3,4-DHPEA, ma anche l’estratto fenolico dell’olio vergine di oliva e altri composti purificati come il 3,4-DHPEA-EDA e il p-HPEA-EDA, sono capaci di indurre l’apoptosi in diverse linee di cellule tumorali come le cellule del carcinoma del colon e del seno, del melanoma e nelle linee cellule HL60 della leucemia (Fabiani et al., 2006; Ragione et al., 2000). Particolarmente interessante è l’evidenza sperimentale secondo cui al contrario del 3,4-DHPEA che è risultato essere molto attivo nell’induzione dell’apoptosi, il p-HPEA è completamente inattivo alla stessa concentrazione (100 μM) e il p-HPEA-EDA è molto più attivo del 3,4-DHPEA-EDA (Fabiani et al., 2002).
E’ chiara da questi risultati sperimentali la relazione tra la struttura della molecola e la sua attività biologica. Infatti, i composti che possiedono un gruppo o-difenolico nella struttura molecolare hanno mostrato una più elevata attività antiossidante, confermando il meccanismo di azione che avviene attraverso la donazione di un radicale idrogeno del gruppo ossidrilico dell’anello benzenico ai radicali liberi. Uno studio condotto da Fabiani et al. nel 2008 ha dimostrato che la capacità del 3,4-DHPEA e del 3,4-3,4-DHPEA-EDA di proteggere il DNA da danni causati dall’ossidazione è superiore rispetto a quella del p-HPEA e del p-HPEA-EDA. E’ stata dimostrata in vitro, entro un basso intervallo di concentrazione (1-10 μM), la capacità del 3,4-DHPEA di inibire la fase di iniziazione della carcinogenesi.
Il p-HPEA-EDA, denominato di recente “oleocantale”, sembra inibire l’attività degli enzimi ciclossigenasi COX-1 e COX-2 che catalizzano le reazioni all’interno della via biochimica infiammatoria dell’acido arachidonico. Questo effetto
farmacologico è simile a quello dell’ibuprofene, potente modulatore dell’infiammazione e analgesico (Beauchamp et al., 2005).
In un recente lavoro di Fabiani et al. (2011) è stato evidenziato che la diversa composizione fenolica degli estratti di oli vergine di oliva esprime in vitro differenti potenziali chemopreventivi verso le linee cellulari HL60. I differenti effetti chemopreventivi mostrati dagli estratti non sembrano essere una diretta conseguenza del contenuto totale in sostanze fenoliche, ma piuttosto della loro composizione. Infatti, gli effetti antiproliferativi e pro-apoptotici sono dovuti ai principali componenti degli estratti, 3,4-DHPEA-EDA e p-HPEA-EDA. E’ importante sottolineare che le concentrazioni del 3,4-DHPEA-EDA e del p-HPEA-EDA puri (IC50% 30 – 35 e 7 – 8 μM, rispettivamente), necessarie per osservare un effetto significativo, erano molto al di sopra di quelle presenti nel mezzo di coltura contenente l’estratto fenolico ad una concentrazione di 5μg/mL. Questo significa che all’interno dell’estratto fenolico si instaurano effetti sinergici con altri componenti.
La correlazione negativa del p-HPEA e del 3,4-DHPEA con gli effetti antiproliferativi e pro-apoptotici degli estratti è spiegabile con la concentrazione. Quando l’estratto fenolico viene disciolto nel mezzo di coltura ad una concentrazione di 5 μg/mL questi due componenti risultano essere presenti in quantitativi più bassi di quelli necessari (>250 μM per il p-HPEA e >10 μM per il 3,4-DHPEA) per avere un effetto sulle cellule HL60 (Fabiani et al., 2011).
Per quanto riguarda i lignani sembrerebbe che il pinoresinolo possieda una piccola attività pro-apoptotica, ma sia capace di inibire la proliferazione delle cellule HL60 a concentrazioni (10 – 100 μM) molto al di sopra di quelle presenti nell’estratto fenolico (Fabiani et al., 2011).
Sebbene diversi studi hanno dimostrato le proprietà chemopreventive, in termini di effetti antiproliferativi e pro-apoptotici, del 3,4-DHPEA restano ancora poco conosciuti gli effetti dell’ estratto fenolico dell’olio vergine di oliva sulle cellule tumorali.
Per diversi autori rimane ancora molto controverso il discorso dell’assorbimento e della biodisponibilità da parte dell’organismo dei composti fenolici dell’olio vergine di oliva (Frankel, 2011).
1.3.3 Attività antiossidante
I polifenoli agiscono come antiossidanti di tipo I, per inibire l’ossidazione dell’olio vergine di oliva inattivano i radicali alchilperossidici generati dall’autossidazione lipidica donando loro un radicale idrogeno e trasformandosi essi stessi in radicali molto più stabili. Il radicale formato dalla reazione di un fenolo con un radicale lipidico è stabilizzato dalla delocalizzazione nell’anello aromatico dell’elettrone spaiato. La stabilità del radicale fenossilico riduce la velocità della fase di propagazione della reazione radicalica di autossidazione lipidica.
I fenoli idrofili, quali alcoli e acidi fenolici, flavonoidi, lignani e secoiridoidi, sono la classe più importante degli antiossidanti naturali dell’olio vergine di oliva, senza comunque tralasciare il contributo dei carotenoidi e dei tocoferoli (Servili et al., 2004).
In letteratura è ampiamente documentato il ruolo determinante dei composti fenolici in tema di stabilità ossidativa dell’olio vergine di oliva; sono in grado infatti, di preservare nel tempo le sue proprietà nutrizionali ed edonistiche e questo si traduce in una prolungata shelf-life dell’olio vergine di oliva (Servili et al. 2007a; Carrasco-Pancorbo et al., 2007).
Diversi studi hanno evidenziato la relazione tra polifenoli e relativa shelf-life dell’olio vergine di oliva, misurata usando metodi di ossidazione accelerata come l’AOM ( Active Oxygen Method) e il Rancimat (Baldioli et al., 1996; Pirisi et al., 2000; Brenes et al., 2000).
Successivamente è stata confermata la correlazione tra polifenoli totali contenuti nell’estratto metanolico dell’olio vergine di oliva dosati con il metodo
colorimetrico, la loro attività antiossidante valutata usando l’ORAC test (Oxygen Radical Absorbance Capacity) e la shelf-life dell’olio vergine di oliva valutata con il Rancimat (Gordon et al., 1990; Chimi et al., 1991; Papadopoulus et al., 1991; Ninfali et al., 2001).
Sánchez et al. (2007) hanno sperimentato quattro diversi test (ABTS.+ test, DPPH
test, ORAC test, β-carotene-linoleate test) per determinare l’attività di “free-radical scavenging” di diversi oli vergini di oliva il cui contenuto in polifenoli totali è stato determinato con il metodo del Folin-Ciocalteu. Nonostante tutti e quattro i metodi abbiano mostrato un’ottima correlazione tra il contenuto in polifenoli totali e l’ attività antiossidante misurata, il metodo migliore è risultato essere l’ABTS.+test.
Servili et al. (2004) hanno studiato l’attività antiossidante di alcuni specifici fenoli idrofili dell’olio vergine di oliva, quali 3,4-DHPEA, p-HPEA e acidi fenolici (acido caffeico, acido p-cumarico, acido ferulico, acido siringico e acido vanillico) dimostrando l’elevata attività antiossidante del 3,4-DHPEA.
Baldioli et al. (1996) hanno esaminato questa proprietà attraverso l’utilizzo del Rancimat test in diversi secoiridoidi isolati dall’olio vergine di oliva evidenziando come gli o-difenoli tra cui, 3,4-DHPEA, 3,4-DHPEA-EDA e 3,4-DHPEA-EA hanno una maggiore attività antiossidante rispetto al p-HPEA e all’α-tocoferolo. Questo conferma quanto detto sopra sul 3,4-DHPEA e di conseguenza i secoiridoidi che contengono questo composto nella loro struttura molecolare mostrano una più elevata attività antiossidante.
Artajo et al. (2006) hanno dimostrato, attraverso il Rancimat test, che molecole in cui è presente un anello aromatico sostituito da gruppi ossidrilici in posizione 3, 4 o 5 come l’oleuropeina, il 3,4-DHPEA-EDA e la forma metilata del 3,4-DHPEA-EA possiedono una più elevata attività antiossidante. Questo è spiegato dall’elevato effetto elettron donatore del gruppo ossidrile che aumentando la densità elettronica
sul gruppo ossidrilico adiacente per effetto induttivo, aumenta la reattività del fenolo verso i radicali lipidici.
Carrasco-Pancorbo et al. 2005 hanno esaminato l’attività di radical scavengin di singoli polifenoli estratti dall’olio vergine di oliva attraverso metodi chimici (1,1-diphenyl-2-picrylhydrazyl test, DPPH test), metodi di ossidazione accelerata in sistemi lipidici modello (OSI, oxidative stability instrument) e attraverso metodi elettrochimici (analisi in iniezione diretta [FIA], amperometria e voltammetria ciclica). I risultati ottenuti hanno dimostrato che l’abilità di donare un radicale idrogeno ai radicali alchilperossidici, generati dall’autossidazione lipidica con conseguente diminuzione della velocità della fase di propagazione della reazione radicalica a catena, aumenta all’aumentare del numero dei gruppi ossidrilici presenti nel fenolo. In particolare l’introduzione di un secondo gruppo ossidrilico in posizione 2 o 4 del fenolo aumenta l’attività antiossidante. Questo è spiegato dalla stabilizzazione via legame a idrogeno intramolecolare del radicale fenossilico formatosi dalla reazione del fenolo con il radicale lipidico. I risultati ottenuti con i tre test hanno dimostrato che il 3,4-DHPEA, 3,4-DHPEA-EDA, e 3,4-DHPEA-EA sono gli antiossidanti più forti. Questo conferma che la presenza di un solo gruppo ossidrilico nella molecola diminuisce la sua attività antiossidante; anche la presenza del gruppo carbossimetile, come nel caso dell’oleuropeina aglicone, sembra causare una diminuzione dell’attività antiossidante, non essendo un gruppo elettron donatore (Carrasco-Pancorbo et al., 2005).
A differenza di altri autori (Ninfali et al., 2001; Carrasco-Pancorbo et al., 2005; Artajo et al., 2006), che hanno trovato nessuna se non una debole attività antiossidante dei lignani, Owen et al. (2000) hanno evidenziato una chiara correlazione tra l’attività di radical scavenging dell’estratto fenolico dell’olio vergine di oliva e la concentrazione dei lignani.
Obied et al. (2007) hanno isolato due nuovi secoiridoidi da reflui derivanti dalla lavorazione di olive australiane appartenenti alla varietà Frantoio: l’idrossitirosil aciclodiidroelenolato e il p-cumaril-6’-secologanoside (comselogoside). Entrambi
questi composti comparati al 3,4-DHPEA e all’oleuropeina hanno evidenziato in vitro attività di radical scavenging nei confronti di radicali stabili come il 2,2-difenil-1-picrilidrazile (DPPH). In particolare è stato evidenziato che l’idrossitirosil aciclodiidroelenolato risulta essere un radical scavenger più efficiente del 3,4-DHPEA e dell’oleuropeina. Questo si può attribuire alla sua struttura lineare che facilita la reazione con il radicale DPPH ingombrato stericamente (Obied et al., 2007).
Uno studio recente fatto da Obied et al. (2008) ha evidenziato che il verbascoside isolato da un estratto di reflui oleari da olive appartenenti alla varietà Correggiola è il più potente antiossidante seguito dal 3,4-DHPEA-EDA.
Negli ultimi anni sono stati fatti molti studi di simulazione del comportamento dell’olio vergine di oliva durante la frittura e altri tipi di cottura (Servili et al., 2004). E’ ormai noto dalla letteratura che tra gli oli vegetali l’olio vergine di oliva mostra una maggiore stabilità durante la fase di frittura del cibo quando scaldato ad elevate temperature (Fedeli et al., 1988; Andrikopoulos et al., 1989) o con microonde, questo significa che i polifenoli reagiscono rapidamente con i radicali lipidici e vengono di conseguenza consumati.
I composti fenolici con la più elevata attività antiossidante come il 3,4-DHPEA, il 3,4-DHPEA-EDA e il 3,4-DHPEA-EA diminuiscono notevolmente durante il riscaldamento per preservare l’olio vergine di oliva dai processi ossidativi.
Il p-HPEA, i derivati del ligustroside quali il p-HPEA-EDA e il p-HPEA-EA e i lignani, al contrario, hanno mostrato un’elevata stabilità durante studi di simulazione del processo di frittura e di cottura a microonde, confermando il loro scarso contributo nella protezione dell’olio vergine di oliva dai fenomeni ossidativi in fase di cottura (Servili et al., 1989).
Gomez-Alonso et al. (2003) hanno confermato questa stabilità del tirosolo e dei suoi derivati secoiridoidei durante la fase di frittura evidenziando che la diminuzione della loro concentrazione è molto piu bassa di quella osservata per i composti appartenenti alla famiglia dell’idrossitirosolo.
In letteratura diversi autori riportano che il DHPEA, l’acido elenolico, il 3,4-DHPEA-EDA e il 3,4-DHPEA-EA riducono la loro concentrazione durante il trattamento termico molto più velocemente di altri composti fenolici presenti nell’olio vergine di oliva come 3,4-DHPEA acetato e p-HPEA-EA, mentre è stata confermata l’elevata resistenza al trattamento termico dei lignani (Carrasco-Pancorbo et al. 2007).
Pellegrini et al. (2001) hanno dimostrato che i polifenoli dell’olio vergine di oliva stabilizzano l’α-tocoferolo durante il riscaldamento dell’olio di oliva contribuendo al valore nutrizionale del cibo cotto.
Molte ipotesi sui meccanismi di azione dei singoli antiossidanti fenolici sono state formulate.
Lo studio sulla chimica di degradazione degli antiossidanti durante l’autossidazione dell’olio è importante anche per comprendere l’azione degli effetti sinergigi dei composti fenolici contenuti nell’estratto fenolico dell’olio vergine di oliva che sembrerebbe potenziarne l’attività antiossidante (Fabiani et al. 2011).
Alcuni studi sono stati condotti anche sulla possibile attività antiossidante dei prodotti di degradazione ossidativa degli antiossidanti fenolici. L’attività di “radical scavenging” degli antiossidanti fenolici sembrerebbe rafforzata dalle reazioni di dimerizzazione e di polimerizzazione che seguono la reazione di ossidazione stessa (Hotta et al. 2002, Arakawa et al., 2004).
In letteratura è riportato che certi dimeri formatisi dall’accoppiamento ossidativo dell’acido ferulico sono antiossidanti più potenti dell’acido ferulico stesso (García-Conesa et al., 1997). La loro attività antiossidante sembrerebbe essere relazionata all’esistenza di un sistema coniugato all’interno della molecola.
1.4 Analisi quali-quantitativa delle sostanze fenoliche dell’olio vergine di oliva
I derivati dell’oleuropeina e del ligustroside rappresentano gran parte della frazione fenolica totale dell’olio vergine di oliva. Negli ultimi anni è stato confermato l’elevato potere antiossidante in vitro e in vivo di queste sostanze.
Il livello dei derivati fenolici nella valutazione della qualità dell’olio vergine di oliva è un parametro molto importante dal momento che i fenoli sono fortemente relazionati sia alla resistenza all’ossidazione dell’olio che ad importanti attività biologiche (Papadoupoulos et al., 1991; Servili et al 2004) in parte responsabili degli effetti benefici per la salute umana della dieta mediterranea.
Tecniche analitiche sempre più sofisticate sono state messe a punto per la determinazione e l’identificazione delle sostanze fenoliche dell’olio vergine di oliva (Owen et al., 2000; Fu, 2009; Casale et al., 2010; Alonso-Salces 2010). L’analisi dei composti fenolici dell’olio vergine di oliva prevede in genere prima la loro estrazione e purificazione dalla matrice oleosa poi, la scelta della giusta tecnica analitica per la loro valutazione quali-quantitativa (Servili et al., 2004).
Per quanto riguarda il metodo di estrazione le principali tecniche riportate in letteratura sono l’estrazione liquido-liquido (LLE) (Tsimidou et al., 1996) e l’estrazione in fase solida (SPE) (Servili et al., 1999; Pirisi et al., 2000).
Tra i metodi analitici convenzionali di determinazione dei fenoli dell’olio vergine di oliva ci sono i metodi colorimetrici con l’utilizzo del reagente Folin-Ciocalteu (Solinas et al., 1981) e l’HPLC tra i metodi cromatografici (Montedoro et al., 1993; Baldioli et al.1996; Owen et al. 2000; Romero et al., 2002; Brenes et al., 2002). L’HPLC accoppiata alla spettroscopia UV (Montedoro et al.1992b; Brenes et al. 1999; Pirisi et al. 2000) è la tecnica più usata per la determinazione delle sostanze fenoliche, in letteratura sono riportati anche metodi elettrochimici e fluorimetrici (Tsimidou et al., 1996; Brenes et al., 2002). L’utilizzo del rivelatore elettrochimico
(EC) per la determinazione dei fenoli semplici fu proposto per la prima volta da Mannino et al. (1993).
Selvaggini et al. (2006) hanno messo a punto un metodo per la determinazione dei polifenoli mediante iniezione diretta dell’olio vergine di oliva nell’HPLC utilizzando per l’analisi quali-quantitativa un rivelatore a fluorescenza.
Secondo Brenes et al. (2000b) il fluorimetro è molto utile per la determinazione dei lignani nelle analisi di routine dei fenoli dell’olio vergine di oliva data la sua facilità rispetto alla gascromatografia accoppiata alla spettrometria di massa (GC-MS) nel discriminare il (+)-1-pinoresinolo e il (+)-1-acetossipinoresinolo.
Angerosa et al. (1996) hanno messo a punto un metodo GC-MS per la valutazione dei composti fenolici dell’olio. Questo metodo prevede un ulteriore passaggio nella preparazione del campione, ossia la derivatizzazione con tetrametilsilano (TMS) dei gruppi ossidrilici delle sostanze fenoliche estratte. Nello spettro di massa dei derivati dei secoiridoidi sono stati identificati due picchi principali con rapporto m/z di 192 o 280 relativi al tirosolo e all’idrossitirosolo rispettivamente, che risultano essere molto utili per definire qualitativamente e quantitativamente la composizione fenolica dell’olio vergine di oliva.
Successivamente Owen et al. (2000) hanno confermato l’utilizzo del metodo GC-MS per la determinazione di tutte le classi di composti fenolici dell’olio vergine di oliva.
Miglioramenti nella strumentazione e avanzamenti nelle tecniche di separazione hanno contribuito all’espansione della spettrometria di massa in campo alimentare (Careri et al., 2002).
La cromatografia liquida accoppiata alla spettrometria di massa (LC-MS) è una tecnica ormai consolidata nell’analisi soprattutto qualitativa dei fenoli dell’olio vergine di oliva (Rovellini et al., 2002). La cromatografia liquida accoppiata ai metodi di MS-MS è uno strumento molto efficiente nella chimica degli alimenti grazie alla sua elevata selettività (Careri et al., 2002).
Perri et al. (1999) hanno messo a punto un metodo di MS/MS (Ionspray tandem mass spectrometry, ISI-MS/MS) per la determinazione quantitativa dell’oleuropeina nell’olio vergine di oliva.
Fu et al. (2009) hanno separato e caratterizzato i diversi composti fenolici contenuti nell’olio vergine di oliva attraverso l’utilizzo della cromatografia liquida a rapida risoluzione e della spettrometria di massa a tempo di volo (RRLC/ESI-TOF-MS) e a trappola ionica (RRLC/ESI-IT-MSn).
Nell’analisi strutturale dei composti fenolici dell’olio vergine di oliva accanto alla spettrometria di massa si colloca la tecnica della risonanza magnetica nucleare (NMR).
Una eccellente serie di esperimenti è stata condotta da Montedoro et al. (1993) che utilizzando le tecniche HPLC e NMR hanno separato e identificato il 3,4-DHPEA-EDA, il 3,4-DHPEA-EA e il p-HPEA-EDA.
Owen et al. (2000) attraverso l’utilizzo delle techniche MS e NMR hanno identificato e determinato la struttura dei lignani, 1-acetossipinoresinolo, (+)-pinoresinolo e (+)-1-idrossi(+)-pinoresinolo, contenuti nell’olio vergine di oliva.
1
H-NMR e la più recente tecnica LC-SPE-NMR sono state applicate per lo studio della frazione fenolica dell’olio vergine di oliva per scopi autenticativi (Christophoridou et al., 2005).
1.4.1 Analisi qualitativa dei prodotti di ossidazione delle sostanze fenoliche
In letteratura il ruolo antiossidante delle sostanze fenoliche nel prevenire o ritardare l’autossidazione dell’olio vergine di oliva è ben documentato.
Dal momento che Bolland nel 1946 dimostrò che l’autossidazione dei grassi e dell’olio avveniva tramite una reazione radicalica a catena, diversi studi sono stati condotti sul meccanismo di azione degli antiossidanti (Kikugawa et al., 1990). E’ stato dimostrato che gli antiossidanti fenolici ostacolano i radicali liberi, prodotti durante la fase di propagazione della reazione a catena, donando loro un radicale idrogeno.
I prodotti di degradazione ossidativa degli antiossidanti fenolici dell’olio vergine di oliva restano ancora sconosciuti. Diversi esperimenti riguardanti la degradazione di fenoli semplici sono stati condotti attraverso sistemi modello che riproducono le condizioni di autossidazione dell’olio.
Cilliers et al. (1991) hanno condotto studi sull’ossidazione nonenzimatica, attraverso il metodo dell’ossigeno attivo, dell’acido caffeico considerato come un sistema fenolico modello per i derivati cinnamici. I prodotti di degradazione ossidativa, in particolare dimeri e trimeri dell’acido caffeico formati dalle reazioni che coinvolgono la catena laterale di almeno una delle unità di acido caffeico, sono stati isolati con la tecnica HPLC preparativa e caratterizzati attraverso analisi NMR e FAB-MS (Fast atom bombardment mass spectrometry).
Altri autori hanno confermato la formazione del dimero dell’acido caffeico via o-chinone attraverso sistemi modello di ossidazione chimica (Fulcrand et al., 1994) ed
di elettrochimica accoppiata alla spettrometria di massa (On-Line
Electrochemistry/Electrospray Ionization Mass Spectrometry) (Arakawa et al., 2004).
In uno studio condotto da Pati et al. (2006) l’ossidazione dell’acido caffeico è stata eseguita per via enzimatica con l’utilizzo dell’enzima tirosinasi (EC 1.14.18.1). I principali prodotti di ossidazione identificati attraverso la spettrometria di massa
(HPLC-ESI-MS e HPLC-ESI-MS/MS) sono dimeri dell’acido caffeico che si possono formare anche attraverso legami C-C degli atomi dell’anello aromatico o tramite il gruppo carbossilico.
Di Maio et al. (2011) hanno indagato i prodotti di ossidazione di natura enzimatica e non enzimatica del p-HPEA e del 3,4-DHPEA tramite MS e HPLC-ESI-MS/MS.
In una indagine in vitro condotto da Ward et al. (2001) l’acido ferulico è stato scelto come sistema modello per studiare gli steps iniziali della reazione di polimerizzazione dei composti fenolici catalizzata dalla lignina-perossidasi (LIP). I prodotti della dimerizzazione e polimerizzazione ossidativa sono stati caratterizzati attraverso l’utilizzo della risonanza magnetica (NMR) e della gascromatofrafia accoppiata alla spettrometria di massa (GC-MS).
Antolovich et al. (2004) hanno condotto uno studio sui prodotti di ossidazione di diversi antiossidanti fenolici tra cui acidi cinnamici, acidi benzoici, tirosolo e oleuropeina glucoside. I prodotti di reazione sono stati identificati tramite LC-UV/MS come chinoni, dimeri e aldeidi. Inoltre è stato osservato che variazioni nella struttura dei fenoli influenza la loro reattività e i prodotti di ossidazione formati. Tutti gli acidi cinnamici producono per ossidazione principalmente benzaldeide. La formazione del chinone interessa le molecole aventi gruppi o-idrossilici nella loro struttura molecolare.
Rovellini et al. (2002) mediante la tecnica HPLC-ESI-MS hanno identificato nell’estratto fenolico dell’olio vergine di oliva alcuni prodotti di ossidazione dell’oleuropeina e del ligustroside aglicone. Tali prodotti di ossidazione sono stati confermati mediante analisi GC-MS da Ríos et al. (2005), resta ancora sconosciuta la relativa struttura molecolare.
1.5 Applicazione della spettrometria di massa in campo alimentare e biochimico
L’importanza della spettrometria di massa (MS) nella ricerca in campo biochimico e alimentare si è ormai consolidata (Careri et al. 2002).
In MS viene determinato il rapporto massa su carica (m/z) di ioni in fase gassosa. Le origini di questa tecnica risiedono negli studi condotti da J. J. Thomson (Thomson, 1913) e dal suo studente F. W. Aston (Aston, 1933) intorno alla fine del secolo scorso.
Oggi la spettrometria di massa è il metodo più sensibile per la caratterizzazione strutturale di biomolecole.
Gli steroidi possono essere identificati e caratterizzati a livelli del picogrammo (Chatman et al., 1999; Griffiths et al., 1999), le proteine separate per elettroforesi su gel di poliacrilammide (PAGE) possono essere determinate a concentrazioni al di sotto delle picomoli (Wilm et al., 1996), e nei casi migliori, i neuropeptidi possono essere valutati a livello delle zeptomoli (Andrén et al., 1994).
In campo alimentare questa tecnica permette la valutazione anche dei trigliceridi, degli acidi grassi, delle cere (De Meulenaer et al., 2000; Byrdwell, 2001), dei carotenoidi e di vitamine idro e liposolubili (Dachtler et al., 2001; Stokes et al., 1999).
Molti progressi nell’applicazione della MS in biochimica sono una diretta conseguenza dell’introduzione delle tecniche di ionizzazione soft come il desorbimento/ionizzazione laser assistito da matrice (MALDI) (Karas et al., 1988) e electrospray (ESI) (Yamashita et al., 1984; Fenn et al., 1989). La tecnica MALDI è un perfezionamento della ionizzazione FAB (Fast-atom-bombardment). A differenza di quest’ultima, applicabile per molecole con pesi molecolari di poche migliaia di dalton (Barber et al., 1982), la massa delle biomolecole valutabili con i metodi MALDI e ESI è oggi entro l’intervallo dei megadalton (Tito et al., 2000).
Queste nuove tecniche di ionizzazione hanno permesso l’analisi diretta di biomolecole polari e termicamente labili senza l’uso di derivatizzazioni come invece era necessario nel caso della spettrometria di massa ad impatto elettronico o a ionizzazione chimica (EI o CI-MS).
Come la ionizzazione FAB anche la MALDI è limitata nell’intervallo dei bassi pesi molecolari perché a causa dell’effetto matrice si può avere la soppressione degli ioni del campione.
A partire dalla fine degli anni ’90 la tecnica MALDI si è affermata soprattutto nel campo della chimica delle proteine, dove è diventata il metodo più efficiente di ionizzazione dei peptidi (Griffiths, 2001); essendo una metodologia pulsata spesso viene accoppiata all’analizzatore a tempo di volo (TOF) (Roepstorff, 2000).
Allo stato attuale dell’arte l’utilizzo di sistemi MALDI-TOF-MS e LC-ESI-MS accoppiata con analizzatori a triplo quadrupolo è l’approccio analitico predominante nello studio delle proteine anche in campo alimentare.
Léonil et al. (2000) hanno applicato tali metodologie per la determinazione di peptidi e proteine nel latte, uova e cereali.
In una review di Alomirah et al. (2000) la capacità delle tecniche ESI-MS e MALDI-TOF-MS per la caratterizzazione strutturale delle proteine è ben discussa con particolare riguardo ai vantaggi in termini di sensibilità, accuratezza di massa (sempre all’interno del range 0.5-1%) e tempi di analisi. Nel lavoro viene anche evidenziato il potenziale di queste tecniche per la determinazione della sequenza delle proteine, delle modificazioni post-translazionali e delle interazioni proteina-proteina, e proteina-legante.
Il sistema MALDI-MS è stato applicato anche nella caratterizzazione delle reazioni non enzimatiche delle proteine alimentari con alcuni metaboliti secondari delle piante quali acido clorogenico, o-, m-, p-diidrossibenzene, acido gallico e acido ferulico (Rawel et al., 2001).
Un approccio basato sull’utilizzo della tecnica HPLC-ESI-MS è stato applicato all’identificazione di oligopeptidi nel prosciutto di Parma (Sforza et al., 2001).
I ricercatori del Centro Ricerca Nestlé hanno applicato la tecnica LC-ESI-TOF-MS per risolvere un problema di identificazione in un siero proteico modificato (Hau et al., 2001). L’accoppiamento di queste tecniche di ionizzazione soft con la spettrometria di massa tandem (MS/MS), nella quale si seleziona uno ione precursore che viene ulteriormente frammentato e se ne analizzano gli ioni prodotto mette a disposizione dei ricercatori un potente mezzo per la caratterizzazione di biomolecole.
In un recente lavoro la metodologia ESI-CID-MS/MS, in cui il precursore viene frammentato in una cella di collisione (collision-induced dissociation), è stata applicata per l’analisi delle mioglobine in campioni di carne (Ponce-Alquicira et al., 2000). La tecnica ESI-MS è stata in grado di distinguere parzialmente le mioglobine provenienti da carne di pecora, cavallo, manzo e maiale.
La tecnica MALDI-TOF-MS si è dimostrata essere un potente strumento nella chimica degli alimenti anche per la caratterizzazione dei carboidrati (Vierhuis et al., 2001).
Accanto alla tecnica di ionizzazione ESI si colloca la ionizzazione APCI (Atmospheric Pressure Chemical Ionization), un’altra tecnica di ionizzazione soft, anche se molto spesso le due metodologie sono intercambiabili, l’ESI è molto più utilizzata.
Thurman et al. (2001) hanno applicato le metodologie di ionizzazione ESI e APCI per la determinazione HPLC-MS e HPLC-MS/MS di 75 pesticidi e dei loro prodotti di degradazione. Dai risultati sperimentali è emerso che la ionizzazione ESI è molto più sensibile della tecnica APCI.
La ionizzazione ESI accoppiata alla spettrometria di massa tandem risulta essere un sistema molto sensibile e selettivo per lo screening multi residuo di una vasta gamma di pesticidi anche nelle bevande, con la possibilità di ottenere rilevanti informazioni strutturali (Pozo et al. 2001).
A causa del largo utilizzo di droghe in medicina veterinaria come terapeutici o di agenti promuoventi la crescita, lo sviluppo di tecniche analitiche per la
determinazione di loro residui nella carne e in altri prodotti di origine animale (latte e uova) è diventato un compito molto importante per gli aspetti tossicologico e normativo. Negli ultimi anni metodi LC-MS e LC-MS/MS sono stati ampliamente applicati per confermare la presenza di residui di droghe veterinarie in diversi alimenti (Horie et al. 2000; Heller et al. 2001; Riediker 2001).
Di recente è stata pubblicata da Quilliam (2001) una review sugli aspetti tossicologici e cromatografici riguardanti la determinazione di ficotossine in ambiente acquatico, inclusa la contaminazione degli alimenti marini e dell’acqua. Nella determinazione delle diverse tossine potenzialmente presenti negli alimenti la spettrometria di massa accopppiata alla tecnica HPLC risulta essere un valido strumento analitico (Leitner et al., 2002).
Un recente progresso nella determinazione delle tossine negli alimenti, riguarda l’applicazione di una metodologia basata sull’analisi MS dell’interazione biomolecolare (BIA-MS) per la simultanea determinazione dell’enterotossina stafilococcica B (SEB) e della tossina-1 della sindrome da shock tossico (TSST-1) (Nedelkov et al., 2000). L’accoppiamento della risonanza plasmonica superficiale per l’analisi delle interazioni biomolecolari (SPR-BIA) con la tecnica MALDI-TOF-MS permette misure e determinazioni inequivocabili delle tossine SEB e TSST-1 (Nedelkov et al., 2000). Conoscendo i pesi molecolari delle tossine target l’analisi MALDI-TOF-MS permette sia di confermare la loro presenza nel campione che di identificare altri composti trattenuti sul chip sensoriale.
Un aspetto altrettanto importante nella chimica degli alimenti è la caratterizzazione dei metalli nelle bevande, in quanto la loro concentrazione può influenzare la qualità del prodotto e quindi le caratteristiche organolettiche e la sua stabilità (Griffiths et al., 2001). L’accoppiamento della cromatografia liquida ad alte prestazioni (HPLC) con la determinazione del rapporto isotopico attraverso la spettrometria di massa (IRMS) è un importante mezzo per l’analisi di alterazioni anche molto piccole nell’abbondanza isotopica di alcuni elementi in campioni di interesse alimentare (Teffera et al., 1996). Questo approccio trova interessanti
riscontri nella valutazioni di frodi alimentari (Guillou et al., 1999; Abramson et al., 2001).
2 SCOPO DELLA TESI
Il presente lavoro di tesi si propone di valutare i prodotti di degradazione ossidativa dei principali antiossidanti fenolici dell’olio vergine di oliva quali, tirosolo (p-HPEA), idrossitirosolo (3,4-DHPEA) e la forma dialdeidica dell’acido decarbossimetilelenolico legato all’idrossitirosolo (3,4-DHPEA-EDA). A tal proposito il lavoro è stato suddiviso in due parti, nella prima parte si è proceduto alla caratterizzazione dei prodotti di ossidazione attraverso lo studio di due sistemi di ossidazione modello: ossidazione enzimatica e ossidazione di Fenton; nella seconda parte, l’attenzione è stata focalizzata sulla identificazione di tali prodotti nell’olio in via di ossidazione.
I prodotti di degradazione ossidativa degli antiossidanti sopra menzionati potrebbero essere usati sia come marker di “freschezza” dell’olio vergine di oliva sia nella valutazione della sua shelf life.
3 MATERIALI E METODI
3.1 Campioni
I campioni di olio vergine di oliva sono stati estratti da olive appartenenti alla cultivar Coratina raccolte nell’anno 2008.
L’olio è stato estratto per centrifugazione usando un decanter Rapanelli modello ECO/G (Rapanelli SpA, Foligno) con un basso livello di acqua di diluizione.
L’acidità libera (%) e il numero di perossidi (mEq O2/Kg) erano 0.25 e 4.0, rispettivamente.
L’olio rettificato è stato acquistato presso l’azienda Monini SpA. (Perugia). L’acidità libera (%) e il numero di perossidi (mEq O2/Kg) erano 0.23 e 2.0, rispettivamente.
3.2 Reagenti
I reagenti usati in questo lavoro di tesi sono stati reperiti come segue: l’idrossitirosolo (3,4-DHPEA) è stato acquistato presso l’azienda Cayman Chemical Ltd. (Milano); il tirosolo (p-HPEA), l’acido 3,4-diidrossifenilacetico, il solfato di ferro (FeSO4·7H2O), il perossido di idrogeno (H2O2 30%), l’acetato d’ammonio, l’acido acetico, l’acido solforico e il cloruro di calcio sono stati acquistati dalla Sigma-Aldrich (Milano); l’enzima tirosinasi da fungo (EC 1.14.18.1), il metanolo e l’acqua per HPLC-MS sono stati acquistati presso la Fluka (Milano). La forma dialdeidica dell’acido decarbossimetilelenolico legato all’idrossitirosolo (3,4-DHPEA-EDA) è stata isolata dall’olio vergine di oliva seguendo la procedura riportata da Montedoro et al. (1993) con le seguenti modificazioni: per l’HPLC semi-preparativa è stata utilizzata una Pursuit XRs C18 (250 mm x 10 mm i.d.), con
un diametro delle particelle di 5 μm (Varian Inc., Walnut Creek, CA). Le fasi mobili impiegate sono state acqua acidificata con acido acetico 0.2% (A) e metanolo (B) a un flusso di 3 mL/min. Il tempo totale della corsa cromatografica è stato di 155 min e il gradiente è stato modificato come segue: dal 70% di A e il 30% di B, si è passati in 8 min al 65% di A e al 35% di B, questa composizione è stata mantenuta per 92 min, in 5 min si è raggiunto il 50% di A e il 50% di B e lo si è mantenuto per 30 min, in 3 min il gradiente è stato portato allo 0% di A e al 100% di B, è rimasto in queste condizioni per 12 min prima di ritornare alle condizioni iniziali dell’analisi in 5 min.
3.3 Reazione di ossidazione di Fenton (Fe2+/H2O2)
La reazione di ossidazione di Fenton è stata eseguita in una vial di vetro da 20 mL; la miscela di reazione del volume di 10 mL è stata tenuta continuamente sotto agitazione a temperatura ambiente nel sistema aperto. Il pH della miscela è stato portato a 3.5 all’inizio di ogni esperimento con una soluzione acquosa di H2SO4. La concentrazione iniziale dello standard fenolico era 1 mM, e la concentrazione iniziale del catalizzatore ferroso era 0.5 mM. Il rapporto molare Fe2+:H2O2era 1:10. Il rapporto molare fenolo:Fe2+:H2O2 utilizzato in questo studio non ha causato la completa mineralizzazione dei composti fenolici indagati.
3.4 Reazione di ossidazione enzimatica
La reazione di ossidazione enzimatica è stata eseguita addizionando alla soluzione tampone (CH3COONH4/CH3COOH; pH = 5) contenente lo standard fenolico a una concentrazione di 5 mM l’enzima tirosinasi da fungo (EC 1.14.18; 300 U/mg). La reazione è avvenuta a temperatura ambiente, in un sistema aperto, una vial da 10
mL. Il volume complessivo della miscela di reazione, sottoposta a continua agitazione, era di 5 mL.
Una soluzione acquosa satura di CaCl2 è stata utilizzata per inattivare l’enzima e bloccare la reazione.
3.5 Autossidazione dell’olio vergine di oliva
Campioni da 60 g di olio vergine di oliva sono stati posti in piastre Petri, coperte con carta da filtro e tenute in stufa per diversi giorni a 60 ºC. Ogni 5 giorni è stato misurato il numero di perossidi secondo il metodo ufficiale della Commissione Europea (Regolamento CE n. 1989/2003 della Commissione del 6 novembre 2003 che modifica il regolamento CEE n. 2568/91). L’estrazione dei composti fenolici dalla matrice oleosa è stata eseguita secondo la procedura riportata da Montedoro et al. (1992a), l’estratto fenolico è stato poi analizzato tramite cromatografia liquida ad alte prestazioni accoppiata con le tecniche di rivelazione UV-Vis a serie di diodi (Diode array detector, DAD) e alla spettrometria di massa ESI-MS (Electrospray ionization mass spectrometry) e LC/MS Q-TOF. La stessa procedura è stata applicata all’olio rettificato, al quale dopo rimozione dell’ossigeno per gorgogliamento di azoto, è stato addizionato l’idrossitirosolo (15.0 mg/Kg).
Il processo di autossidazione dell’olio vergine di oliva è stato monitorato nel tempo per osservare la relazione tra il sistema modello (reazione enzimatica e reazione non enzimatica) e l’autossidazione dell’olio stesso. I prodotti di degradazione ossidativa del 3,4-DHPEA sono stati confermati nell’olio rettificato.
3.6 Analisi HPLC-DAD-ESI-MS
I campioni sono stati analizzati usando un cromatografo Varian composto da una pompa 218 e un rivelatore a serie di diodi ProStar 335 accoppiato ad uno spettrometro di massa a triplo quadrupolo Varian 1200 L con sorgente ESI (Electrospray ionisation).
Per le analisi HPLC è stata utilizzata una colonna C18 Intersil ODS-3 (250 x 4.6 mm, 5μm). Il volume di campione iniettato è stato 20 μL, l’eluizione è stata condotta ad una velocità di flusso di 1.0 mL/min usando come fasi mobili acqua/acido acetico (99.8:0.2 v/v) (solvente A) e metanolo (solvente B). Il gradiente è stato modificato come segue: dal 95% del solvente A, mantenuto per 2 min, si è passati in 8 min al 75% del solvente A, poi al 60% di A in 10 min e al 50% in 16 min, fino ad arrivare allo 0% di A e al 100% di B in 14 min, questa composizione è stata mantenuta per 20 min, per tornare poi alle condizioni iniziali dell’analisi in 7 min. Il tempo totale della corsa cromatografica è stato di 77 min. L’ intervallo di lunghezze d’onda impostato è stato 190 – 600 nm ed è stato registrato anche lo spettro a 278 nm.
Lo spettrometro di massa a triplo quadrupolo utilizzato per le analisi LC-MS è stato connesso al rivelatore a sistemi di diodi tramite una valvola di split che ha consentito un flusso in ingresso di 0.2 mL/min. Durante le analisi LC-MS le scansioni sono state eseguite sia con la ionizzazione ESI in positivo che in negativo. Lo spettro di massa è stato registrato impostando le seguenti condizioni analitiche: il voltaggio dello spray è stato settato a 5000 V per le scansioni degli ioni positivi e a 4500 V per gli negativi, il voltaggio dello shield era 600 V, il voltaggio del capillare è stato ottimizzato dal programma di Autotune, il range di scansione di massa m/z per le analisi in full scan era 100 – 700, la pressione del nebulising gas è stata impostata a 50 psi, la pressione e la temperatura del drying gas erano rispettivamente 18 psi e 230 ºC, il voltaggio dell’elettromoltiplicatore è stato impostato a 1100 V. La dissociazione di ioni precursori selezionati, negli
esperimenti di MS/MS, è stata indotta per collisione (CID) con argon utilizzando diverse energie di collisione. Per la caratterizzazione delle molecole sono stati utilizzati i seguenti metodi di MS/MS: Product Ion Scan (PIS), Neutral Loss Scan (NLS), Single Reaction Monitoring (SRM) e Multiple Reaction Monitoring (MRM). I dati sono stati acquisiti con il sistema Varian MS workstation e con il software PolyView 2000 – Diode Array Spectral Processing.
3.6.1 Analisi Ultra High Definition (UHD) Accurate – Mass Q – TOF LC/ MS
Le analisi LC/MS Q-TOF sono state eseguite utilizzando un sistema HPLC Agilent 1290, nelle stesse condizioni sperimentali riportate sopra, interfacciato con uno spettrometro di massa Q-TOF Agilent Ultra High Definition (UHD) Accurate-Mass 6540. Il sistema 6540 Q-TOF è dotato di tecnologia Agilent Jet Stream con una sensibilità MS/MS a livello di femtogrammi e una capacità di risoluzione di massa pari a 40.000. Le scansioni sono state eseguite sia in modalità di ionizzazione positiva che negativa. Le condizioni analitiche impostate erano le seguenti: il voltaggio del capillare è stato settato a 4000 V per le scansioni degli ioni positivi e a 3500 V per gli ioni negativi, il voltaggio del fragmentor è stato impostato a 120 V, il voltaggio dello skimmer è stato impostato a 65 V, il voltaggio dell’octapole era 750 V, la temperatura e la pressione del drying gas erano 300 ºC e 40 psi, rispettivamente, la temperatura dello sheat gas era 280 ºC. I dati sono stati acquisiti con il software della workstation MassHunter.
4 RISULTATI E DISCUSSIONE
L’ossidazione del p-HPEA, del 3,4-DHPEA e del 3,4-DHPEA-EDA è stata monitorata nel tempo attraverso la cromatografia liquida ad alte prestazioni accoppiata con le tecniche di rivelazione UV-Vis a serie di diodi (Diode array detector, DAD) e alla spettrometria di massa ESI-MS (Electrospray ionization mass spectrometry) e LC/MS Q-TOF.
A diversi tempi di reazione, aliquote della miscela sono state analizzate tramite HPLC-DAD-ESI-MS, HPLC-ESI-MS/MS e LC/MS Q-TOF.
A differenza della reazione di ossidazione di Fenton che è partita immediatamente dopo l’aggiunta del perossido di idrogeno alla miscela che si è colorata di rosso-arancio, la reazione di ossidazione enzimatica è avanzata più lentamente con formazione graduale nel tempo dei prodotti di reazione. In entrambe le reazioni infatti, si è generato il chinone, ma nel caso della reazione di ossidazione di Fenton è sparito nel corso di pochi minuti convertendosi velocemente in prodotti di ossidazione più complessi, come dimeri e probabilmente polimeri.
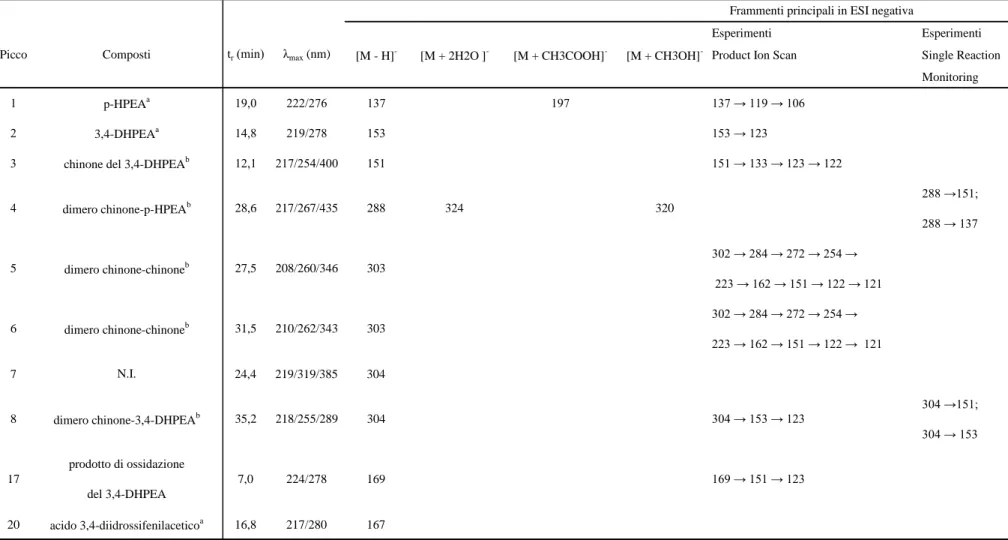
I dati spettrali e i prodotti di frammentazione dei composti di partenza e dei loro prodotti di ossidazione sono mostrati nelle tabelle 3-7.
Il p-HPEA, il 3,4-DHPEA e il 3,4-DHPEA-EDA sono meglio rilevabili in modalità di ionizzazione ESI negativa come [M-H]-.
4.1 p-HPEA (1)
4.1.1 Reazione di ossidazione enzimatica
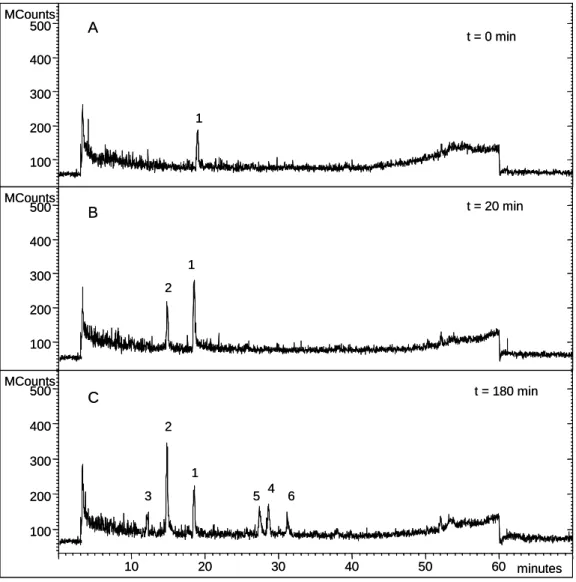
Inizialmente è stata analizzata la soluzione tampone contenente il p-HPEA, prima dell’aggiunta dell’enzima (t = 0 min). Il cromatogramma della corrente ionica totale
![Figura 1. Struttura chimica dei principali acidi fenolici: acido benzoico [I], acido p- p-idrossibenzoico [II], acido vanillico [III], acido protocatechico [IV], acido siringico [V], acido gallico [VI], acido cinnamico [VII], acido p-cumarico [VIII], acido](https://thumb-eu.123doks.com/thumbv2/123dokorg/8191819.127638/7.892.254.709.164.651/struttura-principali-benzoico-idrossibenzoico-vanillico-protocatechico-siringico-cinnamico.webp)