UNIVERSITA’ DEGLI STUDI DI GENOVA
DIPARTIMENTO DI SCIENZE DELLA TERRA, DELL’AMBIENTE E DELLA VITA (DISTAV)
LAUREA MAGISTRALE IN BIOLOGIA ED ECOLOGIA MARINA TESI DI LAUREA SPERIMENTALE IN
ECOLOGIA MARINA
STRUTTURA E FUNZIONALITA’ DELLA COMUNITA’
MESOZOOPLANCTONICA IN AMBIENTE MARINO COSTIERO: AMP DI PORTOFINO (LIGURIA)
RELATORE CANDIDATO Prof. Povero Paolo Bellardini Daniele
Prof. Vassallo Paolo Matricola: 4731113 CORRELATORE
Prof. Bavestrello Giorgio
INDICE
ABSTRACT………... 1
OBIETTIVI ……….. 2
INTRODUZIONE ……… 4
CAPITOLO I – AREA DI STUDIO 1.1 Aspetti ambientali del Mar Ligure……….. 7
1.2 Aspetti Ambientali del Promontorio di Portofino………... 9
1.3 Aspetti biologici ………. 13 1.3.1 Fitoplancton ………. 13 1.3.2 Meso-Zooplancton………. 16 CAPITOLO II – MODELLIZZAZONE 2.1 Approccio modellistico……… 19 2.2 Indici trofodinamici……….. 23 2.3 V.O.R. ………. 28
CAPITOLO III – MATERIALI E METODI 3.1 Piano di campionamento……….. 31
3.1.1 Nutrienti inorganici………... 32
3.1.2 Sostanza organica particellata……….. 33
3.1.3 Clorofilla a ……… 34
3.1.4 Meso – Zooplancton ……….. 34
3.2 Gestione e organizzazione dati ………. 38
3.2.1 Variabili ambientali e nutrienti………. 38
3.2.2 Variabili biologiche………... 38
3.2.3 Modellizzazione………. 40
CAPITOLO IV – RISULTATI 4.1 Triennio 2003 – 2004 – 2005……… 43
4.1.2 Nutrienti e sostanza organica………. 45
4.1.3 Plancton……….. 51
4.1.4 Analisi statistiche ……..……… 56
4.1.5 Modellizzazione………... 62
4.2 Biennio 2018 – 2019………. 67
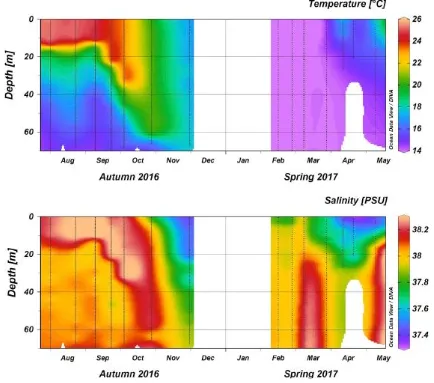
4.2.1 Variabili fisiche dell’acqua: Temperatura e Salinità…….. 67
4.2.2 Nutrienti e sostanza organica……….. 68
4.2.3 Plancton………... 75
4.2.4 Analisi statistiche ………... 79
4.2.5 Fattori di conversione biomassa………. 85
4.2.6 Modellizzazione………... 86
CAPITOLO V – DISCUSSIONE 5.1 Parametri ambientali – biologici……… 89
5.2 Modellizzazione………. 99
CAPITOLO VI – CONCLUSIONI……….. 107
BIBLIOGRAFIA ………... 109
1
ABSTRACT
Il presente lavoro è stato svolto nell’AMP di Portofino, a Punta Faro, all’interno del progetto LTER-Italia (sito IT-15). I campionamenti sono stati condotti negli anni 2018 – 2019 confrontando questi con il triennio 2003 – 2004 – 2005,
particolarmente interessanti da un punto di vista meteo – climatico. Gli studi sono stati svolti al fine di indagare la struttura e la funzionalità delle comunità
mesozooplanctoniche con l’utilizzo di due diversi approcci: uno classico, basato su tecniche multivariate per descrivere la (di)similarità negli anni presi di riferimento, che hanno dimostrato come le osservazioni differiscono significativamente non in base all’anno ma in base alla stagionalità, sia per la componente zooplanctonica adulta che per la componente giovanile; un approccio modellistico per indagare lo stato dinamico del sistema (funzionalità, flussi di energia…) tramite l’utilizzo di indici che riescano a dare delle informazioni sullo stato di salute dell’ecosistema. Dalle analisi effettuate si riscontra una netta differenza tra il triennio 2003 – 2004 – 2005 e il biennio 2018 – 2019, in termini di organizzazione, resilienza e vigore ma soprattutto è risultato evidente come i cambiamenti ambientali, come l’aumento di temperatura, abbiano portato ad una netta ed evidente separazione stagionale degli ultimi due anni ad indicare come il sistema si stia modificando sia in termini di abbondanza di organismi sia in termini di organizzazione e funzionalità.
2
OBIETTIVI
Il lavoro svolto rientra nel progetto LTER (Ricerca Ecologica di Lungo Termine), una rete di siti terrestri, d’acqua dolce, di acque di transizione e marine, sui quali si conducono ricerche ecologiche su scala pluridecennale. LTER studia gli ecosistemi, le loro le dinamiche ed evoluzione, le relazioni tra biodiversità e funzionalità ecologica, la qualità delle acque, la produttività, il ruolo della disponibilità di risorse, gli effetti dell'inquinamento e dei cambiamenti climatici. Vi appartengono 25 siti, distribuiti su tutto il territorio nazionale, gestiti dai principali Enti di Ricerca, Università e Istituzioni che si occupano di ricerca e monitoraggio ecologici in Italia. L’Area Marina Protetta di Portofino dal 2007 fa parte di LTER all’interno del sito IT15 – Mar Ligure con due stazioni più costiere, una di fronte a Punta Faro e una in corrispondenza di Cala dell’Oro, la zona A, soggetta a protezione integrale. Le ricerche ecologiche attualmente in atto sono volte a proseguire lo studio della struttura e dinamica delle principali variabili fisiche, chimiche e biologiche lungo la colonna d’acqua.
In questo contesto rientra il lavoro di tesi che si concentra sullo studio della variabilità dei gruppi zooplanctonici nell’AMP di Portofino, a Punta Faro (N 44°20,000’ E 009°10,000’). I campioni per l’analisi della comunità zooplanctonica sono stati raccolti, in accordo con il programma di monitoraggio marino costiero in ambito nazionale (Di Girolamo I., 2003), ogni 15 giorni a bordo del mezzo UniGe “M/B
Veliger. Successivamente i campioni sono stati analizzati nei laboratori del
dipartimento del DISTAV.
I campionamenti oggetto della presente Tesi sono stati effettuati negli anni 2018 - 2019 e i risultati sono stati messi a confronto con i valori degli anni 2003 – 2004 – 2005, particolarmente interessanti da un punto di vista meteo – climatico e biologico. L’obbiettivo di tale lavoro è di analizzare la struttura e la funzionalità della comunità mesozooplanctonica, tramite l’analisi dei valori di abbondanza e biomassa con un
3
approccio modellistico, per comprendere se il sistema Punta Faro, abbia subito alterazioni e se queste abbiano avuto conseguenze sulla funzionalità del sistema. I risultati ottenuti possono fornire informazioni interessanti per una prima caratterizzazione sullo stato di salute del sistema Punta Faro in quest’inizio di millennio, ma anche valutare criticamente la strategia di campionamento, offrendo suggerimenti per migliorarla nell’ottica di questo tipo di studio.
4
INTRODUZIONE
Lo zooplancton svolge un ruolo fondamentale negli ecosistemi marini. In particolare, gli organismi che compongono il mesozooplancton si nutrono direttamente di fitoplancton, microzooplancton, altro mesozooplancton e detriti e sono regolati e a loro volta regolano la produzione primaria (Buitenhuis et al., 2006). A livello globale sono uno dei principali protagonisti nel flusso di particelle verticali negli oceani; pertanto sono importanti sia nella catena alimentare pelagica sia nei processi di esportazione, influenzando il ciclo biogeochimico del carbonio e di altri nutrienti negli oceani. Quindi comprendere la struttura e il funzionamento della comunità planctonica è fondamentale per tracciare i cicli biogeochimici e prevedere le risposte future degli ecosistemi acquatici ai cambiamenti ambientali. (de Senerpont Domis et al.2013; Behrenfeld e Boss 2014).
Diversi studi hanno studiato se questi organismi potessero essere utilizzati nella valutazione dello stato di qualità ambientale (Webber et al., 2005; White et al., 2006) e quindi essere considerati come indicatori dei cambiamenti dell’ecosistema (Hooff e Peterson, 2006; Valdés et al., 2004; Valdés e Moral, 1998), cioè organismi o gruppo di organismi (popolazioni, comunità) che tramite una risposta biochimica, fisiologica o ecologica permettono di valutare una alterazione della qualità dell’ambiente (Blandin, 1986).
La composizione e l’abbondanza zooplanctonica sono influenzate da diverse variabili chimico – fisiche e biologiche, tra queste è noto come la densità zooplanctonica sia influenzata dalle proprietà delle masse d’acqua in cui vivono (Boucher et al., 1987). Diversi studi sugli organismi zooplanctonici come indicatori biologici si concentrano su due aspetti principali: da un lato l’analisi delle variazioni a medio e lungo termine della comunità in relazione alle alterazioni indotte da variabili idro-climatiche a scala locale (Bonnet e Frid, 2004), regionale (Beaugrand, 2004) e globale (Perry et al., 2005); dall’altro, i cambiamenti a livello zooplanctonico per effetto dal pesante impatto antropico sul sistema marino costiero (Jamet et al., 2005).
5
I cambiamenti climatici sono uno dei fenomeni che hanno ricevuto più attenzione negli ultimi anni; molti, infatti, sono gli studi che si concentrano su come l’aumento della temperatura possa condizionare l’ecosistema marino (Philippart et al., 2007). In diversi lavori si evidenza come questi cambiamenti si riflettono soprattutto alla base della rete trofica (comunità planctoniche) che subiscono modifiche sia quantitative sia qualitative, come ad esempio l’alterazione dei cicli stagionali, delle migrazioni verticali e delle fioriture algali (Fig. 1)
Figura 1- Impatti attesi della variabilità climatica su specie marine (grigio chiaro), popolazioni (grigio medio) e comunità (grigio scuro) a varie scale temporali e spaziali. Philippart et al., 2007
Tutto ciò porta a delle importanti ripercussioni a livello ecosistemico, sia da un punto di vista socio – economico, diminuendo la disponibilità delle risorse ittiche (Beaugrand et al., 2003; Perry et al., 2004), sia da un punto di vista ecologico, in quanto variazioni delle comunità zooplanctoniche influiscono sulla rigenerazione dei nutrienti (Alcaraz et al., 1994) e sul trasporto della materia organica.
Nei lavori di d’Alcalà et al. (2014) e di Molinero et al. (2005) si evidenzia come nel Mediterraneo (golfo di Napoli, Mar Ligure le aree di studio), dalla seconda metà degli anni Ottanta, i cambiamenti climatici, soprattutto l’aumento delle temperature, hanno influenzato la componente zooplanctonica, provocando un incremento del
6
popolamento di organismi gelatinosi ed il conseguente declino nelle abbondanze dei copepodi.
Un primo tentativo di analizzare i cambiamenti della comunità planctonica nei siti LTER Italia è stato effettuato da Morabito et al. (2018). Nel sito di Portofino nel Mar Ligure si evidenza un aumento dell'abbondanza totale di mesozooplancton, caratterizzato da una leggera riduzione del contributo percentuale dei copepodi e da un aumento dei cladoceri. In particolare, specie chiave come il Centropages typicus sono diminuite mentre sono aumentati i copepodi di piccola taglia (0,5-1 mm), insieme all'Appendicularia. È ancora da valutare se questi risultati siano risposte a grandi processi a livello di bacino.
Anche gli organismi fitoplanctonici risentono di questi cambiamenti climatici, in particolare dell’aumento della temperatura; infatti, l’aumento di questa incide sulla velocità di crescita, sulla velocità di assunzione dei nutrienti (Harris, 1986) e sul tasso di trasporto degli elettroni (Geider e MacIntyre, 2002) nel processo fotosintetico. Infatti, a basse temperature il tasso di trasporto degli elettroni è minore e il processo di fotoinibizione inizia a livelli di irradianza più bassi (Falkowski e Raven, 1997). Nell’articolo pubblicato nel 2005 Hays et al. si concentrano sulle problematiche relative agli effetti dei cambiamenti climatici nelle comunità planctoniche marine. Gli autori mettono in evidenza la necessità di promuovere programmi di monitoraggio a livello mondiale, che possano fungere da “sentinelle” per la identificazione dei futuri cambiamenti degli ecosistemi marini.
7
CAPITOLO I – AREA DI STUDIO 1.1 Aspetti ambientali del Mar Ligure
Il Mar Ligure costituisce la parte più settentrionale del bacino occidentale del Mediterraneo, bagna le coste della Liguria, della Provenza e della Corsica (Fig. 1.1). È un mare abbastanza profondo, con un massimo che si aggira intorno ai 2600m (a Nord della Corsica), con fondali di vario tipo (sabbiosi, rocciosi e fangosi) che garantiscono un’importante biodiversità.
Figura 1.1 - Localizzazione geografica e confini del Mar Ligure
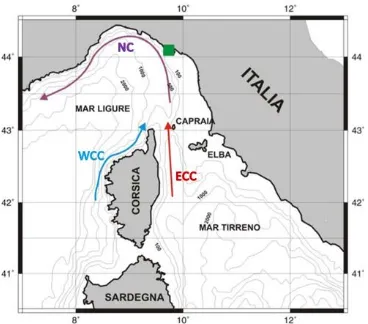
Il movimento delle correnti segue la direzione da Levante a Ponente. La circolazione del Mar Ligure è ben nota e studiata in quanto prende parte della circolazione ciclonica del Mar Mediterraneo, si sviluppa in senso antiorario ed è alimentata da due correnti: la corrente del Tirreno (TC), calda e salata che giunge in Mar Ligure attraverso il Canale della Corsica (Artale et al., 1994) e la corrente della Corsica occidentale (WCC). Queste correnti avendo la stessa direzione, verso Nord, si incontrano generando la corrente del Mar Ligure (Fig. 1.2). Come riportato da Sertorio et al. (1990), nel Mar Ligure si possono individuare tre zone concentriche idrologicamente differenti:
1. Una zona centrale di divergenza debolmente stratificata con salinità e densità elevata (superiori al 38,3 %0 ed a 29,00 kg/mc) e ricca di Sali nutritivi;
8
2. Una zona periferica di bassa salinità (inferiore al 38%0) e densità (inferiore a 29,00
kg/mc) e povera di nutrienti;
3. Una zona frontale situata tra le precedenti, caratterizzata da un ripido gradiente di densità con aumento verso la zona centrale
Figura 1.2 - Circolazione mar Ligure. NC, Corrente del Nord; WCC, Corrente della Corsica occidentale; ECC, Corrente della Corsica orientale
Questa circolazione presenta un andamento stagionale con maggiori flussi tirrenici in inverno mentre il flusso a Ovest della Corsica rimane stabile per tutto l’anno (Cattaneo et al., 2010; Doglioli, 2004). Questa differenza nei flussi è dovuta anche all’Oscillazione Nord Atlantica (NAO), che secondo diversi autori è responsabile della variabilità della produzione primaria e dello zooplancton (Fromentin and Planque, 1996).
Nel lavoro di Cattaneo et al. (2010), queste variazioni hanno delle ricadute anche a livello ecologico, modificando l’abbondanza e la distribuzione di diverse specie marine; osservando inoltre che una delle principali cause di cambiamenti della popolazione di specie è l’aumento della temperatura delle acque superficiali del Mar Ligure (processo di meridionalizzazione). In media la temperatura della colonna d’acqua è di circa 14 – 15°C nelle stagioni fredde e circa 21 – 22°C nei mesi più caldi.
9
Costante per tutto l’anno il valore di salinità che si aggira intorno ai 37 – 38 PSU (Astraldi e Manzella 1983; Astraldi e Gasparini 1986).
Le acque del Mar Ligure dal punto di vista trofico seguono l’andamento generale del Mediterraneo, classificandosi come acque fortemente oligotrofiche e solo in alcuni periodi stagionali (soprattutto primavera) come mesotrofiche (Misic e Fabiano 2006). Anche l’area costiera del Mar Ligure è generalmente oligotrofica; le principali sostanze che entrano nell’acqua di mare (particolato e materia disciolta, nutrienti inorganici, detriti organici) derivano principalmente da apporti fluviali, derivazione atmosferiche che danno origine a fioriture algali localizzate e temporanee (Misic et al., 2011).
1.2 Aspetti ambientali del Promontorio di Portofino
Grazie alle caratteristiche geomorfologiche e le condizioni idrodinamiche, il promontorio di Portofino presenta un ambiente marino ricco e molto diversificato (Doglioli, 2004; Zeichen et al., 2008). Con il decreto del Ministero dell’ambiente del 26 Aprile 1999 l’area che comprende i comuni di Camogli, Portofino e S. Margherita Ligure, viene dichiarata Area Marina Protetta (www.portofinoamp.it). Il promontorio di Portofino si trova lungo la costa ligure nel Levante a circa 25 km a est di Genova e si estende per 13 km, con una forma quadrangolare (Fig 1.3).
Il lato meridionale è caratterizzato da scogliere sommerse, mentre i lati occidentali discendono più gradualmente.
10
Il promontorio di Portofino si inserisce nel contesto ambientale precedentemente descritto per il Mar Ligure sia dal punto di vista idrodinamico sia dal punto di vista trofico.
Tuttavia, la circolazione intorno al Promontorio è assai complessa perché legata sia alle forzanti meteo-climatiche (direzione e intensità del vento) e idrodinamiche (circolazione dominante), sia all’interferenza del promontorio stesso insieme alla stretta piattaforma continentale (Cattaneo Vietti, et al., 2015; Doglioli, et al., 2004a, b). Serie storiche di corrente, pur non acquisite contemporaneamente, mostrano che la corrente al largo di Sestri Levante in inverno ha direzione Nord-Ovest (corrente liguro - provenzale), coerente a tutte le profondità, mentre dall’altro lato del promontorio ha direzione opposta cioè Sud-Est con qualche variazione nella componente verticale e, infine, al largo di Bogliasco ovvero 15 km a valle del promontorio ha nuovamente direzione Nord-Ovest e coerenza a tutte le profondità, confermati anche da modelli numerici (Doglioli et al. 2004 a).
La predominanza della corrente verso Sud-Est durante i rilevamenti nei pressi di Camogli suggerisce l’esistenza di un vortice di ricircolazione o anticiclonico con un’intensità dell’ordine del 10% della corrente di entrata e con un’estensione minore di 15 km. Tale vortice è stato messo in evidenza nel periodo primaverile da un drifter superficiale, catturato dalla corrente costiera (Cattaneo-Vietti et al. 2015), ma la presenza di una trappola per pesci, tonnarella, nell’area prospiciente Camogli fin dal 1600, testimonia come il vortice sia una struttura che si presenta regolarmente nell’area. Occasionali inversioni di corrente al largo di Camogli possono essere indotte dai venti locali.
Di fronte al capo occidentale del Promontorio (Punta del Faro), la corrente principale da Est verso Ovest può intensificarsi ed essere allontanata dal promontorio verso il largo (in caso di venti da NE e SE), mentre occasionalmente, nel caso di venti da SSO, la circolazione costiera all’interno del Golfo del Tigullio si intensifica, come conseguenza di accumulo d’acqua lungo costa generando un vortice a monte e uno contro corrente costiera da Ovest verso Est (Doglioli et al. 2004b).
11
Diversi corsi d’acqua a regime torrentizio sfociano nel Golfo del Tigullio, ma generalmente non portano ad elevate immissioni di acqua dolce. Anche per tale motivo, le acque costiere intorno al Promontorio mantengono una spiccata oligotrofia (Morabito et al. 2018), come le acque più al largo, che tende ad essere più pronunciata negli anni recenti rispetto al passato (Parravicini et al. 2013).
Il principale apporto di acqua dolce deriva dal torrente Entella che sfocia tra Chiavari e Lavagna (Fig. 1.4). Si tratta di un corso d’acqua che si estende per 7 km e il suo bacino si estende per 375 km2 (Roccati et al., 2019) ha una portata media annua di
circa 15m3/s nonostante ciò è soggetto a forti eventi di piena autunnale, anche di
2800m3/s (ARPAL Liguria), che talvolta possono portare ad importanti esondazioni
come accaduto nel Novembre del 2002 (Roccati et al., 2018).
L’area costiera del Promontorio è caratterizzata da una temperatura di circa 14 – 18°C nei mesi freddi mentre nei mesi caldi nello strato superficiale si aggira intorno ai 23 – 25°C, con punte anche maggiori in luglio-agosto; la salinità risulta essere costante per tutto l’anno su valori intorno ai 37-38 PSU, ma può scendere in coincidenza con l’arrivo di acque continentali (Misic et al 2011, Cappari et al 2020, Di Carro et al 2018) (Fig. 1.4).
12
Il torrente Entella, infatti, insieme agli altri corsi d’acqua minori che sfociano del golfo del Tigullio (Fig. 1.5), è importante in quanto modifica le condizioni fisico – chimiche e biologiche dell’ambiente marino, sia come input di nutrienti inorganici sia in quanto favorisce la stabilità della colonna d’acqua, diminuendo la salinità; questo influenza le dinamiche delle biomasse fitoplanctoniche che risentono in tempi brevi dell’input di nutrienti (Povero et al 2002, Ruggieri et al 2006).
Molti autori hanno evidenziato come l’apporto di acqua dolce in aree oligotrofiche sia molto importante negli equilibri e nelle dinamiche fitoplanctoniche che rispondono in maniera rapida ai cambiamenti nelle concentrazioni dei sali nutritivi (Guadayol, et al., 2009; Arin, et al., 2013).
Figura 1.5 - Immagine satellitare del torrente Entella (freccia)
Il promontorio di Portofino è un’area molto urbanizzata e turistica (Zeichen M., et al., 2008) con un forte sviluppo della nautica da diporto (Venturini et al. 2016, in press), ciò può far pensare che altri possibili input di sostanze organiche e inorganiche possano derivare da attività antropica, come è stato dimostrato da recenti studi (Di Carro et al. 2018). Se da una parte questi input possono rappresentare anche una sorgente di nutrienti inorganici favorendo così i bloom fitoplanctonici, un carico di nutrienti eccessivo, dovuto anche agli scarichi urbani, e la presenza di sostanze inquinanti ha già deteriorato i popolamenti bentonici nel Golfo del Tigullio portando una riduzione della complessità dell’architettura delle comunità tra l’inizio degli anni
13
’90 e la fine del primo decennio del 2000, lambendo anche la zona costiera del Promontorio parte dell’AMP Portofino (Parravicini et al. 2013).
1.3 Aspetti Biologici
1.3.1 Fitoplancton
Gli organismi fitoplanctonici, per la maggior parte unicellulari, sono presenti lungo la colonna d’acqua, sia dolce che salata, e non avendo movimenti propri subiscono il trasporto passivo da parte delle onde e delle correnti. Un parametro importante per il fitoplancton è la taglia, sia perché influenza i rapporti con i livelli trofici successivi sia perché influenza le modalità di assorbimento dei nutrienti; ad esempio le specie più piccole (diatomee) mostrano una maggiore efficienza nell’assorbire i nutrienti siccome presentano un rapporto superficie/volume maggiore, ma possono essere più facilmente predate.
In base alla taglia, quindi, il fitoplancton può essere classificato in (Fig. 1.6):
picoplancton (0.2 – 2 µm), nanoplancton (2 - 20 µm) e microplancton (20 – 200 µm)
(Malone T. C., 1980).
Figura 1.6 – Classi dimensionali del fitoplancton.
Essendo organismi fotoautotrofi sono tra i maggiori responsabili della produzione primaria del pianeta, circa il 35-45% dei processi fotosintetici avviene in ambiente acquatico (Falkowski I.P.G e Raven J.A., 2007).
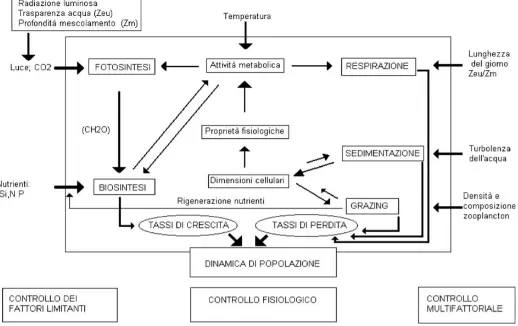
Le dinamiche delle comunità algali sono controllate da molti fattori abiotici e biotici (Fig. 1.7). Uno dei principali fattori è la profondità della zona eufotica e quella di
14
rimescolamento delle acque in quanto influiscono pesantemente sull’attività fotosintetica, infatti la circolazione delle acque superficiali condiziona la permanenza delle alghe nella zona eufotica e la loro possibilità di sottrarsi ad una esposizione prolungata alla radiazione luminosa, evitando di essere fotoinibite con conseguente riduzione dell’efficienza di produzione.
Anche fattori chimici influiscono sulla densità fitoplanctonica, infatti dopo la luce e la temperatura, la disponibilità di nutrienti è il fattore che più condiziona la crescita algale, in particolare silice, azoto e soprattutto fosforo. La disponibilità di nutrienti per le alghe è spesso legata all’attività di organismi appartenenti ad altri livelli trofici. Il ciclo dei nutrienti nella colonna d’acqua costituisce, per esempio, un legame importante tra fitoplancton e zooplancton: infatti, soprattutto nelle acque oligotrofiche i nutrienti rigenerati dallo zooplancton rappresentano una fonte di mantenimento di particolare importanza per le alghe. Di contro lo zooplancton può influire negativamente sullo sviluppo algale attraverso la predazione (grazing), di cui risentono maggiormente le alghe di minori dimensioni, che di solito sono quelle con i più alti tassi di crescita e di assimilazione. La riduzione della biomassa algale causata dal grazing può indurre una minore richiesta di nutrienti, col risultato di aumentarne la disponibilità per le alghe meno commestibili, altrimenti sfavorite dai loro bassi tassi di assimilazione (Michaels A. F., 1988).
Accanto al controllo top-down esercitato dallo zooplancton sulle alghe, esiste anche una efficiente azione di controllo bottom-up, esercitata dai batteri, i quali possono entrare in competizione con le alghe per i nutrienti, in particolare per il fosforo. Il rapporto tra alghe e batteri è molto complesso. In varie occasioni si osserva una sorta di mutualismo tra i due gruppi di organismi: i batteri mineralizzano il fosforo per le alghe e queste producono carbonio per la crescita batterica. Lo spostamento da una situazione di competizione ad una di mutualismo sembra essere legato alle disponibilità di carbonio e di fosforo (Lacroix M. e Grégoire G., 2001). In ambienti oligotrofi la disponibilità di fosforo può essere un fattore limitante per entrambi: questa situazione può innescare fenomeni di competizione che vedono prevalere i
15
batteri. In ambienti eutrofici, invece, il rapporto C:P si abbassa, riducendo il vantaggio dei batteri, che diventano dipendenti dalle alghe per il rifornimento di carbonio (Morabito 1997)
Figura 1.7- Fattori di controllo della dinamica della comunità fitoplanctonica e loro interazioni
Nel sito LTER dell’area di Portofino, recenti studi sulle comunità fitoplanctonica delle acque superficiali condotti sia con analisi al microscopio inverso che tramite lo studio dei pigmenti fotosintetici, mostrano un’evoluzione stagionale tipica di altre aree costiere e del largo mediterranee (Vidussi et al. 2000, Marty et al. 2002, Siokou-Frangou et al. 2010, Arin et al. 2013, Valencia-vila et al. 2016). Questi studi hanno evidenziato che il gruppo più abbondante lungo tutto l’anno è rappresentato dalle diatomee (anche in forma coloniale), che diventano dominanti nel periodo tardo – invernale/inizio primaverile e nuovamente in autunno, con l’arrivo di nutrienti azotati.
I coccolitoforidi sono mediamente sempre presenti, e aumentano il loro contributo percentuale nelle stagioni più calde. I dinoflagellati sono quasi completamente assenti nei periodi freddi ma presenti invece in primavera - estate. Raramente osservate le euglene e le dictiocoficee, queste ultimi solo nei mesi autunnali e invernali. Il nanoplancton è sempre presente ed aumenta il suo contributo percentuale al diminuire
16
delle diatomee (microplancton) soprattutto in estate, quando sono presenti anche organismi picoplanctonici come cianobatteri (Bistolfi, Tesi AA 2017/2018).
1.3.2 Meso – zooplancton
Con il termine plancton si comprendono tutti gli organismi in sospensione nella colonna d’acqua, incapaci di nuotare attivamente ma trasportati dalle correnti principali; alcuni organismi zooplanctonici hanno sviluppato delle strutture atte a contrastare l’affondamento, come la presenza di ciglia, appendici natatorie o la presenza di sostanze lipidiche che aiutano a diminuire la densità corporea rispetto il mezzo esterno. Lo zooplancton presenta un’importante variabilità funzionale, dimensionale, strutturale e di distribuzione sia spaziale che temporale, motivo per il quale la sua classificazione deve fare riferimento all’utilizzo di diversi criteri (Fig.
1.8).
Figura 1.8- Gruppi zooplanctonici - ruolo ecologico. Romagnan et al. (2015)
In base al ciclo biologico lo zooplancton può essere diviso in: oloplancton, se trascorre l’intero ciclo vitale nella colonna d’acqua, o meroplancton ovvero organismi che trascorrono solo una parte del loro ciclo vitale nella colonna d’acqua. In base alle modalità di nutrizione lo zooplancton può essere definito fagotrofo se si nutre di particelle vive e non. Inoltre in base alla loro dieta li possiamo identificare generalmente come organismi erbivori, onnivori o carnivori.
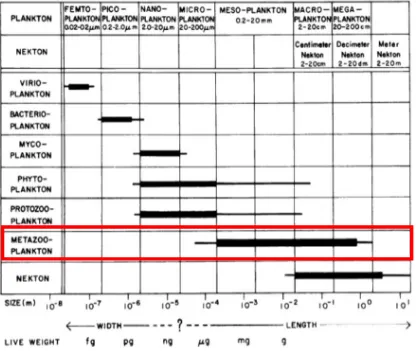
In base alle dimensioni degli organismi lo zooplancton viene suddiviso in diverse categorie (Fig. 1.9). Le dimensioni minori sono caratteristiche di picoplancton
(0,2-17
2 µm) e nanoplancton (2-20 µm), segue per dimensioni il microzooplancton (20-200 µm), il mesozooplancton (0,2- 9 2 mm), il macrozooplancton (2-20 cm) e il
megaplancton (>20cm).
In questo lavoro di tesi la classe dimensionale scelta è quella del mesozooplancton.
Figura 1.9 - Classi dimensionali dei differenti compartimenti trofico-tassonomici del plancton. Sieburth et al., (1978).
Lo zooplancton costituisce l’anello chiave tra i produttori primari e i livelli trofici successivi: il fitoplancton viene consumato dalla componente erbivora dello zooplancton, soprattutto Copepodi, che a loro volta supportano i pesci plancto-trofici. Un’altra caratteristica unica dello zooplancton sono i fenomeni di migrazioni verticali giornaliere, innescati da cicli giorno – notte (oltre alle migrazioni stagionali e ontogenetiche). Questo fenomeno molto interessante e unico nel suo genere ancora non è del tutto chiaro, ma sicuramente è fondamentale nel trasporto di carbonio e altri nutrienti dalla superficie al fondo.
La distribuzione spaziale dello zooplancton nei mari non è di tipo casuale ma è influenzata dalle caratteristiche delle masse d’acqua, sia su larga che piccola scala e dall’insieme delle caratteristiche fisiologiche e comportamentali degli stessi organismi. La distribuzione a livello geografico è influenzata principalmente dalla temperatura dell’acqua. All’interno dello stesso range di temperatura la distribuzione
18
locale viene invece influenzata soprattutto dalla salinità, ma anche da altri fattori come: differenze nella profondità, velocità delle correnti, energia delle onde e torbidità. La maggior parte dei taxa appartenenti allo zooplancton mostrano infatti preferenze per specifici habitat o condizioni idrografiche a cui è legata anche l’opportuna disponibilità trofica (Johnson e Allen, 2005).
Dal punto di vista numerico, tra i maggiori rappresentati del mesozooplancton ci sono i Copepodi (Fig. 1.10). Gruppo tassonomico molto diversificato, con strategie trofiche differenti a seconda della dieta della specie, infatti troviamo organismi erbivori, carnivori e onnivori. Tutta l’area ligure orientale ospita una comunità zooplanctonica con caratteristiche simili, infatti nel sito LTER dell’area di Portofino studi condotti sulle comunità zooplanctoniche mostrano un’evoluzione stagionale tipica di altre aree costiere e del largo mediterranee, con un picco annuale in primavera (Morabito et al. 2018), in accordo con quanto osservato nel Golfo del Tigullio da Licandro e Ibanez (2000). In quest’area insieme ai taxa dominanti
Clausocalanus spp. e Oithona spp. sono presenti altri taxa tipici delle acque costiere
- diverse specie di Paracalanus, Clausocalanus furcatus, Ctenocalanus vanus,
Oncaea e Corycaeus, chaetognathi e doliolidi (Licandro e Icardi, 2009). Si tratta di
specie neritiche opportuniste che aumentano il loro tasso riproduttivo in concomitanza con i massimi valori di produzione primaria, e quindi particolarmente abbondanti nel periodo primaverile-estivo fino a diventare dominanti (Guglielmo et al., 2002). Un altro taxon che in alcuni periodi può raggiungere elevate abbondanze è quello dei Cladoceri. Le specie che si possono usualmente trovare sono Penilia
avirostris, Evadne spinifera, Podon spp. Oltre ai Copepodi ed ai Cladoceri, si trovano
anche: Appendicularia, Chaetognatha, Cnidari e Siphonophora, Thaliacea, uova e larve di Teleostei.
19
CAPITOLO II – MODELLIZZAZIONE 2.1 Approccio modellistico
L’ecosistema rappresenta l’unità funzionale fondamentale dell’ecologia, poiché comprende sia gli organismi sia l’ambiente abiotico, che si influenzano reciprocamente e che sono entrambi necessari per il mantenimento della vita quale noi conosciamo sulla Terra (Odum 1971).
Odum (Odum 1971) definisce l’ecosistema come “l’unità che include tutti gli organismi che vivono insieme (comunità biotica) in una data area, interagenti con l’ambiente fisico in modo tale che un flusso di energia porti ad una ben definita struttura biotica e ad una ciclizzazione dei materiali”. Le relazioni reciproche tra organismi ed ambiente abiotico si traducono in flussi di energia e ciclizzazione dei materiali che permettono il mantenimento strutturale e funzionale del sistema stesso. A causa della grande complessità degli ecosistemi risulta impossibile analizzarne componenti e dettagli.
La moderna teoria degli ecosistemi offre due principali metodi analitici sulla base di due differenti punti di vista (Nielsen 2000). Il primo considera gli ecosistemi come delle ‘macchine’ dissipative che si mantengono ‘consumando’ energia per costruire strutture al loro interno. il secondo affronta la struttura degli ecosistemi secondo un approccio modellistico, legato a tecniche e teorie derivate dallo studio delle reti e dei grafi in relazione ai flussi di un sistema in stato stazionario:
I. Approccio termodinamico
Gli ecosistemi sono sistemi viventi che grazie allo scambio di energia con l’ambiente esterno riescono a mantenere la propria struttura ad un livello di organizzazione superiore rispetto all’ambiente circostante. La ricezione di energia dall’esterno, nella fattispecie energia solare, e lo scarto di energia di bassa qualità verso l’esterno sotto forma di calore caratterizzano gli ecosistemi come sistemi termodinamici aperti.
20
I sistemi naturali riescono a ordinare le proprie strutture interne rilasciando verso l’esterno l’entropia generata durante il processo evolutivo: l’approccio termodinamico al loro studio si occupa appunto della valutazione dell’efficienza con cui questo procedimento viene condotto.
II. Approccio modellistico
La struttura di un ecosistema può essere analizzata adottando un approccio modellistico che concentri l’analisi sui flussi attivi all’interno del sistema. Questi modelli sono in grado di sviluppare caratteristiche tipiche dei sistemi naturali come, ad esempio, la capacità di auto correggersi per sfruttare al meglio le risorse disponibili.
In questo caso la struttura è data dalla disposizione dei sottosistemi e delle componenti in uno spazio tridimensionale in un dato momento. Ciascun sottosistema possiede una certa autonomia, sebbene subisca un condizionamento dagli altri livelli attraversi i flussi di informazione ed energia che li collegano.
Le principali proprietà di un sistema di questo genere sono quattro (Odum E.P., 1971):
1. Gli elementi di un sistema dipendono gli uni dagli altri, in particolare dal loro funzionamento, e costituiscono dunque una rete di interazioni. Ciascuna interazione è mutuale, cioè a dire funziona asimmetricamente nei due sensi. 2. Il livello di interazioni che definisce il sistema vivente comporta, come aspetto
essenziale, uno scambio incessante di materia ed energia tra gli elementi del sistema.
3. Per contro, l'insieme agisce sulle parti: le proprietà ed il funzionamento di un elemento immerso in un sistema sono differenti dalle proprietà e dal funzionamento dello stesso elemento isolato.
4. L’organizzazione di un sistema vivente è di tipo gerarchico.
Gli scambi tra gli elementi sono rappresentati da flussi di energia, materia ed informazione. In base alla prima e alla seconda legge della termodinamica i flussi in
21
entrata devono bilanciare quelli in uscita e ogni trasferimento è necessariamente accompagnato da una dispersione di energia. Gli ecosistemi dunque sono caratterizzati da numerose reti di informazione, rappresentate principalmente dai flussi di comunicazione fisico-chimici che permettono l’interazione di tutte le componenti e la regolazione del sistema. La natura cibernetica dell’ecosistema permette l’equilibrio, l’autoregolazione nonché il sinergismo delle sue componenti. I meccanismi di comunicazione all’interno del sistema svolgono un’azione di controllo per preservare e migliorare la funzionalità generale attraverso il meccanismo del controllo a feedback (detto anche feedback loop), caratteristica fondamentale dei sistemi cibernetici (Wiener 1948). Il feedback è una azione di controllo regolata in funzione delle uscite dal sistema e può operare secondo due diverse modalità:
1. Il feedback positivo interviene per accrescere determinate funzioni è indispensabile per lo sviluppo e la crescita degli organismi (effetto dirompente); 2. Il feedback negativo interviene nella regolazione e nel mantenimento degli
equilibri (effetto stabilizzante).
I meccanismi di controllo negli ecosistemi sono interni e diffusi nel sistema e non richiedono controlli o regolazioni dall’esterno ma prevedono interazioni fra sub-sistemi primari e secondari.
Tecnicamente un feedback consiste in una linea di flusso che si stacca dal flusso principale per riconnettersi più a monte. Si parla di feedback positivo quando il flusso di ritorno aumenta il flusso nel punto di rientro e intersezione e di feedback negativo quando invece diminuisce il flusso nel punto di rientro e intersezione.
Nonostante la presenza di questi controlli un sistema soggetto a stress potrebbe non essere in grado di ritornare alle condizioni iniziali e stabilizzarsi su altre condizioni di equilibrio. E’ accertata la teoria di Holling C.S. (1973) per la quale gli ecosistemi hanno più di uno stato di equili
22
brio e, spesso, dopo una perturbazione raggiungono una condizione di equilibrio differente da quella precedente.
I meccanismi di controllo, in ogni caso, forniscono ai sistemi ecologici la capacità di contrastare un disturbo e dunque garantiscono delle condizioni di stabilità.
La stabilità di un sistema si identifica per mezzo di diverse caratteristiche fra le quali si hanno:
- Resistenza: rappresenta la capacità di resistere ad un disturbo mantenendo struttura e funzioni invariate
- Resilienza: rappresenta la capacità di recupero quando il sistema ha subito una modificazione indotta da una perturbazione
- Persistenza: indica il livello di soglia di un sistema oltre il quale il disturbo viene avvertito.
R.E. Ulanowicz ha recentemente sviluppato una nuova interpretazione della dinamica degli ecosistemi. Il tentativo di Ulanowicz consiste nel ricercare una descrizione non solo qualitativa ma anche quantitativa delle interazioni dei componenti di un ecosistema fra loro e con l’ambiente fisico in cui essi vivono, basandosi esclusivamente sulla valutazione dei fattori termodinamici e sulla teoria dell’informazione (Ulanowicz 1997).
La descrizione di un sistema tramite un modello attraverso funzioni matematiche è sempre una semplificazione che tende ad azzerare i fattori casuali ed imprevedibili che possono intervenire durante lo sviluppo dell’ecosistema. Attraverso l’approccio olistico è stato possibile trasformare questo difetto descrittivo in un punto di forza: il modello infatti tenderà a valutare i flussi di energia e massa e la qualità di tale trasferimento, escludendo le eventuali situazioni che li hanno generati
23
2.1 Indici trofodinamici
Ascendency, Capacity, Overhead e Throughput
L’ascendency è un indice olistico che valuta il flusso della biomassa all’interno del sistema. La sua natura nasce dalla teoria dell’informazione ed in particolare dall’indice di Shannon - Wiener; tale indice calcola la diversità sussistente all’interno di un sistema attraverso la seguente formula:
− = S tot i tot i B B B B k D 1 2 log (1)Dove k è un fattore moltiplicativo, S è il numero totale di specie coinvolte nel sistema,
Bi è la biomassa della specie i e Btot è la biomassa totale del sistema. La frazione Bi/Btot rappresenta la probabilità che una determinata biomassa (o specie) sia presente in un determinato periodo di tempo nell’area specificata.
La teoria olistica unisce ai principi dell’informazione quelli della termodinamica: in particolare Ulanowicz ha applicato alla legge della diversità il calcolo dei flussi di energia attraverso il TST (Total system throughput).
Questo indice valuta la sommatoria di tutti i possibili flussi di energia che intervengono all’interno di ogni comparto del sistema.
La formula per il TST è data da:
tot tot
tot
tot Respirazione Esportazione Flussoaldetrito
Consumo
TST = + + + Quindi
applicandola alla (1.1) si ottiene:
− = n tot i tot i T T T T k D 1 2 log (2)dove Ti rappresenta il flusso i-esimo su tutti gli n possibili ed Ttot il TST totale del comparto ossia Ti.
24
Ora applicando questa formula per tutti i comparti componenti il sistema (quindi i gruppi di specie) si può descrivere la probabilità che un determinato flusso partito dal gruppo i entri in contatto con il gruppo j, ossia il termine Tij.
Tale probabilità si esprime attraverso la frazione:
= = n q iq ij ij T T P 1 (3)Dove il denominatore rappresenta la sommatoria di tutti i possibili flussi in uscita da
i.
Ora dato che dalla teoria della probabilità è noto che due eventi indipendenti hanno probabilità di verificarsi contemporaneamente o in una data sequenza pari al prodotto delle singole probabilità e dato che dalla teoria dell’informazione tale prodotto determina la mutua informazione reciproca si ha che fra
tot ij T T e Pij sussista:
= = = = = n i n j n q n r rj iq tot ij tot ij T T T T T T k I 1 1 1 1 2 log (4)Dove k è una costante moltiplicativa e Tij è il flusso in uscita dal gruppo i-esimo diretto al gruppo j-esimo.
Sostituendo alla costante k il valore T si ottiene la formula per l’ascendency:
= = = = = n i n j n q n r rj iq tot ij tot ij tot T T T T T T T A 1 1 1 1 2 log (5)Applicando nella stessa notazione la biomassa otteniamo il prodotto fra
= q r tot rj iq tot j i T T T B B B 2 2 e tot q r rj iq ij tot T T T B B T
=25
= = = n i n j i j ij ij T B B B T T A 1 2 log (6)La (5.6) viene detta Expanded Ascendency e permette una valutazione quantitativa della biomassa coinvolta nei flussi all’interno del sistema.
In genere si è potuto dimostrare che un aumento della Ascendency indica un aumento della diversità delle specie, una alta efficienza nello sfruttamento delle risorse e quindi una alta specializzazione della rete trofica (Christiensen V., 1995. Mageau M.T. et al, 1998).
Quindi un aumento di ascendency descrive un aumento della crescita dell’ecosistema. Tale aumento è limitato superiormente da una caratteristica tipica di ogni ecosistema ossia la Capacity (capacità di sviluppo).
Questo fattore può essere calcolato come: C =HT
dove H è la “entropia statistica” definita come:
= = n i i i Q Q H 1 log dove
+ = = + = = 2 1 , 0 2 1 n m l lm n k ki i T T Q (7)in cui Qi identifica la probabilità che un flusso passi attraverso il gruppo i-esimo. Nella equazione (7) a numeratore vi è la somma dei flussi che interessano il gruppo i-esimo e a denominatore la quantità totale dei flussi nel sistema. Questo indice fornisce un limite superiore oltre al quale l’ascendency non può crescere e riflette la quantità di “energia di riserva” che il sistema ha a disposizione per affrontare una perturbazione inaspettata (Ulanowicz R.E. 1986).
La differenza fra la capacità di sviluppo e l’ascendency è detta System Overhead e può essere interpretato come misura della stabilità di un ecosistema.
26
Rapporto fra produzione primaria totale e respirazione totale.
Questo bilancio è considerato da Odum (Odum, 1971) come un importante indice di
maturità di un ecosistema. Nei primi stadi di crescita di un sistema si considera che
la produzione sia più consistente della respirazione, con un bilancio maggiore di 1. Al contrario in sistemi che soffrono di inquinamento organico il bilancio tende a scendere sotto 1.
In sistemi maturi il bilancio tenderà invece ad 1: ossia l’energia fissata è bilanciata dal costo del mantenimento del sistema.
Questo indice è dimensionale e contiene sempre valori positivi. Produzione netta del sistema
La produzione netta del sistema è la differenza tra la produzione primaria totale e la respirazione totale.
Come si può dedurre dalla discussione sulla maturità, la produzione netta sarà elevata negli ecosistemi giovani e vicino a zero in quelli maturi. Inoltre i sistemi con elevati importi possono portare questo indice a valori negativi.
La produzione netta è un flusso per cui la sua unità di misura sarà [peso]/[area]/[tempo], in genere t/km²/anno.
Rapporto fra produzione primaria e biomassa totale.
Anche questo indice è considerato funzione della maturità di un sistema. Negli ecosistemi giovani, la produzione eccede la respirazione e come conseguenza ci si può aspettare un accumulo successivo. Questo alternativamente influirà sull’indice di produzione primaria e biomassa, che potrà diminuire.
Rapporto fra biomassa totale e throughput
La biomassa totale di sistema che è supportata dal flusso di energia disponibile può aumentare sino al massimo relativo allo stadio di maturazione di un sistema (Odum, 1971).
27
Biomassa totale del sistema (escluso il detrito)
Questo valore rappresenta semplicemente la somma delle biomasse dei gruppi del sistema.
Indice di connettanza (CI)
L’indice di connettanza è per una data rete trofica, il rapporto fra il numero di collegamenti reali e il numero di collegamenti possibili.
L’apporto al detrito (dai detrivori) è incluso nel conteggio, ma il collegamento opposto (ossia il detrito alimentato in altri gruppi) è ignorato.
E’ stato osservato che l’attuale numero di collegamenti in una rete trofica è proporzionale al numero di gruppi nel sistema (Nee 1990).
Odum ha previsto che la struttura della catena alimentare sarebbe cambiata da lineare a forma di rete quando un sistema avesse raggiunto la maturità (Odum, 1971). Per questa ragione l’indice di connettanza può essere correlato alla maturità di un ecosistema.
Il valore di questo indice è, nei sistemi marini, largamente determinato dal livello di dettaglio tassonomico usato per rappresentare i gruppi predatori e ciò preclude paragoni significativi tra i sistemi.
System omnivory index
Rappresenta l’alternativa all’indice di connettanza.
Questo indice è definito come la media degli Omnivory Index di tutti i consumatori pesata rispetto al logaritmo della quantità di cibo utilizzata da ciascun predatore. Si utilizza il logaritmo perché si suppone che il tasso di prelievo del cibo sia approssimativamente distribuito secondo un andamento logaritmico.
Il System Omnivory Index è in definitiva una misura di quanto le interazioni fra i diversi gruppi siano distribuite fra i livelli trofici e esula dai problemi che presentava la connettanza fra cui la dipendenza dalla definizione dei gruppi trofici delle prede e la non rilevanza del peso di una preda nella dieta di un predatore.
28
Rapporto respirazione e biomassa
In un ecosistema, il rapporto fra respirazione totale (R) e biomassa totale (B) può rappresentare una funzione di ordine termodinamico (Odum, 1971). Tale rapporto viene chiamato da Odum ‘Schrödinger ratio’ e mostra che un sistema biologico in presenza di vibrazioni termiche, deve continuamente espellere ‘disordine’ per mantenere un ordine interno.
Così maggiore è la biomassa più alto sarà il costo del mantenimento.
Tutti i sistemi biologici tendono a massimizzare il rapporto R/B nello sviluppo evolutivo.
Produzione primaria netta
Rappresenta la differenza tra il totale della produzione primaria inserito nel modello e quello calcolato dal software. Questa differenza dovrebbe essere sempre maggiore o uguale a zero.
Si considera che questo bilancio valuti il contributo non assegnato al detrito dai produttori primari e in particolare viene descritto come importo diretto al detrito e non come flusso dai produttori primari al detrito.
2.2 VOR
La valutazione della salute di un ecosistema presenta numerosi problemi: occorre evitare di interpretare la salute di un ecosistema in termini dei vantaggi che da esso se ne possono ricavare, le diverse componenti di un sistema naturale potrebbero non reagire ugualmente ad un cambiamento, i limiti di variabilità di un ecosistema sono spesso difficilmente interpretabili, eccetera.
Nonostante ciò numerosi progressi sono stati ottenuti negli anni recenti nella definizione del concetto e nella capacità di misura della salute degli ecosistemi (Costanza R., 1992. Ehrenfeld D., 1995. Campbell D., 2000). Qualsiasi definizione di salute degli ecosistemi deve comprendere sia informazioni riguardanti la struttura (come le specie e le popolazioni) sia la funzionalità (flussi di energia e materia).
29
Secondo Costanza per comprendere i sistemi complessi è necessario definirne la capacità complessiva (overall performance) e quindi lo stato di salute attraverso una misura comprensiva, multiscala, dinamica e gerarchica del Vigore, dell’Organizzazione e della Resilienza del sistema (V.O.R.) (Costanza R., 1999). Per fare questo è necessario è necessario definire l’importanza relativa dei singoli elementi che descrivono il sistema (endpoint indicators) e interpretare queste informazioni con un approccio integrato.
- Il vigore valuta la produttività totale dell’ecosistema,
- L’organizzazione rappresenta la diversità di specie ma anche il loro grado di interconnessione,
- La resilienza misura la capacità dell’ecosistema di mantenere struttura e funzionalità quando subisce uno stress.
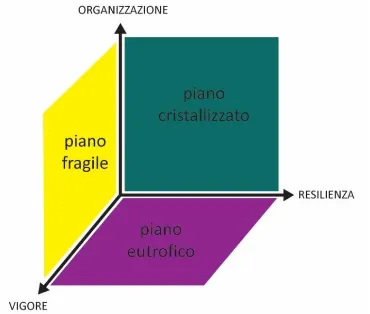
Di conseguenza secondo Costanza un ecosistema in salute è un sistema produttivo (V), che si auto-mantiene (O) e che tende a minimizzare le alterazioni indotte da stress esterni (R) (Boesch D., 2001). In quest’ottica è possibile rappresentare lo stato del sistema in un grafico tridimensionale (Mageau M.T., 1995), i cui assi sono individuati dai tre indicatori proposti (Errore. L'origine riferimento non è stata trovata.). Costanza definisce come “not healthy” le situazioni nelle quali una delle componenti è pari a zero: se il vigore è ridotto il sistema è considerato cristallizzato, alla stregua del ghiaccio o delle rocce, se manca l’organizzazione il sistema è dominato dalle specie a strategia r e dunque viene definito eutrofico (questa situazione si può presentare sia in specchi d’acqua chiusi ricchi di nutrienti sia in presenza di specie pioniere che colonizzano un nuovo ambiente), infine una ridotta resilienza implica che il sistema non sia in grado di ripristinare se stesso in seguito ad una alterazione delle condizioni ambientali e viene per questo definito fragile (Fig. 2.1)
30
Figura 2.1- modello tridimensionale del sistema V.O.R. (Mageau M.T., 1995)
La quantificazione delle tre variabili può avvenire in diversi modi, in funzione dei dati disponibili e della loro significatività.
Ai fini della nostra analisi abbiamo scelto di riferirci ai seguenti parametri: - Total system throughput per il vigore;
- Information per l’organizzazione,
- Overhead per la resilienza (Overhead= Capacity – Ascendency)
Il metodo proposto da Costanza mette in evidenza il fatto che le cosiddette proprietà
emergenti dei sistemi complessi possono essere facilmente identificate utilizzando un
31
CAPITOLO III – MATERIALI E METODI 3.1 Piano di campionamento
Il lavoro di tesi rientra nel progetto LTER e si concentra sullo studio della variabilità dei gruppi zooplanctonici nell’AMP di Portofino, a Punta Faro (N 44°20,000’ E 009°10,000’) (Fig. 3.1), che è oggetto di studi continuati, sia per quanto riguarda la caratterizzazione ambientale che per quanto riguarda lo studio dello zooplancton, sin dalla fine del 1999 e pertanto è inserita nel programma LTER (ricerche ecologiche a lungo termine). Tale stazione si trova inoltre al bordo dell‘Area Marina protetta di Portofino.
I campioni sono stati raccolti a bordo della “M/B Veliger”, mezzo del DISTAV dell’Università di Genova.
Per lo studio della componente planctonica la raccolta dei campioni è stata effettuata ogni 15 giorni, secondo le condizioni meteo-marine, in accordo con il programma di monitoraggio marino costiero in ambito Nazionale (Di Girolamo I., 2003).
Figura 3.1 - Area di campionamento. PF, Punta Faro (PF)
In questa stazione le principali variabili ambientali (temperatura, fluorescenza, salinità) sono state acquisite tramite l’utilizzo della sonda CTD (IDRONAUT Ocean Seven 316 plus). Successivamente tramite bottiglie Niskin (10L) sono stati effettuati
32
prelievi di campioni di acqua a diverse quote lungo la colonna d’acqua (0-80 metri) per la determinazione di diversi parametri chimici (nutrienti, materia organica particellata) e biologici (concentrazione di clorofilla, abbondanza e biomassa della componente fitoplanctonica). Lo studio della comunità meso-zooplanctonica è avvenuto tramite retinate lungo la colonna d’acqua, nei primi 50m.
3.1.1 Nutrienti inorganici
Per determinare la concentrazione dei principali nutrienti (nitrati, nitriti, ammoniaca, fosfati e silicati), i campioni d’acqua sono stati filtrati da apposite siringhe dotate di filtri in policarbonato con porosità 0,2 µm, e conservati al freddo (-20°C). La determinazione della concentrazione dei nutrienti è stata effettuata mediante l’aggiunta di opportuni reattivi che portano alla formazione di complessi colorati. Questi ultimi vengono letti mediante misure colorimetriche a lunghezze d’onda specifiche per ogni complesso (Hansen H. P., Grasshoff K., 1983).
- Nitrati: Il nitrato viene ridotto a nitrito facendo percolare l’acqua da analizzare attraverso una colonna di cadmio metallico ramato ad un pH iniziale di circa 5,5. Successivamente si misura per via spettrofotometrica, a 543 nm, l’assorbanza del prodotto colorato che si ottiene, a pH 1,5-2, dalla diazotazione con solfanilammide dell’acido nitroso formatosi dalla successiva copulazione con α-naftiletilendiammina. Il risultato analitico è costituito dalla concentrazione del nitrato ridotto più quella del nitrito eventualmente già presente; per ottenere, quindi, la concentrazione del solo azoto nitrico occorre sottrarre la concentrazione dell’azoto nitroso.
- Ammoniaca: L’ammoniaca, per reazione con fenolo ed ipoclorito, forma indofenolo, il quale, in ambiente alcalino (pH 10,3-10,8) ed in presenza di nitroprussiato sodico che agisce da catalizzatore, assume una colorazione blu, misurabile spettrofotometricamente alla lunghezza d’onda di 635 nm.
- Fosfati: La determinazione dei fosfati viene effettuata facendo reagire gli ioni fosfato con molibdato d’ammonio, tartrato d’antimonio e potassio, in ambiente
33
ascorbico a blu di molibdeno, intensamente colorato. Il risultante composto fosfomolibdico di colore blu assorbe a 880 nm.
- Silicati: La determinazione dei silicati disciolti viene effettuata aggiungendo 10 mL di Reattivo Molibdato, dopo 15-30 minuti si aggiungono 15 mL di Reagente Riducente. Dopo 1 ora, il campione viene letto allo spettrofotometro a 882 nm.
3.1.2 Sostanza organica particellata
Per determinare la concentrazione delle proteine particellate al campione, previa filtrazione su filtri GF/F di circa 1L di acqua di mare, è stata utilizzata la metodica proposta da Hartree 1972. Al filtro, posto in provetta, viene aggiunta acqua deionizzata (1ml) e viene sminuzzato manualmente. Poi, viene addizionato di 0.9 ml di soluzione A e posto ad una temperatura di 50 °C per 10 minuti. Successivamente si aggiungono 0.1 ml di soluzione B e lasciato a reagire a temperatura ambiente per almeno 10 minuti, infine vengono aggiunti 3 ml di soluzione C agitando rapidamente, l’utilizzo di tali reagenti consente di estrarre completamente le proteine del filtro (Moal et al., 1985).
I campioni vengono posti a 50 °C per 10 minuti e lasciati raffreddare a temperatura ambiente. Il pH al quale la colorazione risulta più intensa è compreso tra 10 e 11. I campioni vengono sottoposti a centrifugazione a 8000 g/min per 15 minuti, successivamente l’assorbanza viene valutata allo spettrofotometro ad una lunghezza d'onda di 650 nm.
Soluzione A: 2 g di tartrato di sodio e potassio e 100 g di NaCO3 vengono sciolti in 500 ml di NaOH 1 N, quindi portati a 1 litro con acqua deionizzata. Soluzione B: 2 g di tartrato di sodio e potassio e 1 g di CuSO4+ 5H2O vengono sciolti in 90 ml di acqua deionizzata ai quali sono aggiunti 10 ml di NaOH 1 N (40g di NaOH in 1litro).
Soluzione C: un volume del reagente di Folin-Ciocalteu viene diluito con 15 volumi di acqua deionizzata. Questa soluzione viene generalmente preparata subito prima dell'uso.
34
Per la determinazione dei carboidrati particellati si è seguita la metodica indicata da Dubois et al. 1956.
La sostanza particellata è concentrata su filtri di tipo GFF tramite filtrazione di circa 1L di acqua di mare. Si pone il filtro in provette di vetro da circa 10 mL e si aggiunge 1 mL di acqua deionizzata, sminuzzando il filtro. Si aggiunge 1 mL di Fenolo 5% e si lascia riposare 10 min a temperatura ambiente. Successivamente, si addizionano 5 mL Acido solforico concentrato, dopo di che, si lascia raffreddare a temperatura ambiente. Per la determinazione della concentrazione dei carboidrati particellati si prosegue tramite lettura spettrofotometrica a 490 nm.
3.1.3 Clorofilla a
Per valutare la concentrazione della clorofilla a i campioni di acqua raccolti in situ sono stati filtrati su filtri in fibra di vetro (GF/F) con porosità 0,7 µm da 25 mm. Per favorire l’estrazione il filtro è stato spezzettato accuratamente, tramite l’utilizzo di una bacchetta di vetro, all’interno di una provetta con 6 mL di acetone al 90%. L’estrazione si completa ponendo il campione al buio ed al freddo per 24 ore. La concentrazione di clorofilla è stata poi determinata tramite l’utilizzo di uno spettrofluorimetro, prima della lettura l’estratto è stato sottoposto a centrifuga (4000giri/min per circa 15 min). Il sopranatante viene posto in cellette di 1cm di vetro che sarà posto all’interno dello strumento ottico. Lo spettrofluorimetro lavora a lunghezze d’onda ai valori massimi di eccitazione ed emissione della clorofilla, ovvero 430 nm e 668 nm (Yentsch e Menzel, 1963; Holm-Hansen et al., 1965).
3.1.4 Meso – zooplancton
La raccolta del meso – zooplancton è stata effettuata utilizzando un retino da plancton di tipo WP2 con maglie da 200 µm, bocca di diametro di 57 cm per gli anni 2003-2005 e una rete General Oceanics con maglie da 200 µm, bocca di diametro di 50 cm per gli anni 2018-2019.
E’ stata effettuata una calata verticale da -50m di profondità alla superficie. La velocità di risalita è stata mantenuta inferiore a 1m/min per permettere una filtrazione
35
efficiente. Il volume di acqua filtrata dalla rete (V = AxL, m3) viene calcolato tenendo conto dell’area della bocca (A, m2) e della lunghezza del cavo rilasciato (L, m). Al
termine della pescata la rete viene accuratamente risciacquata con acqua di mare per recuperare il materiale rimasto adeso sulla rete, facendo scivolare l’acqua all’interno del contenitore di raccolta.
I campioni raccolti sono stati traferiti in contenitori e opportunamente fissati per la conservazione (soluzione di formaldeide al 4% finale tra il 2003-2005 e soluzione di etanolo al 70% finale tra il 2018-2019).
Dai campioni raccolti sono state fatte delle analisi quali – quantitative per stimare che l’abbondanza totale e dei diversi taxa.
Nel sito LTER Portofino dall’ottobre 2010 viene effettuata una seconda calata su ciascuna stazione e il materiale planctonico raccolto viene utilizzato immediatamente per la stima della biomassa totale.
• Biomassa come peso secco
La biomassa a peso secco (dry mass) rappresenta il contenuto di materia organica privata dell’acqua dei tessuti. Per il calcolo della biomassa totale è stato utilizzato il metodo gravimetrico. Il campione di meso-zooplancton, dopo essere raccolto dal retino viene concentrato su un filtro pre-pesato, con maglie minori o uguali di 200 µm, per eliminare l’acqua di mare e risciacquato con acqua distillata, per eliminare il sale, si lascia asciugare brevemente e conservato nel freezer a -20°C. Il campione successivamente viene posto in stufa a 60 °C. Il campione viene pesato la prima volta dopo 24 ore ed eventualmente ancora nel corso della settimana fino al raggiungimento di un peso costante.
Il peso finale viene espresso in mg/m-3.
• Abbondanza totale e dei diversi taxa
Le analisi in laboratorio si avvalgono di semplici apparecchiature come Folsom
plankton splitter (Sell e Evans, 1982) che consente di ottenere la frazione di
36
riconoscimento e la conta degli organismi in essi presenti, secondo le procedure indicate dal Manuale dell‘Istituto Superiore per la Protezione e la Ricerca Ambientale - ISPRA (Socal, 2010). Generalmente gli organismi non - copepodi sono stati contati in un quarto del campione originale. Per quanto riguarda il riconoscimento dei copepodi, questo è stato effettuato su aliquote più piccole del campione totale, fino a raggiungere almeno il conteggio di 100 copepodi. Per l'identificazione sono stati utilizzati sia microscopi binoculare che stereoscopio, per scendere ai livelli di ingrandimento necessari per l'identificazione delle specie dei copepodi. E’ stato possibile ottenere dati relativi all’abbondanza totale e dei diversi taxa, utilizzando una formula che tiene conto del numero di individui contati (n), della frazione di campione esaminata (k) e del volume di acqua filtrata dalla rete durante il campionamento (V, m3) (Harris R.P., Wiebe P.H et al., 2000):
ind. m-3 = (n · k) / v
Per copepodi e cladoceri si è arrivati all‘identificazione della specie, ove riconoscibile. Tutti i giovanili dei copepodi (tranne Pleurommamma abdominalis,
P. gracilis e Oithona plumifera) sono stati attribuiti al genere e non alla specie per
la difficoltà di distinguere i copepoditi tra le numerose specie congeneri nel campione. Il problema non si è presentato per Temora stylifera, unica specie presente del genere. Per quanto riguarda gli organismi non-copepodi si è scesi meno nel dettaglio: alcuni organismi sono stati classificati a livello di Phylum o di Classe, mentre altri sono stati classificati a livello di Genere o di Ordine (ad esempio Pteropodi, Chetognati, Appendicolarie e Taliacei).
(Tab. 3.1 – Allegato 1).
37
Subphylum Subclass Specie Ordine Stadio Crustacea Copepoda Acartia clausi Calanoidi f Crustacea Copepoda Acartia clausi Calanoidi m Crustacea Copepoda Acartia clausi Calanoidi juvenile Crustacea Copepoda Acartia clausi Calanoidi adulto Crustacea Copepoda Acartia discaudata Calanoidi f Crustacea Copepoda Acartia discaudata Calanoidi m Crustacea Copepoda Acartia discaudata Calanoidi juvenile Crustacea Copepoda Acartia discaudata Calanoidi adulto Crustacea Copepoda Acartia longiremis Calanoidi f Crustacea Copepoda Acartia longiremis Calanoidi adulto Crustacea Copepoda Acartia adriatica Calanoidi f Crustacea Copepoda Acartia adriatica Calanoidi m Crustacea Copepoda Acartia adriatica Calanoidi juvenile Crustacea Copepoda Acartia adriatica Calanoidi adulto Crustacea Copepoda Acartia bifilosa Calanoidi f Crustacea Copepoda Acartia bifilosa Calanoidi m Crustacea Copepoda Acartia bifilosa Calanoidi juvenile Crustacea Copepoda Acartia bifilosa Calanoidi adulto Crustacea Copepoda Acartia italica Calanoidi f Crustacea Copepoda Acartia italica Calanoidi m Crustacea Copepoda Acartia italica Calanoidi juvenile Crustacea Copepoda Acartia italica Calanoidi adulto Crustacea Copepoda Acartia spp. Calanoidi f Crustacea Copepoda Acartia spp. Calanoidi m Crustacea Copepoda Acartia spp. Calanoidi juvenile Crustacea Copepoda Acartia spp. Calanoidi adulto
Sarcodina Foraminifera adulto
Ctenophora Ctenophora adulto
Annelida Polychaeta larvae larvale Mollusca Bivalvia larvae larvale
Bryozoa Bryozoa larvae larvale
Crustacea Cirripedia larvae larvale Arthropoda Crustacea naupli naupli
Chordata Pisces uova
Chordata Pisces larvale