1
INTRODUZIONE... 1
-1.1 ILNEONATOPICCOLOPERETÀGESTAZIONALE(SGA) -1- 1.2 IGEMELLI -32- 1.3 IGEMELLIDISCORDANTIPERILPESOALLANASCITA (SGAEAGA) -45-
2
SCOPO DELLO STUDIO... 49
-3
PAZIENTI E METODI ... 50
-4
RISULTATI... 61
-5
DISCUSSIONE... 71
-6
CONCLUSIONI ... 78
-1 INTRODUZIONE
1.1 IL NEONATO PICCOLO PER ETÀ GESTAZIONALE (SGA)
Essere piccoli per l’età gestazionale (Small for Gestational Age) influenza lo stato di salute: il basso peso alla nascita, parametro fondamentale utilizzato per definire questa condizione, non solo rappresenta un fattore di rischio dal punto di vista auxologico, metabolico, cardiovascolare e neuroevolutivo, ma rappresenta anche una delle cause più importanti di mortalità e morbilità perinatale soprattutto nei paesi in via di sviluppo.(1) Essere SGA inoltre è associato ad un aumento della mortalità in età successive, a causa di un ampio range di patologie prime fra tutte le malattie coronarica e l’infarto. La mortalità di questi neonati supera dalle 5 alle 20 volte quella dei neonati AGA (Appropriate for Gestational Age) di uguale età gestazionale, e sempre rispetto a questi ultimi, i neonati SGA presentano un’incidenza di alterazioni neurologiche e di varie patologie da 5 a 10 volte maggiore.(2) È chiara quindi, l’importanza di identificare i neonati di basso peso alla nascita, per un’attenta sorveglianza nel periodo peri- e post- natale, ma anche per seguirne attentamente la crescita riconoscendo prontamente quegli aspetti da tenere sotto controllo e/o da indagare in modo più approfondito.
Chi sono quindi i nati SGA? Nonostante i numerosi articoli pubblicati sull’argomento, la definizione di SGA è ancora imprecisa. Essa si basa su
un’accurata valutazione dell’età gestazionale mediante l’esame ecografico effettuato nel primo trimestre di gravidanza, su un’altrettanto accurata misurazione alla nascita di peso corporeo, lunghezza e circonferenza cranica, da confrontare con stabiliti valori cut-off di riferimento estrapolati da una popolazione scelta seguendo determinati criteri di campionamento.
Partendo da questi presupposti si definisce SGA un neonato che si trovi per valore di peso corporeo e/o lunghezza al di sotto generalmente del 3° o del 10° centile, o rispettivamente al di sotto delle 2 DS dalla media, per una determinata età gestazionale. Possiamo poi riferirci ad una sotto-classificazione in neonati SGA per peso (SGA w), per lunghezza (SGA l) o per entrambi (SGA wl). Addizionalmente questi neonati possono avere una circonferenza cranica ridotta o normale.(3)
A seconda poi del valore di peso alla nascita rispetto a cui il neonato è inferiore, possiamo classificare i nati SGA in: low birth weight ( LBW) se il peso è inferiore ai 2500 g, very low birth weight (VLBW) se il peso è inferiore ai 1500 g, e in estremely low birht weight (ELBW) se il peso è inferiore ai 1000 g.
Si definiscono poi Appropiate for Gestational Age (AGA) e Large for Gestaional Age (LGA) rispettivamente neonati con un peso e/o lunghezza alla nascita normale (entro le 2DS) o superiore alla norma (>2 DS). Essendo quelle di SGA, AGA o LGA definizioni basate su misurazioni alla nascita, è chiara la necessità di carte antropometriche neonatali, su cui
riportare le misure precise prese alla nascita. Esistono numerosi esempi di carte antropometriche in letteratura, dai centili di Lubchenco più datati (1963), anche se usati a lungo e fino al decennio passato, alle recentissime (2007) carte costruite dall’OMS(4); ma non c’è uniformità nel loro utilizzo. E’ ormai riconosciuta da tempo la necessità che tali carte siano “nazionalizzate”, che in pratica per costruirle si prendano in considerazione le problematiche specifiche di ciascun paese. In Italia sono disponibili diverse carte nazionali, e le differenze tra loro sono attribuibili a numerosi fattori, tra cui diversità delle popolazioni sorgente, dei criteri d’inclusione/esclusione (per esempio la differenza tra standard e reference), e variazioni nell’analisi statistica che porta alla costruzione e all’arrotondamento dei centili. Bisogna inoltre considerare le difficoltà incontrate durante la loro costruzione nell’ottenere omogeneità di modalità di campionamento ed elaborazione dei dati; la mancanza di disponibilità per tutte le classi di età gestazionale tra le 23 e le 42 settimane; la presenza di errori nella determinazione dell’ età gestazionale e l’uso di tecniche e/o strumenti di misurazione non appropriati.(1)
Un aspetto importante sui cui focalizzare la nostra attenzione, a cui ho fatto riferimento nel paragrafo precedente, sono i criteri d’inclusione/esclusione. Infatti, bisogna ricordare come la definizione di neonato SGA sia basata esclusivamente su misurazioni antropometriche e non prenda in considerazione i numerosi fattori di diversa natura che possono influenzare la crescita intrauterina. L’etnia, le dimensioni dei
genitori, la parità sono esempi di fattori familiari-ambientali che possono influenzare l’accrescimento come alcune condizioni materni o fetali quali il fumo di sigaretta, la gestosi, il diabete, ecc.., che, se presi in considerazione, ci consentono di ottenere dei valori “corretti” con cui costruire carte che descrivano come la crescita è realmente (reference), non come dovrebbe essere (standard). Avere genitori nati SGA o con IUGR costituisce un importante fattore di rischio aggiuntivo per la nascita di un feto SGA o IUGR. Tale correzione ci permette di identificare un più alto numero di neonati con un maggior rischio di morbilità perinatale rispetto a quelli identificati come SGA sulla base esclusivamente delle 3 misurazioni alla nascita. Ci permette inoltre di compiere una valutazione auxologica personalizzata sulla base del background individuale, che ha un valore comprovato nel periodo perinatale, ma non ha ancora un ruolo accertato nell’identificazione di quei bambini a rischio di morbilità a lungo termine. Questi bambini, infatti, possono presentare problemi di accrescimento, alterazioni metaboliche e dello sviluppo neurologico negli anni successivi.
Prima di proseguire affrontando i diversi tipi di alterazioni che presenta e a cui può andare incontro nella vita un neonato SGA, bisogna prima chiarire la differenza con il concetto di neonato IUGR (Intra Uterine Growth Restriction).
Questi due termini SGA e IUGR in passato erano considerati sinonimi; in realtà sono due concetti differenti che si applicano a neonati diversi.
SGA è una definizione statistica, permette una valutazione auxologica trasversale, pre o postnatale e riguarda un esito; IUGR invece è una definizione clinica (incapacità di raggiungere il potenziale di crescita geneticamente determinato), la sua valutazione auxologica è longitudinale, prenatale e riguarda un processo. (1) Quando definiamo un neonato piccolo per l’età gestazionale ci limitiamo a constatare che alla nascita il suo peso e/o lunghezza sono inferiori al 3° o al 10° centile (o ad un altro centile di riferimento da noi stabilito) o a meno di 2 DS dalla media per quella determinata età gestazionale; la definizione di IUGR presuppone invece la documentazione di una riduzione della velocità di crescita fetale nel corso della gravidanza (5) tramite l’ausilio di almeno due ecografie ostetriche successive. I parametri più predittivi per< diagnosticare un feto IUGR sono la circonferenza addominale (AC) e la stima del peso fetale (Estimated Fetal Weight). La AC infatti risulta il valore più sensibile perché riflette principalmente le dimensioni del fegato fetale che dipendono a loro volta dall’immagazzinamento di glicogeno, perciò AC rispecchia lo stato nutrizionale del feto.(6) La valutazione dell’EFW si può eseguire con diverse formule (la formula di Hadlock è la più utilizzata oggi e include la misurazione della circonferenza addominale, del diametro biparietale, e della lunghezza del femore) e permette di costruire curve di crescita fetale che utilizzino percentili corretti, come per i centili delle carte antropometriche neonatali, per aspetti quali peso e altezza materna, etnia, e sesso del feto. La velocità
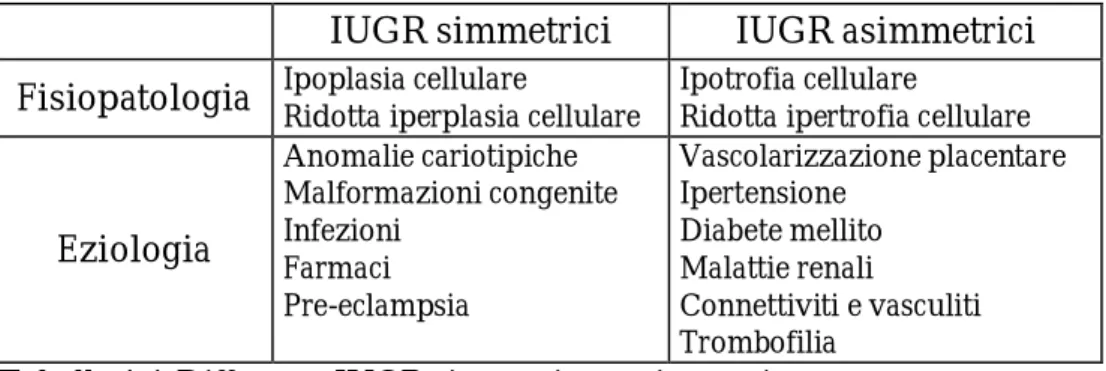
della crescita intrauterina è calcolata come la variazione nei percentili di EFW dalla 22 settimana gestazionale fino alla nascita. (Si definisce IUGR una riduzione nell’EFW superiore a 20 percentili in questo periodo).(13) Attraverso la misurazione di altri parametri sempre ecografici come la circonferenza cranica (HC) e il rapporto tra la circonferenza cranica e quella addominale (HC/AC) è possibile poi differenziare tra i due diversi tipi di restrizione di crescita: simmetrica e asimmetrica. Nel primo caso il rapporto HC/AC è armonico e la restrizione di crescita è a carico di tutti i parametri biometrici; nel secondo caso il profilo di accrescimento risulta disarmonico con risparmio della circonferenza cerebrale (brain sparing) rispetto al resto del corpo. Il ritardo di crescita simmetrico esordisce tipicamente nelle fasi precoci della gravidanza ed è associato con l’esposizione del feto ad agenti chimici, come il fumo, le infezioni virali o i difetti congeniti dell’embrione (ad esempio le cromosomopatie),(7) quindi la riduzione del potenziale di crescita s’instaura in modo cronico. Al contrario lo IUGR asimmetrico è maggiormente presente nelle condizioni d’insufficienza utero-placentare che si instaura in modo acuto o sub-acuto, generalmente nel secondo o terzo trimestre di gravidanza, ed è a questo ultimo gruppo che appartengono il 75% dei nati IUGR.
IUGR simmetrici IUGR asimmetrici Fisiopatologia Ipoplasia cellulare Ridotta iperplasia cellulare Ipotrofia cellulare Ridotta ipertrofia cellulare
Eziologia Anomalie cariotipiche Malformazioni congenite Infezioni Farmaci Pre-eclampsia Vascolarizzazione placentare Ipertensione Diabete mellito Malattie renali Connettiviti e vasculiti Trombofilia
Tabella 1.1 Differenze IUGR simmetrico e asimmetrico
Poiché l’accurata datazione della gravidanza è la chiave per formulare la diagnosi, l’utilizzo di curve di crescita prenatali, ottenute tramite misurazioni ecografiche, consente una maggiore specificità nell’identificazione di feti IUGR e una riduzione nel numero di falsi positivi.
È importante riuscire a identificare non solo precocemente, ma anche tramite una diagnosi eziologica corretta lo IUGR, perché i due tipi, simmetrico e asimmetrico sono associati ad un diverso outcome e ad una differente prognosi; infatti, il feto con uno IUGR insorto cronicamente presenta alla nascita una maggiore stabilità delle proprie condizioni vitali e quindi una prognosi migliore in termini di mortalità postnatale rispetto ad un feto con IUGR asimmetrico. Un feto IUGR potrà esitare o no in un neonato SGA.
Ovviamente la compresenza di entrambe le due condizioni (SGA e IUGR) aumenta il rischio di mortalità pre/perinatale rispetto alla sola condizione di SGA o IUGR; tale rischio aumenta ulteriormente di fronte ad un neonato SGA/IUGR pretermine.
La difficoltà nel considerare i due termini SGA e IUGR diversi deriva anche dalla constatazione che molti fattori di rischio, condizioni patologiche associate, sviluppo auxologico e neuroevolutivo sono simili nelle due condizioni. Quindi cercherò di utilizzare alternativamente i termini SGA o SGA/IUGR quando mi riferirò rispettivamente in modo più specifico ai primi o indistintamente ad entrambi.
Per quanto riguarda le condizioni e i fattori di rischio che possono portare alla nascita di un feto SGA/IUGR alcuni sono ormai accertati, mentre altri rimangono ancora sconosciuti (SGA/IUGR idiopatici). Sono chiamati in causa fattori genetici materni e fetali, fattori nutrizionali, socio-ambientali e alterazioni morfo-funzionali della placenta, nonché l’età gestazionale; la prematurità rappresenta un fattore addizionale che contribuisce ad aumentare la morbilità e la mortalità nei neonati SGA/IUGR.
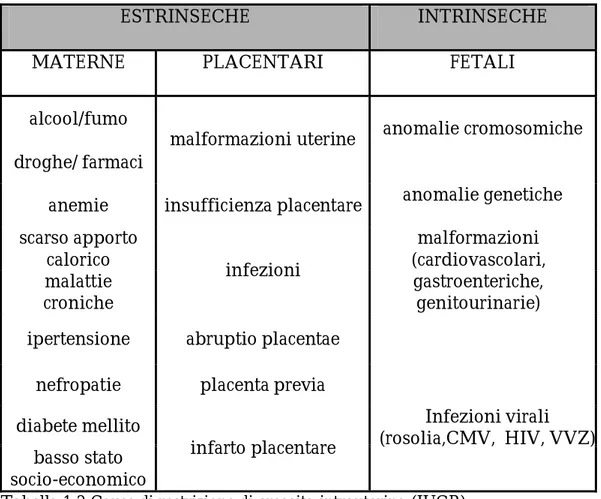
Possiamo classificare le diverse cause in due categorie: cause estrinseche e intrinseche.
Le prime ad esordio in genere più tardivo, instaurano un ambiente utero-placentare sfavorevole alla crescita fetale. Sono rappresentate da fattori materni come il fumo di sigaretta, responsabile della ridotta ossigenazione fetale e della riduzione del flusso utero-placentare, l’abuso di alcool e droghe, la malnutrizione materna soprattutto nel terzo trimestre di gravidanza, periodo in cui il feto subisce un forte incremento ponderale; e da fattori placentari quali anomalie placentari (vascolari, inserzione
anomala, ecc...). Su tutte queste condizioni è possibile intervenire, e quindi sono considerati fattori potenzialmente modificabili.
Un altro fattore idealmente modificabile è rappresentato dalle carenti condizioni socio-economiche.
Le cause intrinseche invece determinano un ridotto potenziale di crescita dovuto ad alterazioni primitivamente fetali (patologie genetiche, aberrazioni cromosomiche, patologie sindromiche o infettive croniche), e sono associate ad una prognosi peggiore. Infine una scorretta datazione ecografia della settimana di gestazione può portare ad un errato sospetto diagnostico di SGA/IUGR in un feto assolutamente normale che presenterà valori adeguati negli intervalli di crescita stabiliti.
ESTRINSECHE INTRINSECHE
MATERNE PLACENTARI FETALI
alcool/fumo droghe/ farmaci
malformazioni uterine anomalie cromosomiche
anemie insufficienza placentare anomalie genetiche scarso apporto calorico malattie croniche infezioni malformazioni (cardiovascolari, gastroenteriche, genitourinarie) ipertensione abruptio placentae
nefropatie placenta previa
diabete mellito basso stato socio-economico infarto placentare Infezioni virali (rosolia,CMV, HIV, VVZ)
Da tutte queste considerazioni emerge come i nati SGA rappresentino un gruppo eterogeneo di bambini, con problematiche di crescita e sviluppo molto varie che non riguardano solo il periodo immediatamente post-natale, ma che si protraggono e/o manifestano durante la prima infanzia, nella crescita puberale fino all’età adulta.
♦ Periodo neonatale: I principali problemi alla nascita di un feto SGA/IUGR sono rappresentati da asfissia post-natale; alterazioni metaboliche quali ipoglicemia, ipocalcemia, riduzione della funzionalità epatica, del metabolismo proteico, e riduzione della funzionalità pancreatica; ipotermia; policitemia e alterazioni della coagulazione; e riduzione della funzione immunologia. (8) Questo tipo di problemi è principalmente legato 1) agli stati di ipossia aggravata dal travaglio e dal parto durante i quali il flusso placentare e la cessione di ossigeno sono ulteriormente ridotti dalle contrazioni intrauterine; e 2) all’ipoglicemia per insufficienza delle riserve di glucosio epatico, alterazioni della gluconeogenesi, e ridotta risposta all’insulina. Da queste due condizioni principali derivano poi l’alterazione delle capacità termoregolatrici, per questo la dispersione di calore non è compensata da una adeguata termogenesi e favorisce il consumo delle riserve energetiche (soprattutto il glicogeno epatico) del feto a discapito della sua crescita; lo stato di ipocalcemia che oltre al ridotto apporto di calcio transplacentare è dipendente anche dalla
sindrome post-asfittica; e anche la policitemia che è una risposta allo stato di ipossia cronica a cui sono sottoposti questi neonati, che induce una ipersecrezione di eritropoietina.
Il deficit immunologico riguarda sia l’immunità umorale sia quella cellulare sia l’immunità aspecifica.
Naturalmente in epoca perinatale sono manifeste anche le malformazioni congenite eventualmente presenti nei neonati SGA/IUGR. Più difficile è riuscire a distinguere, nel caso in cui siano presenti più malformazioni, se queste sono associate casualmente o correlate fra loro facendo parte di una specifica sindrome malformativa, quindi bisogna ricercare scrupolosamente dati anamnestici e segni clinici che ci possano indirizzare verso un preciso sospetto diagnostico.
♦ Infanzia: In quest’epoca, oltre al protrarsi delle condizioni presenti alla nascita, si possono identificare ulteriori alterazioni, quali alterazioni dello sviluppo somatico (accrescimento staturo-ponderale), alterazioni metaboliche (dislipidemia, alterazione dell’omeostasi glucidica), alterazioni endocrine (insulina, IGF-1 e TSH, GH, PTH, e Glucagone), riduzione della massa ossea, alterazioni ematologiche (sindrome policitemia-iperviscosità), infezioni ed allergie, soprattutto nei neonati SGA con IUGR asimmetrico in cui il timo non riuscendo ad attuare meccanismi di compenso allo stato di malnutrizione fetale non si sviluppa in
modo adeguato, per cui risulta inadeguata la componente umorale dei meccanismi difensivi. Possiamo inoltre riscontrare nei nati SGA/IUGR alterazioni neurologiche esito della sofferenza e dello stress a cui è stato sottoposto il sistema nervoso fetale. Il profilo neurologico in questi neonati viene comunque indagato tempestivamente tramite l’esecuzione di una ecografia cerebrale nei primi giorni di vita e della velocimetria Doppler. Durante la prima infanzia (come anche in epoca neonatale) possono emergere elementi suggestivi di quelle problematiche che invece si renderanno clinicamente evidenti solo negli anni successivi.
♦ Pubertà: Per quanto nella maggior parte dei nati SGA la pubertà avvenga regolarmente, entro i limiti temporali fisiologici, in alcuni ragazzi e ragazze SGA alla nascita la crescita puberale è modestamente ridotta e nelle ragazze il menarca si presenta dai 5 ai 10 mesi più precocemente rispetto ai nati AGA di pari età e sesso. La pubertà precoce esita tipicamente in una riduzione della crescita staturale e quindi in una statura da adulti di questi ragazzi/e inferiore alla norma. Inoltre ragazze nate SGA, che vadano incontro ad un rapido recupero del peso corporeo durante la prima infanzia, possono con maggiore probabilità presentare l’adrenarca prematuramente.
In alcune adolescenti nate SGA si può avere un’aumentata secrezione di androgeni sia surrenalici che ovarici, responsabili di
una riduzione della durata dei cicli mestruali, di eccesso di grassi addominali (anche in assenza di obesità), e di uno stato di iperisulinemia.
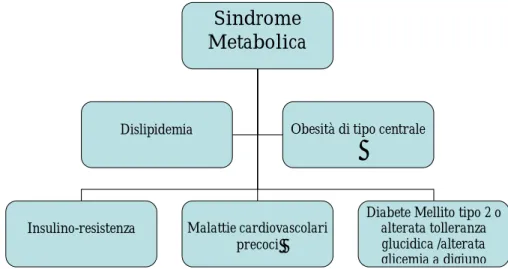
♦ Età adulta: Essere nati piccoli per età gestazionale è associato ad una serie di patologie di ordine principalmente cardiovascolare e metabolico che possono manifestarsi in età adulta o protrarsi fino a questa fase della vita se comparse in età precedenti. Numerosi studi hanno riportato l’associazione tra il basso peso alla nascita e l’aumento dei fattori di rischio cardiovascolari (obesità, aumento della pressione arteriosa, dislipidemia), ed anche un aumentato rischio d’intolleranza glucidica e d’insorgenza di diabete mellito tipo 2. La presenza di più fattori di rischio sopra esposti aumenta quindi il rischio globale di insorgenza di una sindrome metabolica.
Figura 1.1 Sindrome metabolica
Prima di analizzare in modo approfondito le patologie ormai accertate in letteratura che rappresentano le problematiche più frequenti nella
Sindrome Metabolica
Insulino-resistenza
Diabete Mellito tipo 2 o alterata tolleranza glucidica /alterata glicemia a digiuno
Dislipidemia Obesità di tipo centrale
Malattie cardiovascolari precoci
sorveglianza e nella cura dei bambini nati SGA/IUGR, è necessario fare una premessa sul ruolo importante dell’età gestazionale.
I quadri morbosi che si possono presentare nei neonati SGA/IUGR sono influenzati sensibilmente dall’età gestazionale (< a 37 sett. e ancor più se < a 32 sett.). Un feto nato prematuro va incontro solo per la condizione d’immaturità ad un maggior rischio di morbilità e mortalità perinatale; la prematurità conferisce inoltre una maggior suscettibilità ad un ampio range di patologie nelle età successive, a prescindere dal basso peso o dalla presenza di un ritardo di crescita. Un neonato pretermine SGA/IUGR quindi presenta un’incidenza maggiore di complicanze, soprattutto a breve termine, rispetto ai nati AGA della stessa età gestazionale e ai nati a termine di basso peso o con restrizione di crescita intrauterina. Le complicanze più frequenti legate alla nascita pretermine includono patologie polmonari(quali la sindrome da distress respiratorio) causate dallo stato di ipossia che si crea all’interno dell’utero, dall’immaturità del polmone stesso, dall’alterata risposta infiammatoria sistemica e dal danno da riperfusione per l’aumentata produzione di radicali liberi dell’ossigeno; sempre a carico del polmone, una massiva emorragia è riportata come causa di morte improvvisa, in particolare nei neonati con un grado severo di IUGR. L’enterocolite necrotizzante è presumibilmente causata dalla ridistribuzione del flusso sanguigno che danneggia l’intestino come anche altri organi fetali (rene e fegato) e che si verifica principalmente nel ritardo di crescita asimmetrico. Un’altra
complicanza perinatale legata principalmente alla prematurità negli SGA/IUGR è l’emorragia peri-intraventricolare, che origina in una zona del SNC altamente suscettibile ad insulti ipossico-ischemici ed alla rottura vascolare. La somministrazione prenatale di steroidi può ridurre l’incidenza di queste complicanze.(16)
L’asfissia perinatale è una condizione frequente nei nati pretermine SGA/IUGR che rappresenta una delle più importanti complicanze del periodo immediatamente successivo alla nascita anche per i nati SGA/IUGR a termine. I neonati SGA a termine, infatti mostrano un’incidenza due volte superiore di un basso indice di Apgar rispetto ai nati AGA di pari età gestazionale. Chiaramente le cure che questi neonati ricevono nelle unità di terapia intensiva neonatale svolgono un ruolo decisivo. La scelta del momento del parto rappresenta un altro ruolo decisivo per evitare la sofferenza fetale, in particolare a carico del sistema nervoso. Su questo punto esistono ancora molte controversie: un parto troppo precoce, volto a ridurre il tempo di permanenza in utero e quindi la sofferenza fetale è associato ad un maggior rischio di morte neonatale; un parto tardivo volto a favorire la maturazione del feto in utero ed evitare così maggiori complicanze alla nascita, presenta invece un maggior rischio di morte fetale.
Fatta questa premessa esaminiamo più in dettaglio le principali alterazioni dell’accrescimento, endocrine, metaboliche, della massa ossea, neurologiche e comportamentali.
che possono manifestarsi in questi pazienti Accrescimento e massa ossea
Circa il 90% dei nati SGA, presenta un accrescimento staturo-ponderale entro i primi due/tre anni di vita pari ai nati AGA di uguale età gestazionale, ottenendo un completo recupero dei parametri auxologici appropriati per la loro età.
Per quanto riguarda l’accrescimento staturale, la maggior parte dei neonati SGA raggiunge una statura adulta inferiore di circa 1 DS rispetto alla media. Questi bambini presentano generalmente una crescita lineare accelerata durante i primi 12 mesi di vita, raggiungendo una statura e un peso superiore alle -2 DS, abbattendo quasi completamente entro i primi 2 anni di vita il gap presente alla nascita.
Il restante 10% circa, soprattutto quelli nati molto prematuramente o con un severo grado di ritardo di crescita non presenta questo recupero dell’accrescimento (catch-up growth), ed è meno probabile che raggiunga una statura nei limiti del norma in età adulta. Avere genitori di alta statura riduce il rischio di mantenere una bassa statura finale.(10) Il recupero staturale può essere incompleto in alcune sindromi come la Silver Russell o la sindrome delle 3M. I neonati SGA pretermine possono impiegare quattro o più anni per raggiungere una statura nel range di normalità. Alcuni studi dimostrano che il recupero staturale e il rischio che questo non avvenga entro i 5 anni di età sono chiaramente diversi tra i nati
pretermine di età gestazionale < alle 32 settimane rispetto a quelli di età gestazionale superiore.(17)
E’ stato molto studiato nei bambini nati SGA l’asse GH-IGF dato il ruolo prioritario che questi ormoni, e le IGF-binding proteins, assumono nel processo di regolazione della crescita organica. Pur essendo state descritte delle alterazioni nella secrezione diurna, in media in questi bambini l’ormone della crescita non presenta variazioni patologiche importanti tranne che nei rari casi di deficienza congenita di GH o di alterazioni congenite dei suoi recettori.(9)
Un ruolo fondamentale, sempre giocato da fattori genetici, è assunto dal sistema IGF (1 e 2) e delle sue binding proteins. Le mutazioni a carico del gene dell’IGF-1 o dei suoi recettori producono importanti effetti sulla crescita intrauterina e possono portare alla nascita di un feto SGA/IUGR. I livelli di IGF-1 e GF-BP3 (la principale binding-protein ad effetto positivo sull’accrescimento) sono infatti ridotti nei bambini nati SGA di circa 1 DS rispetto alla media, mentre sono incrementati i livelli di IGF-BP1, che ostacola l’attività dell’IGF-1.(14)
Lo stato dell’asse GH-IGF alla nascita o subito dopo non ha però valore predittivo per la crescita futura; le alterazioni dell’IGF-1 e dell’IGF-BP3 sono transitorie, e sia nell’infanzia sia nell’adolescenza i loro dosaggi possono risultare nella norma. Nel caso in cui un bambino nato SGA/IUGR non abbia raggiunto entro i primi 3 anni una statura nei limiti della norma, è consigliato il repentino trattamento con l’ormone della
crescita (GH). Un bilancio tra gli effetti benefici della terapia con l’ormone della crescita, non solo sull’accrescimento dello scheletro, della massa muscolare, ma anche sulla stabilizzazione del metabolismo lipidico e sulla mobilizzazione del tessuto adiposo, e i potenziali rischi, dimostratisi transitori e di lieve entità, come l’alterazione dell’assetto glico-lipidico e l’aumento della pressione arteriosa, è a favore dell’ utilizzo precoce (a partire dai tre anni di età) di questo trattamento nei bambini nati SGA, permettendo così il recupero staturale e il suo mantenimento fino al raggiungimento di una statura finale nella norma (10). A questo fine è fondamentale uno stretto controllo dei parametri auxologici mediante misurazioni mensili dai primi mesi ai primi tre anni di vita e la quantificazione della velocità di accrescimento staturo-ponderale (rispettivamente cm/mese, g/mese). Inoltre sembra che il GH influisca positivamente anche sul miglioramento del quoziente intellettivo (QI) di questi bambini.
Per quanto riguarda il peso, il ritardo nell’accrescimento ponderale è in genere inferiore rispetto a quello staturale. La maggior parte dei bambini nati SGA raggiunge valori di BMI (kg/m2) simili a quelli di nati AGA di
pari età gestazionale (10), anche se questo parametro ha uno scarso valore predittivo sulla composizione corporea per quanto riguarda il contenuto di massa magra, massa grassa, e densità ossea di questi bambini, ed è studiata generalmente con la densitometria (DEXA). Negli ultimi anni sono state messe a punto alcune metodiche che prevedono l’impiego degli
ultrasuoni per la valutazione del contenuto minerale dell’osso. Tali metodiche si basano sulla misurazione delle variazioni della velocità e/o del grado di attenuazione del raggio ultrasonico attraverso il tessuto osseo in esame, sono quindi sistemi non invasivi, che non utilizzano radiazioni ionizzanti o raggi X(11). I neonati SGA presentano tipicamente una riduzione della massa magra, della massa grassa e della densità ossea; nonostante questo nell’infanzia possono però manifestare un aumento dell’adiposità centrale, e un certo grado di sovrappeso (aumento BMI) legati principalmente alla ridotta sensibilità all’insulina correlata al basso peso alla nascita. Un recupero ponderale che avvenga molto rapidamente durante la prima infanzia è associato a un aumento dell’incidenza di obesità centrale in età adulta, costituendo un ulteriore fattore di rischio per l’insorgenza della sindrome metabolica e di malattie cardiovascolari. I nati SGA-IUGR hanno una densità ossea significativamente inferiore rispetto ai nati SGA. Lo stato di malnutrizione o di disfunzione placentare associato alla nascita di un feto SGA/IUGR è responsabile del ridotto apporto dei nutrienti necessari per la crescita dello scheletro, come il calcio e il fosforo, il cui apporto al feto è garantito dal loro passaggio attraverso la placenta. Con l’aumentare dell’età gestazionale, incrementa progressivamente la richiesta di questi minerali. La loro carenza può perciò causare, soprattutto in un feto pretermine, una riduzione della massa ossea che può arrivare a manifestarsi alla nascita con la metabolica dell’osso del prematuro.(11)
Alterazioni metaboliche ed endocrine
I bambini nati SGA hanno un rischio aumentato di sviluppare una serie di disordini endocrino-metabolici; in particolare l’intolleranza al glucosio, il diabete mellito tipo 2, alterazioni del profilo lipidico, aumento della pressione arteriosa, e insulino resistenza.(12) La presenza contemporaneamente di più d’una di queste condizioni patologiche aumenta il rischio complessivo di sindrome metabolica e di malattie cardiovascolari nella vita adulta; soprattutto se associata ad un’eventuale obesità che può, come abbiamo appena detto presentarsi in questi bambini/adulti.
L’origine di questo complesso di alterazioni sembra risalire alla vita intrauterina. La sofferenza fetale legata alla condizione di ipossiemia determinata dall’insufficienza placentare e/o al ridotto o inadeguato apporto di nutrienti al feto, durante finestre temporali critiche, è alla base di un meccanismo di adattamento (reprogramming) che coinvolge i principali sistemi ormonali e fattori responsabili della crescita (insulina, IGF, T4, cortisolo) e che si instaura appunto in epoca fetale.
Mediante la cordonocentesi effettuata al 3° trimestre di gravidanza si denotano, infatti, bassi livelli di glucosio, insulina e leptina, e aumento di uno dei più importanti ormoni catabolici, il cortisolo. Questo adattamento endocrino-metabolico a condizioni intrauterine sfavorevoli può avere effetti negativi a lungo termine. L’insulina svolge un ruolo fondamentale nel processo di accrescimento intrauterino, ed è responsabile delle
alterazioni nel metabolismo glucidico causate da una riduzione della sua secrezione e da una resistenza alla sua azione dei tessuti fetali. Dal punto di vista del metabolismo, l’ipoinsulinemia fetale determina l’attivazione della gluconeogenesi epatica con conseguente deplezione delle riserve di glicogeno e consumo di aminoacidi, alcuni essenziali (valina, leucina, lisina, ecc...); ciò crea uno stato metabolico caratterizzato da elevati livelli di lattato (glicolisi anaerobia) e aumento in circolo di acidi grassi liberi e trigliceridi, con aumento del lavoro epatico e conseguente disfunzione che si rifletterà anche a livello delle altre numerose funzioni svolte da questo organo, per esempio della capacità coagulativa. Dal punto di vista endocrino, oltre alla ridotta secrezione insulinica, amplificata da una disfunzione a carico delle cellule beta pancreatiche che si associa spesso in questi feti, si verifica una down-regulation di tutto il principale asse endocrino della crescita fetale, con riduzione dei livelli di importantissimi fattori di crescita: l’IGF-1 e 2. Alla compromissione delle isole di Langerhans va poi aggiunta la constatazione di una ridotta sensibilità dei tessuti periferici all’insulina che può trovare spiegazioni con diverse ipotesi. La prima chiama in causa la ridotta capacità di up-take del glucosio causata da alterazioni strutturali e funzionali dei muscoli penalizzati dallo stato di malnutrizione; un’altra eventualità chiama invece in causa l’attivazione nella vita extrauterina di un meccanismo di “glucose sparing metabolism”, ovvero l’ossidazione di substrati diversi dal glucosio a vantaggio di un suo risparmio. (14) (15)
E’ chiaro come l’alterazione del metabolismo glucidico con l’instaurarsi dell’insulino-resistenza costituisca un anello di congiunzione tra l’essere SGA/IUGR alla nascita e i processi patologici, in particolare le malattie cardiovascolari che si evidenzieranno in età adulta, e verranno amplificati anche dagli eventi che accadono nei primi anni di vita, quando.
Un altro asse ormonale fondamentale per la crescita coinvolto in questo meccanismo di riprogrammazione fetale è l’asse ipotalamo-ipofisi-surrene (HPA). Le difficili condizioni di vita intrauterina, associate ad alterazioni della funzione protettiva svolta dalla placenta (inattivazione dell’enzima 11-idrossisteroidedeidrogenasi), causerebbero l’esposizione prematura del SNC e delle principali ghiandole endocrine (pancreas, tiroide, surreni, gonadi) ad un’elevata concentrazione di glucocorticoidi di origine materna, a sua volta responsabile di numerosi difetti a livello cellulare (recettori, enzimi, canali ionici e trasportatori di membrana) che si rifletteranno poi nelle alterate risposte tissutali ai diversi ormoni e fattori di crescita, e nelle turbe dei meccanismi regolatori di feed-back.
Stato nutrizionale IGFs Cortisolo Insulina T4 GH Metabolismo Accrescimento tissutale Differenziamento tissutale
Figura 1.2 Relazione tra nutrizione, concentrazioni ormonali, metabolismo,
accrescimento e differenziazione tissutale.( 18 )
La prematura esposizione anche ad elevati livelli di steroidi materni è responsabile di un’alterata espressione di enzimi di metabolizzazione epatica, di alterazioni centrali (ipotalamo), della risposta periferica ad ormoni e steroidi sessuali, e dello sviluppo sessuale in ragazzi/ragazze nati SGA. (18)
I livelli elevati di cortisolo rilevati nel sangue cordonale (sia basali che dopo stimolazione) dei neonati SGA/IUGR, soprattutto pretermine, sono inversamente correlati con il peso e la lunghezza alla nascita, e la loro elevazione potrebbe favorire la comparsa di ipertensione arteriosa e di un
profilo lipoproteico aterogeno nei neonati SGA/IUGR sia pretermine che a termine.
A loro volta i livelli aumentati di cortisolo e il profilo lipoproteico aterogeno potrebbero avere effetti negativi a lungo termine, predisponendo a malattie metaboliche e cardiovascolari in età adulta. Un profilo lipidico alterato in senso aterogeno può essere causato anche da un difettoso sviluppo del fegato fetale (tipico esempio feto SGA con IUGR asimmetrico), che comporta un reset permanente della funzionalità epatica sul metabolismo lipidico, che si esplicita con l’aumento dei valori di colesterolo totale e LDL, Apolipoproteina B e Trigliceridi.
I cambiamenti cellulari e molecolari indotti dal cortisolo nei singoli tessuti si associano, producendo cambiamenti integrati nelle varie funzioni a livello sistemico. L’effetto ipertensivo del cortisolo per esempio è dovuto a disfunzioni a livello cerebrale, cardiaco, vascolare e renale, ed è associato a un’alterazione locale e sistemica della secrezione dei più potenti vasocostrittori dell’organismo: angiotensina 2, adrenalina, ossido nitrico, vasopressina.(18) L’aumento della pressione arteriosa è collegato ad un altro fattore che si verifica sempre prima della nascita di un feto SGA/IUGR. Le sfavorevoli condizioni di vita intrauterina possono causare un blocco della nefronogenesi del rene fetale, che, soprattutto negli SGA/IUGR simmetrici, si presenta alla nascita di ridotte dimensioni (volume e lunghezza). Le ridotte dimensioni renali sono valutate con tecniche ultrasonografiche, e sono appunto probabilmente correlate con lo
scarso numero di nefroni. Nei primi 3 mesi di vita il rene va generalmente incontro ad un recupero delle sue dimensioni, a cui contribuisce un processo di ipertrofia glomerulare, raggiungendo al primo anno di età dimensioni pari ai reni di bambini nati AGA di uguale età gestazionale. Nonostante i reni di bambini nati SGA e AGA raggiungano precocemente le stesse dimensioni, non è stata ancora sufficientemente valutata la possibile differenza per quanto riguarda la funzionalità; anche perché l’ipertrofia glomerulare di per sè determina una iperfiltrazione renale, che a sua volta col passare del tempo induce glomerulosclerosi e progressiva riduzione della funzionalità renale. Gli adulti nati SGA, intorno ai 50 anni di età hanno evidenziato una maggiore incidenza di questo tipo di alterazioni.(19)
Ancora i glucocorticoidi regolano la densità recettoriale e l’attività di importanti enzimi coinvolti in meccanismi di attivazione/inattivazione di ormoni a livello dei tessuti fetali. Il cortisolo induce infatti la produzione epatica della 5’ deiodasi incrementando così la concentrazione di ormone tiroideo T3, riduce invece la concentrazione di alcune binding protein come quelle del sistema IGF.
L’ipotesi dell’adattamento intrauterino, cosiddetta“thrifty phenotype hypotesis”, è perciò decisiva per lo sviluppo di tutta una serie di disordini e patologie che si possono verificare in bambini, adolescenti ed adulti nati SGA/IUGR.
3) Alterazioni neurologiche e comportamentali.
L’esposizione del feto alla carenza di substrati essenziali quali ossigeno, proteine e ferro, comporta l’alterazione dell’integrità morfologica nonché la compromissione funzionale del sistema nervoso centrale, con conseguente insorgenza di un quadro clinico patologico di entità diversa a seconda del timing, della severità, e della durata dell’insulto. La presenza di un feto con ritardo di crescita asimmetrico, che ha messo in atto il meccanismo protettivo nei confronti del suo SNC (brain sparing), migliora la prognosi neuroevolutiva rispetto ai neonati con microcefalia alla nascita. Sulla base di queste considerazioni è chiara l’importanza di poter formulare una diagnosi precoce, che permettano una programmazione tempestiva degli eventuali interventi riabilitativi. La valutazione della motricità spontanea, basata sull’osservazione dei general movements (GMs) si è dimostrata in questo senso uno strumento utile, affidabile dal punto di vista diagnostico in diverse popolazioni di neonati, pretermine e a termine. I GMs rappresentano complessi pattern motori del feto e del neonato, osservabili in utero fin dalle nove settimane di età gestazionale nei neonati e nei lattanti fino ai primi 4-5 mesi di vita. La loro eleganza e fluidità sono le caratteristiche principali che si osservano in bambini sani, mentre se assumono caratteristiche di disorganizzazione e incordinazione, apparendo bruschi e rigidi indicano la presenza di disturbi neurologici. (20)
Il timing del follow-up neurologico è pertanto scandito da tappe ineludibili, che, coincidendo temporalmente con le fasi di maturazione delle componenti del SNC, consentono di giudicare, con accettabile margine di errore, l’eventuale insorgenza di deficit neurologici. La valutazione clinica inizia con la misurazione della circonferenza cranica e dell’indice di cefalizzazione (COF/peso neonatale) poiché esistono in letteratura dati che dimostrano la correlazione tra piccole dimensioni cefaliche neonatali e incidenza di anomalie neurologiche. Prosegue poi avvalendosi di scale di riferimento diverse (Dubowitz, Amiel-Tison, Bayley), studiate appositamente per esaminare l’adeguatezza dello sviluppo neurocomportamentale.
Nell’ambito della valutazione neurologica si inserisce anche la verifica delle funzioni neurosensoriali (esecuzioni delle otoemissioni acustiche alla nascita), e con l’effettuazione prima della dimissione e a un anno dell’esame oculare, per accertare o meno quadri di retinopatia o alterazioni morfologiche dei vasi retinici.
Nell’infanzia e nell’adolescenza i nati SGA possono andare incontro allo sviluppo di anomalie minori come disabilità cognitive lievi, disturbi del linguaggio, disturbi dell’apprendimento, della memoria a breve termine e della sfera comportamentale, se confrontati con i nati di uguale età gestazionale ma di peso adeguato alla nascita, probabilmente per difetto funzionale delle strutture ippocampali.
Sembra che l’allattamento al seno per almeno i primi sei mesi di vita possa svolgere un ruolo protettivo su questi lievi ritardi mentali. Il trattamento con l’ormone della crescita, specialmente nei nati SGA con una ridotta circonferenza cranica alla nascita, sembra migliorare il QI in questi bambini che mostrano un livello globale di intelligenza più basso rispetto alla popolazione di controllo, con un profilo cognitivo caratteristico. E’, infatti, presente una riduzione delle competenze verbali, e minori capacità nelle prove di memoria, riduzione dell’attenzione a scuola e iperattività. Sono stati compiuti numerosi studi che hanno valutato questi parametri (difficoltà di apprendimento, capacità cognitive, attenzione, memoria) mediante test e questionari, che hanno dimostrato una significativa associazione tra lievi alterazioni in queste capacità e l’essere nati SGA.(21)
Per quanto riguarda l’outcome neuroevolutivo a lungo termine, sembra che i nati SGA, pur non presentando differenze significative nella frequenza di impiego, dello stato coniugale e in genere di soddisfazioni nella vita rispetto ai nati AGA, assumano meno frequentemente ruoli manageriali o che implichino maggiori responsabilità decisionali, rispetto ad adulti di normali dimensioni alla nascita.
4) Malformazioni congenite e sindromi malformative
La correlazione tra malformazioni congenite (MC) e nascita di feto SGA/IUGR è ormai ampiamente dimostrata. Numerosi studi confermano che i nati di basso peso hanno un rischio doppio di patologie malformative
congenite rispetto ai neonati di peso appropriato; il rischio diventa tre volte maggiore se il peso è molto basso.
Le malformazioni di più frequente riscontro nei neonati SGA/IUGR sono risultate: aberrazioni cromosomiche, labiopalatoschisi, cardiopatie congenite, ed ipospadia. In particolare l’ipospadia presenta un’associazione significativa con valori ridotti di peso, lunghezza e circonferenza cranica alla nascita, mentre non è correlata significativamente con l’età gestazionale. Le ipotesi o i meccanismi etiopatogenetici più probabili per giustificare tale relazione sono vari: essere SGA/IUGR può costituire una condizione predisponente a difetti congeniti, può essere un fattore secondario alla presenza di MC, o può essere associato al difetto congenito sulla base di fattori etiologici comuni. Di fronte ad un neonato SGA/IUGR, oggi facilmente individuato in epoca prenatale grazie alle indagini ecografiche di routine, resta in ogni modo un compito difficile individuare la presenza di eventuali MC associate, e soprattutto di rilevare anomalie minori (microcefalia, dimorfismi cranio-facciali, anomalie scheletriche/dismetrie, soffi cardiaci, anomalie dei genitali) che possono indirizzare verso una determinata sindrome malformativa. È di fondamentale importanza l’accuratezza con cui il neonatologo ricerca segni clinici all’esame obiettivo e raccoglie i dati anamnestici che possano indirizzare verso un determinato sospetto diagnostico. Nel caso in cui il riscontro di anomalie risulti positivo si dovrà accertare se esse siano riconducibili o meno ad una specifica
sindrome malformativa, distinguere cioè se le malformazioni contemporaneamente presenti siano associate casualmente o siano correlabili da un punto di vista eziologico (sindrome malformativa propriamente detta).
---
ü CROMOSOMICHE
ð Aneuploidie autosomiche (trisomie 13 e 18, monosemie 4 e 5) ð Aneuploidie genosomiche (X0)
ü MONOGENICHE ü AUTOSOMICHE
ð Dominanti (es.: acondroplasia, Rubinstein-Taybi, Williams) ð Recessive (es.: Jeune, Bloom e Dubowitz)
ü LEGATE ALLA X
ð Dominanti (es.: CHILD) ð Recessive (es.: Menkes) ü AMBIENTALI
ð Agenti infettivi (es.: Varicella, CMV, Rosolia, AIDS, Herpes) ð Agenti chimici e farmacologici (es.: sindrome fetoalcolica,
valproato, trimetadione, warfarina) ü CAUSA SCONOSCIUTA
ð Fenotipi comuni (es.: De Lange, Floating-Harbor) ð Fenotipi privati/n.d.d.
--- Tabella 1.3 Principali malformazioni e sindromi malformative nello
IUGR
Abbiamo visto come i nati SGA rappresentino un gruppo eterogeneo di neonati, che possono andare incontro alla nascita e poi nelle varie fasi della loro vita a tutta una serie di problematiche che possono essere prevenute o trattate con buoni risultati grazie ad una scrupolosa sorveglianza medica possono essere prevenute o trattate con buoni risultati. Bisogna però fare alcune considerazioni importanti per capire la difficoltà ad inquadrare, dal punto di vista
P Paattoollooggiiee r riiccoorrrreennttiinneell s soogggg.. S SGGAA//IIUURRGGddaallllaa n naasscciittaaaallll’’eettàà a adduullttaa
medico, questi pazienti; infatti, la maggior parte delle alterazioni o condizioni patologiche di cui abbiamo parlato sono associate ad un 10-20% dei nati SGA, quindi non sarebbe indicata per tutti i bambini, adolescenti o adulti nati piccoli per l’età gestazionale uno stretto controllo routinario. Alcune di esse sono più strettamente correlate con la presenza di una restrizione di crescita che con il basso peso alla nascita, per altre sono stati effettuati molti studi dimostrati sugli animali, solo ipotizzati per l’uomo; alcune condizioni morbose come l’obesità o l’aumento della pressione sanguigna, o altre alterazioni endocrine possono essere associate anche a fattori diversi quali l’etnia, il background socio-culturale, la provenienza geografica, la condizione economica, il sesso, ecc..
Quindi a fronte di una ampissima documentazione sui nati piccoli per età gestazionale ancora molti punti devono essere chiaramente spiegati. I Ippeerrtteennssiioonnee a arrtteerriioossaa A Alltteerraazz.. O Ommeeoossttaassii g glluucciiddiiccaa A Alltteerraazz.. n neeuurroollooggiicchhee A Alltteerraazz..MMaassssaa o osssseeaa A Alltteerraazz.. e emmaattoollooggiicchhee M Maallaattttiiee c caarrddiioovvaassccoollaarrii A Alltteerraazz.. e ennddooccrriinnee I Innffeezziioonniiee a alllleerrggiiee A Alltteerraazz.. S Svviilluuppppoo s soommaattiiccoo D Diisslliippiisseemmiiaa
1.2 I GEMELLI
Si definisce gravidanza multipla quella in cui si sviluppano contemporaneamente più embrioni, e poi feti. Quando gli embrioni sono due si parla di gravidanza gemellare, di gravidanza trigemina se sono tre, quadrigemina, pentagemina e così via se sono quattro, cinque o più. La gravidanza multipla viene classificata come un’anomalia del concepimento; con questo termine si intendono le deviazioni dalla normalità del processo di fusione dei gameti, maschile e femminile, indipendentemente dalla presenza di anomalie del patrimonio ereditario.
Il numero delle gravidanze multiple ha presentato un progressivo e significativo aumento, non solo in Italia, a partire dalla seconda metà degli anni ’70. Questo andamento è stato osservato sia per i parti bigemini, sia soprattutto per i parti trigemini e più; anche se dalla fine degli anni ’90 le
gravidanze plurigemellari sono in diminuzione rispetto a quelle gemellari che continuano ad aumentare. Questa tendenza è stata attribuita in parte ad un recente trend nel ritardare la prima gravidanza; molte nascite avvengono, infatti, con maggior frequenza in donne di circa 30 anni di età o più. La restante parte di questo aumento è correlato all’impiego di terapie ormonali per l’induzione dell’ovulazione e alla tecniche di riproduzione assistita (gravidanze multiple iatrogene), soprattutto in donne di età superiore ai 35 anni.
Si deve sottolineare come i valori in aumento si riferiscano solo alle nascite; è verosimile che un numero imprecisato di gravidanze plurime esiti in aborto, anche molto precoce, e pertanto non venga nemmeno diagnosticato. Inoltre, in un certo numero di gravidanze plurime si verifica l’aborto di uno dei gemelli, mentre l’altro (o gli altri) continuano il proprio sviluppo (circostanza definita “gemello che scompare” o “evanescente”). Si ritiene che questo fenomeno si verifichi in un 30% delle gravidanze gemellari; la perdita di un embrione o di un feto, che si verifica tra la settima e la dodicesima settimana di gestazione, è documentata su base ultrasonografica. Non raramente nelle gravidanze multiple esistono uno o più sacchi gestazionali senza embrione che finiscono per essere riassorbiti. In generale nelle gravidanze con più di un embrione aumenta il rischio di aborto di uno o più embrioni rispetto alle gravidanze singole.
In Italia, circa una gravidanza su 94 è gemellare, e di queste, circa un terzo si rivela di tipo monozigote. La frequenza di gravidanze trigemine o
quadrigemine è invece molto più rara: se l'incidenza della gravidanza gemellare è di 1:94, quella trigemina è di 1:3000 circa e quelle di ordine superiore addirittura di 1:23000 circa (dati ISTAT 1991-1996). Le coppie di gemelli composte da un maschio e una femmina che rappresentano un terzo di tutte le nascite gemellari, sono bizigotiche.
Per quanto riguarda le origini della gravidanza multipla, può derivare da due o più ovociti fecondati da due o più spermatozoi diversi, oppure da un ovocita fecondato da uno spermatozoo, dopodichè segue più o meno precocemente la separazione dell’abbozzo embrionario inziale in due o più abbozzi distinti. Nel primo caso si parla di gravidanza biovulare, triovulare e così via, nel secondo caso si parla di gravidanza multipla monoovulare. Casi particolari di gravidanza multipla monoovulare derivano ipoteticamente quando un ovocita contiene due nuclei, ciascuno dei quali viene fecondato da uno spermatozoo diverso; oppure, quando vengono fecondati ciascuno da uno spermatozoo diverso sia l’ovocita, sia il suo primo o il suo secondo globulo polare.
Le gravidanze derivate da ovulazioni multiple danno origine necessariamente a gravidanze multiple multizigotiche, ognuno degli zigoti derivando dalla fecondazione di un ovocita da parte di uno spermatozoo. Di solito le gravidanze multiple monoovulari danno origine a gravidanze multiple monozigotiche poiché i concepiti derivano dalla separazione di un unico zigote. Fanno eccezione i casi ipotetici sopra menzionati che danno origine a gravidanze monoovulari ma bizigotiche.
I bambini che nascono da gravidanze multiple bizigotiche o polizigotiche sono detti anche gemelli fraterni; quelli che nascono da gravidanze multiple monozigotiche sono detti anche gemelli identici, vale a dire che hanno uguale patrimonio genetico e quindi uguaglianza di caratteri somatici e di sesso. Invece, il grado di similitudine che esiste tra gemelli fraterni è dello stesso ordine di quello che esiste tra fratelli non gemelli; ovviamente i gemelli fraterni possono essere anche di sesso differente.
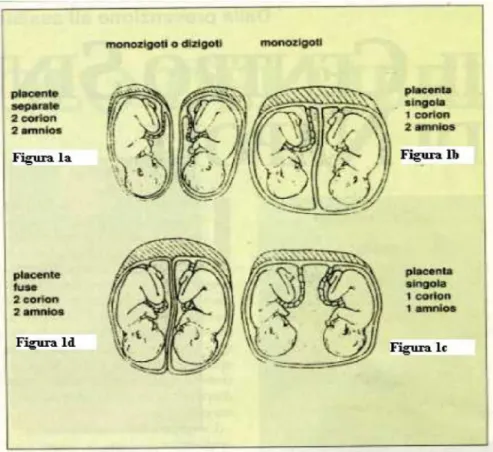
Nel caso di gemelli bizigotici o polizigotici ciascuno avrà la propia placenta e le propie membrane, anatomicamente separate da quelle dell’altro gemello (o degli altri gemelli) anche se topograficamente contigue. Si tratta sempre di gravidanze bicoriali e biamniotiche. Nel caso di gemelli monozigotici le possibilità sono diverse a seconda dell’epoca di sviluppo alla quale si è verificata la separazione degli abbozzi.
A) Se la separazione avviene al momento in cui vi sono solo due blastomeri, ciascuno di essi si anniderà indipendentemente dall’altro e si realizzerà una gravidanza bicoriale e biamniotica. (Figura 1.3,1a-1d)
B) Invece se la separazione avviene dopo la differenziazione del trofoblasto, ma prima che si sia formata la cavità amniotica, si verificherà una gravidanza monocoriale biamniotica. (Figura 1.3,b)
C) Infine, se la separazione avviene dopo la formazione della cavità amniotica, si verificherà una gravidanza monocorialemonoamniotica.(Figura 1.3,1c)
Figura 1.3 Esempi della disposizione della placenta e delle membrane nella
gravidanza gemellare
Fra i vari fattori che influenzano la tendenza alla gravidanza multipla spontanea ne ricordiamo alcuni: nella razza nera la frequenza di gravidanze plurizigotiche è maggiore rispetto alla razza caucasica, mentre nelle razze mongoliche è sensibilmente inferiore; invece la frequenza delle gravidanze monozigotiche non varia in modo apprezzabile. La frequenza delle gravidanze multiple polizigotiche aumenta con la parità, l’età (fino a 40 anni), e la statura della madre. Per queste gravidanze è stata osservata,
inoltre, una manifesta tendenza ereditaria il cui meccanismo è tuttora ignoto; sembra però che il patrimonio genetico della madre abbia importanza preponderante, se non quasi esclusiva, rispetto a quella del padre. Per le gravidanze multiple monozigotiche una tendenza ereditaria è presumibile solo in casi eccezionali.
L’interesse, non tanto biologico quanto clinico e sociale della gravidanza multipla dipende dal fatto che questo tipo di gravidanza dá origine ad un numero elevato di bambini patologici, in particolare per quanto riguarda la prematurità e la restrizione dell’accrescimento intrauterino. Altre possibili complicanze materne e feto-neonatali delle gravidanze multiple sono: l’aborto, le problematiche respiratorie, la trasfusione gemello-gemello, le anomalie congenite, la sindrome del gemello evanescente e le sequele neurologiche. Tutti queste condizioni rappresentano fattori di rischio per mortalità perinatale, aumentata appunto nelle gravidanze multiple.
È interessante notare come la mortalità perineonatale nei gemelli non si discosti da quella dei singoli nel corso delle prime 36 settimane di gestazione, mentre aumenta significativamente nelle ultime settimane. Questo indica come l’effetto sulla mortalità delle complicanze tipiche dei gemelli divenga evidente solo verso il termine di gestazione, mentre nelle prima parte della gravidanza l’aumento della mortalità sia prevalentemente legato alla maggior incidenza di prematurità. La maggior
frequenza con cui la prematurità si associa alle gravidanze multiple è attribuita a numerosi fattori, primo fra tutti l’evidenza clinica di un incremento nella attività contrattile basale uterina; le onde contrattili aumentano infatti sia in ampiezza che in frequenza (soprattutto in parti tri-quadrigemini). Oltre a questa importante differenza nella contrattilità uterina, sussistono fattori materni, fetali, e placentari associati con l’aumento della frequenza di parti pretermine nelle gravidanze multiple; pochi sono modificabili: fumo di sigaretta e aumento ponderale durante la gravidanza. Con particolare frequenza si osservano la rottura prematura delle membrane, il polidramnios, e la gestosi.
Anamnesi ostetrica:
precedente nascita di un bambino piccolo per l’età gestazionale (SGA) precedente/i aborto/i spontanei
precedente parto pretermine storia di perinatale
stria di esposizione in utero …… Fattori socio-demografici:
giovane età nubile
bassa condizione socio economica razza nera
basso livello di educazione Fattori antropometrici:
basso peso pregravidico
ridotta crescita ponderale durante la gravidanza inadeguato crescita ponderale al termine di gravidanza Stile di vita:
fumo di sigaretta abuso di droghe
Fattori che precedono il parto: polidramnios
incompetenza cervicale
rottura prematura delle membrane
Tabella 1.4 Fattori associati alla prematurità
IUGR Anomalie di impianto della placenta Stile di vita Fattori che precedono il parto FETALI UTERO/ PLACENTARI MATERNI Anamnesi ostetrica Fattori socio-demografici Fattori antropometrici
La durata della gravidanza è, inoltre, direttamente correlata con il peso alla nascita, e inversamente con il numero dei feti. L’età gestazionale media è infatti rispettivamente di 39, 35,8 e 32,5 settimane, ed il peso medio di 3357, 2389, 1735 grammi per i nati da gravidanza singola, bigemina e trigemina. La costanza con cui si sono state osservate queste differenze ha portato alla messa a punto di curve di accrescimento intrauterina differenziate per i feti da gravidanza multipla. Da queste curve si osserva come a partire dalla 28ª settimana di gestazione è presente una deviazione, ritenuta fisiologica, nell’accrescimento fetale dei gemelli rispetto ai singoli, cioè tutti i nati da gravidanza multipla presentano un ritardo di accrescimento intrauterino, interpretato come un tentativo naturale di adattamento che tende a privilegiare la maturazione fetale rispetto all’accrescimento. In realtà è solo dopo la 38ª settimana nei bigemini, e dopo la 35ª nei trigemini, che il peso alla nascita scende sotto il 10° centile rispetto ai singoli. Comunque circa il 50% dei bigemini e il 91% dei trigemini nascono prima della 37ª settimana (e pertanto sono di peso inferiore ai 2500 g), contro il 9% dei singoli. La causa del ritardo di crescita intrauterina è attribuito all’insufficienza placentare. Lo IUGR può presentarsi anche nel caso in cui si verifichi la trasfusione gemello-gemello. Questa condizione dinamica si presenta quasi esclusivamente nei gemelli monozigoti in cui vi è condivisione della circolazione sanguingna placentare più o meno pronunciata. Tale condivisione è data dalla quasi costante presenza di anastomosi arterio-arteriose, arterio-venose, e
veno-venose superficiali e profonde che sembrerebbero costantemente presenti in tutti i casi di gemelli monocoriali. Nella maggior parte dei casi i gemelli condividono equilibratamente questa circolazione interfetale o intergemellare, in almeno un 15% di placenta monocoriale invece si stabilisce uno squilibrio emodinamico che favorisce un gemello (gemello ricevente) a scapito dell’altro (gemello donatore).
Oltre alla nascita pretermine e al ritardo di crescita intrauterino ricordiamo altri importanti fattori di rischio per mortalità e complicanze a breve e termine come il distress respiratorio, la displasia broncopolmonare, la retinopatia della prematurità in fase attiva, l’emorragia cerebrale, la leucomalacia periventricolare, l’idrocefalo, la sepsi, l’enterocolite necrotizzante che richiedono il ricovero e spesso una prolungata degenza nella terapia intensiva neonatale.
L’aumentato rischio di mortalità perinenatale è da ricondurre anche alla presenza e soprattutto alla gravità delle malformazioni congenite che colpiscono con maggior frequenza i gemelli. La riduzione dello spazio intrauterino provoca alterazioni dello sviluppo, in particolare nell’ultimo trimestre di gestazione, con incidenza di malformazioni simile nei gemelli mono- e dizigoti. La displasia congenita delle anche,il piede torto, la sinostosi, la paralisi del facciale, l’asimmetria del cranio sono tutte di più comune osservazione nei gemelli. Ci sono poi tutta una serie di anomalie congenite che colpiscono quasi esclusivamente i gemelli monozigoti: alterazioni vascolari che si associano a gravi anomalie del SNC
(microcefalia, idranencefalia), gastrointestinale (atresia intestinale), cardiovascolare (acardia). L’arteria ombelicale unica associata come abbiamo visto allo IUGR, anomalie cromosomiche (in particolare la trisomia 18), alterazioni associate con quelle vascolari come la necrosi corticale renale, la microsomia facciale, l’aplasia cutanea congenita e i difetti terminali degli arti. Ancora alcune malformazioni tipiche dei gemelli monozigoti, quali il teratoma sacro-coccigeo, l’estrofia vescicale, anencefalia, suggeriscono una causa comune della gemellarità e delle alterazioni della blastogenesi e morfogenesi. Una delle più tipiche malformazioni dei gemelli monozigoti, per quanto rara (tra 1: 25.000 e 1:80.000 nati con il 70-80% dei casi di sesso femminile) è rappresentata dai gemelli congiunti, cioè saldati l’uno all’altro in vario modo e con varia estensione (gemelli siamesi). Un’ anomalia congenita, anch’essa eccezionale, tipica invece dei gemelli che derivano da zigoti differenti è il chimerismo.
Sebbene i gemelli monocoriali siano per definizione monozigoti, ci sono casi di discordanza per la presenza di anomalie congenite (un gemello è malformato e uno no), o di deformazioni che derivano dall’azione di forze esterne su strutture originariamente normali(piede torto, displasia delle anche), discordanza per l’assetto cromosomico(un gemello è portatore di una sindrome di Turner o di Down, e uno è normale). Da tutte queste considerazioni è chiara l’attribuzione alla gravidanza multipla della qualifica di gravidanza ad alto rischio, con previsione di entità di rischio
tanto maggiore quanto maggiore è il numero dei concepiti. L’entità poi del rischio ostetrico varia a seconda del tipo di gravidanza multipla; è infatti maggiore nelle gravidanze monozigotiche che nelle polizigotiche, è inoltre maggiore nelle monocoriali rispetto alle policoriali, infine è molto più elevata nelle monoamniotiche che nelle poliamniotiche. I motivi dell’esito infausto sono riconducibili, per le gravidanze monoamniotiche, soprattutto all’insorgenza di aggrovigliamento o attorcigliamento dei funicoli ombelicali; il rischio ostetrico aumenta se si aggiungono altri fattori che compaiono anche nelle gravidanze monocoriali biamniotiche (sindrome da trasfusione feto-fetale, inserzione velametosa del funicolo, aumentata frequenza di malformazioni) e nelle bicoriali (placenta previa, conseguenze della prematurità).
Le distonie meccaniche, pur essendo in genere più frequenti in tutte le gravidanze multiple rispetto alle singole, lo sono ancor di più nelle gravidanze multiple monoamniotiche. Almeno in parte l’entità del rischio può essere ridotta o contrastata se si riesce a fare diagnosi precoce, non solo di gravidanza multipla, ma anche di corionicità, di amnioticità e di zigosia. La diagnosi precoce è necessariamente strumentale, in particolare ecografica, dato che quella clinica è tardiva e può incorrere facilmente in malintesi.
Infine, altri fattori correlati con la mortalità perineonatale sono la giovane età materna (al suo aumentare si riduce la mortalità), l’ordine di nascita (il primo nato ha un rischio di mortalità minore rispetto al
secondo o ai successivi), il sesso maschile e la concordanza del sesso, che incidono negativamente sulla mortalità, la discordanza nel peso che ha un effetto inverso (provoca un aumento della mortalità con discordanza maggiore al 20% del peso del gemello più grosso,con rischio più elevato per il gemello che pesa meno), e ultimo ma più importante ai fini prognostici è il destino dell’altro gemello ( se il gemello è deceduto in utero il rischio di mortalità aumenta di circa 10 volte).
Tra le complicanze a lungo termine ricordiamo principalmente le sequele neurologiche (paralisi cerebrale, ritardo mentale) e sensoriali (sordità, cecità retinopatia cicatriziale), le problematiche cognitive, di apprendimento e comportamentali che insorgono al momento dell’inserimento scolastico, ed i disturbi dell’accrescimento. Da segnalare nei gemelli monozigoti la caratteristica affinità intragemellare, ovvero le identiche qualità sensoriali e percettive in questi gemelli producono in loro una identica rappresentazione del mondo esterno ed una reattività equivalente; questo crea un legame psicologico intenso per cui tendono ad isolarsi nell’ambito familiare formando gruppo a sé. Il legame di coppia produce spesso la formazione e l’uso di un linguaggio segreto costituito non da parole, ma da fonemi incomprensibili agli estranei(criptofasia), di cui neanche i genitori si accorgono, a volte. È chiaro quindi, come i gemelli siano dei pazienti che già prima della nascita richiedono particolari cure e attenzioni(legate soprattutto alla prematurità e al basso peso), che presentano una serie di problematiche nel corso dei primi anni di vita non
solo mediche, ma anche di ordine economico-sociale, e dal punto di vista dello stress a carico dei genitori, e vanno incontro ad una più elevata incidenza di sequele a lungo termine, soprattutto neurologiche.
1.3 I GEMELLI DISCORDANTI PER IL PESO ALLA NASCITA (SGA E AGA)
Oltre alla prematurità e alla restrizione di crescita intrauterina, la gravidanza multipla può presentare come complicanza una crescita, e quindi un peso effettivo alla nascita, discordanti tra i due o più feti che occupano lo stesso utero.
La discordanza di peso alla nascita è un evento abbastanza comune nelle gravidanze multiple. Approssimativamente nel 25% delle nascite gemellari si verifica una differenza di peso che varia tra il 15 e il 25%, mentre circa il 5% dei gemelli presenta un grado severo di discordanza, superiore cioè al 30 %. In realtà il range in cui varia la percentuale di discordanza di peso tra il 15 e il 25% è molto ampio, oscillando tra il 4 e il quasi il 30% ; questo intervallo è probabilmente attribuibile all’eterogeneità dei soggetti esaminati per quanto riguarda l’etnia, il background socioeconomico, e la presenza nei campioni di casi di gravidanze a rischio, in cui sono attesi gradi maggiori di discordanza. In caso di gravidanza trigemellare (o plurigemellare) la frequenza con cui si osserva una discordanza di peso alla nascita severa (compresa tra il 25 e il 35%) è all’incirca del 20%; in un 10% dei casi invece la discordanza supera il 35%.(39)
La discordanza di peso alla nascita è significativamente associata ad un maggior rischio di mortalità perinatale in entrambi o in tutti i gemelli;
questo rischio è aumentato significativamente se uno, entrambi, o più gemelli sono piccoli per l’età gestazionale.
Si è osservato che piccole differenze di peso tra due o più nati da una gravidanza rispettivamente gemellare o multipla, non sono significative ai fini dell’accrescimento e dello sviluppo, ma sono considerate fisiologiche e messe in relazioni con variazioni genetiche individuali (gemelli DZ). Si parla di gemelli discordanti quando la differenza nel peso alla nascita sia > al 15%, calcolando la disparità come una percentuale del peso del gemello di peso maggiore. Questa in percentuale è la definizione di discordanza più utilizzata in letteratura, anche se esistono altri due tipi di definizione, cioè la definizione in valore assoluto(diffrenza di peso alla nascita tra il gemello più piccolo e quello più grande) e quella statistica. (espressa in DS rispetto alla media dei pesi alla nascita di coppie di gemelli di riferimento).(38)
Abbiamo detto come la nascita di gemelli discordanti per il peso sia un evento piuttosto frequente, e numerosi studi sono stati condotti per valutare il periodo postnatale in questi neonati. Da questi studi è emerso come in nati a termine da gravidanze gemellari o multiple la documentazione di una discordanza di peso non sembri essere predittiva di un outcome sfavorevole solo nel caso in cui entrambi i gemelli siano AGA; diversa è la situazione se almeno uno dei nati sia piccolo per l’età gestazionale. Infatti, il rischio di mortalità neonatale è significativamente aumentato nei nati con il peso più basso di cui uno sia SGA (SGA e AGA);