UNIVERSITA’ DEGLI STUDI DI PISA Facoltà di medicina e chirurgia
LA RM NELLA VALUTAZIONE DELLA RISPOSTA DEL
CARCINOMA MAMMARIO ALLA CHEMIOTERAPIA
NEOADIUVANTE: CORRELAZIONE CON IL DATO
ANATOMOPATOLOGICO.
Il relatore Chiar.mo Prof. Carlo Bartolozzi
Il candidato
Rossella Scandiffio
INDICE
RIASSUNTO 4
INTRODUZIONE 6
1. EPIDEMIOLOGIA, ETIOLOGIA ED ETIOPATOGENESI DEL CARCINOMA MAMMARIO 7
2. ANATOMIA PATOLOGICA E STADIAZIONE DEL CARCINOMA MAMMARIO 10
3. LA DIAGNOSTICA PER IMMAGINI NEL CARCINOMA MAMMARIO 14
4. LA RM NELLA DIAGNOSTICA SENOLOGICA 16
5. CONTROINDICAZIONI E CONDIZIONI LIMITANTI L’USO DELLA RM 21
6. VANTAGGI E LIMITI DELL’USO DELLA RM NELLO STUDIO DELLA MAMMELLA 23
7. LA CHEMIOTERAPIA NEOADIUVANTE NEL TRATTAMENTO DEL CARCINOMA MAMMARIO 25
SCOPO 27 MATERIALI E METODI 28 RISULTATI 32 IMMAGINI 1. CASO 1 36 2. CASO 2 37 3. CASO 3 40 4. CASO 4 41
5. CASO 5 44
6. CASO 6 47
DISCUSSIONE 48
CONCLUSIONI 56
RIASSUNTO
Scopo
Il presente studio ha indagato retrospettivamente l’efficacia della RM nel misurare la dimensione residua della neoplasia mammaria in pazienti con carcinoma mammario localmente avanzato e sottoposte a chemioterapia neoadiuvante.
Materiali e metodi
27 pazienti (range di età 33– 74 anni, età media 53 anni) , per un totale di 28 lesioni, sono state indagate prima dell’inizio della terapia primaria e al termine della stessa mediante esame di RM; lo schema terapeutico seguito prevedeva fluorouracile (600mg/ m2 ), epirubicina (60 mg/m2 ) e ciclofosfamide (600 mg/m2).
I dati ricavati dalla misurazione del diametro maggiore sono stati poi confrontati con le dimensioni misurate all’esame istopatologico, considerato il gold standard, effettuato dopo l’escissione chirurgica.
Sono state eseguite sequenze 3 D SPGR, seguite da uno studio dinamico effettuato dopo l’iniezione di mezzo di contrasto; le immagini precontrastografiche sono state sottratte alle corrispettive immagini postcontrastografiche e poi elaborate mediante programmi di post- processing.
L’analisi delle immagini di RM è stata ottimizzata per identificare la malattia residua nella mammella trattata.
Risultati
L’elaborazione dei dati ha dimostrato che la sensibilità dello studio di RM è 84%, la specificità 67%, il valore predittivo positivo (VPP) 95%, il valore predittivo negativo (VPN) 33% .
Conclusioni
La RM risulta essere un valido strumento nella valutazione della risposta alla chemioterapia neoadiuvante del carcinoma mammario localmente avanzato, nonostante l’esistenza di alcune incongruenze che compromettono la corretta misurazione della lesione.
Non esiste infatti una misurazione istologica dimensionale precedente all’inizio della chemioterapia, perciò il controllo è basato su una valutazione dimensionale legata alla RM; inoltre, l’azione diretta del farmaco sui neovasi è causa di sottostima, mentre la reazione flogistica peritumorale può essere responsabile di sovrastima; infine, la presenza di frammenti ed emboli neoplastici residuati al termine della chemioterapia è ulteriore causa di difficoltà nella determinazione dei diametri .
Anche lo studio anatomopatologico può essere gravato da problematiche riguardanti la misurazione, poiché la fissazione in paraffina può compromettere la corretta determinazione delle dimensioni.
Alla luce di queste considerazioni, si impone una collaborazione tra radiologo ed anatomopatologo, al fine di trovare un sistema omogeneo, standard e condiviso di correlazione delle dimensioni iniziali e residue del tumore; questa alleanza dovrebbe essere estesa anche agli studi riguardanti la neoangiogenesi, per effettuare una correlazione tra questa e i parametri funzionali.
INTRODUZIONE
La chemioterapia neoadiuvante si è imposta come primo momento terapeutico in corso di carcinoma mammario classificato in stadio III.
L’efficacia di questo approccio è verificabile direttamente attraverso la regressione della lesione neoplastica ma la valutazione, eseguita comunemente mediante palpazione, non dimostra un’accuratezza diagnostica elevata, né sono giudicabili soddisfacenti le informazioni ricavabili attraverso indagine ecografica o mammografica; la misurazione “a posteriori” del pezzo operatorio è certamente valida, ma priva delle valenze terapeutiche che la conoscenza della risposta avrebbe se ottenuta durante il trattamento e comunque precedentemente rispetto all’esecuzione dell’atto chirurgico.
Nella prospettiva di determinare in modo efficace la percentuale di regressione della lesione neoplastica durante la terapia neoadiuvante, è stata avanzata la proposta di avvalersi della RM per la misurazione del tumore prima dell’inizio del trattamento e al termine dei cicli programmati.
L’uso della RM nella diagnostica senologica è una realtà e la sua accuratezza nella misurazione dell’estensione di una neoplasia mammaria non trattata si è dimostrata elevata, ma il suo utilizzo nel monitoraggio della risposta alla chemioterapia primaria non è ancora entrato nella pratica clinica, nonostante i positivi pareri di diversi autori.
1. EPIDEMIOLOGIA, ETIOLOGIA ED ETIOPATOGENESI DEL CARCINOMA DELLA MAMMELLA
Il carcinoma mammario è la seconda più comune neoplasia nel sesso femminile, preceduta solo dal tumore del polmone.
La sua incidenza è maggiore in Europa nord-occidentale e nel nord America, ma nel corso degli ultimi anni sembra essere in lieve aumento nei Paesi orientali; i tassi minori, fino a dieci volte inferiori, si riscontrano nei Paesi del Terzo Mondo
In Italia si osserva un gradiente di rischio Nord-Sud: a Varese, Torino, Biella e Genova i tassi grezzi superano i 150 casi su 100000 donne/anno, mentre a Ragusa, Sassari e Napoli i tassi sono inferiori a 100 casi su 100000 donne/anno; l’aumento di incidenza è però più rapido al Sud, e per questa ragione le differenze si stanno attenuando.
In Italia, il numero di nuovi casi per anno é stimato in circa 45000, mentre ammontavano a circa 20000 i nuovi casi/anno nel corso degli anni Ottanta; questo trend non deve essere riferito ad un aumento del rischio, ma all’anticipazione della diagnosi, assicurata dai programmi di screening. In definitiva, si calcola che una donna su 14 è destinata ad ammalarsi di carcinoma mammario nel corso della propria vita.
L’incidenza di malattia aumenta con l’aumentare dell’età, ma a differenza della gran parte dei tumori epiteliali il suo andamento non si approssima a quello di una curva esponenziale, del tipo I = a (età), ma cresce esponenzialmente fino alla menopausa, quindi rallenta, mostrando a volte un plateau, per poi ricominciare a crescere.
Il carcinoma mammario è la prima causa di morte per neoplasia nel sesso femminile, ed è seconda alle malattie cardiovascolari come causa di morte in assoluto dopo i 55 anni. Per quanto ancora drammaticamente elevato, il continuo progresso delle tecniche di screening e la sua applicazione su larga scala, unitamente all’evoluzione delle terapie, ha comportato una diminuzione della mortalità a fronte di un incremento del 3% annuo dell’incidenza, a partire dal 1980. 1
elementi, in particolare dietetici e antropometrici, non correlino con il dato numerico abbastanza da giustificare la denominazione di fattori di rischio, e sono quindi più correttamente definiti indicatori di rischio.
-Fattori familiari e genetici
Il rischio di ammalarsi di carcinoma mammario aumenta del doppio in presenza di familiare di primo grado colpito e, nel caso in cui i familiari siano due, il rischio è pari al 50%, percentuale che giustificherebbe i sospetti sull’esistenza di un gene a trasmissione autosomica dominante, coinvolto nell’insorgenza della neoplasia in determinati gruppi familiari. Finora l’evidenza è però limitata ad alcune mutazioni identificate all’analisi genetica, in particolare:
- mutazioni dei geni BRCA-1 e BRCA-2, codificati rispettivamente sui cromosomi 17 e 13, presentano un rischio prossimo al 90%;
-sindrome di Li- Fraumeni, epifenomeno della mutazione dell’oncosoppressore p-53 nella linea germinale;
-malattia di Cowden, o sindrome da amartomi multipli, in cui è coinvolto il cromosoma 10q, associata ad un rischio di sviluppare carcinoma mammario pari al 30-50% a 50 anni;
-gene ATM, con rischio dell’11% a 50 anni. -Fattori ormonali
L’assetto degli ormoni sessuali gioca un ruolo fondamentale nello sviluppo e progressione del carcinoma mammario, come sottolineato da studi epidemiologici, ma anche dimostrato da alcuni successi terapeutici, oltre che in campo sperimentale. L’esposizione prolungata a livelli elevati di estrogeni è infatti associato ad un incremento del rischio, nonostante l’esatto meccanismo patogenetico non sia ancora perfettamente chiarito; questo spiega l’aumento del rischio in donne interessate da menarca precoce e menopausa tardiva, nelle nullipare e nelle primipare attempate. La terapia ormonale sostitutiva, seguita per almeno 8-10 anni, sembra essere associata ad un incremento del rischio di 1,5 volte, mentre le recenti formulazioni estroprogestiniche non sembrano gravate da cifre altrettanto importanti.
Dubbio e controverso il ruolo del progesterone. -Fattori ambientali
La minore incidenza di carcinoma mammario nei Paesi orientali, e il suo aumento nelle generazioni immigrate negli Usa, suggerisce il probabile intervento di fattori dietetici, in particolare grassi animali, ma i risultati sono al momento di difficile interpretazione. L’esposizione a mantello a radiazioni ionizzanti in donne colpite da linfoma di Hodgkin in seconda- terza decade di vita aumenta il rischio del 20-30% a 10-30 anni dal trattamento.
Infine l’obesità che, a causa dell’aromatasi espressa nel tessuto adiposo, si accompagna a iperestrismo, causando alterazioni nel normale assetto ormonale. 2,3
2. ANATOMIA PATOLOGICA E STADIAZIONE DEL CARCINOMA MAMMARIO
Il carcinoma mammario è suddiviso in non invasivo, o in situ, e invasivo. Nel primo gruppo, l’80% è rappresentato dal carcinoma duttale in situ (CDIS), compresa la malattia di Paget; la quota restante è coperta dal carcinoma lobulare in situ (CLIS).
Nella compagine dei carcinomi invasivi sono invece distinti sei istotipi differenti; in ordine di frequenza riconosceremo il carcinoma duttale invasivo NAS; il carcinoma lobulare infiltrante; il carcinoma midollare; il carcinoma colloide; il carcinoma tubulare; il carcinoma papillare infiltrante.
La forma in situ è classificata in duttale e lobulare in base alla somiglianza degli spazi coinvolti a dotti o tubuli, anche se si ritiene che tutti i carcinomi originino dall’unità duttulo - lobulare terminale.
Il CDIS si presenta come popolazione di cellule maligne, ancora contenute all’interno del dotto e circondato dalla membrana basale; esistono cinque sottotipi istologici diversi:
• il comedocarcinoma presenta travate di cellule maligne ad alto grado nucleare e necrosi centrale, spesso calcificata. Macroscopicamente, l’aspetto molle e giallastro della necrosi spiega la denominazione. Comune la fibrosi periduttale concentrica e l’infiltrato infiammatorio cronico.
• le forme non- comedo (solido, cribriforme, papillare, micropapillare) presentano grado nucleare dal basso all’alto, necrosi centrale e calcificazioni.
Un cenno a parte merita la malattia di Paget, che insorge nei dotti escretori principali ed interessa capezzolo e areola. La cute sovrastante è fissurata ed ulcerata, e circondata da edema ed iperemia infiammatoria. Le cellule di Paget, patognomoniche per la lesione, hanno abbondante citoplasma chiaro, nucleoli prominenti, e si colorano con le metodiche per la mucina.
Il carcinoma microinvasivo presenta focolai di 0,1 cm al massimo, che invadono lo stroma.
Non è rara la coesistenza di pattern diversi in un unico CDIS; il CDIS è classificato in base al grado.
Il CLIS si presenta istologicamente come una proliferazione cellulare a livello del dotto terminale e dell’acino. Le cellule appaiono rotondeggianti,con nuclei regolari e piccoli nucleoli. Sono altresì presenti cellule ad anello con castone contenenti mucina.
Il carcinoma duttale invasivo NAS è la lesione più comune (70-80%). Microscopicamente si mostra come un nodulo di consistenza fibrosa, stridente al taglio, sulla cui superficie si notano aree di necrosi e focolai calcifici. L’architettura è distorta e disordinata, con cellule neoplastiche raggruppate in tubuli, cordoni, nidi e strutture pseudoghiandolari. Estrema la variabilità nei diametri e la colorabilità del nucleo. Può essere visibile l’invasione vascolare, perineurale, e dei vasi linfatici.
Il carcinoma lobulare infiltrante è costituito da cellule disposte in filiere, fino al caratteristico aspetto a “fila indiana”; le caratteristiche citologiche sono analoghe a quelle del CLIS, poiché le cellule appaiono piccole, monomorfe e scarsamente coese: risultano essere negative alla caderina E, molecola di adesione intercellulare.
Il carcinoma midollare copre fino al 5% del totale, ma arriva al 13% nelle donne portatrici del BRCA 1. I noduli appaiono ben circoscritti e di consistenza carnosa, in virtù dell’assenza di reazione desmoplastica. Istologicamente presenta travate di cellule grandi, dai nuclei vescicolosi e pleomorfi, con nucleoli prominenti, in attiva proliferazione; la lesione è a margini netti, circondata da un infiltrato infiammatorio.
Il carcinoma colloide (mucinoso) è una variante poco comune, di aspetto grigio- bluastro, simil- gelatinoso, soffice. Le cellule neoplastiche sono solitarie o in piccoli nidi, immerse in laghi di mucina amorfa, che muove lungo i piani di clivaggio.
Il carcinoma tubulare ha tubuli ben formati in rapporto diretto con lo stroma. Possono essere presenti spazi cribriformi, secrezioni apocrine e calcificazioni endoluminali.
I carcinomi papilliferi infiltranti sono rari. 3
La stadiazione è un insieme di manovre diagnostiche, clinico- strumentali e/o anatomopatologiche il cui obiettivo è quello di definire l’estensione della malattia, quindi lo stadio. Da questa definizione generano due implicazioni fondamentali, cioè la possibilità di formulare un giudizio prognostico e di impostare una terapia idonea. Ripetere la stadiazione al termine del trattamento consente di valutare la risposta alla terapia.
Si impone così la necessità di attribuire il caso di carcinoma della mammella che è stato diagnosticato ad una delle categorie dei sistemi classificativi, il più comune ed utilizzato dei quali è il sistema TNM, così come formulato dall’American Joint Committee on Cancer (AJCC). 4
Classificazione TNM clinica T Tumore primitivo
• TX Tumore primitivo non definibile • T0 Tumore primitivo non evidenziabile • Tis Carcinoma in situ
• T1 Tumore <2 cm nella sua dimensione massima • T2 Tumore >2 e <5 cm nella sua dimensione massima • T3 Tumore >5 cm nella sua dimensione massima
• T4 Tumore di qualsiasi dimensione con estensione diretta alla parete toracica o alla cute
T4a Estensione alla parete toracica, escluso il pettorale T4b Edema o ulcerazione della cute
T4c Presenza contemporanea delle caratteristiche T4a e T4b T4d Carcinoma infiammatorio
N Linfonodi regionali
• NX Linfonodi regionali non valutabili
• N0 Assenza di metastasi ai linfonodi regionali • N1 Metastasi a 1-3 linfonodi ascellari omolaterali • N2 Metastasi a 4-9 linfonodi ascellari omolaterali
• N3 Metastasi a 10 o più linfonodi omolaterali M Metastasi a distanza
• MX Metastasi a distanza non accertabili • M0 Assenza di metastasi a distanza
• M1 Presenza di metastasi a distanza
Il TNM è inoltre sfruttato per ottenere una ulteriore classificazione in stadi, recentemente revisionata dall’AJCC: • Stadio 0 Tis N0 M0 • Stadio I T1 N0 M0 • Stadio IIA T0- 1 N1 M0 T2 N0 M0 • Stadio IIB T2 N1 M0 T3 N0 M0 • Stadio IIIA T0- 2 N2 M0 T3 N1- 2 M0 • Stadio IIIB T4 N0- 2 M0 • Stadio IIIC T0- 4 N3 M0 • Stadio 4 T0- 4 N0- 3 M1
3. LA DIAGNOSTICA PER IMMAGINI NEL CARCINOMA MAMMARIO
Lo studio della patologia mammaria si avvale di un approccio che parte dalla semeiotica classica, mediante la raccolta di un’anamnesi mirata e l’esecuzione di un esame obiettivo volto alla valutazione della ghiandola mammaria e delle stazioni linfonodali, e culmina con l’utilizzo di metodiche di imaging .
Le indagini strumentali sfruttate in questo campo sono rappresentate dalla mammografia, dall’ecografia e dalla RM; le informazioni ricavate dalle immagini così ottenute possono poi essere corroborate dall’uso dell’interventistica guidata, che aggiunge un dato citologico o istologico.
La scelta dell’iter deve essere adeguata alle problematiche della singola paziente, prendendo in considerazione la presenza di fattori di rischio, l’esistenza di una eventuale sintomatologia, e l’età; sulla scorta di queste distinzioni, potremo dividere le pazienti in tre classi:
• Pazienti asintomatiche e prive di fattori di rischio; • Pazienti asintomatiche in presenza di fattori di rischio; • Pazienti sintomatiche.
Non sarà quindi indicato alcun esame in donne di età inferiore ai 40 anni e in assenza di fattori di rischio, ma la valutazione anamnestica ed obiettiva e l’ecografia sono comunque ritenute utili.
Le donne tra 40 e 49 anni sono seguite attraverso mammografia annuale ed ecografia in presenza di seno denso o complesso, mentre oltre i 50 anni si impone la mammografia biennale e l’ecografia, se il seno dovesse presentare ancora caratteristiche giovanili o miste.
In presenza di anamnesi positiva per fattori di rischio, le pazienti saranno valutate
attraverso una prima indagine obiettiva, seguita da mammografia annuale ed ecografia se siamo davanti ad un seno denso o complesso; è utile affiancare una RM annuale.
Un gruppo di pazienti ricorrerà alla valutazione per la presenza di sintomi, rappresentati dal rilievo palpatorio di noduli o addensamenti, ma anche da secrezione o mastodinia. In
questi casi, l’approccio clinico ci permetterà di distinguere donne che risulteranno negative, e che potranno essere gestite come asintomatiche, da donne in cui la franca positività o il semplice sospetto devono indurci a proseguire le indagini. Le pazienti di età inferiore ai 35 anni e in assenza di fattori di rischio saranno quindi valutate attraverso indagine ecografica, mentre le pazienti di età inferiore ai 35 anni, ma portatrici di mutazione genetica o in presenza di forte familiarità, e le pazienti di età superiore ai 35 anni saranno indagate con mammografia ed ecografia.
4. LA RISONANZA MAGNETICA NELLA DIAGNOSTICA SENOLOGICA
La RM ha assunto un ruolo importante nella diagnostica senologica 5, 6, trovando sempre più ampia applicazione in alcune specifiche indicazioni :
- follow up dopo quadrantectomia;
- stadiazione pre-chirurgica della neoplasia, in caso di tumore avanzato, sincrono, e di multifocalità/ multicentricità;
- monitoraggio delle lesioni mammarie trattate con chemioterapia neoadiuvante; - studio di donne ad alto rischio genetico o elevato rischio familiare per carcinoma
mammario;
- controllo della mammella secernente; - ricerca di carcinoma primitivo occulto;
- valutazione di protesi mammarie e di mammelle con protesi.
L’esame è eseguito posizionando nel magnete la paziente, prona e con le mammelle adagiate in bobine dedicate. L’uso di bobina dedicata permette di aumentare la risoluzione spaziale, fornendo ulteriori informazioni riguardo morfologia, dimensioni e margini della lesione.
L’apparecchiatura consiste in un magnete superconduttivo di 1,5 T, con intensità di gradiente di 30 mT/m e velocità di raggiungimento del picco di gradiente di 150 mT/m. La tecnica d’esame è eseguita prendendo in considerazione i seguenti aspetti:
• scelta del volume da studiare; • riduzione del movimento;
• scelta della risoluzione spaziale e temporale;
• riduzione degli artefatti legati al movimento cardiaco; • scelta del piano di scansione;
• scelta delle sequenze; • dose del MdC.
La risoluzione spaziale dipende dalla intensità ed omogeneità del campo magnetico, dalla bobina, dal campo di vista, dalla matrice e dall’intervallo tra le sezioni; la risoluzione temporale, invece, è dipendente dalla intensità di gradienti, dalla sequenza, e nuovamente dalla intensità ed omogeneità del campo magnetico.
La riduzione del movimento è ottenuta mediante il posizionamento della paziente in posizione prona, l’immobilizzazione delle mammelle e l’uso di bobine con compressione; per ridurre gli artefatti legati al movimento cardiaco si preferisce il piano coronale e la direzione cranio-caudale della codifica di fase.
La scelta del piano di scansione è dettata dalle caratteristiche di ogni singolo piano, poiché sia il piano assiale che quello sagittale garantiscono una buona anatomia ma sono alterati da artefatti da movimento; il sagittale comporta inoltre un maggior volume da studiare. Il piano coronale ha risoluzione spaziale elevata, assicura una visualizzazione ottimale dell’enhancement duttale e non è gravato da artefatti da movimento cardiaco. Sono sfruttate le seguenti sequenze:
• SE o TSE T1 E T2;
• Gradient echo T1 (2D o 3D) ;
• Sequenze con soppressione del grasso.
La sequenza gradient echo T1 3D (T1-FFE, GRASS, SPGR, FLASH) è utilizzata per lo studio dinamico con MdC, e garantisce una buona risoluzione spaziale e temporale. Il TR e il TE devono essere quanto più brevi possibile, evitando l’opposizione di fase acqua/ grasso (meno di 1,2 o 3-6 ms a 1,5 T). La sequenza va eseguita prima e dopo somministrazione di MdC, e ripetuta cinque volte.
La sequenza 3D T1 – FFE è effettuata con FOV di piccole dimensioni (360x160), numero di strati pari a 60, spessore di strato di 2,5 mm, intervallo tra gli strati uguale a 0, flip angle di 25°, matrice elevata ( 512 x 512), TR pari a 8,7 ms e TE di 4,3 ms; il tempo di scansione è di 1,24 s, ripetuto per sei volte.
La prima acquisizione è effettuata senza mezzo di contrasto; successivamente, dopo la
rapida iniezione di gadolinio DTPA, sono ottenute cinque ulteriori acquisizioni. Le immagini acquisite sono poi elaborate attraverso programmi di post- processing:
• sottrazione: dalle immagini ottenute dopo l’iniezione del mezzo di contrasto si sottrae la prima acquisizione, per evidenziare in maniera ottimale la lesione impregnata di mezzo di contrasto;
• MPR: la ricostruzione multiplanare permette di orientare la lesione nei diversi piani dello spazio;
• MIP: sommatoria di tutte le immagini sottratte in un’unica immagine tridimensionale;
• analisi funzionale: permette la selezione di ROI, e la successiva elaborazione di una curva intensità del segnale/ tempo;
• soppressione del grasso.
Si estrapolano quindi dati riguardanti sia la morfologia della lesione, in particolare forma, margini, dimensioni e multiplanarità (che possono essere sfruttati per ottenere le coordinate chirurgiche), che l’enhancement, che correla con la neoangiogenesi, l’aumento di permeabilità capillare e l’ingrandimento del comparto interstiziale.
Fase imprescindibile dell’esame è dunque l’elaborazione delle immagini acquisite, a cui è subordinata l’accuratezza diagnostica dell’esame. Un parametro fondamentale da valutare è la curva intensità/ tempo, ricavata descrivendo l’enhancement della lesione in fase precoce, intermedia e tardiva rispetto all’ iniezione del mezzo di contrasto.
Sono descritti tre tipi di curve:
Curva tipo I : raramente associato a tumori maligni, è caratterizzata da un aumento di intensità di segnale continuo, di oltre il 10% rispetto al picco dei primi tre minuti;
Curva tipo II : presenta un iniziale aumento di intensità, seguito da un plateau (deviazione dell’ intensità di segnale a tre –otto minuti di +/ - 10% rispetto al picco di intensità iniziale);
Curva tipo III: peculiare il wash-out, con un decremento del segnale di intensità maggiore del 10% rispetto al picco iniziale a tre- otto minuti. Questa curva è altamente predittiva di malignità se associata ad un wash- in precoce (entro i primi tre minuti).
Vengono valutati cinque parametri fondamentali per l’analisi delle lesioni mammarie e ad essi viene attribuito un punteggio secondo lo score proposto da Fisher:
<50% 0 50%-100% 1 >100% 2 - Intensità di segnale a tre – otto minuti dopo il contrasto: aumento continuo del segnale 0 plateau 1 wash out 2 - Margini della lesione
ben definiti 0 scarsamente definiti 1 - Morfologia della lesione
rotonda, ovalare, globulare 0 lineare, dendritica, stellata 1 -Cinetica del contrasto
enhancement centrifugo omogeneo 0 enhancement centrifugo disomogeneo 1 enhancement centripeto 2
Viene infine totalizzato un punteggio, interpretato secondo una scala lineare , per cui valori di 0-2 sono identificati come benigni (RM 1- 2), 3 come incerti (RM 3), 4-8 come maligni (RM 4- 5), in base al livello crescente di sospetto.
L’enhancement che viene raggiunto in meno di un minuto è definito iper- rapido, e si può presentare in presenza di carcinoma duttale, lobulare e in situ, ma anche di displasia proliferativa e in una bassa percentuale di fibroadenomi.
L’enhancement rapido, in cui il picco è raggiunto in meno di tre minuti, può essere riscontrato in caso di displasia proliferativa di alto grado, in una elevata percentuale di
L’enhancement ritardato si rileva in una bassa percentuale di carcinomi scirrosi, lobulari e in situ, ma anche nelle displasie proliferative di basso e medio grado.
L’enhancement diffuso e ritardato si mostra in ghiandole displastiche di secondo e terzo grado, ma anche in fase follicolare del ciclo ovulatorio.
I processi neoplastici sono accompagnati da un’intensa attività neoangiogenetica, che si caratterizza per l’aumento della vascolarizzazione, per la maggiore permeabilità capillare e per l’ampliamento degli spazi interstiziali. Per questa ragione, in corso di studio dinamico, le lesioni infiltranti sono caratterizzate da intenso e precoce wash- in, espressione dei processi di neoangiogenesi tumorale. Gli shunt artero- venosi e l’incremento della permeabilità endoteliale sono responsabili del successivo rapido wash- out. Mentre la crescita invasiva si associa costantemente alla presenza del contrasto, poiché l’attività neoangiogenetica sembra essere un prerequisito della invasione tissutale, questo non è necessariamente vero nel caso del carcinoma in situ, considerato uno stato pre- invasivo, o dei carcinomi lobulari, caratterizzati da crescita cellulare.
Il pattern wash- out si associa ad una probabilità di lesione maligna nell’ 87% dei casi, mentre un pattern di tipo plateau è visibile sia nelle lesioni maligne che nelle benigne, con un rapporto 3:2. Il pattern di continuo incremento della SI si associa ad una probabilità di lesione maligna del 6%. E’ necessario ricordare che la mammella può presentare enhancement in grado variabile per densità e differente fase mestruale.
L’enhancement benigno (fibroadenomi, malattia fibrocistica, mastiti) e quello delle lesioni ad alto rischio (CLIS, papillomi, radial scar) può presentare caratteristiche sovrapponibili alle lesioni maligne sia morfologicamente che dal punto di vista della cinetica.
5. CONTROINDICAZIONI E CONDIZIONI LIMITANTI L’USO DI RM
L’assenza di radiazioni ionizzanti in RM non permette di escludere un rischio biologico. Non è esclusa infatti l’interazione del campo magnetico e delle radiazioni RF con molecole e strutture organiche, siano esse ferromagnetiche, paramagnetiche o diamagnetiche.
Pericolo reale è rappresentato dalla presenza di oggetti metallici nel campo magnetico, poiché essi verrebbero accelerati a velocità elevate, comportandosi come proiettili. Risultano quindi ovvie le controindicazioni assolute alla RM:
• clips ferromagnetiche vascolari; • pacemaker;
• elettrodi endocorporei;
• alcuni tipi di impianti cocleari;
• protesi stapediali metalliche; filtri vascolari, stent e spirali metalliche; • dispositivi endocorporei ad attivazione magnetica o elettrica;
• protesi del cristallino con anse di titanio o platino;
• corpi estranei ferromagnetici in sede intracranica, endoculare o vascolare (ad esempio, schegge metalliche).
Sono considerate controindicazioni assolute l’ipersensibilità nota ai chelanti del Gadolinio e l’insufficienza renale grave, poiché il MdC è escreto per via renale.
Costituiscono controindicazioni relative, per le quali è necessaria una valutazione rischi/ benefici, ma che non mettono a rischio la vita del paziente:
• gravidanza (soprattutto nel primo trimestre); • clips metalliche non vascolari;
• protesi o dispositivi metallici adiacenti o compresi nella zona di esame non suscettibili di significativi effetti magnetomeccanici o termici, ma che creino artefatti sulle immagini (protesi dentarie fisse o protesi ortopediche) o che impediscano la perfetta immobilità del paziente;
• particelle meccaniche prodotte da strumenti chirurgici; • dispositivi intrauterini ferromagnetici;
• movimenti involontari patologici;
• problemi psichici (ansia, claustrofobia, psicosi);
• impossibilità a mantenere a lungo la posizione clinostatica; • pazienti non collaboranti.
L’indagine deve essere effettuata preferibilmente nella seconda settimana del ciclo mestruale e, nelle donne in menopausa, dopo due o tre mesi dalla sospensione di terapia sostitutiva, poiché le stimolazioni ormonali condizionano il quadro di RM in maniera significativa.
A causa di queste controindicazioni è richiesto un consenso informato scritto all’esame di RM e alla somministrazione di chelanti del Gadolinio. 7
6. VANTAGGI E LIMITI DELL’USO DELLA RM NELLO STUDIO DELLA MAMMELLA
La RM rappresenta uno strumento promettente nella diagnostica senologica, nonostante rimangano irrisolte alcune resistenze ad un suo più esteso impiego.
La specificità è uno dei primi limiti, poiché non sempre è possibile distinguere tra lesioni benigne e maligne, e questo comporta la necessità di biopsie. Inoltre, poiché un nodulo identificato alla RM può non essere chiaramente identificato anche con le tradizionali tecniche di imaging, una biopsia eco- o mammoguidata può risultare piuttosto difficoltosa. A questo proposito, sono stati progettati e introdotti dispositivi stereotassici associati all’uso di bobine di superficie e di aghi amagnetici che possono essere utilizzati nella RM, e che permettono di eseguire biopsie cito- istologiche o centrature pre- operatorie di formazioni identificate con la sola RM. Purtroppo, gli apparecchi forniti di sistemi dedicati sono ancora poco diffusi.
La RM, a differenza della mammografia, non è in grado di mostrare immagini di calcificazioni e di microcalcificazioni, reperto altamente suggestivo di carcinoma mammario, in particolare di quello intraduttale in situ.
La RM richiede inoltre costi maggiori rispetto ai tradizionali esami strumentali, se consideriamo che il costo medio di un’indagine effettuata attraverso RM è di mille dollari, contro i cento della mammografia.
Non indifferente è anche l’investimento in termini di tempo, poiché sono spesso necessari più di trenta minuti, in aggiunta al tempo richiesto per la somministrazione del MdC, contro esami notoriamente più rapidi.
L’esame non è doloroso, ma le pazienti sono costrette in posizione prona, e devono restare immobili per tutta la durata dell’esame, per non creare artefatti che comprometterebbero la qualità dell’esame; lo spazio angusto può causare malessere e claustrofobia nei pazienti predisposti.
Devono essere tenute in considerazione le già citate controindicazioni assolute e relative, e i fattori limitanti i risultati, che ne precludono l’uso in alcune categorie di persone. Infine, la RM stessa non ha ancora la diffusione auspicabile nell’ambito della diagnostica senologica, nonostante la sua continua evoluzione.
Alcuni aspetti aprono comunque ampie prospettive alla RM, e sono appunto rappresentate dalle attuali indicazioni a questa tecnica di immagine.
La RM studia efficacemente soprattutto i seni densi, ed è efficace nella diagnosi di carcinoma; integra le valutazioni obiettive o ottenute con altre indagini strumentali, poiché estremamente sensibile, anche se la scarsa specificità deve essere corretta ricorrendo a tecniche tradizionali.
Consente una valutazione pre-operatoria accurata, attraverso cui è possibile formulare un accurato planning terapeutico, e studia il carcinoma localmente avanzato trattato con chemioterapia neoadiuvante; risulta insostituibile nella valutazione della mammella con protesi.
Non deve essere trascurato infine l’ausilio che la RM offre nello screening delle donne con mutazione del gene BRCA 1 e 2, preservandole dalla esposizione a radiazioni ionizzanti. Infatti, in questo gruppo di pazienti, la mutazione genetica condiziona una alterazione dei geni riparatori con conseguente maggior radiosensibilita’. Inoltre, la giovane età di queste donne inficia le possibilità diagnostiche della mammografia per la particolare densità radiologica delle mammelle, per cui le informazioni così ottenute possono spesso risultare inadeguate.
7. LA CHEMIOTERAPIA NEOADIUVANTE NEL TRATTAMENTO DEL CARCINOMA MAMMARIO
La terapia neoadiuvante è una terapia farmacologia effettuata come primo atto di una serie di interventi terapeutici.
Obiettivo della stessa è la riduzione del volume del tumore, per contenere l’estensione del successivo approccio chirurgico o rendere asportabili “en bloc” lesioni non aggredibili in prima battuta.
L’uso precocissimo della terapia sistemica permetterebbe inoltre il controllo di eventuali micrometastasi, e potrebbe così ridurre il rischio di selezione di cloni farmacoresistenti nella popolazione neoplastica residua dopo la rimozione del tumore primitivo.
Ultimo scopo di questo approccio farmacologico è rappresentato dall’aumento della sopravvivenza. 2
L’assegnazione randomizzata di pazienti con carcinoma mammario passibile di terapia chirurgica alla chemioterapia neoadiuvante ed adiuvante non ha mostrato differenze statisticamente significative nel disease-free survival, nel distant disease free survival e nella sopravvivenza, ma solo una correlazione tra la risposta della neoplasia al trattamento primario e l’outcome. 8
L’uso dei taxani nella terapia primaria non si è ancora affermato nella pratica clinica, ma alcuni risultati suggeriscono un loro possibile impiego in corso di terapia di salvataggio. 9 La risposta alla chemioterapia neoadiuvante non sembra modificare la prognosi, ma correla con essa nel senso che le pazienti responder sono quelle che hanno una prognosi migliore per il maggiore controllo della terapia sia sul tumore primitivo che sulle micrometastasi.
Inoltre,il tumore residuo alla chirurgia è altamente predittivo di recidiva.
In caso di risposta completa, il tasso di sopravvivenza a 5 anni è di 89%, contro il 64% in caso di risposta parziale; se il tumore residuo presenta un diametro inferiore ad 1 cm, il tasso di sopravvivenza risulta essere del 70%, ma se dovesse avere un diametro superiore
ad 1 cm, il tasso scenderebbe al 50%. Esiguo il tasso di sopravvivenza per le pazienti con risposta scarsa o assente alla terapia, essendo pari al 10- 30%. 8
Sono considerati passibili di chemioterapia neoadiuvante i carcinomi mammari classificati come localmente avanzati, intendendo così un gruppo eterogeneo di tumori che corrisponde allo stadio III. In particolare, il trattamento è avviato senza indugio nei tumori in stadio T3 e T4, ma può essere proposto anche in stadio T2, per migliorare l’intervento chirurgico e rendere possibili approcci conservativi. In caso di lesioni simultanee, è considerato dirimente quello con il T più elevato .
Lo schema seguito nel campione di pazienti è rappresentata da una combinazione di farmaci, comprendente fluorouracile, epirubicina e ciclofosfamide (FEC), e somministrati per un numero di 4- 6 cicli fino al raggiungimento di un plateau di risposta.
La terapia primaria consente una diretta verifica del suo effetto mediante l’osservazione del grado del tumore, e il precoce riconoscimento delle pazienti responders permette di prospettare un planning terapeutico corretto, così come l’identificazione delle pazienti refrattarie al trattamento permette di considerare l’uso di schemi cosiddetti di salvataggio o di programmare l’intervento chirurgico in tempi più rapidi. La valutazione però è spesso affidata al solo reperto palpatorio, che mostra i suoi limiti, così come l’ecografia e la mammografia, poiché la fibrosi chemioindotta non viene riconosciuta come tale; questo rischia di inficiare gli sforzi effettuati. Analogo limite dell’imaging tradizionale e’ rappresentato dall’impossibilita’ di differenziare la parte neoplastica necrotica dalla parte attiva, limite che si verifica in misura maggiore soprattutto nelle fasi precoci del trattamento, quando e’ utile selezionare le pazienti responders dalle non responders. Si impone di conseguenza la valutazione di tecniche alternative di indagine, e la RM sembra offrire al momento le maggiori prospettive.
SCOPO
Scopo della tesi è indagare l’efficacia della RM nella valutazione della risposta del carcinoma mammario in stadio III alla chemioterapia neoadiuvante.
MATERIALI E METODI
Sono state valutate retrospettivamente 27 pazienti sottoposte a chemioterapia neoadiuvante per carcinoma mammario di età compresa tra i 33 e i 74 anni, con una età media di 53 anni; una paziente era interessata da due neoplasie sincrone e bilaterali, per cui sono 28 i casi esaminati.
La chemioterapia neoadiuvante è stata eseguita in presenza di neoplasia mammaria in stadio T3 e T4, ma è stata proposta anche in stadio T2 e in presenza di neoplasie multifocali, per migliorare l’approccio chirurgico e permettere interventi maggiormente conservativi.
L’intervento è stato eseguito a distanza di 31,5 giorni in media; il 60% delle pazienti ha subito una mastectomia radicale, la restante percentuale ha invece affrontato una quadrantectomia.
Tutte le pazienti sono state sottoposte ad una valutazione attraverso RM dopo aver ricevuto diagnosi di carcinoma mammario ma prima di iniziare la chemioterapia neoadiuvante; di queste, 17 sono state valutate esclusivamente al IV ciclo, 3 al II e al IV ciclo, 1 al I e al IV, 3 al II e al VI, 2 al IV e al VI; un’unica paziente è stata esaminata al II, IV e VI ciclo di terapia.
Nei controlli post- chemioterapia, la RM veniva effettuata a 2 settimane dalla fine del ciclo mestruale.
Lo schema seguito nel campione di pazienti è rappresentata da una combinazione di farmaci, comprendente fluorouracile (600 mg/ m2), epirubicina (60 mg/ m2) e ciclofosfamide (600 mg/ m2) e somministrati per un numero di 4- 6 cicli fino al raggiungimento di un plateau di risposta.
RM
Tutte le pazienti sono state esaminate mediante un apparecchio Symphony, Siemens (Erlangen, Germany ), da 1,5 T; la paziente è stata posizionata prona con le mammelle alloggiate in apposite bobine dedicate multicanale, dove sono posti appositi spessori di
materiale inerte per ridurre gli artefatti da movimento e quelli dovuti al contatto cute/ bobine.
Sono state eseguite sequenze 3D SPGR con soppressione del grasso con i seguenti parametri: • TR 8,9 ms • TE 4,2 ms • Flip angle 20° • Spessore di strato 2,6 mm • Interslice gap 0 mm • Matrice 256 x 256
• Risoluzione spaziale tra 60 e 90 s, in accordo con il volume della mammella e con il FOV.
Allo studio morfologico è seguito uno studio dinamico: dopo la prima sequenza di base sono state eseguite altre cinque sequenze subito dopo la somministrazione endovenosa del mezzo di contrasto (indicata come momento 0), dopo 2, 4, 6, 8 minuti per valutare dinamicamente l’andamento dell’enhancement.
Il mezzo di contrasto paramagnetico è stato iniettato in bolo alla dose di 0,1 mmol/ kg di peso corporeo e alla velocità di 2 ml/ sec, mediante iniettore automatico.
Le immagini precontrastografiche sono state sottratte dalle corrispondenti immagini postcontrastografiche sfruttando il software con funzione di sottrazione disponibile sulla console standard Siemens.
L’acquisizione è avvenuta utilizzando il piano coronale che consente di effettuare una corretta analisi spaziale poiché vengono comprese nel campo di vista anche le regioni ascellari e parasternali posteriori, difficilmente valutabili attraverso la mammografia, e vengono ridotti gli artefatti da movimento respiratorio e cardiaco.
• Sottrazione: si sottrae l’immagine basale (maschera) dalle immagini acquisite dopo iniezione di mezzo di contrasto, per agevolare l’identificazione della lesione, escludendo o dimostrando la presenza di enhancement.
• Ricostruzione MIP (Maximum Intensity Projection): consente l’elaborazione di una immagine 3D della mammella, mettendo in evidenza solamente i pixel che hanno la massima intensità di segnale. E’ inoltre possibile ruotare le ricostruzioni su diversi piani per apprezzare in maniera ottimale le dimensioni e la sede delle lesioni e per valutare la vascolarizzazione.
• Ricostruzione MPR (Multiplanar Reconstruction): permette la rappresentazione della neoplasia nei diversi piani dello spazio (coronale, sagittale, trasversale), ottenendo una ottimale raffigurazione spaziale.
• Selezione delle ROI (Region of Interest): un’area di 4 pixel di dimensione è scelta dalle immagini precedentemente sottratte. Valutando l’intensità di segnale della regione nelle sei immagini (basale e cinque di contrasto), si elabora la curva di intensità segnale/ tempo, che esprime l’intensità e la velocità dell’enhancement.
I dati così ottenuti e riguardanti il wash in, il wash out, la forma, i bordi e l’enhancement pattern sono rielaborati sulla base dello score di Fisher, che attribuisce un valore da 0 a 2 ad ogni singola voce.
Viene infine totalizzato un punteggio, interpretato secondo una scala lineare, per cui valori di 0- 2 sono identificati come benigni (RM 1- 2), 3 come incerti (RM 3), 4- 8 come maligni (RM 4- 5), in base al livello crescente di sospetto.
La neoformazione, indagata prima dell’inizio della terapia, e la lesione residua saranno valutate mediante la modificazione dei parametri morfologici e dinamici, che verranno in seguito estesamente trattati.
Il mezzo di contrasto utilizzato è il Gadolinio DTPA, ione paramagnetico che possiede sette elettroni spaiati e ha quindi un momento magnetico elettronico elevato, riuscendo così a modificare i tempi di rilassamento dei nuclei di idrogeno. È escreto rapidamente per via urinaria, non si accumula negli organi bersaglio e non oltrepassa le membrane cellulari. L’incidenza di effetti collaterali (cefalea, nausea, vomito, tachicardia) è stimata intorno all’1,5%.
Il Gadolinio è stato somministrato per via endovenosa in bolo alla dose di 0,1 mmol/ kg di peso corporeo e alla velocità di 2 ml/ sec, mediante iniettore automatico.
Il dato anatomopatologico è stato considerato gold standard nella misurazione della lesione residua.
RISULTATI
I dati ricavati dallo studio delle lesioni neoplastiche sono stati analizzati non tenendo conto del numero di cicli di chemioterapia effettuati dalla paziente.
Non essendo disponibili le misure delle tre dimensioni dal risultato anatomopatologico, ma solo la lunghezza del diametro maggiore, è stata obbligata la scelta del diametro maggiore anche nello studio di RM. Il diametro medio misurato mediante RM prima dell’inizio della terapia è stato di 6,1 cm, in un range di 2,5 -10 cm. Al termine del trattamento, il diametro medio riscontrato era 2,3 cm, in un range da 0 a 6,3 cm.
Il diametro medio misurato all’anatomia patologica è stato 1,7 cm, in un range da 0 a 6,5 cm.
Sono state classificate come responders le pazienti in cui la riduzione del diametro maggiore, misurato mediante esame di RM prima dell’inizio della terapia e al termine dell’ultimo ciclo studiato, sia stato superiore o uguale al 30%; è infatti riportato che la riduzione della maggiore dimensione di oltre il 30% corrisponda ad una riduzione del volume superiore al 65%. 11
La regressione della lesione superiore al 90%, calcolata mediante misurazione istologica, è stata considerata come risposta patologica completa; in totale, 9 pazienti hanno avuto una risposta patologica completa, ma solo in 2 casi la RM è stata in grado di classificarla come tale.
Le pazienti coinvolte sono 27, ma 28 le lesioni valutate, poiché una donna era colpita da neoplasie sincrone bilaterali; l’analisi degli esami di RM ha mostrato come 24 pazienti abbiano risposto al trattamento, mentre 4 abbiano avuto una riduzione inferiore al 30%. È interessante notare che la neoplasia della mammella destra della paziente precedentemente ricordata ha subito una riduzione del diametro maggiore del 16%, mentre a sinistra la diminuzione è stata del 75% (tab. 1).
Tab. 1
RM CASI
Responder 24
Non responder 4
Tabella 1: valutazione della risposta alla chemioterapia neoadiuvante effettuata mediante esame di RM.
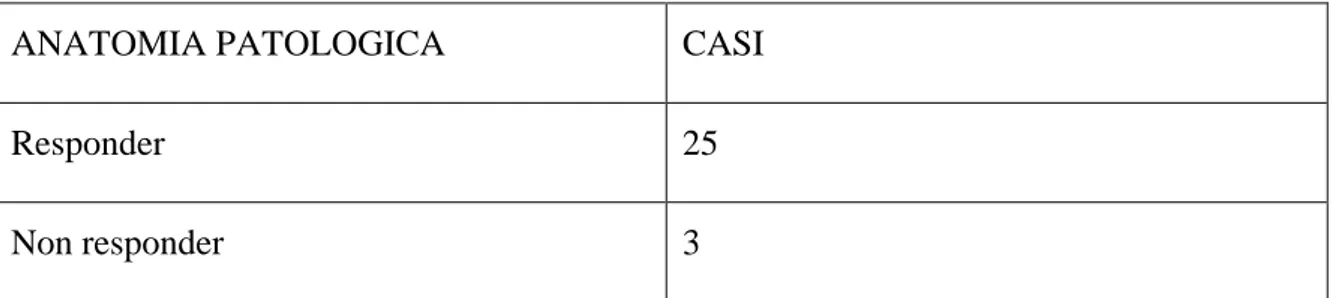
Il gold standard nello studio della risposta alla chemioterapia neoadiuvante è rappresentato dall’anatomia patologica; la valutazione del dato istologico ha indicato che 25 lesioni hanno risposto alla terapia (tab. 2).
Tab. 2
ANATOMIA PATOLOGICA CASI
Responder 25
Non responder 3
Tabella 2: valutazione della risposta alla chemioterapia neoadiuvante effettuata mediante studio istologico.
Confrontando il dato elaborato mediante lo studio di RM con quello ottenuto attraverso la misurazione del pezzo operatorio, si ricava che in 23 pazienti la RM correlava con l’anatomia patologica (21 responders e 2 non responders). In 4 pazienti, la RM non correlava con l’anatomia patologica in quanto segnalava la non responsività, poi dimostrata all’esame istologico, mentre una paziente risultata responder aveva invece subito una riduzione inferiore al 30% ( tab. 3).
Tab. 3
Responder (dato istologico) Non responder (dato istologico)
Responder (dato RM) 21 1
Non responder (dato RM) 4 2
Tabella 3: confronto tra RM e anatomia patologica nella valutazione della risposta alla chemioterapia neoadiuvante nelle pazienti del gruppo 3.
Ai fini di una valutazione statistica, vengono considerati veri positivi (VP) le pazienti risultate responders alla RM e all’istologia, veri negativi(VN) le pazienti risultate non responders alla RM e all’istologia, falsi positivi (FP) le pazienti risultate responders alla RM e non responders all’istologia, e falsi negativi (FN) le pazienti risultate non responders alla RM e responders all’istologia.
Di conseguenza, si desume che siano 21 le pazienti vere positive, 4 le pazienti false negative, 2 vere negative e 1 falsa positiva (tab. 3).
Abbiamo calcolato sensibilità, specificità, valore predittivo positivo (VPP), valore predittivo negativo (VPN), test bias nelle pazienti con i seguenti valori:
SENSIBILITA’ della RM = VP/(VP + FN) = 18/(18+3) = 84% SPECIFICITA’ della RM = VN/(VN + FP) = 1/(1+0) = 67% VPN della RM = VN/(VN + FN) = 1/( 1+3) =33%
VPP della RM = VP/(VP + FP) = 18/18 = 95%
TEST BIAS = (VP + FP)/(VP + FN) = 18/(18 +3) = 0,88
La correlazione è il metodo appropriato per descrivere la relazione esistente tra due variabili mutuamente dipendenti, in questo caso tra il valore del diametro maggiore della lesione misurato mediante RM e il gold standard, rappresentato dal dato misurato in anatomia patologica.
Il coefficiente di correlazione r ha mostrato un valore di 0,15, che dimostrerebbe l’assenza di associazione, come mostrato nel grafico 1; non è stato possibile inserire nella valutazione una paziente che all’esame istopatologico ha mostrato diffusa linfangiosi da carcinoma, dato sufficiente a farla considerare non responder, ma il cui diametro non è stato segnalato dall’anatomopatologo. In particolare, la RM ha nettamente sovrastimato il diametro di una lesione in una paziente che ha poi mostrato alla valutazione anatomopatologica un fibroadenoma immediatamente adiacente alla lesione neoplastica.
0 1 2 3 4 5 6 0 1 2 3 4 5 6 misura anatomopatologica m is u ra m ed ia n te R M
Grafico 1: misurazioni del diametro maggiore delle lesioni residue, effettuate mediante RM e sul pezzo istologico.
CASO 1
Pre-CT
Post-CT
Figura 1 a- b .
MIP coronale pre (1 a) e post (1 b) chemioterapia. In 1 a, grossolana area di enhancement disomogeneo della regione retroareolare sinistra. BI-RADS 6.
Dopo 4 cicli, si osserva una risposta pari al 90% (1 b).
CASO 2.
Figura 2 a. MIP sagittale.
Figura 2b.
Figura 2 c.
Immagine sottratta in coronale. Grossolana area di enhancement disomogeneo in regione retroareolare sinistra con micronodularità riferibile a multifocalità (BI-RADS 6).
Figura 2 d.
Figura 2 e .
MIP assiale post- chemioterapia. Regressione totale.
CASO 3.
Figure 3 a e 3b.
MPR in assiale e in sagittale: grossolana lesione plurifocale in quadrante superoesterno della mammella in esame (BI- RADS 6).
Figure 3 c e 3 d.
CASO 4.
Figura 4 a .
Immagine T1 postcontrastografica. Lesione di aspetto infiltrativo interessante a cuneo la porzione centrale della mammella . Figura 4 b. Immagine sottratta. Figura 4 c. MIP in assiale. Figura 4 d.
Curva tipo II gravata da
Figura 4 e .
Immagine T1 post- contrastografica. Dopo 4 cicli, regressione superiore al 50%. Figura 4 f. Immagine sottratta. Figura 4 g. MIP in assiale. Figura 4 h.
Variazione della curva (tipo I).
Figura 4 i .
Immagine T1 post- contrastografica. Al termine del IV ciclo, non ulteriori variazioni.
Figura 4 l. Immagine sottratta. Figura 4 m. MIP in assiale. Figura 4 n. Curva di tipo I.
CASO 5.
Figura 5 a.
T1 dopo contrasto. Voluminoso processo espansivo necrotico con enhancement
disomogeneo, pattern 2. . Figura 5 b . Immagine sottratta. Figura 5 c.
Curva di tipo II, legata alla contaminazione da parte della necrosi.
Figura 5 d.
Immagine T1 post- contrastografica. Dopo 2 cicli di chemioterapia,riduzione della lesione e della necrosi, quantificabile in circa il 50%. Figura 5 e Immagine sottratta. Figura 5 f.
Figura 5 g.
Immagine T 1 post- contrastografica. Al termine del VI ciclo, regressione pari al 90%.
.
Figura 5 h . Curva di tipo III.
CASO 6.
Figura 6 a. MPR basale: enhancement multinodulari di tutti i quadranti esterni della
mammella sinistra, da retroareolare ad area 3 (BI-RADS 6).
Figura 6 b. MIP in assiale: al II ciclo, riduzione delle lesioni satellite ma non
DISCUSSIONE
Molti studi hanno ormai validato l’uso della RM nella valutazione dell’estensione del carcinoma mammario non trattato, ma la sua accuratezza nel descrivere la malattia residua dopo chemioterapia neoadiuvante è tuttora discussa.
Le implicazioni derivanti dalla precisa conoscenza della risposta alla chemioterapia primaria e dalla valutazione delle dimensioni della neoplasia prima dell’intervento avrebbero un significativo impatto nella gestione delle risorse umane ed economiche. Infatti, la misurazione della lesione residua prima del trattamento chirurgico permetterebbe di ottimizzare l’approccio chirurgico, di aumentare le chances di garantire margini negativi, di minimizzare la morbidità e raggiungere un risultato esteticamente migliore, evitando la mastectomia 12 ed assicurando un livello accettabile di recidiva locale. 13
La pianificazione dell’intervento non può prescindere da un’accurata valutazione ottenuta mediante imaging, essendo la palpazione fortemente dipendente dall’esperienza clinica, dal volume del seno, dal tipo e dalle dimensioni della lesione, dalla fibrosi chemioindotta. Ecografia e mammografia hanno dimostrato diverse problematiche nella valutazione della lesione residua; un limite comune ad entrambe è rappresentato dalla presenza di fibrosi chemioindotta e di necrosi tumorale, che possono comportare sovrastima, poiché difficilmente differenziabili da tessuto neoplastico ancora attivo. Inoltre, lo studio mediante ecografia è ulteriormente gravato dalla dipendenza dall’operatore, che deve avere esperienza sufficiente a gestire situazioni complesse di questo tipo, ma anche dal ridotto campo di vista, che rende difficilmente quantificabile o riproducibile la metodica, soprattutto nei casi di multifocalità e multicentricità.
Studi recenti condotti a questo proposito hanno mostrato come il coefficiente di correlazione tra MRI e il dato anatomopatologico vari tra 0,48 e 0,93 14, 15, 16, 17, 18, 19, 20, 21, sottolineando come le risposte complete alla RM correlino con l’istologia nel 100% dei casi. 20, 22
Tuttavia, Rieber et Al. hanno riportato il 33% di falsi negativi, attribuendo il risultato all’importante riduzione dell’enhancement dopo il trattamento. Recentemente, lo stesso Rieber ha concluso che la RM, sebbene sia un ottimo metodo qualitativo per valutare la
risposta alla terapia, non sia però affidabile nel determinare le dimensioni del tumore residuo, mostrando la tendenza a sottostimare, soprattutto in quei casi dove la risposta alla terapia è stata elevata. 23, 24 Questi dati risultano essere in accordo con altri studi inerenti 18, 19, 20, 25, 26, 27
, nonostante Partridge e Kwong abbiano riportato che la RM tenda piuttosto a sovrastimare il tumore residuo. 16, 28
Nello studio del tumore residuo, i parametri comunemente utilizzati nella valutazione della chemiosensibilità sono i seguenti:
• Dimensioni
• Enhancement pattern • Time intensity curve shape • Early contrast uptake.
Lo studio delle dimensioni della lesione può essere effettuato mediante la stima del volume, ma anche attraverso la misurazione del diametro maggiore, o il prodotto dei diametri, o la misurazione dell’area.
Il volume rappresenta il parametro più affidabile nella valutazione della lesione neoplastica residua, essendo caratterizzata da un’accuratezza diagnostica superiore all’ 84%. 11, 15
Il calcolo del volume è eseguito mediante il programma Volume Analysis, che lo effettua sulla base dell’area coinvolta nelle immagini sottratte, e che rende possibile il riconoscimento di aree di necrosi.
La misurazione dei diametri, e ancora di più il calcolo del volume, possono risultare difficoltose a causa dei contorni mal definiti, dell’aspetto infiltrativo, della morfologia irregolare e della eventuale presenza di multifocalità; in maniera analoga, possono insorgere problemi di misurazione del tumore residuo, per la frammentazione della lesione.
Le variazioni di volume della lesione hanno un valore predittivo maggiore rispetto alle variazioni di diametro; Martincich riporta che una riduzione del volume superiore al 65% corrisponde ad una riduzione del prodotto dei diametri del 50%, e ad una riduzione del diametro maggiore del 30%. Di conseguenza, alcuni autori si affidano alla misurazione
risposta alla chemioterapia; il diametro maggiore sul piano coronale appare maggiormente concordante con la misura istologica.
Appare dunque sufficiente una corretta misurazione dei tre diametri e, sulla base della percentuale di riduzione, calcolare la risposta. In caso di plurifocalità, sarà la misurazione di ogni singola lesione o dell’area coinvolta a valutare la percentuale di riduzione.
La valutazione della lesione effettuata prendendo in considerazione il volume e il pattern enhancement ha dimostrato un’accuratezza diagnostica nella determinazione della risposta pari al 93% .11
Sia Fisher che Martincich individuano due tipologie di pattern nella determinazione dello score e quindi del BI-RADS: un pattern omogeneo, ed uno periferico, detto anche “ring- like”, caratterizzato dalla presenza di necrosi intralesionale. 29
Nella gestione delle pazienti sottoposte a chemioterapia neoadiuvante, oltre al dato morfologico studiato con i criteri precedentemente esposti, risultano essere importanti anche i dati funzionali legati al pattern di enhancement omogeneo o disomogeneo, nel senso che il viraggio dal pattern di tipo 2 al pattern di tipo 1 rappresenta un criterio suggestivo di risposta alla chemioterapia neoadiuvante.
Esserman classifica in maniera più dettagliata l’enhancement pattern e distingue di conseguenza cinque gruppi:
1. massa circoscritta con enhancement periferico; 2. nodulare con bordi irregolari;
3. infiltrazione tissutale diffusa senza massa;
4. enhancement disomogeneo e presenza di masse con enhancement; 5. diffusione tissutale ed ispessimento cutaneo.
L’autrice aggiunge che il parametro maggiormente attendibile nella valutazione della risposta sia il diametro maggiore e che, per quanto riguarda la prognosi e quindi la risposta alla chemioterapia primaria, il primo pattern, nodulare con anello periferico, sia quello che meglio risponde e in cui l’intervento conservativo garantisce risultati migliori. Analizza, oltre al diametro maggiore, anche gli altri parametri, e nota che nel pattern 3 non si verifica una diminuzione del diametro ma una variazione dei parametri funzionali, ai quali non sa attribuire un preciso significato. 10, 30
Time intensity curve shape correla con la neoangiogenesi, ma è un parametro scarsamente riproducibile nella valutazione della risposta alla terapia primaria. 11 Altro parametro funzionale volto a valutare la clearance del MdC nella lesione tumorale è la morfologia della curva, poiché un viraggio dalla curva 3 alla 2, o addirittura alla 1, è certamente criterio indicativo di risposta al trattamento, ma al momento non è possibile assegnarvi un preciso significato, non essendo possibile esprimere una quantizzazione.
Early contrast uptake (ECU) è un ulteriore parametro funzionale, calcolato attraverso la seguente equazione:
ECU = ( SI max – SI bas) / SI bas .
La determinazione della percentuale di incremento del segnale e la sua diminuzione rappresentano un criterio di valutazione: durante il trattamento, infatti, si assiste spesso ad una diminuzione della percentuale di incremento del segnale. In letteratura risulta che la riduzione dell’ECU sia maggiore nelle forme con pattern 1 rispetto a quelle con pattern 2; i valori dipendono dalla neovascolarizzazione tumorale, di conseguenza una loro diminuzione correla con i fenomeni regressivi dovuti all’effetto citotossico della chemioterapia.
L’uso combinato di volume ed ECU nella valutazione della risposta alla terapia raggiunge un’accuratezza diagnostica del 91%; il dato può esser falsato in caso di carcinoma infiammatorio, che potrebbe risultare falso positivo. 11
Rimane il dubbio riguardante i parametri che dovrebbero essere presi in considerazione nella valutazione della risposta alla terapia, poiché finora l’unico valore che possieda un riscontro è rappresentato dalle dimensioni, grazie alla correlazione calcolata tra il dato ottenuto alla RM e quello misurato nello studio anatomopatologico, e che ha un’accuratezza diagnostica dell’84%, prendendo in considerazione il volume. 11, 15
Prendendo in considerazione le dimensioni, è necessario quindi quantificare la risposta alla chemioterapia; a questo proposito, le proposte avanzate sono differenti.
Montemurro distingue infatti una risposta completa, in cui c’è la scomparsa totale di ogni evidenza di malattia, da una parziale, in cui la riduzione è superiore al 50%; la malattia è considerata stabile se la riduzione è inferiore o uguale al 25 – 50%, mentre risulta essere in progressione per un incremento superiore al 25%. 31
Yung- Chung Cheung invece considera una riduzione volumetrica tumorale inferiore al 30% come una risposta scarsa o assente, o come una progressione; tra il 30% e il 50% la riduzione è ritenuta media, e buona se superiore al 50%. L’autore aggiunge che possono essere considerate responders le pazienti che, al termine del II ciclo, abbiano avuto un decremento superiore o uguale al 30% del diametro massimo di ogni singola lesione. 32 Risulta poi complessa l’attribuzione di un significato preciso alle modificazioni dei parametri funzionali, sia per quanto concerne le variazioni nella morfologia della curva, che il viraggio nel pattern enhancement e i cambiamenti nell’ECU, nonostante i tumori con risposta migliore tendano a variare la loro composizione interna da un pattern di distribuzione eterogeneo ad uno omogeneo, e a mostrare una diminuzione nel picco di enhancement. 33, 34
Si può assistere infatti ad una trasformazione nella morfologia della curva, con un passaggio da una curva di tipo III ad una curva di tipo II o I; una curva di tipo II può virare verso una di tipo III o regredire in una curva di tipo I. L’andamento della curva potrebbe anche non subire alterazioni, e rimanere stabile come tipo II o tipo III.
Il pattern enhancement può presentarsi inizialmente come omogeneo o disomogeneo, e subire dopo il trattamento delle modificazioni in un senso o nell’altro, ma potrebbe anche permanere stabile.
Early contrast uptake può presentare al terzo minuto un incremento percentuale inferiore al 50%, tra il 50% e il 100%, o superiore al 100%; le successive valutazioni potrebbero registrare una modificazione della percentuale nel senso di un aumento o di una regressione, ma potrebbero indicare anche la stabilità dell’ECU.
Al momento non è quindi possibile assegnare un valore alle mutazioni dei parametri funzionali; a prescindere dalle variazioni dimensionali, infatti, risulta ostica l’assegnazione di significato alla variazione di morfologia della curva, piuttosto che del pattern enhancement o dell’ECU, dal punto di vista della risposta e, di conseguenza, della prognosi. Questi parametri infatti sono difficilmente quantificabili e riproducibili, e attualmente non è possibile effettuare una correlazione con il dato anatomopatologico, nonostante l’esistenza di studi istologici riguardanti l’angiogenesi. 35, 36
Limitandoci all’analisi dei valori unidimensionali ottenuti mediante immagini di RM e alla loro correlazione con il reperto anatomopatologico, si ricava che la sensibilità della tecnica nello studio delle lesioni residue indagate al termine dei cicli di chemioterapia
neoadiuvante sia pari all’84%, mentre la specificità risulta essere del 67%, dati affiancati da un valore predittivo negativo del 33% ed un valore predittivo positivo del 95%. Il test bias di 0,88 indica una sottostima del fenomeno.
Si segnala un caso problematico e di difficile interpretazione, rappresentato da una paziente risultata negativa all’esame di RM, effettuato al termine del VI ciclo, ma che ha mostrato una linfangiosi diffusa all’esame istopatologico, effettuato al seguito di una quadrantectomia, senza che l’anatomopatologo abbia specificato l’estensione del reperto o di eventuale massa residua. Eliminando questo esempio dal novero delle pazienti, la specificità sale dal 67% al 100% , rimanendo invariata la sensibilità.
Le conclusioni ottenute risultano così compatibili con quanto descritto dalla letteratura, che segnala valori di sensibilità dal 61% al 90%, e di specificità dal 58% al 100% 37, 38, 39, aggiungendo che il nostro studio indica una tendenza del test a sottostimare sensibilità e specificità calcolate.
Il coefficiente di correlazione r, risultato pari a 0,15, risulta invece inferiore rispetto ai dati riportati in letteratura.
L’interesse nella valutazione della risposta delle neoplasie alla chemioterapia neoadiuvante risale già al 1970, quando una serie di criteri furono sintetizzati nei parametri RECIST; tali criteri comprendono la misurazione del diametro maggiore della lesione principale e delle lesioni non target prima e dopo la terapia, purché la prima determinazione non sia precedente alle quattro settimane dall’inizio della terapia stessa. Possono essere sfruttate tutte le metodiche di imaging comunemente usate per lo studio di ogni patologia. 40
Sono invece recenti i parametri FISHER, che compendiano alcuni criteri utilizzati per classificare secondo il BI – RADS le lesioni mammarie con enhancement. I criteri di Fisher comprendono infatti i parametri utilizzati per classificare le lesioni mammarie secondo un livello di sospetto radiologico espresso dal BI – RADS, e comprendono cinque parametri precedentemente esposti, rappresentati da wash in, wash out, forma, bordi e pattern enhancement. 41
La nostra proposta è dunque di sintetizzare i criteri sopra esposti in un unico quadro, che comprenda lo studio della lesione neoplastica prima dell’inizio del trattamento, ed in