1
Indice
Parte I. Introduzione ... 3
Parte II. Razionale e obiettivi dello studio... 26
Parte III. Pazienti, materiali e metodi ... 28
Parte IV. Risultati ... 37
Parte V. Discussione e conclusioni... 50
2
ELENCO DELLE ABBREVIAZIONI
AC Adenilato ciclasi
ADRB1 Recettore beta-1 adrenergico
AMPc Adenosinmonofosfato ciclico
Ca2+ Ione calcio
DAG Diacilglicerolo
FISH Ibridazione in sito fluorescente
GPCR G-protein coupled receptor, recettore accoppiato a proteine G
IP3 Fosfatidilinositolo trifosfato
RFLP Polimorfismi identificati mediante digestione di prodotti di PCR con enzimi di restrizione (restriction fragment lenght polymorphisms)
3
Parte I. Introduzione
Capitolo 1. Il sistema simpatico adrenergico
In questa sezione verrà esaminato principalmente la componente simpatica del sistema nervoso autonomo, ed il suo relativo sistema recettoriale, in quanto maggiormente coinvolto in condizioni patologiche quali l’ipertensione.
La sezione autonoma del sistema nervoso efferente è così chiamata perché in genere le sue funzioni non sono sotto il controllo della volontà. È nota anche come sistema nervoso vegetativo o viscerale, poiché controlla gli organi interni e le funzioni viscerali o della vita vegetativa.
Il sistema nervoso autonomo è suddiviso in simpatico e parasimpatico: entrambi mediano rispettivamente effetti eccitatori ed inibitori sugli organi bersaglio che andranno ad innervare, ed interagendo con il sistema endocrino contribuiscono al mantenimento dell’omeostasi corporea. Tutte le vie del sistema nervoso autonomo, sia simpatiche che parasimpatiche, sono costituite da due neuroni disposti in serie: il primo è definito neurone pregangliare, origina nel sistema nervoso centrale e proietta ad un ganglio autonomo situato all’esterno di esso. Qui il neurone pregangliare effettua sinapsi con il secondo neurone della via, il neurone postgangliare, che ha il corpo cellulare nel ganglio e proietta il suo assone verso il tessuto bersaglio.
La maggior parte delle vie simpatiche origina a livello della regione toracica e lombare del midollo spinale; i gangli simpatici sono situati in due catene che decorrono parallelamente ai lati della colonna vertebrale.
4
Dal punto di vista chimico, i neuroni autonomi pregangliari del sistema simpatico secernono acetilcolina sui recettori nicotinici localizzati sui neuroni postgangliari, e quest’ultimi rilasciano noradrenalina sui recettori adrenergici delle cellule bersaglio. Anche la parte più interna delle ghiandole surrenali, la midollare del surrene, è adibita alla secrezione dell’adrenalina, che è una catecolamina endogena simile alla noradrenalina.
I recettori adrenergici legano sia l’adrenalina che la noradrenalina e possono essere di due tipi:
Recettori α. Sono i recettori più diffusi nel sistema nervoso simpatico e
rispondono intensamente alla noradrenalina e solo debolmente all’adrenalina.
Recettori β. Comprendono tre sottotipi recettoriali che differiscono per la
diversa sensibilità alle catecolamine. I recettori β1 rispondono con uguale intensità sia alla noradrenalina che all’adrenalina, mentre i β2 sono più sensibili all’adrenalina e non sono innervati come i come i β1. I recettori β3 si trovano principalmente nel tessuto adiposo, sono innervati e sono più sensibili alla noradrenalina.
Tutti i recettori adrenergici sono accoppiati a proteine G (GPCR). Quando le catecolamine si legano ai recettori α attivano la fosfolipasi C e provocano la produzione di inositolo trifosfato (IP3) e diacilglicerolo (DAG); l’interazione delle
catecolamine con i recettori β determina invece la produzione di adenosi monofosfato ciclico (cAMP) che attiva la fosforilazione di proteine intracellulari.
La risposta fisiologica delle cellule bersaglio dipende poi dalla via specificamente attivata: l’attivazione dei recettori β1 potenzia la contrazione cardiaca, mentre l’attivazione dei recettori β2 determina il rilascio della muscolatura liscia di molti tessuti fra i quali quello respiratorio.
5
I principali effetti determinati dall’attività simpatica a livello cardiaco sono quindi:
1. aumento della forza di contrazione (effetto inotropo positivo);
2. aumento della frequenza cardiaca per stimolazione del nodo seno-atriale (effetto cronotropo positivo);
3. aumento della velocità di conduzione nel nodo atrio-ventricolare (effetto dromotropo positivo);
4. aumentata velocità di raggiungimento della soglia di depolarizzazione (effetto batmotropo positivo);
5. ridotta efficienza cardiaca (il consumo di O2 aumenta più del lavoro
cardiaco).
Tutti questi effetti derivano dall’attivazione dei recettori β1. Gli effetti delle catecolamine sui recettori β1 cardiaci, sebbene complessi, sono tutti dovuti probabilmente all’aumento della concentrazione cellulare di cAMP. Quest’ultimo attiva la protein chinasi A che a sua volta fosforila le subunità α1 dei canali del calcio.
Questa modificazione aumenta la probabilità di apertura del canale in risposta ad una depolarizzazione e causa un marcato aumento della corrente di Ca2+ verso l’interno e quindi della forza di contrazione dei miocardiociti (Silverthon D.U., 2007).
6
1.2 I recettori beta-adrenergici
1.2.1 Funzioni e classificazione
Il tessuto miocardico è dotato di almeno nove recettori adrenergici, di cui tre α1,
tre α2, e tre β adrenergici (β1, β2, e β3). Questi ultimi fanno parte della grande
famiglia dei GPCR: tra i recettori adrenergici cardiaci, il β1 è il predominante in
quanto comprende circa il 75-80% del totale dei recettori β. In contrasto, vi è solo un numero ridotto di recettori α con un rapporto β/α di 10:1 (Condorelli e Condorelli; 2006).
I recettori β adrenergici, e in particolare i recettori β1 sono importanti mediatori del sistema simpatico adrenergico e regolano numerosi meccanismi fisiologici tra i quali frequenza e contrattilità cardiaca, lipolisi e rilascio di renina (Podlowski et al, 2000).
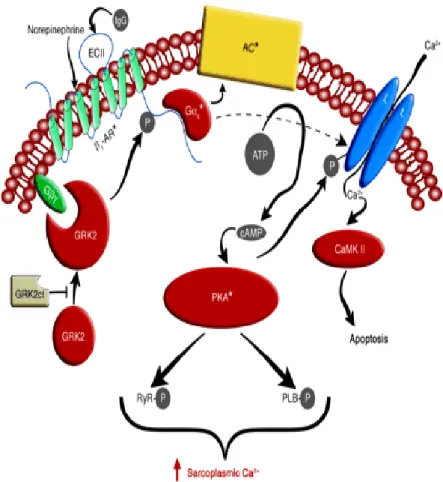
I GPCR β-1 adrenergici (Fig.1) sono espressi principalmente a livello cardiaco e giocano un ruolo importante nella regolazione della contrattilità e del rilascio dei miocardiociti. Hanno la classica conformazione a 7 domini transmembranari; sono classificati sulla base della loro risposta verso agonisti simpaticomimetici e sono attivati dal legame con il loro agonista in una specifica sequenza amminoacidica che permettere un cambiamento conformazionale nella parte intracitoplasmatica del recettore, ovvero nel dominio che lega la proteina G. Il suddetto complesso proteico si distacca dalla sua regione intracitoplasmatica e si va a legare a molecole effettrici di membrana situate in stretta prossimità, come l’AC, le quali attiveranno una via di segnalazione determinante la risposta specifica a livello tissutale (Hausdorf et al, 1990; Hamm, 1998).
7
Fig. 1. Schema relativo al meccanismo di trasduzione del segnale da parte di recettori β-adrenergici previo legame della noradrenalina (norepinefrina, NA). Abbreviazioni: IgG, immunoglobulineG; ECII,enzima transferasi; Ga, proteina G (G sta per nucleotide guanilico); AC, adenilato ciclasi; ATP, adenosina trifosfato; cAMP adenina monofosfato ciclica; PKA, proteina chinasi A; RyR, recettori della rianodina; PLB; fosfolipasi B; GRK2, chinasi dei recettori accoppiati alle proteine G; CaMK, proteina chinasi dipendente da calmodulina.
Anche se l’attivazione di tali recettori è alla base di risposte fisiologiche, una stimolazione cronica gioca un ruolo importante nello sviluppo e nella progressione di patologie cardiovascolari. Infatti, gli effetti deleteri di una stimolazione cronica del sistema adrenergico possono condurre ad alterazioni nella responsività dei tessuti alle catecolamine, determinando un’effettiva perdita di recettori a causa di una desensitizzazione recettoriale (Bristow et al, 1992). Un esempio di tale fenomeno è dato dall’esposizione di agonisti β-2 adrenergici, che dopo pochi minuti determinano la fosforilazione di tali recettori interferendo con l’accoppiamento dei recettori alle
8
proteine G. In aggiunta, esposizioni più prolungate ad agonisti adrenergici determinano la loro internalizzazione e ridotta sintesi dei recettori, fenomeno conosciuto come “down regulation”.
I recettori β-1 sono stati clonati per la prima volta in librerie a cDNA ottenute da placenta umana, ed il relativo gene è stato localizzato sul cromosoma 10 (10q24-q26) tramite l’utilizzo di tecniche citogenetiche come la FISH (Frielle et al, 1987; Hoehe et al, 1989); la successiva costruzione di recettori chimerici β-1/β-2 o la mutazione di singoli residui amminoacidici dei recettori β-1 ha portato verso una comprensione più dettagliata del ruolo di alcuni domini funzionali di tali proteine di membrana. È stato osservato infatti che il terzo dominio ad ansa intracellulare, che comprende una regione ricca in prolina di circa 24 amminoacidi, è responsabile di un inefficiente accoppiamento del recettore con la proteina G specifica (Green e Liggett, 1994).
1.2.2 Significato funzionale dei polimorfismi genetici
Il DNA del genoma umano, così come quello dei genomi di tutti gli organismi, è soggetto a una varietà di cambiamenti ereditabili.
Le variazioni del DNA possono avvenire a diversi livelli. Occasionalmente si verificano cambiamenti quali duplicazioni, inserzioni, delezioni e trasposizioni di segmenti di DNA lunghi varie chilobasi ed anche megabasi, solo alcune delle quali sono associati a malattie. Tuttavia, i cambiamenti più frequenti nella sequenza del DNA coinvolgono sostituzioni, inserzioni e delezioni di pochi o singoli nucleotidi, che solitamente non sono associati a malattie a meno che non alterino una sequenza codificante o un’importante sequenza di regolazione.
9
Una variazione del DNA viene detta polimorfismo se è sufficientemente frequente (maggiore dell’1%) in una popolazione e non può essere spiegata in termini di mutazioni ricorrenti. Nei primi anni ’80, i polimorfismi del DNA hanno fornito per la prima volta un gruppo di marcatori sufficientemente numerosi e spaziati lungo tutto il genoma.
Attualmente i c.d. SNPs, ovvero polimorfismi a singolo nucleotide, sono i marcatori molecolari più utilizzati, perché il grande vantaggio nell’utilizzarli è dato dall’elevato numero di polimorfismi che può essere analizzato e dall’elevata densità lungo tutto il genoma. Costituiscono circa il 90% di tutti i polimorfismi presenti nel genoma umano. A giugno del 2004 nell’uomo è stata stimata una frequenza per gli SNPs pari a 1/700bp. Il recente progresso della genomica ha messo in luce come una parte rilevante della variabilità tra individui sia da attribuirsi ai polimorfismi a singolo nucleotide.
A differenza di altri marcatori come i VNTR e gli STRs, gli SNPs non sono sequenze ripetute e possono trovarsi sia nelle regioni codificanti che non-codificanti del genoma (Dwight et al., 2000). Dal momento che il DNA codificante costituisce soltanto l’1,5% del genoma umano, la maggior parte degli SNPs si trova nel DNA non codificante, come ad esempio all’interno di introni o di sequenze intergeniche. La localizzazione cromosomica degli SNPs è tutt’altro che uniforme: è spesso possibile osservare ampie regioni cromosomiche con pochissimi SNPs adiacenti a regioni che ne contengono invece molti. Gli SNPs, poi, possono determinare due tipi di alterazioni:
Sinonime. Non modificano la sequenza del prodotto genico e riguardano solo il
DNA che codifica i polipeptidi. Una mutazione sinonima determina un cambiamento di codone ma non di amminoacido a causa della degenerazione del codice genetico.
10
Alcune di queste mutazioni possono però non essere silenti perché interessano lo splicing. È possibile però che la presenza di un polimorfismo sinonimo sia associata ad una ridotta espressione/attività della corrispondente proteina, a seguito della relativa bassa concentrazione del corrispondente aminoacil-tRNA.
Non sinonime. Hanno come risultato una sequenza alterata del prodotto genico,
che può essere un polipeptide o un RNA funzionale non codificante e cioè che non viene tradotto.
Gli SNPs acquistano particolare rilevanza in campo biomedico quando possono essere messi in relazione a patologie che non presentano una trasmissione genetica semplice, e che sono perciò definite malattie multifattoriali. Confrontando lo schema e le frequenze degli SNPs su geni potenzialmente coinvolti in patologie e i fenotipi esibiti dai soggetti portatori, è possibile utilizzare tali sequenze come marcatori molecolari.
Il vantaggio degli SNPs è che consentono un’altissima resa di genotipizzazione, e presentano un’elevata densità in ogni regione del genoma (Wang et al; 1998); hanno infatti una frequenza di circa uno ogni 1000 bp. Gli SNPs possono essere analizzati con metodiche automatizzate come la PCR real-time o il Pyrosequencing e non necessitano di ulteriori analisi di elettroforesi su gel come viene effettuata per altri marcatori.
Un consorzio internazionale di collaborazione tra il mondo universitario e quello industriale ha prodotto una banca dati pubblica con più di 4 milioni di SNPs (dbSNP, accessibile tramite il sito web dell’NCBI) ed ha sviluppato diversi metodi per valutare su scala molto ampia gli SNPs senza dover ricorrere all’elettroforesi su gel.
11
1.2.3 Polimorfismi dei recettori β-adrenergici
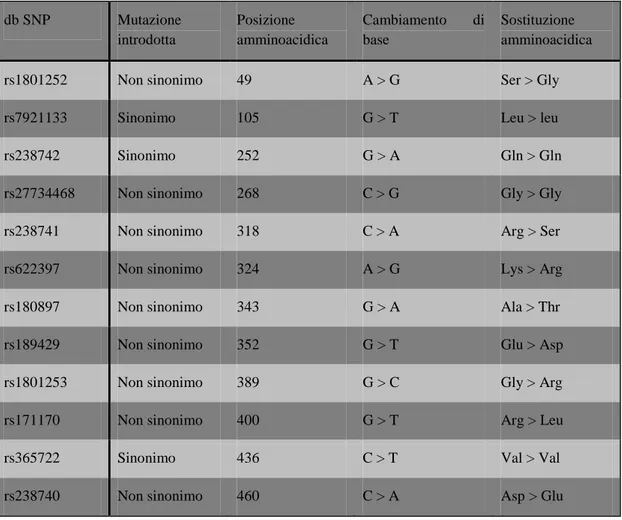
La suscettibilità dei recettori β1-adrenergici verso catecolamine endogene o farmaci antagonisti, e nelle patologie cardiovascolari, mostra una considerevole variabilità interindividuale (Dayer et al, 1986; Van Campen et al, 1998). Attualmente sono stati identificati 12 SNPs all’interno del gene del recettore β-1, per molti dei quali non è ancora stata verificata la frequenza allelica (tabella. 1). Tuttavia è stato osservato che questi SNPs ricadono in regioni del genoma altamente conservate, indicando l’importanza che questi polimorfismi possiedono nella funzionalità recettoriale. I dati fino ad ora ottenuti indicano quindi che vige un’estrema variabilità all’interno del gene che codifica il recettore β-1, ma che l’influenza di molti di questi SNPs sull’espressione genica è ancora incerta.
Uno dei polimorfismi maggiormente informativi del gene β1 comprende la variante genetica al codone 389, che determina la sostituzione amminoacidica di un’arginina in una glicina nella regione C-terminale del recettore stesso (Maqbool et al, 1999; Mason et al, 1999). Questo SNP ricade all’interno del quarto dominio intracellulare che lega la proteina G, ed è importante da un punto di vista funzionale in quanto determina l’affinità dei siti di legame delle proteine G al recettore β1. Il residuo di arginina al codone 389 è anche altamente conservato attraverso le specie, suggerendo il fatto che questa è la variante selvatica o “wild type” del recettore. La differenza nell’accoppiamento tra proteine G alle varianti del recettore β1 è stato dimostrato sia in linee cellulari di roditori (Maqbool et al, 1999) che umane, ed in entrambe è stato osservato un ridotto accoppiamento proteina G-recettore nelle
12
varianti Arg389 durante stimolazione con agonisti β-adrenergici (Bristow et al, 1989; Sandilands et al, 2004).
Tabella 1. Elenco dei 12 SNPs fino ad ora conosciuti del gene ADRB1.
Un secondo polimorfismo importante riguarda la sostituzione al codone 49, della glicina in serina (Ser49Gly) nella regione N-terminale del recettore β1. Questa variante genica sembra influire sull’attività recettoriale come confermano studi sui recettori β1 ricombinanti per i due SNPs, e sulla loro responsività conseguente alla loro attivazione a lungo termine (18-24 h).
db SNP Mutazione introdotta Posizione amminoacidica Cambiamento di base Sostituzione amminoacidica rs1801252 Non sinonimo 49 A > G Ser > Gly
rs7921133 Sinonimo 105 G > T Leu > leu
rs238742 Sinonimo 252 G > A Gln > Gln
rs27734468 Non sinonimo 268 C > G Gly > Gly rs238741 Non sinonimo 318 C > A Arg > Ser rs622397 Non sinonimo 324 A > G Lys > Arg rs180897 Non sinonimo 343 G > A Ala > Thr rs189429 Non sinonimo 352 G > T Glu > Asp rs1801253 Non sinonimo 389 G > C Gly > Arg rs171170 Non sinonimo 400 G > T Arg > Leu
rs365722 Sinonimo 436 C > T Val > Val
13
La variante Ser49 è infatti relativamente resistente alla down-regulation promossa da agonisti β adrenergici (Rathz et al, 2002) e questo sembra essere dovuto al suo elevato stato di N-glicosilazione che si verifica anche nei recettori β2-adrenergici e in quelli per il peptide rilasciante la gastrina (Rands et al, 1990; Benya et al, 2000). Inoltre è stato osservato che varia anche la frequenza di densensitizzazione in risposta all’esposizione a breve termine (10-20 min) di β-agonisti (Tabella 2); la variante Ser49 mostra di nuovo fenomeni di resistenza nei confronti della Gly49 (Levin et al, 2002).
Ser49 Maggiore resistenza alla down-regulation Arg389 Maggiore attività dell’adenilato ciclasi
Tabella 2. Conseguenze fenotipiche delle funzioni dei singoli nucleotidi polimorfici degli adrenorecettori β1
Il grado di funzionalità dei recettori β1-adrenergici è fornito quindi dai diversi aplotipi all’interno della popolazione. I quattro potenziali aplotipi che possono essere espressi, dimostrano che c’è un continuum funzionale in termini di attività costitutiva basale, indotta da agonisti ed efficienza di accoppiamento a proteine G (Sandilands et al, 2004). E’ stato osservato infatti che l’attività recettoriale tra le coppie di aplotipi GG/SG e GR/SR riscontrano differenze poco significative.
Per quanto riguarda la frequenza di questi polimorfismi in ambito di popolazioni sono state riscontrate notevoli differenze, infatti la frequenza della variante allelica Arg389 negli afro-americani è significativamente più bassa rispetto agli altri gruppi
14
etnici: nei cinesi è del 74%, nei caucasici del 72%, negli ispanici del 67% mentre negli afro-americani del 58% (Xie et al, 2001). L’insufficienza cardiaca è una patologia cardiaca più frequente fra gli afro-americani a confronto con altri gruppi etnici, ed il polimorfismo sopra citato può stabilire una base genetica di questa aumentata incidenza. Ulteriori studi non hanno però confermato simili differenze etniche nell’altro polimorfismo Ser49Gly (Moore et al, 1999).
1.2.4 Recettori β-1, polimorfismi e malattie cardiovascolari
Determinare quali genotipi dei recettori β1 adrenergici mostrano un’associazione con prevalenza, gravità e progressione delle malattie cardiovascolari ha lo scopo di definire l’importanza funzionale di tali polimorfismi recettoriali. Malgrado esista un’ampia letteratura sulle implicazioni funzionali riguardo a questi due polimorfismi (Arg389Gly e Ser49Gly) per i recettori β1 espressi in vitro, vi sono anche alcuni studi in vivo che dimostrano l’associazione tra queste varianti alleliche con aumenti nell’incidenza dell’ipertensione.
I polimorfismi dei recettori β1 valutati ex vivo, ovvero utilizzando cellule umane o tessuti esprimenti i recettori β1 adrenergici di un particolare genotipo, si avvalgono dell’utilizzo di piccoli frammenti di tessuto atriale ottenuto da pazienti sottoposti a terapia chirurgica cardiaca, sono facilmente reperibili e permettono una diretta valutazione della funzionalità di recettori ex vivo; è stato osservato infatti che frammenti di tessuto atriale ottenuti da pazienti omozigoti per la variante allelica Arg 389 presentano una maggior sensibilità alla noradrenalina rispetto a pazienti omozigoti Gly 389.
15
Vari studi hanno riportato che individui con genotipo omozigote per lo SNP Arg389, presentano alterati valori di pressione diastolica e frequenza cardiaca rispetto a genotipi omozigoti per lo SNP Gly389; anche studi caso-controllo hanno dimostrato che questo genotipo determina un fattore di rischio per l’ipertensione, con probabilità due volte maggiore di sviluppare tale patologia.
Più nello specifico la variante Arg389 del recettore β1 è stata associata, in diversi studi sia in vitro che ex vivo, con un incremento nell’attività dell’adenilato ciclasi dovuta ad una maggior efficienza nell’accoppiamento proteina G- recettore. L’aplotipo Ser49/Arg389 è quindi ritenuto responsabile di una maggior sensibilità dei recettori β1 alle catecolamine circolanti, concomitante ad un incremento della pressione arteriosa, e quindi ad un incremento della suscettibilità verso malattie cardiovascolari (insufficienza cardiaca, infarto miocardico, ipertensione..) in individui con tale aplotipo.
Nell’insieme, tutti questi studi indicano che i polimorfismi all’interno del gene
β1 influenzano la risposta ai farmaci β-bloccanti in individui con differenti aplotipi,
16
1.3 PATOLOGIE CARDIOVASCOLARI
1.3.1 Classificazione
Le principali patologie del sistema cardiocircolatorio che rappresentano la maggiore causa di morbilità e mortalità nel mondo occidentale comprendono:
• ipertensione;
• infarto miocardico;
• insufficienza cardiaca;
• angina.
Ad essi si sommano poi tutte quelle patologie prettamente vascolari (quali i fenomeni trombo-embolici, gli attacchi ischemici transitori, danni micro- e macro-angiopatici) che possono seguire o aggravare un evento maggiore.
L’aumento della pressione del sangue o ipertensione è definita come pressione diastolica persistentemente superiore a 90 mmHg. La pressione sanguigna può essere elevata aumentando la gittata cardiaca o le resistenze periferiche vascolari: il primo effetto è prodotto da un aumento del volume del sangue o da un aumento della contrattilità cardiaca; il secondo effetto è promosso da variazioni dell’attività di fattori umorali, nervosi e autoregolatori. L’ipertensione è una malattia comune che se non trattata efficacemente può determinare un significativo aumento della trombosi coronaria, di infarto e di insufficienza renale. Sono distinti due tipi di ipertensione: primaria e secondaria. L’ipertensione primaria o essenziale è un aumento della pressione arteriosa con l’età, e comprende circa il 90% di tutti i casi; il fenotipo risultante è frutto di interazioni tra predisposizione genetica, obesità, consumo di
17
alcol, attività fisica ed altri fattori ancora non identificati (Stevens e Lowe, 2001). Una caratteristica molto importante dell’ipertensione, indipendentemente dalla causa, è l’adattamento dei barocettori aortici e carotidei a valori pressori maggiori, con conseguente attenuazione o down regulation della loro attività. In assenza dell’attivazione barocettoriale, il centro di controllo cardiovascolare bulbare interpreta i valori elevati della pressione come normali, perciò non s’innescano quei riflessi finalizzati a diminuire i valori pressori.
L’ipertensione è, come già accennato, un fattore di rischio per l’aterosclerosi: l’elevata pressione nelle arterie danneggia il rivestimento endoteliale non solo dell’aorta, ma anche di altri vasi sanguigni e promuove la formazione delle placche aterosclerotiche. Inoltre, la presenza di una pressione elevata nelle arterie aumenta il lavoro cardiaco: quando la resistenza delle arteriole è elevata, il miocardio deve lavorare maggiormente per spingere il sangue nelle arterie.
Sorprendentemente, la gittata cardiaca sistolica negli individui ipertesi resta costante fino ad un valore di pressione arteriosa media di circa 200 mmHg, a dispetto dell’incremento del lavoro cardiaco richiesto al ventricolo. Il muscolo cardiaco del ventricolo sinistro risponde a valori pressori costantemente elevati nello stesso modo in cui il muscolo scheletrico risponde ad un allenamento anaerobico: il muscolo si ipertrofizza aumentando le dimensioni e la forza delle fibre muscolari.
Se le resistenze restano elevate nel tempo, tuttavia, il muscolo miocardio non è più in grado di sopportare il carico di lavoro e diviene insufficiente: la gittata cardiaca del ventricolo sinistro diminuisce. Se la gittata cardiaca del ventricolo destro resta costante mentre quella del ventricolo sinistro diminuisce, si osserva l’edema polmonare; lo scambio di O2 a livello polmonare diminuisce determinando anche un
18
insufficienza cardiaca congestizia o scompenso cardiaco congestizio, può condurre alla morte (Silverthon, 2007).
I depositi ateromatosi, ovvero l’accumulo di placche lipidiche nell’intima delle arterie, sono ubiquitari nei vasi coronarici della popolazione adulta di Paesi sviluppati, ma sono asintomatici nella maggior parte della storia naturale della malattia. Importanti conseguenze dell’aterosclerosi coronaria sono l’infarto miocardico e l’angina.
L’infarto del miocardio si verifica quando un vaso coronarico viene occluso da un trombo. Può essere fatale, e la morte generalmente è provocata da insufficienza meccanica dei ventricoli o da aritmia. Dato che la condizione energetica dei miocardiociti è basata sul metabolismo aerobico, se l’apporto di ossigeno scende al di sotto di un certo valore critico si verificano una serie di eventi che portano alla morte cellulare del tessuto cardiaco per necrosi.
L’angina si manifesta quando l’ossigeno fornito al miocardio è insufficiente alle sue necessità. Il dolore si rivela un bersaglio importante per l’intervento terapeutico. Clinicamente si distinguono tre tipi di angina: stabile, instabile e variante. L’angina stabile è caratterizzata da un prevedibile dolore da sforzo. È provocata da un aumento del lavoro cardiaco ed è dovuta ad un restringimento fisso dei vasi coronarici, quasi sempre causato da ateromi. L’angina instabile è caratterizzata da dolore che si manifesta con un’attività fisica progressivamente ridotta e che culmina con il dolore a riposo. Questa patologia è la stessa implicata nell’infarto miocardico, e cioè un trombo formato da piastrine e fibrina associato con la rottura di una placca ateromatosa ma senza occlusione completa del vaso. Vi è un chiaro rischio d’infarto e il principale target della terapia è la sua riduzione. L’angina variante è poco
19
frequente, si manifesta a riposo ed è causata da uno spasmo delle arterie coronariche. È solitamente associata ad una malattia ateromatosa (Rang, 2005).
L’innalzamento della pressione arteriosa rappresenta quindi un fattore di rischio per le suddette patologie cardiovascolari; pertanto le conseguenze patologiche sono osservabili principalmente in quattro tessuti:
Cuore. Con l’aumentare della pressione il miocardio ventricolare va in
ipertrofia. Dato che l’ipertensione abitualmente è associata con un aumento della gravità della aterosclerosi, la portata coronaria può essere insufficiente, e può determinare una cardiopatia ischemica; anche l’insufficienza ventricolare di sinistra è frequente nella cardiopatia ipertensiva.
Encefalo. I soggetti sono particolarmente a rischio di emorragie da rottura di
vasi sanguigni intracerebrali. Danni di piccoli vasi dentro gli emisferi cerebrali producono microinfarti, in forma di piccole aree di distruzione cerebrale piene di liquido.
Rene. L’aterosclerosi porta a un’ischemia progressiva del nefrone, che giunge a
determinare distruzione dei glomeruli e atrofia del sistema tubulare associato. Questa malattia è lentamente progressiva da che i nefroni sono distrutti uno ad uno; quando l’ischemia ha non funzionanti un certo numero di nefroni insorgerà un insufficienza renale cronica.
Aorta. L’ipertensione predispone allo sviluppo di gravi ateromi, di aneurismi
20
1.3.2 Farmacogenetica e patologie cardiovascolari
La risposta ai farmaci, come molte altre caratteristiche fisiche (colore degli occhi o altezza) ed alcuni aspetti della nostra intelligenza, può essere ricondotta ai nostri geni. La farmacogenetica è lo studio scientifico del modo in cui la genetica può influenzare la risposta umana a questi agenti, al cibo ed altre sostanze chimiche presenti nell’ambiente.
Durante gli anni ’50, è stata dimostrata l’identità del DNA come materiale ereditario, e la doppia elica del DNA ha stabilito le basi molecolari dell’eredità. Durante gli anni ’70 ed ’80, la base informativa dell’eredità è stata dimostrata tramite la scoperta del meccanismo che consente agli eritrociti di leggere le informazioni codificate nel gene, e sono state sviluppate le tecnologie che consentono di clonare, sequenziale ed esprimere i geni. Entro il 1990 queste tecnologie, combinate con l’approccio farmacologico ad un’ampia gamma di fenomeni, hanno stabilito i rapporti diretti tra le risposte individuali alle sostanze esogene e la variazione genetica di oltre 100 enzimi, recettori ed altre proteine umane (Weber WW, 2001).
Per molti anni, la farmacogenetica dei recettori è rimasta molto indietro rispetto a quella degli enzimi responsabili del metabolismo dei farmaci (Weber WW, 2001); Per quanto riguarda i recettori di superficie cellulare che recano mutazioni genetiche, la letteratura abbonda di esempi clinicamente rilevanti. Differenze geneticamente determinate nei recettori β-adrenergici possono influenzare il rischio di sviluppare eventi cardiovascolari cosi come la risposta ad alcuni farmaci che inibiscono l’attività del sistema nervoso adrenergico, tra i quali i β-bloccanti.
21
In diversi studi in vitro e in ex vivo sui recettori β1-adrenergici è risultato che i polimorfismi Ser49 ed Arg389 risultano associati, rispettivamente, sia ad una maggior resistenza alla down-regulation (Levin MC et al, 2002) recettoriale che ad un’elevata attività dell’adenilato ciclasi di membrana (Mason DA et al, 1999); entrambi gli SNPs, seppur con due meccanismi diversi, promuovono una maggior responsività dei recettori β-adrenergici alle catecolammine.
Pazienti omozigoti per l’aplotipo Ser49/Arg389 presenteranno quindi una maggior risposta, rispetto alle altre varianti alleliche, verso alcuni farmaci antagonisti per tali recettori come i β-bloccanti (Johnson JA et al, 2003), utilizzati nell’ambito della prevenzione di patologie cardiovascolari. Altri studi su pazienti con insufficienza cardiaca, hanno suggerito che lo SNP Arg389 o l’aplotipo Ser49/Arg389 sono associati con un miglioramento della gittata cardiaca sotto terapia β-bloccante (Mialet Perez J, et al, 2003; Terra SG, et al, 2005; Yu WP et al, 2006).
Diversi dati in letteratura confermano quindi che suddetti polimorfismi all’interno del gene ADRB1 rappresentano un importante target farmacogenetico nell’ambito della risposta ai farmaci β-bloccanti, e che possono influenzare le risposte farmacologiche nell’aumento del volume di eiezione e della pressione arteriosa in patologie cardiovascolari (insufficienza cardiaca, ipertensione, etc).
La conoscenza delle specifiche variazioni genetiche presenti negli enzimi, nei recettori e nelle altre proteine umane e delle conseguenze fenotipiche ad esse associate fornirà i dati necessari alla costruzione dei profili di rischio individualizzati per la suscettibilità ai farmaci e ad altre sostanze adattabili alla pratica medica. Se il trattamento viene guidato da tali profili, prevediamo di facilitare il medico nella
22
scelta del farmaco più appropriato per ogni paziente e di consentirgli di ridurre enormemente, o di evitare, il fallimento terapeutico e la tossicità farmacologica.
1.3.3 Farmaci d’utilizzo
I farmaci antipertensivi rappresentano un’eterogenea classe di farmaci ognuno dei quali è specifico per un determinato bersaglio cellulare (Fig.2), e sono utilizzati non solo per il trattamento dell’ipertensione arteriosa, ma anche per la prevenzione delle malattie cardiovascolari, quali infarto miocardico, insufficienza cardiaca, angina, etc. Essi sono suddividi in:
• diuretici;
• ACE inibitori;
• Ca2+ antagonisti;
• sartani;
• β-bloccanti.
I diuretici sono farmaci che, agendo sul rene causano una perdita netta di Na+ e di acqua dall’organismo. Il loro effetto principale consiste nel diminuire il riassorbimento di Na+ e Cl- dal filtrato; l’aumento della perdita di acqua è secondario all’aumento dell’escrezione di NaCl.
I farmaci vasoattivi possono influenzare la muscolatura liscia vascolare sia direttamente come nel caso dei Ca2+ antagonisti, sia indirettamente tramite gli ACE inibitori ed i Sartani.
23
I Ca2+ antagonisti interferiscono con l’ingresso di Ca2+ nelle cellule miocardiche: tutti questi farmaci si legano alle subunità α1 del canale del Ca2+ di tipo L ma a siti
diversi, ognuno dei quali interagisce allostericamente con gli altri.
Fig. 2. Principali target dei farmaci anti-ipertensivi.
Gli ACE inibitori hanno come target l’enzima di conversione dell’angiotensina; inibendone la sua attività prevengono la conversione dell’angiotensina I in angiotensina II, che un potente vasocostrittore. I Sartanici sono antagonisti del recettore AT-1 (Rang H.P. et al, 2005).
I farmaci β-bloccanti rientrano nella categoria degli antagonisti competitivi per i recettori β-adrenergici, ed il loro utilizzo rientra soprattutto nel trattamento dell’ipertensione, anche se sono utilizzati in numerose patologie cardiovascolari tra le quali l’insufficienza cardiaca e l’angina. Tra le varie classi di antipertensivi sono quelli di nostro maggior interesse in quanto agiscono sui recettori β1, e i principali polimorfismi di tali recettori sono stati indagati nell’ambito di questo studio clinico.
24
Circa 17 tipi di diversi farmaci betabloccanti sono stati approvati dalla Food and Drug Administration; il loro effetto farmacologico è attribuito alla loro selettività nel bloccare i recettori β1 o β2 adrenergici. La cardioselettività per i recettori β1 (localizzati a livello del tessuto miocardico) induce un effetto inotropo e cronotropo negativi, ovvero causa un’inibizione sia sulla contrattilità cardiaca che sull’attività del nodo senoatriale; il blocco selettivo dei recettori β2 , che sono localizzati anche a livello polmonare, provoca invece la contrazione della muscolatura liscia delle vie aeree e quindi broncocostrizione in individui predisposti (Kaplan, 2005b; Opie e Yusuf, 2005). I β-bloccanti di prima generazione come il Propanololo, non essendo cardioselettivi, bloccano entrambi i recettori β1 e β2 mentre quelli di seconda generazione tra i quali Atenololo e Metaprololo presentano una elevata selettività per i recettori β1, e, sono utilizzati maggiormente in pazienti con malattie croniche polmonari e nei fumatori. Infine i farmaci di terza generazione come il Labetalolo presentano in aggiunta effetti vasodilatatori dovuti alla loro capacità nel blocco α-adrenergico (Frishman 1998; Sica 2007). L’emivita plasmatica dei beta bloccanti varia dai 9 minuti alle 24 ore, con una media di 6 ore, ed è dovuta al rilascio di metaboliti attivi.
La terapia beta bloccante genera spesso risposte variabili nei diversi pazienti, e le differenze genetiche tra individui contribuiscono a questa variabilità nella risposta verso la somministrazione di β-bloccanti. Circa il 30-60% dei pazienti ipertesi sottoposti a terapia beta bloccante non riesce a raggiungere livelli adeguati nel controllo della pressione ematica (Materson et al., 1993; Jama, 1982) e questa variabilità dovuta proprio ai differenti polimorfismi genetici, tra i quali i due già citati SNPs Ser49Gly e Arg389Gly localizzati all’interno del gene ADRB1 codificante per i recettori β1. Studi in vitro hanno mostrato che la variante Ser49
25
incrementa la resistenza alla down regulation promossa da agonisti, mentre la variante Arg389 presenta un’elevata attività recettoriale basale ed indotta da isopretenololo (Bristow et al, 1992). Individui con polimorfismi Ser49 e/o Arg389 presenteranno una miglior risposta alla terapia β-bloccante, che varierà quindi in risposta ai differenti genotipi.
Altre categorie di farmaci utilizzati per la prevenzione del danno ischemico causato da episodi di trombosi coronarica, sono rappresentati da:
• Oppioidi
• Farmaci trombolitici
Gli oppioidi riducono il dolore ed i livelli eccessivi di attività simpatica (sono più frequentemente utilizzati per l’angina).
Per il trattamento delle malattie trombotiche, quali l’infarto miocardico e l’ictus sono utilizzati principalmente i farmaci antipiastrinici come l’aspirina, i quanto i trombi neoformati sono ricchi di piastrine. I farmaci trombolitici sono utilizzati a livello clinico, principalmente per rendere pervie le coronarie occluse in pazienti con infarto acuto del miocardio; agiscono influenzando il sistema fibrinolitico determinando un aumento della fibrinolisi.
26
Parte II. Razionale e obiettivi dello studio
Capitolo 2. Scopo del lavoro
Le malattie cardiovascolari, dopo i tumori, rappresentano in epoca odierna una delle maggiori cause di morbilità e mortalità nei paesi industrializzati del mondo occidentale.
Se i suddetti polimorfismi dei recettori β-1 adrenergici sembrano risultare associati a patologie cardiovascolari, come suggeriscono alcuni dati in letteratura, sarebbe utile poter definire il rischio di tali eventi cardiovascolari in relazioni agli SNPs presi in esame in questo lavoro.
L’obiettivo di questo studio è stato quello di genotipizzare un campione di pazienti di sesso femminile (arruolati in uno studio clinico più ampio presso l’Azienda Ospedaliera di Pisa) per i due SNPs Ser49Gly e Arg389Gly, descritti nella parte introduttiva. L’utilizzo di metodiche automatizzate di biologia molecolare come la PCR real-time ha permesso di effettuare l’analisi dei genotipi per questi polimorfismi e di stabilire, per mezzo di calcoli biostatistici, un’ipotetica associazione tra genotipo e fenotipo.
In particolare, gli endpoint ed obiettivi del presente studio sono stati:
1) validare tecniche di analisi come l’estrazione di DNA dalla saliva anziché da sangue intero.
2) applicare le tecniche di biologia molecolare ad una casistica di pazienti per la determinazione dei genotipi rispetto ai recettori sopra indicati;
27
3) valutare la possibile associazione tra i polimorfismi Arg389Gly/Ser49Gly e malattie cardiovascolari.
4) valutare se i soggetti omozigoti per alcuni polimorfismi dei recettori β1-adrenergici presentino un diverso profilo di rischio cardiovascolare.
Uno degli scopi di questo lavoro, infatti, era quello di valutare la possibilità di isolare DNA genomico da campioni salivari in quantità sufficienti per le analisi farmacogenetiche. La possibilità di ottenere quantità sufficienti di acido nucleico per ulteriori analisi rappresenta un importante progresso, dato che il paziente non è esposto ai rischi connessi ad un prelievo ematico, tra cui le emorragie, i sanguinamenti, il dolore, le infezioni. Le concentrazioni di DNA sono risultate sufficientemente elevate per poter condurre le analisi farmacogenetiche. In merito a queste ultime, i parametri di analisi hanno dimostrato un’elevata efficienza, a ulteriore riprova della bontà del materiale genetico di partenza.
In secondo luogo, l’impiego della PCR real-time ha mostrato come tale metodica sia sostanzialmente caratterizzata da una elevata rapidità di analisi e dalla facile interpretazione dei risultati ottenuti. Infatti, impiegando sonde allele-specifiche è possibile genotipizzare circa 96 pazienti nel corso della stessa reazione di PCR, mentre la fluorescenza specifica per ciascuna sonda identifica in maniera inequivocabile il genotipo del singolo paziente. A differenza di altre tecniche meno “evolute”, quali la genotipizzazione mediante digestione del prodotto di PCR con endonucleasi (PCR-RFLP), non è possibile che si ottengano reazioni aspecifiche grazie alla complementarietà tra sequenza di DNA contenente il polimorfismo e le corrispondenti sonde. Inoltre, è possibile ripetere l’analisi con maggiore facilità al fine di confermare il risultato ottenuto, ed il grado di automazione è molto elevato.
28
Parte III. Pazienti, materiali e metodi
Capitolo 3
3.1 Pazienti
Ai fini del presente studio sono stati considerati 108 pazienti femmine arruolate in uno studio clinico più ampio, ed afferenti dall’azienda ospedaliera universitaria pisana (AOUP). Tutte le pazienti hanno fornito un campione di saliva (circa 1 ml) per l’estrazione del DNA genomico.
Per tutte le pazienti sono stati compilati questionari per screening di fattori di rischio cardiovascolari, comorbidità e terapie in atto. Particolare attenzione è stata posta alla raccolta di informazioni anamnestiche riguardanti le malattie cardiovascolari, sia centrali (angina, infarto miocardico, aritmie, coronaropatie) che periferiche (eventi tromboembolici, ipertensione, etc), e di segni e sintomi durante l’esame obiettivo della paziente (es., misuraizone della pressione arteriosa, esecuzione di elettrocardiogramma a riposo, etc). Inoltre, è stato raccolto un campione salivare per polimorfismi del recettore β-1 adrenergico (Arg389Gly e Ser49Gly). La saliva è stata inviata alla Divisione di Farmacologia e Chemioterapia e congelata (-20 °C) in eppendorf fino al momento dell’analisi. Brevemente, un’aliquota (200 µl) del campione di saliva raccolta dal paziente è stata impiegata per l’estrazione del DNA secondo procedure standard (Qiagen DNA Mini Kit e
29
QIAamp DNA Blood Mini Kit, Milano, Italia). Il DNA ottenuto è stato conservato a -70 °C presso i laboratori della Divisione di Farmacologia e Chemioterapia del Dipartimento di Medicina Interna fino al monento delle analisi. Infatti, un’aliquota di DNA è stato impiegato per le analisi di identificazione allelica mediante strumento ABI PRISM 7900 HT Sequence Detection System (Applied Biosystems, Foster City, USA). A tal fine, per ciascun polimorfismo genico è stato impiegato un kit composto da una coppia di primers e due sonde ciascuna delle quali specifica per uno dei due alleli (wild-type e polimorfico; Taqman(C) SNP Genotyping Assay, Applied Biosystems). In particolare, sono stati impiegati i seguenti kit: C___8898508_10 (Arg389Gly) e C___8898494_10 (Ser49Gly). La reazione a catena della polimerasi è stata analizzata mediante software SDS versione 2.1 (Applied Biosystems) che permette l’identificazione del genotipo del paziente sulla base della fluorescenza delle due sonde impiegate. I programmi software Genetix e Arlequin sono stati usati per calcolare la frequenza allelica e genotipica degli alleli presenti nei due loci.
3.2 Materiali e metodi
3.2.1 Estrazione del DNA genomico
L’estrazione del DNA genomico è effettuata su campioni di saliva provenienti dai pazienti arruolati per tale studio. Le tre fasi principali di questo processo sono:
Demolizione della struttura cellulare: il materiale genetico viene liberato
30
Digestione delle proteine: in questa fase vengono degradate le proteine
istoniche che tengono legato il DNA nel nucleo; avviene quindi la denaturazione delle proteine ma non degli acidi nucleici.
Precipitazione del DNA: rappresenta la parte finale del processo nella quale,
aggiungendo l’Etanolo, il DNA genomico precipita in quanto non è solubile in tale solvente.
Al fine di estrarre il DNA dai campioni di saliva prelevati dalle 108 pazienti, 20
µl di QIAGEN Proteasi (o Proteinasi K) sono stati posti sul fondo di una provetta da
microcentrifuga da 1,5 ml. Sono stati aggiunti 200 µl di saliva nella provetta e 200 µl di Buffer AL presente nella confezione del kit impiegato. Il campione è stato poi agitato per 15 secondi e quindi incubato a 56 oC per 10 minuti affinché la proteasi possa degradare le membrane nucleari e permettere così il rilascio del materiale genetico. Al campione sono stati aggiunti 200 µl di etanolo al 100% (v/v) ed è stato agitato per altri 15 secondi, di modo che possa avvenire la precipitazione del DNA. Il campione ottenuto è stato quindi posto in una colonna per la separazione del DNA (QIAamp Spin Column) e quindi centrifugato a 8000 giri/minuto per 1 minuto in una centrifuga da banco Sigma K15.
Dopo aver scartato l’eluato, nella QIAamp Spin Column sono stati aggiunti 500
µl di buffer AW1 ed il campione è stato poi centrifugato a 8000 giri/minuto per 1
minuto. Il filtrato è stato nuovamente eliminato, e, dopo aver aggiunto il buffer AW2 (500 µl), il campione è stato centrifugato a 14.000 giri/minuto per 3 minuti. Dopo aver eliminato il filtrato, ed aver incubato il campione a temperatura ambiente per 1 min in 200 µl buffer AE, il DNA adsorbito sulla resina presente nella colonna è stato
31
eluito in una nuova provetta da 1,5 ml mediante centrifugazione a 8000 giri/min per 1 minuto.
La concentrazione di DNA presente nell’eluato è stata calcolata sulla base dell’assorbanza mediante uno spettrofotometro alla lunghezza d’onda di 260 nm (Abs260). La seguente formula è stata impegata per il calcolo:
[DNA] (ng/µl) = Abs260 x 50
3.2.2 Analisi dei polimorfismi tramite PCR-real time
La reazione a catena della polimerasi (PCR) di tipo quantitativo (Real Time PCR) permette l’amplificazione e la quantificazione simultanee del DNA. Questa metodica consente di misurare la quantità di DNA o di RNA durante la fase esponenziale di crescita della curva di amplificazione, in modo tale da risalire alla quantità di template di partenza usando una scala di calibrazione.
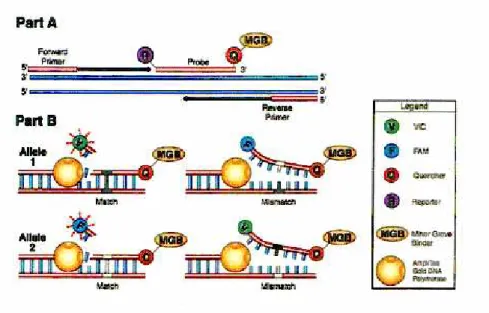
Il principio è quello di aggiungere ad una normale reazione di PCR un frammento di DNA complementare ad un tratto della sequenza di interesse (DNA template), legato covalentemente a 2 molecole fluorescenti: R (Reporter), un fluorocromo ad alta energia e Q (Quencher), un fluorocromo a bassa energia. Il quencher ha la funzione di spegnere la fluorescenza del reporter. Se R e Q si trovano vicini, Q spegne l'effetto di R perchè i fotoni di R vengono assorbiti da Q. In particolare, nel saggio TaqMan (Fluorogenic 5' Nuclease Assay), una speciale sonda fluorogenica complementare alla sequenza del DNA bersaglio compresa tra il primer senso ed antisenso viene aggiunta alla miscela di PCR.
32
Durante l'amplificazione, nella fase di "annealing", sia i primer che la sonda si ibridizzano al template. La sonda, essendo bloccata all’estremità 3' non può essere usata dalla polimerasi per la replicazione. Durante l'estensione del primer, l’enzima Taq incontra la sonda ibridata che le sbarra la strada e quindi la taglia utilizzando la sua attività 5'-3' esonucleasica, liberandosi la strada e portando così a termine la copiatura del frammento.
Se la sonda è intatta Q spegne la fluorescenza di R perchè la loro distanza è molto ravvicinata, se invece la sonda è frammentata la distanza tra Q ed R è maggiore e Q non riesce a spegnere l'effetto di R, quindi si ha emissione di fluorescenza (Fig. 3).
Il risultato è che, per ogni copia di prodotto di PCR portata a termine, la sonda che si era legata al DNA template viene degradata. Utilizzando le apposite sonde fluorogeniche TaqMan, ogni qualvolta una sonda viene tagliata dalla Taq polimerasi, si libera in soluzione una molecola fluorescente che genera il segnale rivelabile dal detector.
33
Confrontando la fluorescenza dei campioni rispetto ad uno standard di riferimento si può risalire al numero di copie di DNA di partenza. Non è possibile misurare i primi cicli, perchè il segnale emesso è troppo basso, ma è comunque possibile misurare la fluorescenza dei cicli all'interno della fase di crescita esponenziale. Per ogni campione si otterrà un grafico con la sua curva di crescita, e tale curva salirà tanto prima quanto maggiore era la quantità di DNA template di partenza.
Lo scopo principale della Real time PCR non è dunque quello dell'amplificazione del DNA, ma quello della sua quantificazione. Le applicazioni sperimentali sono molteplici, e nel caso del presente studio il metodo è stato utilizzato per l'analisi genotipica. In tal caso, il metodo prevede che per ogni variante allelica sia presente nella miscela di reazione la sonda specifica complementare. Ogni sonda reca con se un fluoroforo che emette ad una diversa lunghezza d’onda, così che è possibile distinguere la presenza di una base specifica sulla posizione corrispondente al locus polimorfico. Quindi utilizzando due sonde, una per ogni variante allelica, e attraverso la misurazione della fluorescenza è stato possibile stabilire se un soggetto è eterozigote o omozigote per uno dei due alleli. L'efficiente rivelazione dell'accumulo di prodotti PCR è ottenuta con il Fluorogenic 5' nuclease assay TaqMan®.
In questo studio, le due sonde specifiche per i due alleli e la coppia di primers per l’amplificazione sono state disegnate con il programma File Builder versione 2.0 (Applied Biosystem). In particolare, le due sonde sono state marcate con due differenti fluorocromi (VIC e FAM), sulla base della sequenza genica:
34
Ser49Gly (145 A>G) (rs 1801252)
CTCGTTGCTGCCTCCCGCCAGCGAA[A/G]GCCCCGAGCCGCTGTCTCAGC
AGTG Sonde
CTCGTTGCTGCCTCCCGCCAGCGAAA VIC (allele G wt)
GGCCCCGAGCCGCTGTCTCAGCAGTG FAM (allele A)
Arg389Gly (1165 C>G) (rs 1801253)
CCCCGACTTCCGCAAGGCCTTCCAG[C/G]GACTGCTCTGCTGCGCGCGCA
GGGC Sonde
CCCCGACTTCCGCAAGGCCTTCCAGC VIC (allele C wt)
GGACTGCTCTGCTGCGCGCGCAGGGC FAM (allele G)
La reazione di PCR è stata eseguita usando 11,25 µL di DNA genomico, diluito in acqua DNAse-RNAse free (1, 5, 10 and 20 ng), 12,5 µL di TaqMan Universal PCR Master Mix, con AmpliTaq Gold®, e 0,625 µL di miscela (contenente i due primers forward e reverse e le due sonde specifiche), in concentrazione ottimizzata con reazioni precedenti, in un volume totale di 25 µL. I campioni sono stati amplificati usando le seguenti condizioni termiche di ciclizzazione: un’incubazione iniziale di 5 min a 50 °C, una successiva incubazione di 10 min a 95 °C, per denaturare il DNA, e 40 cicli costituiti da una fase di denaturazione a 95 °C per 15
35
sec seguiti da una fase di annealing e da una estensione di un minuto ad una temperatura di 60 °C.
Durante la reazione, il taglio della sonda ad opera della AmpliTaq Gold® separa il cromoforo reporter dal cromoforo quencher, con conseguente aumento della fluorescenza. L’accumulo dei prodotti di PCR viene calcolato valutando direttamente l’aumento di fluorescenza del reporter.
Al termine dei cicli programmati, lo strumento 7900 HT misura la fluorescenza che si è sviluppata permettendo di stabilire il contenuto allelico di ogni campione presente sulla piastra. Infatti, un aumento sostanziale della fluorescenza dovuta solo a VIC indica che l’allele è omozigote wild type, se questo aumento deriva solo da FAM indica che l’allele è omozigote polimorfismo. Quando l’emissione di fluorescenza deriva da entrambe le sonde il paziente è in una condizione di eterozigosi rispetto a quel locus genico.
3.2.3. Analisi statistica
I risultati sono stati analizzati secondo i principali test statistici ed il livello di significatività è stato posto uguale a 0,05.
In particolare, sono stati applicati test parametrici e non parametrici per dati non appaiati (test t di Student e di Mann-Whitney, rispettivamente) per il confronto tra gruppi nel caso di variabili continue. Per confermare la distribuzione normale o gaussiana dei valori di tali variabili, è stato adottato il test di Kolmogorov-Smirnov. Per variabili categoriche sono stati i test di Fisher e di χ2, e quest’ultimo è stato impiegato anche per la verifica della distribuzione delle frequenze alleliche secondo la legge di Hardy Weinberg. I software Microsoft Excel e Prism GraphPad sono stati
36
impiegati per tali analisi. La conferma dell’equilibro secondo la legge di Hardy Weinberg è stata ottenuta mediante i software Genetix e Arlequin, il quale ha permesso poi di stabilire il grado di linkage disequilibrium tra i due loci genici. Infine, la correlazione tra polimorfismi e patologie cardiovascolari è stata analizzata mediante modello multivariato usando il programma JMP.
37
Parte IV. Risultati
Capitolo 4
4.1 GENOTIPIZZAZIONE
In questo lavoro di tesi è stata condotta un’analisi relativa a due SNPs presenti nel gene codificante per il recettore β1-adrenergico mediante una tecnica di real-time
PCR. La maggiore novità del lavoro, però, è stata quella di aver impiegato come matrice biologica per l’isolamento di DNA genomico la saliva e non il sangue, come invece avviene nella maggioranza degli studi clinici e di farmacogenetica. L’impiego di campioni salivari per la genotipizzazione dei pazienti ha alcuni innegabili vantaggi, riferibili essenzialmente alla facilità con la quale è possibile ottenere il campione senza esporre il paziente ai rischi (seppur minimi) legati al prelievo da un accesso venoso periferico (emorragie, dolore, infezioni). In secondo luogo, la specificità della reazione di PCR esclude la possibilità di amplificazioni di frammenti di DNA estratti dalla flora microbica orale. Terzo, la raccolta diretta di saliva in un tubo sterile porta anche ad un vantaggio economico, sia nei confronti del prelievo ematico che di cellule dell’epitelio buccale (esempio, i buccal swab). Un possibile aspetto negativo dell’impiego di saliva invece del sangue o dell’epitelio mucoso potrebbe essere la bassa resa della procedura di estrazione, con quantità di DNA genomico inadeguate ai fini delle analisi.
38
Fig. 4 Distribuzione dei valori di resa della procedura di estrazione di DNA genomico dalla saliva delle 108 pazienti.
In realtà, la misurazione della quantità di DNA ottenuto mediante estrazione con il kit Qiagen ha mostrato quantità sufficienti di DNA e paragonabili, se non addirittura sovrapponibili, a quelle ricavate dallo stesso volume di sangue intero che garantisce una resa di circa 200 ng/ml. Infatti, nonostante la concentrazione media di DNA da saliva sia stata minore di 100 ng/ml (Figura 4), la raccolta di saliva è ben accetta dai pazienti e le reazioni di real-time PCR sono state effettuate con successo. Pertanto, questo lavoro di tesi ha permesso di stabilire che l’impiego di campioni salivari è da considerarsi paragonabile a quello di campioni ematici per la valutazione di SNP della linea germinale.
La genotipizzazione condotta mediante piattaforma Taqman per l’identificazione dei polimorfismi (Ser49Gly/Arg389Gly) del gene codificante il recettore β1-ADR ha
prodotto risultati univoci in tutti i pazienti. In particolare, i metodi di analisi mediante sonde Taqman hanno dimostrato di essere sensibili e affidabili, e l’impiego dello
39
strumento HT7900 ha ridotto in misura significativa il tempo di analisi dei campioni di DNA grazie all’automazione dell’apparecchiatura ed alla possibilità di condurre in triplicato le determinazioni per ciascun paziente. La discriminazione allelica ha permesso di identificare sia pazienti omozigoti che eterozigoti, sulla base dell’andamento delle curve di amplificazione. Infatti, nel caso del paziente omozigote è stato possibile identificare una sola curva di amplificazione (Figura 5), a dimostrazione del fatto che una delle due sonde non si è legata al templato e non ha emesso fluorescenza, a differenza invece di quanto è stato osservato nei campioni eterozigoti, con la comparsa delle due curve di amplificazione (Figura 6).
Omozigote
x
Fig. 5. Grafico relativo all’amplificazione di un campione di DNA per un polimorfismo biallelico. Il paziente è omozigote perché una delle due sonde (x) non può ibridarsi alla sequenza complementare di DNA ed iniziarne l’amplificazione.
Inoltre, essendo presenti nella nostra popolazione tutti e tre i genotipi omozigote wild type, eterozigote ed omozigote per l’allele polimorfo è stato possibile eseguire la fase di discriminazione allelica automatica da parte dello strumento. Il tempo necessario per l’analisi di campioni clinici, estremamente ridotto, e l’elevata
40
produttività, assicurata dalla possibilità di analizzare fino a 96 campioni, sono elementi tali da permettere l’applicazione del metodo in un contesto analitico clinico.
Fig. 6. Grafico relativo all’amplificazione di un campione di DNA per un polimorfismo biallelico. Il paziente è eterozigote perché entrambe le sonde portano correttamente all’amplificazione.
4.2 Analisi statistica dei dati
4.2.1 Analisi delle frequenze alleliche
La frequenza degli alleli nei due loci e la frequenza genotipica sono state calcolate mediante il programma software Microsoft Office Excel.
I risultati ottenuti dalla genotipizzazione sono stati elaborati per valutare la distribuzione delle frequenze genotipiche secondo la legge di Hardy-Weinberg. I pazienti sono stati suddivisi in tre gruppi in base al genotipo per ciascun locus
41
polimorfico (omozigoti wild-type, eterozigoti e omozigoti polimorfici) ed è stata calcolata dapprima la frequenza allelica mediante la formula:
dove A e B sono i due alleli.
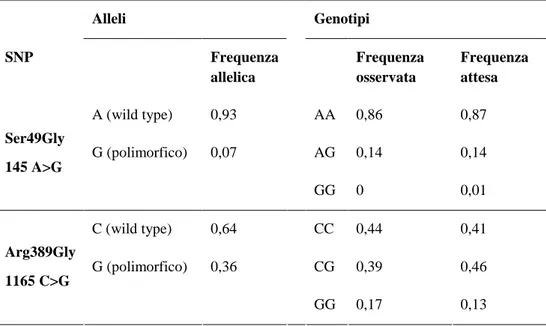
Sulla base delle frequenze alleliche è stata calcolata la frequenza genotipica attesa, e la differenza tra distribuzione osservata e attesa è stata valutata mediante test del χ2 di Pearson (Tabella 3), i cui valori di p sono risultati rispettivamente per i polimorfismi Ser49Gly di 0,601 e per Arg389Gly di 2,669. Il test non rigettava l’ipotesi nulla per valori inferiori a 3,841 e quindi la popolazione doveva essere considerata in equilibrio per la legge di Hardy-Weinberg.
Tabella 3. Frequenze alleliche e genotipiche per i due SNPs analizzati in questo studio.
Alleli Genotipi SNP Frequenza allelica Frequenza osservata Frequenza attesa A (wild type) 0,93 AA 0,86 0,87 G (polimorfico) 0,07 AG 0,14 0,14 Ser49Gly 145 A>G GG 0 0,01 C (wild type) 0,64 CC 0,44 0,41 G (polimorfico) 0,36 CG 0,39 0,46 Arg389Gly 1165 C>G GG 0,17 0,13
42
4.2.2 Polimorfismi ed eventi cardiovascolari
Dall’analisi delle frequenze alleliche abbiamo osservato che per il polimorfismo Ser49Gly, la frequenza dell’allele G risultava molto bassa (0,07) e quindi non è stato possibile determinare un’influenza statistica di tale SNP sull’insorgenza di eventi cardiovascolari; tale risultato è da attribuire sicuramente alle ridotte dimensioni del campione. Per quanto riguardava il secondo polimorfismo, abbiamo invece ottenuto una frequenza allelica che risulta essere molto simile a quella descritta in letteratura (C = 0,717 / G = 0,283). Questo ci ha così permesso di procedere ad un’analisi statistica valutando, all’interno del nostro campione, il numero di individui affetti e non affetti da patologie cardiovascolari in relazione al genotipo. Per effettuare così uno studio del tipo caso-controllo è stato necessario calcolare la numerosità dei due gruppi affinché l’analisi potesse risultare statisticamente significativa.
Quindi, considerando le frequenze alleliche dello SNP Arg389Gly e impostando un errore alfa pari a 0,05 e una potenza dello studio di 0,80, i risultati del software impiegato per il calcolo della numerosità (PS versione 3.0.14) hanno indicato la necessità di arruolare almeno 24 pazienti per il gruppo di affetti e 24 per il gruppo di controllo; il nostro tipo di studio ha raggiunto un arruolamento nel corso del tempo di 108 pazienti di sesso femminile, suddivise in 52 pazienti affetti da eventi cardiovascolari e 56 di controllo. In particolare, gli eventi cardiovascolari che sono stati osservati nelle pazienti arruolate erano rappresentati da 15 aritmie, 13 ipertesi, 4 eventi trombotici, 11 angine e 9 arteropatie periferiche.
Possiamo osservare dalla classificazione dei pazienti in base al genotipo (Tabella 4), che i pazienti portatori dell’allele C presentano una maggior frequenza di
43
malattie cardiovascolari rispetto agli omozigoti GG; inoltre il rapporto di circa 1:1 tra omozigoti CC ed eterozigoti CG indica che l’allele C ha un’elevata penetranza e pertanto abbiamo preso in considerazione un’ipotesi di tipo dominante, dove l’allele C prevale sul G (Tabella 5).
GENOTIPO CASI CONTROLLI PAZIENTI TOTALI
CC 26 22 48
CG 24 18 42
GG 2 16 18
52 56 108
Tabella 4. Classificazione dei pazienti affetti e non affetti in base al genotipo.
GENOTIPO CASI CONTROLLI PAZIENTI TOTALI
CC + CG 50 40 90
GG 2 16 18
52 56 108
Tabella 5. Classificazione dei pazienti secondo l’ ipotesi dominante dell’allele C.
Il risultato dell’analisi statistica, condotta applicando il test di Fisher, ha mostrato una significativa differenza (P< 0,001) nella distribuzione dei pazienti con eventi cardiovascolari rispetto al genotipo ArgArg/ArgGly dato che gli omozigoti GlyGly mostravano una minor incidenza degli eventi; Infatti la frequenza di eventi cardiovascolari riscontrata nei pazienti affetti portatori dell’allele C è di 0,55 (50/90) contro una frequenza di 0,11 (2/18) negli omozigoti GG.
44
4.2.3 Analisi dei fattori di rischio
Avendo considerato l’apparato cardiovascolare è necessario considerare oltre ai polimorfismi genetici anche i fattori di rischio fisiopatologici ed ambientali/comportamentali, tra i quali abbiamo preso in considerazione l’età, il peso, l’indice di massa corporea (BMI), il tabagismo, le malattie metaboliche (dislipidemia e diabete), la menopausa e l’attività fisica.
Come è possibile osservare, le variabili prese in considerazione sono sia di tipo continuo (età, peso, BMI) che di tipo dicotomico (fumo, malattie metaboliche, menopausa e attività fisica). Per l’analisi statistica delle variabili continue è stato condotto un test T di student per campioni indipendenti, al fine di valutare se i due gruppi mostrano una media significativamente diversa e quindi verificare se ogni fattore di rischio per lo sviluppo di eventi cardiovascolari è statisticamente significativo. Come per l’analisi dei polimorfismi, anche per le altre variabili dicotomiche è stato condotto un test di Fisher.
Prima di procedere al test T di student però è stato applicato il test di Kolmogorov-Smirnov, un test atto alla verifica delle omogeneità dei due campioni, che è in grado di definire se questi sono distribuiti normalmente cosicché è possibile applicare il test T di student.
I risultati forniti dal programma Prism Graphpad 4 hanno messo in luce che due delle variabili continue considerate (età e peso) sono distribuite normalmente, e quindi è stato possibile applicare il test T di student. Il BMI non segue questo tipo di distribuzione e pertanto è stato effettuato un test non parametrico (test di Mann-Whitney).
45 I risultati ottenuti sono stati i seguenti:
Età: le pazienti con eventi cardiovascolari hanno un’età significativamente
maggiore (51,9±7,2 anni) rispetto alle altre pazienti (48,6±9,2 anni) ; (test t di
Student, p=0,041).
Peso: le pazienti con eventi cardiovascolari hanno un peso significativamente
maggiore (65,8±12,0 kg) rispetto alle altre pazienti (61,3±10,3 kg) ; (test t di
Student, p=0,036).
Indice di massa corporea (BMI): le pazienti con affette hanno un BMI
maggiore (25,0±4,8) rispetto alle altre pazienti (23,5±4,2) ma tale differenza non è significativa (test di Mann-Whitney, p=0,086).
Fumo: non esiste differenza significativa per quanto riguarda la proporzione di
fumatrici nei due gruppi (30 vs. 32 fumatrici per eventi cardiovascolari e gruppo di controllo ; test di Fisher, p>0,05).
Menopausa: risultato analogo è stato osservato per quanto riguarda il numero di
pazienti in menopausa (25 controlli vs. 34 affetti; test di Fisher, p=0,055).
Dislipidemia e diabete: nessuna differenza significativa nel gruppo di controllo
(19 individui) e con eventi cardiovascolari (15 donne) ; (test di Fisher, p>0,05).
Attività fisica: solo 6 e 7 donne erano dedite regolarmente alla pratica di
un’attività sportiva nei due gruppi (con eventi e di controllo, rispettivamente; test di
Fisher, p>0,05).
Pertanto, le due variabili età e peso sono risultate significativamente differenti tra casi e controlli, cosicché, tra i fattori di rischio associati all’insorgenza di patologie cardiovascolari, sono state prese in considerazione tre variabili: genotipo, età e peso corporeo.
46
4.2.4 Analisi ROC (Receiver Operating Charateristic)
L’analisi ROC ha dimostrato la sua utilità in diversi campi della scienza, compresa la medicina e consente di valutare la performance di un test diagnostico basato su valori soglia in modo semplice, efficace, essendo basato su una ormai consolidata teoria statistica, e di eseguire di conseguenza confronti tra test diversi.
L’utilizzo di questo test ci permette di individuare un valore soglia definito anche cut-off, al di sopra del quale il rischio di sviluppare eventi cardiovascolari, nel nostro campione, aumenta con un determinato grado di specificità e sensibilità.
Nel presente lavoro abbiamo utilizzato il ROC test per valutare il livello di informatività delle due variabili età e peso, considerate come un vero e proprio parametro diagnostico predittivo per le patologie cardiovascolari considerate.
I valori di cut-off stabiliti sono di 52,5 anni per l’età e 64,5 Kg per il peso. La capacità discriminante di un test, ossia la sua attitudine a separare propriamente la popolazione in studio in “malati” e “sani” è proporzionale all’estensione dell’area sottesa alla curva ROC (Area Under Curve, AUC) ed equivale alla probabilità che il risultato di un test su un individuo estratto a caso dal gruppo dei malati sia superiore a quello di uno estratto a caso dal gruppo dei non-malati (Bamber, 1975; Zweig e Campbell, 1993). Per quanto riguarda l’interpretazione del valore di AUC, si può tenere presente la classificazione della capacità discriminante di un test proposta da Swets (1998). Essa è basata su criteri largamente soggettivi ed avviene secondo lo schema seguente: