Riassunto
Inizialmente descritto nel 2002, e diffuso in clinica a partire dal 2005 con lo sviluppo degli approcci transfemorale e transapicale, l'impianto di protesi aortica transcatetere (Transcatheter Aortic Valve Implantation, TAVI) è rapidamente divenuto una valida alternativa alla chirurgia convenzionale in pazienti selezionati ad alto rischio o inoperabili con stenosi aortica severa sintomatica.
La TAVI rimane però procedura complessa, che richiede l'acquisizione di nuove abilità tecniche e la stretta cooperazione tra specialità differenti. Per tale motivo, il monitoraggio della performance e della “Learning curve” degli operatori coinvolti è essenziale.
La TAVI è associata ad un'aumentata incidenza di specifiche complicanze rispetto alla chirurgia convenzionale. Tra queste, alcune sono chiaramente in relazione alla curva d'apprendimento (complicanze legate all'accesso, malposizione o embolizzazione della protesi), mentre altre appaiono meno operatore-dipendenti e tendono a verificarsi con una certa frequenza anche nelle mani degli operatori più esperti. Tra queste, i disturbi del ritmo cardiaco ed il leak paravalvolare sono le più importanti e frequenti.
Il presente studio è stato sviluppato per analizzare l'incidenza di leak paravalvolare in pazienti sottoposti a TAVI, con particolare riguardo allo studio dei fattori in grado di predire l'occorrenza di tale complicanza, ed alla valutazione di efficacia delle manovre mirate a correggerla o risolverla.
Pazienti e Metodi
I primi 104 pazienti consecutivi sottoposti a TAVI con protesi “Balloon Expandable” presso l'Ospedale del Cuore di Massa, Fondazione “G. Monasterio”, costituiscono la popolazione in esame. L'indicazione alla procedura è sempre stata data da un “Heart team” composto da due cardiologi clinici, due cardiologi interventisti, due cardiochirurghi ed un anestesista. Sono stati sottoposti a TAVI pazienti considerati inoperabili o ad alto rischio chirurgico in base ad un'accurata valutazione multidisciplinare.
cardiologica/cardiochirurgica, ecocardiografia transtoracica, ed angio-TC torace-addome-assi iliacofemorali. Il “Sizing” della protesi transcatetere si è basato sulle misurazioni eseguite all'ecografia transesofagea, alla TC e nei casi dubbi all'aortografia durante valvuloplastica con pallone calibrato. La procedura è stata eseguita per via transapicale o transfemorale. Tutti i 104 pazienti sono stati sottoposti ad impianto di protesi “Balloon-expandable” Edwards Sapien o Sapien XT.
Le variabili dicotomiche sono espresse come percentuale, e sono state analizzate mediante test di Fisher. Le variabili continue sono espresse come media, e sono state analizzate mediante test di Student. Il rischio di leak paravalvolare nel singolo paziente è stato valutato a priori in base a fattori di rischio noti riportati in letteratura. Il ruolo dei fattori potenzialmente associati ad un aumentato rischio di leak paravalvolare è stato inoltre testato mediante regressione logistica. I fattori che all'analisi univariata sono risultati associati ad un rischio aumentato di leak (p<0.05), quelle in cui l'associazione pur non essendo provata è apparsa molto probabile (p<0.1) e quelle il cui ruolo è riconosciuto nella letteratura internazionale sono state inserite nella regressione logistica. Tutti i dati presentati nello studio sono stati raccolti in modo prospettico.
La performance del TAVI team è stata monitorata mediante “CUSUM charts”. Il metodo impiegato è quello descritto da Rogers e collaboratori. Il monitoraggio si è basato su due degli end-points riconosciuti dal “Valve Academy Research Consortium 2” e cioè “Procedural success” ed “Early safety endpoint”. A partire dal quarantesimo paziente, per monitorare selettivamente l'incidenza di leak paravalvolare, è stato monitorato un terzo end-point composito costituito da “Procedural success” ed assenza di leak paravalvolare.
Risultati
L'età media dei pazienti all'impianto era di 81.3±3.6 anni e 51 pazienti erano di sesso maschile. In 44 pazienti la procedura è stata eseguita per via transapicale, ed in 60 per via percutanea
sviluppato complicanze maggiori.
Ventinove pazienti (27,8%) sono stati considerati a priori ad alto rischio di sviluppare leak paravalvolare in base alla presenza di fattori di rischio noti (calcificazioni anulari massive e/o asimmetriche, anulus “Border-line”, anulus ellittico). Di questi, 19 (65,5%) presentavano un leak significativo al primo controllo post-impianto (vs . 21,3% nei pazienti non ad alto rischio, p<0.01). In 29 pazienti la protesi è stata ridilatata mediante catetere da valvuloplastica. La manovra è risultata efficace in 18 pazienti. In ventuno pazienti a fine procedura era ancora presente un leak paravalvolare significativo.
Il monitoraggio della curva d'apprendimento mediante CUSUM charts ha dimostrato la presenza di due “Cluster” di insuccessi. Il primo tra le procedure 1 e 17, ed il secondo tra le procedure 34 e 42. In entrambi i casi sono stati indetti Audit che hanno portato all'identificazione di problemi tecnici (nel primo caso) e nella selezione dei pazienti (nel secondo caso). In enrambi i casi l'Audit ha portato alla soluzione del problema.
Di converso, la curva per il monitoraggio dell'endpoint “Procedural success + assenza di leak paravalvolare” è rimasta sempre al di sopra della linea di “Controllo” (“Reassurance line”), e nonostante ripetuti Audit l'incidenza di leak paravalvolare è sempre rimasta superiore al livello accettabile posto a priori al 10%, sebbene a partire dalla procedura n. 105 si sia osservata un'inversione del trend, forse in relazione con l'introduzione di protesi di seconda generazione.
Conclusioni.
Il rischio di leak paravalvolare dopo TAVI può essere stimato accuratamente in base a caratteristiche cliniche ed anatomiche del paziente, ma nonostante questo sia le manovre preventive che quelle messe in atto nel tentativo di risolvere il problema (postdilatazione, espansione della protesi con volume aumentato o ridotto) si sono dimostrate nella nostra esperienza scarsamente efficaci. Nella nostra esperienza l'impiego delle CUSUM chart si è dimostrato estremamente utile in generale, ma non è servito a prevenire l'occorrenza di questa specifica complicanza. I dispositivi di seconda
generazione, molti dei quali dotati di specifici accorgimenti tecnologici mirati alla prevenzione del leak paravalvolare, potrebbero offrire un mezzo per ridurre l'incidenza di questa complicanza.
Introduzione
Inizialmente descritto nel 2002 (1), e diffuso in clinica a partire dal 2005 con lo sviluppo degli approcci transfemorale (2) e transapicale (3), l'impianto di protesi aortica transcatetere
(Transcatheter Aortic Valve Implantation, TAVI) è rapidamente divenuto una valida alternativa alla chirurgia convenzionale in pazienti selezionati ad alto rischio o inoperabili con stenosi aortica severa sintomatica (4-6).
La TAVI rimane però procedura complessa, che richiede l'acquisizione di nuove abilità tecniche e la stretta cooperazione tra specialità differenti. Per tale motivo, il monitoraggio della performance e della “Learning curve” degli operatori coinvolti è essenziale. La TAVI è infatti associata ad
un'aumentata incidenza di specifiche complicanze rispetto alla chirurgia convenzionale. Tra queste, alcune sono chiaramente in relazione alla curva d'apprendimento (complicanze legate all'accesso, malposizione o embolizzazione della protesi) (6-8), mentre altre appaiono meno operatore-dipendenti e tendono a verificarsi con una certa frequenza anche nelle mani degli operatori più esperti. Tra queste, i disturbi del ritmo cardiaco ed il leak paravalvolare sono le più importanti e frequenti (8, 9).
Il presente studio è stato sviluppato per analizzare l'incidenza di leak paravalvolare in pazienti sottoposti a TAVI con protesi transcatetere “Balloon-Expandable”, con particolare riguardo allo studio dei fattori in grado di predire l'occorrenza di tale complicanza, ed alla valutazione di efficacia delle manovre mirate a correggerla o risolverla.
Pazienti e Metodi
A partire dal Gennaio 2010, presso l'Ospedale del Cuore “G. Pasquiucci”, Fondazione Toscana “G. Monasterio” è stato istituito un programma TAVI comprendente un ambulatorio dedicato ed un “Heart Team” costituito da un cardiochirurgo, un cardiologo interventista, un cardiologo clinico ed un anestesista. Tutti i pazienti con stenosi aortica severa sintomatica ritenuti inoperabili o ad alto rischio (tabella 1) vengono indirizzati ad un protocollo di screening basato sui seguenti passaggi:
1. valutazione ambulatoriale congiunta cardiologo-cardiochirurgo ed ecocardiografia transtoracica
2. Esecuzione di altri esami clinico-strumentali e laboratoristici qualora indicato per escludere o stadiare significative comorbidità (visita pneumologica e PFR, valutazione neurologica, valutazione oncologica...)
3. Esecuzione di angio-TC del torace, dell'addome e degli assi arteriosi iliaco-femorali
4. Rivalutazione ambulatoriale mirata a definire l'indicazione al trattamento della valvulopatia e la possibilità di procedere ad impianto di una protesi transcatetere
5. Discussione congiunta e valutazione del caso da parte dell'”Heart Team”.
Sono stati sottoposti a TAVI pazienti considerati inoperabili o ad alto rischio chirurgico in base ad un'accurata valutazione multidisciplinare (tabella 1). Una volta confermata la presenza di stenosi aortica severa sintomatica, i pazienti ritenuti ad alto rischio o inoperabili con un'aspettativa di vita di almeno un anno ed in assenza di comorbidità tali da compromettere in maniera significativa la qualità della vita e la vita di relazione, sono stati indirizzati a TAVI. I primi 104 pazienti consecutivi sottoposti a TAVI con protesi “Balloon-expandable” presso il nostro centro costituiscono la
popolazione in esame.
Valutazione pre-procedurale e scelta dell'accesso
Presso il nostro centro è stata adottata una politica per la scelta dell'accesso del tipo “Femoral First”, e cioè i pazienti venivano indirizzati alla procedura transapicale solo in presenza di condizioni tali
da precludere o rendere molto problematico l'accesso per via percutanea transfemorale. La scelta dell'accesso si è basata sull'esame degli assi vascolari alla TC operata congiuntamente dal
cardiologo interventista e dal cardiochirurgo. In presenza di grave vasculopatia aterosclerotica degli arti inferiori, di arterie femorali di piccolo calibro o estremamente tortuose si è preferito procedere per via transapicale, mentre in presenza di grave broncopneumopatia cronica si è preferito in ogni caso procedere per via extratoracica, transfemorale o, quando non possibile, transascellare.
“Sizing” della protesi transcatetere
Nella nostra esperienza, la scelta della misura della protesi da impiantare si è basata sempre su una valutazione multimodale comprendente l'ecocardiografia transtoracica e transesofagea, la angio-TC cardiaca e l'aortografia durante valvuloplastica con pallone calibrato. In presenza di una TC di buona qualità, la misura dell'area del “Virtual basal ring” è stata considerata il parametro guida per la scelta della protesi da impiantare. Nei casi dubbi si è fatto affidamento sull'ecocardiografia transesofagea, quando disponibile, ed eventualmente sulla misurazione invasiva dell'anulus con il pallone da valvuloplastica.
Tecnica chirurgica
Le procedure transfemorali (60 pazienti) sono state eseguite nel laboratorio di emodinamica. In 26 pazienti la procedura è stata eseguita in anestesia generale, mentre in 34 pazienti la procedura è stata eseguita in sedazione con anestesia locale. Nei primi la procedura è sempre stata monitorizzata con l'ecocardiografia transesofagea, mentre nei secondi l'ecografia transesofagea è stata impiegata al bisogno. L'accesso è stato preparato con dispositivi di emostasi preimpiantabili tipo Perclose Prostar XL (Abbott Vascular, Abbott Park, Illinois, USA). Un apposito introduttore arterioso è stato introdotto per via percutanea su guida “Amplaz Extra-stiff” (Cook Medical Europe, Limerick, Ireland). Un catetere “Pig Tail” è stato introdotto dall'arteria femorale controlaterale e portato a livello dell'aorta ascendente. Dallo stesso lato, un elettrocatetere per stimolazione temporanea è
stato avanzato fino al ventricolo destro dalla vena femorale e testato. Una volta ottenuta una
proiezione angiografica adeguata (con il nadir delle tre cuspidi sullo stesso piano), la valvola aortica è stata sondata con una guida retta “Soft-tip” orientata mediante un catetere “Amplatz”. La guida è stata sostituita con una guida “Extra-stiff” precedentemente curvata. La valvola è stata quindi predilatata durante un periodo di stimolazione ventricolare rapida con un apposito pallone da valvuloplastica (Edwards Lifesciences, Irvine, CA; Cristal Balloon, BALT, Montmorency, France). Ottenuta un'adeguata predilatazione, si è proceduto all'impianto della protesi transcatetere
selezionata.
Le procedure transapicali (44 pazienti) sono state eseguite in sala operatoria, con un angiografo portatile (Philips Pulsera, Philips, The Nederlands). In tutti i pazienti sono state impiegate
l'anestesia generale e l'ecocardiografia transesofagea. L'apice cardiaco è stato esposto mediante una minitoracotomia sinistra al quinto o al sesto spazio intercostale. Una volta marsupializzato il pericardio, si è proceduto a confezionare due borse di tabacco concentriche in Prolene 3/0. L'apice veniva quindi punto con un apposito ago angiografico, attraverso il quale una guida a J veniva introdotta in aorta e portata fino al carrefour aortoiliaco. La guida veniva quindi sostituita con una guida “Extra-stiff” usando un catetere “Judkins” per protezione. Sulla guida “Extra-stiff” veniva avanzato un introduttore dedicato attraverso il quale si procedeva alla predilatazione con pallone e poi all'impianto della protesi prescelta, sempre durante stimolazione ventricolare rapida con
elettrodi epicardici. Una volta confermato il corretto posizionamento della protesi si procedeva alla rimozione dell'introduttore, alla chiusura delle borse di tabacco, ed alla ricostruzione della parete toracica secondo i piani anatomici, su drenaggio declive.
Monitoraggio intraprocedurale e postoperatorio e definizione degli outcome
L'ecocardiografia transesofagea è stata impiegata per il monitoraggio di tutte le procedure
transapicali e nelle prime 26 procedure percutanee. Negli ultimi 34 impianti percutanei il risultato finale è stato valutato con l'ecocardiografia transtoracica e l'angiografia, e l'ecografia transesofagea
è stata impiegata al bisogno.
La presenza e l'entità del rigurgito paravalvolare aortico è stata stimata all'aortografia con il metodo di Sellers, ed all'ecocardiografia mediante una valutazione multiparametrica fondata sulla
misurazione di una serie di parametri semi-quantitativi tra cui la larghezza del jet di rigurgito, la sua densità ed il “Pressure Half-time”, l'estensione circonferenziale in gradi del leak nella parasternale asse corto, la presenza di inversione di flusso in aorta discendente, ed il volume e la frazione rigurgitante, come definiti dal “VARC-2 consensus document” (tabella 2) (10, 11). Il volume rigurgitante è stato calcolato come la differenza tra la gittata sistolica a livello di qualsiasi valvola continente (efflusso ventricolare destro, valvola mitrale) e la gittata sistolica attraverso l'efflusso ventricolare sinistro. Infine, il carico emodinamico derivante dalla presenza di insufficienza aortica residua è stato valutato mediante il calcolo dello ”Aortic Index”, come descritto da Patzalis e collaboratori (12):
Aortic Index = (Pressione diastolica aortica – pressione telediastolica ventricolare sinistra) / Pressione sistolica aortica
Un Aortic Index minore di 25 è considerato indice di un rigurgito aortico significativo.
Fattori di rischio e gestione del rigurgito paravalvolare aortico
La presenza di diverse caratteristiche preprocedurali è considerata associata ad un aumentato rischio di rigurgito paravalvolare aortico dopo impianto di protesi transcatetere. In particolare, i seguenti sono considerati fattori di rischio: dimensioni dell'anulus aortico, grado di ellitticità dell'anello, presenza ed entità delle calcificazioni delle cuspidi e dell'anulus, simmetricità e distribuzione delle calcificazioni (9-14). A partire dalla procedura n. 46, tali fattori sono stati considerati durante la fase di screening dei pazienti, per definire a priori il rischio di rigurgito paravalvolare aortico.
I pazienti considerati ad alto rischio di sviluppare rigurgito paravalvolare ma indirizzati comunque ad impianto di protesi transcatetere sono stati gestiti secondo protocollo, tentando di impostare la procedura in modo da ridurre al minimo il rischio di rigurgito paravalvolare aortico. In quest'ottica
sono state liberamente impiegate le seguenti contromisure: (a) misurazione intraprocedurale dell'anello mediante valvuloplatica con pallone calibrato (13, 15); (b) gonfiaggio con volume modificato rispetto al volume nominale prescritto dalla casa produttrice (da -3 a +3 ml di soluzione) per migliorare l'adesione della protesi all'anulus; (3) postdilatazioni ripetute con pallone di
dimensioni crescenti (9).
Controllo di qualità e auditing
La TAVI è una procedura complessa, che richiede l'acquisizione di nuove abilità tecniche e la stretta cooperazione tra specialisti di diversi settori. Per tale motivo, il monitoraggio della performance e della “Learning curve” degli operatori coinvolti è essenziale. Fin dalla sua introduzione, il
programma TAVI della nostra istituzione è stato sottoposto a controllo di qualità mediante il sistema delle “Cumulative sum observed minus expexted failure (“CUSUM) charts”. Le curve CUSUM rappresentano l'andamento della performance di un individuo, di un team o di un processo in forma di grafico lineare in cui sull'asse delle ascisse è riportata la sequenza temporale delle procedure, mentre sulle ordinate è riportato il “CUSUM score”. Quest'ultimo è definito come Sn=(Xi –p0), dove Xi=0 per ogni procedura non complicata, ed Xi=1 per ogni insuccesso. Il grafico comincia al punto 0, ed il valore del “CUSUM score” aumenta di 1-p0 per ogni insuccessi, e diminuisce di p0 ad ogni successo. p0 rappresenta il tasso di insuccesso che può essere attribuito alla normale fluttuazione casuale degli eventi, ed è quindi ritenuto accettabile (“acceptable failure rate”). In questo studio p0 è stato impostato al 10% per tutti gli endpoint considerati. Oltre alla curva CUSUM, sul grafico sono state riportate la “Reassurance line” o “Lower boundary line”, il superamento della quale indica che l'incidenza dello specifico endpoint in esame è minore della “Acceptable failure rate”, e due “Alert line”, il superamento delle quali indica che il tasso di insuccesso è maggiore del 20% e del 25%, rispettivamente. Le CUSUM chart sono un sistema molto intuitivo per il controllo di qualità, poiché rendono molto facile la detezione di anomali tassi di insuccesso: una decisa impennata della curva sta infatti ad indicare un aumento del tasso di
insuccesso mentre la costante e graduale discesa della curva indica che il processo tende alla fase di controllo. Le CUSUM chart impiegate per il controllo di qualità nel presente studio sono state costruite mediante algoritmi preimpostati su Microsoft Excel, secondo il “Tutorial” di Rogers e collaboratori (Appendice A) (16).
Definizione degli endpoint
Il primo passo per l'analisi della curva d'apprendimento è la scelta degli endpoint da monitorare, e la definizione di successo ed insuccesso. La mortalità ospedaliera è solo il più estremo degli insuccessi procedurali, e non può quindi essere considerato come l'unico indicatore di qualità nel monitorare la performance e la curva di apprendimento del TAVI team. Per tale motivo, abbiamo scelto due endpoint più sensibili mirati alla analisi del tasso di successo tecnico della procedura (successo procedurale) ed alla valutazione complessiva dei risultati a 30 giorni (assenza di complicanze maggiori). La definizione di questi endpoint è riportata in tabella 3.
Il tasso di incidenza di alcune complicanze tipiche della TAVI (complicanze legate all'accesso, necessità di pace-maker, malposizione / embolia della protesi, rottura / dissezione aortica, TIA /ictus, Complicanze coronariche, leak paravalvolare) è stato inoltre sottoposto selettivamente a monitoraggio. Una CUSUM chart specifica per il monitoraggio del tasso di leak paravalvolare è stata introdotta durante un audit indetto a seguito di un insuccesso (procedura n. 46), con la procedura apparentemente in controllo (come indicato dalla CUSUM chart relativa al successo procedurale). In tal sede infatti fu evidenziato un tasso di leak paravalvolare lieve o lieve moderato (<2+) decisamente superiore all'atteso. Per tale motivo abbiamo introdotto il monitoraggio
dell'endpoint composito “Successo procedurale + assenza di leak paravalvolare”.
Analisi statistica
Le variabili dicotomiche sono espresse come percentuale, e sono state analizzate mediante test di Fisher. Le variabili continue sono espresse come media, e sono state analizzate mediante test di
Student. Il rischio di leak paravalvolare nel singolo paziente è stato valutato a priori in base a fattori di rischio noti riportati in letteratura. Il ruolo dei fattori potenzialmente associati ad un aumentato rischio di leak paravalvolare è stato testato mediante regressione logistica. I fattori che all'analisi univariata sono risultati associati ad un rischio aumentato di leak (p<0.05), quelle in cui
l'associazione pur non essendo provata è apparsa molto probabile (p<0.1) e quelle il cui ruolo è riconosciuto nella letteratura internazionale sono state inserite nella regressione logistica. Tutti i dati presentati nello studio sono stati raccolti in modo prospettico.
Risultati
Outcome della procedura e complicazioni
Le caratteristiche demografiche ed intraprocedurali della popolazione in esame sono riportate in tabella 4. L'età media era di 81.3±3.6 anni, e 51 pazienti erano di sesso maschile (49%). 60 procedure sono state eseguite per via percutanea e 44 (42.3%) per via transapicale. Sei pazienti furono sottoposti a TAVI per degenerazione di una bioprotesi aortica (“Valve-in-valve”) (5.7%), e 4 (3.8%) furono sottoposti a procedure associate (PTCA, 2; CABG, 2).
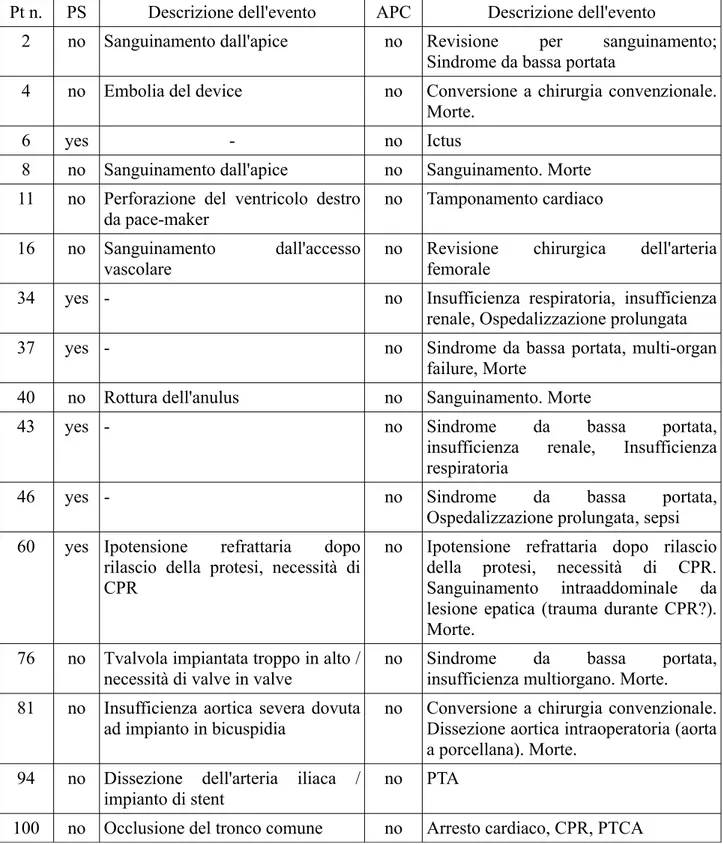
Sette pazienti morirono a seguito della procedura (6.7%) e 16 (15.4%) presentarono complicanze maggiori. Tutte le complicanze e gli eventi avversi registrati in questa serie di pazienti sono riportate in tabella 5.
Identificazione dei fattori di rischio
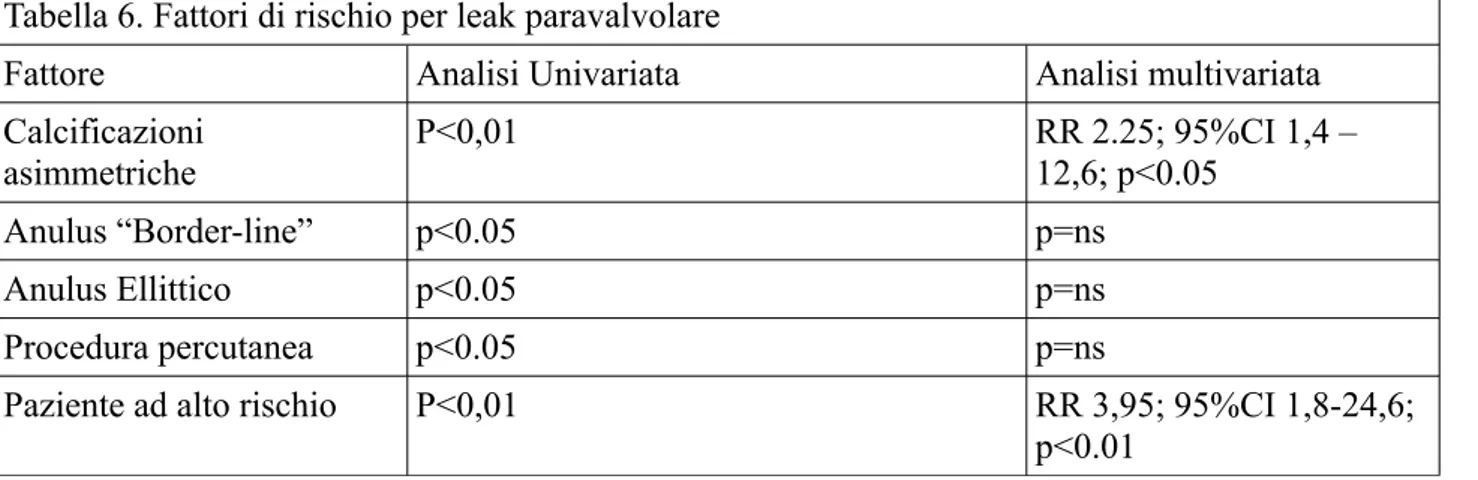
In sede di screening preprocedurale, 29 pazienti (27,8%) furono ritenuti esposti ad un rischio significativo di leak paravalvolare. In 19 di questi (65,5%) dopo l'iniziale rilascio della protesi transcatetere era presente un leak paravalvolare più che triviale (contro il 21, 3% dei pazienti non considerati ad alto rischio, p<0.01). All'analisi univariata, i seguenti fattori risultavano
significativamente associati con un aumentato rischio di leak paravalvolare: presenza di
calcificazioni asimmetriche (p<0.01), anulus “Border-line” (p<0.05), anulus ellittico (rapporto tra i diametri minimo e massimo del virtual basal ring < 0.7, p<0.05); impianto per via percutanea (p<0.05), paziente considerato a rischio di leak paravalvolare (p<0.01). All'analisi multivariata rimanevano significativamente associati ad un rischio aumentato di leak paravalvolare la presenza di calcificazioni asimmetriche, la presenza di anulus “Border-line” e il rischio di leak stimato a priori.
In tutto, trentacinque pazienti (33,6%) presentavano un rigurgito aortico significativo dopo l'iniziale rilascio della valvola. In tre di questi (pazienti n. 4, 76 ed 81, tabella 4) il rigurgito era di entità tale da precludere il successo procedurale e da richiedere ulteriori manovre terapeutiche. Gli altri
presentavano un rigurgito non tale da precludere il successo procedurale (<2+), ma tuttavia significativo (figura 1).
In 29 pazienti si è proceduto alla post-dilatazione della protesi impiantata. Questa manovra ha portato alla scomparsa del leak in 4 pazienti, a una significativa riduzione del grado di insufficienza aortica in 14, e non ha modificato il risultato in 11. A fine procedura, 21 pazienti (20,2%)
presentavano ancora un rigurgito aortico significativo.
Analisi della curva di apprendimento e monitoraggio della performance
Il successo procedurale è stato ottenuto in 94 pazienti (90,4%). La CUSUM chart per il successo procedurale è riportata in figura 2. Durante i primi 17 impianti furono registrati 5 insuccessi, da riferire verosimilmente alla curva di apprendimento degli operatori (tabella 4). Dopo questa fase iniziale di apprendimento, la procedura è entrata in fase di controllo e la CUSUM line ha
attraversato la “Reassurance line” dopo la procedura n. 41. Nonostante 5 ulteriori insuccessi relativi alle procedure 40, 76, 81, 94 e 100 (figura 2, tabella 4), la CUSUM line non ha mai riattraversato la “Reassurance line”. Va sottolineato che I pazienti n. 21, 27, 42, 47, 51, 55, 63, 66, 69, 71, 78, 85, 89, 99 e 102 hanno lasciato la sala con un significativo rigurgito paravalvolare di entità però non tale da configurare un insuccesso procedurale.
La CUSUM chart per l'endpoint “Assenza di complicanze” è riportata in figura 3. L'analisi della curva dimostra che la fase di apprendimento si è completata dopo circa 70 procedure. In particolare, la “Reassurance line” è stata attraversata alla procedura n. 69. L'analisi di questa curva dimostra una prima fase ascendente con attraversamento della “Alert line”, verosimilmente legata alla curva di apprendimento “Tecnica”. La curva presenta quindi una fase discendente costante interrotta, dopo 18 procedure non complicate, da un nuovo cluster di 5 insuccessi molto ravvicinati, indicante la perdita del controllo sulla procedura. Una attenta analisi degli eventi avversi dimostrò che quattro dei cinque insuccessi non erano in relazione con problemi relativi alla tecnica di impianto, ma al profilo di rischio eccessivamente elevato ed alla estrema fragilità dei pazienti trattati. Un Audit
identificò nell'inappropriata selezione dei pazienti e nella mancanza di un team per la gestione post-procedurale dedicato le possibili cause di insuccesso (Figura 3, Tabella 5). L'identificazione e la correzione di questi due problemi portò ad una rapida discesa della curva CUSUM, la “Reassurance line” fu attraversata alla procedura n. 69, e la procedura è successivamente rimasta in controllo nonostante quattro ulteriori insuccessi alle procedure n. 76, 81, 94 e 100.
La CUSUM chart per l'assenza di leak paravalvolare è riportata in figura 4. La curva mostra numerosi tratti ascendenti successivi, e la “Reassurance line non è mai attraversata, ad indicare che l'incidenza di rigurgito paravalvolare significativo è sempre rimasta maggiore del 10%, e cioè del valore definito a priori come tasso di insuccesso accettabile. Non è presente, inoltre, alcun trend positivo nel periodo esaminato.
Discussione
Il presente studio dimostra che (a) il rischio di leak paravalvolare può essere determinato a priori con buona accuratezza nel singolo paziente candidato a TAVI; e (b) Le manovre preventive e correttive messe in opera per prevenire o risolvere l'occorrenza di questa complicanza sono scarsamente efficaci.
Fin dall'introduzione della TAVI è apparso evidente che tale metodica era associata ad un rischio di rigurgito aortico paravalvolare significativamente maggiore rispetto a quanto osservato dopo la sostituzione valvolare aortica chirurgica convenzionale, ed anzi un rigurgito di grado lieve moderato è stato a lungo considerato tollerabile e comunque vantaggioso rispetto alla presenza di una stenosi aortica severa. Ancora nel 2010, era esperienza comune incontrare sui testi specialistici frasi come la seguente :
“We will discuss only the management of grade ≥ 2+ following correct implantation of the valve. Albeit not a true complication, AR grade ≥ 2+ on control angiogram or TEE is not rare (>20% of
overall cases)” (17).
I fatti hanno purtroppo dimostrato che le cose non sono esattamente così: numerosi lavori hanno confermato che un rigurgito paravalvolare di grado più che lieve è sicuramente associato ad un significativo peggioramento della sopravvivenza. Tamburino e collaboratori, in una analisi su 663 pazienti sottoposti ad impianto di protesi Medtronic Corevalve, hanno trovato che la presenza di un leak paravalvolare ≥ 2+ era associato ad un significativo aumento della mortalità ad un anno, con un rischio relativo di 3,7 (18). Tale reperto è stato successivamente confermato da De Carlo e
collaboratori (19). Più recentemente, in una analisi combinata delle coorti del “PARTNER trial” presentata al congresso della European Society of Cardiology del 2013, Kodali e collaboratori hanno dimostrato un significativo impatto sulla mortalità a un anno del rigurgito paravalvolare moderato severo (RR=2,7), ma anche del rigurgito paravalvolare di grado lieve (RR=1,6; p<0.001)
(20). Tale reperto è stato ribadito da una recente meta-analisi su 45 studi (12926 pazienti totali), che ha confermato gli effetti negativi del rigurgito moderato severo, ed ha richiamato nuovamente l'attenzione sul rigurgito paravalvolare di grado lieve, definito come < 2+ (21). Ancora più rilevante è quest'osservazione se si considera che secondo una recente review, un rigurgito lieve è presente nel 8-40% dei pazienti sottoposti a TAVI, ed un rigurgito moderato nel 5-38% (22).
Oltre che incidere negativamente sulla mortalità periprocedurale e ad un anno, la presenza di un leak paravalvolare significativo comporta un significativo peggioramento della qualità della vita. Abdel Wahab e collaboratori hanno riportato che pazienti con rigurgito residuo ≥ 2+ tendono ad avere punteggi più bassi all'EuroQol 5d, ed in particolare tendono ad avere mobilità e capacità di cura di se stessi significativamente ridotte rispetto ai pazienti senza rigurgito residuo. Inoltre, quasi il 20% dei pazienti con rigurgito residuo ≥ 2+ (vs 7,7% di quelli senza, p<0.001) considerava il proprio stato di salute peggiore rispetto a prima dell'impianto (23).
Nella nostra casistica, un rigurgito aortico residuo ≥ 2+ (tale da comportare un insuccesso procedurale) era presente in tre pazienti (tabella 5). Nel primo (paziente 4) il rigurgito, di grado massivo, era verosimilmente in relazione ad un errore nel sizing, con scelta di una protesi troppo piccola. Nel secondo (paziente 76) era dovuto ad un errore tecnico (impianto troppo alto della protesi). Il terzo paziente (81) aveva una valvola bicuspide ed era stato sottoposto ad impianto compassionevole in mancanza di alternative percorribili. Altri 18 pazienti presentavano, al termine della procedura, un rigurgito significtaivo, ma non ≥ 2+. In 14 di questi il rischio di leak
paravalvolare era stato etichettato come “Alto” in fase di screening. Numerosi fattori sono stati chiamati in causa nella genesi del leak paravalvolare (19, 21, 22). Lo “Aortic area cover index” esprime il grado di “Oversizing” della protesi transcatetere rispetto al diametro dell'anello aortico (CI= (P-A)/A%, dove A=diametro dell'anello aortico, P diametro della protesi). Il mancato o insufficiente “Oversizing” della protesi è stato ripetutamente chiamato in causa come fattore causativo del leak, soprattutto nelle casistiche più datate (21, 22, 24-26). Più recentemente, con la diffusione della TC come metodo di scelta per la misurazione dell'anello aortico, il valore predittivo
dell “Area cover index” è stato rivisto. E' emersa però come fattore predittivo di leak paravalvolare la presenza di un anello aortico di dimensioni “Border line”, fattore che comporta ovvie difficoltà nella scelta della misura della protesi da impiantare (27). Questo fattore è risultato
significativamente associato ad un maggior rischio di insufficienza aortica residua nella nostra casistica. Anche la presenza di calcificazioni anulari massive e/o asimmetriche è risultata, nella nostra esperienza, significativamente associata ad un più alto rischio di leak paravalvolare. Questo risultato è in accordo con i dati della letteratura (21, 22), e dimostra ulteriormente che il principale meccanismo del leak paravalvolare dopo TAVI, se si escludono gli errori tecnici legati al sizing ed alla malposizione della protesi transcatetere, è costituito dalla inadeguata apposizione dello stent valvolare, che è circolare e regolare, all'anello aortico nativo, che è ellittico, ed irregolare. Infine, l'ultimo fattore significativamente associato ad un rischio di leak aumentato nella nostra casistica è stato il giudizio degli operatori basato sullo studio degli esami pre-procedurali. Nella nostra
esperienza i pazienti considerati ad alto rischio avevano un rischio di circa 4 volte maggiore rispetto ai pazienti non ad alto rischio di lasciare la sala con un rigurgito paravalvolare (tabella predittori leak). Nonostante tutti i limiti di un'osservazione non randomizzata, non in doppio cieco e fondata su un parametro non quantitativo, riteniamo comunque che questo reperto confermi l'ipotesi che il rischio di leak paravalvolare può essere accuratamente stimata a priori.
Alcune manovre sono state introdotte allo scopo di prevenire o trattare il leak paravalvolare dopo TAVI. Tra le prime, oltre al già menzionato “Sizing” basato sulla TC, vanno ricordati il sizing durante valvuloplastica aortica con pallone calibrato ed l'espansione della protesi con palloni di volume adeguatamente adattato. Il Sizing all'aortografia durante valvuloplastica, inizialmente descritto da Cribier (17), e successivamente perfezionato da Babaliaros e da altri autori (15, 28, 29), consiste nell'eseguire un'aortografia durante valvuloplastica aortica con un pallone di volume noto. Tale manovra consente di ottenere preziose informazioni sull'anatomia della radice aortica e sul comportamento dinamico della valvola aortica e dell'anello durante il gonfiaggio. La comparsa di un'impronta sul pallone, l'aumento della pressione all'interno del pallone e l'assenza di jet da
rigurgito tra il pallone e l'anulus sono tutti indicatori dell'adeguatezza del diametro scelto. La manovra può eventualmente essere ripetuta con palloni di volume crescente, e consente di selezionare una protesi di dimensioni adeguate nei casi dubbi. Patsalis e collaboratori hanno riportato una riduzione significativa dell'incidenza di leak con questa metodica (28). Noi abbiamo descritto un metodo per il sizing basato sulla valvuloplastica nel 2012, ed abbiamo integrato con questo dato le misurazioni ottenute con le altre metodiche di imaging nella grande maggioranza dei pazienti (13, 29). Se questo abbia in qualche modo modificato l'outcome nella nostra casistica non è possibile stabilirlo. Sicuramente però nonostante il ricorso a questa manovra l'incidenza di leak paravalvolare <2+ è rimasta significativa.
Nei pazienti con anello aortico “Border-line” alcuni autori hanno suggerito di scegliere la protesi con diametro maggiore e gonfiarla in prima istanza con un volume leggermente inferiore rispetto a quanto prescritto dal bugiardino, in modo da ridurre il rischio di rottura dell'anello.
Alternativamente, è possibile sovraespandere la protesi più piccola con volumi leggermente maggiori di quanto prescritto (30). Entrambe queste manovre sono state impiegate con discreti risultati nella nostra esperienza, senza però riuscire ad abolire del tutto il problema.
La post-dilatazione della protesi mediante riespansione con pallone da valvuloplastica è senza dubbio la manovra correttiva più diffusa (17, 30). Nella nostra casistica la protesi impiantata è stata postdilatata in 29 pazienti, con risultati misti. Anche se non sono disponibili dati a sostegno di questa ipotesi, è verosimile che la postdilatazione possa essere più efficace quando il leak è dovuto a lieve sottodimensionamento della protesi o a calcificazioni simmetriche e concentriche, mentre tale manovra tende ad essere meno efficace (e potenzialmente più pericolosa) in presenza di calcificazioni asimmetriche e / o massive. Va comunque ricordato che la postdilatazione è una manovra invasiva associata ad un significativo rischio di complicanze, e che ,on è escluso che influenzi negativamente la durata della protesi impiantata (17). Inoltre studi recenti hanno dimostrato un significativo incremento del rischio di ictus a un anno dalla procedura (31).
ridurre l'incidenza degli eventi avversi. Tutti gli outcome negativi si verificano infatti con una certa frequenza anche nelle mani degli operatori più esperti. I processi di controllo di qualità intendono differenziare gli eventi avversi che si verificano per la normale fluttuazione casuale da quelli che invece avvengono a causa di un errore sistematico, e non sono quindi legati al caso (16). Le CUSUM chart sono un metodo semplice ed intuitivo per monitorare in tempo reale ed in modo prospettico il tasso di incidenza di un determinato fenomeno. Inizialmente introdotte negli anni 60 da Page per il controllo di qualità in contesto industriale (32), le CUSUM chart sono state impiegate con successo in ambito medico chirurgico, ed in particolare in cardiochirurgia (16, 33). Noi
abbiamo precedentemente impiegato questo metodo con ottimi risultati per monitorare la
performance di chirurghi giovani introdotti a nuove tecniche mini-invasive (34), ed è stato pertanto naturale impiegare le CUSUM chart per monitorare la performance del nostro TAVI team (35). Le CUSUM chart sono state inizialmente impiegate per monitorare un endpoint squisitamente tecnico (il successo procedurale, tabella 3) ed un endpoint che riflettesse efficacia e sicurezza della
procedura (assenza di complicanze, tabella 3). Come già discusso, l'identificazione di un distinto cluster di insuccessi in questa seconda curva ha portato alla convocazione di un audit ed alla correzione di problemi non tecnici, legati all'arruolamento dei pazienti ed alla loro gestione
nell'immediato post-impianto. A partire dalla procedura n. 46, avendo constatato che l'incidenza di leak significativo ma <2+ era rimasta elevata, abbiamo introdotto un terzo endpoint per monitorare selettivamente questo parametro. Sfortunatamente, nonostante la sorveglianza prospettica e
nonostante tre audit, non siamo riusciti a ridurre in modo significativo l'incidenza di leak
paravalvolare lieve e lieve-moderato (figura 4), e questo conferma ulteriormente la nostra ipotesi secondo cui il leak paravalvolare dopo TAVI è spesso prevedibile, ma non sempre evitabile.
Limitazioni
Il presente studio ha alcune importanti limitazioni. In primo luogo, gli endpoint analizzati sono leggermente diversi da quelli stabiliti dal VARC. Questo è dovuto al fatto che il primo “Consensus
document” del VARC è stato pubblicato più di un anno dopo l'inizio del nostro processo di monitoraggio. Tuttavia i nostri endpoint sono molto simili agli endpoint compositi riportati nel VARC-2 e cioè “Device success” (paragonabile al nostro successo procedurale) ed “Early safety” + “Clinical efficacy” (che appaiono combinati nel nostro assenza di complicanze) (11).
Un secondo limite del nostro studio consiste nel fatto che abbiamo impiegato CUSUM charts non “Risk-adjusted”. I vantaggi teorici e pratici delle chart “Risk-adjusted” sono molteplici, ed il più ovvio è rappresentato dalla possibilità di settare la “Acceptable failure rate” ad un livello
compatibile con l'incidenza di ogni specifico endpoint legata al caso (36, Appendice A). Tuttavia, le curve risk adjusted sono particolarmente utili in presenza di un adeguato modello di rischio, come ad esempio lo STS score per la valutazione del rischio operatorio in cardiochirurga. Infatti, l'analisi “Risk-adjusted” è di limitata utilità in presenza di modelli di rischio scadenti. Poichè nessuno degli score di rischio attualmente disponibili è adeguato per la popolazione dei pazienti sottoposti a TAVI, abbiamo preferito definire la “Acceptable failure rate” in base ai dati presenti in letteratura, che riportano un'incidenza di complicanze maggiori del 10-15%.
Il terzo e più significativo limite del nostro studio è legato al fatto che la nostra analisi ed il processo di monitoraggio sono stati focalizzati sul rigurgito paravalvolare solo dopo la procedura 46, e che i dati concernenti il rischio, i meccanismi e l'entità del rigurgito per i primi 46 pazienti, pur essendo stati raccolti in modo prospettico, sono stati analizzati retrospettivamente. Siamo comunque convinti che questo non abbia alterato in modo significativo i risultati del nostro studio. Infatti, la presenza e l'entità del rigurgito paravalvolare è sempre stata valutata da un ecografista indipendente. Inoltre, anche se la CUSUM chart per il rigurgito paravalvolare è stata in parte costruita in modo retrospettivo, tutti i dati impiegati erano stati raccolti in modo prospettico.
Prospettive future
La TAVI è una procedura di recente introduzione ed i progressi tecnici e tecnologici della metodica sono stati notevolissimi. Fatte salve alcune riserve legate alla possibilità che le protesi transcatetere
degenerino più velocemente delle protesi chirurgiche convenzionali, attualmente i principali limiti della metodica sono rappresentati dal prezzo dei dispositivi, che rimane ancora elevatissimo, e dal rischio di alcune complicanze specifiche. Tra queste, il leak paravalvolare è probabilmente quella su cui più si è richiamata l'attenzione della comunità medico-scientifica negli ultimi due anni.
Il riconoscimento del fatto che anche un leak paraprotesico di grado lieve può significativamente peggiorare l'outcome della procedura ha portato molte case produttrici a studiare varianti tecniche mirate a ridurre l'incidenza di questa complicanza, e molte delle così dette protesi di seconda generazione (Medtronic Engager, Symetis Acurate, CoreValve Evolut R, Edwards Sapien III, Boston Lotus, and Heart leaflet technology) presentato accorgimenti e caratteristiche
specificamente mirate alla prevenzione del leak (37). A partire dalla procedura 105 due di queste protesi sono state impiegate presso la nostra struttura, la Symetis ACURATE TA (5 pazienti) e la Sapien III (13 pazienti). I primi risultati sono stati estremamente incoraggianti (4 pazienti senza leak ed uno con un rigurgito <1+ con Symetis e 12 pazienti senza leak ed uno con rigurgito 1-2 + con Sapien III). Ulteriori e più approfondite analisi sono necessarie per confermare questo dato.
Conclusioni
Il rischio di leak paravalvolare dopo TAVI può essere stimato accuratamente in base a caratteristiche cliniche ed anatomiche del paziente, ma nonostante questo sia le manovre preventive che quelle messe in atto nel tentativo di risolvere il problema (postdilatazione, espansione della protesi con volume aumentato o ridotto) si sono dimostrate nella nostra esperienza scarsamente efficaci. Nella nostra esperienza l'impiego delle CUSUM chart si è dimostrato estremamente utile in generale, ma non è servito a prevenire l'occorrenza di questa specifica complicanza. I dispositivi di seconda generazione, molti dei quali dotati di specifici accorgimenti tecnologici mirati alla prevenzione del leak paravalvolare, potrebbero offrire in futuro un mezzo per ridurrne l'incidenza.
Bibliografia
1. Cribier A, Eltchaninoff H, Bash A, Borenstein N, Tron C, Bauer F, et al. Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific aortic stenosis: first human case description. Circulation. 2002;106:3006-8.
2. Webb JG, Chandavimol M, Thompson CR, Ricci DR, Carere RG, Munt BI, et al. Percutaneous aortic valve implantation retrograde from the femoral artery. Circulation. 2006;113:842-50.
3. Walther T, Falk V, Borger MA, Dewey T, Wimmer-Greinecker G, Schuler G, et al. Minimally invasive transapical beating heart aortic valve implantation--proof of concept. Eur J Cardiothorac Surg. 2007;31:9-15.
4. Leon MB, Smith CR, Mack M, Miller DC, Moses JW, Svensson LG, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med 2010;363:1597-1607.
5. Smith CR, Leon MB, Mack MJ, Miller DC, Moses JW, Svensson LG, et al. Transcatheter vs. Surgical Aortic Valve Replacement in High Risk Patients with Severe Aortic Stenosis. N Engl J Med 2011; 364:2187-98.
6. Tamburino C, Capodanno D, Ramondo A, Petronio AS, Ettori F, Santoro G, et al. Incidence and predictors of early and late mortality after transcatheter aortic valve implantation in 663 patients with severe aortic stenosis. Circulation 2011; 123:299-308.
7. Gurvitch R, Tay EL, Wijesinghe N, Ye J, Nietlispach F, Wood DA, Lichtenstein S, Cheung A, et al. Transcatheter aortic valve implantation: lessons from the learning curve of the first 270 high-risk patients. Catheter Cardiovasc Interv. 2011;78:977-84.
8. Stortecky S, Buellesfeld L, Wenaweser P, Windecker S. Transcatheter aortic valve
implantation: prevention and management of complications. Heart. 2012;98 Suppl 4:iv52-64.
aortic regurgitation after transcatheter aortic valve implantation. EuroIntervention 2013;9 Suppl S:S72-S76.
10. Ewe SH, Delgado V, Bax JJ. Imaging and quantification of aortic regurgitation after TAVI. EuroIntervention. 2012 Sep;8 Suppl Q:Q21-30.
11. Kappetein AP, Head SJ, Généreux P, Piazza N, van Mieghem NM, Blackstone EH, et al. Valve Academic Research Consortium-2. Updated standardized endpoint definitions for transcatheter aortic valve implantation: the Valve Academic Research Consortium-2 consensus document. J Thorac Cardiovasc Surg. 2013;145:6-23.
12. Patsalis PC, Konorza TF, Al-Rashid F, Plicht B, Riebisch M, Wendt D, et al. Incidence, outcome and correlates of residual paravalvular aortic regurgitation after transcatheter aortic valve implantation and importance of haemodynamic assessment. EuroIntervention.
2013;8:1398-406.
13. Cerillo AG, Mariani M, Berti S, Glauber M. Sizing the aortic annulus. Ann Cardiothorac Surg. 2012 Jul;1:245-56.
14. Athappan G, Patvardhan E, Tuzcu EM, Svensson LG, Lemos PA, Fraccaro C, et al. Incidence, predictors, and outcomes of aortic regurgitation after transcatheter aortic valve replacement: meta-analysis and systematic review of literature. J Am Coll Cardiol.
2013;61:1585-95.
15. Babaliaros VC, Junagadhwalla Z, Lerakis S, Thourani V, Liff D, Chen E, Vassiliades T, Chappell C, Gross N, Patel A, Howell S, Green JT, Veledar E, Guyton R, Block PC. Use of balloon aortic valvuloplasty to size the aortic annulus before implantation of a balloon-expandable transcatheter heart valve. JACC Cardiovasc Interv. 2010 Jan;3(1):114-8. 16. Rogers CA, Ganesh JS, Banner NR, Bonser RS; Steering Group. Cumulative risk adjusted
monitoring of 30-day mortality after cardiothoracic transplantation: UK experience. Eur J Cardiothorac Surg. 2005 Jun;27(6):1022-9.
valve implantation. Tips and tricks to avoid failure. New York:Informa Healhcare USA, INC, 2010:198-218.
18. Tamburino C, Capodanno D, Ramondo A, Petronio AS, Ettori F, Santoro G, Klugmann S, Bedogni F, Maisano F, Marzocchi A, Poli A, Antoniucci D, Napodano M, De Carlo M, Fiorina C, Ussia GP. Incidence and predictors of early and late mortality after transcatheter aortic valve implantation in 663 patients with severe aortic stenosis. Circulation. 2011 Jan 25;123(3):299-308.
19. De Carlo M, Giannini C, Fiorina C, Bedogni F, Napodano M, Klugmann S, Tamburino C, Maisano F, Santoro G, Ettori F, Petronio AS. Paravalvular leak after CoreValve implantation in the Italian Registry: predictors and impact on clinical outcome. Int J Cardiol. 2013 Oct 12;168(5):5088-9.
20. Kodali S. Analysis of the combined PARTNER cohorts. Abstract presented at the 2013 ESC Congress, Amsterdam, the Nederlands.
21. Athappan G, Patvardhan E, Tuzcu EM, Svensson LG, Lemos PA, Fraccaro C, Tarantini G, Sinning JM, Nickenig G, Capodanno D, Tamburino C, Latib A, Colombo A, Kapadia SR. Incidence, predictors, and outcomes of aortic regurgitation after transcatheter aortic valve replacement: meta-analysis and systematic review of literature. J Am Coll Cardiol. 2013 Apr 16;61(15):1585-95.
22. Lerakis S, Hayek SS, Douglas PS. Paravalvular aortic leak after transcatheter aortic valve replacement: current knowledge. Circulation. 2013 Jan 22;127(3):397-407.
23. Abdel Wahab M. Impact of aortic regurgitation after TAVI on thirty day mortality, morbidity and quality of life. An analysis from the German TAVI registry. Abstract presented at the 2011 ESC Congress, Paris, France.
24. Gripari P, Ewe SH, Fusini L, Muratori M, Ng AC, Cefal. C, Delgado V, Schalij MJ, Bax JJ, Marsan NA, Tamborini G, Pepi M. Intraoperative 2D and 3D transoesophageal
implantation. Heart. 2012;98:1229–1236.
25. Willson AB, Webb JG, Labounty TM, Achenbach S, Moss R, Wheeler M, Thompson C, Min JK, Gurvitch R, Norgaard BL, Hague CJ, Toggweiler S, Binder R, Freeman M, Poulter R, Poulsen S, Wood DA, Leipsic J. 3-dimensional aortic annular assessment by multidetector computed tomography predicts moderate or evere paravalvular regurgitation after
transcatheter aortic valve replacement: a multicenter retrospective analysis. J Am Coll Cardiol. 2012;59:1287–1294.
26. Detaint D, Lepage L, Himbert D, Brochet E, Messika-Zeitoun D, Iung B, Vahanian A. Determinants of significant paravalvular regurgitation after transcatheter aortic valve: implantation impact of device and annulus discongruence. J AM COLL CARDIOL. Cardiovasc Interv. 2009;2:821–827.
27. Binder RK, Webb JG, Willson AB, Urena M, Hansson NC, Norgaard BL, Pibarot P, Barbanti M, Larose E, Freeman M, Dumont E, Thompson C, Wheeler M, Moss RR, Yang TH, Pasian S, Hague CJ, Nguyen G, Raju R, Toggweiler S, Min JK, Wood DA, Rodés-Cabau J, Leipsic J. The impact of integration of a multidetector computed tomography annulus area sizing algorithm on outcomes of transcatheter aortic valve replacement: a prospective, multicenter, controlled trial. J Am Coll Cardiol. 2013 Jul 30;62(5):431-8. 28. Patsalis PC, Al-Rashid F, Neumann T, Plicht B, Hildebrandt HA, Wendt D, Thielmann M,
Jakob HG, Heusch G, Erbel R, Kahlert P. Preparatory balloon aortic valvuloplasty during transcatheter aortic valve implantation for improved valve sizing. JACC Cardiovasc Interv. 2013 Sep;6(9):965-71.
29. Cerillo AG, Mariani M, Glauber M, Berti S. Sizing the annulus for transcatheter aortic valve implantation: more than a simple measure? Eur J Cardiothorac Surg. 2012 Mar;41(3):717-8 30. Kalhert P. Addressing aortic regurgitation: longer term outcome and intermediate risk
patients. Abstract presented at the 2013 PCR London Valves Meeting, London, UK.
study. Abstract presented at the 2013 EuroPCR Meeting, Paris, France. 32.Page, E. S. Continuous Inspection Scheme. Biometrika 1954;41:100–115.
33. Noyez L. Control charts, Cusum techniques and funnel plots. A review of methods for monitoring performance in healthcare. Interact Cardiovasc Thorac Surg. 2009;9:494-9. 34. Murzi M, Cerillo AG, Bevilacqua S, Gasbarri T, Kallushi E, Farneti P, et al. Enhancing
departmental quality control in minimally invasive mitral valve surgery: a single-institution experience. Eur J Cardiothorac Surg. 2012;42:500-6.
35. Cerillo AG, Murzi M, Glauber M, Berti S. Quality control and the learning curve of transcatheter aortic valve implantation. JACC Cardiovasc Interv. 2012 Apr;5(4):456.
36. Novick RJ, Fox S, Stitt LW, Forbes TL, Steiner S. Direct comparison of risk-adjusted and non-risk-adjusted CUSUM analyses of coronary artery bypass surgery outcomes. J Thorac Cardiovasc Surg. 2006;132: 386-91.
37. Bourantas CV, Van Mieghem NM, Soliman O, Campos CAM, Iqbal J, Serruys PW. Transcatheter aortic valve update 2013. Eurointervention 2013;9:Suppl S:S84-S90.
Legende delle figure
Figura 1. (a) Leak paravalvolare di grado lieve. All'aortografia il jet opacizza 1/3 della camera ventricolare; (b) stesso paziente all'ecocardiografia; (c, d, e) leak paravalvolare di grado moderato alla aortografia ed all'eco; (f, g, h) rigurgito di grado severo all'aortografia ed all'ecocardiografia. Vedi anche tabella 2.
Figura 2. CUSUM chart per il successo procedurale.
Figura 3. CUSUM chart per l'assenza di complicanze post-procedurali.
Figura 4. CUSUM chart per l'endpoint composito "Successo procedurale + assenza di leak paravalvolare".
Tabelle
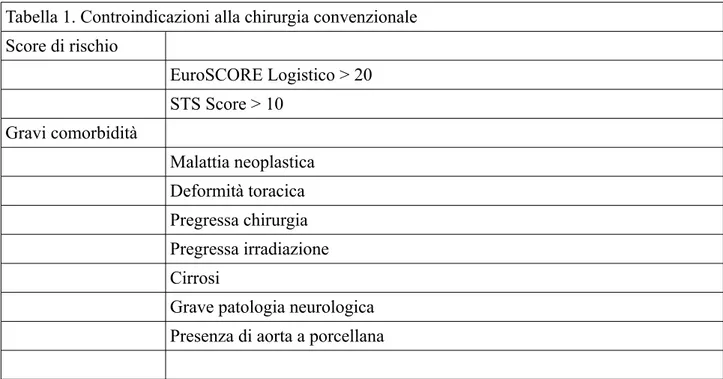
Tabella 1. Controindicazioni alla chirurgia convenzionale Score di rischio EuroSCORE Logistico > 20 STS Score > 10 Gravi comorbidità Malattia neoplastica Deformità toracica Pregressa chirurgia Pregressa irradiazione Cirrosi
Grave patologia neurologica Presenza di aorta a porcellana
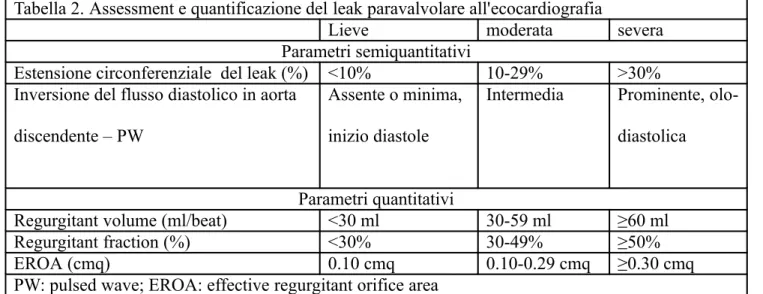
Tabella 2. Assessment e quantificazione del leak paravalvolare all'ecocardiografia
Lieve moderata severa
Parametri semiquantitativi
Estensione circonferenziale del leak (%) <10% 10-29% >30% Inversione del flusso diastolico in aorta
discendente – PW
Assente o minima, inizio diastole
Intermedia Prominente, olo-diastolica
Parametri quantitativi
Regurgitant volume (ml/beat) <30 ml 30-59 ml ≥60 ml
Regurgitant fraction (%) <30% 30-49% ≥50%
EROA (cmq) 0.10 cmq 0.10-0.29 cmq ≥0.30 cmq
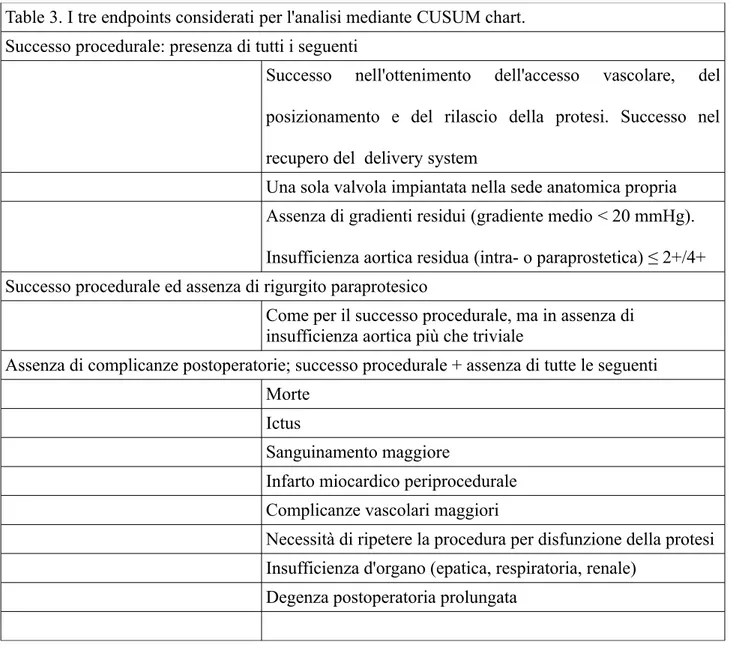
Table 3. I tre endpoints considerati per l'analisi mediante CUSUM chart. Successo procedurale: presenza di tutti i seguenti
Successo nell'ottenimento dell'accesso vascolare, del posizionamento e del rilascio della protesi. Successo nel recupero del delivery system
Una sola valvola impiantata nella sede anatomica propria Assenza di gradienti residui (gradiente medio < 20 mmHg). Insufficienza aortica residua (intra- o paraprostetica) ≤ 2+/4+ Successo procedurale ed assenza di rigurgito paraprotesico
Come per il successo procedurale, ma in assenza di insufficienza aortica più che triviale
Assenza di complicanze postoperatorie; successo procedurale + assenza di tutte le seguenti Morte
Ictus
Sanguinamento maggiore
Infarto miocardico periprocedurale Complicanze vascolari maggiori
Necessità di ripetere la procedura per disfunzione della protesi Insufficienza d'organo (epatica, respiratoria, renale)
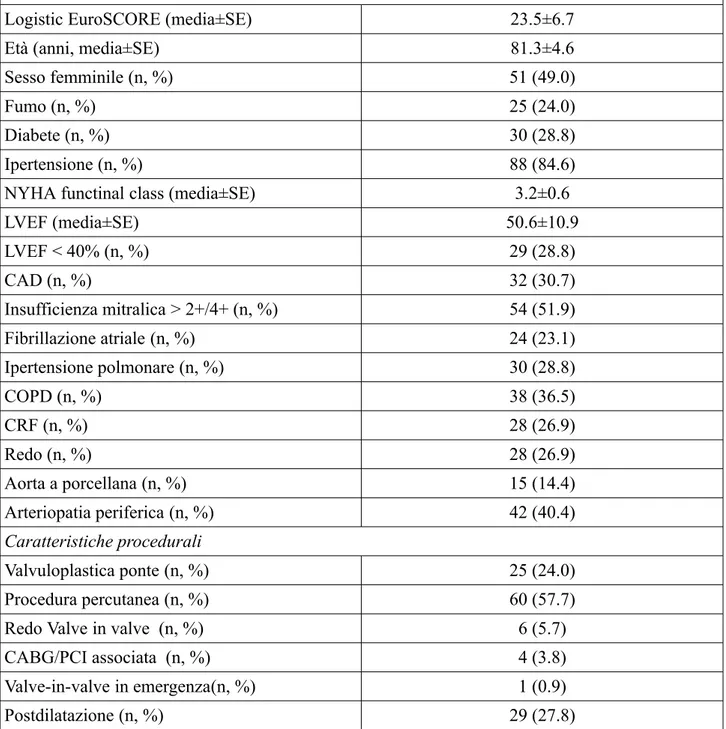
Table 3. Caratteristiche pre ed intra-procedurali Caratteristiche pre-procedurali
Logistic EuroSCORE (media±SE) 23.5±6.7
Età (anni, media±SE) 81.3±4.6
Sesso femminile (n, %) 51 (49.0)
Fumo (n, %) 25 (24.0)
Diabete (n, %) 30 (28.8)
Ipertensione (n, %) 88 (84.6)
NYHA functinal class (media±SE) 3.2±0.6
LVEF (media±SE) 50.6±10.9 LVEF < 40% (n, %) 29 (28.8) CAD (n, %) 32 (30.7) Insufficienza mitralica > 2+/4+ (n, %) 54 (51.9) Fibrillazione atriale (n, %) 24 (23.1) Ipertensione polmonare (n, %) 30 (28.8) COPD (n, %) 38 (36.5) CRF (n, %) 28 (26.9) Redo (n, %) 28 (26.9) Aorta a porcellana (n, %) 15 (14.4) Arteriopatia periferica (n, %) 42 (40.4) Caratteristiche procedurali Valvuloplastica ponte (n, %) 25 (24.0) Procedura percutanea (n, %) 60 (57.7)
Redo Valve in valve (n, %) 6 (5.7)
CABG/PCI associata (n, %) 4 (3.8)
Valve-in-valve in emergenza(n, %) 1 (0.9)
Postdilatazione (n, %) 29 (27.8)
NYHA: New York Heart Association, LVEF: Left ventricular ejection fraction, COPD: Chronic obstructive pulmonary disease, CRF: Chronic renal failure (creatininemia > 2 mg/dl).
Table 4. Complicanze e cause di morte
Pt n. PS Descrizione dell'evento APC Descrizione dell'evento
2 no Sanguinamento dall'apice no Revisione per sanguinamento; Sindrome da bassa portata
4 no Embolia del device no Conversione a chirurgia convenzionale. Morte.
6 yes - no Ictus
8 no Sanguinamento dall'apice no Sanguinamento. Morte 11 no Perforazione del ventricolo destro
da pace-maker no Tamponamento cardiaco
16 no Sanguinamento dall'accesso vascolare
no Revisione chirurgica dell'arteria femorale
34 yes - no Insufficienza respiratoria, insufficienza
renale, Ospedalizzazione prolungata
37 yes - no Sindrome da bassa portata, multi-organ
failure, Morte
40 no Rottura dell'anulus no Sanguinamento. Morte
43 yes - no Sindrome da bassa portata,
insufficienza renale, Insufficienza respiratoria
46 yes - no Sindrome da bassa portata,
Ospedalizzazione prolungata, sepsi 60 yes Ipotensione refrattaria dopo
rilascio della protesi, necessità di CPR
no Ipotensione refrattaria dopo rilascio della protesi, necessità di CPR. Sanguinamento intraaddominale da lesione epatica (trauma durante CPR?). Morte.
76 no Tvalvola impiantata troppo in alto / necessità di valve in valve
no Sindrome da bassa portata, insufficienza multiorgano. Morte. 81 no Insufficienza aortica severa dovuta
ad impianto in bicuspidia
no Conversione a chirurgia convenzionale. Dissezione aortica intraoperatoria (aorta a porcellana). Morte.
94 no Dissezione dell'arteria iliaca /
impianto di stent no PTA
Tabella 6. Fattori di rischio per leak paravalvolare
Fattore Analisi Univariata Analisi multivariata
Calcificazioni asimmetriche P<0,01 RR 2.25; 95%CI 1,4 – 12,6; p<0.05 Anulus “Border-line” p<0.05 p=ns Anulus Ellittico p<0.05 p=ns Procedura percutanea p<0.05 p=ns
Paziente ad alto rischio P<0,01 RR 3,95; 95%CI 1,8-24,6;
Appendice A
Per costruzione di CUSUM charts contenenti limiti di controllo (“Reassurance line”; “Alert line” e “Alarm line” richiede la determinazione di quattro parametri specifici: il tasso ritenuto accettabile per l'evento in esame; p1: il tasso eccessivamente elevato dell'evento che si vuole rilevare; α: il tasso di errore di tipo I (probabilità di respingere l'ipotesi nulla (H0) che l'incidenza dell'evento in esame è p0 quando essa è invece vera); e β, il tasso di errore di tipo II (probabilità di accettare l'ipotesi nulla (H0) che l'incidenza dell'evento in esame è p0 quando essa è falsa). Definito Xi come l'esito della procedura i, con Xi=1 in caso di insuccesso ed Xi=0 in caso di successo, allora per la curva che rappresenta il numero cumulativo di eventi Ei, dove
Ei=E(i-1)+Xi con E0=0
alla procedura i, il limite superiore l1 (“Upper control boundary”, in grado di indicare il passaggio da p0 a p1) ed il limite inferiore l0 (“Lower control limit”, che indica l'esattezza di p0) sono derivabili con le formule
l1=1xs+h1 e
l0=1xs-h0 dove
dove OR è il rischio relativo (“Odds Ratio” corrispondente all'aumento del tasso della complicanza in esame da p0 a p1.