INTRODUZIONE
La sindrome dell’intestino irritabile.
La sindrome dell’intestino irritabile (SII) o irritable bowel syndrome (IBS), è la più frequente patologia funzionale di pertinenza gastroenterica, con una prevalenza nella popolazione generale che si aggira intorno al 10-15% (Spiller, 2007).
Nel quadro delle alterazioni funzionali dell’apparato digerente rientrano disturbi caratterizzati da una combinazione variabile di sintomi gastrointestinali a decorrenza cronica o recidivante che non sono spiegabili con la presenza di alterazioni strutturali o biochimiche. In assenza di “markers” biologici e/o strumentali al momento chiaramente identificabili, la diagnosi si basa esclusivamente sulla presentazione clinica. I criteri diagnostici ritenuti al momento più applicabili sono i cosiddetti criteri di Roma III (Longstreth et al., 2006) che definiscono la SII come un disturbo caratterizzato dalla presenza di dolore o fastidio addominale presente per almeno 3 giorni al mese negli ultimi 3 mesi associato ad almeno 2 delle seguenti 3 caratteristiche: dolore alleviato dalla defecazione, variazione della frequenza evacuativa, cambiamento nella consistenza delle feci.
La presenza di altri sintomi o segni (meno di tre evacuazioni alla settimana, più di tre evacuazioni al giorno, feci dure o caprine, feci molli o liquide, sforzo durante l’evacuazione, sensazione di incompleto svuotamento intestinale, presenza di muco con le feci e distensione addominale) contribuisce a rafforzare la diagnosi (Longstreth et al., 2006).
In base al tipo di associazione dolore-alterazione dell’alvo predominante si differenziano generalmente 3 sottogruppi:
- SII ad alvo prevalentemente costipato in presenza di feci dure o caprine in più del 25% delle evacuazioni e feci molli o liquide in meno del 25%;
- SII ad alvo prevalentemente diarroico in presenza di feci molli o liquide in più del 25% delle evacuazioni e feci dure o caprine in meno del 25%;
- SII ad alvo alternante in presenza di feci dure o caprine in più del 25% delle evacuazioni e feci molli o liquide in più del 25%.
Poiché si tratta di una patologia non in grado di incidere negativamente sulla sopravvivenza, spesso ne vengono sottovalutate le gravi ripercussioni sia in ambito sociale che economico.
In realtà, la SII è responsabile di una marcata riduzione della qualità della vita dei pazienti, di un notevole consumo di farmaci, di un elevato ricorso a visite specialistiche e prestazioni di pronto soccorso, di una maggior frequenza di interventi chirurgici e di un numero considerevole di ore lavorative perdute (Gunn et al., 2003). Si calcola che negli Stati Uniti il costo annuo di tale sindrome si aggiri intorno a 1,7 miliardi di dollari (Sandler et al., 2002).
Inoltre, molti pazienti con SII presentano elevata prevalenza di disturbi psicologici/psichiatrici (depressione, ansia, fobie, attacchi di panico, somatizzazioni, disturbo ossessivo-compulsivo) (Pae et al., 2007) che in passato sono stati a lungo considerati un fattore eziologico della sindrome.
Attualmente si ritiene invece che il disturbo psicopatologico sia un fattore di comorbidità in grado di aggravare la sintomatologia dei pazienti, i quali ricorrono quindi più frequentemente all’aiuto del medico. Pertanto, identificare tale comorbidità con certezza e trattarla
con tempestività fa parte a pieno titolo della diagnosi e del trattamento della SII (Whitehead et al., 2007).
Al momento non sono disponibili trattamenti specifici in grado di curare in maniera efficace e risolutiva ogni manifestazione di questa patologia, e vengono perciò impiegati moltissimi presidi, di tipo farmacologico e non, per i singoli sintomi che caratterizzano la sindrome, con esiti spesso insoddisfacenti ed elevata variabilità di risposta sia tra pazienti diversi che nello stesso paziente in tempi differenti (Gunn et al., 2003). Ciò è dovuto anche al fatto che, tra le numerose ipotesi etiopatogenetiche formulate nel corso degli anni sulla SII, nessuna si sia affermata con certezza sulle altre.
Il sistema nervoso enterico.
Il sistema nervoso enterico (SNE) è il sistema nervoso intrinseco del tubo digerente che si estende senza interruzione dall’esofago fino all’ano ed è connesso al sistema nervoso centrale attraverso il sistema nervoso autonomo e attraverso molte fibre nervose sensitive afferenti. L’attività del sistema nervoso autonomo (simpatico e parasimpatico) si ripercuote sulla funzionalità del tubo digerente influenzandone la motilità, l’attività secretoria ed il flusso sanguigno locale, sia in senso eccitatorio che inibitorio (Figura 1). Stimoli in grado di attivare le fibre nervose afferenti giungono da processi flogistici che insorgono a livello mucosale, da un’eccessiva distensione delle pareti dei visceri e/o da sostanze di diversa natura chimica presenti nel tratto gastrointestinale. Una volta attivate, tali fibre inviano segnali che, integrandosi con quelli provenienti dal sistema nervoso autonomo, partecipano al controllo dei riflessi gastrointestinali ed alla percezione del dolore viscerale (sensibilità viscerale).
Figura 1. Controllo nervoso della parete del tubo gastroenterico
(Da Sikander et al., 2009)
L’ipersensibilità viscerale caratterizza la SII.
Un’aumentata percezione degli stimoli viscerali (ipersensibilità viscerale) (Mayer et al., 1994) potrebbe giocare un ruolo chiave nella fisiopatologia della SII.
Numerosi studi manometrici hanno dimostrato che molti pazienti con SII percepiscono dolore per volumi di distensione rettale e/o colica inferiori a quelli necessari a provocare la medesima sensazione nella popolazione sana (Mertz et al., 1995).
L’ipotesi più accreditata è che l’iperalgesia viscerale sia dovuta ad una “down regulation” dei meccanismi che mediano la percezione del dolore viscerale. Possono esserne responsabili l’attivazione, in seguito
alla stimolazione prolungata e ricorrente (flogosi, aumentata motilità o danno tissutale), di fibre C normalmente silenti che rendono dolorosa la percezione dell’attività afferente basale (allodinia), o l’aumento della eccitabilità dei sistemi che, all’interno del SNC, regolano la trasmissione ed elaborano lo stimolo sensoriale e/o nocicettivo. I neurotrasmettitori coinvolti nell’inibizione discendente dei neuroni del corno dorsale comprendono l’adrenalina, la serotonina ed i peptidi oppioidi.
Più importanti i meccanismi centrali? (I fattori stressogeni).
I fattori psicosociali e stressogeni giocano un ruolo molto importante nell’espressione clinica e nelle manifestazioni della SII (Lea et al., 2003). Infatti si stima che un numero considerevole di pazienti (fino al 60% di coloro che si rivolgono al gastroenterologo) presenti un chiaro coinvolgimento psichiatrico (ansia, depressione, disturbi somatoformi, etc.), mentre altri mostrano disturbi di personalità o tratti di personalità (Pae et al., 2007) in grado di determinare marcate alterazioni del comportamento (Drossman et al., 1999). Sembra inoltre che questo tipo di pazienti richieda più frequentemente l’aiuto del medico.
La risposta individuale allo stress è generata da strutture cerebrali integrate che includono l’amigdala, l’ipotalamo, l’area grigia periacqueduttale, la regione anteriore del cingolo e la corteccia prefrontale. Tale sistema di circuiti nervosi viene chiamato “sistema motorio emozionale” e i maggiori sistemi efferenti sono: la via monoamminergica, il sistema nervoso autonomo, l’asse ipotalamo-ipofisi-surrene e i sistemi regolatori del dolore (Schwetz et al., 2004).
Nei pazienti con SII si evidenzia, all’esecuzione della Tomografia ad Emissione di Positroni (PET), un’iperattivazione delle aree associate all’ansia e all’aumentata vigilanza localizzate nella corteccia prefrontale, un’incapacità ad attivare un centro collegato con il sistema endogeno di inibizione del dolore posto a livello della regione anteriore del cingolo, ed una ridotta attività della regione periacqueduttale.
Più importanti i meccanismi periferici? (L’ipotesi flogistica).
In condizioni fisiologiche, nell’intestino vige una condizione di tolleranza immunitaria che impedisce l’innesco di inopportune e potenzialmente dannose reazioni immunologiche verso antigeni comunemente presenti nel lume intestinale. Recenti studi sul possibile ruolo dell’attivazione della risposta immunitaria a livello della mucosa intestinale e delle alterazioni del quadro di latente infiammazione, hanno avanzato l’ipotesi fisiopatologica che vede la SII come malattia di tipo infiammatorio (Collins, 2002). E’ quindi ipotizzabile che, almeno in un consistente numero di pazienti, anomalie “periferiche”, quali una pur modesta flogosi intestinale, alterazioni del sistema immunitario presente a livello della mucosa intestinale, o un abnorme livello di ormoni gastrointestinali, possano contribuire alla comparsa della sindrome (Ohman et al., 2007).
Il concetto che alterazioni infiammatorie della mucosa intestinale giochino un ruolo nella fisiopatologia della SII è stato suggerito da diverse osservazioni:
1) il 7-30% dei pazienti con SII riferisce la comparsa della sintomatologia tipica della SII in seguito ad una malattia gastrointestinale (Chaudhary et al., 1962);
2) disturbi funzionali gastrointestinali persistenti sono riferiti nel 25% dei pazienti, a seguito di documentata gastroenterite dovuta a Shigella, Campylobacter e Salmonella (Neal et al., 1997);
3) in pazienti con SII “post infettiva”, biopsie rettali hanno evidenziato un’aumentata cellularità infiammatoria ed un aumento della conta delle cellule enterocromaffini e dei linfociti intraepiteliali (Costedio et al., 2006);
4) circa il 50% dei pazienti con storia di remissione di malattie infiammatorie croniche intestinali presenta sintomi tipici della SII. Studi su animali e sull’uomo indicano che le alterazioni infiammatorie determinano cambiamenti del contenuto di 5-HT, della conta della cellule enterocromaffini e del rilascio e del “reuptake” di 5-HT che potrebbero essere responsabili della sintomatologia (Simren et al., 2002).
Il ”brain-gut axis” come modello interpretativo della SII.
Ogni modello interpretativo della SII dovrebbe prendere in considerazione sia il sistema nervoso centrale che il tubo digerente. Attualmente un interesse sempre maggiore viene rivolto al cosiddetto brain-gut axis, l’asse funzionale che, garantendo una complessa e continua interazione tra sistema nervoso centrale (SNC) e sistema nervoso enterico (SNE), rende possibile la continua comunicazione tra i due sistemi che, sia in condizioni normali che patologiche, si influenzano in modo reciproco nel modulare la loro azione, e, più in generale, alla complessa relazione tra meccanismi centrali e periferici (Gershon et al., 2007).
In conclusione, è possibile che in alcuni pazienti sia maggiore il ruolo svolto da un disturbo “centrale”, mentre in altri siano le alterazioni dei meccanismi “periferici” a prevalere (Ohman et al., 2007).
Il ruolo della serotonina a livello intestinale.
Più di cento anni fa, Bayliss e Starling notarono che l’intestino aveva la capacità di generare “pattern” di complessi motori indipendentemente dal sistema nervoso centrale quando stimolato dalla distensione, da alterazioni del pH o da nutrienti. Questi fattori innescavano quella che oggi noi chiamiamo peristalsi. Le componenti cellulari e le molecole responsabili di questo riflesso coordinato continuarono ad essere studiate.
La serotonina fu scoperta nel 1930 da Valli ed Erspamer i quali chiamarono la sostanza “enterammina” poiché estratta dall’intestino. La stessa sostanza venne indipendentemente estratta da campioni di sangue nel 1948 da Page e Rapport durante le loro ricerche sui fattori circolanti che causavano ipertensione. Inconsapevoli di aver a che fare proprio con l’enterammina, Page e Rapport chiamarono il composto serotonina a causa della sua azione vasocostrittice e successivamente identificarono la struttura come 5-idrossitriptammina (5-HT). Negli anni ’50 Bulbring e Crema dimostrarono che la 5-HT era un importante neurotrasmettitore gastroenterico (Costedio et al., 2006). In seguito agli studi condotti sul ruolo della 5-HT nell’innesco e nella propagazione della motilità gastrointestinale, e sulla capacità di modulare l’attività secretiva e la sensibilità viscerale, negli ultimi anni si è sempre più rafforzata l’ipotesi di un suo coinvolgimento nei meccanismi etiopatogenetici che sono alla base della SII. Tuttavia, il suo reale ruolo nell’ambito della fisiopatologia intestinale, ed in
particolare in quella della SII, non è ancora completamente e correttamente conosciuto.
La 5-HT è un neurotrasmettitore ampiamente diffuso nell’organismo, isolato dalle piastrine, dal tratto gastrointestinale, e dal sistema nervoso centrale (SNC) e periferico (SNP), e la sua attività a livello encefalico e gastrointestinale consiste nella regolazione di diverse funzioni. La sua sintesi inizia a partire dall’amminoacido triptofano ad opera dell’enzima triptofano idrossilasi presente a livello neuronale e delle cellule enterocromaffini (EC) (Coates et al., 2006) (Figura 2). La maggior parte della 5-HT dell’organismo è infatti localizzata a livello del tratto digestivo, circa il 95% del totale, di cui il 90% immagazzinato nelle EC ed il restante 10% prodotto dai neuroni del plesso mioenterico (Kim et al., 2000; Gershon, 2003).
Le cellule enterocromaffini appaiono come elementi caratterizzati da un “ciuffo” di microvilli in regione apicale e da un gran numero di granuli intracitoplasmatici contenenti il principio ormonale. In prossimità delle cellule sono presenti fibre nervose afferenti che esprimono recettori serotoninergici. Tale conformazione depone per una funzione di trasduttore sensoriale capace di trasformare uno stimolo endoluminale chimico o fisico in uno stimolo nervoso (Hansen et al., 2008). L’accreditata teoria secondo la quale le cellule del sistema endocrino diffuso perverrebbero alla mucosa gastroenterica per dislocazione dalla cresta neurale e quindi avrebbero un’origine comune con le cellule nervose, avvalora tale interpretazione.
Le EC sono dotate di enzimi deputati alla sintesi della 5-HT a partire dal suo precursore, l’amminoacido aromatico triptofano, e liberano il neurotrasmettitore in risposta a stimoli di natura meccanica, chimica (modifiche del pH enterico, della concentrazione di glucosio o di acidi biliari) o nervosa, che determinano un transitorio aumento della concentrazione dello ione calcio nelle cellule. Tale aumento è alla base del meccanismo di fusione delle vescicole contenenti 5-HT con la membrana basale e del rilascio del neurotrasmettitore a livello della lamina propria.
L’attività della 5-HT è quasi esclusivamente paracrina e si ripercuote sulle strutture cellulari limitrofe che esprimono specifici sottotipi recettoriali classificati in base alla struttura, al meccanismo di azione ed al profilo farmacologico (Tonini, 2005).
Ad oggi sono noti 18 diversi recettori serotoninergici suddivisi in 8 famiglie: 5-HT1, 5-HT2, 5-HT3, 5-HT4, 5-HT5, 5-HT6, 5-HT7, 5-HT1P
(Tabella 1) sulla base dei loro profili farmacologici, delle sequenze di cDNA, e dei meccanismi di trasduzione del segnale innescati dal
ligando. I recettori 5-HT1A, 5-HT1B, 5-HT1P, 5-HT2A, 5-HT2B, 5-HT3,
5-HT4 e 5-HT7 sono stati identificati a livello intestinale. Gli
enterociti esprimono i recettori 5-HT2A, le EC 5-HT2C, 5-HT3, 5-HT4,
mentre i neuroni del sistema nervoso enterico esprimono 5-HT1A,
5-HT1P, 5-HT2A, 5-HT2B, 5-HT3, 5-HT4, e a questo livello sono stati
isolati almeno tre recettori di tipo eccitatorio ed uno di tipo inibitorio. Quelli eccitatori sono i sottotipi 5-HT1P, 5-HT3 e 5-HT4, l’inibitorio è
5-HT1A (Hoyer et al., 1997; Vanhoenacker et al., 2000; Glatzle et al.,
2002; Gershon, 2003).
Tra i vari sottotipi, soltanto uno è accoppiato a canali ionici (5-HT3),
gli altri sono accoppiati a proteine G. Tale varietà di sottotipi recettoriali rende ragione della difficoltà nella corretta comprensione del ruolo preciso della 5-HT.
I recettori serotoninergici localizzati a livello centrale ed intestinale maggiormente oggetto degli studi volti all’individuazione di un’associazione tra la 5-HT e la SII sono 5-HT3 e 5-HT4.
Essi sono coinvolti nella regolazione dei riflessi che controllano la motilità e la secrezione, e svolgono un ruolo anche nella percezione delle sensazioni gastrointestinali. Dunque è ovvia la loro importanza nella fisiopatologia della sindrome dell’intestino irritabile.
SOTTOTIPI
RECETTORIALI LOCAZIONE RUOLO FUNZIONALE
5-HT1A SNC, SNE
Iperpolarizzazione neuronale; ipotensione e bradicardia; az.inibitoria neuroni sensitivi estrinseci, interneuroni ascendenti, motoneuroni eccitatori 5-HT 1B SNC, nervi periferici, stomaco Inibizione liberazione neurotrasmettitore; accomodazione gastrica 5-HT 1D SNC, vasi intracranici Inibizione liberazione neurotrasmettitore;
contrazione muscolatura liscia vasale 5-HT 1E SNC Non noto 5-HT 1F SNC Non noto 5-HT 1-like SNC, Vasi intracranici Inibizione rilascio noradrenalina; contrazione muscolatura liscia 5-HT 2A SNC, Muscoli lisci, piastrine, tratto gastrointestinale Vasocostrizione; aggregazione piastrinica; broncocostrizione; azione contrattile muscolatura liscia gastrointestinale
5-HT 2B
SNC, intestino, stomaco, cuore, rene
Aumenta risposta contrattile muscolo liscio longitudinale colon
5-HT 2C SNC, Plessi coroidei Stimolo fame; produzione
fluidi cerebrospinali
5-HT3
SNC, nervo vago, SNE
Az. eccitatoria fibre afferenti vagali, neuroni sensitivi estrinseci, motoneuroni
inibitori ed eccitatori del tratto gastrointestinale
5-HT4
SNC, cuore, tratto gastrointestinale
Rilascio neurotrasmettitori; azione inotropa e cronotropa positiva; contrazione
muscolatura liscia colon; effetto pro cinetico
5-HT 5A e 5B SNC Non noto
5-HT6 SNC Non noto
5-HT7
SNC, cellule
muscolari lisce vasi e intestino
Azione miorilassante tratto gastrointestinale,
vasodilatazione
5-HT1P SNE
Stimolazione neuroni sensitivi intrinseci sottomucosali
Tabella 1. Localizzazione e ruolo funzionale
All’interno del sistema nervoso enterico, il recettore 5-HT3 è
localizzato a livello dei neuroni sensitivi primari (intrinseci ed estrinseci) e sui corpi cellulari della maggior parte dei neuroni enterici (Figura 2). L’attivazione del recettore 5-HT3 dei neuroni intrinseci
afferenti può stimolare, soprattutto a livello del plesso mioenterico, neuroni che vanno ad attivare fibre motorie eccitatorie colinergiche e fibre motorie inibitorie nitrergiche che danno origine alla peristalsi. L’attivazione di fibre contenute nel plesso sottomucoso modula la secrezione ghiandolare e la vasodilatazione, mentre l’attivazione delle fibre afferenti estrinseche stimola il centro del vomito (Andrews et al., 1988; Andrews et al., 1993) e diminuisce la soglia nocicettiva (Hamon et al., 1990; Fozard et al., 1993).
Sebbene non sia stato ancora possibile determinare in modo preciso la distribuzione del recettore 5-HT4 (Figura 3), gli studi condotti finora
suggeriscono che la sua attivazione abbia un effetto di accelerazione della funzione motoria piuttosto che di iniziazione della stessa (Costedio et al., 2006).
Figura 3. Azioni dei recettori serotoninergici nel SNE
Nel tratto gastrointestinale l’attivazione dei recettori 5-HT4 media la contrazione della muscolatura liscia del colon umano (Tam et al., 1992) e facilita il riflesso peristaltico. Recettori 5-HT4 presenti sugli
enterociti stimolano direttamente la secrezione ghiandolare. Inoltre i recettori 5-HT4 sembrano modulare il dolore viscerale nel processo
della trasmissione nocicettiva (Schikowski et al., 2002).
I segnali nocicettivi sono trasmessi dai visceri alle lamine specifiche del corno dorsale a livello midollare. L’input sinaptico attiva specifici neuroni di secondo ordine, i quali portano all’attivazione di specifiche aree cerebrali e talamiche, alla sensazione e percezione del dolore e, successivamente, a processi di valutazione e di discriminazione nei centri cerebrali più alti. Anche vie discendenti si attivano in risposta allo stimolo nocicettivo: le fibre del fascio bulbospinale inviano proiezioni discendenti che vanno dal grigio periacqueduttale e dai neuroni del rafe ai neuroni localizzati nel corno dorsale, in grado di inibire o facilitare il segnale nocicettivo. I mediatori utilizzati in tale processo sono serotoninergici, sostanze oppioidi e noradrenergici, e i recettori 5-HT3 e 5-HT4 agiscono a tale livello. Le vie bulbospinali,
attivate dalla nocicezione, mandano proiezioni discendenti dalla sostanza grigia periacqueduttale e dai neuroni del rafe ai neuroni del corno dorsale, che inibiscono o facilitano il segnale nocicettivo. Le vie discendenti bulbospinali utilizzano trasmettitori serotoninergici, oltre che oppioidi e noradrenergici, e i recettori 5-HT4 e 5-HT3 sembrano
agire a tale livello. Per i recettori 5-HT1A e 5-HT1P è stato ipotizzato
un ruolo come sensori del contenuto luminale (Wood et al., 1999). Il metabolismo della 5-HT inizia con il reuptake dell’ammina localizzata nello spazio interstiziale. La quasi totalità del neurotrasmettitore viene rimossa da una molecola di natura proteica avente funzione di trasportatore specifico (SERT o 5-HTT) localizzata
a livello della membrana basale degli enterociti. Una parte della 5-HT sintetizzata dalle cellule EC viene liberata nel flusso ematico, dove viene captata dalle piastrine che non possiedono gli enzimi necessari per sintetizzarla, e, mediante il SERT espresso sulla loro superficie, viene immagazzinata (Racke et al., 1996). Studi di biologia molecolare hanno evidenziato che il SERT possiede un profilo strutturale identico nelle diverse sedi cellulari (Lesch et al., 1993). In seguito al reuptake, la 5-HT viene immagazzinata in vescicole secretorie, oppure entra in contatto con enzimi citoplasmatici che la degradano. La principale via catabolica è quella delle monoammino ossidasi (MAO). Questi enzimi catalizzano una reazione che produce 5-idrossindolo-acetaldeide che, per azione dell’enzima aldeide deidrogenasi, viene ossidata ad acido 5-idrossindol acetico (5-HIAA). A fronte di una notevole diversità di recettori serotoninergici, esiste dunque un solo trasportatore che media il reuptake della 5-HT dall’interstizio, e quindi rappresenta il meccanismo principale di regolazione delle azioni svolte localmente dal neurotrasmettitore (Chen et al., 1998).
LA PROTEINA SERT
Struttura e meccanismo d’azione.
Nell’ultimo decennio sono stati fatti molti progressi nella comprensione della struttura e della funzione del trasportatore della serotonina (SERT) localizzato a livello della membrana presinaptica dei neuroni serotoninergici.
Il SERT fa parte della famiglia dei trasportatori delle ammine biogene, proteine di membrana in grado di mediare il passaggio del substrato all’interno della cellula, ed è significativamente simile ai trasportatori di dopamina (DAT) e noradrenalina (NET) che appartengono infatti allo stesso gruppo insieme a quelli di glicina, acido γ-ammino butirrico (GABA), prolina, creatina e betaina (Inoue et al., 2002). La proteina (Figura 4) è un peptide di 630 amminoacidi comprendente 12 segmenti transmembrana, ed ha un peso molecolare di 70320 Da. Le estremità N-terminale e C-terminale sono intracellulari e ciascun dominio transmembrana è costituito da 25 amminoacidi idrofobici (Olivier et al., 2000).
Fino ad oggi non sono state identificate isoforme e la proteina integrale presenta:
- 2 siti per la N-glicosilazione (in verde nella figura 4) nel secondo loop extracellulare tra i domini transmembrana 3 e 4 (Takeshi et al., 2002);
- 3 siti intracitoplasmatici per la fosforilazione da parte della proteina chinasi AMPciclico dipendente (in rosso nella figura 4), situati nella regione N-terminale;
- 2 siti per la fosforilazione ad opera della protein kinasi C (PKC) (in blu nella figura 4): uno nel segmento intracellulare tra i domini 4 e 5, e l’altro sul segmento C-terminale.
Figura 4. Struttura del trasportatore della serotonina
(Da Sikander et al., 2009)
In condizioni basali il SERT esiste come complesso con la protein-fosfatasi 2A (PP2A). Quando il trasportatore viene fosforilato dalla protein kinasi C, PP2A si dissocia e la concentrazione del SERT espressa sulla membrana cellulare diminuisce, con accumulo del SERT in siti intracellulari. La successiva defosforilazione consente al SERT di riassociarsi con proteine vescicolari e di tornare sulla membrana plasmatica in forma attiva (Blakely et al., 1998).
L’N-glicosilazione a livello del secondo grande loop del trasportatore sembra facilitare la ricaptazione della 5-HT inducendo un aumento dell’espressione della proteina sulla membrana plasmatica. Dopo la
glicosilazione il SERT è portato all’interno della membrana plasmatica.
La 5-HT a pH fisiologico non è in grado di attraversare autonomamente le membrane lipidiche (Gill et al., 2008). L’ipotesi maggiormente accreditata è che il SERT esprima sul versante extracellulare un sito in grado di legare in maniera simultanea Na+, Cl -e 5-HT. Tal-e l-egam-e inn-esca un cambiam-ento conformazional-e ch-e permette il rilascio di 5-HT, Na+ e Cl- sul versante interno della cellula dove avviene il legame di K+ che facilita il ritorno alla conformazione iniziale ed il conseguente rilascio dello ione all’esterno. L’intero processo è reso possibile dall’attività della pompa Na+-K+ in grado di mantenere il gradiente ionico.
Diversi studi sono stati rivolti al tentativo di localizzare con esattezza i siti di espressione del SERT nell’organismo. Aiutandosi con modelli animali, la proteina è stata identificata nel sistema nervoso centrale di diverse specie di mammiferi (Gill et al., 2008). A livello intestinale, le prime evidenze si sono avute sul ratto e sulla cavia (Chen et al., 1998). Solo recentemente mRNA in grado di codificare per il SERT è stato identificato nello stomaco e nell’intestino umano, con una maggior densità di espressione nel piccolo intestino (ileo, duodeno e digiuno) rispetto al colon, in soggetti sani (Coates et al., 2004; Meier et al., 2007; Van Lelyveld, 2007; Gill et al., 2008). Ciò ha fatto ipotizzare che nel colon siano attivi meccanismi alternativi che permettano il reuptake della molecola. La teoria più accreditata è che la 5-HT possa a questo livello utilizzare trasportatori normalmente usati da altre ammine quali noradrenalina e dopamina, oltre che un trasportatore specifico per i cationi (Gill et al., 2008).
Il gene e i suoi polimorfismi.
Il gene umano che codifica il SERT è il gene SLC6A4 (Solute Carrier Family Six Member Four), chiamato anche gene SERT o 5-HTT (5-HT Transporter) (Camilleri, 2007), è stato mappato sul cromosoma 17q11.2-q12 e si estende su una lunghezza di 31kb, composto da 14 esoni che codificano una proteina di 630 amminoacidi.
Esistono due varianti di esone 1 chiamate 1A e 1B (Bradley et al., 1997) e tramite splicing alternativo si perviene alla sintesi di due diversi mRNA, comprendenti rispettivamente le sequenze di esoni 1A+2 ed 1A+1B+2. Recenti studi hanno identificato a livello intestinale tre differenti sequenze di mRNA. Ciò rafforza l’ipotesi che il gene abbia la potenzialità di generare più di due diverse varianti di mRNA, e ulteriori conferme sono giunte da studi effettuati su roditori. Nei ratti infatti possono essere codificate tre differenti varianti dell’esone 1 che si esprimono in differenti combinazioni (1A+2, 1A+1B+2 e 1C+2). Le combinazioni 1A+2 e 1A+1B+2 trovano espressione in siti diversi dell’organismo: SNC, cuore e tratto gastrointestinale e sono regolate dallo stesso promotore, mentre 1C+2 ha localizzazione esclusivamente intestinale ed un promotore distinto (Ozsarac et al., 2002). L’analogia tra la sequenza dell’esone 1C del ratto ed una regione dell’esone 1B umano ha suggerito che anche nell’uomo possa esistere la variante 1C dell’esone 1. La netta prevalenza della sequenza 1C+2 nell’intestino implica che la regione polimorfica del promotore che regola l’espressione di 1A+2 non possa interferire a livello intestinale.
Alcuni degli elementi in grado di regolare l’attività trascrizionale e l’espressione del SERT sono comunque conosciuti (Figura 5):
- una regione del promotore formata dalla ripetizione di sequenze di basi situata a monte dell’inizio della zona di trascrizione, denominata 5-HTTLPR (5HTT-gene linked polymorphic region);
- una regione all’interno del secondo introne che può essere costituita da un numero variabile di ripetizioni in tandem (VNTR);
- una regione del promotore situata fra 5-HTTLPR e il sito di inizio di trascrizione che può subire una delezione di 381 bp.
Figura 5. Gene SERT e polimorfismo 5-HTTLPR.
A livello cromosomico possono esistere diverse varianti alleliche corrispondenti ad ogni singolo gene, da cui la possibilità che ogni proteina possa esistere in più forme molecolari anche dotate di differente funzionalità. Alcune variazioni sono, infatti “silenti”, non in grado cioè di alterare la funzione della proteina codificata
(polimorfismi sinonimi), a fronte di altre capaci di modificarne funzionalità e/o densità di espressione, determinando così alterazioni fenotipicamente rilevanti (polimorfismi regolatori) che possono influenzare la manifestazione di particolari patologie o condizionare la risposta ai farmaci. Altre variazioni sono associate ad alterazioni di sequenze codificanti di mRNA con un differente pattern amminoacidico nella sequenza della proteina espressa (polimorfismi codificanti).
Per quanto riguarda il gene SERT sono stati individuati principalmente:
1) Polimorfismi codificanti: tali mutazioni riguardano un singolo nucleotide (SNPs). Ne sono stati identificati 2, indicati come rs25531 e rs25532. Il nucleotide sostituito può indurre un’alterazione funzionale della proteina. Comunque la loro frequenza nella popolazione generale è inferiore all’1% (Leabman et al., 2003). In seguito ai processi di traduzione dell’mRNA mutato si ha la sostituzione di un’Isoleucina con una Valina (Ile425Val), e di una Glicina con un’Alanina (Gly56Ala) (Lesch et al., 1996; Kilic et al., 2003; Prasad et al., 2005; Sutcliffe et al., 2005);
2) Polimorfismi sinonimi: sono stati identificati altri SNPs del gene SERT, che sono relativamente comuni e localizzati sia nelle regioni codificanti che non codificanti, ma non causano nessun cambiamento nel pattern amminoacidico;
3) Polimorfismi regolatori: alcuni studi hanno mostrato un polimorfismo VNTR (Variable Number of Tandem Repeats) nell’introne 2 del gene SERT umano. In questo caso una sequenza di 16-17 bp (GGCTGTGACCCGAGGTG) è ripetuta nove (STin2*9), dieci (STin2*10), o dodici (STin2*12) volte e sembra influenzare l’attività trascrizionale del gene (Figura 6). E’ stato documentato che
il polimorfismo STin2*12 è associato ad una maggiore efficienza trascrizionale del SERT rispetto a quello STin2*10 (Fiskerstrand et al., 1999).
Figura 6. Gene SERT e polimorfismo 5-HTTLPR
(Da Murphy 2008)
Regione promoter e polimorfismo 5-HTTLPR.
L’estremità 5′ del gene SERT si trova poco a monte della sequenza del promotore, la regione di inizio del processo trascrizionale identificata dal motivo “TATA-box” e da una serie di siti di legame per fattori di trascrizione tra cui AP1, AP2 ed SP1. Nella regione del promotore del gene SERT è stata individuata una sequenza di 20-23 bp ricca di Guanina (G) e Citosina (C), ripetuta dalle 14 alle 23 volte.
Più recentemente è emersa l’esistenza di un ulteriore polimorfismo, caratterizzato dalla inserzione/delezione di un frammento di 43 bp localizzato tra le sequenze di G e C ripetute. Nello specifico,
l’inserzione del frammento, unitamente alla sequenza di basi G e C ripetuta 16 volte, dà origine all’allele L, mentre la sua delezione, unitamente alla sequenza di basi G e C ripetuta 14 volte, all’allele S (Heils et al., 1996; Heils et al., 1997; Lesch et al., 1998). L’allele L si comporta da allele dominante. La sequenza nucleotidica compresa tra −1376 e −1048 è la sequenza di 20-23 bp ricca di basi G e C ripetuta 14 o 16 volte, mentre la sequenza compresa tra −1265 e −1221 è quella di 44 bp (o secondo studi più recenti, 43) soggetta ad inserzione/delezione. Si pensa che tale polimorfismo sia responsabile della modulazione trascrizionale del SERT ed abbia un ruolo nella fisiopatologia della SII e nella capacità di risposta alla terapia farmacologica che è caratterizzata da una spiccata variabilità interindividuale (Camilleri et al., 2002).
E’ stato dimostrato che la variante L aumenta l’espressione del trasportatore in vitro di 3-5 volte, mentre la variante S è stata associata ad una ridotta trascrizione del gene. Le condizioni di omozigosi per la variante short (S/S) e di eterozigosi (L/S) sono associate ed una riduzione di trascrizione del gene SERT e la proteina codificata presenta una minore efficienza nel processo di ricaptazione della 5-HT rispetto all’omozigosi per la variante long (L/L) (Chen et al., 1998). Diversi esperimenti sono stati condotti su topi omozigoti recessivi o eterozigoti per la mutazione, con l’obiettivo di quantificare le variazioni di concentrazione della 5-HT in rapporto alla ridotta espressione del SERT. I risultati hanno suggerito un incremento del neurotrasmettitore nell’interstizio, che si traduce in uno stimolo di maggiore intensità e durata sui recettori (Mathews et al., 2004; Kim et al., 2005), in grado di alterare l’omeostasi del sistema serotoninergico. In condizioni di omozigosi S/S è stata osservata una riduzione della concentrazione di 5-HT nel sangue periferico, nelle piastrine (Chen et
al., 2001; Eddahibi et al., 2000) e in molti organi, confermando l’ipotesi che essa sia direttamente dipendente dalla corretta funzionalità del SERT (Bengel et al., 1998; Kim et al., 2005; Li et al., 2003; Tjurmina et al., 2002). Come conseguenza della ridotta ricaptazione, la sintesi e il turnover della molecola nei topi studiati appaiono aumentati a livello encefalico, soprattutto nelle femmine (Fox et al., 2008; Kim et al., 2005). L’eterozigosi si associa ad analoghi deficit del “reuptake”, non accompagnati però da alterazioni della concentrazione periferica del neurotrasmettitore, poiché il deficit di un singolo allele permette comunque di mantenere l’omeostasi serotoninergica nella maggior parte dei tessuti.
Nonostante queste siano le due mutazioni maggiormente frequenti, ne sono state riscontrate altre con 15, 19, 20 e 22 ripetizioni o con variazioni nella sequenza genica dell’elemento ripetuto. In realtà la frequenza con la quale si presentano è estremamente bassa, tanto che si ritiene sia superfluo condurre studi a riguardo (Delbruck et al., 1997; Michaelovsky et al., 1999; Nakamura et al., 2000).
La distribuzione dei diversi tipi di polimorfismo 5-HTTLPR nelle diverse popolazioni è assai variabile: l’allele L è presente nell’83-89% degli Africani, nel 50-59% dei Caucasici e nel 29-33% degli Asiatici, mentre il genotipo S/S si evidenzia nel 25% dei Caucasici rispetto al 57% degli Asiatici (Smits et al., 2004). Ciò aumenta la possibilità che un polimorfismo risulti associato ad una particolare condizione patologica in una determinata popolazione ma non in un’altra e potrebbe contribuire a giustificare la disomogeneità dei dati presenti in letteratura riguardo al suo rapporto con la SII.
Nel gene SERT è stato più recentemente identificato un ulteriore polimorfismo: si tratta dell’inserzione/delezione di una sequenza di 381 bp localizzata tra 5-HTTLPR ed il sito di avvio del processo di
trascrizione in grado di conferire instabilità al promotore e di provocare variazioni nell’espressione del SERT a causa della presenza di siti di legame di fattori di trascrizione, tra cui AP1 (Activator Protein 1), Elk1, e NF-kB (Nuclear Factor-kB) (Flattern et al., 2000) che possono essere attivati in condizioni patologiche come l’infiammazione. Una riduzione nell’espressione del SERT e nel contenuto di 5-HT è stata dimostrata nella mucosa intestinale di pazienti affetti da Colite Ulcerosa, così come il fatto che citochine proinfiammatorie riducono l’espressione e la funzione del SERT. Questi sono aspetti molto importanti dato che ci sono sempre più evidenze a supporto di un coinvolgimento del sistema immunitario come substrato della SII, soprattutto in quei soggetti in cui l’insorgenza della sintomatologia coincide con la risoluzione di un episodio infettivo. In questi casi è stata infatti dimostrata una ridotta espressione del SERT. Tutto ciò apre nuove importanti prospettive, in quanto si pensa che mutazioni genetiche possano tradursi in una differente suscettibilità del SERT a stimoli infiammatori, con conseguenti modifiche in termini di severità della sintomatologia associata alla SII, presentazione clinica e, forse, anche risposta a trattamenti con antiinfiammatori. Esmaili et al. (2009) hanno dimostrato a questo proposito un’inibizione dell’espressione del SERT in seguito all’infezione di linee cellulari di carcinoma colorettale da parte del ceppo enteropatogeno di E.Coli (EPEC). L’infezione riduce il numero di proteine SERT attive senza tuttavia alterare l’affinità di legame per la 5-HT. Ciò è in accordo con quanto verificato in studi precedenti che documentavano la presenza di processi di fosforilazione/defosforilazione della tirosina a seguito di infezioni delle stesse linee cellulari con EPEC (Kenny et al., 1997). Il “reuptake” serotoninergico diminuisce gradualmente sul versante
apicale della membrana cellulare raggiungendo il massimo in un arco di tempo di 60 minuti, mentre sul versante basocellulare l’inibizione è molto minore, coerentemente con le informazioni finora acquisite circa una maggiore espressione del SERT a livello del versante apicale degli enterociti (Gill et al., 2008). In esperimenti simili condotti su topi, l’infezione è in grado anche di indurre maggiore espressione di citochine proinfiammatorie quali TNF-α, oltre ad un’alterazione dell’espressione e dell’attività delle EC. Tali alterazioni nel complesso possono determinare il quadro diarroico che è tipico di un’infezione da E.Coli enteropatogeno nell’uomo.
Oggi si ritiene che quanto ipotizzato circa la struttura molecolare e l’attività trascrizionale del SERT sia in realtà troppo semplicistico e sulla base di nuove ricerche sono state apportate delle modifiche al modello sinora esposto: sembra infatti che combinazioni diverse delle sequenze ripetute possano generare quattro sottovarianti di allele S, sei di L, e molte ulteriori varianti alleliche (Delbruck et al., 1997; Kunugi et al., 1997; Michaelowsky et al., 1999; Frisch et al., 2000; Nakamura et al., 2000; Rasmussen et al., 2007). Hu et al. nel 2005 hanno descritto all’interno della sequenza di inserzione di 43 bp 5-HTTLPR, un SNP in cui si verifica la sostituzione di una guanina con un’adenina, chiamato “rs25531 G allele”. Ciò conferisce la possibilità di trascrivere la variante A dell’allele L (LA) e di ridurre di
conseguenza la trascrizione della variante G (LG). Una sequenza
simile di eventi si verifica a carico dell’allele S (Wendland et al., 2006). La sostituzione A→G sembra anche essere associata a variazioni nell’effetto terapeutico degli SSRI (inibitori selettivi del “reuptake” serotoninergico), in quanto l’espressione dell’allele G si associa ad una ridotta trascrizione del SERT rispetto al più frequente allele A (Hu et al., 2006), e ad una prevalenza maggiore in soggetti
con SII. Pertanto, le suddette alterazioni geniche vanno considerate due polimorfismi distinti.
SERT e SII.
Per cercare conferme che avvalorassero l’ipotesi di un’implicazione del SERT nella SII, Bellini et al. nel 2003 hanno isolato piastrine di donne affette dalla variante diarroica della SII (D-SII), confrontando la capacità di trasporto della paroxetina marcata con un campione di volontari sani. Le piastrine delle donne con D-SII mostravano una ridotta densità di espressione del SERT ed una minore affinità di legame per la paroxetina. Il fatto che il SERT codifichi per una sola proteina ha fatto pensare che alterazioni simili a quelle espresse a livello piastrinico potessero nel tubo digerente render ragione delle manifestazioni cliniche della D-SII, nonostante il meccanismo molecolare alla base di tale processo non sia stato ancora determinato con esattezza.
Coates et al. (2006) hanno dimostrato in soggetti affetti da SII e Malattie Infiammatorie Croniche Intestinali, una riduzione dell’espressione e/o della funzionalità del SERT senza una concomitante alterazione dei meccanismi di rilascio della 5-HT. Pertanto sembra essere possibile che le alterazioni dei livelli serotoninergici che ne conseguono influenzino le modalità di espressione clinica di tali patologie. Esperimenti condotti sui topi hanno loro permesso di valutare meglio questo legame. Somministrando paroxetina (un inibitore selettivo del SERT) per un periodo di 14 giorni, sono state registrate una riduzione quantitativa del volume fecale ed una diminuzione della velocità di transito colico e della sensibilità nocicettiva intestinale rispetto ai controlli,
configurando un quadro assimilabile ad una condizione di alvo costipato. La riduzione della sensibilità nocicettiva è compatibile con l’azione della 5-HT che ha un effetto di riduzione della trasmissione della sensibilità dolorifica a livello dei cordoni spinali (Kharkevich, 1999; Fioramonti et al., 2002; Millan, 2002). La paroxetina, incrementando la disponibilità della 5-HT, agisce dunque in questo senso.
Il significato clinico del polimorfismo 5-HTTLPR è attualmente oggetto di dibattito. Si è cercato, negli ultimi anni, di comprenderne le possibili relazioni con la sindrome dell’intestino irritabile (SII) in termini di etiopatogenesi, espressione clinica e risposta a terapia farmacologica. Ciò soprattutto in rapporto alle evidenze ottenute circa l’influenza che i polimorfismi hanno sul processo di trascrizione e sull’espressione e la funzione del SERT nel cervello. Quest’ultimo dato in particolare orienta verso il trattamento della SII con SSRI. Infatti, inibire il SERT con inibitori selettivi del reuptake serotoninergico, inibitori selettivi del reuptake noradrenergico e antidepressivi triciclici aumenta la biodisponibilità della 5-HT. Coates et al. (2006) hanno studiato l’espressione del SERT e l’attività serotoninergica in frammenti bioptici di mucosa rettale di soggetti sani ed affetti dalle varianti diarroica (D-SII) e costipata (C-SII) della sindrome. In entrambi i gruppi l’espressione dell’mRNA del gene SERT era diminuita, ed il contenuto di 5-HT e triptofano idrossilasi-1 a livello mucosale ridotto. Questi risultati hanno fornito la dimostrazione diretta di un’espressione alterata del SERT nell’intestino dei soggetti affetti da SII rafforzando l’opinione che le manifestazioni cliniche della SII siano dipendenti da alterazioni delle vie serotoninergiche. In realtà, da studi di metanalisi condotti su un campione di 1034 pazienti affetti da SII e 1377 volontari sani, sembra
che il polimorfismo esaminato non abbia il ruolo di fattore di rischio etiopatogenetico per la SII (Van Kerkhoven et al., 2007), ma il riscontro di un’associazione tra polimorfismo e gravità del dolore addominale, caratteri dell’alvo, e comorbidità psichiatrica spinge alla prosecuzione delle indagini.
Uno studio condotto da Pata et al. su 54 pazienti turchi nel 2002 ha dimostrato una netta prevalenza del genotipo S/S in soggetti affetti dalla variante stitica (46.1%) rispetto a quella dei pazienti con alvo diarroico (11.1%) o alternante (10%), facendo sì che si facesse strada l’ipotesi che il genotipo S/S fosse protettivo nei confronti dello sviluppo di una sintomatologia di tipo diarroico. In tali pazienti la ridotta attività del SERT determinerebbe un accumulo extracellulare di 5-HT con desensibilizzazione dei recettori della 5-HT e comparsa della stipsi. Risultati contrastanti giunsero da studi condotti nel 2004 da Yeo et al., i quali, prendendo in esame 8 diversi polimorfismi del SERT in donne caucasiche con SII caratterizzata dalla presenza di alvo diarroico, riscontrarono che il genotipo S/S aveva prevalenza doppia nei casi rispetto ai controlli, suggerendo così che una ridotta attività del SERT fosse piuttosto da collegare all’insorgenza di una SII con alvo diarroico. Altri Autori, invece, non hanno dimostrato variazioni significative della prevalenza del polimorfismo 5-HTTLPR in pazienti di razza caucasica affetti da SII o da dolore addominale cronico di natura funzionale rispetto ai volontari sani (Kim et al., 2004; Saito et al., 2007).
Un’eventuale correlazione tra polimorfismi del SERT e SII è stata ricercata anche nei pazienti asiatici (Lee et al., 2004; Wang et al., 2004; Park et al., 2006; Li et al., 2007).
Nel 2006 uno studio condotto da Park et al. su pazienti coreani ha messo in evidenza una prevalenza maggiore del genotipo S/S in
pazienti con SII ad alvo alternante (73.3%) rispetto ai volontari sani (62.5%), non riuscendo però a dimostrare un’associazione significativa tra polimorfismo 5-HTTLPR e durata e/o gravità della sintomatologia. Questi risultati concordano con le osservazioni di Yeo et al. (2004) e con quelli di altri studi che avevano dimostrato nei pazienti con SII ad alvo diarroico un’alterazione del metabolismo della 5-HT e della sua ricaptazione (Houghton et al., 2003; Atkinson et al., 2006), e supportano l’ipotesi che una riduzione dell’attività del SERT possa incrementare l’attività e la sensibilità intestinali.
Wang et al. (2004) sulla base del riscontro di una maggiore frequenza del genotipo L/L nei pazienti cinesi con SII ad alvo costipato, e di una elevata frequenza di associazione tra genotipi STin2*12 e L/L in questo gruppo di pazienti, hanno ipotizzato che questa associazione conferisca un maggiore rischio di sviluppare una SII ad alvo costipato. Più recentemente un altro studio condotto su pazienti cinesi da Li et al. (2007) non ha evidenziato alcuna associazione col polimorfismo STin2, come già riportato nel 2002 da Pata et al., ma ha dimostrato una più elevata frequenza del genotipo L/L nei pazienti con SII ad alvo costipato (25%) rispetto ai soggetti di controllo (7.3%), confermando in maniera indiretta i risultati di Yeo et al. (2004) e di Park et al. (2006), che avevano osservato una più elevata frequenza del genotipo S/S nei pazienti con SII ad alvo diarroico. La grande variabilità di espressione genotipica in relazione alla popolazione studiata è confermata quindi da questi studi (Tabella 2). Tra gli ultimi, Sikander et al. (2009) hanno riscontrato un’associazione statisticamente significativa tra genotipo S/S e SII ad alvo costipato nella popolazione indiana mettendo a confronto 151 soggetti con SII e 100 controlli sani ed analizzando la prevalenza del genotipo S/S e di quelli non-S/S (riunendo quindi L/L ed L/S in un unico gruppo).
STUDI SII VOL.
SANI RISULTATI
Pata et al,
2002 54 91
Maggiore frequenza del genotipo S/S in pazienti con C-SII (rispetto a D-SII e A-SII)
Maggiore frequenza del genotipo L/S in pazienti con D-SII (rispetto a C-SII e A-SII)
Yeo et al,
2004 194 448
Maggiore frequenza del genotipo S/S in pazienti con D-SII (rispetto ai vol. sani) [genotipo non rilevato rispettivamente nel 4.1% e 4.2% dei pazienti e dei vol. sani]
Kim et al,
2004 276 120
Assenza di associazioni
significative [i pazienti
includevano 256 casi di SII e 20
casi di dolore addominale
cronico] Saito et al, 2007 50 53 Assenza di associazioni significative Lee et al, 2004 33 56 Assenza di associazioni significative Park et al, 2006 190 437
Maggiore frequenza del genotipo S/S in pazienti con D-SII (rispetto ai vol. sani)
Wang et al,
2004 81 48
Maggiore frequenza del genotipo L/L in pazienti con C-SII (rispetto ai vol. sani)
Li et al,
2007 87 96
Maggiore frequenza del genotipo L/L in pazienti con C-SII (rispetto ai vol. sani)
Tabella 2. Polimorfismo 5-HTTLPR e SII. Studi condotti a riguardo
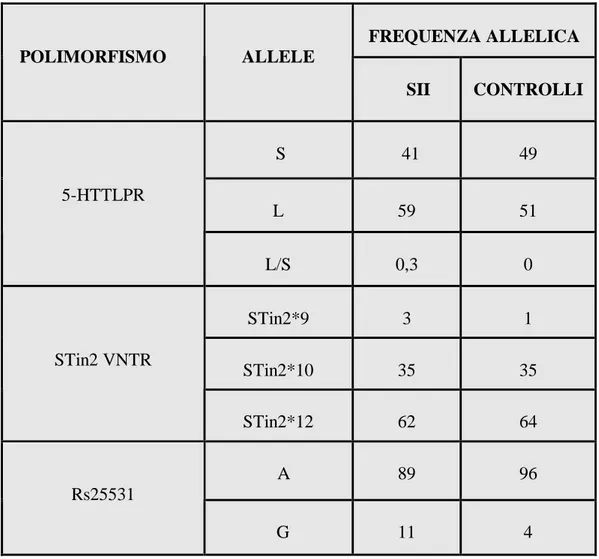
Kohen et al. nel 2008 sono stati i primi a trovare un’associazione tra i vari polimorfismi e l’assetto genetico più frequentemente associato alla SII. Uno studio effettuato su un campione di individui suddivisi in base alla razza ha messo in evidenza le frequenze alleliche riportate in Tabella 3.
FREQUENZA ALLELICA POLIMORFISMO ALLELE SII CONTROLLI S 41 49 L 59 51 5-HTTLPR L/S 0,3 0 STin2*9 3 1 STin2*10 35 35 STin2 VNTR STin2*12 62 64 A 89 96 Rs25531 G 11 4
Tabella 3. Distribuzione delle frequenze alleliche su un totale di 186 soggetti con SII e 50 controlli. I soggetti erano di razza
caucasica (n=193), ed appartenenti ad altre etnie (n=50) (Da Kohen et al., 2008)
Mentre per il genotipo S/S, L/L o S/L ed i polimorfismi STin2*9, STin2*10 ed STin2*12 non è stata trovata una differenza statisticamente significativa tra casi e controlli, per il polimorfismo rs25531 si è osservata l’espressione nettamente predominante dell’allele G nei soggetti affetti da SII, con una percentuale d’incidenza dell’11% rispetto al 4% dei volontari sani. Tale differenza persisteva sia considerando uomini e donne insieme, sia
separatamente, e la modalità di espressione clinica prevalentemente associata era quella di una SII ad alvo diarroico. Confrontando poi tali frequenze genotipiche con la distribuzione nelle varie razze in studio, è emerso che l’allele S nella razza bianca è maggiormente associato al polimorfismo STin2*12 e all’allele A di rs25531.
Niesler et al. (2009) hanno indagato la distribuzione genotipica in relazione al sesso, mettendo in evidenza una minore frequenza del genotipo S/S negli uomini affetti dalla variante diarroica della sindrome, e la prevalenza del genotipo S/S nelle donne affette dalla variante costipata. Nessun legame è stato invece trovato con i genotipi L/S ed L/L. Alla luce di ciò, il sesso potrebbe quindi risultare un fattore di confondimento negli studi precedenti, soprattutto quelli condotti su un piccolo numero di pazienti (Yeo et al., 2004; Park et al., 2006). Ulteriore fattore di confondimento potrebbe essere l’etnia delle popolazioni in studio, considerando che il genotipo L/L è molto più frequente rispetto al genotipo S/S nei soggetti di razza caucasica rispetto agli asiatici (Van Kerkhoven et al., 2007).
Altri Autori hanno cercato di mettere in evidenza anche una eventuale correlazione tra i polimorfismi del SERT e la variabilità interindividuale nella risposta a farmaci in grado di agire sui recettori della 5-HT. Nel 2002 Camilleri et al. hanno infatti riscontrato in un campione di 23 pazienti affetti da SII ad alvo diarroico, riduzione del tempo di transito colico in seguito a somministrazione di alosetron, antagonista dei recettori 5-HT3. Tale effetto era maggiore in pazienti
con genotipo L/L rispetto a quelli con genotipo L/S, coerentemente con l’ipotesi che tale farmaco abbia un’efficacia maggiore nel bloccare i recettori quando minor quantità del neurotrasmettitore è disponibile nello spazio intercellulare, come infatti accade nei soggetti con genotipo L/L in virtù di un miglior reuptake della 5-HT.
Più recentemente Li et al. (2007) hanno studiato la possibile associazione tra il polimorfismo 5-HTTLPR e l’attività terapeutica di tegaserod (un agonista parziale dei recettori 5-HT4) in 41 pazienti
cinesi affetti dalla variante costipata di SII. La percentuale di pazienti responsivi al trattamento era significativamente più elevata nei pazienti con genotipo S/S (85%) e L/S (70%) in confronto ai pazienti con genotipo L/L (36.4%); sfortunatamente gli autori non spiegano i possibili meccanismi alla base di questa differente risposta terapeutica.
Gli studi più recenti hanno posto l’attenzione sul riscontro di un’influenza del polimorfismo 5-HTTLPR nei confronti della risposta agli SSRI (Lerer et al., 2002). Un’efficiente clearance della 5-HT modifica infatti la sensibilità recettoriale. Ne è un esempio la riduzione del fenomeno della “down regulation” nel caso di persistenza del ligando nel vallo sinaptico o a livello dei siti recettoriali. I farmaci come gli SSRI, in grado di modificare la concentrazione della 5-HT o la funzionalità dei suoi recettori, incidono anche sull’assorbimento intestinale e sulle funzioni motorie e secretorie (Camilleri, 2007). Ci si è soprattutto soffermati sulla correlazione tra genotipo S/S e minore efficacia degli SSRI e/o maggiore frequenza di comparsa di effetti collaterali, anche se non tutti gli studi confermano tale dato (Murphy et al., 2004). Infine, confrontando soggetti affetti da SII e controlli sani, è stata messa in luce un’associazione tra genotipo S/S, in combinazione con la variante allelica del polimorfismo del recettore adrenergico α2c caratterizzato
dalla delezione della sequenza nucleotidica 322-325 [α2c
-DEL(322-325)], e maggiore severità della sintomatologia extraintestinale consistente in cefalea, mal di schiena, disturbi del sonno e astenia, oltre ad una incrementata incidenza di comorbidità psichiatrica. Ciò
suggerisce che il polimorfismo 5-HTTLPR sia implicato nella risposta allo stress dei soggetti con SII (Kim et al., 2004). In esperimenti condotti su topi omozigoti recessivi ed eterozigoti per la mutazione la risposta allo stress era particolarmente accentuata, come dimostrato da un anomalo incremento dell’ACTH e del rilascio di ossitocina. Lo stimolo in questo caso consisteva nel posizionare i topi in un labirinto posto ad una determinata altezza dal piano (Li, 2006). Il fatto che la risposta ad un analogo stimolo nei topi con genotipo L/L abbia un’intensità notevolmente ridotta, ha fatto ipotizzare un ruolo del SERT nel limitare la risposta allo stress (Tjurmina et al., 2004).
Fukudo et al. nel 2009 hanno dimostrato una maggiore attivazione delle aree corticali normalmente implicate nella risposta a stimoli emozionali nei soggetti con genotipo S/S in condizioni di aumentata distensione colo-rettale.
In base ai dati attualmente disponibili sembra quindi che il polimorfismo genetico del SERT, pur non svolgendo un ruolo etiopatogenetico primario nella sindrome, possa essere in grado di influenzare l’espressione clinica della SII e la risposta al trattamento con farmaci attivi sui recettori serotoninergici. Non essendo ancora giunti a conclusioni univoche, è necessario proporre ulteriori ricerche per confermare tali possibili associazioni.
SCOPO DELLO STUDIO
Scopo dello studio è stato quello di ricercare possibili associazioni del polimorfismo della regione 5-HTTLPR con le differenti forme della SII (alvo diarroico, alvo costipato e alvo alternante) e/o con la gravità della sintomatologia clinica.
MATERIALI E METODI
Pazienti.
Sono stati arruolati 179 pazienti (41 maschi e 138 femmine) affetti da SII secondo i criteri di Roma II (presenza per un periodo di almeno 12 settimane, anche non consecutive, negli ultimi 12 mesi, di dolore o fastidio addominale caratterizzato da almeno due delle seguenti caratteristiche: dolore alleviato dalla defecazione, variazione della frequenza evacuativa e cambiamento di consistenza delle feci) e suddivisi nelle 3 varianti cliniche: alvo diarroico (D-SII), alvo costipato (C-SII) e alvo alternante (A-SII). L’età dei pazienti era compresa fra i 18 e i 75 anni con un’età media di 38.9 anni. La gravità dei sintomi è stata valutata mediante apposita scala (Francis et al., 1997) che prende in considerazione la gravità e la frequenza del dolore addominale, la gravità della distensione addominale, il grado di soddisfazione delle abitudini intestinali e l’interferenza della SII con la qualità della vita (IBS-Symptome Severity Score; IBS-SSS) (Figura 7).
Sono stati inoltre arruolati 177 volontari sani compatibili per età e sesso. Tutti i soggetti erano italiani di origine caucasica.
Dai pazienti e dai volontari sani è stato estratto DNA genomico ed è stata eseguita genotipizzazione della regione 5-HTTLPR.
Figura 7. Irritable Bowel Syndrome – Symptome Severity Score (IBS-SSS).
Estrazione di DNA genomico da sangue.
Il DNA genomico per la genotipizzazione della regione 5-HTTLPR è stato estratto, sia nei pazienti che nei volontari sani, da sangue intero tramite l’uso di un kit QIAamp DNA blood MINI kit (Qiagen).
IBS-SS Score
Qual è la gravità del suo dolore addominale?
Su un periodo di dieci giorni,quanti giorni ha dolore addominale?
0% 50% 100%
Può quantificare la gravità della distensione addominale?
Quanto è soddisfatto/ delle sue abitudini intestinali?
Quanto l’intestino irritabile interferisce e condiziona il suo lavoro e le sue abitudini di vita? 100% 50% 0% 0% 50% 100% _____X 10 = 0% 50% 100% TOTALE:
Il principio su cui si basa l’estrazione dipende dalla proprietà del DNA di legarsi a supporti inerti. Questi supporti o filtri sono contenuti in colonne e permettono il legame specifico del DNA e l’eliminazione dell’RNA e delle proteine per mezzo di una serie di lavaggi con tamponi appropriati. Il DNA legato al filtro può successivamente essere eluito tramite acqua o tampone contenente Tris-HCl in volume variabile (tampone AE).
Per eseguire l’estrazione, a 25 µl di proteasi K (con attività 600AU/ml), posti sul fondo della provetta, vengono aggiunti 200 µl di sangue intero, a temperatura ambiente, e 200 µl di tampone AL, contenente guanidina cloridrata, senza invertire la sequenza dal momento che la proteasi verrebbe disattivata dal tampone AL. A questo passaggio segue l’incubazione del campione a 56°C per 10 minuti. Al termine si aggiungono al campione 200 µl di etanolo al 100% e, dopo averlo trasferito in apposite provette, si centrifuga e si procede ai lavaggi con due diversi tamponi denominati AW1 e AW2. I tamponi di lavaggio vengono precedentemente diluiti nel seguente modo: 19 ml di AW1 concentrato con 25 ml di etanolo al 100% e 13 ml di AW2 concentrato con 30 ml di etanolo al 100%, e possono essere conservati a temperatura ambiente per un periodo non superiore ad un anno. Infine si procede all’eluizione del DNA genomico con acqua deprivata di enzimi ad azione nucleasica (DNAase free) o con apposito tampone di eluizione AE.
La qualità del DNA genomico così estratto viene verificata per mezzo di analisi elettroforetica in gel di agarosio all’1%. Una volta constatata l’integrità del campione di DNA, questo viene quantificato mediante spettrofotometria e conservato alla temperatura di -20°C fino all’esecuzione delle successive procedure analitiche.
Determinazione del polimorfismo 5-HTTLPR del gene SERT.
La presenza del polimorfismo 5-HTTLPR del gene che codifica per il SERT è stata determinata mediante analisi PCR (polymerase chain reaction). Sono stati disegnati oligonucleotidi specifici (primers) per amplificare regioni di DNA genomico contenenti le varianti short (S) e long (L) 5-HTTLPR. I primers disegnati per tale scopo sono i seguenti:- LPR-F: 5’-GGCGTTGCCGCTCTGAATGC-3’ senso,
corrispondente alla sequenza nucleotidica che va da –1416 a –1397 all’estremità 5’ della regione del promotore del gene SERT;
- LPR-R: 5’-GAGGGACTGAGCTGGACAACCAC-3’ antisenso, corrispondente alla sequenza nucleotidica che va da –910 a –888 all’estremità 5’ della regione del promotore del gene SERT.
La reazione di PCR è stata eseguita in un volume finale di 50 µl contenente i seguenti reattivi: 1 µl di DNA genomico, 25 µl di acqua
DNAase free, 1 µl di dNTP, 1µl di primer F, 1l di primer LPR-R, 10 µl di BUFFER GC resolution, 10 µl di BUFFER 5x DMSO e 1 µl di enzima AmpliTaq polimerasi (ROCHE Diagnostics). La reazione è stata condotta in un thermocycler PCR express (HYBAID) sulla base del seguente protocollo di amplificazione:
1. Denaturazione iniziale del DNA genomico a 94°C per 3 minuti; 2. Denaturazione a 94° per 1 minuto;
3. Annealing a 55°C per 1 minuto; 30 cicli 4. Estensione a 72°C per 1 minuto;
Separazione elettroforetica e determinazione prodotti di PCR.
I prodotti di amplificazione sono stati visualizzati tramite separazione elettroforetica del DNA in gel di agarosio al 2% in tampone TAE 1X (TAE 10X: 48.4 g di Tris base in 800 ml di acqua distillata, 11.42 ml di acido acetico glaciale, 20 ml di EDTA 0.5 M portati ad un volume finale di 1 litro con acqua distillata autoclavata) contenente 3.5 µl di etidio bromuro (10 mg/ml).Si preparano miscele contenenti 2 µl di colorante per DNA e 15 µl di prodotto di amplificazione, e si introducono le singole miscele nei pozzetti del gel. Si procede quindi alla separazione elettroforetica che viene eseguita per mezzo di una apparecchiatura Easy Cast (Genenco Milano, Italia) applicando una differenza di potenziale di 70 V per circa 150 minuti. Le bande relative ai prodotti di PCR vengono visualizzate mediante transilluminatore a raggi ultravioletti UV LIGHT (BioRad Richmond, CA, USA) e fotografate con apparecchio Polaroid MP4 Land Camera (Polaroid, MA, USA) (Figura 8).
Figura 8. Bande elettroforetiche relative ai prodotti di PCR
528 bp 572 bp Omozigote S/S Omozigote L/L Eterozigote L/S
RISULTATI
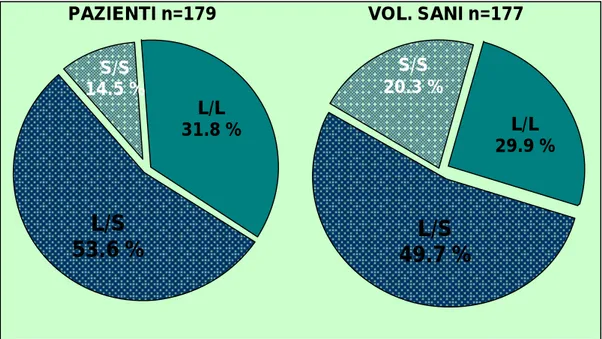
Nei pazienti affetti da SII sono state rilevate le seguenti frequenze genotipiche: (L/L 31.8%, L/S 53.6%, S/S 14.5%). Tali frequenze non differiscono significativamente rispetto a quelle riscontrate nei volontari sani (L/L 29.9%, L/S 49.7%, S/S 20.3%); (Chi-square test: P=0.351) (Figura 9).
Figura 9. Frequenze genotipiche dei pazienti con SII e dei volontari sani
Stratificando i pazienti in base alle varianti cliniche si osserva la distribuzione genotipica riportata nella Tabella 4.
L/S
53.6 %
L/L 31.8 %L/S
49.7 %
PAZIENTI n=179 VOL. SANI n=177
S/S 14.5 % L/L 29.9 % S/S 20.3 %
Tabella 4. Polimorfismo e forme cliniche della SII
Confrontando le frequenze genotipiche dei 3 sottogruppi con quelle dei volontari sani non emergono differenze significative nei differenti gruppi di pazienti. Tuttavia, nel sottogruppo con variante costipata (C-SII), è da sottolineare una tendenza verso una più bassa prevalenza del genotipo S/S (10.9% nei pazienti con C-SII rispetto al 20.3% dei volontari sani) e una più alta frequenza del genotipo L/L (39.1% rispetto al 29.9% dei volontari sani).
La gravità dei sintomi, stimata tramite la scala di Francis-Whorwell, nei differenti genotipi è risultata: L/L 282.7 ± 76.8; L/S 290.3 ± 77.6; S/S 303.6 ± 92.5 senza differenze significative tra i diversi gruppi (ANOVA: F=0.620, P=0.539) (Figura 10).
Ponendo in relazione i punteggi della gravità clinica con le tre combinazioni genotipiche del polimorfismo (L/L, L/S e S/S) nell’ambito delle varianti cliniche, è stato notato che, nel sottogruppo di pazienti con alvo prevalentemente costipato, i soggetti con genotipo
20.3% 15.7% 10.9% 17.2% O Ommoozziiggoottee S S//SS 49.7% 62.7% 50.0% 50.0% E Etteerroozziiggoottee L L//SS 29.9% 21.6% 39.1% 32.8% O Ommoozziiggoottee L L//LL Volontari sani N=177 Pazienti A-SII N=51 Pazienti C-SII N=64 Pazienti D-SII N=64 G GEENNOOTTIIPPOO
S/S tendono ad avere un punteggio superiore (360.0 ± 91.8) rispetto ai pazienti con genotipo L/S (312.1 ± 73.1) e ai pazienti con genotipo L/L affetti da SII (303.6 ± 92.5). Tuttavia tali differenze non riescono, seppur di poco, a raggiungere la significatività statistica.
Figura 10. Gravità dei sintomi distribuita per genotipi
Infine, indipendentemente dal genotipo, tra le differenti forme cliniche della SII si rileva una differenza significativa della gravità dei sintomi nelle tre varianti: i soggetti con alvo prevalentemente costipato riferiscono una maggiore gravità dei sintomi (312.1 ± 73.1) rispetto ai soggetti con alvo prevalentemente diarroico (271.9 ± 84.9) o alternante (284.4 ± 74.9) (ANOVA: F=4.405, P=0.014).