UNIVERSITÀ DEGLI STUDI DI PISA
Dipartimento di Farmacia
Corso di Laurea Specialistica in Farmacia
Tesi di Laurea
Utilizzi di colture sferoidi come
modello tridimensionale per
sperimentazioni in vitro
Relatore: Candidato:
Prof. Antonio Lucacchini Alberto Furia
Correlatore:
Prof. Gino Giannaccini
1
A Stefania, ai miei genitori,
2
Indice
Introduzione ... 3
Elenco delle abbreviazioni... 4
Glossario ... 5
Sezione Introduttiva ... 7
1 La coltura cellulare di sferoidi ... 7
1.1 Comparazione tra la coltura sferoide e la coltura 2D ... 7
1.2 Metodi di fabbricazione di sferoidi cellulari ... 8
1.3 Gli sferoidi come strumento per l’indagine dei rapporti intercellulari ... 11
1.3.1 Studi sulla biologia tumorale e sul fenomeno nemosis……….11
1.3.2 Ingegneria dei tessuti nativi………...11
1.4 Sfide Analitiche ... 13
2 Il microambiente della coltura di sferoidi ... 14
2.1 Le tre dimensioni del microambiente: interazioni tra i fattori biochimici, fisici e geometrici ... 16
2.2 Limiti di spazio nelle piattaforme 3D ... 18
2.3 Relazione tra dimensione del microtessuto ed espressione genica ... 21
2.4 Ruolo dell’ipossia nelle colture cellulari 3D ... 22
3 Le cellule staminali in colture 3D di sferoidi ... 24
3.1 Formazione di sferoidi da tessuto adiposo di cellule staminali coltivate su chitosano e miglioramento del potenziale cardiomiogenico ... 25
4 Gli sferoidi come modello 3D per lo studio di tumori ... 30
4.1 Differenze nella risposta a test farmacologici tra colture monostrato 2D e colture di sferoidi 3D ... 31
4.2 Sviluppo e caratterizzazione in vitro di un mesotelioma umano in un modello 3D per studiare la terapia con l’immunotossina SS1P ... 33
Conclusioni e sviluppi futuri ... 37
3
Introduzione
Il lavoro proposto in questa tesi si pone l’obiettivo di analizzare alcune tra le possibili applicazioni delle colture cellulari in sferoidi come modello 3D per la sperimentazione in vitro.
Nella coltura di sferoidi un piccolo aggregato di cellule cresce libero da materiali estranei ed è in grado sia di secernere la matrice extracellulare (ECM) in cui risiede, sia di interagire con le altre cellule dal suo microambiente originale.
Il valore delle colture di sferoidi sta aumentando rapidamente grazie alle nuove piattaforme microfabbricate trattabili con le tecniche di high-throughput screening (HTS) e ai progressi nella coltura cellulare.
In questo lavoro di tesi andiamo ad esaminare nuove possibilità che uniscono i punti di forza della coltura di sferoidi con i moderni metodi di fabbricazione del microambiente che permettono la creazione di un elevato numero di tessuti complessi altamente riproducibili, ponendo particolare attenzione a quei lavori di ricerca dove tale approccio è stato utilizzato su colture di cellule staminali, per test farmacologici e di biologia tumorale.
4
Elenco delle abbreviazioni
− 5-azacitidina (5-aza)
− 5-fluorouracile (5-FU)
− cellule endoteliali della vena ombelicale umana (HUVEC)
− cellule staminali adulte (ASC)
− cellule staminali embrionali (ESC)
− cellule staminali mesenchimali umane (hMSCs)
− cellule stromali mesenchimali multipotenti (MSC)
− high-throughput screening (HTS)
− matrice extracellulare (ECM)
− tecnica di sovrapposizione del liquido statico (LOT)
5
Glossario
High-throughput screening (HTS): è un metodo per la sperimentazione scientifica
particolarmente utilizzato nella scoperta di farmaci ed è di importanza rilevante nei campi della biologia e della chimica. Utilizzando la robotica, l’elaborazione dei dati e il software di controllo, dispositivi di movimentazione dei liquidi e rivelatori sensibili, l’High-Throughput Screening consente al ricercatore di condurre rapidamente milioni di esami chimici, farmacologici e genetici. Attraverso questo processo si possono identificare rapidamente i composti attivi, gli anticorpi o i geni che modulano un particolare percorso biomolecolare. I risultati di questi esperimenti forniscono punti di partenza per la progettazione di farmaci e per comprendere l’interazione o il ruolo di un particolare processo biochimico in biologia.
Cellule mature: sono isolate da organi specifici, hanno limitata capacità di
proliferazione e non ne possono essere ottenute grandi popolazioni.
Tecniche di microfabbricazione: tecniche per facilitare la formazione di modelli di
dimensioni micrometriche attraverso l’uso della tecnologia con cui si producono chip per computer (ad esempio, wafer di silicio).
Microfluidica: gestione di volumi di microlitri con forme di dimensioni micrometriche
(per esempio, canali) per controllare la precisa compartimentalizzazione di cellule e / o sostanze.
Organoidi: organizzazione di cellule mature, cellule staminali adulte e cellule staminali
6 possono essere utilizzati come modelli per la scoperta di nuovi farmaci, come unità di tessuto per l’impianto, o per comprendere meccanismi di rigenerazione dell’organo.
Cellule organo-specifiche staminali adulte o cellule progenitrici: cellule che possono
formare strutture tissutali riproducendo precisamente la fisiologia adulta. Non sono cancerogene ma possono far parte di un solo organo (ad esempio, epitelio).
Cellule staminali pluripotenti: possono formare tutti i tessuti, ma anche generare
inadeguate popolazioni cellulari e tumori. Le cellule staminali embrionali possono formare interi organi.
Coltura cellulare in sferoidi: popolazione di cellule non-substrato-aderenti, aggregate,
reciprocamente aderenti, che adottano una forma più o meno sferica.
Matrigel: nome commerciale di una miscela proteica gelatinosa secreta dalle
Engelbreth - Holm - Swarm (EHS), le cellule del sarcoma di topo. Questa miscela è simile all’ambiente extracellulare complesso presente in molti tessuti ed è utilizzata dai biologi cellulari come substrato per la coltura cellulare.
7
Sezione Introduttiva
1
La coltura cellulare di sferoidi
1.1
Comparazione tra la coltura sferoide e la coltura 2D
Nel corpo le cellule sono tipicamente circondate da una matrice extracellulare (ECM) o sono in contatto fisico diretto con cellule sia della medesima che di altra linea. Tuttavia, la maggior parte degli studi di biologia cellulare viene eseguita utilizzando cellule aderenti a substrati di polistirene coltura-compatibile in un monostrato 2D. Questo approccio si traduce in un ambiente cellulare ben controllato e omogeneo che facilita l’analisi microscopica e sostiene la proliferazione della maggior parte dei tipi di cellule. Tuttavia, questo non è generalmente considerato il microambiente naturale delle cellule. Alternativamente, nei metodi di coltura 3D, le cellule sono coltivate come aggregati (1), sono coltivate su di un’impalcatura di materiali 3D (2), o sono incorporate in un gel (3). Gli aggregati hanno molti nomi diversi, che vanno da mammosfere (4), micromasse (5), sferoidi (6), fino a tessuti microfabbricati (7). Preferiamo il termine
sferoide per indicare le cellule aggregate (non necessariamente di una perfetta forma
sferica), che non aderiscono a qualsiasi substrato colturale (ad esempio, polistirene). Le cellule in un ambiente 3D si comportano in modo fondamentalmente diverso dalle cellule in coltura monostrato. Per esempio, sia i condrociti primari che gli epatociti perdono rapidamente il loro normale fenotipo una volta tolti dal corpo e messi in coltura cellulare 2D, ma questa perdita può essere attenuata o addirittura annullata dalla metodologia di coltura 3D (8; 9). Inoltre, le cellule stromali mesenchimali multipotenti
8 (MSC) derivate dagli epatociti, supportano funzioni chiave come la sintesi dell’albumina e dell’urea, così come la clearance di ammoniaca e di farmaci, con una maggiore efficienza in ambiente 3D (10). Molte delle differenze osservate tra coltura 2D e sferoide sono dovute a differenti interazioni cellula-cellula e cellula-matrice.
1.2
Metodi di fabbricazione di sferoidi cellulari
Sono molti i metodi di fabbricazione utilizzati per creare sferoidi (Figura 1). I primi dati descrivono il metodo della goccia pendente (Figura 1a e b), dove le cellule si aggregano spontaneamente nel fondo di una goccia dopo l’inversione di un piatto con gocce di sospensione cellulare (11). In alternativa, gli spinner flasks permettono l’aggregazione spontanea delle cellule (12). Un’altra tecnica, chiamata tecnica di sovrapposizione del liquido statico (LOT), dove le cellule sospese sono coltivate su un substrato non aderente, induce le cellule ad aggregare anziché aderire a una superficie (13) (Figura 1a). Gli sferoidi possono anche essere formati tramite centrifugazione (14). Più recentemente, le cellule sono state seminate su superfici micromodellate non aderenti in dispositivi microfabbricati (7) (Figura 1d). Queste tecniche aprono le porte a nuove applicazioni di colture di sferoidi, come gli high-throughput screening di tessuto 3D, e come gli innesti di tessuto organotipici (15).
9 Figura 1. Metodi di fabbricazione di sferoidi: (a) tecnica della sovrapposizione di liquido, (b) tecnica della goccia a sospensione; (c) micropozzetti nella tecnica di goccia a sospensione; (d) micropozzetti a matrice di agarosio (e, f) formazione di sferoidi tramite microfluidica.
Per essere ampiamente applicate dalla comunità scientifica, tali tecniche devono essere facili e rapide da usare, convenienti e compatibili con i macchinari (ad esempio, i dispositivi robotici di manipolazione dei liquidi ed i microscopi). Vediamo, in sintesi, le procedure di produzione di sferoidi con le tecniche sopracitate:
Overlay Liquido / coltura cellulare in sospensione: questo metodo consiste nella
formazione di aggregati cellulari in sospensione mediante agitazione di grandi volumi di terreno di coltura. Questa è una soluzione interessante per la produzione di massa che ha
10 beneficiato principalmente dello sviluppo di bioreattori (16). Attualmente non consente un controllo preciso della dimensione degli aggregati (Figura 1a).
Microfabbricati a goccia appesa: questo metodo consiste nel formare aggregati in
gocce appese ad una superficie (Figura 1b). Nuove piattaforme di 96 e 384 pozzetti permettono la formazione di aggregati più piccoli, con una dimensione più controllata e un minor lavoro manuale. Queste nuove piattaforme sono disponibili in commercio (Figura 1c).
Array di Micropozzetti: il metodo originale consiste nel formare aggregati in piastre
da 96 pozzetti a fondo tondo non aderenti. Nuove piattaforme chiamate array di micropozzetti hanno un elevato numero di pozzi in scala micrometrica (17; 18; 19). I laboratori a bassa capacità tecnologica potrebbero utilizzare timbri (ad esempio, stampe elastomeriche realizzate tramite leggera litografia) per imprimere continuamente sull’agarosio degli array di micropozzetti (metodo semplice e buon rapporto costo-efficacia (17; 18) (Figura 1d). I laboratori ad alta capacità tecnologica posso invece usare questo metodo per piastre a 96 pozzetti (20) o combinarlo con le tecniche microfluidiche (21). Attualmente è in commercio una piattaforma con pozzetti di 400 micrometri.
Microfluidica: i canali microfluidici sono utilizzati per promuovere la formazione di
aggregati cellulari. Si ha così la possibilità di produrre in continuo aggregati di dimensioni altamente controllate (22). Questo metodo richiede attualmente una alta capacità tecnologica (Figura 1e, 1f).
11
1.3
Gli sferoidi come strumento per l’indagine dei rapporti
intercellulari
1.3.1
Studi sulla biologia tumorale e sul fenomeno nemosis
Gli sferoidi sono stati utilizzati anche come strumento per investigare il ruolo delle molecole di adesione nella biologia tumorale. Gli sferoidi multicellulari tumorali hanno una maggiore resistenza chemioterapica rispetto alle stesse cellule in coltura monostrato. La cultura sferoide è stata anche fondamentale per l’analisi di un nuovo fenomeno di immuno-attivazione, definito nemosis (23). Questo fenomeno è descritto come una morte cellulare programmata in sferoidi di fibroblasti attivati senza l’espressione di marcatori apoptotici e accompagnata da produzione di ciclossigenasi (COX) 2.
1.3.2
Ingegneria dei tessuti nativi
Organi e tessuti non sono in genere composti da una popolazione cellulare omogenea, ma piuttosto sono strutture complesse con una complicata architettura di vasi, nervi e stroma. Questa complessa interazione di fattori richiede un ambiente 3D per analizzare le molte variabili implicate. Classici esempi dell’uso di sferoidi per la replicazione di un ambiente di un tessuto complesso sono il tessuto cartilagineo (24), il tessuto pancreatico (25) e il tessuto del muscolo cardiaco (26).
Questi costrutti di ingegneria tissutale hanno dimensioni limitate a causa del fatto che in genere non hanno una rete vascolare. Ciò si traduce in una distribuzione inadeguata dell’apporto di ossigeno e sostanze nutritive al costrutto impiantato ed una limitata integrazione con l’ospite.
12 Figura 2. Schema di due esempi di una popolazione mista di due tipi di cellule incorporate in uno sferoide conseguentemente alla formazione o di uno strato (percorso superiore: fibroblasti umani aortici misti - in rosso - e delle cellule endoteliali HUVEC della vena ombelicale umana - in verde - rapporto 10:1) o di strutture vascolari (percorso inferiore: co-coltura di cellule staminali mesenchimali umane (hMSCs) e HUVECs; rapporto sconosciuto (Scala in bar, 20 µm).
Una possibile soluzione a questo problema è la prevascolarizzazione di innesti in
vitro (6; 27; 28) (Figura 2). La vascolarizzazione è un processo 3D in cui si sviluppano
le strutture vascolari all’interno di un altro tessuto. La coltura di sferoidi è un modello di sistema interessante per la vascolarizzazione, perché il denso ambiente cellulare è combinato con la presenza di ECM naturale e si ha la possibilità di includere il sostegno di cellule, come precursori mesenchimali, che offrono una buona somiglianza con l’ambiente naturale in cui avviene la vascolarizzazione. Oltre a tessuti come fegato, muscolo e tessuto cardiaco (29), sono stati utilizzati sferoidi per progettare ossa prevascolarizzate (6). Normalmente, i vasi si formano negli embrioni da cellule endoteliali che sono assemblate in reti vascolari primitive (30). Similmente, negli sferoidi formati dalle MSC umane e dalle cellule endoteliali della vena ombelicale umana (HUVEC) si sviluppano strutture vascolari primitive (31) (Figura 2).
Funzionalmente, queste reti vascolari ingegnerizzate contribuiscono a migliorare la sopravvivenza delle cellule impiantate (32), la formazione de novo di osso (6), e
13 tessuti muscolari scheletrici (28). Così risulta possibile la formazione di caratteristiche native (ad esempio, reti vascolari e neurali) in sferoidi in modo da promuovere la formazione di un tessuto adatto allo sviluppo in vitro.
1.4
Sfide Analitiche
Fino a poco tempo fa, l’high-throughput screening (HTS) è stato eseguito prevalentemente con colture monostrato. La Tecnica Statica di HTS ha recentemente incorporato metodi di coltura 3D, e può essere utilizzata per la selezione di farmaci clinicamente rilevanti (33).
Le nuove tecnologie robotiche facilitano l’HTS a lungo termine di sferoidi, permettendo sia la coltivazione di 384 sferoidi in una sospensione ridotta, sia il cambiamento di terreno, sia lo screening di sostanze tossiche (34). Per lo screening di tossicità tuttavia, l’HTS è ancora ostacolato da limitazioni nella penetrazione del principio attivo, da fenomeni di multiresistenza ai farmaci, e dalla carenza di ossigeno. Il controllo delle dimensioni dello sferoide può trasformare lo svantaggio della carenza di ossigeno in un vantaggio, diventando una parte essenziale del saggio, per esempio, in screening di farmaci antineoplastici (35).
Inoltre, gli sferoidi possono essere usati per predire gradienti di ossigeno che determinano risposte cellulari (36) o embriotossicità (37).
La cultura in 3D può essere ottenuta anche con i canali microfluidici per fornire un flusso costante di nutrienti o di sostanze per una larga serie di sferoidi (38; 39) (Figura 1e, 1f). Mentre i protocolli analitici HTS basati su colture cellulari 2D sono ben definiti (40), mentre i metodi HTS 3D pongono nuove sfide analitiche.
14
2
Il microambiente della coltura di sferoidi
La coltura di cellule come aggregati in tre dimensioni (3D) può migliorare i saggi in vitro sia per la ricerca biologica di base sia per lo sviluppo di terapie. I modelli di colture 3D, tuttavia, sono spesso molto più complicati, macchinosi, e costosi delle colture a due dimensioni (2D). La coltura cellulare a tre dimensioni (3D) è però giustificata dalla necessità di lavorare con modelli cellulari che meglio simulino i tessuti fisiologici. Le funzioni e le risposte cellulari che sono presenti nei tessuti sono spesso perse nelle tradizionali colture cellulari 2D basate su piastra. È così dunque limitata la capacità predittiva dei saggi farmacologici ed i risultati della ricerca in biologia cellulare ne risultano deviati (41). Di conseguenza, molti ricercatori si sono dedicati a sviluppare tecniche di coltura cellulare 3D che replicassero in modo migliore le condizioni in vivo.
La formazione di sferoidi è uno dei modelli meglio caratterizzati per la coltura 3D grazie alla sua semplicità, riproducibilità e somiglianza con i tessuti fisiologici se paragonato ad altri metodi che richiedono impalcature a matrice extracellulare (ECM) e sistemi in idrogel (33; 42).
Gli sferoidi sono raggruppamenti sferici auto-assemblanti di colonie cellulari coltivate in ambienti dove le interazioni cellula-cellula predominano sulle interazioni cellula-substrato, e spontaneamente mimano tumori non vascolarizzati. Pertanto, gli sferoidi sono eccellenti modelli fisiologici di tumore e sono noti per fornire dati terapeutici più affidabili e significativi rispetto ai saggi 2D (33; 43). Gli sferoidi permettono l’auto-organizzazione cellulare di appropriate strutture 3D dell’ECM con complesse interazioni cellula-matrice e cellula-cellula che simulano le proprietà funzionali dei corrispondenti tessuti in vivo.Ancora più importante, gli sferoidi possono
15 essere monitorati facilmente per le osservazioni pratiche giornaliere. Come risultato, le colture di sferoidi sono state considerate come un’alterativa fisiologicamente valida alle colture 2D per decenni (44; 45).
Sebbene i vantaggi degli sferoidi siano stati ampiamente riconosciuti, è stato difficile adattare la coltura di sferoidi ad un sistema di controllo e saggio HTS. I metodi tipici di formazione degli sferoidi includono le gocce pendenti sul lato inferiore dei coperchi della piastra di coltura, coltura delle cellule su superfici non aderenti, matracci di coltura a mescolamento e sistemi di coltura cellulare a vaso rotante (46). Questi tradizionali sistemi di coltura e formazione di sferoidi, comunque, sono spesso troppo lunghi, producono sferoidi dalle dimensioni variabili, a bassa resa e difficili da manipolare.
Recentemente, sono stati sviluppati diversi strumenti a microfluido (sferoidi su chip) (47; 48) per aumentare l’efficienza della formazione degli sferoidi, per offrire un miglior controllo delle dimensioni degli stessi e per semplificare le procedure di manipolazione. Molte di queste tecniche, comunque, soffrono ancora di problemi come la coltura a lungo termine e la compatibilità dello strumento con i farmaci. Purtroppo però queste tecniche spesso non sono compatibili con gli attuali robots per la manipolazione dei liquidi e per l’esecuzione di controlli HTS.
16
2.1
Le tre dimensioni del microambiente: interazioni tra i
fattori biochimici, fisici e geometrici
Tradizionalmente, il significato di tridimensionalità nella coltura cellulare è stato semplicemente associato ad un microambiente purché 3D. In realtà il significato va esteso all’intero microambiente che sostiene la formazione di microtessuti che mostrano una “complessa” rilevanza fisiologica o una migliore emulazione della funzionalità del microtessuto in vivo, che non risulta possibile ottenere nelle colture 2D (49). Gli studi hanno fornito delle informazioni sui tre fattori principali del microambiente (o le “tre dimensioni”) delle cellule: la composizione chimica o biochimica, le dimensioni spazio-temporali (geometria 3D) e le proprietà fisiche del substrato (49; 50; 51; 52). Sebbene sia stata rivolta maggiore attenzione ai fattori biochimici, come l’adesione intercellulare mediata da integrine o la presenza di peptidi RGD nelle colture 3D, e ai fattori biofisici, come il carico e lo scarico di matrici di collagene, le interazioni tra queste due classi di fattori non sono state studiate approfonditamente.
L’effetto dei fattori microambientali già menzionati non è unico, ma essi agiscono sinergicamente nello spingere le cellule verso un risultato specifico. Per esempio, anche se la dimensione regolare del microtessuto potrebbe sembrare irrilevante, potrebbe avere indirettamente maggiori implicazioni sulla risposta funzionale delle cellule. Se lo sferoide tissutale formato è troppo piccolo, potrebbe mancare della complessità fisiologicamente rilevante e potrebbe non emulare la complessa funzionalità presente in vivo. Al contrario, se lo sferoide tissutale è grande entra in gioco il fattore spazio: la limitata diffusione dell’ossigeno potrebbe portare alla formazione di una zona centrale necrotica, riducendo la viabilità e influenzando il
17 risultato fenotipico. È risaputo che l’ossigeno può diffondersi quando lo spessore del tessuto è di 100-200 µ m: per prevenire fenomeni ipossici bisogna quindi mantenere l’aggregato ad una dimensione ottimale di circa 250 µm (50). Tuttavia, questa dimensione non va considerata come un valore assoluto, in quanto quella ottimale potrebbe dipendere dall’applicazione specifica.
Nel campo della medicina rigenerativa, si cerca incessantemente di evitare l’ipossia per produrre tessuti più grandi con una viabilità più alta per impianti in vivo, mentre nel campo della farmacologia si potrebbe beneficiare della variabile ipossia nella progettazione di piattaforme sperimentali dato che l’ipossia è un fenomeno fisiologicamente rilevante ed è importante per molti processi in vivo, come lo sviluppo e l’avanzamento di una neoplasia. Infatti l’ipossia è stata ampiamente ritenuta l’iniziatore dell’angiogenesi dei tumori vascolari, della vasculogenesi durante lo sviluppo delle strutture vascolari embrionali e il regolatore delle differenziazioni terminali (53). In quanto tale, è importante regolare la dimensione del tessuto nella coltura 3D per includere o eliminare gli effetti dell’ipossia nel fenomeno fisiologico interessato.
Ad esempio, nella farmacologia antitumorale, la prova di un composto potrebbe avere successo nei primi stadi del tumore mentre potrebbe risultare inadeguato se testato su di uno sferoide tumorale di grandi dimensioni, evidenziando una resistenza farmacologica del tumore causata invece dall’ipossia. È pertanto importante una progettazione razionale ed accurata nella scelta di una piattaforma 3D, dove il bisogno di un rigido controllo dei microtessuti si associa alla necessità di flessibilità per alterare la dimensione del microtessuto per meglio emulare le condizioni in vivo (Figura 3).
18 Figura 3: Tre categorie di piattaforme 3D. (a) idrogel (AlgiMatrix) con microtessuti eterogenei (epatociti umani C3A) colorati con colorante sopravitale: le cellule non vitali (in rosso) sono visibili al centro di aggregati di grandi dimensioni. (b) Piastra di polistirene che impone un vincolo di dimensioni ma offre una vasta gamma di dimensioni del poro. (c) SU-8 (materiale fotosensibile) impalcatura a micropozzetti che fornisce una porosità uniforme.
2.2
Limiti di spazio nelle piattaforme 3D
La maggior parte delle piattaforme 3D disponibili in commercio possono essere classificate in tre categorie in base ai costituenti che, a loro volta determinano i vincoli di spazio:
19
1) Idrogel (acido alginico, agar, chitosano, fibrina, acido ialuronico e collagene
per nominarne solo alcuni) che non può esercitare un controllo sulla dimensione dei microtessuti, dando vita quindi a sferoidi eterogenei per dimensioni. In tali costrutti, i microtessuti variano dall’essere giusto un aggregato di poche cellule, fino ad ammassi più grandi al di sopra della dimensione cruciale per la diffusione di ossigeno, tanto da poter procurare una risposta alterata. Le dimensioni dei tessuti dipendono dalla densità di produzione e dalla proliferazione cellulare e, dato che il materiale della struttura è flessibile, non vi è limite fisico alla dimensione degli aggregati formati. Recentemente, è stata usata una strategia del gradiente di depressurizzazione per controllare la porosità e il diametro del poro in idrogel di chitosano. Tuttavia è da verificare se questa tecnologia possa avere successo con idrogel composti da altri substrati (54). Anche le colture sferoidi libere dalle strutture rientrano nella stessa categoria perché la loro dimensione dipende anche dai fattori già menzionati piuttosto che da restrizioni fisiche. Le dimensioni degli aggregati, che crescono in flasks rotanti o in reattori a serbatoio con agitazione continua, possono essere regolati da fattori fisici, come i giri al minuto e le forze tangenziali della fluidica, che si attiva solo quando gli sferoidi crescono al di sopra della dimensione cruciale. Inoltre, i tessuti più grandi subiscono un frazionamento casuale dando origine a microtessuti di dimensioni eterogenee. Anche i tessuti più piccoli presenti nelle colture, che vanno da cellule singole alla soglia limite, non sono colpiti da questo meccanismo.
2) Strutture microporose sintetiche costituite da materiali rigidi (ad esempio, i
polimeri, come il polistirene) che pongono un vincolo fisico sulla dimensione dei microtessuti, ma con un’ampia gamma di dimensione dei pori, dando nuovamente
20 origine a sferoidi di dimensioni variabili. Tuttavia, l’estensione della variabilità è più bassa rispetto a quanto riscontrato negli idrogel, definibile nel momento in cui la gamma delle dimensioni dei pori è conosciuta dal fruitore.
3) Strutture polimeriche, con una geometria definita e dimensioni omogenee dei
pori, che forniscono un rigido controllo dello spazio e quindi della dimensione del microtessuto. Se seminati ad una densità cellulare ottimale, tali strutture producono una serie di aggregati delle stesse dimensioni; tuttavia, potrebbero mancare della necessaria flessibilità e per un’applicazione specifica. Per esempio, una struttura con un poro di una dimensione definita di 200 µm potrebbe non essere adatta allo studio o allo sviluppo di un farmaco antitumorale mirato agli ultimi stadi del processo neoplastico, quando le dimensioni della massa tumorale possono indurre ipossia e/o neoangiogenesi. Al contrario, nello sviluppo di un modello sperimentale in cui un farmaco venga testato su di un tessuto ottenuto dalla differenziazione di cellule staminali, una dimensione maggiore del poro (ad esempio 500 µm) potrebbe produrre sferoidi con nuclei ipossici e questo potrebbe influenzare la capacità di differenziazione delle cellule, dando vita ad un modello tissutale diverso.
Ammettendo tale variabilità, si potrebbe osservare una differenza nella risposta generata dallo stesso trattamento specifico delle stesse cellule che crescono su diverse piattaforme 3D, rendendo quindi ogni paragone troppo difficile se non impossibile. Si deve considerare che la variabilità della dimensione del tessuto può portare ad ipossia come anche ad altre reazioni non identificabili che, turbando l’espressione genica, causano un’alterazione della risposta riguardo al trattamento somministrato.
21
2.3
Relazione tra dimensione del microtessuto ed
espressione genica
Come discusso sopra, se la dimensione del microtessuto supera la soglia limite per la diffusione dell’ossigeno, le cellule all’interno dell’aggregato diventano ipossiche. L’ipossia può manifestarsi con un turbamento dell’espressione genica poiché il potenziale redox regola l’espressione di un’ampia gamma di geni responsabili del trasporto dell’ossigeno, del metabolismo del ferro, dell’assorbimento dei nutrienti e del glucosio, della produzione di ATP, di vie metaboliche come glicolisi o proteosintesi, dell’angiogenesi, della produzione della matrice extra-cellulare, così come del sistema della coagulazione, della resistenza al farmaco, della regolazione del pH, della produzione di fattori di crescita e citochine (55; 56).
Generalmente queste variazioni nell’espressione genica sono state attribuite unicamente alla transizione dalla piattaforma 2D a quella 3D; bisogna invece considerare che anche altri fattori, associati ad una dimensione maggiore del tessuto, potrebbero essere responsabili di queste variazioni dell’espressione genica, e che quindi molti di loro potrebbero essere assenti nelle colture 3D di piccole dimensioni.
Perciò, per valutare i geni la cui espressione è significativamente alterata a causa delle condizioni della coltura 3D, è necessario che la dimensione del microtessuto sia accuratamente controllata, altrimenti i geni influenzati, vanno a sommarsi e, potenzialmente, a mascherare quelli variati a causa del trattamento specifico.
22
2.4
Ruolo dell’ipossia nelle colture cellulari 3D
Il fattore spazio e il fattore biochimico del microambiente non sono reciprocamente indipendenti perché un aumento della dimensione porta ad un esaurimento dell’ossigeno e crea condizioni di crescita ipossica. La maggior parte delle piattaforme di crescita 3D disponibile in commercio o non regolano la dimensione delle piattaforme o la limitano per prevenire l’ipossia.
Tuttavia, l’ipossia è un fenomeno fisiologicamente rilevante incontrato nei tumori vascolari e nei loculi di cellule staminali e modifica l’espressione genica delle cellule. Come tale, dovrebbe essere un fattore chiave nella progettazione razionale o nella selezione di piattaforme 3D HTS nella fase preclinica di studo dei farmaci. Per esempio, per testare il potenziale citotossico degli agenti chemioterapici, potrebbe essere più auspicabile usare microtessuti ipossici piuttosto che normossici (più piccoli) perché potrebbero essere suscettibili alle loro azioni apoptopiche e produrre falsi positivi.
Allo stesso modo, per la generazione di modelli di tessuto dalle cellule staminali per la selezione di farmaci, una dimensione limite dovrebbe essere scelta in base allo stato delle cellule (inteso come quota in grado di autorinnovarsi e differenziare) richiesto per l’applicazione.
Considerando l’incremento dell’uso dalle piattaforme 3D rispetto alle tradizionali colture in monostrato nel mantenimento e differenziazione di cellule staminali con lo scopo di generare modelli complessi di particolari tipi di tessuto per testare i farmaci, le condizioni associate al microambiente 3D vanno prese in considerazione dato che è risaputo che la tensione dell’ossigeno influenza la quiescenza,
23 la proliferazione e la differenzazione delle cellule staminali sia in vitro che in vivo (57). È stato dimostrato che le cellule staminali emopoietiche risiedono probabilmente nelle aree del midollo con un basso livello di ossigeno, lontano dai vasi sanguigni, e l’ipossia sembra regolare l’emopoiesi midollare, influenzando la sopravvivenza, il metabolismo e il ciclo delle cellule staminali emopoietiche, e fornendo altresì una protezione dallo stress ossidativo (58).
Dato che l’ipossia ha un ruolo così importante nel determinare il destino delle cellule staminali, è essenziale regolare la dimensione del microtessuto sia per mantenere la capacità di differenziazione delle cellule che per indurre la differenziazione verso una linea particolare. Perciò una piattaforma che non mantenga una omogeneità dimensionale dei microtessuti potrebbe produrre una eterotopia cellulare, con alcune differenziate in un senso, altre in un altro, ed altre ancora che hanno perso la capacità di differenziare, producendo quindi differenti risposte farmacologiche. Una popolazione mista è una condizione fisiologicamente rilevante; tuttavia ogni microtessuto dovrebbe avere la stessa distribuzione percentuale dei tipi cellulari costituenti per generare una valida e paragonabile risposta ai farmaci. Se la dimensione degli aggregati è diversa, quelli più piccoli potrebbero avere una proporzione più alta di cellule differenziate mentre in quelli più grandi vi potrebbe essere una frazione staminale maggiore dato che i loro nuclei diventano ipossici e mantengono la staminalità delle cellule.
24
3
Le cellule staminali in colture 3D di sferoidi
La disponibilità di tipi di cellule ben caratterizzate è la preoccupazione principale nel processo di scoperta dei farmaci. Queste cellule sono generalmente ottenute da un tessuto primario sottoposte ad un processo di immortalizzazione oppure sono cellule tumorali o infine cellule geneticamente modificate.
Rispetto alle cellule primarie e alle cellule immortalizzate, le cellule staminali offrono indubbi vantaggi poiché sono geneticamente normali e possono essere mantenute in coltura per periodi prolungati, aumentando la loro applicabilità nel processo di screening.
Recentemente, molti studi hanno mostrato che le colture 3D hanno prestazioni migliori rispetto alle colture monostrato 2D per quanto riguarda la promozione della crescita delle cellule staminali, la loro differenziazione, lo sviluppo e la funzionalità di strutture complesse fisiologicamente rilevanti.
In confronto alle colture 2D, le cellule staminali embrioniali cresciute in colture 3D possono essere differenziate in epatociti che mostrano una stretta somiglianza con i loro equivalenti in vivo in termini di morfologia, espressione genica e comportamento biologico (59; 60).
Risultati simili sono stati ottenuti con colture 3D di cellule staminali differenziate in cellule di tipo neurale (60; 61; 62), epiteliale (60), endoteliale (60; 61), condrocitico (61; 63) e ematopoietico (64). Inoltre, le colture 3D hanno anche mostrato di sostenere un auto-rinnovamento a lungo termine di cellule staminali embrionali umane, mantenendole in uno stato indifferenziato, preservando il loro cariotipo normale e
25 conservando la loro capacità di differenzazione come indicato dalla possibilità di formazione di corpi embrioidi (65).
3.1
Formazione di sferoidi da tessuto adiposo di cellule
staminali coltivate su chitosano e miglioramento del
potenziale cardiomiogenico
L’infarto del miocardio è una delle principali malattie cardiovascolari che ha come conseguenza l’ischemia dei cardiomiociti, l’ipertrofia ventricolare, l’insufficienza cardiaca ed eventualmente la morte. Una volta che un infarto miocardico risulta nell’ischemia dei cardiomiociti, è difficile recuperare i cardiomiociti danneggiati mediante processi di auto-riparazione. Diversi studi hanno indotto con successo la differenziazione delle cellule staminali embrionali (ESC) in cardiomiociti che esprimono i geni cardiaco-specifici, le proteine ed i canali ionici e mostrano attività contrattile spontanea con un potenziale d’azione simile al pacemaker (66).
Tuttavia, la pluripotenza della porzione indifferenziata di cellule derivate dalle ESC può portare alla formazione di teratomi (67). Prima di poter pensare ad una loro potenziale applicazione terapeutica nell’uomo, bisogna quindi risolvere le preoccupazioni riguardanti l’omogeneità delle cellule ESC-derivate.
Le cellule staminali mesenchimali (MSC) sono cellule multipotenti, con proprietà di auto-rinnovamento. Esse hanno la capacità di differenziazione multilineare e possono differenziarsi in osteociti, condrociti, adipociti e miociti (68) (Figura 4). Derivate dal tessuto adiposo, le cellule staminali adulte (ASC) sono considerate più abbondanti e più facili da raccogliere rispetto agli altri tipi di MSC adulte.
26 Figura 4. Schema che mostra come gli sferoidi possano essere utilizzati per creare un tessuto più grande. (a) Gli sferoidi vengono seminati in forme e (b) formano un tessuto.
(c) Gli sferoidi della vena umana ombelicale di cellule endoteliali (HUVEC) e cellule
staminali mesenchimali umane (hMSCs) formano tessuti complessi (scala bar, 500 µm).
Le ASC mostrano un normale tempo di raddoppiamento e bassi livelli di senescenza dopo coltura per diversi mesi in vitro e possono essere differenziate in vari tipi cellulari in risposta ai fattori di induzione specifica per tali linee (69). Il trattamento con 5-azacitidina (5-aza) può indurre le ASC a differenziarsi in cardiomiociti per demetilazione casuale del DNA genomico (70). Inoltre, il trapianto di ASC è stato utilizzato per rigenerare diversi tipi di tessuti in varie condizioni, come il fegato dopo epatectomia parziale, il cervello dopo ischemia, come pure nella neoangiogenesi nei casi di ischemia degli arti superiori (71; 72; 73).
Per prolungare la vita dei pazienti infartuati, è importante aumentare il tasso di rigenerazione dei cardiomiociti in modo da migliorare significativamente la funzionalità cardiaca. Le ESC umane sono state utilizzate per la loro capacità a differenziarsi in
27 cardiomiociti (74). Tuttavia, la plasticità delle ESC rende la condizione difficile da controllare, e il grado di differenziazione si è dimostrato inefficiente in molti studi. Anche se alcuni studi sugli animali sono stati promettenti, il rendimento insufficiente di cardiomiogenesi dalle ESC è ancora la limitazione maggiore alle loro applicazioni cliniche. La maggior parte degli studi hanno impiegato una strategia comune per differenziare le ESC umane in senso cardiaco, vale a dire la formazione di corpi embrionali in coltura in sospensione, dove sono riusciti a raggrupparsi in aggregati 3D e a differenziarsi in cardiomiociti che mostrano la capacità di contrarsi spontaneamente.
Uno studio recente ha indicato che la dimensione dei corpi embrionali può giocare un ruolo importante durante la cardiomiogenesi (75). D’altra parte, anche le cellule somatiche riprogrammate (cellule staminali pluripotenti indotte) sono capaci di formare dei corpi embrioidi che si sono poi differenziati in cardiomiociti (76; 77). Questi risultati suggeriscono che il processo di formazione del corpo embroide può essere una tappa importante nella cardiomiogenesi da ESC umane.
Nello studio di Liu Bing-Hsien, et al. (78) il potenziale cardiomiogenico delle ASC di ratto è stato valutato in vitro. In particolare, gli autori hanno osservato che le ASC in terreno base hanno formato degli sferoidi su membrane di chitosano dopo 3 giorni. Gli sferoidi hanno mostrato una maggiore cardiomiogenesi con e senza il supporto di induzione cardiaco (Figura 5). Il potenziale terapeutico di questi sferoidi è stato ulteriormente dimostrato nel modello animale di infarto miocardico.
Il chitosano è ottenuto principalmente dai molluschi grazie alla deacetilazione della chitina, che è il secondo polisaccaride più abbondante in natura dopo le cellulose vegetali (79). Il chitosano è ampiamente utilizzato nell’ingegneria del tessuto come
28 materiale biomimetico (80). Tuttavia, l’uso di chitosano è limitato dalla sua caratteristica di stimolare l’adesione cellulare (81).
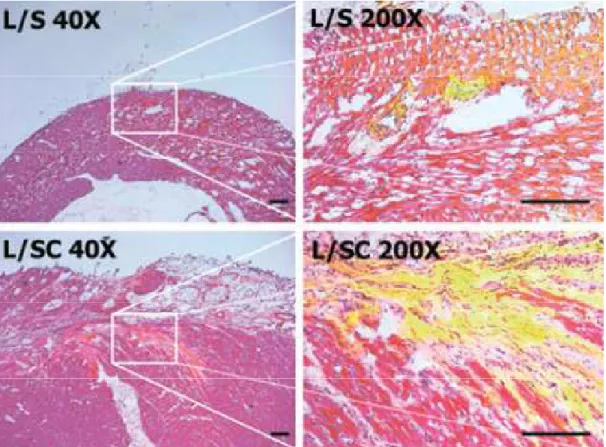
Figura 5. Monitoraggio di ASC trapiantati. Cuori congelati sono stati sezionati e colorati in ematossilina-eosina. L’immagine di sovrapposizione del citoplasma cardiaco (in rosso) e delle ASC trapiantate (pre-marcate in verde con un composto specifico per i lipidi, il PKH67) produce la colorazione gialla. Ingrandimenti 40x e 200x; Le barre di scala rappresentano 200 µm.
Nel corso dello studio, gli autori hanno dimostrato che le membrane di chitosano possono indurre la formazione di sferoidi da ASC di ratto, che imitavano morfologicamente la formazione del corpo embroide. Poiché studi recenti avevano dimostrato che la crescita di sferoidi su membrane di chitosano ne può aumentare le capacità di differenzazione multilineare, incluse condrogenesi, osteogenesi, neurogenesi
29 ed patogenesi (82; 83), gli autori sono partiti dall’ipotesi che tali membrane avessero la capacità di indurre la cardiomiogenesi da ASC di ratto. Nei loro esperimenti hanno infatti dimostrato non solo che le membrane di chitosano aumentavano l’espressione di geni marcatori cardiaci in tali cellule, ma che tale effetto era specificatamente dipendente da tali membrane; tale effetto scompariva quando gli sferoidi di ASC venivano piastrate su capsule di petri (crescita 2D), con terreno di coltura basale o di induzione cardiaca.
I risultati di Liu Bing-Hsien, et al. (78) suggeriscono che il chitosano può promuovere la differenziazione delle ASC verso la linea miocardica in assenza di qualsiasi induttore cardiaco tradizionale come la 5-aza o lo SB202190, un inibitore della p38 MAP chinasi. Dal momento che la formazione degli sferoidi di ASC è stata la caratteristica che distingueva la crescita 3D su chitosano da quella 2D su capsule di petri tradizionali, bisogna ipotizzare che sia proprio tale crescita 3D su chitosano il fattore chiave responsabile della formazione dei corpi embroidi dai quali, mediante una progressione attraverso tappe che sono al momento ancora in gran parte ignote, sia arriva alla cardiomiogenesi.
30
4
Gli sferoidi come modello 3D per lo studio di tumori
I tumori solidi rimangono un problema importante nonostante il vasto numero di farmaci antineoplastici disponibili. I progressi nelle terapie a base di anticorpi rappresentano un nuovo promettente approccio per il trattamento di tumori solidi (84). Affinché un anticorpo abbia successo come farmaco antineoplastico deve soddisfare due requisiti: deve essere efficace nel microambiente tumorale e deve raggiungere le cellule tumorali in quantità ottimali.
I microambienti tumorali presentano significative barriere alla penetrazione di anticorpi e immunoconiugati, e sono quindi difficili da studiare in vitro. Le cellule coltivate come monostrati mostrano una minor resistenza alla terapia rispetto a quelle cresciute in vivo, per cui si rende necessario lo sviluppo di modelli alternativi più rappresentativi del tumore in vivo.
Tale differenza di sensibilità può essere spiegata come “resistenza multicellulare”, un meccanismo di farmaco-resistenza conferita dai contatti cellula-cellula, dai contatti cellula-matrice e dalla forma tridimensionale che assume il tessuto (85; 86; 87). La resistenza multicellulare acquisita dalle cellule tumorali può contribuire alla difficoltà di tradurre in terapia risultati promettenti ottenuti in studi in vitro (88).
Le colture in vitro di sferoidi tumorali multicellulari hanno cominciato a colmare il divario tra la complessità dei tumori in vivo e le colture cellulari in monostrato e sono diventati modelli preziosi per lo studio della resistenza ai farmaci (41).
31
4.1
Differenze nella risposta a test farmacologici tra colture
monostrato 2D e colture di sferoidi 3D
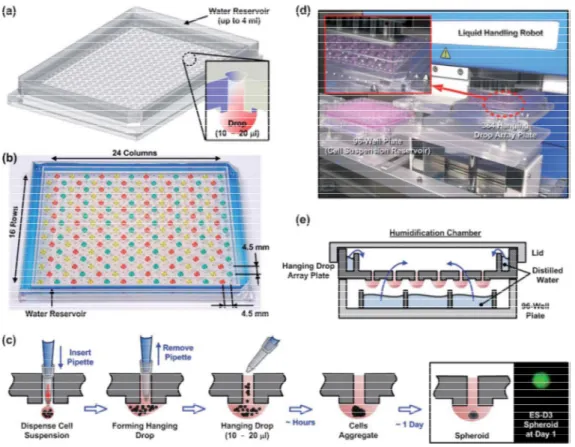
Nel recente studio condotto da Tung, Yi-Chung, et al. (89) viene descritta una piastra di coltura per sferoidi a 384 pozzetti basata sullo scientificamente comprovato ma tradizionalmente troppo complesso metodo in goccia pendente. La piattaforma sviluppata per coltura in serie a goccia pendente permette un’efficiente formazione di sferoidi di dimensioni uniformi, una coltura a lungo termine e il saggio di farmaci usando l’esistente strumentazione HTS (per esempio, robots per la manipolazione dei liquidi e lettori di piastre) (Figura 6d).
Figura 6. (a, b) Illustrazione della piastra multipla a 384 gocce pendenti per coltura di sferoidi. (c) Disegno del processo di formazione delle gocce pendenti nella piastra multipla. (d) Foto della piastra multipla a 384 gocce pendenti gestita da robot per manipolazione di liquidi capace di pipettare allo stesso tempo 96 siti di coltura cellulare.
(e) Disegno della camera di umidificazione finale usata per la coltura di sferoidi 3D
32 In questo tipo di piattaforme la sospensione cellulare è rapidamente attratta dalla superficie idrofilica della piastra ed una goccia pendente si forma velocemente e resta confinata entro il piano della piastra. Nell’arco di alcune ore, le singole cellule iniziano ad aggregarsi ed infine formano un singolo sferoide in circa 1 giorno.
Usando questa piattaforma, Tung, Yi-Chung, et al. (89) hanno dimostrato come farmaci con differenti meccanismi d’azione producano risposte differenti in sferoidi cellulari 3D rispetto ai convenzionali monostrati cellulari 2D. In particolare, viene mostrato come il farmaco antitumorale 5-fluorouracile (5-FU) ha effetti antiproliferativi maggiori sulle colture 2D, mentre la tirapazamina (TPZ), farmaco antitumorale attivato dall’ipossia, è più efficace contro le colture 3D.
Il saggio della sensibilità dei farmaci antitumorali sulle cellule di carcinoma epiteliale A431/H9 dimostra che la citotossicità può essere drasticamente differente negli sferoidi 3D formati nelle piastre multiple a 384 gocce pendenti rispetto alle colture monostrato 2D nelle piastre multi-pozzetto convenzionali.
Sebbene lo studio di Tung, Yi-Chung, et al. (89) sia centrato sulla risposta degli sferoidi tumorali, il sistema di coltura 3D ad alta resa è di facile utilizzo ed è applicabile a diversi tipi cellulari. Crediamo che tale piattaforma sarà utile in un’ampia gamma di studi dove sono necessarie colture di sferoidi 3D e raccolte di informazioni multiple ad alta resa.
33
4.2
Sviluppo e caratterizzazione in vitro di un mesotelioma
umano in un modello 3D per studiare la terapia con
l’immunotossina SS1P
Il mesotelio è un monostrato cellulare di tipo epiteliale che avvolge le grandi cavità sierose. Le cellule mesoteliali sono di derivazione mesodermica ed hanno una morfologia piatta e molto espansa. I mesoteli prendono il nome dalla grande cavità che avvolgono e sono: il peritoneo, il pericardio e le pleure.
Il mesotelioma è un tumore che origina dal mesotelio, dovuto prevalentemente alla lunga esposizione all’amianto (90). Il mesotelioma maligno è spesso resistente alla chemioterapia (91) e alla radioterapia (92). La prognosi è infausta e la sopravvivenza media varia da pochi mesi a meno di 2 anni (93).
Studiando la resistenza all’apoptosi del mesotelioma, Broaddus et al. hanno riportato, in uno articolo del 2008, che le cellule di mesotelioma acquisiscono tale resistenza una volta formati gli sferoidi 3D in vitro (94). È quindi evidente come gli sferoidi in vitro riescano a riprodurre molte caratteristiche del microambiente tumorale. La terapia a base di anticorpi è emersa come una nuova strategia promettente per il trattamento del mesotelioma e altri tumori solidi (95; 84). Tuttavia, i microambienti tumorali che presentano significative barriere alla penetrazione di anticorpi e di immunoconiugati sono stati studiati solo in vivo. Un modello di tumore in vitro semplice, affidabile e ad alta produttività potrebbe essere molto utile per la caratterizzazione e lo screening di anticorpi e immunoconiugati nella terapia antitumorale.
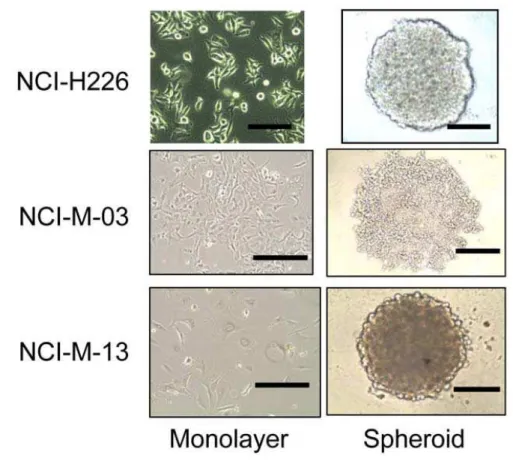
34 Attualmente in fase di sperimentazione clinica nel mesotelioma, la SS1P è un’immunotossina costituita dalla fusione del frammento Fv (la porzione variabile che lega l’antigene) di un anticorpo anti-mesotelina con la esotossina A dello pseudomonas. Xiang et al. (43) hanno esaminato come il microambiente tumorale influenzi la penetrazione e l’attività tumoricida della SS1P in un nuovo modello di sferoide coltivato in vitro utilizzando una linea cellulare del mesotelioma umano (NCI-H226) e due linee di cellule primarie isolate dalle asciti dei pazienti affetti da mesotelioma maligno (Figura 7).
Figura 7. Costituzione di sferoidi di mesotelioma umani.
Monostrati e sferoidi della linea cellulare di mesotelioma umano NCI-H226 e delle linee di mesotelioma primario NCI-M-03 e M-NSC-13. Barre di scala 400 µ m (eccetto 200 µm per gli sferoidi NSC-M-13).
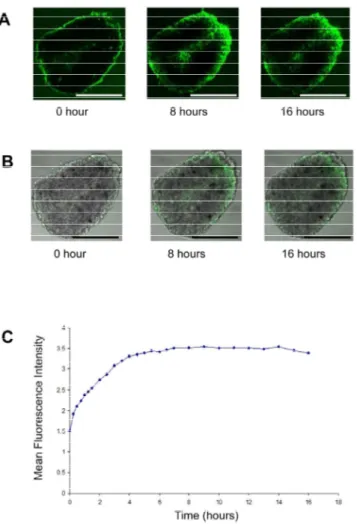
35 Anche se le cellule di mesotelioma cresciute come monostrato e come sferoidi hanno espresso livelli simili di mesotelina, gli sferoidi sono stati almeno 100 volte meno sensibili alla SS1P. Per comprendere questa disparità di citotossicità, Xiang et al. (43) hanno prodotto delle molecole SS1P marcate con il fluorocromo Alexa488 (Figura 8): utilizzando la microscopia confocale per esaminare l’andamento temporale della penetrazione di SS1P all’interno degli sferoidi, hanno osservato una limitata penetrazione dopo 4 ore.
Figura 8. Penetrazione della immunotossina SS1P marcata
con Alexa488 in sferoidi
tumorali.
A) L’SS1P marcata con Alexa488
(fluorescenza verde). Una sezione trasversale vicino al centro di uno sferoide NCI-H226 valutato a ore 0, 8 e 16 mediante microscopia confocale.
B) Sovrapposizione delle immagini
in campo luminoso e in
fluorescenza di uno sferoide.
C) Media dell’intensità di fluorescenza della SS1P. Barre di scala, 400 µm.
36 Mediante microscopia elettronica è stato evidenziato un significativo aumento sia del numero di giunzioni strette nella zona centrale degli sferoidi, sia dell’espressione di E-caderina, una proteina coinvolta nel montaggio e nella sigillatura delle giunzioni strette e altamente espressa nel mesotelioma maligno, negli sferoidi rispetto alle colture in monostrato. È interessante notare come l’E-caderina sia uno tra i biomarker più importanti che sono stati proposti come utili nella diagnosi del mesotelioma (96; 97).
Nel loro studio, Xiang et al. (43) hanno dimostrato come un trattamento mirato alla inibizione dell’espressione (mediante siRNA – small inhibitory RNA) o dell’attività (mediante anticorpi) della E-caderina fosse in grado di migliorare la terapia con l’immunotossina SS1P.
L’E-caderina e le altre molecole di adesione cellulare saranno quindi alla base degli studi futuri sul mesotelioma come potenziali bersagli terapeutici.
37
Conclusioni e sviluppi futuri
La cultura di sferoidi è un strumento di biomimetica versatile e importante in molte aree: dalla medicina rigenerativa, allo studio in vitro e agli approcci orientati ad altre applicazioni. I miglioramenti tecnici negli ultimi dieci anni hanno facilitato la fabbricazione di un gran numero di sferoidi altamente riproducibili sia per dimensioni che per costituzione cellulare.
Nonostante nei processi biologici si possa osservare un’aggregazione spontanea in forme sferiche, bisogna considerare come sia opportuno non limitare questi modelli alla forma sferica, perché dei meccanismi di deformazione locale potrebbero svolgere dei ruoli importanti ed attualmente sconosciuti. Di primaria importanza è l’utilizzo degli sferoidi insieme a metodiche di HTS. Questo pone però nuove problematiche, a partire da quelle tecniche, che devono essere risolte di volta in volta con soluzioni su misura. Lo sviluppo di nuovi saggi e l’analisi di grosse moli di dati sono due importanti sfide da affrontare per il futuro dello studio HTS degli sferoidi.
Per concludere, crediamo che la coltura di cellule sferoidi sia in grado di fornire nuove intuizioni e soluzioni per la ricerca scientifica. Abbiamo apprezzato gli studi che hanno indagato e indagheranno sulla formazione di tessuti complessi come modelli biologici o soluzioni ingegnerizzate, soprattutto perché, in un futuro non lontano, potranno permettere ad un numero sempre maggiore di pazienti di beneficiare di tessuti ingegnerizzati di organi come cuore e pancreas per la terapia di malattie con grosso impatto sia sociale che economico come l’insufficienza cardiaca congestizia o il diabete mellito.
38
Bibliografia
1. Recent advances in threedimensional multicellular spheroid culture for biomedical
research. Lin, R-Z. and Chang, H-Y. 3, s.l. : Biotechnol., 2008. 1172–1184.
2. Integrating novel technologies to fabricate smart scaffolds. Moroni, L. et al. 19, s.l. : Biomater. Sci. Polym. Ed., 2008. 543–572.
3. Hydrogels in regenerative medicine. Slaughter, B.V. et al. 21, s.l. : Adv. Mater, 2009. 3307–3329.
4. Mesenchymal stem cells promote mammosphere formation and decrease E-cadherin
in normal and malignant breast cells. Klopp, A.H. et al. 5, s.l. : PLoS ONE, 2010.
e12180.
5. High density micromass cultures of a human chondrocyte cell line: A reliable assay
system to reveal the modulatory functions of pharmacological agents. Greco, K.V. et
al. 82, s.l. : Biochem. Pharmacol, 2011. 1919–1929.
6. Sonic Hedgehog-activated engineered blood vessels enhance bone tissue formation.
Rivron, N.C. et al. 109, s.l. : Proc. Natl. Acad. Sci. U.S.A., 2012. 4413–4418.
7. Tissue assembly and organization: developmental mechanisms in microfabricated
tissues. Rivron, N.C. et al. 30, s.l. : Biomaterials, 2009. 4851–4858.
8. Primary rat hepatocyte culture on 3D nanofibrous polymer scaffolds for toxicology
and pharmaceutical research. Bierwolf, J. et al. 108, s.l. : Biotechnol. Bioeng., 2011.
141–150.
9. Relationship between cell shape and type of collagen synthesised as chondrocytes
lose their cartilage phenotype in culture. von der Mark, K. et al. 267, 1977. 531–532.
10. 3D PLGA scaffolds improve differentiation and function of bone marrow
mesenchymal stem cell-derived hepatocytes. Li, J. et al. 19, s.l. : Stem Cells Dev.,
2010. 1427-1436.
11. Observations on the living developing nerve fiber. Harrison, R.G. 4, s.l. : Proc. Soc. Exp. Biol. Med, 1907. 140-143.
12. Growth of multicell spheroids in tissue culture as a model of nodular carcinomas.
Sutherland, R.M. et al. 46, s.l. : J. Natl. Cancer Inst, 1971. 113-120.
13. A simplified method for production and growth of multicellular tumor spheroids.
Yuhas, J.M. et al. 37, s.l. : Cancer Res., 1977. 3639–3643.
14. Prospects of micromass culture technology in tissue engineering. Handschel,
J.G.K. et al. 3, s.l. : Head Face Med, 2007. 4.
15. High throughput generated microaggregates of chondrocytes stimulate cartilage
formation in vitro and in vivo. Moreira Teixeira, L.S. et al. 23, s.l. : Eur. Cell Mater,
2012. 387-399.
16. Emergent patterns of growth controlled by multicellular form and mechanics.
Nelson, C.M. et al. 102, s.l. : Proc. Natl. Acad. Sci. U.S.A., 2005. 11594–11599.
17. Tissue deformation spatially modulates VEGF signaling and angiogenesis. Rivron,
N.C. et al. 109, s.l. : Proc. Natl. Acad. Sci. U.S.A., 2012. 6886–6891.
18. Dynamics of the self-assembly of complex cellular aggregates on micromolded
39 19. Thermoforming of film-based biomedical microdevices. Truckenmuller, R. et al. 23, s.l. : Adv. Mater., 2011. 1311–1329.
20. A polymer microstructure array for the formation, culturing, and high throughput
drug screening of breast cancer spheroids. Markovitz-Bishitz, Y. et al. 31, s.l. :
Biomaterials, 2010. 8436–8444.
21. Microwell perfusion array for high-throughput, long-termimaging of clonal growth.
Chen, H. et al. 5, s.l. : Biomicrofluidics, 2011. 44117–44117-13.
22. Efficient formation of uniform-sized embryoid bodies using a compartmentalized
microchannel device. Torisawa, Y.S. et al. 7, s.l. : Lab Chip, 2007. 770–776.
23. Nemosis, a novel way of fibroblast activation, in inflammation and cancer. Vaheri,
A. et al. 315, s.l. : Exp. Cell Res, 2009. 1633–1638.
24. Endochondral bone tissue engineering using embryonic stem cells. Jukes, J.M. et
al. 105, s.l. : Proc. Natl. Acad. Sci. U.S.A., 2008. 6840-6845.
25. Differentiation of embryonic stem cells to insulin-secreting structures similar to
pancreatic islets. Lumelsky, N. et al. 292, s.l. : Science, 2001. 1389-1394.
26. Human embryonic stem cells can differentiate into myocytes with structural and
functional properties of cardiomyocytes. Kehat, I. et al. 108, s.l. : J. Clin. Invest, 2001.
407–414.
27. Vascularization in tissue engineering. Rouwkema, J. et al. 26, s.l. : Trends Biotechnol, 2008. 434–441.
28. Improved vascular organization enhances functional integration of engineered
skeletal muscle grafts. Koffler, J. et al. 108, s.l. : Proc. Natl. Acad. Sci U.S.A., 2011.
14789-14794.
29. Microscale tissue engineering using gravity-enforced cell assembly. Kelm, J.M.
and Fussenegger, M. 22, s.l. : Trends Biotechnol, 2004. 195-202.
30. Angiopoietins-1 and -2 play opposing roles in endothelial sprouting of embryoid
bodies in 3D culture and their receptor Tie-2 associates with the cell–cell adhesion molecule PECAM1. Gu, A. and Shively, J.E. 317, s.l. : Exp. Cell Res., 2011. 2171–
2182.
31. Endothelial cells assemble into a 3-dimensional prevascular network in a bone
tissue engineering construct. Rouwkema, J. et al. 12, s.l. : Tissue Eng, 2006. 2685–
2693.
32. Engineering vascularized skeletal muscle tissue. Levenberg, S. et al. 23, s.l. : Nat. Biotechnol, 2005. 879–884.
33. Spheroid-based drug screen: considerations and practical approach. Friedrich, J.,
C. Seidel, R. Ebner and L. A. Kunz-Schughart. 4, s.l. : Nat. Protoc., 2009. 309-324.
34. High-throughput 3D spheroid culture and drug testing using a 384 hanging drop
array. Tung, Y.C. et al. 136, s.l. : Analyst, 2011. 473.
35. Microtissue size and hypoxia in HTS with 3D cultures. Asthana, A. and Kisaalita,
W.S. 17, s.l. : Drug Discov. Today, 2012. 810–817.
36. Implication of necrosis-linked p53 aggregation in acquired apoptotic resistance to
5-FU in MCF-7 multicellular tumour spheroids. Lee, S.Y. et al. 24, s.l. : Oncol. Rep.,
2010. 73-79.
37. The validated embryonic stem cell test to predict embryotoxicity in vitro. Seiler,
40 38. Continuously perfused microbubble array for 3D tumor spheroid model. Agastin, S.
et al. 5, s.l. : Biomicrofluidics, 2011. 024110.
39. Automation of three-dimensional cell culture in arrayed microfluidic devices.
Montanez-Sauri, S.I. et al. 16, s.l. : J. Lab. Autom, 2011. 171–185.
40. Cell-based assays: fuelling drug discovery. Michelini, E. et al. 398, s.l. : Anal. Bioanal. Chem, 2010. 227-238.
41. The third dimension bridges the gap between cell culture and live tissue. Pampaloni
F, Reynaud EG, Stelzer EH. 8, s.l. : Nat Rev Mol Cell Biol, 2007. 839-845.
42. The use of 3-D cultures for high-throughput screening: the multicellular spheroid
model. L. A. Kunz-Schughart, J. P. Freyer, F. Hofstaedter and R. Ebner. 9.4, s.l. :
Journal of biomolecular screening, 2004. 273-285.
43. The development and characterization of a human mesothelioma in vitro 3D model
to investigate immunotoxin therapy. Xiang, Xinran, et al. 1, s.l. : PLoS One 6.1, 2011,
Vol. 6. e14640.
44. A. I. M. Kubbies. 11, s.l. : J. Biomol. Screening, 2006. 922-932.
45. Spheroid preparation from hanging drops: characterization of a model of brain
tumor invasion. Del Duca, Danny, Tamra Werbowetski, and Rolando F. Del
Maestro. 3, s.l. : Journal of neuro-oncology, 2004, Vol. 67. 295-303.
46. Experimental anti-tumor therapy in 3-D: spheroids-old hat or new challenge?
Friedrich, Juergen, Reinhard Ebner, and Leoni A. Kunz-Schughart. 11, s.l. :
International journal of radiation biology, 2007, Vol. 83. 849-871.
47. Technique for the control of spheroid diameter using microfabricated chips. Sakai,
Yusuke, and Kohji Nakazawa. 6, s.l. : Acta Biomaterialia, 2007, Vol. 3. 1033-1040.
48. Reproducible, ultra high-throughput formation of multicellular organization from
single cell suspension-derived human embryonic stem cell aggregates. Ungrin, Mark
D., et al. 2, s.l. : PloS one, 2008, Vol. 3. e1565.
49. 3D Cell-based Biosensors in Drug Discovery Programs: Microtissue Engineering
for High Throughput Screening. Kisaalita, W.S. s.l. : CRC Press, Taylor & Francis
Group, 2010.
50. Capturing complex 3D tissue physiology in vitro. Griffith, L.G. and Swartz, M.A. 7, s.l. : Nat. Rev. Mol. Cell Biol, 2006. 211-224.
51. Three-dimensional microenvironments modelate fibroblast signaling responses.
Green, J.A. and Yamada, K.M. 59, s.l. : Adv. Drug Deliv. Rev., 2007. 1289-1293.
52. Biomarkers for simplifying HTS 3D cell culture platforms for drug discovery: the
case for. Lai, Y. et al. 16, s.l. : Drug Discov. Today, 2011. 293-297.
53. HIF-2alpha regulates Oct-4: effects of hypoxia on stem cell function, embryonic
development, and tumor growth. Covello, K.L. et al. 20, s.l. : Genes Dev., 2006.
557-570.
54. Enhancing cell penetration and proliferation in chitosan hydrogels for tissue
engineering applications. Ji, C. et al. 32, s.l. : Biomaterials, 2011. 9719-9729.
55. Tumour hypoxia, chemotherapeutic resistance and hypoxia-related therapies.
Shannon, A.M. et al. 29, s.l. : Cancer Treat. Rev, 2003. 297-307.
56. Hypoxia-inducible factor-1 (HIF-1). Ke, Q. and Costa, M. 70, s.l. : Mol. Pharmacol., 2006. 1469–1480.
57. The role of oxygen availability in embryonic development and stem cell. Simon,
41 58. The hematopoietic stem cell niche: low in oxygen but a nice place to be. Eliasson,
P. and Jonsson, J.I. 222, s.l. : J. Cell. Physiol, 2010. 17-22.
59. Differentiation of human embryonic stem cells into hepatocytes in 2D and 3D
culture systems in vitro. Baharvand, H. et al. 50, s.l. : Int. J. Dev. Biol., 2006. 645-652.
60. Biomimetic three-dimensional cultures significantly increase hematopoietic
differentiation efficacy of embryonic stem cells. Liu, H. and Roy, K. 11, s.l. : Tissue
Eng., 2005. 319-330.
61. Multilineage differentiation of rhesus monkey embryonic stem cells in
threedimensional. Chen, S.S. et al. 21, s.l. : Stem Cells, 2003. 281-295.
62. Differentiation of human embryonic stem cells on three-dimensional polymer
scaffolds. Levenberg, S. et al. 100, s.l. : Proc. Natl. Acad. Sci. U.S.A., 2003. 12741–
12746.
63. Neurotrophin-induced differentiation of human embryonic stem cells on
three-dimensional polymeric scaffolds. Levenberg, S. et al. 11, s.l. : Tissue Eng., 2005.
506-512.
64. Effects of three-dimensional culture and growth factors on the chondrogenic
differentiation. Hwang, N.S. 24, s.l. : Stem Cells. 284-291.
65. Hyaluronic acid hydrogel for controlled self-renewal and differentiation of human.
Gerecht, S. et al. 104, s.l. : Proc. Natl. Acad. Sci. U.S.A., 2007. 11298–11303.
66. Do stem cells in the heart truly differentiate into cardiomyocytes? Guan K,
Hasenfuss G. 43, s.l. : J Mol Cell Cardiol., 2007. 377-387.
67. Transplantation of undifferentiated murine embryonic stem cells in the heart:
teratoma formation and immune response. Nussbaum J, Minami E, Laflamme MA, et
al. 21, s.l. : FASEB J., 2007. 1345-1357.
68. Multilineage potential of adult human mesenchymal stem cells. Pittenger MF,
Mackay AM, Beck SC, et al. 284, s.l. : Science, 1999. 143-147.
69. Human adipose tissue is a source of multipotent stem cells. Zuk PA, Zhu M,
Ashjian P, et al. 13, s.l. : Mol Biol Cell, 2002. 4279–4295.
70. Transformation of adult mesenchymal stem cells isolated from the fatty tissue into
cardiomyocytes. Rangappa S, Fen C, Lee EH, et al. 75, s.l. : Ann Thorac Surg, 2003.
775-779.
71. Effect of partial hepatectomy on in vivo engraftment after intravenous
administration of human adipose tissue stromal cells in mouse. Kim DH, Je CM, Sin
JY, et al. 23, s.l. : Microsurgery, 2003. 424-431.
72. Improvement of neurological deficits by intracerebral transplantation of human
adipose tissue-derived stromal cells after cerebral ischemia in rats. Kang SK, Lee DH,
Bae YC, et al. 183, s.l. : Exp Neurol, 2003. 355-366.
73. Human adipose tissue-derived stem cells differentiate into endothelial cells in vitro
and improve postnatal neovascularization in vivo. Cao Y, Sun Z, Liao L, et al. 332,
s.l. : Biochem Biophys Res Commun, 2005. 370-379.
74. Human cardiomyogenesis and the need for systems biology analysis. Adam Young
D, Dequach JA, Christman KL. 3, s.l. : Wiley Interdiscip Rev Syst Biol Med, 2011.
666-680.
75. The microwell control of embryoid body size in order to regulate cardiac
differentiation of human embryonic stem cells. Mohr JC, Zhang J, Azarin SM, et al.