UNIVERSITÀ DI PISA
Dipartimento di Biologia
Corso di Laurea Magistrale in Biologia Molecolare e Cellulare
TESI DI LAUREA
Valutazione degli effetti prodotti in vivo da un alcaloide di origine naturale,
la sanguinarina, nella planaria Dugesia japonica
RELATORE CANDIDATA
Prof.ssa Renata Batistoni Alessia Di Donfrancesco
1. RIASSUNTO
5
Abstract
82. INTRODUZIONE
10
2.1. Anatomia di una planaria 12
2.2. Omeostasi tissutale e rigenerazione 17
2.3. Rigenerazione e omeostasi tissutale in planaria 18
2.4. Determinazione della polartà antero-posteriore durante la rigenerazione 22
2.5. Piante medicinali 24
2.6. Alcaloidi naturali 26
2.7. Proprietà degli alcaloidi 28
2.8. Gli alcaloidi come sostanze nutraceutiche 29
2.9. Chelidonium majus 34
2.10. L’alcaloide SANGUINARINA 36
2.11. Scopo della tesi 44
3. MATERIALI E METODI
453.1. Animali 46
3.2. Protocollo di “soaking” 46
3.3. Analisi morfometrica 49
3.4. Sintesi di sonde ad RNA 50
4 3.4.2. Digestione del DNA plasmidico mediante enzimi di restrizione 51
3.4.3. Sintesi della sonda 51
3.5. Ibridazione in situ “whole-mount” 53
3.6. “Whole-mount” immunostaining 56
3.7. Estrazione proteica e test della caspasi-3 59
3.8. Estrazione dell’RNA totale e sintesi del cDNA 61
3.9. RT-qPCR 62
3.10. Analisi statistica 64
4. RISULTATI
654.1. Valutazione tossicologica della sanguinarina in planaria 66
4.2. Assorbimento della sanguinarina nelle planarie 69
4.3. Osservazione degli effetti prodotti dalla sanguinarina sulla rigenerazione 70
4.4. Ibridazioni in situ “whole-mount” 79
4.5. Analisi dei livelli di espressione di marcatori molecolari diversi tramite RT-qPCR 88
4.6. Effetti della sanguinarina sull’apoptosi 95
5. DISCUSSIONE
996. CONCLUSIONI
1117. BIBLIOGRAFIA
1135
6 La Sanguinarina (13-methyl[1,3]benzodioxolo[5,6-c]-1,3-dioxolo [4, 5-i] phenanthridium) è un alcaloide benzofenantridinico presente in alcune piante come
Sanguinaria canadensis (radice), Chelidonium majus e Macleaya cordata. Possiede
proprietà antimicrobiche, antinfiammatorie ed antiossidanti. Viene utilizzata nei dentifrici nel trattamento e nella prevenzione di gengiviti ed altre condizioni infiammatorie, ma anche in acquacoltura o in ambito veterinario. La sanguinarina è in grado di intercalarsi tra le basi del DNA e dell’RNA alterandone la struttura ed il metabolismo. I suoi effetti inibitori si realizzano a livello di proteine quali Na+/K+ e Ca2+-ATPasi bloccando i gruppi SH essenziali per la loro attività. E’ anche un potente inibitore della proteina chinasi C ed infine blocca l’assemblaggio dei microtubuli. Recenti studi hanno rivelato che a concentrazioni micromolari, questo alcaloide è anche in grado di inibire la crescita tumorale attraverso la via apoptotica. Nonostante gli effetti di questo alcaloide siano stati ampiamente studiati e descritti in vitro, ad oggi non sono ancora noti i suoi effetti in vivo. Lo scopo del mio studio è stato quello di analizzare in
vivo gli effetti prodotti dalla sanguinarina nella planaria Dugesia japonica, un animale
modello noto per la straordinaria capacità rigenerativa basata sull’attività di cellule staminali (i neoblasti) e, proprio per questo, recentemente utilizzato per studi farmacologici e tossicologici. La rigenerazione in planaria è un processo complesso che implica, in seguito ad una lesione, il rimodellamento dei tessuti pre-esistenti e l’attivazione e migrazione dei neoblasti nel punto in cui è avvenuta tale lesione con riformazione delle parti mancanti (blastema rigenerativo). Nel mio lavoro di tesi ho inizialmente effettuato una valutazione tossicologica della molecola con probit analysis, un metodo di calcolo comunemente usato in tossicologia per determinare la tossicità relativa di sostanze chimiche testate su organismi viventi. A questo è seguita
7 l’osservazione diretta dei fenotipi morfologici ottenuti in seguito al trattamento con sanguinarina alla concentrazione di 0,15 μM. Gli animali, osservati a 7 giorni di rigenerazione, mostrano evidenti anormalità soprattutto durante la rigenerazione della testa rispetto agli animali di controllo. L’analisi morfometrica del rapporto tra l’area del blastema e quella dell’intero corpo ha evidenziato che l’esposizione a questa sostanza causa una riduzione significativa delle dimensioni del blastema negli animali trattati rispetto agli animali controllo. Esperimenti di immunostaining e di ibridazioni in situ con marcatori molecolari specifici del sistema nervoso e visivo hanno evidenziato evidenti anomalie nella rigenerazione di queste strutture. Inoltre, sono stati analizzati gli effetti prodotti dalla sanguinarina sulla proliferazione cellulare e apoptosi. La sanguinarina infatti promuove il processo apoptotico attraverso il pathway mitocondriale con attivazione in ultima analisi di specifiche proteasi note con il nome di caspasi. L’analisi spettrofotometrica basata sull’attività della caspasi-3 conferma un aumento di tale fenomeno negli animali trattati con sanguinarina rispetto agli animali di controllo. Inoltre, sono stati valutati i livelli di espressione di marcatori specifici della proliferazione cellulare e marcatori specifici di cellule staminali tramite RT-qPCR. Quest’analisi, effettuata a 7 giorni di rigenerazione, non evidenzia alcun effetto sulla proliferazione delle cellule staminali. Al contrario, il trattamento con sanguinarina ha evidenziato un notevole aumento nel livello di espressione di alcuni marcatori che svolgono un ruolo nel maintenance/differenziamento di queste cellule. Inoltre, l’identificazione dei meccanismi biologici con cui agisce questo alcaloide a livello delle cellule staminali potrebbe avere importanti risvolti non solo per il suo utilizzo nella terapia antitumorale ma anche per una possibile applicazione nella medicina rigenerativa.
8 Sanguinarine (SA) is 13-methyl[1.3]benzodioxolo[5,6,- c]-1,3-dioxolo[4,5-i] Phenanthradinium. SA is present in plants such as Sanguinaria Canadensis (blood root),
Poppy fumaria, Bocconia frutescens, Chelidonium majus, and Macleya cordata.
Sanguinarine has been shown to have antimicrobial, anti-inflammatory and antioxidant properties. It is widely used in toothpaste and mouthwash for the prevention/treatment of gingivitis and other inflammatory conditions but also in aquaculture and in the veterinary field. It intercalates into DNA and RNA altering the structure and the metabolism. It has inhibitory effects on proteins such as Na+/K+ and Ca2+-ATPase blocking their –SH groups that are essential for their activity. Like chelerythrine, sanguinarine is also a potent inhibitor of protein kinase C, and finally it can blocks the assembly of microtubules. Recent studies suggest that, at micromolar concentrations, this alkaloid is also able to inhibit tumor growth through the apoptotic pathway. Despite the effects of this alkaloid have been extensively studied and described in vitro, they are not yet known in vivo. The purpose of my study was to test the effects produced in vivo by sanguinarine in the planarian Dugesia japonica, an animal model known for the extraordinary regenerative capacity and recently used for pharmacological and toxicological studies.The remarkable regenerative abilities of planarians are due to the presence of pluripotent stem cells, the neoblasts, distributed throughout the mesenchyme of these organisms. Planarian regeneration is a complex process that involves, following a lesion, the remodeling of pre-existing tissues and activation and migration of neoblasts that progressively accumulate under the wound epithelium, forming the regenerative blastema. In my thesis work I initially performed a toxicological evaluation of the molecule with probit analysis, a method commonly used in toxicology to determine the relative toxicity of chemicals tested on living organisms.
9 This approach was followed by morphological observation of phenotypes obtained following treatment with sanguinarine at the concentration of 0.15 μM. The animals, observed at 7 days of regeneration, show significant abnormalities especially during the regeneration of the head when compared to control animals that, on the contrary, show a correct and complete regeneration. The morphometric analysis of the ratio between the area of the blastema and the area of the whole body showed that exposure to this compound causes a significant reduction in the size of the blastema in the treated animals compared to control animals. Experiments of immunostaining and in situ hybridization with specific molecular markers of the nervous and visual system showed obvious abnormalities in the regeneration, not observed in control animals. In addition, I have analyzed the effects produced by sanguinarine on cell proliferation and apoptosis. I have analyzed the levels of expression of specific markers for cell proliferation and specific markers for stem cells by RT-qPCR. This analysis, carried out after 7 days of regeneration, does not show any effect on the proliferation of stem cells. In contrast, treatment with sanguinarine showed a significant increase of the expression of some markers involved in maintenance/differentiation of these cells. Sanguinarine, also promotes the apoptotic process through the mitochondrial pathway with activation of specific proteases known as caspases. In fact, the spectrophotometric analysis based on the activity of caspase-3 confirms an increase in this phenomenon in animals treated with sanguinarine compared to control animals. The identification of the biological mechanisms by which this alkaloid acts may provide insight into unanticipated effects on stem cells at the organismal level. These effects may have important implications not only for cancer research but also for possible applications in regenerative medicine.
10
11 Le planarie, platelminti a vita libera, sono un sistema molto utilizzato nella ricerca sulla rigenerazione (Newmark e Sánchez Alvarado, 2002) ed anche per studi tossicologici (Best e Morita, 1991; Grebe e Schaeffer 1991; Kapu e Schaeffer, 1991; Li, 2008; Oviedo e Levin, 2008) e per l’identificazione di sostanze chimiche teratogene (Best e Morita, 1982; Sabourin et al., 1985; Schaeffer, 1993). Le planarie costituiscono il primo esempio di bilateri con una netta cefalizzazione, comprendente un cervello primitivo, per alcuni aspetti simile a quello dei vertebrati in termini di morfologia cellulare e fisiologia (Sarnat e Netsky, 1985-2002). Nelle planarie, infatti, sono stati ritrovati conservati numerosi neurotrasmettitori e secondi messaggeri presenti nei mammiferi (Buttarelli et al., 2000, 2008; Ribeiro et al., 2005). Le planarie rappresentano, quindi, un’ottima alternativa alla complessità dei sistemi modello comunemente utilizzati per studi farmacologici. E’ noto come questi vermi vengano impiegati per studiare l’effetto di alcune droghe quali cocaina, anfetamine, cannabinoidi ed oppiacei (Buttarelli et al., 2002; Kusayama et al., 2000; Passarelli et al., 1999; Raffa et al., 2005; Raffa et al., 2003). Recentemente la planaria Dugesia japonica è diventata una delle specie più utilizzate per questi studi. Uno fra gli esempi più eclatanti è rappresentato da studi sugli effetti del praziquantel, il principale farmaco utilizzato per il trattamento di infezioni causate da vermi parassiti. E’ stato dimostrato come il trattamento degli animali con questa sostanza causi, durante la rigenerazione, una completa duplicazione dell’asse antero-posteriore (Chan e Marchant, 2011). Questo organismo modello è quindi molto importante per lo studio dei meccanismi di rigenerazione tissutale, regolazione delle cellule staminali, azione farmacologica di farmaci diversi, cancro e invecchiamento (Oviedo et al.,2008).
12
2.1. Anatomia di una planaria
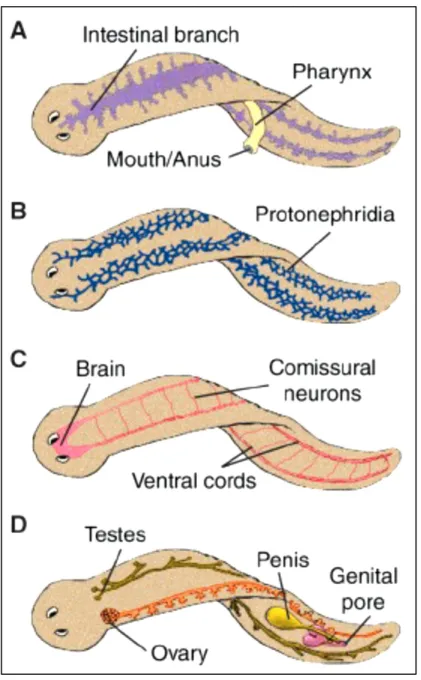
Le planarie sono bilateri triblastici acelomati con derivati di tutti e tre i foglietti embrionali (ectoderma, mesoderma ed endoderma). In questi animali non sono presenti l’apparato circolatorio e respiratorio e gli scambi di gas e liquidi con l’ambiente avvengono per diffusione. L’epidermide è organizzata in monostrato, poggia su una membrana basale e si presenta ciliata sul lato ventrale dell’animale. Associate all’epidermide sono presenti anche cellule ghiandolari secernenti una sostanza mucillaginosa; alcune di queste cellule producono dei rabditi, corpiccioli bastoncellari che sembrano essere implicati nella motilità (Weisz, 1978). Sotto l’epidermide sono presenti due strati muscolari, uno trasversale ed uno longitudinale, sono presenti anche muscoli che attraversano l’animale in direzione dorso-ventrale (Miller e Harley, 2005); i muscoli, oltre a permettere il movimento, regolano il funzionamento del faringe e degli organi copulatori. L’apparato digerente è costituito dal faringe, una struttura muscolare estensibile usato sia come bocca che come ano, e da un intestino a sacco costituito da un sistema di canali ramificati a fondo cieco rivestiti internamente dal gastroderma (Figura 1A). Tutto lo spazio compreso tra l’apparato digerente e l’epidermide è riempito da tessuto mesenchimale, generalmente definito parenchima. Il parenchima è costituito da vari tipi di cellule differenziate non proliferanti e dai neoblasti. I neoblasti sono una particolare popolazione proliferante di cellule somatiche non differenziate pluripotenti da cui hanno origine tutti gli altri tipi cellulari (Baguñà, 1998). L’escrezione avviene tramite un sistema di protonefridi a fiamma contenuto nel parenchima e che si apre in diverse regioni del corpo attraverso numerosi nefridopori (Figura 1B). Il sistema nervoso centrale (SNC) è costituito da un cervello bilobato, localizzato nella regione
13 anteriore del tronco, e da due cordoni nervosi ventrali che decorrono longitudinalmente lungo l’animale, interconnessi tra di loro da neuroni commissurali (Figura 1C).
Figure 1: Anatomia della planaria. A) Sistema gastro-vascolare; B) Sistema escretore; C)
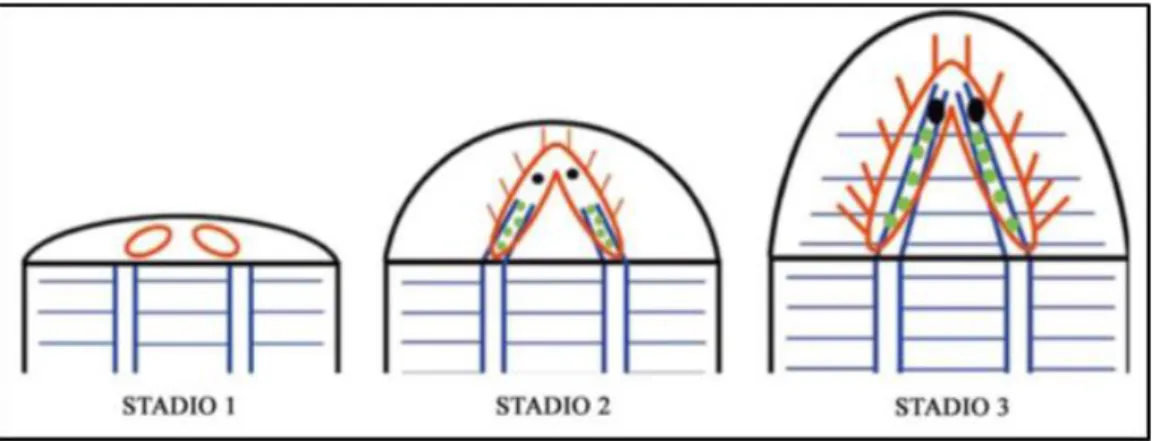
14 È stato proposto un modello di rigenerazione del SNC in tre stadi (Cebrià et al., 2002) (Figura 2). Nel primo stadio, a 24-36 ore dall’inizio della rigenerazione, all’interno del blastema rigenerativo si formano i due primordi dei gangli che probabilmente sono già divisi in differenti domini molecolari lungo i loro assi antero-posteriore e medio-laterale, inclusa un’area visiva. Nel secondo stadio (intermedio) si assiste alla crescita dei due primordi e alla formazione dei primi circuiti neurali. In questo stadio si attivano i geni che controllano la crescita assonale. I più importanti sono gli omologhi di netrin,
robo e slit, che sono stati recentemente identificati e caratterizzati attraverso
l’osservazione di fenotipi anormali ottenuti dopo esperimenti di RNAi. Infine durante l’ultimo stadio, il SNC rigenerato recupera la sua funzionalità.
Figura 2. Modello di rigenerazione a tre stadi del sistema nervoso di planaria.
Durante la rigenerazione del sistema nervoso centrale avviene anche la formazione delle strutture visive. In particolare, nella regione anteriore del corpo, sul lato dorsale dei gangli cefalici, si possono distinguere due macchie oculari, dette ocelli, che contengono solo due tipi cellulari: fotorecettori rabdomerici e cellule pigmentate. In particolare, i
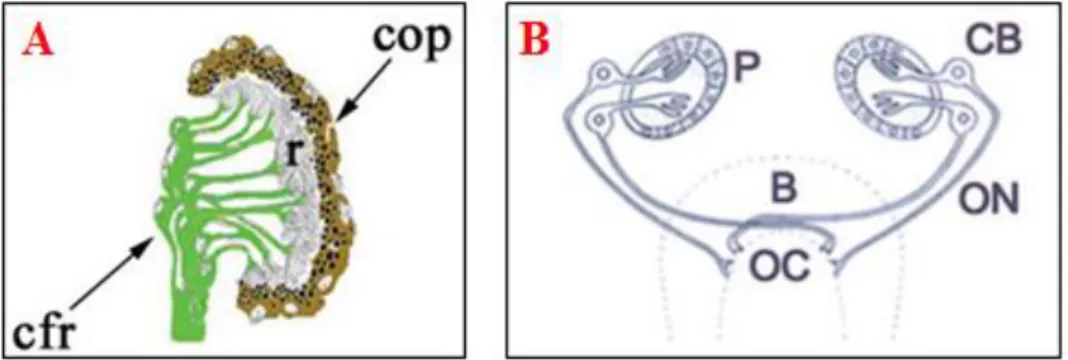
15 fotorecettori sono incorporati in una coppa ottica monostratificata di cellule pigmentate contenenti melanina (Figura 3A) ed i loro assoni proiettano ai gangli cefalici: alcuni direttamente al ganglio ipsilaterale, altri a quello controlaterale, incrociandosi in un chiasma ottico (Figura 3B). In questo modo, l’informazione visiva può essere integrata ed elaborata. In realtà, nella planaria, la fotorecezione permette solo di rilevare la direzione della luce per evitare l’esposizione diretta, ma non forma immagini. Le planarie, infatti, mostrano una fototassi negativa, allontanandosi dalla luce.
Figura 3. A) Diagramma di un ocello; cfr: corpi dei fotorecettori; r: estremità dendritiche
rabdomeriche; cop: coppa ottica pigmentata (Saló e Batistoni, 2008). B) Organizzazione schematica del chiasma ottico P: coppa ottica pigmentata; CB: corpi cellulari dei fotorecettori; ON: nervi ottici; B: cervello; OC: chiasma ottico (Sakai et al., 2000).
Le planarie sono generalmente organismi ermafroditi ed hanno la capacità di riprodursi sia sessualmente (Figura 1D) che asessualmente. Nella condizione di riproduzione asessuata, le planarie non hanno gonadi mature e queste si formeranno de novo quando l’animale acquisisce la condizione sessuale. Recenti dati molecolari dimostrano che l’organismo asessuato possiede cellule germinali primordiali. Al contrario, gli organi riproduttori degenerano quando le planarie passano ad una condizione asessuata così come durante la rigenerazione o la fase di starvation (Handberg-Thorsager e Saló, 2007;
16 Wang et al., 2007; Sato et al., 2006). Le dimensioni delle planarie dipendono sia dalla specie considerata che dalla disponibilità di cibo. Un ambiente “favorevole” stimola la crescita dell’animale mentre una condizione di digiuno provoca una riduzione delle dimensioni che sembra legata ad una diminuzione del numero totale delle cellule (Newmark e Sanchèz, 2002).
17
2.2. Omeostasi tissutale e rigenerazione
Una grande varietà di diversi processi biologici, che agiscono a differenti livelli, contribuiscono al mantenimento della forma anatomica e funzionale negli animali adulti (Rando, 2006). Le cellule staminali giocano un ruolo molto importante nell’omeostasi e nella rigenerazione tissutale. Durante il turnover cellulare, queste cellule costituiscono una riserva per la rigenerazione tissutale in quanto rimpiazzano le cellule differenziate che sono state eliminate attraverso morte cellulare (Raff, 2003). Questo processo consiste in: 1) Continua e periodica eliminazione di cellule differenziate dai tessuti; 2) Le cellule morte vengono rimpiazzate attraverso divisione cellulare, generalmente coinvolgendo cellule staminali adulte e i loro discendenti; 3) Le cellule che sono state generate nuovamente differenziano e diventano parte integrante del tessuto pre-esistente (Figura 4). Molti phyla includono specie che sono in grado non solo di rimpiazzare cellule dei loro tessuti, ma anche di rigenerare estese regioni del corpo. La rigenerazione negli organismi adulti può essere vista come un esempio di morfogenesi post-embrionale. Essa include il riconoscimento del tessuto perso, ricostruzione e ripristino delle strutture principali (Brockes e Kumar, 2008).
18
2.3. Rigenerazione e omeostasi tissutale in planaria
La planaria è nota per la sua plasticità corporea e per l’incredibile capacità di rigenerare qualsiasi parte del corpo. Il processo di rigenerazione in planaria consiste in un modello misto morfallassi-epimorfosi (Agata et al., 2007; Salò e Bagunà, 1984). Dopo l’amputazione, per morfallassi, si ha una riorganizzazione dei tessuti nel moncone rigenerante. Inoltre, l’interazione tra epitelio e parenchima a livello della ferita e i segnali che derivano dal tessuto danneggiato (Kato et al., 2001; Wenemoser et al., 2012; Gaviño et al., 2013) attivano la proliferazione dei neoblasti nella regione posta sotto la ferita (post-blastema), permettendo alla rigenerazione di procedere. Le cellule prodotte attraverso l’attività mitotica migrano progressivamente accumulandosi sotto l’epitelio della ferita, formando il blastema rigenerativo (epimorfosi). Nel blastema si hanno processi di differenziamento cellulare e morfogenesi che portano alla completa rigenerazione delle strutture mancanti. In seguito al riarrangiamento dei tessuti pre-esistenti del moncone (morfallassi) vengono ristabilite le giuste proporzioni nel corpo della planaria (Figura 5).
19
Figura 5: Rigenerazione in planaria. Dopo l’amputazione, le cellule indifferenziate migrano
nella regione del taglio con formazione del blastema (epimorfosi). In seguito al processo di morfallassi vengono ristabilite le proporzioni; dopo 1-2 settimane il processo di rigenerazione è completato.
Nelle planarie la rigenerazione e l’omeostasi tissutale -che avviene in tutti i tessuti- coinvolgono una vasta popolazione di cellule staminali adulte, note come neoblasti. Queste cellule sono state definite sulla base della morfologia, della distribuzione anatomica, e dell’attività mitotica. In particolare, i neoblasti sono piccole cellule (approssimativamente di 5-10 μm) con un grande nucleo e un citoplasma scarso (Figura 6). Queste cellule sono distribuite in tutto il parenchima, ma sono assenti nel faringe e nella regione anteriore ai fotorecettori.
Figura 6: I neoblasti: A) Neoblasto visualizzato al microscopio ottico; B) Neoblasto
visualizzato al microscopio elettronico; C) Neoblasti localizzati nel parenchima, visualizzati utilizzando l’ibridazione in situ con mcm2 (Salvetti et al., 2000). Scale bars: 8 μm in (A); 1 μm in (B); 100 μm in (C).
I neoblasti costituiscono circa il 25-30% delle cellule di planaria e sono le uniche cellule proliferanti (Baguñà et al., 1989). Questo è stato dimostrato sperimentalmente tramite una marcatura specifica utilizzando un anticorpo contro la forma fosforilata dell’istone H3 (H3P), e tramite l’analogo della timidina BrdU (Newmark e Sánchez Alvarado,
20 2000). Recentemente è stata dimostrata la pluripotenza dei neoblasti sfruttando la loro selettiva distruzione attraverso l’irraggiamento. Essendo le uniche cellule proliferanti, i neoblasti vengono infatti selettivamente distrutti con raggi X. E’ stato dimostrato che un singolo neoblasto iniettato in una planaria irradiata è capace di ripopolare il corpo dell’intero animale, dando origine a tutti i tipi cellulari e garantendo così la sopravvivenza dell’animale (Slack, 2011; Wagner, 2011). Dunque i neoblasti sono cellule pluripotenti che possono differenziare in tutti i tipi cellulari presenti in planaria (Figura 7). Sono stati descritti almeno 20 tipi diversi di cellule differenziate (Baguñà e Romero, 1981). Il meccanismo di divisione e differenziamento di queste cellule è ancora una questione aperta e non è chiaro come si dividano asimmetricamente dando origine ad un neoblasto e ad una cellula differenziata o come si dividano simmetricamente dando origine solo a cellule pluripotenti o solo a cellule differenziate a seconda degli stimoli che li circondano. Ci sono anche prove, ottenute grazie alla sensibilità all’irraggiamento, al pattern di espressione e alla marcatura con bromodeossiuridina (BrdU), che suggeriscono l’esistenza di differenti sottopopolazioni di cellule staminali in planaria.
21
Figura 7. Esempi di cellule differenziate di planaria: a) cellula epiteliale; b) neurone
unipolare; c) cellula muscolare; d) cellula “fixed” del parenchima; e) cellula del gastroderma; f) cellula calciforme; g) cellula del pigmento; h) cellula a fiamma; i) cellula acidofila; l) ed m) neuroni bipolari.
22
2.4
Determinazione della polarità antero-posteriore durante la
rigenerazione
In seguito all’amputazione della testa e della coda di una planaria, l’estremità anteriore del frammento restante (tronco) rigenera una testa, mentre l’estremità posteriore rigenera una coda. Ciò avviene perché, lungo l’asse antero-posteriore dell’animale, esiste una polarità che, durante la rigenerazione, viene ristabilita. Sono noti diversi pathways di segnalazione coinvolti nel ristabilimento e nel mantenimento della polarità assiale durante la rigenerazione (Petersen e Reddien, 2008). Recenti studi di RNA interference (RNAi) hanno dimostrato che il pathway di Wnt/beta-catenina è fondamentale per la determinazione della polarità in questi animali. Il legame di Wnt al suo recettore frizzled causa la distruzione del “complesso di degradazione” della beta-catenina costituito da Axina, GSK3, CKI e APC. La beta-beta-catenina si accumula nel citoplasma, entra nel nucleo ed attiva la trascrizione di numerosi geni. Esiste un unico gene che è richiesto per la determinazione della polarità, Smed-beta-catenina-1. Il silenziamento di questo gene causa, durante la rigenerazione, la formazione ectopica di una testa nella regione posteriore dell’animale; questi animali mostrano anche un secondo faringe orientato nella direzione opposta a quello wild-type (Petersen e Reddien, 2008). L’RNAi della beta-catenina, quindi, induce la formazione di teste in seguito all’amputazione in diverse posizioni lungo l’asse antero-posteriore indicando, quindi, l’importanza di questo gene per il ristabilimento della polarità durante la rignerazione ed il mantenimento della stessa (Figura 8).
23
Figura 8. L’ inibizione di Smed-beta-catenina-1 altera la determinazione ed il mantenimento
della polarità lungo l’asse antero-posteriore. A) Formazione di una testa durante la rigenerazione della regione posterione dell’animale (in tutti e tre i casi di taglio I, II e III). B) RNAi dopo un’ora dall’amputazione: l’animale genera una testa nella regione posteriore del corpo. C) Animali con tagli multipli e code rimosse hanno generato un animale a sei teste (asterischi, teste sovrannumerarie). D) L’RNAi della beta-catenina non danneggia la rigenerazione dell’estremità della testa. ( Petersen e Reddien, 2008).
Inoltre, le planarie in cui è stata silenziata l’espressione della beta-catenina mostravano up-regolazione di ERK, una delle MAP chinasi, nel blastema anteriore indicando che la beta-catenina, in condizioni normali, ha la capacità di inibire il segnale di ERK (Umesono et al., 2013). Agata et al. (2014) hanno recentemente dimostrato come l’attivazione di ERK sia importante non solo per la formazione del blastema anteriore ma anche per il differenziamento dei neoblasti; infatti, la sua inibizione mantiene i neoblasti nella condizione di cellule indifferenziate proliferanti.
24
2.5. Piante medicinali
Le proprietà terapeutiche di molte piante sono tradizionalmente note. Evidenze fossili e ritrovamenti archeologici suggeriscono come le piante siano state usate come medicinali già in tempi preistorici, e documenti scritti a proposito di piante dotate di proprietà terapeutiche risalgono ad almeno 5000 anni fa (Raskin et al., 2002). L’impiego primitivo delle piante per gli scopi medicinali avveniva sulla base di esperienze empiriche maturate utilizzando direttamente la pianta stessa, fresca o essiccata (droga), oppure sottoposta a procedimenti di estrazione molto semplici, probabilmente di origine domestica, quali gli infusi e i decotti con acqua o i macerati con alcool o liquidi alcolici (tinture). Anche in Italia l’impiego delle erbe, utilizzate nella cura delle malattie, ha tradizioni antichissime e raggiunge il suo maggior interesse tra il XVI e XVIII secolo, periodo in cui si ha la testimonianza, tramite importanti esperienze e scoperte, di una approfondita cultura botanica. A partire dalla prima metà dell’ottocento, invece, i progressi della chimica hanno consentito di ottenere per sintesi i singoli composti chimici e la farmacologia ha permesso di saggiare la loro attività biologica specifica, favorendo l’uso dei composti sintetici purificati e riducendo l’impiego delle piante e dei loro derivati. Così, i continui miglioramenti in merito alle caratteristiche farmacologiche, farmacocinetiche e tossicologiche delle strutture molecolari hanno consentito la realizzazione di farmaci molto potenti in sostituzione delle primitive medicine vegetali. Anche in seguito, con il progredire delle varie tecniche d’isolamento e sintesi chimica di principi attivi, il mondo scientifico si è indirizzato, verso i prodotti di quest’ultimo procedimento, sottraendo, così, interesse alle piante officinali. Tale cambiamento è favorito da diversi fattori come la scarsità e la difficoltà di recuperare nuove fonti vegetali, i lenti procedimenti d’estrazione messi a confronto con la velocità
25 dei procedimenti sintetici e non ultimi i costi elevati. Tuttavia, dagli ultimi decenni del XX secolo fino ad oggi, tale interesse per le piante è nuovamente in auge a causa di una maggior attenzione per la salute, il benessere individuale e l’interesse per il naturale. L’attività terapeutica delle piante dipende, quindi, dai suoi costituenti chimici, e tali costituenti anche se con struttura chimica molto simile tra loro possono conferire alle piante diversa attività farmacologica. La diversità chimica che caratterizza le piante rende l’esplorazione delle loro proprietà biologiche non solo una delle principali fonti di nuovi composti potenzialmente utilizzabili per la realizzazione di nuovi farmaci, ma anche uno strumento utile per la scoperta di nuovi meccanismi d’azione. Composti farmacologicamente attivi sono stati sviluppati per il trattamento di malattie umane in quasi tutte le aree terapeutiche. Infatti, l’impiego dei prodotti medicinali vegetali da parte della popolazione generale degli USA è cresciuto di uno stupefacente 380% fra il 1990 e il 1997 (NCCAM, 2000); l’aumento annuale è stato del 2,5% nel 1990 e ha raggiunto il 12,1% nel 1997. Nel Regno Unito, la fitoterapia costituisce oggi la più popolare pratica medica fra tutte le terapie complementari e in Germania una media annuale della popolazione generale pari al 65% fa ricorso ai farmaci vegetali. Ad oggi, infatti, l’utilizzo delle piante a scopo medico per migliorare la salute dell’uomo, è alla base della moderna industria farmaceutica (Ribnicky et al., 2008).
26
2.6. Alcaloidi naturali
Tra i metaboliti secondari delle piante, ovvero i prodotti del metabolismo che non sono essenziali per la semplice crescita, sviluppo o riproduzione della pianta, figurano gli alcaloidi, composti naturali contenuti nei vegetali; possono essere rilasciati nel suolo e quindi accumularsi nelle piante, oppure essere prodotti da microrganismi strettamente associati con alcuni vegetali; vengono rilasciati nelle cellule e grazie al loro sapore amaro trovano applicazione nella protezione della pianta da organismi che altrimenti se ne ciberebbero. I primi alcaloidi isolati furono la narcotina nel 1803 e la morfina nel 1806; negli anni successivi ne furono isolati molti altri e successivamente si cominciò ad indagarne la struttura. Nel 1870 venne stabilita la precisa struttura dell’alcaloide coniina, ma fu necessario un secolo, prima che tutte le strutture fossero chiarite. Correntemente il numero di alcaloidi conosciuti è di circa 100.000, principalmente derivati dalle angiosperme, da funghi e da animali. Nel regno vegetale la loro distribuzione è piuttosto ampia, infatti, in 34 ordini su 60 (circa il 40% delle famiglie e il 9% dei generi) sono state riscontrate specie che producono alcaloidi. Le più importanti famiglie sono: Amarillidaceae, Compositae, Leguminosae, Liliaceae,
Papaveraceae, Rutaceae e Solanaceae. La parola “alcaloide” deriva da “alcali vegetali”
e veniva usata per esprimere la basicità di questi composti. La maggior parte di essi sono eterociclici, ma altri come l’efedrina e la mescalina, sono aciclici e spesso sono chiamati “pseudo-alcaloidi”. A causa dell’estrema eterogeneità, gli alcaloidi possono essere classificati in base alla loro origine botanica e biochimica, alla struttura chimica e all’azione farmacologica. La classificazione in base alla struttura chimica prevede due principali divisioni:
27 • ALCALOIDI NON ETEROCICLICI o alcaloidi atipici chiamati proto-alcaloidi o ammine biologiche;
• ALCALOIDI ETEROCICLICI, divisi in 14 gruppi a seconda della struttura ad anello derivante da un nucleo:
Imidazolico
Pilocarpina – Pilocarpidina
Steroidico
Solanina – Germidina – Tomatina - Conessina
Tropanico
Atropina – Scopolamina – Cocaina - Isociamina
Isochinolinico
Berberina – Emetina – Idrastina – Canadina
Benzilisochinolinico
Papaverina – Narcotina – Narceina
Fenantrenico
Morfina – Codeina – Tebaina
Indolico
Reserpina – Stricnina – Brucina – Eserina
Chinolinico
Chinina – Chinidina – Cupreina
Piridinico
Nicotina – Arecolina
Piperidinico
Lobelina – Pelletierina – Coniina
Pirrolidinico
Igrina – Stachidrina
Purinico
Caffeina – Teobromina - Teofillina
Pirrolizidinico
Alcaloidi del Senecio
Terpenico
Aconitina – Elatina
del Nor-lupano
Sparteina – Lupanina – Genisteina – Anagyrina
dell’Apomorfina
Boldina – Coridalina - Bulbocapnina
28
2.7. Proprietà degli alcaloidi
Gli alcaloidi sono comunemente sostanze quaternarie e possono contenere atomi di carbonio, idrogeno, azoto e la maggior parte di essi contiene anche ossigeno. Altri, invece, come la coniina estratta dalla cicuta e la nicotina dal tabacco, non contengono ossigeno e sono liquide. La maggior parte degli alcaloidi sono sostanze solide, cristalline che reagiscono con gli acidi per formare sali. Nella pianta possono presentarsi nella forma libera, come sali o come N-ossidi. Esistono alcaloidi, anche se relativamente rari, che possiedono la caratteristica di essere colorati: due esempi sono la berberina che è gialla e la sanguinarina che è di color rosso-rame. Sono molecole basiche poco solubili in acqua ma facilmente solubili in solventi organici quali alcoli, etere, cloroformio, diclorometano, acidi diluiti. In particolare, nella forma basica sono spesso scarsamente solubili in acqua, ma solubili in solventi organici; al contrario, i loro sali sono difficilmente solubili nei solventi organici ma solubili in acqua. Eccezioni sono ad esempio, la caffeina (basica) che può essere estratta dal thè con l’acqua e la colchicina che è solubile in soluzioni acquose acide, basiche o neutre. La conoscenza delle caratteristiche di solubilità degli alcaloidi è di notevole importanza farmaceutica non solo perché queste sostanze sono spesso somministrate in soluzione, ma anche perché le differenze di solubilità tra gli alcaloidi e i loro sali forniscono metodi per l’isolamento di questi composti dalle piante e per la separazione di essi dalle altre sostanze presenti.
29
2.8. Gli alcaloidi come sostanze nutraceutiche
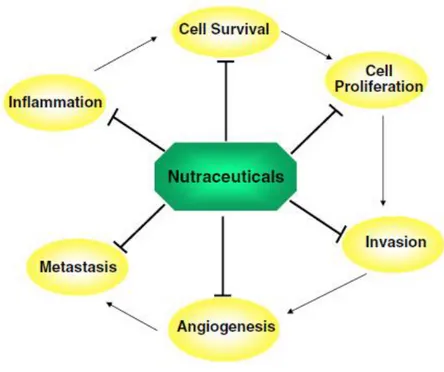
La formazione di un tumore è un processo multisteps che risulta dalla disregolazione di circa 500 geni coinvolti nella trasformazione, sopravvivenza, proliferazione, invasività, angiogenesi e metastasi delle cellule tumorali (Vogelstein e Kinzler, 2004). Diversi alcaloidi sono in grado di regolare questi eventi modulando i processi infiammatori e influenzando i processi di sopravvivenza delle cellule tumorali, proliferazione, invasività, angiogenesi e metastasi (Gupta et al., 2010).
Figura 9: Principali target di alcuni alcaloidi durante la progressione tumorale: i processi di
sopravvivenza cellulare, proliferazione, invasività, angiogenesi e metastasi (Gupta et al., 2010).
Durante il processo infiammatorio, NF-kB svolge un ruolo fondamentale. E’ un fattore di trascrizione pro-infiammatorio coinvolto nella regolazione dei processi di apoptosi, tumorigenesi, imfiammazione, aterosclerosi, replicazione virale e numerose patologie
30 autoimmuni. Nella sua forma inattiva, NF-kB è sequestrato nel citoplasma, legato a proteine inibitorie della famiglia IkB. Vari stimoli che includono citochine, loro recettori, fattori di crescita, proteine di adesione cellulare, linfochine, radiazioni, agenti farmacologici e stress, causano la fosforilazione di IkB, che quindi viene ubiquitinato e degradato. NF-kB, attivo, trasloca nel nucleo dove attiva l’espressione di numerosi geni. NF-kB, costitutivamente attivo, è stato ritrovato nei tessuti della maggior parte dei pazienti affetti da cancro, compresi quelli con leucemia, linfoma e tumori della prostata, della mammella, cavo orale, fegato, pancreas, colon e ovaio (Aggarwal e Gehlot, 2009). Negli ultimi due decenni, è stato dimostrato come numerosi alcaloidi svolgano un’azione antitumorale inibendo l’attivazione di NF-kB. Ad esempio, la curcumina inibisce la degradazione di IkB attraverso la down-regolazione di IKK (IkB kinase). Altri, invece, come la berberina, sono in grado di indurre apoptosi nelle cellule tumorali attraverso l’alterazione del pathway mitocondriale; essa, infatti, up-regola l’espressione di proteine pro-apoptotiche (Bax) e down-regola quella di proteine anti-apoptotiche (Bcl-2 e Bcl-xL) inducendo il rilascio del citocromo c e attivando, in ultima analisi, le caspasi 3, 8 e 9, proteine effettrici del processo apoptotico (Ho et al., 2009). La maggior parte degli alcaloidi vegetali sono agenti chemioterapici che agiscono in modo specifico sul ciclo cellulare, bloccando, così, la proliferazione delle cellule tumorali.Il ciclo cellulare consiste di quattro fasi che si susseguono: G0/G1, S, G2, ed M. Cicline e chinasi ciclina-dipendenti (CDK) sono i principali regolatori della progressione del ciclo cellulare. I complessi Ciclina/CDK sono costituiti da una subunità regolatoria, la ciclina, e da una subunità con attività chinasica, CDK. Tali complessi sono controllati da regolatori sia positivi che negativi; p21WAF1 (p21) e p27KIP1 (p27) sono i due principali regolatori negativi di CDK e giocano un ruolo
31 importante nell’inibizione dell’attività chinasica. Entrambi inibiscono la fosforilazione di CDK4/ciclina D e di CDK2/ ciclina E determinando l’inibizione di questi complessi e causando, in ultima analisi, l’arresto del ciclo cellulare in fase G1 (Sandal, 2002). Gli alcaloidi possono agire up-regolando l’espressione degli inibitori p21 e p27 o down-regolando quella della ciclina D bloccando la progressione del ciclo cellulare. Tra i composti naturali più importanti ad azione antineoplastica sono da annoverarsi quelli che interagiscono con la tubulina (alcaloidi della vinca e derivati del taxano). La tubulina è una proteina globulare che costituisce l'unità fondamentale delle strutture del citoscheletro, il microtubulo. I microtubuli sono un target privilegiato per numerosi agenti antitumorali. I composti appartenenti a questa famiglia possono essere classificati in due categorie:
- composti che inibiscono la depolimerizzazione e stabilizzano i microtubuli;
- composti che inibiscono la polimerizzazione della tubulina e impediscono la formazione dei microtubuli.
Della prima categoria fanno parte i “Taxani”, alcaloidi isolati dal Taxus canadensis; un esempio è il placlitaxel. Questa molecola, infatti, si lega alla subunità β dell’eterodimero della tubulina, accelerando la polimerizzazione della tubulina stessa ed allo stesso tempo stabilizzando i microtubuli formatisi, inibendone la depolimerizzazione. L’inibizione della depolimerizzazione dei microtubuli tra la profase e l’anafase della mitosi porta all’arresto del ciclo di divisione cellulare, con la conseguente morte delle cellule cancerose (Jordan et al., 1993). Attualmente il paclitaxel è approvato dalla FDA (Food & Drug Administration) per il trattamento del cancro alle ovaie in stato avanzato e del cancro metastatico al seno. Alla seconda categoria appartiene, invece, la
32 colchicina isolata dalla “freddolina” (Colchicum autumnale). Questo alcaloide impedisce la polimerizzazione dei microtubuli bloccando, quindi, la mitosi. La colchicina è tuttavia molto tossica e il suo impiego nella terapia dei tumori è oggi del tutto abbandonato. Gli alcaloidi della Vinca sono farmaci ciclo-specifici e, come la colchicina, bloccano la mitosi con arresto in metafase. In particolare, essi agiscono determinando la dissoluzione dei microtubuli e causando, così, la disgregazione dell’apparato mitotico. Tra questi, la vinblastina, è impiegata principalmente nel trattamento del morbo di Hodgkin, una neoplasia che colpisce il sistema linfatico, la milza ed il fegato, ma anche in altre forme maligne, quali carcinoma mammario, carcinoma della vescica, melanoma e carcinoma testicolare (Porter, 1989). La vincristina, invece, molto più usata della vinblastina, è particolarmente utile nella cura delle leucemie dell’infanzia, ed è anche impiegata in molte associazioni tra farmaci antitumorali nel trattamento di sarcomi dei tessuti molli, sarcoma osteogenico e tumori cerebrali. Infine, la camptotecina è un alcaloide estratto dalla pianta di Camptotheca
acuminata Decne la cui principale attività citotossica dipende dall’interazione con
l’enzima topoisomerasi I, che è responsabile della riduzione della tensione torsionale nel DNA superavvolto. Le camptotecine, infatti, si legano e stabilizzano il legame tra topoisomerasi I e DNA, consentendo il taglio dell'acido nucleico da parte della topoisomerasi, ma inibendo la successiva richiusura dell'elica e determinando l'accumulo di filamenti singoli di DNA e conseguente morte cellulare (Covey et al., 1989). Inoltre, diversi alcaloidi hanno proprietà antiangiogeniche; l’angiogenesi è il processo durante il quale si formano nuovi vasi sanguigni da quelli pre-esistenti, al contrario della vasculogenesi durante la quale le cellule endoteliali si differenziano ex novo da precursori nel mesoderma. Negli embrioni entrambi i processi sono essenziali
33 per un loro normale sviluppo. Negli adulti, l’angiogenesi patologica è un processo indesiderato in alcuni stadi di malattie come il cancro, la retinopatia diabetica, l’artrite reumatoide e la psoriasi. Il Fattore di Crescita Endoteliale Vascolare (VEGF) svolge un ruolo chiave sia nel processo di formazione dei vasi normali che nell’angiogenesi patologica; infatti, è stato ampiamente dimostrato che, in cellule tumorali VEGF ed i suoi recettori sono over-espressi; esso promuove la progressione della trasformazione tumorale in quanto consente alle cellule un rifornimento costante di nutrienti necessari al soddisfacimento del loro metabolismo. Curcumina, capsaicina, taxolo e molti altri agiscono inibendo la produzione di VEGF (Min et al., 2004; Okamoto et al., 2002). Ad oggi, quindi, molti farmaci contengono molecole di natura vegetale e molti principi attivi di sintesi sono modellati sulla struttura di ben note molecole vegetali. Negli ultimi venti anni la chimica delle sostanze naturali è stata oggetto di un’intensa attività di ricerca, infatti sebbene la maggior parte dei farmaci di ultima generazione sul mercato sia di origine sintetica, le sostanze naturali ed in particolare i metaboliti secondari di origine vegetale, isolati e caratterizzati da un grande e vario numero di specie, hanno un ruolo fondamentale nella ricerca e nello sviluppo di nuovi farmaci. Questo successo è legato all’incredibile biodiversità presente nel regno vegetale che ha dimostrato e continua a dimostrare di essere una preziosa fonte di nuovi farmaci in campo antitumorale ma non solo (Cragg e Newman,1999; Newman et al., 2003).
34
2.9.Chelidonium majus
Il Chelidonium majus (Figura 10) è l’unica specie del genere Chelidonium della famiglia delle Papaveraceae. La famiglia delle Papaveraceae comprende circa 700 specie localizzate nelle regioni temperate e fredde dell'emisfero boreale. Si tratta soprattutto di piante erbacee e soltanto raramente arbustive (Bocconia), perenni e annuali, solitamente laticifere; il latice può essere bianco (Papaver), aranciato (Chelidonium), o rosso (Sanguinaria). Il C. majus è una pianta erbacea perenne, largamente diffusa in Europa e nell’Asia orientale.
Figura 10. Pianta del Chelidonium majus o “erba dei porri”.
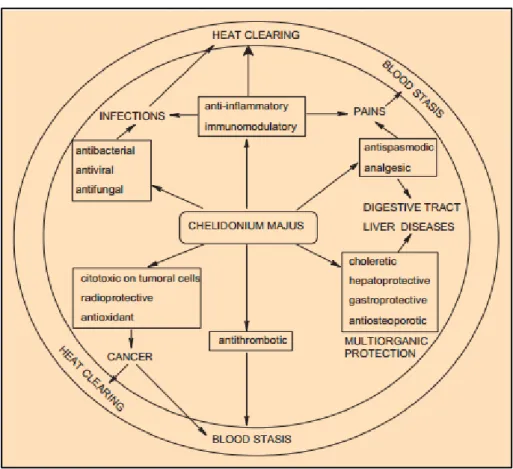
Il latice di C. majus contiene alcuni alcaloidi isochinolinici, presenti nelle parti aeree
della pianta (berberina e chelidonina) e nelle radici (cheleritrina e sanguinarina). Essi conferiscono alla pianta C. majus diverse proprietà biologiche; i suoi estratti, infatti, mostrano un’azione antivirale, antibatterica ed antimicotica, antinfiammatoria ed antitumorale sia in vitro che in vivo (Colombo e Bosisio, 1996). Anticamente, il C.
35 psoriasi ed eczemi. In Europa e in Cina, la pianta viene tradizionalmente utilizzata da secoli per il trattamento di varie malattie, soprattutto epatiche. E’ stata ampiamente dimostrata l’attività citotossica dei suoi alcaloidi in vitro in colture di cellule tumorali, umane ed animali, e ciò è stato considerato di grande interesse per un potenziale utilizzo nella terapia del cancro.
36
2.10. L’alcaloide SANGUINARINA
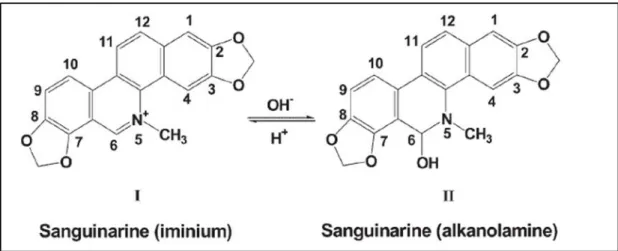
La sanguinarina (SA; 13-methyl[1.3]benzodioxolo[5,6,-c]-1,3-dioxolo[4,5-i] phenanthradinium) è un alcaloide benzofenantridinico di origine naturale presente in alcune Papaveraceae come Chelidonium majus, Sanguinaria canadensis (radice), ma anche Poppy fumaria, Bocconia frutescens, e Macleaya cordata. E’ presente in due forme: la forma di catione quaternario (forma imminica) e quella neutra di alcanolammina (Figura 12). Le due forme sono interconvertibili tra loro e la conversione della forma imminica in quella di alcanolammina, in seguito ad una reazione di idrossilazione, conferisce alla SA maggiore lipofilicità. Utilizzando tecniche spettrofotometriche e spettrofluorimetriche, è stato osservato come la sanguinarina mostri un equilibro pH-dipendente tra la forma imminica (carica) e quella di alcanolammina (neutra). In particolare, la prima è presente in un pH con un range di 1.0–6.0 e la seconda in un pH di range 8.5–11.0 (Maiti et al., 2006).
Figura 12. Formazione della forma neutra (II) per idrossilazione di quella cationica (I) sul
37 Studi di fluorescenza in vivo hanno dimostrato come la sanguinarina, principalmente nella sua forma cationica, sia in grado di inibire la Na+/K+-ATPasi, probabilmente legandosi ai gruppi –SH di quest’enzima, fondamentali per la sua attività (Janovská et
al., 2010). Inizialmente era stato riportato come entrambe le forme, imminica e
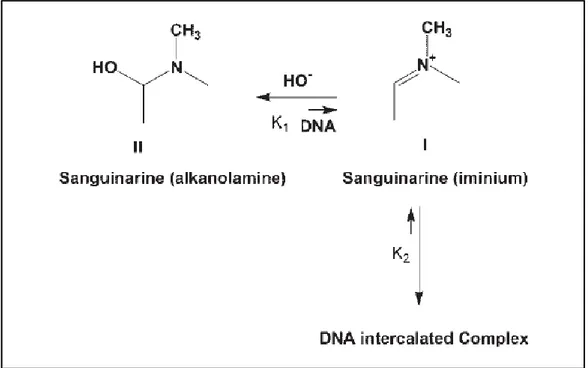
alcanolammina, fossero in grado di intercalarsi tra le basi del DNA alterandone la struttura (Smekal et al., 1984); successivamente, questa conclusione è stata contradetta da Sen e Maiti in seguito ai risultati ottenuti dagli spettri di assorbimento e fluorescenza, dicroismo circolare, temperatura di melting e viscosità. Essi conclusero che la forma di alcanolammina non era in grado di legare il DNA a causa della sua neutralità e della struttura non planare. Tuttavia, è stato osservato che in presenza di elevate concentrazioni di DNA, la forma neutra veniva trasformata in quella cationica formando, così, un complesso con il DNA (Figura 13) (Maiti et al., 2006).
Figura 13. Conversione della sanguinarina in forma di alcanolammina nella forma imminica, in
presenza di elevate concentrazioni di DNA, e formazione del complesso intercalante (Maiti et
38 L’alcaloide sanguinarina viene impiegato in campo umano principalmente come componente ad azione antibatterica, antifungina ed antinfiammatoria in prodotti per l’igiene orale (dentifrici e colluttori). Numerosi studi in vitro, infatti, hanno ampiamente dimostrato come il trattamento con sanguinarina riduca le infiammazioni gengivali e la formazione della placca sopragengivale (Southard et al., 1984). Riguardo i possibili meccanismi d’azione è stato anche dimostrato che la sanguinarina, alla concentrazione di 16 μg/ml inibisce il 98% dei microbi isolati dalla placca dentaria umana (Dzink e Socransky, 1985) e che la sanguinarina e lo zinco agiscono sinergicamente nel sopprimere la crescita di diversi ceppi orali di streptococco e di actinomiceti (Eisenberg
et al., 1991). L’inclusione della sanguinarina nei comuni prodotti per l’igiene orale è
stata approvata dalla FDA ma negli ultimi anni la Colgate-Palmolive Company ha deciso di eliminare l’alcaloide dai suoi prodotti Viadent® in quanto è stata dimostrata un’associazione tra l’utilizzo di tali prodotti, contenenti sanguinarina, e il rischio di sviluppare leucoplachia, patologia del cavo orale caratterizzata dall’insorgenza di placche biancastre spesso asintomatiche ma che potrebbero mutare e diventare maligne (Mascarenhas et al., 2001). In particolare in questo studio, effettuato da Mascarenhas et
al., (2001), è stato affermato come i consumatori di prodotti Viadent® abbiano un
rischio 9,7 volte in più rispetto a coloro che non li utilizzano, di sviluppare questa patologia. Per cui, ad oggi, l’inclusione della sanguinarina nei prodotti per l’igiene orale è una questione controversa. Inoltre, la sanguinarina è contenuta all’interno di un additivo comunemente aggiunto al mangime per animali, il Sangrovit®. E’ stato osservato che bovini, suini e pesci alimentati con Sangrovit® crescono molto più rapidamente rispetto ai controlli; la sanguinarina che viene assunta, infatti, sembra incrementare l’assorbimento del cibo favorendo, quindi, la crescita degli animali
39 (Tschirner et al., 2003; Tschirner, 2004). Rawling et al., (2009) hanno valutato gli effetti dell’assunzione di Sangrovit® sul pesce Oreochromis niloticus, la tilapia del Nilo dimostrando come il trattamento favorisca la crescita degli animali senza alterare i parametri epatici, immunologici ed ematologici. La sanguinarina è attiva, inoltre, contro il protozoo Ichthyophthirius multifiliis, parassita olotrico dei pesci (Yao, 2010). Per le sue proprietà antiparassitarie, infatti, è considerata un potenziale agente chemioterapico per il trattamento della schistosomiasi (Zhang e Coultas, 2013), parassitosi causata da Platelminti del genere Schistosoma che colpisce circa 200 milioni di persone l’anno, diffusa soprattutto in Africa e in America meridionale. Dal 2013 la sanguinarina è considerata una valida alternativa al praziquantel che da 30 anni è l’unico farmaco utilizzato per il trattamento di questa malattia (Seubert et al., 1977). E’ stato dimostrato, infatti, come la sanguinarina sia in grado di causare la distruzione del tegumento e la paralisi del parassita, probabilmente agendo sul sistema nervoso (Zhang e Coultas, 2013), attraverso un meccanismo dose-dipendente. Inoltre, la sanguinarina ha dimostrato di avere proprietà antinfiammatorie sia in vitro che in vivo (Niu et al,. 2012). In particolare, essa inibisce l’attivazione della MAPK (mitogen-activated protein kinase) che svolge un ruolo importante durante il processo infiammatorio in quanto regola la sintesi dei mediatori dell’infiammazione ed il loro rilascio in vitro, in seguito a fosforilazione da parte di citochine pro-infiammatorie prodotte dai macrofagi attivati (Niu et al., 2012). La sanguinarina, quindi, altera l’espressione di alcuni mediatori dell’infiammazione quali istamina, serotonina e prostaglandine responsabili della vasodilatazione e dell’aumento della permeabilità vascolare. L’attività antinfiammatoria di quest’alcaloide è correlata alla sua capacità antiangiogenetica. L’angiogenesi è indispensabile perché si instauri l’infiammazione e nella maggior parte dei casi dipende
40 da VEGF. La sanguinarina sopprime in modo marcato la migrazione indotta da VEGF, la crescita e la sopravvivenza delle cellule endoteliali in vitro, in maniera dose-dipendente (10-300 nM) (Eun e Koh, 2004). La soppressione dell’angiogenesi indotta dalla sanguinarina è stata dimostrata anche in vivo (nel topo “Matrigel plugs” e nella membrana corionallantoidea degli embrioni di pollo). Essa agisce sopprimendo la fosforilazione basale della proteina kinasi B e VEGF-indotta, mentre non produce alcuna alterazione sull’attivazione di ERK1/2 e PLCγ1 indotta da VEGF (Eun e Koh, 2004). Inoltre, dati di letteratura dimostrano come la sanguinarina inibisca l’espressione di specifiche metalloproteinasi (MMP-2, MMP-9), in cellule tumorali umane, riducendone l’invasività ed impedendo, quindi, eventi di metastatizzazione (Choi et al., 2009). A concentrazioni micromolari, inoltre, è un potente inibitore del fattore di trascrizione nucleare NF-kB, che svolge un ruolo molto importante nella regolazione dell’infiammazione modulando l’espressione di geni che codificano per citochine, molecole di adesione cellulare e fattori di crescita. Numerosi studi in vitro hanno dimostrato le proprietà antiproliferative della sanguinarina che è in grado di causare l’arresto del ciclo cellulare limitando, così, la proliferazione delle cellule tumorali. E’ stato osservato in cellule muscolari come la sanguinarina induca l’arresto del ciclo cellulare in fase G1 attraverso un meccanismo dose-dipendente. In particolare, quest’alcaloide inibisce l’attività dei complessi CDK4/ciclina D e CDK2/ciclina E impedendo la progressione del ciclo cellulare (Lee et al., 2008). Inoltre, cellule trattate con sanguinarina mostrano up-regolazione di p27, regolatore negativo dei complessi CDK/ciclina. La down-regolazione delle cicline E, D1 e D2 e delle chinasi ciclina-dipendenti 2, 4 e 6 è stata anche descritta come possibile meccanismo d’azione della sanguinarina nell’inibire la proliferazione e la crescita in cellule del cancro alla prostata
41 (Adhami et al., 2004) suggerendo come tale alcaloide possa essere utilizzato nel trattamento di patologie tumorali. La capacità antiproliferativa della sanguinarina si realizza anche attraverso un ulteriore meccanismo: essa causa la depolimerizzazione dei microtubuli perturbando l’organizzazione dei cromosomi in cellule HeLa sia in interfase che in mitosi, inibendo la proliferazione ed inducendo la morte delle cellule stesse. La depolimerizzazione dei microtubuli avviene perché la sanguinarina lega covalentemente la tubulina causando modificazioni irreversibili sulla sua struttura secondaria; in particolare, l’alcaloide copolimerizza con la tubulina determinando la formazione di polimeri di tubulina (Lopus e Panda, 2006). L’interesse verso la sanguinarina, quale agente antiproliferativo, ha indotto ad investigare anche circa le possibili interazioni con la cromatina. E’ stato dimostrato come il legame della sanguinarina alla cromatina causi modificazioni epigenetiche quali l’inibizione della metilazione di H3K4 e H3R17 e l’inibizione dell’acetilazione degli istoni sia in vivo che in vitro (Selvi et al., 2009). Alterazioni nella regolazione epigenetica sono generalmente correlate con alcune patologie come il cancro; infatti, gli enzimi coinvolti nella modificazione della cromatina sono ad oggi considerati dei possibili target nella terapia contro i tumori. Quale agente chemioterapico, la sanguinarina induce apoptosi nelle cellule tumorali, limitando la progressione del tumore ed, in ultima analisi, la metastatizzazione. E’ stato ampiamente dimostrato come la sanguinarina induca apoptosi nelle cellule tumorali attraverso tre meccanismi (Figura 14) (Maliková et al., 2006):
Arresto del ciclo cellulare in seguito all’inibizione dei complessi CDK/ciclina;
Inibizione dell’attivazione del fattore NF-kB;
42
Figura 14. Induzione dell’apoptosi mediata dalla sanguinarina attraverso tre differenti pathways: inibizione dell’attivazione di NF-kB; arresto del ciclo cellulare; danno al mitocondrio
43 La sanguinarina, infine, riduce la vitalità cellulare attraverso un meccanismo dose-dipendente; è in grado di indurre apoptosi nelle cellule del carcinoma dell’epidermide a dosi di 1-2-5 μM; in cheratinociti, invece, l’effetto necrotico si manifesta solo con l’impiego di dosi maggiori (10 μM) (Eun e Koh, 2004). In conclusione, quest’alcaloide è stato ampiamente studiato non solo per essere un potente agente antimicrobico ed antinfiammatorio ma anche per le sue proprietà antiproliferative ed antitumorali e per questo ampiamente utilizzato nell’ambito della nutraceutica.
44
2.11. Scopo della tesi
Lo scopo del mio lavoro di tesi è stato quello di analizzare gli effetti prodotti in vivo dalla sanguinarina nella planaria Dugesia japonica. Numerosi studi in vitro hanno dimostrato le tante proprietà biologiche di questo alcaloide nel campo della nutraceutica. E’ stato dimostrato come tutte le sostanze nutraceutiche, in misura diversa, siano in grado di modulare processi biologici differenti: infiammazione, sopravvivenza cellulare, proliferazione, invasività, angiogenesi e metastasi (Gupta et al., 2010). Per questi motivi sono anche considerate di interesse come potenziali agenti chemioterapici nella terapia contro il cancro. Tuttavia, ad oggi, sono poco noti gli effetti della sanguinarina in vivo. A tal proposito, per verificare se quanto osservato in vitro sia, in ultima analisi, riscontrabile anche in vivo, ho utilizzato la planaria quale organismo modello alternativo a quelli comunemente utilizzati per studi di tipo farmacologico e tossicologico. La planaria è frequentemente utilizzata per lo studio dei meccanismi di rigenerazione tissutale, regolazione delle cellule staminali, azione farmacologica di numerosi farmaci, cancro ed invecchiamento in quanto dotata di una straordinaria capacità rigenerativa dovuta alla presenza di cellule staminali che, peraltro, condividono molte caratteristiche con quelle dei mammiferi. Inoltre, diversi geni umani, spesso associati con uno stato patologico, hanno ortologhi in planaria. In un’ottica traslazionale, lo studio degli effetti di una sostanza nutraceutica, quale la sanguinarina, e dei suoi potenziali meccanismi d’azione in planaria può fornire risultati importanti ed utilizzabili nella medicina rigenerativa e nel trattamento di numerose patologie.
45
46
3.1. Animali
In tutti gli esperimenti, sono state utilizzate planarie appartenenti alla specie Dugesia
japonica (Dj), ceppo clonale GI. Questi esemplari si riproducono asessualmente
attraverso scissione trasversale spontanea, ogni 15 giorni circa. Sono ben adattati a vivere in ambienti di laboratorio dove sono mantenuti ad una temperatura di 18˚C, in acqua artificiale (2,5 mM CaCl2, 0,4 mM MgSO4, 0.8 mM NaHCO3, 77 mM KCl); sono nutriti una volta a settimana con fegato di pollo e lasciati affamati due giorni prima dell'inizio di ogni esperimento.
3.2.
Protocollo di “soaking”
Generalmente, per testare gli effetti di una sostanza chimica in un sistema modello, si mette l’animale direttamente a contatto con essa; per cui, è stato scelto un protocollo di “soaking”, ossia l’immersione delle planarie in una soluzione costituita dall’acqua in cui normalmente esse vivono, alla quale è stato aggiunto l’alcaloide. Inoltre, le planarie hanno un epitelio monostratificato e permeabile a piccole molecole, come la sanguinarina, nonostante la presenza di uno strato mucoso sulla superficie. La sanguinarina (Sigma) è stata sciolta in dimetilsulfossido (DMSO), sostanza generalmente utilizzata per migliorare la solubilità dei farmaci in soluzione acquosa. Dati di letteratura dimostrano come il DMSO, in concentrazioni superiori a 0,1%, possa essere tossico per le planarie (Pagán et al., 2006) influenzandone il comportamento; per cui, per evitare che eventuali effetti tossici del dimetilsulfossido potessero mascherare, poi, quelli prodotti dalla sostanza oggetto di studio, è stata utilizzata una concentrazione limite di DMSO pari a 0,03%, sufficiente a solubilizzare la sostanza ma, al tempo stesso innocua per gli animali. Pertanto, per uno screening iniziale, sono state saggiate 4
47 concentrazioni di sanguinarina (0,05 μM, 0,1 μM, 0,2 μM e 0,3 μM) in modo tale che le concentrazioni finali di DMSO, fossero comprese tra 0,005% e 0,03%. In un primo esperimento, per ogni concentrazione, 10 animali, di dimensioni simili (5 mm circa), sono stati immersi in 15 ml di soluzione contenente sanguinarina all’interno di piastre Petri di plastica (diametro 9 cm); per ciascuna concentrazione, sono state effettuate 3 repliche. Gli animali sono stati mantenuti a 18˚C per 2 ore e successivamente tagliati sopra il faringe (Figura 15) e lasciati rigenerare per 7 giorni cambiando le soluzioni a giorni alterni. Il controllo negativo è rappresentato da animali rigeneranti immersi in 15 ml di soluzione contenente DMSO alla concentrazione più alta tra quelle testate (0,03%) senza l’aggiunta dell’alcaloide. Gli animali sono stati osservati a tempi diversi di rigenerazione (24h, 48h, 72h, 96h, 120h, 144h, 168h) controllandone lo stato (vivi/morti). Quindi, dopo 7 giorni di trattamento è stata calcolata la percentuale per la quale si ha il 50% e il 95% di morti, LC50 e LC95 rispettivamente, utilizzando probit
analysis, calcolo comunemente usato in tossicologia per determinare la tossicità relativa
di sostanze chimiche in organismi viventi. Attraverso questo metodo, si può testare la risposta di un organismo sottoposto a diverse concentrazioni della sostanza in questione ed il tipo di risposta che si ottiene è sempre binomiale (morte/ non morte).
48
Figura 15. Rappresentazione schematica della procedura di amputazione di una planaria e del
49
3.3. Analisi morfometrica
L'analisi morfometrica è stata usata per calcolare il rapporto tra l’area del blastema in animali rigeneranti rispetto a quella dell’intero corpo dell’animale dopo 7 giorni di trattamento con sanguinarina 0,15 μM. Gli animali sono stati fotografati, in vivo, allo stesso ingrandimento con un microscopio digitale (Celestron). Le aree del blastema e dell’intero corpo sono state misurate con il programma ImageJ contornando la regione da misurare (Figura 16).
Figura 16. Rappresentazione schematica di come è stata effettuata la misurazione delle aree.
La stessa procedura è stata utilizzata per misurare le dimensioni del faringe degli animali.
50
3.4. Sintesi di sonde ad RNA
La sintesi in vitro delle sonde ad RNA antisenso utilizzate nelle ibridazioni in situ ha richiesto l’inoculo del clone batterico, contenente i costrutti d’interesse, in terreno liquido LB in presenza di antibiotico appropriato, in concentrazione 100 μg/ml. In seguito si è proceduto con la purificazione del DNA plasmidico, utilizzando le soluzioni e il protocollo forniti dalla ditta Promega.
3.4.1. Mini Preps
I 5 ml di cellule batteriche cresciute in terreno liquido LB addizionato con 100 μg/ml di ampicillina, sono stati centrifugati a 12800 rpm per 5 minuti. Il pellet è stato processato mediante il kit Wizard® Plus SV Minipreps DNA Purification System (Promega). Il pellet è stato risospeso in 250 μl di “ Cell Resuspension Solution”; sono stati aggiunti, poi, 250 μl di “Cell Lysis Solution” e successivamente 10 μl di “Alkaline Protease Solution”; il campione, poi, è stato incubato 5 minuti a temperatura ambiente. Sono stati aggiunti 350 μl della soluzione di neutralizzazione e si è proceduto con una centrifugazione alla massima velocità per 10 minuti a temperatura ambiente. A questo punto, è stato fatto avvenire il legame del DNA plasmidico seguito da successivi lavaggi con “Wash solution” per rimuovere eventuali contaminanti come sali e metaboliti; infine, il DNA plasmidico è stato eluito con 30 μl di “Nuclease-Free Water”. Infine, è stato centrifugato alla massima velocità per 1 minuto a temperatura ambiente e il DNA ottenuto è stato conservato a -20˚C.
51
3.4.2. Digestione del DNA plasmidico mediante enzimi di
restrizione
Il DNA plasmidico è stato digerito con opportuni enzimi di restrizione in modo da produrre dei frammenti linearizzati necessari per la sintesi di sonde ad RNA. Generalmente, gli enzimi utilizzati per la digestione sono Apa o Pst1; la reazione è costituita da: 10 μg di DNA plasmidico, 1-2 unità di enzima per ciascun μg di DNA, buffer 1X, e H2O a volume. La reazione è stata condotta a 37˚C per 2 ore.
3.4.3. Sintesi della sonda
Il DNA plasmidico linearizzato è stato purificato mediante il kit Wizard® SV Gel and PCR Clean-Up System (Promega). Per ogni reazione di trascrizione in vitro, effettuata in un volume di 20 μl, è stato utilizzato 1 μg di DNA linearizzato; la reazione di trascrizione è costituita da:
DNA linearizzato X μl
10X buffer di trascrizione 2 μl
10X DIG RNA labelling mix 2 μl
10 mM DTT 2 μl
Rnasi hinibitor (40U/μl) (Promega) 1 μl
T7/Sp6 RNA Polimerasi (20U/ μl) (Promega) 2 μl; si trascrive con T7 se il DNA è stato digerito con l’enzima di restrizione Pst1; al contrario, si trascrive con Sp6 nel caso di Apa.
52 Il campione è stato incubato 2 ore a 37ºC; successivamente, è stato aggiunto 1 μl di DNasi RNasi-free (10U/μl) (Roche) per 20 minuti a 37ºC, in modo da rimuovere contaminazioni di DNA linearizzato. A questo punto, ciascun trascritto è stato precipitato over night (ON) a -20ºC, mediante l’aggiunta di 200 μl di EDTA 200 mM, 2.5 μl di LiCL 4M e 75 μl di etanolo 100%. Il giorno successivo, il campione è stato centrifugato a 12000 rpm per 20 minuti a 4ºC e successivamente il pellet è stato lavato con etanolo al 75% e risospeso in 20 μl di H2O RF. Per una precipitazione più veloce, subito dopo il trattamento con DNasi, si può aggiungere acetato d’ammonio 2,5M e due volumi di etanolo 100% ed si lascia precipitare a -20˚C.
Per la sintesi del probe Dj-vas1, non è stato necessario effettuare il clonaggio poiché sono stati utilizzati, per l’amplificazione, due primers forward e reverse alla cui estremità 5’ di quest’ultimo è stato aggiunto il promotore della polimerasi T7, enzima che è stato utilizzato, poi, per la trascrizione del probe. La reazione di sintesi della sonda è stata allestita come descritto in 3.4.3.