POLITECNICO DI MILANO
Scuola di Ingegneria Industriale e dell’Informazione
Corso di Laurea Magistrale in Ingegneria Biomedica
ANALISI DEI FATTORI PREDISPONENTI
ALL’IPOTENSIONE INTRA – DIALITICA VALUTABILI
A INIZIO TRATTAMENTO
Relatore: Prof. Ing. Maria Laura COSTANTINO
Correlatore: Ing. Domenico VITO
Tesi di Laurea di:
Giulia CAPPOLI
Matricola 781499
Anno Accademico 2013 – 2014
Indice
SOMMARIO ... VI ABSTRACT ... IX
INTRODUZIONE ... 1
1. ANATOMIA, FISIOLOGIA E PATOLOGIA DEL RENE ... 6
1.1 ANATOMIA DEL RENE ... 6
1.2 FISIOLOGIA DEL RENE ... 9
1.3 PATOLOGIE RENALI ... 11
1.3.1 Insufficienza renale acuta ... 11
1.3.2 Insufficienza renale cronica ... 12
2. TERAPIE DIALITICHE ... 14
2.1 TERAPIE SOSTITUTIVE DELLA FUNZIONALITÀ RENALE ... 14
2.2 TRAPIANTO DI RENE ... 14 2.3 DIALISI ... 14 2.3.1 Dialisi peritoneale ... 16 2.3.2 Emodialisi standard ... 17 2.3.3 Emofiltrazione ... 18 2.3.4 Emodiafiltrazione ... 19
2.4 COMPLICANZE DELLA TERAPIA DIALITICA ... 19
3. INSORGENZA DELL’IPOTENSIONE INTRADIALITICA: STATO DELL’ARTE ... 21
3.1 DEFINIZIONE DI IPOTENSIONE INTRADIALITICA E MECCANISMO DI INSORGENZA ... 21
3.2 VARIABILI CORRELATE A IDH ... 24
3.2.1 Variabili di uso clinico ... 24
3.2.2 Variabili elettrocardiografiche ... 30
3.2.3 Variabili fotopletismografiche ... 34
3.3 INDICI PREDITTORI DI IDH ... 37
4. MATERIALI E METODI ... 39
4.1 PROGETTO DIALYSIS–INTERREG ... 39
4.2 PROTOCOLLO DI ACQUISIZIONE DEI DATI ... 40
4.3 ANALISI DEI DATI ... 43
4.4 ANALISI STATISTICA DESCRITTIVA ... 45
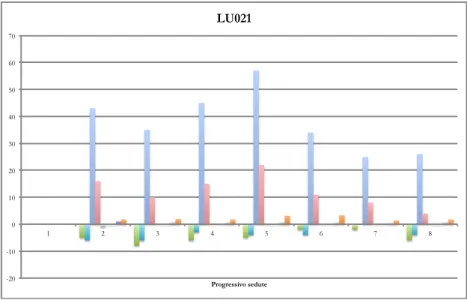
4.5 RAPPRESENTAZIONE GRAFICA DEI RISULTATI ... 48
4.6 DEFINIZIONE DEI NUOVI INDICI ... 52
5. RISULTATI ... 57
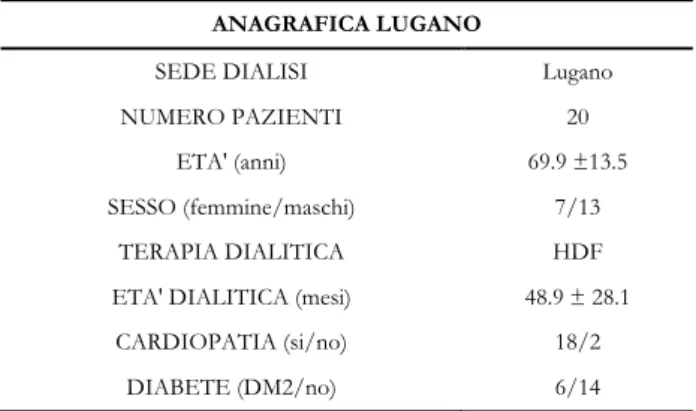
5.1 DATI ACQUISITI A LUGANO ... 57
5.2 DATI ACQUISITI A LECCO ... 83
5.3 INDICI ... 107
5.3.1 Indici di letteratura ... 107
5.3.2 Nuovi indici di propensione a IDH ... 111
6. DISCUSSIONE DEI RISULTATI ... 117
6.1 ANALISI STATISTICA DESCRITTIVA ... 117
6.2 INDICI DI LETTERATURA ... 119
IV
7. CONCLUSIONI E SVILUPPI FUTURI ... 122
BIBLIOGRAFIA ... 123
APPENDICE A ... 128
A1)PAZIENTI DI LUGANO ... 129
A2)PAZIENTI DI LECCO ... 136
APPENDICE B ... 153
B1)VALORI PREDIALISI DI LUGANO ... 154
B2)VALORI PREDIALISI DI LECCO ... 163
APPENDICE C ... 172
C1)VALORI PREDIALISI DI LUGANO ... 172
C2)VALORI PREDIALISI DI LECCO ... 178
APPENDICE D ... 188
D1)PAZIENTI DI LUGANO ... 189
D2)PAZIENTI DI LECCO ... 196
APPENDICE E ... 213
E1)VALORI PREDIALISI DI LUGANO ... 214
VI
Sommario
L’ipotensione intradialitica (IDH) è una delle complicanze a breve termine più rilevanti dell’emodialisi, che si verifica in circa il 25-30% delle sedute.
Le cause dell’insorgenza dell’ipotensione nei pazienti in dialisi sono molteplici e legate a fattori di diversa natura, alcuni dipendenti dal paziente (patologie vascolari e cardiache, neuropatie, anemia), altri più strettamente dipendenti dal trattamento (temperatura del dializzato, concentrazione di sodio, composizione del tampone, tasso di ultrafiltrazione, tasso di riempimento plasmatico, tipo di membrana, tipo di alimentazione e idratazione, cambiamenti di posizione durante la dialisi).
Le conseguenze a breve termine dell’ipotensione sono malessere generale del paziente, nausea, vomito e svenimenti. L’insorgenza di IDH spesso comporta l’interruzione prematura della sessione di dialisi, determinando una conseguente inadeguata depurazione del sangue del paziente al termine del trattamento. A lungo termine, inoltre, frequenti episodi di IDH possono causare danni permanenti al cuore e all’intestino, oltre al rischio di occlusione della fistola arterovenosa (1).
Il trattamento clinico della IDH prevede la riduzione del flusso ematico del circuito extracorporeo, la riduzione del tasso di ultrafiltrazione e l’aumento della volemia tramite somministrazione di liquidi, eventualmente con infusione di una soluzione ipertonica che faciliti il passaggio osmotico di fluido dal compartimento extravascolare a quello intravascolare (2). Queste azioni sono necessarie quando i sintomi sono già manifesti, ma sarebbe auspicabile prevenire gli episodi ipotensivi, piuttosto che correggerli. Il principale ostacolo al raggiungimento di tale obiettivo è il fatto che l’insorgenza di IDH non è sempre osservabile attraverso segni esterni, poiché alcuni pazienti non mostrano sintomi precursori.
Questo lavoro di tesi si inserisce nel contesto del Progetto DialysIS (Dialysis therapy between Italy
and Switzerland) durante la fase di sviluppo di un modello computazionale che descriva le
reazioni al trattamento di ogni paziente e definisca la terapia più efficace e personalizzata. In particolare, nucleo di questa indagine è la definizione di indici che permettano di prevedere ad inizio trattamento la probabilità che si verifichino eventi ipotensivi durante dialisi.
Il lavoro esposto consiste in uno studio osservazionale retrospettivo sui dati riguardanti 70 pazienti, di cui 50 arruolati nell’Azienda Ospedaliera di Lecco e 20 nell’Ente Ospedaliero di Lugano.
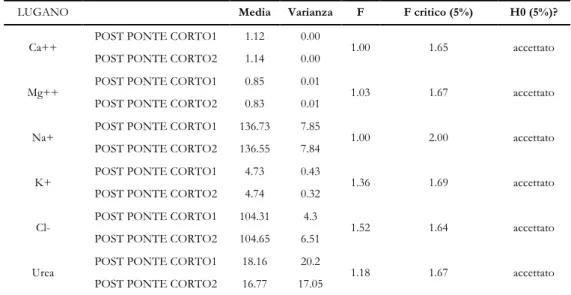
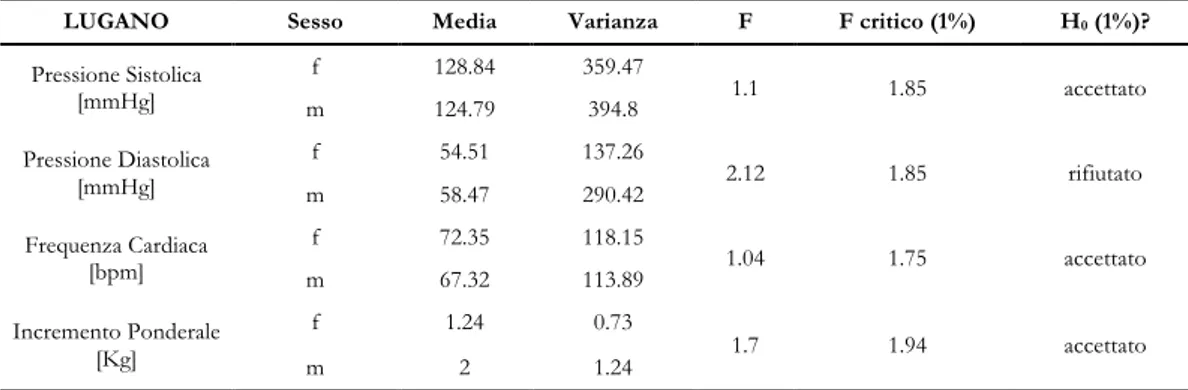
La prima fase del lavoro è stata scandita dall’acquisizione e dalla classificazione dei dati registrati nei reparti di nefrologia dell’Ente Ospedaliero Cantonale di Lugano e dell’Azienda Ospedaliera di Lecco. Con specifico riferimento alla condizione predialisi, i parametri presi in considerazione sono stati la concentrazione dei principali elettroliti nel sangue (Ca2+ [mmol/l], Mg2+ [mmol/l], Na+ [mmol/l], K+ [mmol/l], Cl- [mmol/l]), il livello di urea [mmol/l], la pressione arteriosa [mmHg] e la frequenza cardiaca [bpm].
In un secondo momento la popolazione è stata suddivisa in sottogruppi in base a sesso, terapia dialitica, età dialitica, cardiopatia, diabete e propensione all’ipotensione allo scopo di indagare nel dettaglio l’influenza di determinati fattori sulla condizione di presentazione del paziente alla seduta dialitica.
In seguito, ci si è concentrati sullo studio della condizione predialisi con riferimento al periodo inter trattamento. Studiando i valori di pressione, frequenza cardiaca e composizione ematica come differenza tra l’inizio di una seduta dialitica e la fine della precedente, si sono indagati quali dei meccanismi di compensazione della mancanza di funzionalità renale intervengano durante il periodo interdialitico.
Dopo aver raccolto e descritto tutti i dati predialisi dei pazienti arruolati nello studio, si è passati alla valutazione degli indici di letteratura, in particolare di HI (hydration index) e alla definizione di nuovi indici che, come combinazione di parametri ritenuti particolarmente influenti, siano in grado di fornire un allarme di possibile ipotensione alla luce della condizione con cui il paziente si presenta al trattamento.
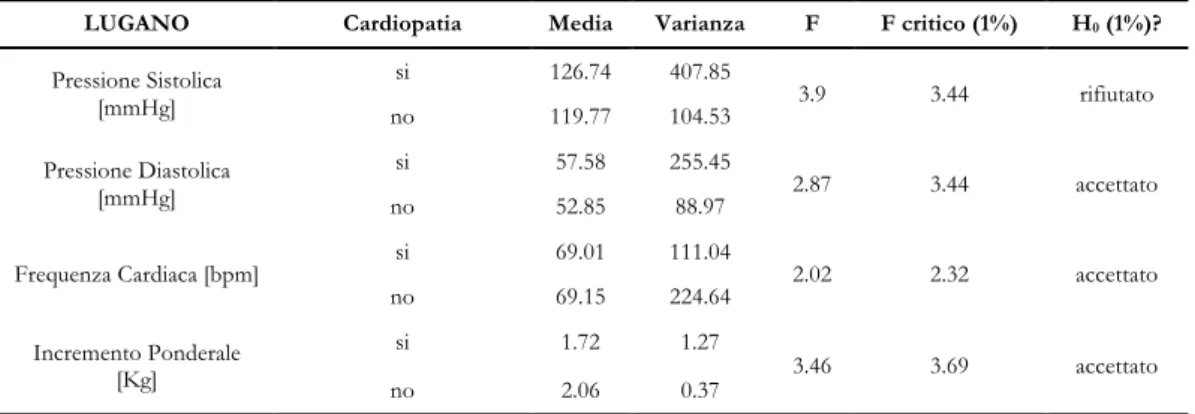
Per la scelta dei parametri da considerare nella definizione di questi indicatori è stata posta l’attenzione sui fattori che sono risultati significativamente differenti tra pazienti propensi a ipotensione e pazienti resistenti, cioè la concentrazione del potassio, la pressione sistolica, la pressione diastolica, la frequenza cardiaca e il peso del paziente.
La formulazione degli indici è stata fatta assegnando un peso a ogni evento riconosciuto come fattore di rischio per l’insorgenza di IDH e moltiplicando ogni parametro per il coefficiente ponderato corrispondente, al fine di rendere il calcolo paziente-dipendente.
VIII
Per testare l’efficacia degli indicatori è stato definito un valore oltre il quale il sistema automatico collegato alla macchina di dialisi dovrebbe fornire un allarme ed è stato confrontato il numero di allarmi con il numero di ipotensioni verificatesi.
Nella fase di definizione degli indici, i due gruppi di dati provenienti dai due centri sono stati mantenuti separati; questo ha permesso di definire i coefficienti sulla base delle informazioni fornite dal centro di Lecco e poi testare i risultati anche sul gruppo di Lugano.
Complessivamente, i risultati ottenuti sono soddisfacenti; in particolare, l’indicatore J4 ha permesso di prevedere la totalità dei casi di IDH sintomatica che si sono effettivamente manifestati durante le sedute di cui si avevano dati sufficienti per l’elaborazione dell’indice. Sono stati identificati casi falso – negativi; si tratta di situazioni in cui l’indicatore di propensione J avrebbe fornito un allarme (basandosi sulla condizione predialisi del paziente distante dalla sua normalità, con scostamenti in direzione dell’evento ipotensivo, oppure sulla condizione predialisi stabile rispetto alla norma ma con elevata propensione del soggetto a sviluppare IDH) ma in cui non si sono verificati fenomeni ipotensivi, molto probabilmente grazie alla cura del personale medico che è intervenuto prima che incorressero complicazioni.
Abstract
Intradialytic hypotension (IDH) is one of the main short – term hemodialysis complications, occuring in 25-30% of cases .
The causes of hypotension onsetting in patients undergoing dialysis treatments are various and due to different factors: some were found to be more related to the patient status (vascular and cardiac diseases, neuropathy, anemia), others to the treatment itself (temperature of the dialysate, sodium concentration, buffer composition, ultrafitration rate, plasma refilling rate, type of membrane, type of nutrition and hydration, changes in the posture during dialysis). Hypotension short term consequences are general unease - attributable to fatigue -, nausea and faint. IDH onsetting frequently implies a premature interruption of dialysis section, causing a resulting inadequate purification of the patient’s blood.
In the long term, moreover, frequent episodes of IDH may cause permanet damages to the heart and intestine, in addition to the occlusion of the arterovenous fistula (1).
IDH clinic treatment requires a reduction in the hematic flow, a reduction in the ultrafiltration rate and an increase in volemy through administration of liquids, and, eventually, an infusion of hypertonic solution to facilitate the osmotic flow from extravascular to intravascular compartment (2).
These manoeuvres are essential when symptoms have occurred already; however, preventing hypotension episodes is more desirable than corretting them. The main obstacle faced in preventing IDH relies in the fact that not all patients show forerunner symptoms.
This thesis workpaper is part of the DialysIS (Dialysis therapy between Italy and Switzerland) Project which aims to the development of a computational model able to describe each patient’s reaction to the treatment and to define the more efficacious and personalized therapy possible. Specifically, the aim of this study is the definition of indexes capable to foresee, at the beginning of the treatment, the possibility that IDH occurs during the dialysis.
This paper consists in an observational retrospective research on data regarding 70 patients, of which 50 are enrolled in Azienda Ospedaliera “A. Manzoni”, Lecco, and 20 in Ente Ospedaliero Cantonale, Lugano.
X
The first phase consisted in the acquisition and classification of data recorded in the Nephrology Division of the two Dialysis Centres. Regarding the predialysis conditions, the parameters taken into consideration are: blood concentration of the main electrolytes (Ca2+ [mmol/l], Mg2+ [mmol/l], Na+ [mmol/l], K+ [mmol/l], Cl- [mmol/l], urea [mmol/l],), arterious pressure and heart rate.
Secondly, the population has been divided into groups according to gender, dialytic therapy, dialytic age, cardiopathy, diabetes and proneness to hypotension, in order to evaluate these factors’ influence on predialytic conditions.
Later on, focus has been put on the interdialytic period: the values of pressure, heart rate and hematic composition have been calculated as the difference between the end of a session and the begining of the next one.
At this point an application of indexes coming from academic literature (hydration index, HI) has been conducted. Subsequently, new indexes capable of detecting IDH onsetting risk have been defined as a combination of parameters significantly different between HP (hypotension prone) and HR (hypotension resistant) patients. Those parameters are: potassium concentration, systolic and dyastolic pressure, heart rate and weight.
These new indexes have been defined by assigning different weights to each event seen as a potential risk factor for IDH onsetting, and multiplying each parameter for the corresponding weighted coefficient, to have them patient-dependent.
To test the indicators’ efficacy a threshold has been set so that the dyalisis machine could alarm whenever an IDH potential event was about to occur, and the number of alarms has been compared to the number of actual IDH events.
The indexes definition phase has been based on data coming from Lecco. In a second moment hte indicators have been applied on data coming from Lugano.
Overall, the analysis results were satisfying, and particularly index J4 allowed to predict the entirety of sympthomatic IDH cases.
Cases of faulse – positive have occurred. Those are situations in which the indicator J would have set the alarm on (either because of far initial conditions of the patient from his/her normality, or stable conditions but individual proneness to IDH) but they have actually presented no IDH events during the session, most likely thanks to the clinicians awareness.
Introduzione
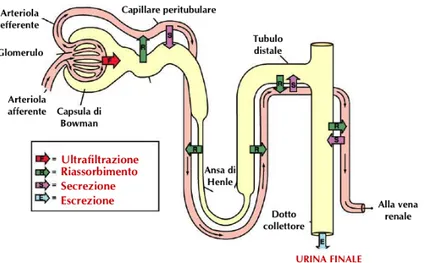
I reni sono organi parenchimatosi escretori che, insieme alle vie urinarie, costituiscono l’apparato urinario deputato alla depurazione del sangue dai prodotti di scarto del metabolismo e alla loro espulsione. All’interno dei reni scorre tutta la portata di sangue circolante nell’organismo e in questa sede il sangue perde cataboliti solidi (prodotti azotati della sintesi proteica) e liquidi (acqua derivante dalla reazione fondamentale di glucosio e ossigeno) che devono essere eliminati affinchè l’accumulo eccessivo di tossine uremiche non porti a squilibri elettrolitici dannosi per l’organismo (3). Le principali funzioni svolte dai reni attraverso le loro unità funzionali, cioè i nefroni, sono la regolazione della volemia extracellulare, della pressione arteriosa, della osmolarità dei liquidi corporei e dell'equilibrio acido base e la produzione di ormoni fondamentali per il controllo pressorio, la produzione di globuli rossi e il bilancio calcico (4) (5). Il meccanismo di depurazione del plasma si articola in tre fasi: ultrafiltrazione di una grossa percentuale di plasma attraverso la membrana glomerulare, riassorbimento di sostanze utili come acqua ed elettroliti nel plasma dei capillari peritubulari ed eliminazione di sostanze di rifiuto attraverso secrezione dal plasma nel liquido tubulare. L’urina che si forma è quindi costituita principalmente da sostanze filtrate ma anche da piccole quantità di sostanze secrete.
Poiché i reni non possono rigenerare nefroni, in caso di danno o malattia renale e in seguito all’invecchiamento, il numero di questi diminuisce gradualmente. Quando la funzione renale è compromessa e i reni non sono più in grado di trattenere gli elettroliti o di mantenere il livello di sostanze nocive nel sangue entro una soglia limite, insorge l'insufficienza renale, una patologia che può essere acuta (IRA) se la compromissione parziale o totale avviene improvvisamente (nel volgere di ore o giorni, dovuta ad esempio ad avvelenamento, risolvibile in un simile lasso di tempo) o cronica (IRC) se il danno si instaura progressivamente ed irreversibilmente nel corso degli anni. L’IRC diventa critica quando il numero di nefroni regolarmente funzionanti si riduce del 70%. La patologia cronica nel suo stadio finale è identificata dalla sigla inglese ESRD (End-Stage Renal Disease) ed è caratterizzata da una condizione nella quale la funzionalità renale è ridotta a meno del 10%, ragione per cui si rendono necessari la terapia dialitica e/o il trapianto di reni.
Il trattamento dialitico è una tecnica che sostituisce la funzione renale, cioè uno strumento di depurazione ematica che consente di eliminare le sostanze tossiche che si accumulano nell’organismo in corso di insufficienza renale, cedendole ad un liquido, la soluzione di dialisi, a contenuto elettrolitico analogo a quello del plasma normale in cui tali sostanze non sono presenti (3) (6). Esistono due tipi di assistenza renale dialitica che dipendono fortemente dal profilo del paziente uremico: la dialisi peritoneale e l’emodialisi; entrambe le tecniche sfruttano particolari membrane semipermeabili, cioè membrane permeabili all’acqua e selettivamente permeabili ai soluti disciolti, che permettono il passaggio di liquidi e soluti per diffusione e convezione, in funzione delle differenze di pressione idrostatica, pressione oncotica e pressione osmotica ai due capi della membrana stessa.
Nonostante i notevoli progressi tecnologici che hanno migliorato la sicurezza del trattamento dialitico, l’intervento non è mai privo di rischio. L’ipotensione intradialitica (IDH) è una delle complicanze a breve termine più rilevanti dell’emodialisi, che si verifica in circa il 25-30% delle sedute (7). Sono state proposte numerose definizioni di IDH, tra cui quella che riconosce come ipotensione ogni riduzione di pressione arteriosa sistolica (SAP) del 20% (8), ma la più accreditata in letteratura prevede la considerazione di tre criteri: i) se la SAP predialisi è maggiore di 100 mmHg, per IDH si intende ogni episodio con SAP minore di 90 mmHg, anche senza disturbi; ii) se la SAP predialisi è minore di 100 mmHg, ci si riferisce ad IDH per ogni riduzione di SAP di almeno il 10% del valore iniziale associata a sintomi; iii) IDH è ogni riduzione di SAP del 25% o più rispetto al valore predialisi, con i tipici sintomi richiedenti specifici interventi (crampi, nausea, vomito) (9).
Le cause dell’insorgenza dell’ipotensione nei pazienti in dialisi sono molteplici e legate a fattori di diversa natura. Alcuni elementi sono dipendenti dal paziente (patologie vascolari e cardiache, neuropatie, anemia), altri fattori sono più strettamente dipendenti dal trattamento (temperatura del dializzato, concentrazione di sodio, composizione del tampone, tasso di ultrafiltrazione, tasso di riempimento plasmatico, tipo di membrana, tipo di alimentazione e idratazione, cambiamenti di posizione durante la dialisi). Fra le cause non autonomiche di IDH, la riduzione di liquido ematico (ipovolemia) dovuta ad uno sbilanciamento tra il tasso di ultrafiltrazione (ultrafiltration rate, UFR) e il tasso di riempimento plasmatico (plasma refilling rate, PRR) è la principale.
Le conseguenze a breve termine dell’ipotensione sono malessere generale del paziente, riconducibile ad affaticamento, nausea, vomito e svenimenti. L’insorgenza di IDH spesso
Introduzione
3
comporta l’interruzione prematura della sessione di dialisi, determinando una conseguente inadeguata depurazione del sangue del paziente al termine del trattamento. A lungo termine, inoltre, frequenti episodi di IDH possono causare danni permanenti al cuore e all’intestino, oltre al rischio di occlusione della fistola arterovenosa (1).
In molti ospedali l’ipotensione è trattata a livello clinico con posizionamento del paziente nella posizione di Trendelenburg, ovvero corpo in posizione supina con i piedi più in alto della testa (10). In generale la procedura prevede la riduzione del flusso ematico del circuito extracorporeo, la riduzione del tasso di ultrafiltrazione e l’aumento della volemia tramite somministrazione di liquidi. Una soluzione alternativa è l’infusione di una soluzione ipertonica che faciliti il passaggio osmotico di fluido dal compartimento extravascolare a quello intravascolare e, quindi, permetta di aumentare il volume di sangue e la pressione sanguigna (2). Queste azioni sono necessarie quando i sintomi sono già manifesti, ma sarebbe auspicabile prevenire gli episodi ipotensivi, piuttosto che correggerli. Il principale ostacolo al raggiungimento di questo obiettivo è il fatto che l’insorgenza di IDH non è sempre osservabile attraverso segni esterni, poiché alcuni pazienti non mostrano sintomi precursori.
Le variabili correlate all’ipotensione sono molteplici e tra esse hanno un ruolo particolare la pressione ematica, la temperatura del sangue, il volume di sangue relativo (relative blood volume, RBV), la bioimpedenza e le variabili elettrocardiografiche (ECG) e fotopletismografiche (PPG). Inoltre, le variabili cardiovascolari che riflettono la variabilità della frequenza cardiaca, la turbolenza della frequenza cardiaca e la sensibilità baroriflessa sono importanti per studiare con controllo in feedback i sistemi di emodialisi, in modo da migliorare le loro performance (11).
La prevenzione della IDH è stata oggetto, negli ultimi anni, di indagine da parte di molti studiosi che hanno evidenziato la necessità di una migliore valutazione del peso secco del paziente, di una corretta regolazione della temperatura del dialisato, di un particolare profilo della concentrazione di sodio nel dialisato (dialysate sodium concentration, DSC) e del monitoraggio online del volume ematico (blood volume, BV). Una delle sfide aperte è quella di determinare, prima della sessione di emodialisi, la probabilità che il paziente soffrirà di ipotensione intradialitica o meno (offline prediction).
Alla luce di quanto indagato in letteratura, con gli elementi forniti nei colloqui con i medici delle Strutture Ospedaliere coinvolte e con i dati messi a disposizione dalle stesse, in questo lavoro di tesi si vuole definire un indice che, come combinazione dei parametri ritenuti più
influenti, permetta di individuare una condizione critica del paziente all’inizio della seduta dialitica che potrebbe indurre ipotensione durante il trattamento.
Volendo focalizzare l’attenzione sulla condizione predialisi, una grande porzione di fattori predittivi della IDH riconosciuti in letteratura, cioè quelli tempo – dipendenti, è stata esclusa. Inoltre, tutte le variabili collegate a IDH rilevabili in modo continuo tramite ECG o PPG non sono state prese in considerazione poiché non disponibili nella maggior parte dei Centri Dialisi.
Questo lavoro di tesi si inserisce nel contesto del Progetto DialysIS durante la fase di sviluppo di un modello computazionale che descriva le reazioni al trattamento di ogni paziente e definisca la terapia più efficace e personalizzata. In particolare, nucleo di questa indagine è la definizione di indici che permettano di prevedere ad inizio trattamento la probabilità che si verifichino eventi ipotensivi durante dialisi. Il lavoro esposto consiste in uno studio osservazionale retrospettivo sui dati riguardanti 70 pazienti, di cui 50 arruolati nell’Azienda Ospedaliera di Lecco e 20 nell’Ente Ospedaliero di Lugano.
Il capitolo 1 è dedicato ad una breve descrizione dell’anatomia e della fisiologia renale, seguita da una presentazione delle principali e più diffuse patologie, quali l’insufficienza renale acuta e l’insufficienza renale cronica.
Nel capitolo 2 sono descritte le tipologie di terapia dialitica più frequentemente utilizzate per sostituire la funzione renale in caso di insufficienza renale cronica, cioè dialisi peritoneale, emodialisi standard, emofiltrazione ed emodiafiltrazione.
Il capitolo 3 affronta il concetto di ipotensione intradialitica come principale complicanza del trattamento dialitico; ne sono delineate cause, conseguenze e azioni correttive. In esso è brevemente descritto lo stato dell’arte dei metodi di prevenzione di IDH indagati in letteratura.
Nel capitolo 4 sono descritti i materiali e i metodi utilizzati per raggiungere gli obiettivi prestabiliti per questo lavoro di tesi, le tecniche di acquisizione e di analisi utilizzate per il trattamento dei dati acquisiti durante il progetto DialysIS, i metodi statistici, le scelte di rappresentazione e la tecnica di definizione degli indici di previsione di IDH.
Il capitolo 5 contiene l’esposizione di tutti i risultati ottenuti. Nella parte iniziale sono presentati i risultati che riguardano i dati acquisiti presso il centro di Lugano, seguono i risultati ottenuti dalle analisi effettuate sui dati riguardanti la popolazione di Lecco e il
Introduzione
5
confronto tra i due gruppi di pazienti. L’ultima parte del capitolo descrive i risultati ottenuti utilizzando i nuovi indici definiti per la previsione di ipotensione intradialitica applicati prima alla popolazione di Lecco, poi a quella di Lugano.
Nel capitolo 6 sono stati discussi i risultati presentati nel capitolo 5; nel capitolo 7 si riportano le conclusioni del lavoro, gli obiettivi raggiunti e i possibili sviluppi futuri.
Nelle appendici sono riportati i grafici stilati durante il corso delle analisi statistiche: condizione predialisi pura di ogni paziente (A), distribuzione delle variabili pure in tutta la popolazione (B), distinzione dei dati in sottocategorie (C), condizione predialisi con riferimento al periodo inter – dialitico di ogni paziente (D) e distribuzione degli incrementi dei parametri nel periodo intra – dialitico (E).
1. Anatomia, fisiologia e patologia del rene
In questo capitolo saranno brevemente descritte l’anatomia funzionale del rene e le principali patologie renali, quali l’insufficienza renale acuta e l’insufficienza renale cronica.1.1 Anatomia del rene
I reni sono organi parenchimatosi escretori che, insieme alle vie urinarie, costituiscono l’apparato urinario deputato alla depurazione del sangue dai prodotti di scarto del metabolismo e alla loro espulsione.
I due reni presenti nel corpo umano sono organi simmetrici, di forma ovoidale, posizionati nella parte posteriore dell’addome, all’esterno della cavità peritoneale. Nell’adulto ciascun rene pesa circa 150 g, ha una lunghezza media di 12 cm, una larghezza media di 6.5 cm e uno spessore medio di 3 cm.
Ogni rene presenta nella parte mediana una rientranza detta ilo in cui si inseriscono arteria e vena renali, vasi linfatici, nervi e ureteri. L’ilo immette nel seno renale, una cavità appiattita con vasi, nervi e tessuto adiposo, circondata da parenchima renale; nell’ilo l’uretere si espande per formare la pelvi renale. Ciascun rene è rivestito da una capsula fibrosa (3) (12).
Anatomia, fisiologia e patologia del rene
7
In sezione sagittale (Figura 1.1) si riconoscono due porzioni distinte che costituiscono il rene: una parte più periferica detta corticale e una più interna che prende il nome di midollare. Tali regioni contengono i nefroni, cioè le unità funzionali del rene, i vasi sanguigni, i vasi linfatici e i nervi.
Il rene dell’uomo ha un’organizzazione lobulare; ciascuno dei 6 - 8 lobi consiste in una massa di tessuto midollare di forma conica detta piramide renale, che origina dalla giunzione corticomidollare ed è rivestita da una porzione di tessuto corticale. L’apice della piramide forma una papilla renale che si proietta nello spazio della pelvi renale, il tratto terminale superiore dell’uretere a forma di imbuto. La parte esterna della pelvi è suddivisa in sacche aperte chiamate grandi calici, ciascuno dei quali si divide ulteriormente in piccoli calici in cui si raccoglie l’urina proveniente dai tubuli delle papille; il grande calice confluisce poi nell’uretere. Le pareti dei calici, della pelvi e dell’uretere contengono strutture lisce contrattili che convogliano l’urina prodotta dal rene verso la vescica, dove si raccoglie fino allo svuotamento di questa grazie al riflesso della minzione.
Nell’uomo ogni rene è costituito da circa un milione di nefroni che rappresentano l’unità anatomo - funzionale fondamentale (Figura 1.2). Ogni nefrone è costituito da due strutture principali: il glomerulo che filtra il sangue sotto la spinta della pressione arteriosa e il tubulo nel quale il liquido filtrato dal glomerulo viene in parte riassorbito e in parte trasformato in urina dopo il convogliamento negli ureteri.
Il glomerulo è costituito da una fitta rete di capillari ramificati che si fondono per anastomosi, caratterizzati da una pressione idrostatica elevata (circa 60 mmHg). I capillari glomerulari sono rivestiti da cellule epiteliali e l’intero glomerulo è avvolto da un involucro che prende il nome di capsula di Bowman. Il liquido filtrato dai capillari glomerulari fluisce nella capsula di Bowman e da lì nel tubulo prossimale, la porzione più vicina al glomerulo, localizzata nella parte corticale del rene. Il tubulo prossimale si suddivide in tubulo contorto prossimale e porzione rettilinea del tubulo
prossimale, che si dirige verso la parte midollare, abbandonando la superficie dell’organo. Dal
tubulo prossimale il liquido fluisce nell’ansa di Henle, situata nella zona midollare, in cui avvengono il riassorbimento di sostanze utili e la secrezione di cataboliti. Ogni ansa è formata dalla porzione rettilinea del tubulo prossimale e dalle branche ascendente e discendente. Le pareti della branca ascendente costituiscono la porzione sottile dell’ansa di Henle; nel tratto della branca ascendente che ritorna verso la corteccia lo spessore delle pareti aumenta e questo tratto è detto porzione spessa dell’ansa di Henle.
Il liquido filtrato scorre in seguito nel tubulo distale situato nella corticale renale; tutti i tubuli distali confluiscono nel tubulo collettore e, in corrispondenza della midollare, formano il dotto
collettore. Infine, il fluido è convogliato nella pelvi renale attraverso le papille.
Figura 1.2 Dettagli anatomici del rene e struttura del nefrone.
Sebbene tutti i nefroni siano costituiti dagli elementi descritti, essi presentano delle peculiari caratteristiche in dipendenza dalla posizione occupata nell’organo, in particolare dalla distanza dalla corticale:
• i nefroni i cui glomeruli sono situati nella corticale esterna sono chiamati nefroni corticali e presentano anse di Henle che entrano solo per un breve tratto della midollare;
Anatomia, fisiologia e patologia del rene
9
• i nefroni juxtamidollari, i cui glomeruli sono localizzati nella zona della corteccia più vicina alla midollare, costituiscono circa il 20-30% dell’intera popolazione di nefroni e presentano lunghe anse di Henle che si inseriscono in profondità nella midollare, una lunga ansa sottile con ben evidenti porzioni discendenti ed ascendenti, un glomerulo più grosso ed una diversa vascolarizzazione dei tubuli rispetto ai nefroni corticali.
1.2 Fisiologia del rene
All’interno dei reni scorre tutta la portata di sangue circolante nell’organismo e in questa sede il sangue perde cataboliti solidi (prodotti azotati della sintesi proteica) e liquidi (acqua derivante dalla reazione fondamentale di glucosio e ossigeno). Questi cataboliti devono essere eliminati affinchè l’accumulo eccessivo di tossine uremiche non determini squilibri elettrolitici dannosi per l’organismo. Di conseguenza, la principale funzione di ogni nefrone è la depurazione del plasma dalle sostanze di scarto provenienti dai meccanismi metabolici (urea, creatinina, acido urico e urati) e dagli eccessi di sostanze, quali ioni sodio, ioni potassio, ioni idrogeno e cloruri, che tendono ad accumularsi nell’organismo. I reni devono assicurare, per mezzo delle loro unità funzionali, una costante depurazione di 150 - 170 litri di sangue al giorno.
E’ possibile riassumere le principali funzioni svolte dai reni come segue (4) (5):
• regolazione della volemia extracellulare e della pressione arteriosa, attraverso la cooperazione tra apparato urinario ed apparato cardiovascolare, per garantire un’adeguata perfusione del cervello e degli altri organi vitali;
• regolazione della osmolarità dei liquidi corporei mediante meccanismi di recupero ed eliminazione di acqua e soluti, con conseguente escrezione di urina che, a seconda delle esigenze dell'equilibrio idrico ed elettrolitico, può essere in concentrazione ipertonica, isotonica o ipotonica;
• regolazione dell’equilibrio idro – elettrolitico mediante integrazione tra processi di filtrazione, riassorbimento, secrezione ed escrezione a livello del nefrone che, bilanciando l’apporto dietetico con la perdita renale, mantengano le concentrazioni di particolari elementi (sodio Na+, potassio K+, cloro Cl-, bicarbonato HCO
3-, fosfato PO43-, calcio Ca2+, glucosio, aminoacidi, acido urico, urea, creatinina, ormoni) e di sostanze esogene (farmaci, additivi alimentari) entro intervalli di valori accettabili;
• regolazione dell'equilibrio acido – base per il controllo del pH ematico tramite riassorbimento di HCO3- e secrezione di H+ in caso di liquido extracellulare troppo acido e rimozione di ioni bicarbonato e trattenimento di ioni idrogeno quando il liquido extracellulare diviene troppo basico;
• produzione di ormoni come renina, eritropoietina e prostaglandine che hanno ruoli fondamentali rispettivamente nel controllo pressorio, nella produzione dei globuli rossi e nella conversione della vitamina D3 in un ormone che regola il bilancio calcico. Il meccanismo di depurazione del plasma si articola in tre fasi: una grossa percentuale di plasma è ultrafiltrata attraverso la membrana glomerulare nell’apparato glomerulare del nefrone e, mentre il filtrato scorre lungo i tubuli, le sostanze utili come acqua ed elettroliti sono riassorbite di nuovo nel plasma dai capillari peritubulari, mentre le sostanze di rifiuto restano nel lume tubulare. Infine, l’eliminazione dei prodotti di scarto consiste nel processo di secrezione di sostanze dal plasma direttamente nel liquido tubulare attraverso le cellule epiteliali dei tubuli. L’urina che si forma è quindi costituita principalmente da sostanze filtrate ma anche da piccole quantità di sostanze secrete (Figura 1.3).
Figura 1.3 Meccanismo di depurazione del plasma attraverso ultrafiltrazione glomerulare, riassorbimento capillare e secrezione tubulare.
Poiché i reni non possono rigenerare nefroni, in caso di danno o malattia renale e in seguito all’invecchiamento, il numero di questi diminuisce gradualmente. Dopo i 40 anni di età il numero di nefroni funzionali si riduce di circa il 10% ogni dieci anni. Questa perdita non è però incompatibile con la sopravvivenza poiché alcuni meccanismi di adattamento consentono ai nefroni restanti di eliminare le quantità appropriate di acqua, elettroliti e scorie.
Anatomia, fisiologia e patologia del rene
11
1.3 Patologie renali
Le malattie renali sono classificate secondo la sede del danno e le cause che le hanno provocate. Le glomerulonefriti colpiscono i glomeruli e possono essere causate da processi immunologici o da fenomeni genetici; le tubulopatie e le nefropatie tubulo – interstiziali interessano i tubuli in seguito a infezioni, ostruzioni delle vie urinarie e uso inappropriato di farmaci; le
patologie ereditarie comprendono malformazioni congenite dei reni o delle vie urinarie, come il
rene policistico.
Quando la funzione renale è compromessa e i reni non sono più in grado di trattenere gli elettroliti o di mantenere il livello di sostanze nocive nel sangue entro una soglia limite, insorge l'insufficienza renale, una patologia che può essere acuta (IRA) se la compromissione parziale o totale avviene improvvisamente (nel volgere di ore o giorni, dovuta ad esempio ad avvelenamento, risolvibile in un simile lasso di tempo) o cronica (IRC) se il danno si instaura progressivamente ed irreversibilmente nel corso degli anni.
1.3.1 Insufficienza renale acuta
L’insufficienza renale acuta si contraddistingue per la rapidità con cui avvengono la perdita di funzionalità dei reni e il conseguente aumento dei valori di creatinina e azotemia nel sangue che l’apparato urinario non è in grado di espellere (3).
L’organismo reagisce inizialmente agli ostacoli incontrati nella filtrazione del sangue producendo quantità maggiori di urina (poliuria), nonostante il livello di concentrazione resti sempre basso. A tale fase segue la condizione di oliguria in cui il liquido espulso tramite le vie urinarie è in quantità notevolmente inferiore ai livelli di normalità.
L’insufficienza renale acuta generalmente non passa inosservata perché, già nelle prime ore di insorgenza della stessa, al rapido squilibrio dei valori di laboratorio e alla variazione di quantità e concentrazioni di urina emesse corrispondono segni clinici preoccupanti, soprattutto per il loro celere peggioramento.
L’insufficienza renale acuta può essere classificata come prerenale, renale e postrenale. L’IRA prerenale può risultare da un ridotto afflusso di sangue ai reni conseguente a insufficienza cardiaca o forte emorragia. Con cause intrarenali si intendono alterazioni del rene a livello di vasi, glomeruli o tubuli in seguito alle quali sono necessarie cure dialitiche specifiche. La patologia postrenale, infine, può essere dovuta all’insorgenza di calcoli renali che ostruiscono il sistema di raccolta dell’urina.
Le cause prerenali e postrenali sono potenzialmente reversibili se diagnosticate e trattate precocemente; sono curabili anche alcune cause renali che provocano glomerulopatia e nefropatia tubulo-interstiziale acute, come l'ipertensione maligna, le glomerulonefriti, le vasculiti, le infezioni batteriche, le reazioni ai farmaci e le malattie metaboliche (ipercalcemia, iperuricemia).
In presenza di insufficienza renale acuta l’immediato effetto fisiologico è la ritenzione di fluidi, elettroliti e cataboliti con conseguenti ipertensione ed edema. In queste condizioni l’alterazione del livello di potassio può indurre aritmie e conseguente compromissione della funzionalità cardiaca. Nei casi più gravi di completa anuria, la mancanza di trattamento dialitico può condurre rapidamente al decesso.
1.3.2 Insufficienza renale cronica
In molte forme di malattia renale numerosi nefroni vengono distrutti o gravemente danneggiati e i rimanenti non riescono ad assicurare il normale funzionamento degli organi. Le possibili cause sono molteplici: tra le più diffuse si riconoscono la glomerulonefrite cronica, la pielonefrite e le vasculopatie (3) (13).
La glomerulonefrite cronica causa una lesione glomerulare simile a quella che occorre nella glomerulonefrite acuta. La precipitazione a livello della membrana glomerulare di complessi antigene – anticorpo porta ad infiammazione dei glomeruli e conseguente ispessimento della membrana glomerulare; negli stadi finali i glomeruli vengono sostituiti da tessuto fibroso compromettendo definitivamente la funzione dei nefroni coinvolti. La pielonefrite è un processo infiammatorio infettivo, causato da vari agenti microbici di origine intestinale, che provoca la distruzione di tubuli, glomeruli e altre strutture renali fondamentali per il funzionalmente degli organi. Vi sono poi differenti vasculopatie renali capaci di provocare ischemia renale e necrosi di tessuto renale. Le forme più comuni sono l’aterosclerosi delle grosse arterie renali, con progressivo restringimento sclerotico dei vasi, l’iperplasia fibromuscolare di una o più delle maggiori arterie renali, anch’essa capace di determinare occlusione dei vasi colpiti, e nefrosclerosi benigna, condizione molto comune causata da lesioni sclerotiche delle arterie minori e delle arteriole.
Le lesioni ateriosclerotiche o iperplastiche delle arterie più grandi colpiscono spesso un rene più dell’altro causando una riduzione della funzionalità di uno dei due reni (ipofunzione renale unilaterale). La nefrosclerosi benigna ha inizio con una fuoriuscita di plasma attraverso l’intima
Anatomia, fisiologia e patologia del rene
13
delle piccole arterie ed arteriole. Ciò provoca l’accumulo di materiale fibroso negli strati della parete di questi vasi, cui segue una progressiva invasione di tessuto fibroso che finisce col restringere il lume del vaso, in molti casi occludendolo completamente. Poiché non esiste circolazione collaterale tra le piccole arterie renali, la distruzione di una di esse comporta la necrosi di una corrispondente quantità di tessuto renale. Gran parte del tessuto renale è quindi sostituito da piccole aree di tessuto fibroso, i reni diventano molto più piccoli e progressivamente assumono un aspetto nodulare alla loro superficie. Tale processo si verifica in quasi tutte le persone di età avanzata, provocando una diminuzione della portata ematico - renale e quindi una riduzione della funzione escretoria.
I principali effetti causati da insufficienza renale cronica sono (14): • edema generalizzato conseguente a ritenzione di liquidi e sali;
• uremia, cioè aumento della concentrazione di composti azotati non proteici come urea, creatinina e acido urico, causata dalla mancata eliminazione dei residui proteici del metabolismo;
• acidosi dovuta a mancata eliminazione dei cataboliti acidi; • anemia provocata da ridotta secrezione di eritropoietina;
• osteomalacia in seguito a ridotta produzione di vitamina D e a ritenzione del fosfato. L’insufficienza renale cronica diventa critica quando il numero di nefroni regolarmente funzionanti si riduce del 70%. La patologia cronica nel suo stadio finale è identificata dalla sigla inglese ESRD (End-Stage Renal Disease) ed è caratterizzata da una condizione nella quale la funzionalità renale è ridotta a meno del 10%, ragione per cui si rendono necessari la terapia dialitica e/o il trapianto di reni.
2. Terapie dialitiche
In questo capitolo saranno descritte le tipologie di terapia dialitica più frequentemente utilizzate per sostituire la funzione renale in caso di insufficienza renale cronica, cioè dialisi peritoneale, emodialisi standard, emofiltrazione ed emodiafiltrazione.
2.1 Terapie sostitutive della funzionalità renale
Il paziente uremico generalmente non produce urina perché il rene non è in grado di filtrare adeguatamente il sangue, quindi i liquidi non espulsi si insinuano nei compartimenti ematico e interstiziale, portando ad edema, gonfiore, ipertensione, aumento di volemia e aumento del turgore dei tessuti. L’acqua presente nell’interstizio crea un sovraccarico della struttura vascolare e cardiaca, il punto di lavoro del cuore cambia rispetto al punto fisiologico perché aumentano notevolmente le resistenze pressorie, e il paziente spesso passa da una condizione di ipertensione a cardiopatia secondaria a patologia renale. Inoltre, l’accumulo di liquidi provoca diluizione del sangue con riduzione dell’ematocrito fino al 32 – 34%, perciò i pazienti devono essere trattati con eritropoietina per migliorare il trasporto di ossigeno che, data la carenza di globuli rossi, si riduce notevolmente.
Le terapie sostitutive della funzionalità renale sono il trapianto e la dialisi.
2.2 Trapianto di rene
Il trapianto renale è, in termini di efficacia, costi, qualità della vita e aspettativa di vita, la migliore tecnica terapeutica per un paziente uremico. L’intervento chirurgico prevede l’anastomosi dei vasi del rene del donatore ai vasi iliaci del ricevente e l’attacco dell’uretere del donatore alla vescica del ricevente. Il trapianto può essere effettuato prelevando l’organo da cadavere o da un donatore vivente; la seconda possibilità, oltre ad avere il vantaggio della programmabilità dell’operazione, offre migliori risultati in termini di sopravvivenza dell’organo trapiantato. Trattandosi di un trapianto d’organi, comunque, è necessario che il paziente riceva un’adeguata terapia immunosoppressiva per evitare il rigetto.
2.3 Dialisi
La dialisi è una terapia di assistenza renale destinata ai pazienti con insufficienza renale acuta e cronica nei quali la funzionalità renale residua è inferiore al 5 – 10%.
Terapie dialitiche
15
Il trattamento dialitico è una tecnica che sostituisce la funzione renale, cioè uno strumento di depurazione ematica che consente di eliminare sostanze tossiche che si accumulano nell’organismo in corso di insufficienza renale, cedendole ad un liquido a contenuto elettrolitico analogo a quello del plasma normale in cui tali sostanze non sono presenti. Tale liquido è chiamato liquido (o soluzione) di dialisi (3) (6).
Gli obiettivi principali della dialisi sono l’eliminazione di sostanze tossiche dal sangue del paziente, l’aggiunta di soluti fondamentali per l’omeostasi plasmatica e la rimozione di volumi fluidi tramite ultrafiltrazione.
Il principale fenomeno fisico alla base del funzionamento della dialisi è la diffusione, cioè lo scambio di materia che si realizza quando due soluzioni contenenti differenti concentrazioni di soluti sono poste a contatto fra loro per mezzo di una membrana semipermeabile. La caratteristica saliente di questa membrana è la presenza di pori microscopici che permettono il passaggio dell’acqua e delle sostanze a peso molecolare medio-basso in essa disciolte, ma non quello di sostanze a peso molecolare più alto. Per raggiungere l’obiettivo depurativo desiderato, il liquido di dialisi, posto a contatto con il sangue del paziente, contiene soluti con concentrazione stabilita e tale da consentire il riequilibrio delle sostanze di interesse nel sangue, arrivando ad opportune concentrazioni finali. Un altro meccanismo di scambio che permette di depurare efficacemente il sangue è la convezione che induce il passaggio di soluti da un compartimento all’altro secondo un gradiente di pressione idrostatica e che porta alla rimozione di volumi liquidi attraverso l’ultrafiltrazione.
Esistono due tipi di assistenza renale dialitica che dipendono fortemente dal profilo del paziente uremico: la dialisi peritoneale e l’emodialisi.
Usualmente la dialisi peritoneale è destinata a chi ha maggiori difficoltà di movimento, agli anziani e a tutti coloro ai quali l’emodialisi può provocare danni cardiopatici collaterali; tale trattamento è eseguito sfruttando la membrana peritoneale come elemento filtrante e inserendo una soluzione di pulizia all’interno del corpo. L’emodialisi è, invece, un trattamento in cui si instaura una piccola circolazione extracorporea all’interno della quale fluisce il sangue del paziente che deve essere purificato; è la terapia più diffusa, che risulta essere adeguata anche in caso di patologie acute come blocchi renali o avvelenamento.
Sia la dialisi peritoneale sia l’emodialisi sfruttano particolari membrane semipermeabili, cioè membrane permeabili all’acqua e selettivamente permeabili ai soluti disciolti, che permettono il passaggio di liquidi e soluti per diffusione e convezione, in funzione delle differenze di
pressione idrostatica, pressione oncotica e pressione osmotica ai due capi della membrana stessa.
2.3.1 Dialisi peritoneale
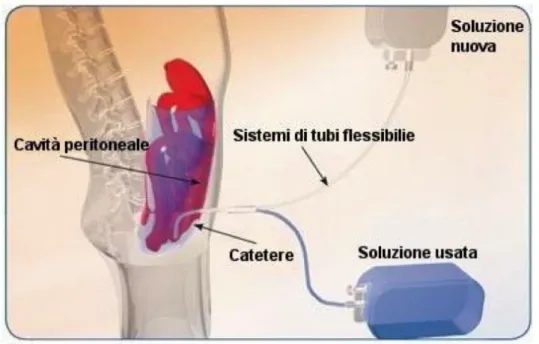
La dialisi peritoneale consiste nello scambio diffusivo di soluti tra i vasi del peritoneo e il fluido di dialisi in esso contenuto attraverso la membrana peritoneale, una membrana semipermeabile che ricopre la cavità addominale. Tale membrana, essendo una struttura vivente, ha il pregio di poter adattare perfusione e permeabilità vascolare del letto capillare peritoneale in risposta a fattori ormonali.
Tramite un catetere transdermico si riempie l’addome del paziente con liquido dializzante; lo scambio di acqua e soluti attraverso la membrana peritoneale è regolato dagli stessi principi validi per le membrane semipermeabili impiegate nella dialisi extracorporea (Figura 2.1).
Figura 2.1 Connessioni tra le due sacche utilizzate nella dialisi peritoneale (soluzione nuova e soluzione usata) e il paziente.
Il gradiente di concentrazione permette la diffusione passiva dei soluti tra acqua plasmatica e soluzione dializzante e il gradiente osmotico ottenuto aggiungendo glucosio alla soluzione consente il trasporto convettivo delle sostanze verso la cavità peritoneale. Infine, l’ultrafiltrazione dei liquidi in eccesso ha luogo grazie all’osmolarità del fluido di dialisi.
La dialisi peritoneale, che può essere intermittente o continua, si articola in quattro fasi: i) creazione di un accesso alla cavità peritoneale; ii) introduzione della soluzione di dialisi che
Terapie dialitiche
17
staziona per un periodo variabile (circa 30 minuti) durante il quale si realizzano gli scambi diffusivi; iii) drenaggio all’esterno della soluzione arricchita delle scorie metaboliche cedute dal sangue; iv) sostituzione con soluzione di dialisi fresca. Gli scambi sono ripetuti con una frequenza determinata dall’entità della rimozione di soluti e acqua necessaria, può quindi variare da paziente a paziente.
Il vantaggio principale di questa tecnica è l’indipendenza del paziente dai centri specializzati, mentre il principale limite è legato alla presenza del catetere che, oltre a creare disturbi psicologi e sociali per il paziente, può essere causa di gravi infezioni.
2.3.2 Emodialisi standard
L’emodialisi standard (hemodialysis, HD) è una tecnica di trattamento sostitutivo della funzionalità renale che utilizza un circuito di circolazione extracorporea costituito da tre sezioni principali: la via ematica, la linea che convoglia il liquido e il filtro di dialisi, come mostrato in Figura 2.2.
Figura 2.2 Circuito extracorporeo per emodialisi. Il sangue del paziente è prelevato dalla linea arteriosa, spinto da una pompa peristaltica, filtrato dal dializzatore e reinfuso nella linea venosa.
Il sangue del paziente, prelevato dalla linea arteriosa, è spinto da una pompa peristaltica attraverso tubi di materiale plastico, introdotto nel filtro di dialisi e poi reinfuso, una volta depurato, al paziente stesso nella linea venosa.
Capitolo I Anatomia funzionale e dialisi! !
!
16 !
1.3.2
È la tecnica più diffusa di trattamento sostitutivo
i pazienti con grave insufficienza renale, che sono obbligati a recarsi 3 volte a settimana presso i centri specializzati e a sottoporsi a trattamenti emodialitici per circa 4 h a seduta, dato che non esiste un vero e proprio rene artificiale completamente impiantabile. iene eseguita impiegando la circolazione extracorporea e consiste di tre componenti: la via ematica, il circuito che produce e convoglia il liquido di dialisi e il filtro di dialisi.
!
Figura 1.4: Circuito extracorporeo di emodialisi.
pompa peristaltica attraverso tubi di materiale plastico, verso il filtro di dialisi (linea arteriosa), per poi reinfonderlo, depurato, al paziente stesso (linea venosa). In emodialisi è i: il sangue deve poter raggiungere con una buona portata il filtro, che rappresenta il punto di depurazione, e poter quindi ritornare al paziente. Un accesso vascolare per emodialisi deve
Il liquido dializzante è una soluzione acquosa con composizione elettrolitica simile a quella del liquido extracellulare, che può essere in parte modificata sulla base delle necessità del singolo paziente, in modo da ottimizzare il riequilibrio metabolico. Fra le sostanze presenti nel bagno di dialisi le più importanti sono sodio (Na+), potassio (K+), calcio (Ca2+), magnesio (Mg2+), bicarbonato (HCO3-) e acetato (CH3COO-).
Durante l’emodialisi il sangue da depurare e il bagno di dialisi sono separati dalla membrana semipermeabile microporosa del dializzatore; tale membrana trattiene globuli rossi e proteine plasmatiche e lascia passare le molecole di scarto a basso peso molecolare. Mentre i soluti sono scambiati per diffusione, l’acqua da rimuovere viene ultrafiltrata grazie ad un gradiente pressorio tra i due compartimenti che consente la convezione dei liquidi. I filtri attualmente più utilizzati sono quelli costituiti da fibre cave (Figura 2.3): il sangue circola all’interno delle fibre in controcorrente rispetto al fluido che scorre fuori da esse e tale meccanismo garantisce la massima efficienza del trattamento attraverso la realizzazione contemporanea di diffusione, convezione e ultrafiltrazione.
Figura 2.3 Filtro a fibre cave utilizzato in emodialisi. Il sangue da depurare e il fluido dializzante scorrono in controcorrente, il primo dentro le fibre e il secondo all’esterno di esse.
Il volume liquido eliminato deve essere costantemente monitorato e adeguato alla risposta del paziente per evitare che una brusca diminuzione della volemia provochi collasso cardiocircolatorio. Generalmente l’emodialisi viene effettuata 3 volte a settimana per una durata di circa 4 ore a seduta.
La tecnica emodialitica più diffusa è l’emodialisi standard, ma esistono anche terapie emodialitiche alternative quali l’emofiltrazione e l’emodiafiltrazione, prescrivibili dal medico nell’ottica di migliorare la risposta del paziente alla terapia.
2.3.3 Emofiltrazione
Nell’emofiltrazione (hemofiltration, HF) si usano filtri con membrane altamente porose che favoriscono gli scambi convettivi e la rimozione di soluti a peso molecolare medio – alto
Capitolo I Anatomia funzionale e dialisi! !
!
attraverso la parete polimerica, mentre quello ultrafiltrativo sfrutta la presenza dei pori creati nella parete in fase di fabbricazione. Le fibre siliconiche, che hanno un diametro di garantiscono una ridotta risposta infiammatoria e possono essere estruse ottenendo un elevato rapporto spessore/diametro in modo da garantire rigidezza e non collassabilità senza per questo gravare sulle difficoltà di ottenimento industriale. Spessori troppo elevati possono ostacolare il processo diffusivo; per questo di carico e agli sforzi di taglio) e il più possibile omogenee tra loro in modo da garantire un flusso di soluti uniforme in tutto il filtro.
!
Figura 1.6: Filtro a fibre cave utilizzato in emodialisi.
I filtri più usati attualmente sono quelli a fibre cave. Il sangue circola dentro queste fibre mentre il bagno di dialisi circola fuori di esse, con un flusso inverso. Questo tipo di dinamica garantisce la realizzazione di tutti i processi precedentemente descritti (ultrafiltrazione, diffusione, convezione) con prestazioni dialitiche più efficienti.
Durante la seduta dialitica è necessario praticare una terapia anticoagulante allo scopo di prevenire la formazione di trombi nel circuito extracorporeo. Il farmaco più utilizzato è che ha un effetto immediato e facilmente quantizzabile. Se è necessario essa è rapidamente neutralizzabile da un antagonista specifico che è la protamina.
Durante la seduta di emodialisi si possono verificare degli eventi destabilizzanti quali: Ipotensione arteriosa: rappresenta la complicanza più frequente.
Terapie dialitiche
19
trascinati dal fluido ultrafiltrato. Con questa tecnica il volume di ultrafiltrazione è particolarmente elevato, quindi è necessario reinfondere un liquido di diluizione; tale reinfusione avviene a monte del filtro in caso di pre – diluizione o a valle se si sceglie la post – diluizione.
2.3.4 Emodiafiltrazione
La terapia dialitica di emodiafiltrazione (hemodiafiltration, HDF) combina i meccanismi di diffusione e convezione usando membrane semipermeabili di materiale polimerico sintetico con spessori molto ridotti. In questo modo si ottimizza lo scambio di molecole sia a basso sia ad alto peso molecolare, come le β2-microglobuline che altrimenti si accumulerebbero in quantità dannose per l’organismo.
HDF con pre – diluizione
L’infusione del fluido dializzante a monte del dializzatore viene generalmente prescritta ai pazienti con portate ematiche ridotte o emoconcentrazioni elevate in modo da limitare l’aumento della pressione transmembrana per evitare complicazioni intradialitiche.
Gli svantaggi di questa tecnica sono il rischio intrinseco di contaminazione del volume di reinfusione, il rischio di rimozione di sostanze utili per l’organismo e la riduzione dell’efficacia diffusiva come conseguenza della riduzione del gradiente di concentrazione dei soluti.
HDF con post – diluizione
Nel caso di post – diluizione il liquido di sostituzione è miscelato al sangue a monte del dializzatore, prima della reimmissione nel paziente. L’ultrafiltrazione elevata può indurre coaguli o emolisi all’interno dei capillari del filtro, con conseguenti aumento della pressione transmembrana e rischio di otturazione dei capillari stessi e di perdita di proteine sulla membrana con alterazione dell’equilibrio osmotico.
2.4 Complicanze della terapia dialitica
Nonostante i notevoli progressi tecnologici che hanno migliorato la sicurezza del trattamento dialitico, le sedute non sono mai prive di rischio; durante la seduta dialitica si possono verificare degli eventi avversi, quali ipotensione arteriosa, emorragia, crampi, embolia, incidenti tecnici.
L’ipotensione arteriosa rappresenta la complicanza più frequente, conseguenza del mancato adattamento del letto vascolare alla riduzione della massa circolante, qualora la deidratazione
sia troppo rapida o eccessiva; il calo pressorio è spesso preceduto da riduzione della portata ematica, sbadigli ripetuti e sintomi come crampi, nausea, vomito. I crampi muscolari che si manifestano più frequentemente interessano gli arti inferiori, con contratture dolorose ai muscoli dei polpacci, provocati da elevata ultrafiltrazione o ridotta concentrazione di sodio nel dialisato. Il paziente uremico presenta un rischio emorragico aumentato durante il trattamento emodialitico, con possibile insorgenza di sanguinamenti spontanei, più frequentemente a carico dell’apparato gastroenterico. L’embolia gassosa provocata da penetrazione di aria nel circuito ematico è una complicanza che si manifesta raramente ma è quella più pericolosa per il paziente. Infine, possono occorrere incidenti tecnici sulle apparecchiature, come coaguli nel circuito, rottura delle linee o del filtro emodializzatore, errori di impostazione del calo peso.
3. Insorgenza dell’ipotensione intradialitica:
stato dell’arte
In questo capitolo sarà introdotto il concetto di ipotensione intradialitica come principale complicanza del trattamento dialitico; ne verranno delineate cause, conseguenze e azioni correttive e saranno riportati i principali metodi di prevenzione indagati in letteratura.
3.1 Definizione di ipotensione intradialitica e meccanismo di insorgenza
Nonostante i notevoli progressi tecnologici che hanno migliorato la sicurezza del trattamento dialitico, l’intervento non è mai privo di rischio. L’ipotensione intradialitica (intradialytic
hypotension, IDH) è una delle complicanze a breve termine più rilevanti dell’emodialisi, che si
verifica in circa il 25% delle sedute. Nei trattamenti di emodialisi standard eseguiti 3 volte a settimana, a causa della maggior dose di ultrafiltrazione, tale incidenza è anche maggiore e raggiunge valori del 50% (7).
Nonostante l’ipotensione sia la più comune complicanza acuta che si riscontra durante l’emodialisi, non vi è una definizione univoca e non sono disponibili sistemi automatici che permettano di rilevarla durante il trattamento.
Una definizione di IDH che coinvolga solo la pressione sanguigna assoluta non è significativa; è interessante, piuttosto, considerare criteri che tengano conto della riduzione relativa di pressione durante la sessione dialitica.
In clinica non esiste una definizione di IDH universalmente accettata; alcuni studiosi (8) riconoscono come ipotensione intradialitica ogni riduzione di pressione arteriosa sistolica (systolic arterial pressure, SAP) del 20%, mentre altri (9) hanno proposto una definizione che si basa sui tre criteri seguenti:
1. se la SAP predialisi è maggiore di 100 mmHg, per IDH si intende ogni episodio con SAP minore di 90 mmHg, anche senza disturbi;
2. se la SAP predialisi è minore di 100 mmHg, ci si riferisce ad IDH per ogni riduzione di SAP di almeno il 10% del valore iniziale associata a sintomi;
3. IDH è ogni riduzione di SAP del 25% o più rispetto al valore predialisi, con i tipici sintomi richiedenti specifici interventi (crampi, nausea, vomito).
L’andamento della pressione sanguigna nel tempo può essere introdotto nella definizione come riflesso della durata di riduzione della pressione (15).
Se la riduzione, in termini di mmHg, è rapida si parla di ipotensione acuta, altrimenti di IDH non acuta. La rapidità con cui la pressione diminuisce è, insieme alla durata del fenomeno, determinante per l’eziologia della IDH, quindi i metodi di riconoscimento e rilevazione dell’ipotensione dovrebbero differenziarsi a seconda che l’obiettivo sia prevedere un episodio acuto o non acuto di IDH.
Le cause dell’insorgenza dell’ipotensione nei pazienti in dialisi sono molteplici e legate a fattori di diversa natura. Alcuni elementi, dipendenti dal paziente, che inficiano il trattamento sono riconducibili a patologie vascolari e cardiache (compromessa vasocostrizione, aterosclerosi, ipertrofia ventricolare sinistra, cardiomiopatia dilatativa), neuropatie, anemia. Altri fattori, più strettamente dipendenti dal trattamento, sono legati alla temperatura del dialisato, alla concentrazione di sodio, alla composizione del tampone, al tasso di ultrafiltrazione, al tipo di membrana, al tipo di alimentazione e idratazione e agli eventuali cambiamenti di posizione durante la dialisi.
Fra le cause non autonomiche di IDH, la riduzione di liquido ematico (ipovolemia) è la principale. L’ultrafiltrazione è il meccanismo che permette di eliminare i liquidi in eccesso durante il trattamento; ciò comporta un aumento della pressione oncotica nel sangue, con conseguente richiamo di liquido interstiziale (plasma refilling, PR). Il compartimento interstiziale, a sua volta, richiama liquido dallo spazio intracellulare e l’equilibrio tra il tasso di ultrafiltrazione (ultrafiltration rate, UFR) e il tasso di riempimento plasmatico (plasma refilling rate, PRR) è fondamentale per il bilanciamento volemico complessivo, al fine di evitare eventi ipotensivi.
In condizioni fisiologiche, la riduzione del volume intravascolare stimola il sistema simpatico, facendo aumentare la frequenza cardiaca e favorendo la vasocostrizione arteriosa per contrastare il fenomeno ipotensivo.
La combinazione di ultrafiltrazione eccessiva o troppo rapida con inadeguato riempimento vascolare, insieme a alterazione della risposta simpatica e della riserva cardiaca, invece, porta frequentemente a insorgenza di ipotensione indotta durante trattamento dialitico. La
Insorgenza dell’ipotensione intradialitica: stato dell’arte
23
diminuzione di volume ematico, inoltre, influenza il riempimento cardiaco e, di conseguenza, la gittata cardiaca (16).
Le conseguenze a breve termine dell’ipotensione sono malessere generale del paziente, riconducibile ad affaticamento, nausea, vomito e svenimenti; tali sintomi non sono solo stenuanti per il paziente, ma anche impegnativi da gestire per lo staff infermieristico. Inoltre, dato che l’IDH comporta spesso l’interruzione prematura della sessione di dialisi, il sangue del paziente potrebbe non essere adeguatamente depurato.
A lungo termine, frequenti episodi ipotensivo possono causare danni permanenti al cuore e all’intestino, oltre al rischio di occlusione della fistola arterovenosa (1). È stato dimostrato che ripetuti episodi di IDH sono, infatti, un fattore di rischio importante e indipendente per l’aumento di morbilità e mortalità nei pazienti in emodialisi, poiché possono indurre aritmia cardiaca e predisporre all’ischemia miocardica (17) (18) (19). L’ipotensione è ritenuta particolarmente grave se insorge all’inizio della sessione di HD (20).
In molti ospedali l’ipotensione è trattata a livello clinico con posizionamento del paziente nella posizione di Trendelenburg, ovvero corpo in posizione supina con i piedi più in alto della testa (10). In generale la procedura prevede la riduzione del flusso ematico del circuito extracorporeo, la riduzione del tasso di ultrafiltrazione e l’aumento della volemia tramite somministrazione di liquidi. Una soluzione alternativa è l’infusione di una soluzione ipertonica che faciliti il passaggio osmotico di fluido dal compartimento extravascolare a quello intravascolare e, quindi, permetta di aumentare il volume di sangue e la pressione sanguigna (2).
Queste azioni sono necessarie quando i sintomi sono già manifesti, ma sarebbe auspicabile prevenire gli episodi ipotensivi, piuttosto che correggerli. Il principale ostacolo al raggiungimento di questo obiettivo è il fatto che l’insorgenza di IDH non è sempre osservabile attraverso segni esterni, poiché alcuni pazienti non mostrano sintomi precursori.
La prevenzione dell’ipotensione intradialitica è stata oggetto, negli ultimi anni, di indagine da parte di molti studiosi che hanno evidenziato la necessità di una migliore valutazione del peso secco del paziente, di una corretta regolazione della temperatura del dialisato, di un particolare profilo della concentrazione di sodio nel dialisato (dialysate sodium concentration, DSC) e del monitoraggio online del volume ematico (blood volume, BV).
Una delle sfide aperte è quella di determinare, prima della sessione di emodialisi, la probabilità che il paziente soffrirà di ipotensione intradialitica o meno (offline prediction). In questo caso non si tratta di processare i dati online ma di verificare se vi siano parametri valutabili ad inizio trattamento la cui contemporanea variazione sia indicativa di una particolare risposta al trattamento.
3.2 Variabili correlate a IDH
Le variabili correlate all’ipotensione sono molteplici e tra esse hanno un ruolo particolare la pressione ematica, la temperatura del sangue, il volume di sangue relativo (relative blood volume, RBV), la bioimpedenza e le variabili elettrocardiografiche (ECG) e fotopletismografiche (PPG). Inoltre, le variabili cardiovascolari che riflettono la variabilità della frequenza cardiaca, la turbolenza della frequenza cardiaca e la sensibilità baroriflessa sono importanti per studiare con controllo in feedback i sistemi di emodialisi, in modo da migliorare le loro performance (11).
3.2.1 Variabili di uso clinico
Negli anni numerosi studi hanno analizzato il significato di variabili “sensori” che caratterizzano il sistema circolatorio riguardo all’IDH, in particolare la temperatura del sangue, il volume del sangue e la bioimpedenza, con lo scopo ultimo di modificare le variabili "attuatori" (UFR, DSC e temperatura del dialisato) per ridurre l’incidenza di ipotensione durante la seduta dialitica (10). Per molti anni le impostazioni delle macchine per dialisi sono state modificate manualmente dagli operatori; attualmente tali modifiche sono soggette ad automazione nel quadro del controllo in retroazione.
Pressione del sangue
Il tracciato temporale della pressione arteriosa sanguigna sarebbe il naturale punto di partenza per sviluppare un algoritmo per la predizione e la prevenzione online dell’ipotensione. Tale approccio non è possibile poiché i sensori per la misurazione della pressione (dispositivi con bracciale gonfiabile) utilizzati nel reparto dialisi non permettono una valutazione continua del parametro e sono talmente invasivi per il paziente che non è possibile effettuare misurazioni più frequentemente di 10 minuti. Frequenti misurazioni di questo tipo, inoltre, influenzano la pressione stessa. D’altra parte, misure indirette di variazione della pressione arteriosa possono essere facilmente ottenute con la fotopletismografia che necessita solamente di un pulsiossimetro collegato al dito del paziente, che può essere combinato con l’informazione