INDICE
1. RIASSUNTO pag. 3
2. INTRODUZIONE
2.1 Ruolo della chirurgia bariatrica nel trattamento pag. 4 dell’obesità e del diabete mellito di tipo II
2.2 Caratteristiche, meccanismi d’azione e effetti pag. 14
endocrino-metabolici della proteina legante gli IGFs di tipo 2 (IGFBP 2)
2.1 Scopo dello studio pag. 24
3. MATERIALI E METODI
3.1 I pazienti pag. 25
3.2 Misurazioni antropometriche pag. 27
3.3 Prelievi ematici e quantificazione dell’IGFBP 2 pag. 27
3.5 Analisi statistiche pag. 29
4. RISULTATI pag. 30
5. DISCUSSIONE pag. 36
1. RIASSUNTO
L’obesità è un importante problema di salute pubblica, in quanto si associa ad un aumentato rischio di sviluppare importanti comorbidità
con conseguente aumento della mortalità.
La chirurgia bariatrica sta assumendo sempre maggior importanza
nel trattamento delle forme di obesità grave. L’intervento chirurgico
permette di ottenere un marcato calo ponderale, stabile nel tempo ed un
miglioramento o risoluzione del diabete mellito di tipo 2. I meccanismi
responsabili di tali miglioramenti non sono ad oggi completamente noti:
l’ipotesi principale coinvolge le variazioni degli ormoni del tratto gastro-intestinale (GLP-1, GIP, PYY, grelina, colecistochinina), della leptina,
dell’insulina e probabilmente di altri ormoni non ancora caratterizzati. L’IGFBP 2, appartiene ad una famiglia di sei proteine di trasporto
degli IGFs e sembra svolgere un ruolo nel controllo metabolico: in
modelli murini l’IGFBP 2 si è dimostrata in grado di proteggere dallo
sviluppo dell’obesità, promuovere il calo ponderale e migliorare il profilo glicemico.
Scopo di questa tesi è stato quello di misurare, per la prima volta,
medio di 47,53 ± 7,3 kg/m2) , le eventuali variazioni dei livelli sierici di
IGFBP-2 (misurati con metodica ELISA) prima e dopo intervento
bariatrico di bypass gastrico. Lo studio è stato condotto fino ad un anno
dall’intervento con particolare attenzione alla finestra temporale (0-3 mesi) durante la quale sono attesi i maggiori rimaneggiamenti degli
ormoni regolatori del peso e delle funzioni metaboliche.
I nostri risultati mostrano che i livelli di IGFBP-2 aumentano
parallelamente all’aumentare dell’età e sono significativamente più bassi
nei grandi obesi (179,7 ± 13,5 ng/ml) rispetto ai soggetti normopeso.
Dopo bypass gastrico i livelli di IGFBP 2 aumentano significativamente
(aumento medio del 77%) tre giorni dopo intervento (346,2 ± 34,6
ng/ml) e si normalizzano molto precocemente durante il follow up.
In conclusione, i nostri dati supportano l’ipotesi che, nel paziente
grande obeso, l’IGFBP 2 possa essere uno dei mediatori coinvolti nella
perdita di peso e nel miglioramento del diabete, rivestendo un ruolo nel
raggiungimento dei risultati che seguono la chirurgia bariatrica. In
questo caso l’IGFBP 2 non sarebbe più da considerare soltanto una
2. INTRODUZIONE
2.1 Ruolo della chirurgia bariatrica nel trattamento dell’obesità e
del diabete mellito di tipo II
L’obesità è un importante problema di salute pubblica in quanto si associa ad un aumentato rischio di sviluppare comorbidità fra cui le
patologie cardiovascolari, il diabete mellito tipo 2 e la steatosi epatica
non alcolica, con un conseguente aumento della mortalità (1).
Si parla di obesità quando l’indice di massa corporea (IMC=peso (Kg)/altezza espressa in metri al quadrato) risulta essere superiore a 30
(2).
La prevalenza dell’obesità è aumentata significativamente in tutto il mondo negli ultimi 30 anni e le stime più recenti indicano che circa il
34% degli adulti, negli Stati Uniti, sia obeso (3). In Italia secondo i dati
pubblicati nel 2010 dall’Istituto Nazionale di Statistica (ISTAT), le
persone obese sono circa 5 milioni e la prevalenza di tale condizione
quindi il rapido e progressivo incremento di casi osservato negli ultimi
anni, l’obesità viene considerata una vera e propria “epidemia” o “pandemia” (1).
Il peso corporeo è regolato da un sistema a feedback in grado di
interfacciare l’introito calorico e la spesa energetica giornalieri.
Le differenze di peso corporeo fra gli individui sono il risultato di una
forte interazione fra l’ambiente e il background genetico individuale. I
geni dell’obesità codificano per le componenti molecolari del sistema fisiologico di regolazione del bilancio energetico (5). Alcuni dei
componenti di questo sistema omeostatico sono ormoni, un esempio dei
quali e’ l’ormone leptina, prodotto dal tessuto adiposo, che segnala lo stato nutrizionale ai centri regolatori situati a livello ipotalamico. Altri
importanti segnali ormonali che contribuiscono alla regolazione del peso
corporeo sono rilasciati dal tratto gastro-intestinale, dal pancreas e dal
tessuto adiposo (6).
farmaco autorizzato) e, nei casi più gravi e selezionati, mediante chirurgia (7).
La chirurgia bariatrica si è dimostrata in grado di indurre una notevole
diminuzione dell’eccesso ponderale e di mantenere il risultato ottenuto
nel tempo. In uno studio che ha preso in considerazione più di 4000
soggetti, si è evidenziata una riduzione della mortalità per tutte le cause
(in particolare malattie cardiovascolari e tumori) nei pazienti operati
rispetto ai controlli (8).
Le attuali linee guida per l’approccio alla chirurgia bariatrica fanno
riferimento a quanto stabilito dal NIH Consensus Development
Conference Statement del 1991 e pongono le seguenti indicazioni
all’intervento: uno stato di obesità grave, caratterizzata da un IMC > 40 kg/m2 o da un IMC > 35kg/m2 in presenza di comorbidità, soprattutto in
casi con anamnesi positiva per precedenti fallimenti della terapia
dietetica-comportamentale e farmacologica (9).
Tradizionalmente si usano suddividere gli interventi di chirurgia
bariatrica (figura 1) in tre categorie, in base al meccanismo utilizzato per
prima tipologia di intervento permette di ottenere il calo ponderale
attraverso una diminuizione del volume gastrico (a cui consegue una
obbligata riduzione dell’introito calorico): il bendaggio gastrico
regolabile e la gastrectomia a manica (“sleeve gastrectomy”) fanno parte
di questo primo gruppo. La diversione bilio-pancretica, invece, permette
di ottenere il calo ponderale attraverso il malassorbimento. Infine
esistono interventi, come il bypass gastrico con ansa alla Roux, che
uniscono entrambi gli approcci. Ogni procedura chirurgica ha differenti
indicazioni in relazione alle specifiche caratteristiche comportamentali e
cliniche del paziente (10).
Il bendaggio gastrico regolabile si effettua ponendo una protesi circolare
di silicone regolabile attorno allo stomaco prossimale al fine di creare
una tasca gastrica di circa 20-25 ml (10).
L’intervento di gastrectomia a manica (sleeve gastrectomy) si caratterizza per una marcata riduzione del volume gastrico ottenuta
La diversione biliopancreatica si ottiene effettuando una gastrectomia
distale con una lunga ricostruzione ad Y sec. Roux; la
gastro-entero-anastomosi è confezionata utilizzando l’ileo distale e completata
generalmente con una colecistectomia preventiva (10).
Il bypass gastrico è oggi l’intervento più praticato nei centri di
riferimento bariatrico: consiste nella separazione definitiva dello
stomaco con creazione di una tasca gastrica di 25-30 ml anastomizzata
con un’ansa digiunale sezionata tra 40 e 120 cm dal legamento del Treitz ed il tratto bilio-pancreatico anastomizzato tra 100 e 150 cm a
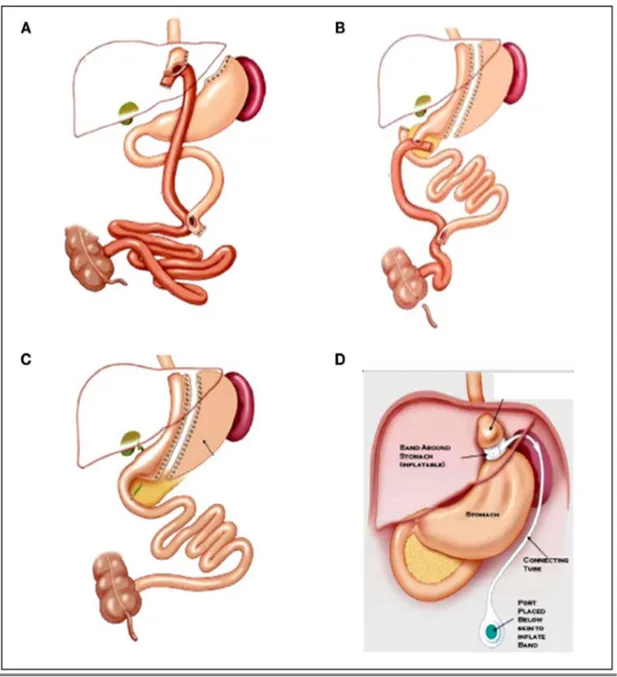
Figura 1: le principali procedure di chirurgia bariatrica. A: bypass
gastrico su ansa alla Roux; B: diversione bilio-pancreatica; C: gastrectomia a manica; D: bendaggio gastrico regolabile (figura
Da una meta-analisi che ha preso in considerazione più di 135.000
pazienti trattati, si è visto che la chirurgia bariatrica è molto efficace nel
determinare una considerevole perdita di peso, quantificabile
mediamente nel 55,9 % dell’eccesso ponderale; gli interventi
maggiormente efficaci in questo senso sono la diversione
biliopancreatica con swich duodenale e il bypass gastrico, che portano a
una riduzione media del peso in eccesso di circa il 63% e il 59%
rispettivamente (11). Per la gastroplastica e per il bendaggio le
percentuali sono invece inferiori, con una riduzione media del 55% per
la prima procedura e del 46% per la seconda. La velocita’ della perdita
di peso risulta più marcata nel periodo successivo all’intervento e
rallenta dopo circa 6 mesi; il massimo calo ponderale viene raggiunto
dopo circa 18-24 mesi dall’intervento. In seguito alla chirurgia si
ottiene, inoltre, un miglioramento fino alla risoluzione del diabete in una
percentuale molto elevata (11). La meta-analisi di Buchwald e
collaboratori riporta un miglioramento nell’86,6% dei pazienti e la
completa remissione nel 78,1% dei casi.La diversione bilio-pancreatica
nel portare a una risoluzione del diabete, con percentuali del 95,1% e del
80,3% rispettivamente (11).
Le basi fisiologiche del marcato calo ponderale e del rapido
miglioramento del diabete dopo la chirurgia non sono ancora del tutto
chiare; l’ipotesi principale coinvolge le variazioni degli ormoni del tratto
gastro-intestinale, che regolano il senso di sazietà, la velocità di
svuotamento gastrico, la sensibilità e la secrezione insulinica (12,13).
Fra tali ormoni, le “incretine” (GLP-1, glucagon like peptide-1) e GIP (gastric inibitory peptide), così denominate per la loro capacità di
incrementare la secrezione insulinica post-prandiale, svolgono un ruolo
principale; esse inoltre diminuiscono la secrezione di glucagone,
incrementano il senso di sazietà e rallentano la velocità di svuotamento
gastrico (14).
Altri ormoni intestinali sono probabilmente coinvolti, come il PYY
(peptide YY), che potenzia il senso di sazietà e ritarda il tempo di
l’insulina, sembrano avere un ruolo in questo senso. Si ritiene che le modificazioni di tutti questi fattori ormonali dopo la chirurgia bariatrica
migliorino profondamente l’omeostasi glicemica ed abbiano un effetto
positivo sulla perdita di peso (14,15).
Sorprendentemente, il ritorno a valori normoglicemici si ottiene in molti
casi nell’arco di pochi giorni dall’intervento prima ancora che si sia
verificato un significativo calo ponderale e rimane tale nel tempo pur in
assenza di terapia (14-16).
Inutile dire che questo aspetto suscita grande interesse sia dal punto di
vista fisiopatologico che potenzialmente terapeutico.
Due sono le principali ipotesi che cercano di spiegare il meccanismo
grazie al quale la chirurgia porterebbe ad un miglioramento del controllo
glicemico: l’ ipotesi dell’ “intestino distale” e quella dell’”intestino prossimale" (17). La prima si basa sul presupposto che grazie alla
modifica dell’anatomia gastrointestinale i nutrienti semi-digeriti
arrivano più velocemente alla parte distale dell’intestino tenue (ileo)
determinando un incremento dello stimolo al rilascio delle incretine
livelli aumentano dopo intervento (17). La seconda ipotesi, sostenuta
dagli esperimenti di Rubino e coll., ritiene che il meccanismo
responsabile del miglioramento della sensibilità insulinica sia da
ricercarsi nelle modifiche riguardanti la parte prossimale dell’intestino
(duodeno e digiuno), che in questi interventi viene bypassata escludendo
così, secondo questi autori, l’effetto di agenti ad azione
“anti-incretinica” e “pro-diabetica” costituito da ormoni non ancora scoperti (17).
Il modello del paziente bariatrico risulta quindi assai interessante per la
possibilità di indagare potenziali nuovi ormoni che regolano il
2.2 Caratteristiche, meccanismi d’azione e effetti
endocrino-metabolici della proteina legante gli insulin-like growth
factors di tipo 2 (IGFBP-2)
L’insulina e gli insulin-like growth factors (IGF) sono ormoni centrali nella regolazione del metabolismo, capaci di stimolare la captazione del
glucosio da parte delle cellule, la glicogenosintesi, la lipogenesi e di
prevenire la proteolisi. In questo contesto si inserisce l’IGFBP-2 che
sembra avere anch’essa un ruolo nel controllo metabolico, con
meccanismi ancora non del tutto noti.
L’IGFPB-2 è una proteina plasmatica di 34 kDa prodotta dal fegato, originarimente isolata in base alla capacità di legare sia 1 che
IGF-2. Il gene è stato isolato e sequenziato nella metà degli anni ’80: la
proteina risulta costituita da 289 aminoacidi ed appartiene alla famiglia
composta di sei membri (IGFBP1-6) che mostrano tra loro omologia nei
domini amino e carbossiterminale (18-20 figura 2). L’IGFBP-2 fra tutte
le IGF binding proteins circolanti è la seconda in ordine di
dai plessi corioidei e dagli astrociti, è quella maggiormente presente
(18).
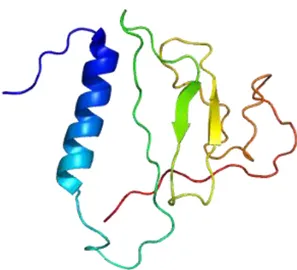
Figura 2: Diagramma a nastro della porzione carbossiterminale di
Insulin-like Growth Factor Binding Protein 2 (IGFBP 2) (da Kuang et al. 2006) (20).
L’IGFBP-2, la cui emivita plasmatica è di 30-90 minuti, lega con elevata affinità gli IGFs. Studi in vitro indicano che ne inibisce l’azione
formando dei complessi binari di circa 50 kDa (18,21), come
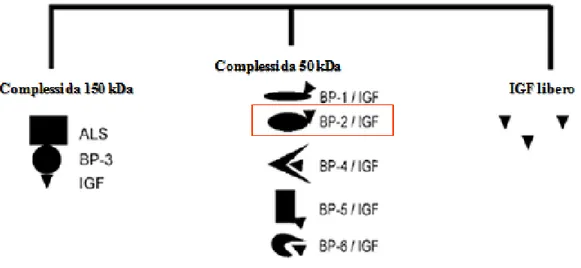
Figura 3: Le forme di IGFBPs presenti nel circolo ematico. I complessi
circolanti da 50 kDa sono costituiti da IGF-1 o IGF-2 legati ad una delle cinque IGFBPs; in rosso è evidenziato il complesso relativo alla IGFBP 2 (figura modificata da Rajaram e coll, 1997) (18).
Il fatto che IGFBP-2 circoli in concentrazioni equimolari (od inferiori) a
quelle del suo principale ligando IGF-1, fa dubitare che il suo ruolo di
essa sia semplicemente di trasportatore; in questo caso infatti ci si
attenderebbero concentrazioni in eccesso molare rispetto a quelle di
IGF-1 (22).In realtà la funzione primaria dell’IGFBP-2 non e’ del tutto
chiara, come non e’ del tutto chiaro il suo ruolo regolatorio nei confronti dell’IGF-1 e le eventuali azioni indipendenti dall’IGF-1 stesso. Sono sempre maggiori le prove che mostrano come l’IGFBP-2, svolga, per se,
azioni in qualità di ormone e fattore di crescita durante lo sviluppo, nella
progressione tumorale e in ambito metabolico (23,24).
L’IGFBP-2, secreta principalmente dal fegato, è prodotta anche da altri tessuti, fra cui quello adiposo (25-27) come mostrato in figura 4.
Le concentrazioni sieriche circolanti variano significativamente da
soggetto a soggetto; negli adulti normopeso, nella nostra esperienza,
sono compresi fra 400 ± 43,9 ng/ml ( media ± SEM )
I livelli sierici dell’IGFBP-2 si modificano in relazione all’età: sono elevati alla nascita e durante la senescenza; subiscono un aumento
progressivo nell’età adulta, ed un rialzo particolarmente marcato a partire dai sessanta anni; i meccanismi responsabili di questo andamento
non sono noti (28).
I livelli circolanti dell’IGFBP-2 variano, inoltre, in relazione a diverse
patologie, fra cui quelle tumorali (aumentando durante la progressione
della malattia e diminuendo in fase di remissione) e in quelle che
coinvolgono lo stato nutrizionale, aumentando nelle condizioni croniche
di malnutrizione calorico-proteica, nel digiuno prolungato e
nell’anoressia nervosa (18).
In uno studio effettuato su cellule neoplastiche mammarie che
risultavano prive di recettori per gli IGF-1, la IGFBP-2 ha mostrato un
ruolo nell’induzione di geni coinvolti nella proliferazione, migrazione/adesione e apoptosi cellulare; verosimilmente legandosi a
recettori integrinici α5β1 e ad altre componenti della matrice
extracellulare (proteoglicani, eparina, glicosaminoglicani) (19,23).
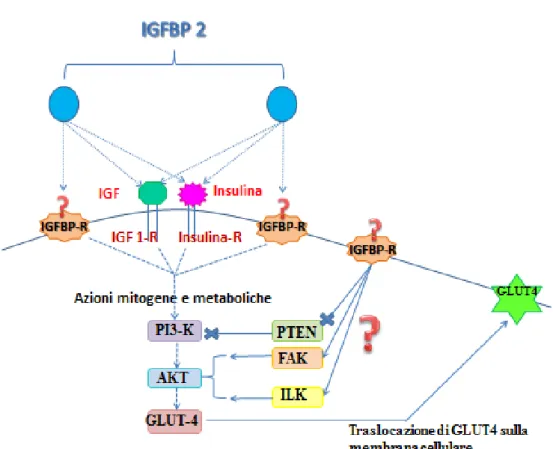
Tali recettori integrinici (o altri non ancora identificati) modulano
diverse vie di segnalazione intracellulare implicate nel controllo
metabolico: inibiscono infatti l’azione della fosfatasi PTEN, attivano la
chinasi FAK e diminuiscono l’attività della chinasi ILK portando così ad
un aumento dell’attivazione della via del PI3K-AKT responsabile della
traslocazione del GLUT4 sulla superficie cellulare (24,29), come
mostrato nella figura 5 .
Questi risultati forniscono ulteriore supporto agli studi che mettono in
relazione i livelli sierici della IGFBP-2 con la patogenesi di diverse
malattie del metabolismo, come la sindrome metabolica, l’obesità e il diabete mellito (19,22,30,31).
FIGURA 5: Modello di azione della IGFBP 2: la IGFBP-2 sarebbe in
grado di svolgere azioni dirette attraverso degli ipotizzati recettori specifici. Tali recettori sarebbero in grado di modulare tra gli altri il “signaling” intracellulare attivato dall’insulina (figura modificata da Ruan W e Lai M, 2009 ) ( 29 ).
Questi risultati forniscono ulteriore supporto agli studi che mettono in
relazione i livelli sierici della IGFBP-2 con la patogenesi di diverse
malattie del metabolismo, come la sindrome metabolica, l’obesità e il
diabete mellito (19,22,30,31).
Già nel 1999 e’ stato riportato come i livelli sierici dell’IGFBP-2
diminuissero nei soggetti obesi e ancora di più negli obesi con associata
una condizione di diabete mellito di tipo II, rispetto ai controlli
normopeso sani (32).
Nell’adulto, i valori sierici correlano inversamente con l’indice di massa corporea, sono inoltre positivamente associati all’HOMA index ed
inversamente all’insulinemia (33). I valori sierici dell’IGFBP-2 sono anche stati proposti come marker da utilizzare nella diagnosi di
sindrome metabolica. Essi non hanno un andamento circadiano, e
potrebbero cosi riflettere la condizione cronica insulino-resistenza (29).
Wheatcroft e coll. hanno dimostrato che l’IGFBP-2, oltre che dal fegato,
grassi, risultavano protetti dallo sviluppo di obesità ed insulino
resistenza (31).
Inoltre, questi animali conservavano una migliore tolleranza glucidica e
più bassi valori di pressione arteriosa durante l’invecchiamento (31).
Alcuni studi hanno evidenziato un ruolo diretto dell’IGFBP-2
nell’inibire l’adipogenesi e nell’indurre un miglioramento del profilo
citochinico prodotto dal tessuto adiposo (19,31).
Studi ancor più recenti rafforzano l’ipotesi che l’IGFBP-2 sia in stretta
relazione con il sistema ormonale responsabile del controllo metabolico:
è stato infatti dimostrato come l’espressione dell’IGFBP-2 sia
fortemente regolata dalla leptina: è sufficiente un’infusione di basse dosi
di tale ormone per indurre l’espressione dell’IGFBP-2; questa proteina
potrebbe perciò essere un importante mediatore degli effetti positivi
indotti dalla leptina sulla glicemia e sull’insulino-sensibilità (31).
Sempre nel medesimo studio, si è evidenziato come l’iper-espressione
epatica dell’IGFBP-2 ottenuta mediante un vettore adenovirale in topi
normalizzazione della glicemia, dell’insulinemia e ad un miglioramento
della steatosi epatica (con conseguente insulino-sensibilizzazione):
l’IGFBP-2 riesce a inibire, almeno parzialmente, i geni responsabili della gluconeogenesi e della produzione degli acidi grassi a livello
epatico. (31) È possibile che tale proteina abbia, almeno in parte, un
ruolo indipendente dall’insulina come evidenziato dall’effetto positivo
sulla glicemia in topi insulino-privi affetti da diabete indotto dalla
streptozotocina (31).
I livelli dell’IGFBP-2 oltre ad essere regolati dalla leptina e dall’IGF-1
(che ne diminuisce la produzione), sarebbero controllati dall’insulina,
che ne inibirebbe la sintesi (34), dal GH, durante trattamento per bassa
statura od in corso di doping e dai glucocorticoidi. I meccanismi
molecolari responsabili di tali effetti non sono ancora ben conosciuti.
(18).
Alla luce di tutti questi risultati che conferiscono all’IGFPB-2 un ruolo
biliopancreatica in soggetti francamente obesi (35). I livelli di IGFBP-2
incrementavano piuttosto rapidamente in seguito alla chirurgia
bariatrica, normalizzandosi a circa 1 anno dall’intervento. I livelli della
proteina correlavano con la diminuzione della massa grassa e con il
miglioramento dell’omeostasi glucidica e lipidica conseguenti all’intervento (35). Queste recenti osservazioni evidenziano un possibile ruolo dell’IGFBP-2 nel mediare gli effetti terapeutici della chirurgia bariatrica.
2.3 Scopo dello studio
Scopo di questa tesi è stato quello di misurare, per la prima volta, in un
gruppo di pazienti affetti da obesità grave, le eventuali variazioni dei
livelli sierici di IGFBP-2 dopo intervento bariatrico di bypass gastrico.
Lo studio è stato condotto fino ad un anno dall’intervento chirurgico con
particolare attenzione alla finestra temporale (0-3 mesi) durante la quale
sono attesi i maggiori rimaneggiamenti degli ormoni regolatori del peso
MATERIALI E METODI
3.1 I pazienti
Erano inclusi 50 pazienti, selezionati fra i pazienti candidati ad
intervento di chirurgica bariatrica presso il Centro Obesità della U.O. 1
di Endocrinologia della Azienda Ospedaliera Universitaria Pisana.
Dei 50 pazienti, 10 erano uomini e 40 erano donne, con un’età media di
44 ± 8 anni (media ± DS ), peso corporeo medio di 127 ± 25 kg e IMC
medio di 47,53 ± 7,3 kg/m2. I pazienti avviati alla terapia chirurgica
rispettavano le indicazioni della Società Italiana dell’Obesità (SIO) al
trattamento bariatrico.
Erano esclusi dallo studio i pazienti sottoposti precedentemente a
chirurgia bariatrica o a cardiochirurgia, affetti da patologie
infiammatorie acute, epatopatie virali croniche, neoplasie recenti od
(costituito dall’endocrinologo, anestesista, psicologo, nutrizionista, psichiatra, chirurgo).
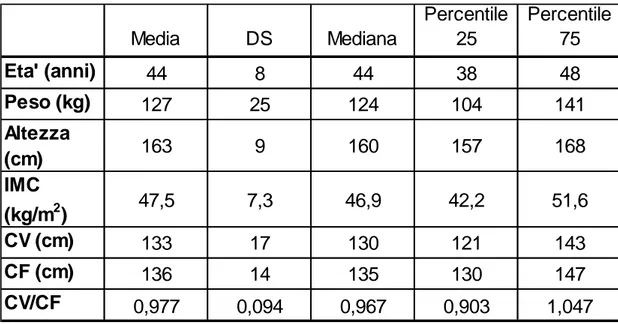
Le caratteristiche generali dei pazienti sono riportate nella tabella 1.
Come gruppo di controllo sono stati selezionati un gruppo di 15 soggetti
(10 donne e 5 uomini) normopeso paragonabili per età con i nostri
pazienti e non affetti da malattie endocrino-metaboliche.
Media DS Mediana Percentile 25 Percentile 75 Eta' (anni) 44 8 44 38 48 Peso (kg) 127 25 124 104 141 Altezza (cm) 163 9 160 157 168 IMC (kg/m2) 47,5 7,3 46,9 42,2 51,6 CV (cm) 133 17 130 121 143 CF (cm) 136 14 135 130 147 CV/CF 0,977 0,094 0,967 0,903 1,047
3.2 Misure antropometriche
Le misurazioni antropometriche erano effettuate dopo una notte di
digiuno. Il peso corporeo era approssimato al kg più vicino all’unità,
mentre l’altezza e la circonferenza addominali erano riferite al cm più vicino all’unità. Era inoltre calcolato il rapporto fra la circonferenza della vita e dei fianchi.
3.3 Prelievi ematici e misurazione dell’IGFBP-2
I prelievi ematici erano eseguiti prima della chirurgia (prelievo tempo
0’) e dopo tre giorni, un mese, tre mesi, sei mesi e un anno dall’intervento. In tutti i casi i prelievi erano effettuati dopo 12 ore di digiuno.
I livelli sierici dell’IGFBP-2 erano misurati tramite ELISA (Mediagnost, Reutlingen, Germany) ai tempi 0’, 3 giorni, 1 mese, 3 mesi, 6 mesi ed un anno post-intervento seguendo le istruzioni del produttore. Per il
Il kit da noi utilizzato, impiega due anticorpi specifici ad alta affinità: il
primo adsorbito alla piastra a 96 pozzetti ed il secondo che lega
successivamente l’IGFBP-2 immobilizzata; il secondo anticorpo è biotinilato ed interagisce con un coniugato che contiene
streptavidina-perossidasi: la reazione colorimetrica sviluppata assume una intensità
variabile in funzione dei livelli di IGFBP-2 in modo direttamente
proporzionale alla concentrazione di quest’ultima. Le misurazioni erano
effettuate in duplicato per ciascun campione, che è stato diluito 1:21
mediante buffer. Il dosaggio effettuato utilizzando piastre da 96 pozzetti
era condotto con metodo manuale.
La sensibilità analitica di questo saggio è di circa di 0,2 ng/ml; il kit
utilizzato è specifico per l’IGFBP-2 umana e non presenta cross reattività con le IGFBP-1 e -3 (particolarmente rappresentate nel siero);
inoltre il saggio non risente di eventuali incrementi di bilirubina o
trigliceridi. I coefficienti di variabilità intra e inter-saggio sono risultati
3.4 Analisi statistiche
I dati numerici discreti sono espressi come frequenza e percentuale
mentre i dati di tipo continuo sono riportati come media e media
dell’errore standard o deviazione standard (variabili Gaussiane) o o mediana con range interquartile (variabili con distribuzione non
Gaussiana). La normalità delle distribuzione dei dati continui è stata
valutata mediante il test di Kolmogorov-Smirnov. Le variazioni
post-chirurgiche (∆) sono state calcolate come valore al follow-up meno il rispettivo valore basale.
Il confronto statistico tra i valori basali e i valori ai vari follow-up (3
gironi, 1 mese, 6 mesi, 9 mesi e 12 mesi post-intervento) è stato
effettuato mediante test t di Student per dati appaiati (variabili
Gaussiane) oppure tramite test di Wilcoxon (variabili Gaussiane).
4. RISULTATI
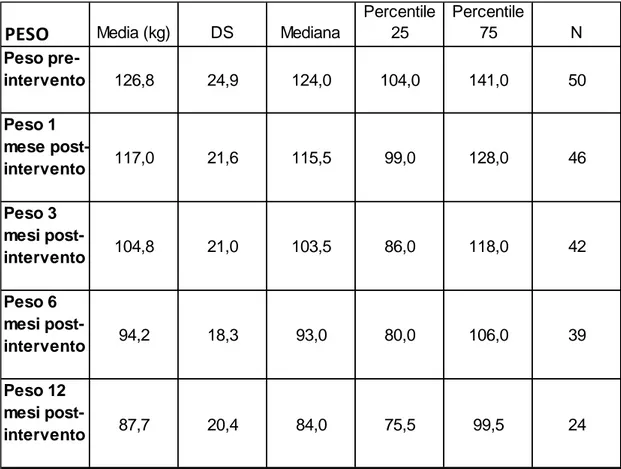
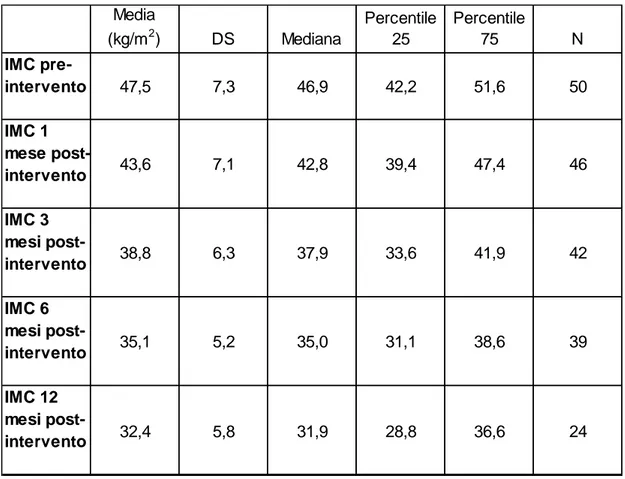
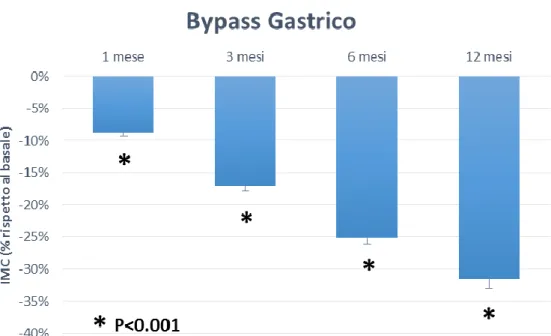
Come atteso, i pazienti operati hanno avuto significative riduzioni di
peso e IMC (p < 0,0001) nel corso del follow-up già a partire dal primo
mese post intervento (tabella 2,3 e figura 6 ).
PESO Media (kg) DS Mediana
Percentile 25 Percentile 75 N Peso pre-intervento 126,8 24,9 124,0 104,0 141,0 50 Peso 1 mese post-intervento 117,0 21,6 115,5 99,0 128,0 46 Peso 3 mesi post-intervento 104,8 21,0 103,5 86,0 118,0 42 Peso 6 mesi post-intervento 94,2 18,3 93,0 80,0 106,0 39 Peso 12 mesi post-intervento 87,7 20,4 84,0 75,5 99,5 24
Tabella 2: calo ponderale medio durante il follow up nei pazienti
Media (kg/m2) DS Mediana Percentile 25 Percentile 75 N IMC pre-intervento 47,5 7,3 46,9 42,2 51,6 50 IMC 1 mese post-intervento 43,6 7,1 42,8 39,4 47,4 46 IMC 3 mesi post-intervento 38,8 6,3 37,9 33,6 41,9 42 IMC 6 mesi post-intervento 35,1 5,2 35,0 31,1 38,6 39 IMC 12 mesi post-intervento 32,4 5,8 31,9 28,8 36,6 24
Tabella 3: modificazione dell’indice di massa corporea (IMC) durante il
Figura 6: variazione dell’indice di massa corporea ( IMC ) espresso
come media ± SEM uno, tre, sei e dodici mesi dopo l’intervento di bypass gastrico. *P<0,001 rispetto al valore di IMC basale.
I livelli basali di IGFBP-2 risultavano (media ± ESM) 179.7 ± 13.53
ng/ml, significativamente ridotti (p<0.0001) rispetto al gruppo di
soggetti di controllo normopeso (406 ± 43.9 ng/ml) paragonabili per età
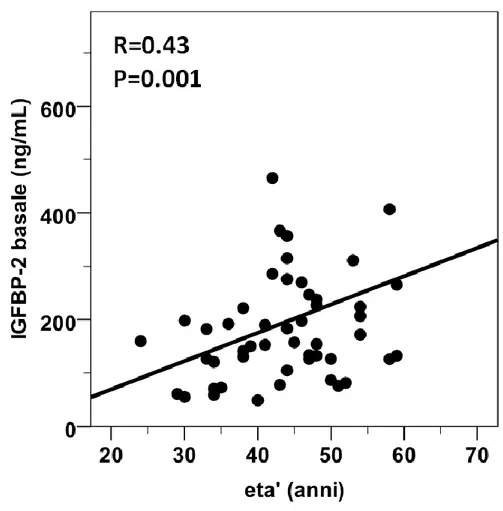
Inoltre i valori basali di IGFBP-2 erano significativamente (p=0.001)
correlati in modo diretto all’eta’ dei pazienti come peraltro gia’ riportato (28) per individui nell’ambito del normopeso. (figura 7)
Figura 7: correlazione fra età e concentrazioni sieriche basali di
Dopo intervento di by pass gastrico, i valori di IGFBP-2 risultavano
aumentati (346.2 ± 34.6 ng/ml) già dopo 3 giorni dalla procedura
chirurgica (p<0.0001) ed ulteriormente incrementati dopo 1-3 mesi
(p<0.0001) raggiungendo valori pienamente normali (467 ± 40 ng/ml)
(tabella 4, figura 8).
Media (ng/ml) Numero pazienti ESM Media % p (2-tailed)
basale 179,7 50 13,5 100 3 giorni 346,2 43 34,6 177 p < 0.0001 1 mese 363,2 39 25,3 188 p < 0.0001 3 mesi 449,2 40 37,2 248 p < 0.0001 6 mesi 484,2 36 33,7 253 p < 0.0001 12 mesi 467,4 22 40 271 p < 0.0001
Tabella 4: variazione delle concentrazioni sieriche di IGFPB 2 dopo
intervento di bypass gastrico nei pazienti arruolati nello studio. ESM = errore standard della media.
Figura 8: concentrazioni sieriche di IGFBP 2 nei pazienti obesi
sottoposti a bypass gastrico ( media ± ESM ). Sono inoltre riportati i valori (media ± ESM ) delle concentrazioni sieriche dell’IGFBP 2 nel gruppo di controllo (n = 15), costituito da soggetti normopeso. *P<0,0001 rispetto al valore pre-intervento.
Questo aumento non si modificava in base al sesso, come del resto non
abbiamo riscontrato apparentemente un dimorfismo sessuale tra i valori
5. DISCUSSIONE
Il ricorso alla terapia chirurgica per l’obesità è stato in costante aumento
nelle ultime decadi per la possibilità di conseguire un calo ponderale
rilevante e stabile nel tempo, con un conseguente miglioramento delle
comorbidità associate (36).
Nel caso di bypass gastrico non sono ancora del tutto chiariti, i
meccanismi che permettono di ottenere questi risultati. Oltre ad una
riduzione dell’ introito calorico dovuta a restrizione gastrica ed a una minima quota malassorbitiva, la spiegazione va ricercata nei
cambiamenti della sintesi dei numerosi ormoni implicati nella
regolazione del metabolismo energetico che conseguono alla chirurgia
(14).
Non vi è dubbio che alcuni degli ormoni che rivestono questo ruolo
debbano ancora essere identificati (16).
Sono sempre maggiori le prove che indicano una funzione dell’IGFBP-2
nella regolazione dell’omeostasi glucidica e lipidica, conferendole un ruolo all’interno del complesso pattern di vie di segnalazione ormonale
Poichè l’iperespressione di IGFBP-2, in modelli di obesità murina, favorisce la perdita di peso ed induce la remissione del diabete (31) è
avvincente studiare l’andamento delle concentrazioni di questa proteina in obesi sottoposti ad intervento di chirurgia bariatrica.
Nel nostro studio, in cui abbiamo analizzato 50 pazienti affetti da
obesità grave sottoposti a bypass gastrico, con un IMC medio di 47,53 ±
7,3 kg/m2, il valore basale medio di IGFBP-2 era di 179,7 ng/ml ±
13,53 , significativamente inferiore al gruppo di controllo normopeso
selezionato e sovrapponibile per età (valore medio 406,5 ± 43,9). In uno
studio effettuato su pazienti con un IMC compreso fra 28 e 32 kg/m2 il
valore basale medio era 300 ng/ml (32,37,38); tutti questi risultati messi
assieme depongono a favore dell’esistenza di una correlazione inversa
fra adiposità e livelli sierici di tale proteina. Questa correlazione dovrà
essere indagata mediante l’ausilio di una metodica accurata di quantificazione del tessuto adiposo.
soggetti di più giovane età, in accordo con quanto descritto nella
letteratura (28).
Un dato estremamente interessante è che nel nostro studio, i livelli
circolanti di IGFBP-2 si innalzano significativamente, già nei primi tre
giorni dopo l’intervento.
Questo aumento in acuto dell’IGFBP-2, che si evidenzia dopo soli tre giorni dalla chirurgia, raggiunge valori paragonabili a quelli dei
normopeso. Teoricamente è possibile che lo stress chirurgico o che il
digiuno che segue l’intervento possano svolgere un qualche ruolo; tuttavia nello studio di Li e coll. le variazioni di IGFBP-2 dopo
interventi chirurgici di altre natura non risultano significative (36).
D’altra parte, l’aumento dell’IGFBP-2 è troppo precoce per poter essere attribuito al calo ponderale e potrebbe dipendere da qualche
modificazione nelle vie di segnalazione ormonali che provengono dal
tratto gastrointestinale.
In alternativa l’aumento acuto dell’IGFBP-2 da noi documentato potrebbe essere mediato dalla leptina che è un induttore della sintesi
modificano sostanzialmente in questa fase, si può ipotizzare che dopo
intervento si verifichi una sensibilizzazione all’azione della leptina.
In studi molto recenti si è dimostrato come l’insulina induca l’espressione dell’IGFBP-2 negli adipociti, attraverso la via PI3K-AKT-mTOR, evidenziando perciò un legame positivo fra i due ormoni,
almeno in alcuni tessuti. L’insulino-sensibilizzazione che consegue alla chirurgia bariatrica potrebbe perciò avere una funzione
nell’incrementare i livelli dell’IGFBP-2: in analogia con quanto detto per la leptina.
Poichè, i soggetti obesi hanno livelli sierici di IGFBP2 più bassi rispetto
alle persone normopeso, e considerato che l’IGFBP-2 ha un ruolo attivo nel favorire il calo ponderale (22,31) è lecito pensare che il rapido
aumento dell’IGFBP-2 dopo chirurgia bariatrica contribuisca a favorire il dimagrimento. Quest’ultimi effetti non dipendono solamente dalla
diminuzione della massa grassa; è probabile che l’IGFBP-2 svolga un ruolo diretto a tale proposito: in topi che iperesprimono l’IGFBP-2 si
dietetica (e conseguente calo ponderale) (31). Da modelli murini si sono
inoltre ottenute dimostrazioni di un ruolo dell’IGFBP-2 nella riduzione della steatosi epatica, con conseguente insulino-sensibilizzazione; dato
che nei pazienti sottoposti a chirurgia bariatrica la steatosi epatica
regredisce (39), la clearance di trigliceridi dall’organo potrebbe essere
favorita dall’IGFBP-2 (22).
Probabilmente, le modificazioni del metabolismo glucidico e lipidico
mediate dall’IGFBP-2 sono indipendenti dall’azione dell’IGF-1, dal momento che, l’aumento dei livelli sierici dell’IGFBP-2 si associa ad una diminuzione della bioattività dell’IGF-1: agendo da proteina legante, l’IGFBP-2 diminuisce la biodisponibilità di tale ormone, sequestrandolo e impedendone il legame ai recettori di membrana. (18)
A questo proposito è da ricordare che i valori sierici di IGF-1, ridotti nei
pazienti obesi, aumentano dopo perdita di peso indotta da bendaggio
gastrico (40).
L’azione di IGFBP-2 richiederebbe la presenza di un recettore specifico la cui esistenza è stata postulata da alcuni autori (24), in questo senso è
Un’altra domanda che sorge dall’analisi dei nostri dati riguarda la sede primaria di secrezione dell’ IGFBP-2, responsabile dell’incremento della concentrazione sierica dopo chirurgia bariatrica. Il fegato è certamente
un organo capace di sintetizzarla ma molti altri organi esprimono la
proteina ( figura 4 ), tra cui anche il tessuto adiposo bianco. Il tessuto
adiposo bianco subisce un marcato rimaneggiamento dopo intervento
bariatrico e numerosi segnali potrebbero convergere a questo livello
stimolando la secrezione di IGFBP-2 (ad esempio la riduzione di
trigliceridi, l’espressione di recettori come incretine, insulina etc).
In conclusione, i pazienti affetti da obesità grave mostrano una marcata
riduzione dei livelli sierici di IGFBP-2. La chirurgia bariatrica determina
un’incremento fino alla normalizzazione dei livelli dell’IGFBP-2, che si mantiene stabile. Alla luce delle recenti dimostrazioni sperimentali,
ottenute in modelli murini, circa gli effetti positivi svolti dall’IGFBP-2 sul metabolismo glucidico (riduzione dell’insulinemia e mantenimento
di una condizione di euglicemia) e lipidico (inibizione dell’adipogenesi e diminuzione della steatosi epatica) (22,31), è probabile che l’IGFBP-2
comprendere interamente quali sono le azioni mediate dall’IGFBP-2; in particolare, il ruolo che svolge nel controllo del metabolismo energetico
nell’uomo e quanto degli effetti positivi ottenuti mediante la chirurgia bariatrica sulla diminuzione del peso in eccesso e sul controllo
dell’omeostasi metabolica, sia da imputare all’innalzamento delle sue concentrazione sieriche. È inoltre fondamentale capire interamente i
meccanismi molecolari alla base delle sue funzioni: l’IGFBP-2 potrebbe,
infatti, avere un ruolo che va ben oltre quello di semplice proteina
legante gli IGFs, agendo attraverso recettori propri, al momento non
noti, e guadagnandosi così il diritto di essere considerata un vero e
6. RIFERIMENTI BIBLIOGRAFICI
1. Malnick SD, Knobler H. The medical complications of obesity. QJM
2006; 99:565–579.
2. Walley A J, Blakemore A I, Froguel P. Genetics of obesity and the
prediction of risk for health. 2006 Hum Mol Genet, 15, Review Issue
No. 2, R124-30
3. http://www.cdc.gov/nccdphp/dnpa/obesity/index.htm
4. Noi Italia: 100 statistiche per capire il Paese in cui viviamo. 2013.
Istituto Nazionale di Statistica.
http://noi-italia.istat.it/fileadmin/NoiItalia2013.pdf
6. Friedman JM. A war on obesity, not the obese. 2003 Science 299,
856
7. Lonut V, Bergman RN. Mechanisms responsible for excess weight
loss after bariatric surgery. J Diabetes Sci Technol. 2011 Sep
1;5(5):1263-1282
8. Sjostrom L., Narbro K., Sjostrom D., Karason K., Larsson B., Wedel
H., Lystig T., Sullivan M., Bouchard C., Carlsson B., Bengtsson C.,
Dahlgren S., Gummesson A., Jacobson P., Karlsson J., Lindroos
A.K., Lonroth H., Naslund I., Olbers T., Stenlof K., Torgerson J.,
Agren G. e Carlsson L. Effects of bariatric surgery on mortality in
swedish obese subjects 2007 NEJM; 357:741-52
9. Standard italiani per la Cura dell’Obesità 2012-2013. Società Italiana
Clinica (ADI). 2012
10. Saber A., Elgamal M., McLeod M. Bariatric surgery: the past,
present and future 2008 Obes Surg. 18:121-128
11. Henry Buchwald, Rhonda Estok, Kyle Fahrbach, Deirdre Banel,
Michael D. Jensen, Walter J. Pories, John P. Bantle, e Isabella
Sledge, Weight and Type 2 Diabetes after Bariatric Surgery:
systematic Review and Meta-analysis. The American Journal of
Medicine 2009; 122, 248-256
12. Cummings DE, Overduin J, Foster-Shubert KE: Gastric Bypass for
obesity: mechanisms of weight loss and diabetes resolution. J Clin
Endocrinol Metab 89; 2608-2615,2004
14. C.N Ochner, C.Gibson, M Shanik, V Goel and A. Geliebter.
Changes in neurohormonal gut peptides following bariatric surgery
2011 International Journal of Obesity 35, 153-166
15. Vetter M.L., Cardillo S., R.Rickels M.R., Iqbal N. Narrative review :
effect of bariatric surgery on type 2 diabetes mellitus Ann Intern Med
2009 ;150 :94-103
16. Rubino F. Is type 2 diabetes an operable intestinal disease ? A
provocative yet reasonable hypothesis. Diabetes Care. 2008 ; 31
(Suppl 2) : S 290-296
17. Rubino F, Forgione A, Cummings D.E., Vix M, Gnuli D, Mingrone G,
Castagneto M. e Marescaux J. The mechanism of diabetes control after gastrointestinal bypass surgery reveals a role of the proximal small intestin in the pathophysiology of Type 2 Diabetes Ann Surg 2006 ;244 :741-749
18. Rajaram S., Baylink D. e Mohan S. Insulin-like growth
factor-binding proteins in serum and other biological fluids: regulation and
functions 1997 Endocrine reviews 18(6):18(6): 801-831
19. Xi G., Solum M.A., Wai C., Maile L., Rosen C.J. e Clemmons D.R.
The Heparin-Binding Domains of IGFBP-2 Mediate Its Inhibitory
Effect on Preadipocyte Differentiation and Fat Development in Male
Mice. Endocrinology 154: 0000-0000, 2013
20. Kuang Z., Yao S., Wang C.C., Bach L.A., Forbes B.E., Wallace J.C.,
Norton R.S. Structure, dynamics and heparin binding of the C-terminal domain of insulin-like growth factor-binding protein-2 (IGFBP-2) J Mol Biol. 2006 Dec 8; 364(4):690-704. Epub 2006 Sep 7
21. Kiefert M.C., Masiarz F.R., Bauer D.M. e Zapf J. Identification and molecular cloning of two new 30-kDa insulin-like growth factor binding proteins isolated from adult human serum. The journal of biological chemistry 266 May 15; 9043-9049, 1991.
22. Hedbacker K., Birsoy K., Wysocki R.W., Asilmaz E., Ahima R.S., Farooqi I.S. e Friedman J.M. Antidiabetic effects of IGFBP2, a Leptin-Regulated Gene. Cell Metab 2010;11:11-22
23. Frommer K.W., Reichenmiller K., Schutt B.S., Hoeflich A., Ranke
M.B., Dodt G. e Elmlinger M.W. IGF-indipendent effects of
IGFBP-2 on the human breast cancer cell line Hs578T IGFBP-2006 Journal of
molecular endocrinology 37,12-23
24. Wheatcroft S.B. e Kearney M.T. dependent and
metabolic homeostasis 2009 Trends in Endocrinology and
Metabolism 20 n 4
25. Boney CM, Moats Staats BM, Stiles AD, D’Ercole AJ. Expression of
insulin-like growth factor – 1 (IGF-I) and IGF- binding proteins
during adipogenesis. Endocrinology 1994; 135:1863-1868
26. Li Z, Picard F. Modulation of IGFBP-2 mRNA expression in white
adipose tissue upon aging and obesity. Horm Metab Res 2010; 42:
787-791
27. www.genecards.org/cgi-bin/carddisp.pl?gene=IGFBP2
28. Schwander J, Mary Jl The RIA for IGFBP-2 in man- a meagre
possible marker for the metabolic syndrome? Acta Diabetol 2010
47:5-14
30. Sanghera D.K., Ortega L., Han S., Singh J., Ralhan S.K., Wander
G.S., Mehra N.K., Mulvihill J.J., Ferrel R.E., Nath S.K e Kamboh
M.I. Impact of nine common type 2 diabetes risk polymorphism in
Asian Indian Sikhs: PPARG2 (Pro12Ala), IGFBP2, TCF7L2 and
FTO variants confer a significant risk 2008 BMCMedical Genetics
9-59
31. Wheatcroft S.B., Kearney M.T., Shah A.M., Ezzat V. E., Miell J.R.,
Modo M., Williams S.C.R., Cawthorn W.P., Medina-Gomez G.,
Vidal-Puig A., Sethi J.K. e Crossey P.A. IGF-binding protein-2
protects against the development of obesity and insulin resistance.
Diabetes 2007; 56:285-294
32. Frystyk J., Skjærbæk C., Vestbo E., Fisker S. e Ørskov H.
subjects: the impact of type 2 diabetes. Diabetes Metab Res Rev
1999; 15:314-322
33. Martin R.M., Holly J.M.P., Smith G.D e Gunnel D. Associations of
adiposity from childhood into adulthood with Insulin Resistance and
the Insulin-like growth factor system: 65-year follow-up of the Boyd
Orr Cohort 2006 JCME 91: 3287-3295
34. Lee CY., Wu H., Suh D., Rechler MM., Insulin-Like Growth
Factor-I (Factor-IGF-1) concentration in 150-kDa complexes containing human
IGFBP-3 after intravenous injection of adult rats with hIGFBP-3.
1997 Endocrinology 138: 1649–1657
35. Li Z., Martin J., Poirier P., Caron-Cantin S-M., Hould F-S., Marceau
S., Marceau P. e Frederic Picard Upregulation of Plasma Insulin-like
36. Lunca S., Pertea M., Bouras G., Dumitru L e Hatjissalatas S.G.
Morbid Obesity: a surgical perspective Romanian Journal of
Gastroenterology June 2005 Vol. 14 N.2 151-158
37. Arafat AM., Weickert M.O., Frystyk J., Spranger J., Schofl C.,
Mohlig M. e Pfeiffer A. The role of insulin-like growth factor (IGF)
binding protein-2 in the insulin-mediated decrease in IGF-1
bioactivity. J Clin Endocrinol Metab 2009; 94: 5093-5101
38. Heald AH., Kaushal K., Siddals KW., Rudenski A.S., Anderson S.G.
e Gibson J.M. Insulin-like growth factor binding protein-2
(IGFBP-2) is a marker for the metabolic syndrome. Exp Clin Endocrinol
Diabetes 2006;114;371-376
39. Giannetti M, Piaggi P, Ceccarini G, Mazzeo S, Querci G,
Fierabracci P, Salvetti G, Galli G, Ricco I, Martinelli S, Di Salvo S,
Anselmino M, Landi A, Vitti P, Pinchera A and Santini F. Hepatic
obese women after gastric banding. International Journal of Obesity
(2011) 1 – 5
40. Galli G., Pinchera A., Piaggi P., Fierabracci P., Giannetti M., Querci
G., Scartabelli G., Manetti L.,Ceccarini G., Martinelli S., Di Salvo
C., Anselmino M., Bogazzi F., Landi A., Vitti P., Maffei M., Santini
F.,Serum insulin-like growth factor-1 concentrations are reduced in
severely obese women and raise after weight loss induced by
laparoscopic adjustable gastric banding. Obesity Surgery August
RINGRAZIAMENTI
Giunta al termine di questo lavoro, vorrei ringraziare tutte le persone
che, in modi diversi, mi hanno aiutata ad arrivare a questo importante
risultato:
Il Professor Paolo Vitti, che mi ha permesso di svolgere il lavoro di tesi
in un centro di così alto livello formativo.
Il Professor Ferruccio Santini, che mi ha dato preziosi consigli per lo
svolgimento di questo lavoro e che, con la sua grande professionalità e
umanità, mi ha sempre pazientemente aiutata e sostenuta con estrema
gentilezza.
Il Dottor Giovanni Ceccarini, per l’immensa disponibilità, senza la quale non sarebbe stata possibile la realizzazione di questo lavoro e che mi ha
supportata sia dal punto di vista professionale che umano.
Tutto il "gruppo obesità", in particolare i dottori Alessio Basolo e Paolo
Piaggi e le dottoresse Caterina Pelosini, Ilaria Ricco, Silvia Martinelli,
Anna Tamberi, Silvia Magno, Giorgia Querci per il loro sostegno e per
il contributo alla realizzazione di questa tesi.
Vorrei inoltre ringraziare di cuore :
I miei genitori, che mi hanno da sempre aiutata e sostenuta in ogni
lezioni e avermi sempre ascoltata..lo sai..questa laurea è anche un pò
tua.
Mia sorella Alessia..i motivi sono troppi..come farei senza di te ??
I miei nonni, Elide e Olinto per l’affetto incondizionato che mi hanno
sempre dimostrato.
La mia grande amica Silvia, con cui ho trascorso moltissime serate
divertenti e che mi è sempre stata accanto, sostenendomi e credendo in
me.
Nicoletta, Andrea e Francesca, miei amici da sempre.
Rossella : ti ho conosciuta in questi anni universitari e sei diventata
davvero un’ Amica.
Le mie conquiline Elisa, Sylvia, Laura ed in particolare Eleonora con cui
mi sono trovata a condividere le gioie ed i dolori della "vita pisana"..
uniche le nostre serate "fra conquiline".
E infine, grazie a Angela, Mariagrazia, Alice, Anna, Francesca, Sara,
Eleonora, Elisa, Carlotta, Linda e a tutte le altre amiche e amici con cui
ho condiviso paure e angosce, ma anche le tante gioie e le serate
divertenti di questa meravigliosa esperienza di vita che ha rappresentato