1. RIASSUNTO
La patologia nodulare tiroidea e’ frequente, e nei paesi dove la carenza alimentare di iodio è stata corretta, come negli Stati Uniti, noduli tiroidei clinicamente manifesti sono presenti nel 4-7% della popolazione generale. La frequenza di noduli tiroidei non manifesti clinicamente, rilevabili solo ecograficamente, è superiore al 50% nelle donne di età superiore a 60 anni. La maggior parte dei noduli tiroidei e’ benigna, seppur con grandi differenze tra casistiche cliniche e chirurgiche e la percentuale di malignità varia fra l’8 e il 20%.
Il carcinoma della tiroide rappresenta circa l’1% di tutte le neoplasie maligne dell’adulto e prevale nella seconda, terza e quarta decade di vita. Con il termine di carcinoma tiroideo differenziato (CTD) si intendono le neoplasie maligne ad origine dall’epitelio follicolare della tiroide a morfologia papillare (circa l’80%) e/o follicolare (circa il 20%).
Tenendo conto che la mortalità legata al cancro della tiroide è molto bassa la diagnosi quanto più accurata della natura dei noduli è
un elemento indispensabile per la corretta impostazione della strategia terapeutica. Pertanto di fondamentale importanza nella patologia nodulare tiroidea riveste la distinzione fra noduli benigni e noduli maligni resa possibile dalla FNAC (Fine Needle Aspiration Citology). Purtroppo come per altri settori della diagnostica, anche per la FNAC la presenza di falsi positivi e di falsi negativi ne rappresenta i limiti. Il problema esiste per le forme follicolari ben differenziate, spesso minimamente invasive; l’esame citologico non riesce a cogliere caratteri morfologici indicativi di neoplasia maligna e, per sua natura, non può dare informazioni circa la capacità di infiltrare del tumore, dimostrabile solo all’esame istologico. In molti di questi casi si ricorre ad una diagnosi piuttosto generale di “neoplasia follicolare” da controllare con l’esame istologico. D’altra parte in molti studi retrospettivi la frequenza di carcinoma nei noduli con citologia “di neoplasia follicolare o di nodulo microfollicolare” è variabile dal 12 al 42% a seconda delle diverse casistiche. In altre situazioni la FNAC non risulta conclusiva a causa dell’esiguità del materiale prelevato dal nodulo e in questo caso si parla di “esame citologico inadeguato”. Da qui è nata la necessità di ricorrere a sperimentare nuove metodiche
diagnostiche da integrare alla FNAC nella valutazione della patologia nodulare tiroidea. Negli ultimi anni la biologia molecolare ha ampiamente dimostrato che i recettori tirosino-chinasici giocano un ruolo importante nella patogenesi del cancro della tiroide. I riarrangiamenti di RET/PTC sono stati trovati in circa il 40% dei casi di PTC (Carcinoma Papillare della Tiroide) spontaneo e in una percentuale superiore nei carcinomi tiroidei radioindotti. I riarrangiamenti di TRK sono invece presenti in circa il 10% dei casi di PTC. Più recentemente sono state descritte mutazioni puntiformi attivanti BRAF nell’esone 15.
Sulla base di questi primi risultati e allo scopo di valutare la possibilità di utilizzare la biologia molecolare per l’analisi del materiale agoaspirato dai noduli tiroidei, al fine di ottenere una diagnosi pre-chirurgica più accurata, abbiamo eseguito l’analisi della mutazioni di BRAF, dei riarrangiamenti RET/PTC e di TRK nel materiale ottenuto da un “singolo agoapirato”.
Abbiamo raccolto un totale di 100 casi consecutivi di campioni di materiale agoaspirato da noduli tiroidei su cui era gia’ stato effettuato un primo esame citologico ed erano risultati noduli “a
citologia indeterminata/non diagnostica” o “ acitologia inadeguata” e su questi campioni abbiamo effettuato l’analisi molecolare e ripetuto l’esame citologico. Come controllo abbiamo utilizzato 15 campioni di materiale agoaspirato da noduli tiroidei di pazienti con diagnosi accertata di PTC. La FNA (Fine Needle Aspiration) e’ stata eseguita in tutti i pazienti dallo stesso operatore. Il materiale ottenuto da un “singolo agoaspirato”, e’ stato in parte strisciato su uno o piu’ vetrini e in parte e’ stato incluso in un tampone appropriato per la successiva estrazione di RNA, lavando l’ago con cui e’ stata effettuata la FNA nello stesso tampone. L’RNA estratto e’ stato poi retrotrascritto in cDNA ed utilizzato per lo studio dei riarrangiamenti RET/PTC1, RET/PTC3, TRK e per l’esone 15 di BRAF. Abbiamo valutato la prevalenza e la distribuzione delle mutazioni di RET/PTC1, RET/PTC3, TRK e di BRAF sul materiale ottenuto dalla FNA dei noduli tiroidei, complessivamente in 49 casi di PTC e 66 NTB, definiti tali sulla base della diagnosi istologica. Abbiamo riscontrato che il 40% dei casi di PTC preenta un’alterazione molecolare e la mutazione di BRAFV600E rappresenta circa il 50% di tutte le mutazioni descritte. Al contrario solo il 6% dei casi di NTB presenta
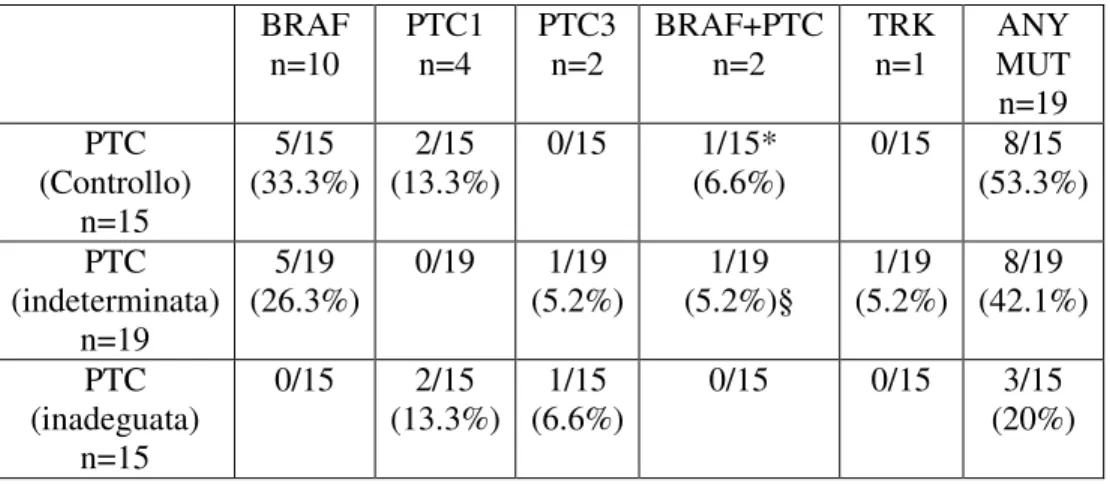
un’alterazione molecolare e in particolare in questo gruppo non e’ stata osservata alcuna mutazione di BRAFV600E.Abbiamo poi analizzato la prevalenza e la distribuzione delle alterazioni molecolari nei 49 casi di PTC in accordo alla diagnosi citologica. Nel gruppo dei 15 casi di PTC con diagnosi accertata di PTC e usati come gruppo di controllo la frequenza totale di alterazioni geniche era del 53,3%, con una netta prevalenza di BRAFV600E (33,3%). In questo gruppo non sono stati trovati riarrangiamenti RET/PTC3 E TRK. Nel gruppo dei PTC (19 casi) che erano risultati “indeterminati” alla citologia la frequenza totale delle alterazioni geniche (42,1%) era inferiore a quella riscontrata nel gruppo precedente, ma anche in questo caso si osservava una netta prevalenza di BRAFV600E (26,3%). Nella serie di campioni di PTC per i quali la diagnosi citologica non era stata posta a causa dell’inadeguatezza del materiale (15 casi) e risultati PTC all’esame istologico, la frequenza totale delle alterazioni geniche era molto bassa (20%) e la mutazione BRAFV600E era completamente assente. Abbiamo poi voluto analizzare la distribuzione delle alterazioni molecolari sulla base della variante istologica. In particolare dei 49 casi con diagnosi istologica di PTC 25 (51%) erano PTC variante
classica, 19 (38,8%) PTC variante follicolare e in soli 5 casi (10,2%) erano presenti le varianti piu’ rare (3 casi di PTC a cellule alte e 2 casi di PTC a cellule trabecolari/solide). Abbiamo riscontrato la piu’ alta prevalenza di alterazioni molecolari in questo ultimo gruppo di casi (5/49), in particolare la mutazione piu’ frequente era la BRAFV600E (40%). I riarrangiamenti RET/PTC1 e RET/PTC3 erano presenti in 1/5 casi (20%) rispettivamente. Confrontando il gruppo di PTC variante classica con quello di PTC variante follicolare abbiamo osservato che mutazioni di BRAF erano presenti in 6/25 casi (24%) della variante classica e in 2/19 casi (10.5%) della variante follicolare, mutazioni di di RET/PTC1 erano presenti in 2/25 (8%) della variante classica e in 6/25 (1,5%) della variante follicolare. Per quanto concerne le mutazioni di RET/PTC3 , non abbiamo riscontrato alcuna mutazione nel gruppo dei casi a variante classica e solo in 1/19 casi (5,26%) della variante follicolare.
I nostri risultati mostrano che nel gruppo dei casi di carcinoma papillare utilizzato come controllo la frequenza di alterazioni genetiche è paragonabile a quella osservata nelle casistiche in cui lo studio viene eseguito su tessuto fresco dimostrando che la ricerca delle mutazioni
eseguita sul liquido di lavaggio dell’agoaspirato è una metodica sensibile e specifica. Osservando la frequenza delle alterazioni geniche nei PTC individuati all’istologia nel gruppo di casi con citologia inadeguata emerge che questa è simile (42,1%) a quella ottenuta nei casi di controllo (53,3%). Inoltre in entrambi i casi l’alterazione molecolare più frequente è quella di BRAFV600. Quindi anche in questo gruppo caratterizzato da un’alta frequenza di varianti follicolari, il materiale raccolto consente di effettuare correttamente l’analisi molecolare.
Da questo studio quindi emerge che la biologia molecolare, ed in particolare l’analisi delle varie alterazioni oncogeniche, è sicuramente applicabile, con risultati attendibili, a campioni derivanti dal liquido di lavaggio dell’agoaspirato tiroideo utilizzato per l’esame citologico.L’analisi che noi abbiamo messo a punto è sicuramente applicabile in tutti i casi e la presenza di alterazioni molecolari nei campioni deve porre un dubbio sulla natuta maligna del campione anche quando l’analisi citologica non ponga una diagnosi certa di malignità. Un limite di questa metodica è rappresentato dai casi in cui il campione risulta inadeguato anche alla citologia. In questi casi infatti
la presenza di un ridotto numero di cellule o di cellule degradate non permette di eseguire un’accurata analisi molecolare. In questi casi l’unica diagnosi possibile rimane quella istologica.
2. INTRODUZIONE
2.1 Il carcinoma tiroideo differenziato2.1.1 Epidemiologia
Il carcinoma della tiroide rappresenta circa l’1% di tutte le neoplasie maligne dell’adulto e prevale nella seconda, terza e quarta decade di vita. La sua incidenza è andata aumentando dal 2,4 per 100.000 abitanti riportata negli anni ‘40-‘50 fino a 10 per 100.000 delle più recenti casistiche (1-3). Tuttavia la mortalità annua per cancro della tiroide è relativamente bassa ed è compresa tra 0,2 e 1,2 per 100.000 persone negli uomini e tra 0,4 e 2,8 per 100.000 persone nelle donne. Nella maggior parte dei Paesi la mortalità è due volte più elevata nelle femmine che nei maschi (4). Il carcinoma tiroideo si riscontra in circa il 3-4% dei noduli tiroidei la cui incidenza è del 5-10% nella popolazione generale (5-7). In casistiche chirurgiche, non selezionate sulla base della citologia preoperatoria, la percentuale di malignità aumenta fino all’8-20% di tutti i noduli sottoposti a tiroidectomia (8,9) ed in casistiche autoptiche varia dal 6 al 35,6% (10-13).
Le neoplasie maligne tiroidee sono più frequenti nelle aree ad endemia gozzigena e l’esposizione a radiazioni ionizzanti, particolarmente durante l’infanzia e l’adolescenza, rappresenta il maggior fattore di rischio ad oggi noto (12). A conferma di quanto detto, un drammatico e progressivo aumento dell’incidenza dei carcinomi tiroidei di tipo papillare è stato riscontrato nelle regioni della Bielorussia e dell’Ucraina colpite dal fall-out radioattivo successivo al disastro nucleare di Chernobyl del 1986 (14,15).
Circa l’ 80-85% dei tumori maligni della tiroide sono carcinomi differenziati, la cui prognosi è generalmente favorevole. Gli altri tipi di cancro sono meno frequenti e sono rappresentati dai carcinomi anaplastici (5%), dai carcinomi midollari (10%) e dai linfomi primitivi della tiroide (1-2%).
Con il termine di carcinoma tiroideo differenziato (CTD) si intendono le neoplasie maligne ad origine dall’epitelio follicolare della tiroide a morfologia papillare e/o follicolare, che mantengono le caratteristiche di differenziazione tipiche del tessuto tiroideo normale (TSH dipendenza, sintesi di tireoglobulina, capacità iodocaptante). Il carcinoma papillare e follicolare rappresentano circa l’80% e il 20%
rispettivamente delle forme ben differenziate, colpiscono tutte le fasce di età, con un picco di incidenza tra la terza e la sesta decade di vita ed hanno una netta prevalenza per il sesso femminile nell’adulto (F:M=4:1), mentre nei bambini il rapporto femmine/maschi è quasi uguale all’unità. Nell’ambito dei carcinomi papillari si distingue una variante istologica classica che rappresenta circa il 70% dei casi diagnosticati (16); essa è caratterizzata da papille formate da un asse connettivo vascolare rivestito di cellule con un nucleo di aspetto tipico (Figura 1).
La variante follicolare interessa soprattutto soggetti giovani e rappresenta il 20% circa dei carcinomi papillari diagnosticati nell’infanzia in Bielorussia dopo l’incidente di Chernobyl (17,18) (Figura 2).
Si riconoscono poi le forme diffuse sclerosanti che colpiscono soprattutto bambini e giovani adulti (19) e le varianti a cellule alte o cilindriche, tipiche dei soggetti anziani (20) (Figura 3).
Anche nel carcinoma follicolare si distingue una variante istologica classica, quella a cellule chiare, quella a cellule ossifile (o a cellule di Hurthle) e infine i carcinomi insulari.
2.1.2 Comportamento biologico
Il carcinoma papillare ha la tendenza a rimanere localizzato nella ghiandola tiroidea e, quando metastatizza, si diffonde localmente alle stazioni linfoghiandolari cervicali e del mediastino superiore. Talora, i linfonodi sede di metastasi, sono di dimensioni superiori rispetto al tumore primitivo, che può non essere rilevato alla palpazione. Da un punto di vista prognostico, ancora più grave della diffusione linfatica è il superamento della capsula tiroidea, e, seppur raramente, il tumore può giungere sino all’invasione di importanti strutture adiacenti quali esofago, trachea e nervo laringeo ricorrente. Per via ematogena il tumore può diffondere più frequentemente ai polmoni e alle ossa. Nel 40-50% dei casi circa il carcinoma papillare presenta focolai multipli in uno o entrambi i lobi tiroidei (21-24).
Il carcinoma papillare è un tumore che cresce assai lentamente ed è certamente uno dei carcinomi a prognosi più favorevole (sopravvivenza a 5, 10, 20 anni del 95, 90, 83% rispettivamente) (25); ciò nonostante la potenzialità di questo tumore di trasformarsi nel
tempo in una neoplasia a malignità di grado più elevato non può essere trascurata (26-28).
L’istotipo follicolare rappresenta circa il 10% dei carcinomi tiroidei e predilige la fascia di età tra i 30 e i 50 anni. Anch’esso è un tumore a lenta crescita e con prognosi relativamente favorevole; è comunque più aggressivo e pericoloso del carcinoma papillare ed è, al pari di quest’ultimo, più frequente nelle donne. La diffusione del tumore avviene prevalentemente per via ematogena localizzandosi preferibilmente a livello di polmoni e ossa dove provoca lesioni osteolitiche soprattutto a carico del cingolo scapolo-omerale, dello sterno e del cranio. Sebbene più raramente, anche il parenchima cerebrale e il fegato possono essere sede di lesioni secondarie.
2.1.3 Terapia
Benché il CTD abbia una lenta evoluzione con una prognosi generalmente buona, non va dimenticato che resta una neoplasia potenzialmente letale, soprattutto in quel 20% dei casi che si dedifferenziano nel tempo, perdendo sia la capacità di produrre tireoglobulina che quella di captare il radioiodio. Pertanto il trattamento
iniziale deve essere il più radicale possibile e deve tendere ad ottenere una guarigione definitiva, una bassa incidenza di recidive locali e di metastasi a distanza, ed un’ottima qualità della vita, evitando complicanze iatrogene (29-31).
Benché vi siano ancora delle controversie, la terapia iniziale del CTD consiste in una tiroidectomia totale o “quasi totale” (una lobectomia e istmectomia totale della parte del tumore e una lobectomia parziale del lobo controlaterale), associata alla dissezione linfonodale solo nei casi di evidente coinvolgimento linfonodale. Una chirurgia radicale riduce notevolmente il rischio di recidive, specialmente se accompagnata dalla terapia radiometabolica con 131I che ha lo scopo di ablare il tessuto tiroideo residuo. L’ablazione post-chirurgica del residuo tiroideo con 131I si basa sulla conservata capacità delle cellule tiroidee neoplastiche di captare e organificare lo iodio per la sintesi ormonale. In una ampia casistica di carcinomi tiroidei raccolta presso la Ohio University è stato chiaramente dimostrato che i pazienti affetti da CTD e trattati con tiroidectomia totale, terapia radioablativa con 131I e terapia soppressiva con l-tiroxina erano quelli con minor rischio di recidiva e/o persistenza di malattia (32). Il
razionale dell’ablazione del residuo tiroideo può essere riassunto in 3 punti: diminuisce la frequenza di recidive e, secondo alcuni, anche la mortalità, eradicando foci microscopici del tumore all’interno del tessuto tiroideo residuo (33); facilita la scoperta precoce di recidive da parte del dosaggio della tireoglobulina circolante (Tg) e della scintigrafia totale corporea con 131I, grazie all’eliminazione dell’interferenza del residuo tiroideo normale (34); la scintigrafia corporea totale eseguita sfruttando la radioattività della dose ablativa permette di svelare metastasi locali e/o a distanza non rilevabili al momento dell’intervento chirurgico (35). La terapia radiometabolica con 131-I è la terapia di scelta anche per le lesioni metastatiche, almeno fin quando sono in grado di captare lo iodio. Trattamenti ripetuti con 131I possono essere eseguiti ogni 6-12 mesi fino alla guarigione. Quando le metastasi perdono la capacità di captare lo iodio occorrerà intervenire con altri approcci terapeutici di tipo chirurgico e/o chemioterapico e/o radioterapico a seconda del caso (35).
2.1.4 Fattori prognostici
I pazienti con CDT hanno un’alta probabilità di guarigione completa e una bassa probabilità di recidiva. Tra i fattori prognostici più importanti che influenzano sia la frequenza di recidiva che la morte, seppur rara, sono stati identificati: l’età del paziente all’insorgenza del tumore; le dimensioni del tumore primitivo; la presenza di invasione extratiroidea e di metastasi a distanza; le metastasi linfonodali presenti all’esame iniziale non aumentano il rischio di mortalità per CTD ma aumentano il rischio di recidiva locale e regionale (30,31;36-39).
2.2 Nodulo tiroideo e cancro della tiroide
Come già detto precedentemente la maggior parte dei noduli tiroidei sono benigni, seppur con grandi differenze tra casistiche cliniche e chirurgiche; nelle casistiche cliniche, meno del 5% dei noduli tiroidei sono carcinomi, mentre nelle casistiche chirurgiche, non selezionate sulla base della citologia preoperatoria, la percentuale di malignità varia fra l’8 e il 20% (8,10).
I noduli tiroidei sono frequenti e nei paesi dove la carenza alimentare di iodio è stata corretta, come negli Stati Uniti, noduli tiroidei clinicamente manifesti sono presenti nel 4-7% della popolazione generale (40). La frequenza di noduli tiroidei non manifesti clinicamente, rilevabili solo ecograficamente, è superiore al 50% nelle donne di età superiore a 60 anni; analogamente, nelle casistiche autoptiche, l’incidenza di noduli tiroidei in ghiandole apparentemente normali, raggiunge e talora supera il 50% (41,42). In un paese come l’Italia dove persiste una lieve o moderata carenza iodica, il trattamento chirurgico di tutti i noduli tiroidei, senza alcuna selezione, porterebbe ad operare centinaia di migliaia o più di pazienti. Pertanto, come detto in precedenza, tenendo conto che la mortalità legata al cancro della tiroide è molto bassa e che solo una piccola frazione di noduli tiroidei e’ maligna, è assolutamente necessario limitare gli interventi chirurgici attraverso una rigorosa selezione pre-chirurgica. La diagnosi quanto più accurata della natura del nodulo è quindi un elemento indispensabile per la corretta impostazione della strategia terapeutica. Pertanto un’importanza fondamentale nella patologia nodulare tiroidea riveste la distinzione fra noduli maligni e
benigni. I consueti criteri di indagine clinica, quali l’anamnesi, l’esame obiettivo e le indagini di laboratorio, non consentono il completo inquadramento diagnostico della lesione nodulare. Verso la metà del secolo scorso alcuni autori scandinavi suggerirono di definire la natura dei noduli tiroidei attraverso l’analisi microscopica di materiale citologico pelevato direttamente dalla lesione mediante aspirazione con un ago sottile (FNA: Fine Needle Aspiration) (40,43). Dopo un periodo di scetticismo da parte della comunità scientifica internazionale, la metodica venne universalmente applicata, diventando al giorno d’oggi uno strumento diagnostico insostituibile. Come per altri test diagnostici, l’efficacia dell’esame citologico dipende dall’esperienza dell’operatore e dall’adeguatezza del campione (44). Ove eseguito correttamente e interpretato da un citologo esperto, questo esame permette la diagnosi della natura dei noduli tiroidei con un elevato grado di sensibilità e specificità, tanto che l’introduzione della FNA nella pratica clinica ha permesso di ridurre drasticamente il numero degli interventi chirurgici. Nel caso di lesioni nodulari non palpabili il prelievo può essere guidato dalla localizzazione del nodulo mediante
esame ecografico. L’esame citologico pertanto rappresenta un eccellente metodo per definire la natura dei noduli della tiroide (42-45). I principali quadri microscopici rilevabili all’esame citologico del materiale agoaspirato mediante ago sottile dai noduli tiroidei, sono riportati in Fgura 4.
L’uso sistematico della FNA riduce del 35-75% il numero dei pazienti operati per nodulo tiroideo e aumenta di 2-3 volte il numero dei tumori maligni, fra i noduli operati.
Come per altri settori della diagnostica, anche per la FNA la presenza di falsi positivi e di falsi negativi ne rappresenta i limiti: una errata diagnosi di cancro può determinare un intervento radicale non necessario, mentre tumori maligni possono sfuggire alla identificazione. La diagnosi falsamente negativa è uno dei problemi principali in medicina. Per quanto concerne il nodulo tiroideo l’errore riguarda essenzialmente il carcinoma follicolare non distinguibile, per caratteristiche strutturali e biologiche, dall’adenoma. Il problema esiste in particolare per le forme follicolari ben differenziate, spesso minimamente invasive: l’esame citologico non riesce a cogliere caratteri morfologici indicativi di neoplasia maligna e, per sua natura,
non può dare informazioni circa la capacità di infiltrare del tumore, dimostrabile solo all’esame istologico. In molti di questi casi si ricorre ad una diagnosi piuttosto generale di “neoplasia follicolare o di nodulo microfollicolare” da controllare con l’esame istologico. D’altra parte in molti studi retrospettivi la prevalenza di carcinoma nei noduli con citologia di “neoplasia follicolare o di nodulo microfollicolare” è variabile dal 12 al 42% a seconda delle diverse casistiche (Figura 5). Anche nella casistica di questo Dipartimento il 18,7% dei noduli a citologia follicolare risulta maligno all’istologia. L’eta’ e il sesso dei pazienti, le caratteristiche palpatorie del gozzo, il carattere uni o multinodulare e l’aspetto ecografico del nodulo non rappresentano criteri attendibili per discriminare la natura benigna o maligna della neoformazione. Solo la presenza o l’assenza all’ecografia dell’alone periferico del nodulo puo’ fornire una modesta indicazione sulla natura benigna o maligna del nodulo stesso. Il riscontro di atipie cellulari all’esame citologico del nodulo aumenta la probabilita’ che il nodulo possa essere un carcinoma; tuttavia il mancato rilievo di atipie cellulari all’esame citologico non permette di escludere la natura maliga della lesione. Pertanto in presenza di “citologia follicolare” e’ indicata la
terapia chirurgica del nodulo tiroideo indipendentemente dalle sue caratteristiche cliniche e citologiche. Di conseguenza è nata la necessità di ricorrere e sperimentare nuove metodiche diagnostiche da integrare alla FNA nella valutazione della patologia nodulare tiroidea.
2.3 Oncogeni e tumori della tiroide
Lo sviluppo del carcinoma tiroideo richiede il verificarsi di molteplici eveni genetici: puo’ trattarsi dell’attivazione di oncogeni o dell’inattivazione di geni oncosoppressori. La maggior parte delle alterazioni geniche esercita un’azione oncogena attraverso l’attivazione della via MAP chinasica (mitogen-activated protein kinase) che include RET→ Ras→Raf→MAP chinasi. L’attivazione di questa via è infatti un importante meccanismo nella genesi e nella progressione tumorale poiché stimola la divisione e la proliferazione cellulare (46). Alterazioni a carico di ognuno di questi oncogeni è sufficiente ad iniziare la trasformazione tumorale della cellula follicolare della tiroide.
L’oncogene Ras codifica per proteine G monomeriche che attivano l’attività adenilato-ciclasica e i canali del calcio. Le mutazioni di Ras
sono state riscontrate prevalentemente nella serie follicolare ma sia negli adenomi che nei carcinomi e pertanto Ras è definito un oncogene precoce della trasformazione tiroidea. L’attivazione dell’oncogene Ras per mutazioni puntiformi è presente in circa il 40% dei tumori tiroidei benigni e maligni e può essere considerata l’alterazione genica più frequente (47). Nei tumori della tiroide sono state ritrovate mutazioni dei tre geni Ras (Ki-, H- e N-Ras) con frequenza simile. Mutazioni di questi geni sono a carico dei codoni 12, 13 e 61. Il gene Ras mutato stimola la proliferazione cellulare e inibisce la differenziazione delle cellule follicolari determinando la perdita o l’attenuata espressione dei marcatori della differenziazione, quali la tireoglobulina, la tireoperossidasi e la captazione dello iodio.
Rispetto a Ras , il proto-oncogene RET è coinvolto nella tumorigenesi tiroidea molto più frequentemente e la sua attivazione è stata descritta solo nell’istotipo papillare (PTC) (48). Il proto-oncogene RET è localizzato sul cromosoma 10 e codifica per un recettore di membrana con attività tirosino-chinasica. Il gene è espresso in varie linee cellulari neuronali, nelle cellule C della tiroide e nella midollare del surrene ma non nelle cellule follicolari della tiroide. L’attivazione di RET nel PTC
è conseguente a riarrangiamenti genici che portano il dominio tirosino-chinasico di questo recettore sotto il controllo di geni ubiquitariamente espressi con conseguente espressione di questa chimera nella tiroide. Fino ad oggi sono state identificate almeno 10 forme attivate del proto-oncogene RET. La proteina derivante dalla fusione è localizzata nel citoplasma e non nella membrana plasmatica (49, 50). Tre sono i riarrangiamenti più frequenti presenti soprattutto nei PTC e in alcuni adenomi benigni. La loro frequenza, escludendo i tumori con storia di esposizione a radiazioni, varia tra il 2,5 e il 59%, a seconda delle casistiche (Figura 6) (51).
RET/PTC1 è il risultato di un riarrangiamento intracromosomico nel cromosoma 10 che porta alla fusione del dominio tirosino-chinasico di RET con la porzione regolatrice di un gene ubiquitario chiamato H4 la cui funzione non è ancora nota (52).
RET/PTC2 deriva invece da un riarrangiamento intercromosomico con fusione del dominio tirosino-chinasico di RET sul cromosoma 10 con un gene localizzato sul cromosoma 17 che codifica per la subunità regolatoria R1a della protein chinasi A (53).
RET/PTC3 è infine il risultato di un riarrangiamento intracromosomico nel cromosoma 10 con fusione del dominio tirosino-chinasico di RET con un gene chiamato ELE 1 la cui funzione non è ancora nota (54).
L’attivazione del proto-oncogene TRK, localizzato nel cromosoma 1 e codificante un recettore di membrana con dominio tirosino-chinasico, avviene attraverso un riarrangiamento genico. Sono stati identificati 4 tipi di riarrangiamenti in cui si ha la fusione del dominio C-terminale di TRK con la regione 5’ di un gene ad espressione ubiquitaria con l’attivazione costitutiva dell’oncogene. Questi sono presenti nei carcinomi tiroidei papillari con una frequenza compresa tra lo 0 e il 10%. Ad oggi, l’oncogene associato alla forma anaplastica è p53. Mutazioni puntiformi di questo “oncosoppressore” sono state infatti riscontrate prevalentemente nelle forme sdifferenziate e anaplastiche suggerendo un ruolo di queste mutazioni nella progressione finale verso forme completamente indifferenziate (Figura 7).
L’ultimo oncogene facente parte della via MAPK e descritto più recentemente è BRAF. Le proteine della famiglia Raf sono protein-chinasi che fanno parte della cascata di attivazione della via
RAS→RAF→MEK→ERK/MAP chinasi e hanno un ruolo centrale nella regolazione della crescita, divisione e proliferazione cellulare.
La forma B delle proteine Raf è quella più coinvolata nei meccanismi di trasformazione tumorale (Figura 8). Mutazioni di BRAF sono state descritte con alta frequenza nel melanoma (70%) e, con una prevalenza più bassa (10-20%), anche nel cancro del colon, dell’ovaio, del polmone e dello stomaco e nei sarcomi (55). Recentemente una mutazione somatica puntiforme del gene BRAF è stata identificata come la più comune alterazione genetica nel carcinoma papillare della tiroide (56). La mutazione è stata chiamata T1799A ed interessa l’esone 15 del gene BRAF localizzato nel cromosoma 7. La sostituzione in eterozigosi della timina con una adenina in corrispondenza del nucleotide numero 1799 determina la presenza dell’acido glutammico al posto della valina nel codone 600. Questa sostituzione amminoacidica detta V600E determina l’attivazione costitutiva della BRAF chinasi (57). Questa mutazione del gene si ritrova esclusivamente nei PTC e nei cancri tiroidei anaplastici derivati da PTC. Ad oggi non è stata identificata nè nel normale tessuto tiroideo, nè nelle neoplasie tiroidee benigne e neppure nei carcinomi
follicolari e midollari. La prevalenza della mutazione T1799A nei PTC varia dal 23 al 62% a seconda delle casistiche (58,59). L’alta frequenza e la specificità della mutazione BRAFV600E dimostra che essa svolge un ruolo fondamentale nel processo di tumorigenesi del cancro papillare. Questa affermazione è supportata anche dalla presenza della suddetta mutazione nel microPTC (60). La presenza di BRAFV600E nelle componenti indifferenziate dei carcinomi anaplastici derivati dai PTC suggerisce un ruolo della mutazione anche nella progressione tumorale da forme ben differenziate a forme anaplastiche, indifferenziate (61).
La prevalenza di BRAFV600E varia a seconda del tipo istologico di carcinoma papillare; essa infatti raggiunge il 77% nei PTC a cellule alte, il 60% nella forma classica e il 12% nella variante follicolare. Da questi dati sembra quindi che BRAF abbia un ruolo maggiore nella tumorigenesi del PTC convenzionale e della variante a cellule alte; ciò potrebbe spiegare la maggiore aggressività di questi due sottotipi istologici rispetto alla variante follicolare del PTC (62).
Fino ad ora non sono state individuate correlazioni inequivocabili tra la mutazione di BRAFV600E e le caratteristiche clinico patologiche dei pazienti con PTC (63). In alcuni studi (64) è stata
trovata un’associazione significativa tra la mutazione di BRAF e l’invasione extratiroidea, le metastasi linfonodali e a distanza, uno stadio più avanzato del tumore e la recidiva tumorale.
Tuttavia in due studi questa associazione non è stata confermata (59,65). In particolare solo pochissimi studi e con follow-up relativamente brevi, hanno correlato la mutazione di BRAFV600E con l’andamento clinico della malattia (65,66). Il valore prognostico quindi di BRAFV600E nel tumore primitivo è ancora da definire.
Quanto sopra riportato dimostra il ruolo svolto dagli oncogeni nella trasformazione tumorale della cellula follicolare della tiroide e sottolinea anche che c’è una relazione tra alterazione genica e biologia del tumore. La ricerca di mutazioni è stata utilizzata per identificare eventuali fattori prognostici e per definire nuove strategie diagnostiche. Di particolare rilievo sono gli studi che dimostrano l’utilità dell’analisi molecolare del materiale ottenuto da agoaspirati tiroidei per la diagnosi prechirurgica dei noduli (67-69). I dati pubblicati fino ad oggi in letteratura sono pochi e per lo più retrospettivi. Questi dati dimostrano tuttavia che l’analisi molecolare può essere utilizzata per descrivere l’assetto genetico di un determinato tessuto; questo tipo di informazione
può essere utilizzata per migliorare la diagnosi prechirurgica del carcinoma tiroideo.
3. SCOPO DELLO STUDIO
Considerato il ruolo degli oncogeni nella trasformazione tumorale del PTC, durante questi anni di dottorato abbiamo voluto verificare se la ricerca di mutazione geniche nell’agoaspirato potesse in qualche modo migliorare la diagnosi prechirurgica dei noduli tiroidei. A questo scopo abbiamo studiato 3 degli oncogeni più frequentemente coinvolti (BRAF, Trk e RET/PTC nel materiale ottenuto da un “singolo agoaspirato”, in parte utilizzato per l’esame citologico e in parte per l’analisi molecolare.
Abbiamo pertanto effettuato l’analisi genetica su un totale di 115 campioni di materiale agoaspirato da noduli tiroidei allo scopo di verificare il significato clinico della presenza-assenza di alterazioni molecolari, con particolare riguardo a quei campioni con esame citologico “non diagnostico” o perche’ “indeterminato” (neoplasia follicolare) o perche’ “inadeguato” (cellule tireocitosimili/materiale scarso) allo scopo di migliorare la diagnosi prechirurgica e conseguentemente il tipo di approccio terapeutico.
4. MATERIALI E METODI
4.1 Raccolta dei campioni di FNAAbbiamo raccolto un totale di 100 casi consecutivi di campioni di materiale agoaspirato da noduli tiroidei su cui era gia’ stato effettuato un primo esame citologico ed erano risultati noduli “a citologia indeterminata/non diagnostica” o “ acitologia inadeguata” e su questi campioni abbiamo effettuato l’analisi molecolare e ripetuto l’esame citologico.
Come controllo abbiamo utilizzato 15 campioni di materiale agoaspirato da noduli tiroidei di pazienti con diagnosi accertata di PTC . La FNA e’ stata eseguita in tutti i pazienti dallo stesso operatore, dal momento che la manualita’ e’ un elemento fondamentale per ottenere un materiale idoneo per la diagnosi ed effettuato sotto guida ecografica al fine di essere certi dell’esatta localizzazione del nodulo (AU 590 Asynchronous, Esaote Biomedica, Firenze, Italy).
Tutti i campioni utilizzati per l’analisi molecolare sono stati sottoposti anche ad esame citologico. Il materiale ottenuto da un
“singolo agoaspirato”, e’ stato in parte strisciato su uno o piu’ vetrini, colorato con i consueti metodi di Papanicolau e di May-Grunwald-Giemsa per l’esame citologico. L’ago con cui e’ stata effettuata la FNA e’ stato lavato in un tampone appropriato per la successiva estrazione di RNA al fine di recuperare le cellule rimaste. Il campioni è stato poi conservato a -80 fino al momento dell’analisi. Successivamente tutti i pazienti in cui e’ stata effettuata la FNA sono stati sottoposti ad intervento chirurgico di tiroidectomia e quindi e’ stato effettuato l’esame istologico della lesione nodulare su cui era stata effettuta la FNA al fine di valutarne la natura benigna o maligna.
4.2 Estrazione dell’RNA e RT-PCR
L’RNA è stato estratto usando l’RNeasy Mini Kit (QIAGEN) secondo le istruzioni del fornitore ed è stato poi retrotrascritto in cDNA seguendo un protocollo già descritto dal nostro gruppo (Elisei et al 2001). La buona qualità e l’origine follicolare del materiale recuperato sono state verificate amplificando un gene ubiquitario (GAPDH) e un gene specifico della tiroide (Pax8).
Lo stesso cDNA è stato poi utilizzato per lo studio dei riarrangiamenti RET/PTC1, RET/PTC3 e TRK e per l’esone 15 di BRAF. I primers e le condizioni utilizzate per la PCR sono riportate nella Tabella 1. Per quanto riguarda i riarrangiamenti RET/PTC, i prodotti di amplificazione sono stati sottoposti a southern blot utilizzando sonde oligonucleotidiche specifiche marcate con fluorescine e rilevate in chemiluminescenza (gene Images 3’Oligolabelling and CDP-Star Detection System; Amersham Pharmacia Biotech, Milano, Italia).
Per la ricerca delle mutazioni di BRAF il prodotto di amplificazione è stato purificato e sottoposto a reazione di sequenza con metodo di Sanger. Il prodotto della reazione di sequenza è stato poi analizzato con l’ausilio di un sequeziantore automatico (ABI prism 310, perkin-Elmer, Foster City, CA).
4.3 Analisi dei risultati
Di tutti i pazienti in cui e’ stata effettuata la FNA del nodulo tiroideo sono stati rivisti e raccolti i dati clinici e i risultati ottenuti dall’analisi genetica del materiale prelevato dalla FNA sono stati
confrontati con il risultato dell’esame citologico (eseguito sullo stesso prelievo) e del successivo esame istologico.
5. RISULTATI
5.1 Esame citologico su FNA (FNAC)
Complessivamente abbiamo valutato 115 campioni di materiale proveniente da 115 FNA di noduli tiroidei strisciati su uno o piu’ vetrini, corrispondenti a 115 pazienti 100 con diagnosi di gozzo nodulare e 15 con diagnosi accertata di PTC. Sulla base della risposta citologica abbiamo suddiviso i 100 casi con diagnosi di gozzo nodulare in 75 con diagnosi citologica “indeterminata” (neoplasia follicolare), 25 casi con diagnosi citologica “inadeguata” in cui il materiale prelevato dal nodulo tiroideo non era sufficiente per una adeguata diagnosi e 15 casi in cui avevamo la diagnosi citologica certa di PTC, usati come gruppo di controllo. Tutti i 115 pazienti sono stati sottoposti ad intervento di tiroidectomia totale presso la Clinica Chirurgica dell’ Azienda Ospedaliero-Universitaria Pisana, e in tutti i casi e’ stata effettuato l’esame istologico della lesione nodulare. In fig 9 sono riportati e messi a confronto i risulati dell’esame citologico e del successivo esame istologico della stessa lesione nodulare. In particolare
all’esame istologico il 74,4% dei noduli con citologia “indeterminata” e’ risultato benigno (NTB) e nel restante 25,3% e’ risultato essere carcinoma papillare della tiroide. In questo gruppo la variante piu’ frequente era quella follicolare essendo presente nel 68,5% dei casi. Dei 25 casi con citologia “inadeguata” il 40% e’ risultato NTB e il 60% PTC. Diversamente da quanto osservato nel gruppo precedente (a citologia “indeterminata”) la variante istologica piu’ frequente di questo gruppo (a citologia “inadeguata”) era la variante classica . Anche nei 15 casi con citologica accertata di PTC, usati come gruppo di controllo, la variante predominante era quella classica (80%).
5.2 Analisi delle alterazioni molecolari su liquido di lavaggio di FNA
Abbiamo valutato la prevalenza e la distribuzione delle mutazioni di RET/PTC1, RET/PTC3, TRK e di BRAF sul materiale ottenuto dalla FNA dei noduli tiroidei, complessivamente in 49 casi di PTC e 66 NTB, definiti tali sulla base della diagnosi istologica e i risultati sono riportati in Figura 10. In particolare circa il 40% dei casi di PTC presenta un’alterazione molecolare e la mutazione di
BRAFV600E rappresenta circa il 50% di tutte le mutazioni descritte. Al contrario, solo il 6% dei casi di NTB presenta un’alterazione molecolare e in particolare in questo gruppo non e’ stata osservata alcuna mutazione di BRAF. Abbiamo poi analizzato la prevalenza e la distribuzione delle alterazioni molecolari nei 49 casi di PTC in accordo alla diagnosi citologica (Tab. 2). Nel gruppo dei 15 casi di PTC con diagnosi accertata di PTC e usati come gruppo di controllo la frequenza totale di alterazioni geniche era del 53,3%, con una netta prevalenza di BRAFV600E (33,3%). In questo gruppo non sono stati trovati riarrangiamenti RET/PTC3 E TRK. Nel gruppo dei PTC (19 casi) che erano risultati “indeterminati” alla citologia la frequenza totale delle alterazioni geniche (42,1%) era inferiore a quella riscontrata nel gruppo precedente, ma anche in questo caso si osservava una netta prevalenza di BRAFV600E (26,3%). Nella serie di campioni di PTC per i quali la diagnosi citologica non era stata posta a causa dell’inadeguatezza del materiale (15 casi) e risultati PTC all’esame istologico, la frequenza totale delle alterazioni geniche era molto bassa (20%) e la mutazione BRAFV600E era completamente assente. Abbiamo poi voluto analizzare la distribuzione delle alterazioni
molecolari sulla base della variante istologica, come riportato nella Fig. 11. In particolare dei 49 casi con diagnosi istologica di PTC 25 (51%) erano PTC variante classica, 19 (38,8%) PTC variante follicolare e in soli 5 casi (10,2%) erano presenti le varianti piu’ rare (3 casi di PTC a cellule alte e 2 casi di PTC a cellule trabecolari/solide). Abbiamo riscontrato la piu’ alta prevalenza di alterazioni molecolari in questo ultimo gruppo di casi (5/49), in particolare la mutazione piu’ frequente era la BRAFV600E (40%). I riarrangiamenti RET/PTC1 e RET/PTC3 erano presenti in 1/5 casi (20%) rispettivamente. Confrontando il gruppo di PTC variante classica con quello di PTC variante follicolare abbiamo osservato che mutazioni di BRAF erano presenti in 6/25 casi (24%) della variante classica e in 2/19 casi (10.5%) della variante follicolare, mutazioni di di RET/PTC1 erano presenti in 2/25 (8%) della variante classica e in 6/25 (1,5%) della variante follicolare. Per quanto concerne le mutazioni di RET/PTC3 , non abbiamo riscontrato alcuna mutazione nel gruppo dei casi a variante classica e solo in 1/19 casi (5,26%) della variante follicolare.
6. DISCUSSIONE
La patologia nodulare tiroidea è molto frequente nella popolazione generale e l’introduzione della ecografia tiroidea ha ulteriormente aumentato la percentuale di incidenza di questa patologia. Infatti la frequenza dei noduli tiroidei non manifesti clinicamente ma rilevabili solo ecograficamente è superiore al 50% nelle donne di età superiore ai 60 anni. Tuttavia, come già detto precedentemente, la maggior parte dei noduli tiroidei e’ benigna, seppur con grandi differenze tra casistiche cliniche e chirurgiche; nelle casistiche cliniche, meno del 5% dei noduli tiroidei sono carcinomi, mentre nelle casistiche chirurgiche, non selezionate sulla base della citologia preoperatoria, la percentuale di malignità varia fra l’8 e il 20% (8,10). Quindi sulla base di questo la diagnosi quanto più accurata della natura dei noduli è un elemento indispensabile per la corretta impostazione della strategia terapeutica. Pertanto di fondamentale importanza nella patologia nodulare tiroidea riveste la distinzione fra noduli benigni e noduli maligni resa possibile dalla FNAC. Ove
eseguito correttamente e interpretato da un citologo esperto, questo esame permette la diagnosi di natura dei noduli tiroidei con un elevato grado di sensibilità e specificità. Infatti l’introduzione della FNAC nella pratica clinica ha permesso di ridurre del 35-75% il numero dei pazienti operati per nodulo tiroideo ed ha aumentato di 2-3 volte il numero dei tumori maligni fra i noduli operati. Purtroppo come per altri settori della diagnostica, anche per la FNAC la presenza di falsi positivi e di falsi negativi ne rappresenta i limiti: una errata diagnosi di sospetto cancro può determinare un intervento radicale non necessario, mentre tumori maligni possono sfuggire alla diagnosi. In particolare per quanto concerne il nodulo tiroideo il problema esiste per le forme follicolari ben differenziate, spesso minimamente invasive; ‘esame citologico non riesce a cogliere caratteri morfologici indicativi di neoplasia maligna e, per sua natura, non può dare informazioni circa la capacità di infiltrare del tumore, dimostrabile solo all’esame istologico. In molti di questi casi si ricorre ad una diagnosi piuttosto generale di “neoplasia follicolare” da controllare con l’esame istologico. D’altra parte in molti studi retrospettivi la frequenza di carcinoma nei noduli con citologia “di neoplasia follicolare o di nodulo microfollicolare” è
variabile dal 12 al 42% a seconda delle diverse casistiche. In altre situazioni la FNAC non risulta conclusiva a causa dell’esiguità del materiale prelevato dal nodulo e in questo caso si parla di “esame citologico inadeguato”. Da qui è nata la necessità di ricorrere a sperimentare nuove metodiche diagnostiche da integrare alla FNAC nella valutazione della patologia nodulare tiroidea. Negli ultimi anni la biologia molecolare ha ampiamente dimostrato che i recettori tirosino-chinasici giocano un ruolo importante nella patogenesi del cancro della tiroide. I riarrangiamenti di RET/PTC sono stati trovati in circa il 40% dei casi di PTC spontaneo e in una percentuale superiore nei carcinomi tiroidei radioindotti (51). I riarrangiamenti di TRK sono invece presenti in circa il 10% dei casi di PTC. Più recentemente sono state descritte mutazioni puntiformi attivanti BRAF nell’esone 15. Sulla base di questi primi risultati e allo scopo di valutare la possibilità di utilizzare la biologia molecolare per l’analisi del materiale agoaspirato dai noduli tiroidei, al fine di ottenere una diagnosi pre-chirurgica più accurata, abbiamo eseguito l’analisi della mutazioni di BRAF, dei riarrangiamenti RET/PTC e di TRK nel materiale ottenuto da un “singolo agoapirato”.
Esistono già degli studi pubblicati che hanno ricercato la presenza di questi geni nel materiale agoapirato dai noduli tiroidei, ma sono studi retrospettivi e limitati all’analisi di un oncogene o di pochi oncogeni per volta (67-69).
I nostri risultati mostrano che nel gruppo dei casi di carcinoma papillare utilizzato come controllo la frequenza di alterazioni genetiche è paragonabile a quella osservata nelle casistiche in cui lo studio viene eseguito su tessuto fresco dimostrando che la ricerca delle mutazioni eseguita sul liquido di lavaggio dell’agoaspirato è una metodica sensibile e specifica. Osservando la frequenza delle alterazioni geniche nei PTC individuati all’istologia nel gruppo di casi con citologia inadeguata emerge che questa è simile (42,1%) a quella ottenuta nei casi di controllo (53,3%). Inoltre in entrambi i casi l’alterazione molecolare più frequente è quella di BRAFV600. Quindi anche in questo gruppo caratterizzato da un’alta frequenza di varianti follicolari, il materiale raccolto consente di effettuare correttamente l’analisi molecolare.
Nella serie di campioni di PTC per i quali la diagnosi citologica non era stata posta a causa dell’inadeguatezza del materiale e risultati PTC
all’esame istologico, la frequenza totale delle alterazioni geniche era significativamente più bassa (20%) che nelle altre forme di PTC e la mutazione BRAFV600E era completamente assente. Una possibile spiegazione di questo risultato potrebbe essere che la scarsità, l’esiguità del materiale in esame non consente una adeguata diagnosi sia citologica che molecolare.
Nella nostra casistica 66 casi con citologia non diagnostica sono risultati NTB. Nel 6% di questi abbiamo trovato riarrangiamenti RET/PTC. Il riscontro di queste alterazioni in patologie di natura benigna è attualmente molto dibattuto in letteratura (70). Non si può escludere che l’utilizzo di una metodica così sensibile come la PCR e il southern blot riescano ad individuare, nel campione in esame, anche quella poche cellule che hanno gia’ subito la trasformazione neoplastica. Nello stesso tempo la presenza di RET/PTC nelle neoplasie benigne potrebbe essere anche spiegata dal fatto che questa alterazione genetica costituisca una lesione pre-neoplastica. Nessuna mutazione di BRAF è stata individuata in questo gruppo ad indicare che questo tipo di alterazione genica e specifica della forma maligna del carcinoma tiroideo. Da questo studio quindi emerge che la biologia
molecolare, ed in particolare l’analisi delle varie alterazioni oncogeniche, è sicuramente applicabile, con risultati attendibili, a campioni derivanti dal liquido di lavaggio dell’agoaspirato tiroideo utilizzato per l’esame citologico. Dal momento che l’analisi molecolare viene effettuata sul liquido di lavaggio dell’ago con cui e’ stata effettuta la FNA del nodulo tiroideo, e’ sufficiente sottoporre il paziente ad un “singolo agoapirato”, evitando cosi’ il possibile disconforto legato ad un eventuale doppio prelievo. L’analisi che noi abbiamo messo a punto è sicuramente applicabile in tutti i casi e la presenza di alterazioni molecolari nei campioni deve porre un dubbio sulla natuta maligna del campione anche quando l’analisi citologica non ponga una diagnosi certa di malignità. Un limite di questa metodica è rappresentato dai casi in cui il campione risulta inadeguato anche alla citologia. In questi casi infatti la presenza di un ridotto numero di cellule o di cellule degradate non permette di eseguire un’accurata analisi molecolare. In questi casi l’unica diagnosi possibile rimane quella istologica.
7. BIBLIOGRAFIA
1.U.S. National Cancer Institute. Surveillance, Epidemiology and
End Results. http://seer.cancer.gov/csr/1975-2001.
2.Landis SH, Murray T, Bolden S, PA Wingo. Cancer statistics. CA
Cancer J Clin 1998; 48: 6.
3.Burke JP, Hay ID, Dignan F, Goellner JR, Achenbach SJ, Oberg
AL et al. Long term trends in thyroid carcinoma: a population-based study in Olmsted County, Minnesota, 1935-1999. Mayo Clin Proc 2005; 80: 753.
4. Franceschi S, Boyle P, Maisonneuve P, La Vecchia C, Burt AD,
Kerr DJ, MacFarlane GJ. The epidemiology of thyroid carcinoma. Crit Rev Oncogenesis 1993; 4:25.
5. Mazzaferri EL. Management of a solitary thyroid nodule. New
Engl J Med 1993; 328: 553.
6. Pinchera A, Chiovato L, Pacini F, Di Coscio GC, Miccoli P et al.
Il nodulo tiroideo: diagnosi e terapia. Aggiornamento del medico 1987; 11:494.
7. Pacini F, Pinchera A. Il nodulo tiroideo e il cancro della tiroide.
Nei: Tumori della tiroide. Mediserve 2003.
8.Brooks JR. The solitary thyroid nodule. American J Surg 1973;
125: 477.
9.Prince R, Horvath K, More FA. Surgery of solitary thyroid
nodule: assessment of methods to select patients at low risk for unsuspected malignancy in the unaffected lobe and the possible utility of preoperative thyroid ultrasound. Thyroid 1993; 3: 87.
10.Sampson RJ, Key CR, Buncher CR, Iijima S. Thyroid carcinoma
in Hiroshima and Nagasaki. Prevalence of thyroid carcinoma at autopsy. JAMA 1969; 209: 65.
11.Cutler SJ, Scotto J, Devesa SS, Connelly RR. Thyroid national
cancer survey an overview of available information. J Natl Cancer Ist 1974; 53: 1565.
12.Sampson RJ, Woolner LB, Bahn RC, Kurland LT. Occult
thyroid carcinoma in Olmaster Country, Minnesota: prevalence of autopsy compared with that in Hiroshima and Nagasaki, Japan. Cancer 1976; 34: 2072.
13.Harach HR, Franssila KO, Wasenius VM. Occult papillary
carcinoma of the thyroid. A “normal” finding in Finland. A systematic autopsy study. Cancer 1985; 56: 531.
14.Kazakov VS, Demidchik EP, Astachova LN. Thyroid cancer
15.Baverstock K, Egloff B, Pinchera A, Ruchti C, Williams D.
Thyroid cancer after Chernobyl. Nature 1992; 359: 21.
16. Li Volsi VA. Papillary neoplasms of the thyroid: Phatologic and
prognostic features. Am J Clin Pathol 1992; 97:426.
17. Rosai J.Papillary carcinoma. Monogram Pathol 138, 1993.
18. Rosai J, Zampi G, Carcangiu ML. Papillary carcinoma of the
thyroid: A discussion of its several morphologic expressions,with particular emphasis on the follicular variant. Am J Surg Pathol 1983;7:809.
19. Furmanchuk AW, Averkin JI, Egloff B, Ruchti C, Abelin T,
Scappi W, Korotkevich EA. Pathomorphological findings in thyroid cancers of children from the republic of Belarus: A study of 86 cases occurring between 1986 (post Chernobyl) and 1991. Histopathology 1992; 21:401.
20. Carcangiu ML, Bianchi S. Diffuse sclerosing variant of
papillary thyroid carcinoma. Am J Surg. Pathol 1989; 13:1041-1049.
21.Paessler M, Kreisel FH, LiVolsi VA, Akslen LA, Baloch ZW.
Can we rely on pathologic parameters to define conservative treatment of papillary thyroid carcinoma? Int J Surg Pathol 2002; 10: 267.
22.Kawaura M, Pathak I, Gullane PJ, Mancer K, Irish J, Brown D et
al. Multicentricity in papillary thyroid carcinoma: analysis of predictive factors. J Otolaryngol 2001; 30: 102.
23.Segal K, Friedental R, Lubin E, Shvero J, Sulkes J, Feinmesser
R. Papillary carcinoma of the thyroid. Otolaryngol Head Neck Surg 1995; 113: 356.
24.Lang W, Borrusch H, Bauer L. Occult carcinomas of the thyroid.
Evaluation of 1,020 sequential autopsies. Am J Clin Pathol 1998; 90: 72.
25.Eichhorn W, Tabler H, Lippold R, Lochmann M, Schreckenberger M, Bartenstein P. Prognostic factors determining long-term survival in well-differentiated thyroid cancer: an analysis of four hundred eighty-four patients undergoing therapy and aftercare at the same institution. Thyroid 2003; 13: 949.
26.Wiseman SM, Loree TR, Rigual NR, Hicks WL Jr, Douglas
WG, Anderson GR et al. Anaplastic transformation of thyroid cancer: review of clinical, pathologic, and molecular evidence provides new insights into disease biology and future therapy. Head Neck 2003; 25: 662.
27.Ozaki O, Ito K, Mimura T, Sugino K, Ito K. Anaplastic
regional lymph nodes: a histologic and immunohistochemical study. J Surg Oncol 1999; 70: 45.
28.Ain KB. Anaplastic thyroid carcinoma: a therapeutic challenge.
Semin Surg Oncol 1999; 16: 64.
29.McConahey WM, Hay ID, Woolner LB, Van Heerden JA,
Taylor WF. Papillary thyroid cancer treated at the Mayo Clinic, 1946 through 1970: initial manifestations, pathologic findings, therapy and outcome. Mayo Clinic Proc 1986; 61: 978.
30.Mazzaferri EL, Jhiang SM. Long term impact of initial surgical
and medical therapy on papillary and follicular thyroid cancer. Am J Med 1994; 97: 418.
31.DeGroot LJ, Kaplan EL, McCornick M, Straus FH. Natural
history, treatment and course of papillary thyroid carcinoma. J Clin Endocrinol Metab 1990; 71: 414.
32.Mazzaferri EL, Kloos RT. Clinical review 128: current
approaches to primary therapy for papillary and follicular thyroid cancer. J Clin Endocrinol Metab 2001; 86: 1447.
33.Mazzaferri EL, Young RL, Oertel JE, Kemmerer WT, Page CP.
Papillary thyroid carcinoma: the impact of therapy in 576 patients. Medicine (Baltimore) 1977; 56: 171.
34.Pacini F, Pinchera A. Serum and tissue thyroglobulin
measurement: clinical applications in thyroid disease. Biochimie 1999; 81: 463.
35.Schlumberger M. Papillary and follicular thyroid carcinoma. N
Engl J Med 1998; 338: 297.
36.Hermanek P, Sobin LH. UICC: TNM classification of malignant
37.Beahrs O, Henson D, Hutter R, Myers M. Manual for staging of
cancer. 3rd edition. Philadelphia: J.B. Lippincott, 1988.
38.Byar DP, Green SB, Dor P et al. A prognostic index for thyroid
carcinoma: a study of the EORTC thyroid cancer cooperative group. Eur J Cancer Clin Oncol 1979; 15: 1033.
39.Hay ID, Bergstralh EJ, Goellner J, Ebersold JR, Grant CS.
Predicting outcome in papillary carcinoma: development of a reliable prognostic scoring system in a cohort of 1779 patients treated surgically at one institution during 1940 through 1989. Surgery 1993; 114: 1050.
40. Mazzaferri EL. Management of a solitary thyroid nodule. N
Engl J Med 1993; 388: 553.
41. Silverberg SG, Vidone RA. Carcinoma of the thyroid n surgical
42. Bisi h, Fernandes VSO, Asato de Camargo RY et al. The
prevalence of unsuspected thyroid pathology in 300 sequential autopsies, with special reference to the incidental carcinoma. Cancer 1989; 64: 1888.
43. Belfiore A, La Rosa GL, La Porta GA et al. Cancer risk in
patints with cold thyroid nodules: relevance of iodine intake, sex, age, and multinodularity. Am J Med 1992; 93:363.
44. Baloch ZV and Livolsi VA. Fine-needle aspiration of thyroid
nodules: past, present, and future. Endocr Pract 2004; 10:234.
45. Ogilvie JB, Piatigorsky EJ, Clark OH. Current status of fine
needle aspiration for thyroid nodules. Advanc in Surgery 2006 40: 223.
46. Peyssonnaux C & Eychene A. The Raf/Mek/Erk pathway:new
47. Karga h, Lee J, Vickery AL, Thor A, Gaz R, Jameson L. Ras
oncogene mutation in benign and malignant thyroid neoplasms. J Clin Endocrinol Metab 1991;73:832.
48. Fusco A, Grieco M, Santoro M, Berlingieri MT, Pilotti S,
Pierotti MA, Della Porta G, Vecchio G. A new oncogene in human papillary thyroid carcinoma and their lymph-nodal metastases. Nature 1987; 328:170.
49. Pierotti MA, Santoro M, Jenkins RB, Sozzi G, Bongarzone I,
Grieco M, Monzini N, Mozzo M, Herrmann MA, Fusco A. Characterization of an inversion on the long arm of chromosome 10 juxtaposes D10S170 and ret and creating the oncogenic sequence Ret/PTC. Proc Natl Acad Sci USA.1992; 89:1616.
50. Jhiang SM, Smanik PA, Mazzaferri EL. Development of single
step duplex RT-PCR detecting different forms of Ret activation, and identification of a third form of in vivo Ret activation in human papillary thyroid carcinoma. Cancer Lett 1994; 78:69.
51. Pacini F, Elisei R, Romei C, Pinchera A. RET/PTC
rearrangements in thyroid carcinoma: clinical relevance. J Endocrinol Invest. 2000; 23:328.
52. Tonq Q, Li Y, Smanik PA, Fithian V, Xing S, Mazzaferri EL,
Jhiang SM. Characterization of the promoter region and oligomerization domain of H4 (D10S170), a gene frequently rearranged with the ret proto-oncogene. Oncogene 1995;10:1781.
53. Sozzi G, Bongarzone I, Miozzo M, Borrello MG, Blutti MG,
Pilotti S, Della Porta G, Pierotti MA. A t(10;17) translocation creates the RET/PTC2 chimeric transforming sequence in papillary thyroid carcinoma. Genes Chromosomes Cancer 1994; 9:244.
54. Santoro M, Dathan NA, Berlingieri MT et al. Molecular
characterization of RET/PTC3; a novel rearranged version of the RET proto-oncogene in a human thyroid papillary carcinoma. Oncogene 1994; 9:509.
55. Davies H, Bignell GR, Cox C, Sthephens P, Edkins S, Clegg S,
Teague j, Woffendin H, Garnett Mj, Bottomley W et al. Mutations of the BRAF gene in human cancer. Nature 2002; 417:949.
56. Cohen Y, Xing M, Mambo E, Guo Z, Wu G, Trink B, Beller U,
Westra WH, Ladenson PW & Sidransky D. Braf mutation in papillary thyroid carcinoma. J Nat Cancer Inst 2003; 95:625.
57. Mercer KE, Pritchard CA. Raf proteins and cancer:B-Raf is
identified as a mutational target. Biochim Biophys Acta 2003; 1653:25.
58. Kim KH, Suh KS, Kang DW & Kang DY. Mutations of the
BRAF gene in papillary thyroid carcinoma and in Haschimoto’s thyroiditis. Pathology International 2005; 55:540-545.
59. Fugazzola L, Mannavola D, Cirello V, Vannuccchi G, Muzza
M, Vicentini L, Beck-Peccoz P. BRAF mutations in an Italian cohort of thyroid cancers. Clin Endocrinol 2004; (Oxf)61:239.
60. Trovisco V, Vieira de Castro I, Soares P, Maximo V, Silva P,
Magalhaes J, Abrosimov A, Guiu XM & Sobrinho-Simoes M. BRAF mutations are associated with some histological types of papillary thyroid carcinoma. J Pathol 2004; 202:247.
61. Begum S, Rosembaum E, Henrique R, Cohen Y, Sidransky D &
Destra WH. BRAF mutations in anaplastic thyroid carcinoma:implications for tumor origin, diagnosis and treatment. Modern Pathology 2004; 17:1359.
62. Xing M. BRAF mutation in thyroid cancer. End Relat Cancer
2005; 12:245.
63. Trovisco V, Soares P, Preto A, De Castro IV, Lima J, Castro P,
Maximo V Botelho T et al. Type and prevalence of BRAF mutations are closely associated with papillary thyroid carcinoma histotype and patients’age but not with tumour aggressiveness. Virchows Archives 2005; 446:589.
64. Xing M, Westra W, Tufano R, Cohen Y, Rosenbaum E et al.
BRAF mutation predicts a poorer clinical prognosis for papillary thyroid cancer. J Clin Endocrinol Metab 2005; 90:6373.
65. Fugazzola L, Puxeddu E, Avenia N, Romei et al. Correlation
between B-RAF V600E mutation and clinico-pathologic parameters in papillary thyroid carcinoma:data from a multicentric Italian study and review of the literature. End Relat Cancer 2006; 13:455.
66. Kim TY, Kim WB, Rhee YS, Song JY, et al. The BRAF
mutation is useful for prediction of clinical recurrence in low-risk patients with conventional papillary thyroid carcinoma. Clin Endocrinol 2006; 65:364.
67. Salvatore G, Giannini R, Faviana P, Caleo A, Migliaccio I,
Fagin JA, Nikiforov YE, Troncone G, Palombini L, Basolo F, Santoro M. Analysis of BRAF point mutation and RET/PTC rearrangement refines the fine-needle aspiration diagnosis of
papillary thyroid carcinoma. J Clin Endocrinol Metab. 2004 Oct;89(10):5175-80.
68. Domingues R, Mendonca E, Sobrinho L, Bugalho MJ.
Searching for RET/PTC rearrangements and BRAF V599E mutation in thyroid aspirates might contribute to establish a preoperative diagnosis of papillary thyroid carcinoma. Cytopathology. 2005 Feb;16(1):27-31
69. Cheung CC, Carydis B, Ezzat S, Bedard YC, Asa SL. Analysis
of ret/PTC gene rearrangements refines the fine needle aspirationdiagnosis of thyroid cancer. J Clin Endocrinol Metab. 2001 May;86(5):2187-90.
70. Elisei R, Romei C, Vorontsova T, Cosci B, Veremeychik V, Kuchinskaya E, Basolo F, Demidchik EP, Miccoli P, Pinchera A, Pacini F. RET/PTC rearrangements in thyroid nodules: studies in irradiated and not irradiated, malignant and benign thyroid lesions
in children and adults. J Clin Endocrinol Metab. 2001 Jul;86(7):3211.
8. LEGENDA DELLE FIGURE
Figura 1:
Carcinoma papillare variante classica
Figura 2: Carcinoma papillare variante follicolare
Figura 3: Carcinoma papillare variante a cellule alte
Figura 4: L’efficacia dell’esame citologico dipende dall’adeguatezza del
campione e dall’esperienza dell’operatore: possibili risposte riscontrabili all’esame citologico del materiale prelevato da lesioni nodulari della tiroide
Figura 5: Prevalenza del carcinoma tiroideo in noduli tiroidei a “citologia
indeterminata” (o “neoplasia follicolare”)
Figura 6: Rappresentazione schematica dei principali riarrangiamenti RET/PTC
(RET/PTC1, 2, 3)
Figura 7: Oncogeni e tumori della tiroide
Figura 9: Risultati e confronto tra l’esame citologico e l’esame istologico della
stessa lesione nodulare
Figura 10: Prevalenza e distribuzione delle alterazioni molecolari riscontrate sul
liquido di lavaggio della FNA sulla base della diagnosi istologica
Figura 11: Prevalenza e distribuzione delle alterazioni molecolari riscontrate sul
liquido di lavaggio della FNA sulla base delle varianti istologiche
Figura 12: Riepilogo della prevalenza e distribuzione delle alterazioni
molecolari riscontrate sul liquido di lavaggio della FNA di tutti i campioni in esame.
9. TABELLE E FIGURE
Tabella 1. Primers e condizioni sperimentali utilizzate per
l’amplificazione con RT-PCR di RET/PTC1, RET/PTC3, TRK e BRAF
Gene Sonda 5’->3’ sequenza primer Condizioni di PCR
RET/PTC1 GGCACTGCAGGAGGAGAACCGCGA For:GTCGGGGGGCATTGT Rev: AAGTTCTTCCGAGGGAAT
TM= 55° MgCl2= 1.5mM RET/PTC3 GCAGACCTTGGAGAACAGTCA For: AAGCAAACCTGCCAGTGG
Rev: CTTTCAGCATCTTCAACGG TM= 55° MgCl2= 1.5mM TRK GACCTGGAAGACACTAACAG For:AGAGGTGGCTCGTAAGTTGG Rev: CAAGGAGGAGCGTAGAAAGG TM= 55° MgCl2= 1.5mM
BRAF Non usata For:GCACAGGGCATGGATTACTT
Rev: CCACAAAATGGATCCAGACA
TM= 60° MgCl2= 1.5mM PAX8 GACTCACAGAGCAGCAGTAG For:GGCCACCAAGTCCCTGAGTC
Rev: GGGGGTTTCCTGCTTTAT
TM= 60° MgCl2= 1.5mM
Tabella 2. Prevalenza e distribuzione delle alterazioni
molecolari riscontrate sul liquido di lavaggio della FNA sulla base della diagnosi citologica
BRAF n=10 PTC1 n=4 PTC3 n=2 BRAF+PTC n=2 TRK n=1 ANY MUT n=19 PTC (Controllo) n=15 5/15 (33.3%) 2/15 (13.3%) 0/15 1/15* (6.6%) 0/15 8/15 (53.3%) PTC (indeterminata) n=19 5/19 (26.3%) 0/19 1/19 (5.2%) 1/19 (5.2%)§ 1/19 (5.2%) 8/19 (42.1%) PTC (inadeguata) n=15 0/15 2/15 (13.3%) 1/15 (6.6%) 0/15 0/15 3/15 (20%)