INDICE GENERALE
PREFAZIONE ... 4
RIASSUNTO ... 5
ABSTRACT ... 7
INTRODUZIONE ... 9
Struttura e biosintesi dell’aldosterone ... 9
Meccanismi di regolazione dell’aldosterone ... 11
Meccanismi d’azione dell’aldosterone ... 15
Significato biologico dell’aldosterone ... 16
Utilizzazione clinica dell’aldosterone ... 17
SCOPO DELLA TESI ... 20
MATERIALI E METODI ... 21 Metodi analitici ... 21 Campioni ... 22 VEQ Immunocheck ... 23 Analisi statistica ... 24 RISULTATI ... 25
Valutazione della sensibilità e riproducibilità analitica del metodo LIAISON ... 25
Confronto dei risultati ottenuti ... 27
Confronto tra i risultati ottenuti in campioni di controllo esterno di qualità ... 31
Valutazione dei limiti di riferimento nella popolazione normale ... 32
DISCUSSIONE ... 34
CONCLUSIONI ... 36
PREFAZIONE
La maggior parte dei risultati sperimentali presentati in questa tesi sono stati ottenuti presso il Dipartimento di Medicina di Laboratorio della Fondazione G. Monasterio di Pisa in cui ho svolto il tirocinio della scuola di specializzazione di Biochimica Clinica.
Infatti, lavorando da vari anni come assegnista della Scuola Superiore Sant'Anna di Pisa e avendo come Tutore il Prof.Aldo Clerico, ho potuto collaborare con il Dipartimento di Medicina di Laboratorio della Fondazione G. Monasterio di Pisa di cui il Prof.Aldo Clerico è anche il primario responsabile.
La Fondazione G.Monasterio costituisce un ente pubblico specialistico per la cura delle patologie cardiopolmonari svolgente al contempo attività clinica e attività di ricerca ad essa correlata, anche in collaborazione con Istituti del Consiglio Nazionale delle Ricerche , primo tra tutti l'Istituto di Fisiologia Clinica, le Università, l'Industria e le Scuole Superiori tra cui la Scuola Superiore Sant'Anna di Pisa. Pertanto lo scopo di questa tesi di natura sperimentale è stato valutare le caratteristiche analitiche ed i risultati clinici ottenuti con un nuovo metodo di misura dell’aldosterone che si avvale della piattaforma automatizzata LIAISON con il fine ultimo di migliorare e velocizzare la pratica clinica.
In questo ambito il mio contributo è stato l'esecuzione dei dosaggi immunometrici dell'aldosterone e l'analisi dei dati che in conclusione suggeriscono che il metodo di dosaggio dell’aldosterone che utilizza la piattaforma automatizzata LIAISON sembra essere preferibile ai metodi manuali RIA soprattutto in quei laboratori, che già utilizzano la piattaforma LIAISON per il dosaggio di altri analiti e, che devono eseguire il dosaggio di questo ormone in pochi campioni ogni giorno ed inoltre fornire al clinico una risposta in tempi brevi.
RIASSUNTO
In questi ultimi anni sono stati sviluppati kit commerciali per il dosaggio dell’aldosterone utilizzabili su piattaforme automatizzate. Lo scopo del presente studio è stato valutare le caratteristiche analitiche ed i risultati clinici ottenuti con un nuovo metodo di misura dell’aldosterone che si avvale della piattaforma automatizzata LIAISON (DiaSorin, Saluggia – VC) e confrontare i valori di aldosterone misurati con questo nuovo metodo con quelli ottenuti, sugli stessi campioni, con il metodo RIA ALDO-CTK (DiaSorin, Saluggia - VC)
,
con il metodo automatizzato che utilizza la piattaforma iSYS (IDS, Boldon, UK - distributore italiano: Pantec srl, Torino) e con la spettrometria di massa (metodica Perkin-Elmer). Sono stati anche misurati con questo nuovo metodo 5 campioni di controllo, distribuiti nella VEQ Immunocheck (QualiMedLab srl, Pisa) e i valori trovati sono stati confrontati con quelli ottenuti con la media di consenso dei laboratori partecipanti.A questo scopo sono stati reclutati 147 soggetti apparentemente sani e 199 pazienti con malattie cardiovascolari.
Il metodo di dosaggio dell’aldosterone che utilizza la piattaforma automatizzata LIAISON presenta valori di LoB e LoD rispettivamente di 18 pg/mL e 30 pg/mL; mentre i valori di LoQ al 10% CV e al 20% CV corrispondono a concentrazioni di aldosterone pari a 95 pg/mL e 40 pg/mL, rispettivamente. Il metodo automatizzato LIAISON presenta una migliore praticabilità sperimentale rispetto al metodo RIA; in particolare il tempo di analisi è inferiore ad un’ora per il metodo automatizzato, mentre con il metodo RIA occorrono circa 18-24 ore. Infine, il metodo LIAISON presenta risultati clinici che sono confrontabili con quelli ottenuti con il metodo automatizzato che utilizza la piattaforma iSYS (R=0,906, N=294), con quelli della
spettrometria di massa (R=0,746, N=30), e con i valori ottenuti in 5 campioni di controllo della VEQ Immunocheck (R=0,936, p= 0,0191). In conclusione, il metodo di dosaggio dell’aldosterone che utilizza la piattaforma automatizzata LIAISON sembra essere preferibile ai metodi manuali RIA ed EIA, soprattutto in quei laboratori, che già utilizzano la piattaforma LIAISON per il dosaggio di altri analiti e che devono eseguire il dosaggio di questo ormone in pochi campioni ogni giorno, ed inoltre fornire al clinico una risposta in tempi brevi.
ABSTRACT
In recent years commercial kits have been developed for the determination of aldosterone using automated platforms. The purpose of this study was to evaluate the analytical and clinical results obtained with a new method of measurement of aldosterone by using the automated platform LIAISON (DiaSorin, Saluggia - VC) and compare the values of aldosterone measured by this new method with those obtained, on the same samples, with the RIA method ALDO-CTK (DiaSorin, Saluggia - VC), with the automated platform iSYS (IDS, Boldon, UK -distributed in Italy by Pantec srl, Turin, Italy) and with mass spectrometry technique (CHSTM MSMS Steroids Kit, produced by Wallac Oy, Turku, Finland).
With this new method, have been also measured 5 control samples, distributed in the external quality control survey Immunocheck (QualiMedLab srl, Pisa) and the values found were compared to those obtained by all laboratories participant to the survey.
For this purpose were recruited 147 apparently healthy subjects and 199 patients with cardiovascular disease.
The blank of the method (LoB) and the limit of detection (LoD) for the automated LIAISON method were 18 pg/mL and 30 pg/mL of aldosterone, respectively; while the limit of quantitation (LoQ) at 10% CV and 20% CV were 95 pg/mL and 40 pg/mL of aldosterone, respectively. Moreover, the LIAISON method showed a better experimental practicability compared to the RIA method; in particular, the turnaround time (TAT) was less than 60 min for the automated method, while about 18-24 hours for the RIA. Finally, the automated LIAISON method showed clinical results similar to those obtained with the automated method using iSYS platform (R=0.906, N=294, p<0.0001), with the mass spectrometry technique
(R=0.746, N=30, p<0.0001), and also to values measured in 5 control samples distributed in the Immunocheck external quality control survey (R=0.936, p=0.0191). In conclusions, the new automated assay for aldosterone may be adopted instead of RIA and EIA methods by those laboratories, which already use the LIAISON platform for other analytes than aldosterone, and have to perform the aldosterone measurement in only few samples every day, and to report the results within few hours.
INTRODUZIONE
Struttura e biosintesi dell’aldosterone
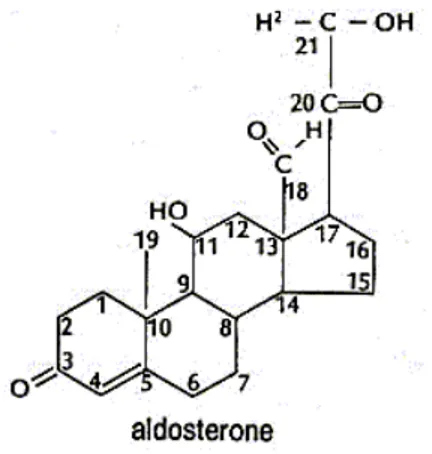
Nel 1934 Zwemer e Sullivan (1) suggerivano l’esistenza di una “sostanza” prodotta dal corticosurrene capace di influenzare il metabolismo cellulare di acqua e sale. Inizialmente chiamato “elettrocortina”, in virtù della sua struttura e per la sua origine surrenalica, venne successivamente rinominato aldosterone, e isolato nel 1953 da Simpson e i suoi collaboratori (2). L’aldosterone appartiene alla famiglia degli ormoni corticosteroidi che vengono classificati in due gruppi principali: glicocorticoidi e mineralcorticoidi (aldosterone, deossicorticosterone, 18-idrossicorticosterone). L’aldosterone è composto da 21 atomi di carbonio, da un doppio legame tra il carbonio C4 e il carbonio C5, da una funzione chetonica in C3 e C20, da un gruppo idrossilico in C11 e C21 e da una funzione aldeidica (CHO) in posizione C18 (Fig 1).
Figura 1. Struttura dell’aldosterone (11β, 21-diidrossi-3, 20- diossopregn-4-en-18-ale)
L’aldosterone è il principale ormone mineralcorticoide, prodotto dalle cellule della zona glomerulosa della corteccia surrenalica (3). Tuttavia, più recenti ricerche suggeriscono che l’ormone può anche essere sintetizzato e liberato localmente in tessuti extra surrenalici, come il cuore o le pareti dei vasi. Anche i glucocorticoidi (cortisone e cortisolo) e gli ormoni sessuali maschili (androgeni), sono prodotti
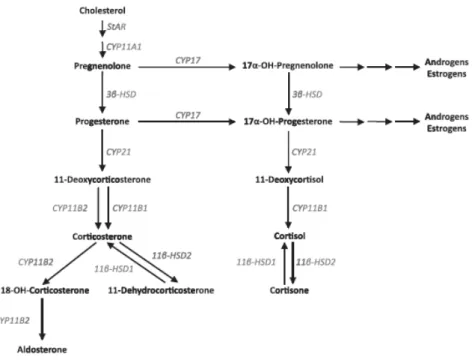
nella corteccia del surrene, ma attraverso vie biosintetiche distinte. Infatti i glucocorticoidi sono prodotti nella zona fasciculata e gli ormoni sessuali maschili sono prodotti nella zona reticolata della corteccia del surrene. La biosintesi dell’aldosterone è esclusiva della zona glomerulare della corteccia del surrene a causa dell'espressione specifica dell’enzima aldosterone sintasi (o 18-idrossilasi) nella zona glomerulare e quella della 11β-idrossilasi, enzima chiave per la sintesi del cortisolo, nella zona fasciculata. Ciò porta ad una “zonazione” funzionale della corteccia surrenalica. La sintesi dell’aldosterone avviene attraverso l’azione di tre enzimi citocromo P450 specifici e un idrossisteroide deidrogenasi che si trovano localizzati in parte nella membrana interna del mitocondrio e in parte nel reticolo endoplasmatico (Fig 2 ).
La sintesi dell'aldosterone avviene a partire dal colesterolo che è convertito successivamente in pregnenolone, progesterone, 11-deossicorticosterone, corticosterone, 18-idrossicorticosterone ed infine in aldosterone (4,5).
Figura 2. Tappe della biosintesi dell’aldosterone (Matthew D. Taves, Celso E. Gomez-Sanchez,
Kiran K. Soma. Extra-adrenal glucocorticoids and mineralocorticoids: evidence for local synthesis, regulation, and function. American Journal of Physiology - Endocrinology and MetabolismPublished 1 July 2011 Vol 301 no. E11-E24).
Meccanismi di regolazione dell’aldosterone
I principali fattori che regolano la secrezione di aldosterone da parte delle cellule corticosurrenali sono l’angiotensina II e il potassio.
Anche l’ACTH, il sodio e altri effettori neuro-ormonali intervengono nella regolazione della produzione di aldosterone ma con un ruolo secondario.
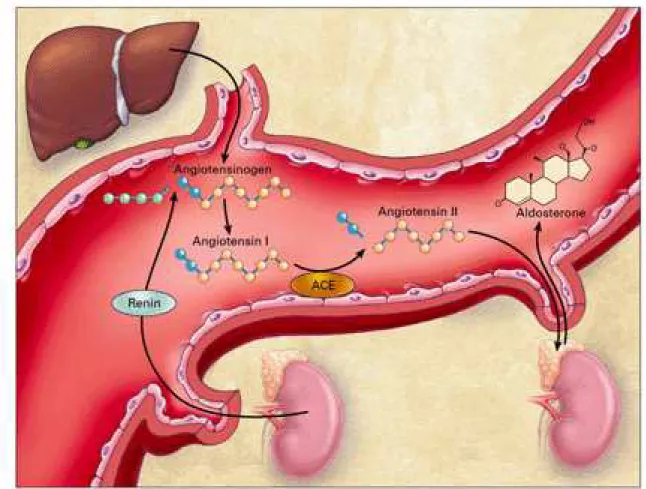
La sintesi di aldosterone nella zona glomerulare risente in maniera predominante della regolazione da parte del sistema renina-angiotensina-aldosterone (RAAS- Fig.3) (6).
Figura 3. Sistema renina angiotensina aldosterone (RAAS)
(Karl T. Weber, M.D. Aldosterone in Congestive Heart Failure. N Engl J Med 2001; 345:1689-1697).
I passaggi che portano alla formazione dell’aldosterone sono:
• Produzione dell’ enzima renina a partire dalla prorenina. Questo processo si svolge nell’apparato iuxtaglomerulare dei glomeruli renali.
• Conversione dell’angiotensinogeno, polipeptide prodotto dal fegato, in angiotensina I attraverso l’azione dell’enzima renina.
• Idrolisi dell’angiotensina I in angiotensina II attraverso l'azione dell'enzima di conversione dell'angiotensina (ACE) il quale viene sintetizzato in maniera predominante a livello polmonare.
• Stimolazione della produzione di aldosterone nella glomerulare del surrene da parte dell’angiotensina II.
L’azione dell’angiotensina II sulla glomerulosa surrenalica è mediata da recettori che appartengono alla classe dei recettori di membrana accoppiati a una o più proteine G. Sono stati clonati due principali categorie di recettori dell’angiotensina II, il tipo 1 e il tipo 2. Comunque la maggior parte delle azioni dell’angiotensina II sono attribuite al recettore di tipo 1 che è ampiamente espresso in vari tessuti cardiovascolari e renali. Il recettore di tipo 2, invece, è altamente espresso nei tessuti mesenchimali nel feto e diminuisce drasticamente dopo la nascita. Il ruolo del recettore di tipo 2 rimane incerto (7). Pertanto la sintesi dell’aldosterone ha
come tappa limitante i livelli circolanti di renina la cui sintesi è controllata principalmente dalla pressione del flusso arteriolare renale. Fattori che riducono il flusso renale (disidratazione, emorragie, restrizione sodica, posizione ortostatica o stenosi delle arterie renali) aumentano i livelli di renina al contrario fattori che aumentano il flusso renale (introito di sodio, vasocostrizione periferica o clinostatismo) riducono la secrezione di renina (8).
Anche la concentrazione plasmatica o tissutale di potassio hanno un ruolo importante nella regolazione della secrezione di aldosterone. L’ipopotassemia deprime la secrezione di aldosterone aumentando il rilascio di renina, mentre l’iperpotassemia stimola la secrezione di aldosterone riducendo il rilascio di renina. Tra i livelli sierici di potassio e le concentrazioni di aldosterone vi è una
regolazione reciproca in quanto il potassio può aumentare direttamente la secrezione di aldosterone da parte della glomerulosa ma l’aldosterone a sua volta può ridurre i livelli di potassio, stimolando la sua escrezione a livello renale. (9). L’ACTH è uno tra i fattori ipofisari che regolano la secrezione di aldosterone.
Un incremento dei livelli di ACTH aumenta direttamente i livelli circolanti di aldosterone plasmatico. L’ACTH aumenta generalmente in condizioni di stress psico-fisico severo, per esempio dopo esercizi fisici estremamente intensi e prolungati o interventi chirurgici (10).
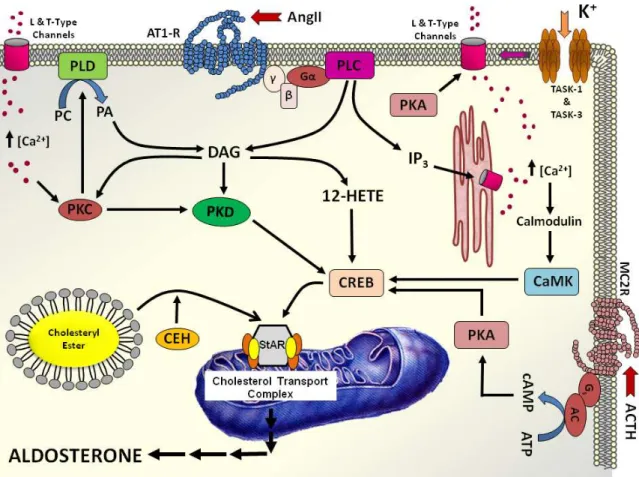
I meccanismi attraverso i quali l’angiotensina II, il potassio e l’ACTH modulano la steroidogenesi della corticale surrenalica si esplicano attraverso diverse vie di trasduzione del segnale che conducono tutte alla fosforilazione (e attivazione) della proteina di trasporto StAR (steroidogenic acute regulatory protein) dopo il legame del promotore di StAR al fattore cellulare di trascrizione CREB (cAMP response-element (CRE)-binding protein). Quindi, una volta attivato, StAR trasporta il colesterolo nella membrana mitocondriale interna dove avviene la produzione di aldosterone (Fig 4) (11).
L’azione dell’angitensina II si espica attraverso il gegame con il suo recettore di tipo 1, la conseguente attivazione della fosfolipasi C la quale converte PIP2 (phosphatidylinositol 4,5-bisphosphate) a DAG (diacylglycerol) e IP3 (inositol 1,4,5-trisphosphate). DAG e IP3 innescano una serie di reazioni che, anche attraverso l’attivazione di una PKC (protein chinasi C), conducono ad un incremento intracellulare di calcio e all’attivazione di CREB.
Piccoli incrementi di potassio extracellulare invece depolarizzano le cellule della zona glomerulare che attraverso l’attivazione di canali per il calcio di tipo L e T, inducono un incremento di entrata di calcio e pertanto la fosforilazione di CREB.
Infine l’ACTH stimola la secrezione di aldosterone legandosi a specifici recettori di membrana (MCR2R). Tale legame attiva l’adenilato ciclasi (AC) che converte l’adenosina trifosfato (ATP) in adenosina monofosfato ciclica (cAMP) . il cAMP attiva una PKA (protein chinasi A) che fosforila CREB (11).
Figura 4. Meccanismi di trasduzione del segnale dell’Angiotensina II, del potassio e della
corticotropina (ACTH) sulla produzione dell’aldosterone da parte della zona glomerulare del surrene. (Namita Hattangady, Lawrence Olala, Wendy B. Bollag and William E. Rainey. Acute and Chronic Regulation of Aldosterone Production. Mol Cell Endocrinol. 2012 March 24; 350(2): 151– 162. doi:10.1016/j.mce.2011.07.034).
Variazioni della concentrazione plasmatica o tissutale di sodio possono modulare la secrezione di aldosterone tramite un’azione indiretta sulla secrezione di renina e, in minor misura, tramite un’azione diretta sulla sintesi di angiotensina II. L’iposodemia stimola, mentre l’ipersodemia deprime la produzione di aldosterone (12). Studi in vivo ed in vitro su modelli animali hanno dimostrato che la
vasopressina (AVP), le catecolamine, il neurotrasmettitore serotonina e il petide VIP stimolano la secrezione di aldosterone e cortisolo.
La loro azione è mediata dai recettori V1-AVP, dai recettori β1, dal sottotipo recettoriale 5-HT4R, dai recettori VIPR2/VIPR3, rispettivamente (13-24).
Invece la dopamina, il peptide natriuretico atriale (ANP) e la somatostatina inibiscono la produzione di aldosterone tramite il legame a siti specifici sulle cellule della glomerulosa surrenalica (25-27).
Meccanismi d’azione dell’aldosterone
I piu’ noti effetti dell’aldosterone sono mediati dal recettore mineralcorticoide (28,29); si tratta di un recettore a localizzazione intracellulare che appartiene alla superfamiglia dei recettori nucleari e, in quanto tale, presenta tre domini funzionali:dominio N-terminale o dominio A/B, domino di legame per il DNA o DBD, dominio C-terminale o LBD ( dominio di legame per il ligando).
Il recettore mineralcorticoide, in assenza di ormone, è mantenuto in una struttura trascrizionalmente inattiva dall’interazione, attraverso il suo sito LBD, con il complesso HSP (“heat-shock” protein) (hsp90, hsp70 e immunofilline) presente nel citoplasma. Il legame dell’aldosterone al recettore provoca una modificazione conformazionale del recettore stesso che comporta la dissociazione del complesso proteico (HSP complex), la dimerizzazione di due complessi ormone-recettore e la successiva traslocazione nel nucleo del dimero. Il ormone-recettore attivato si lega ad una sequenza specifica del DNA detta HRE (hormones response elements) che a sua volta attiva una serie di fattori di trascrizione che modulano la sintesi delle proteine indotte dall'aldosterone come le subunità dei canali sodio epiteliali posti a livello apicale (ENaC), dalla kinasi sgk-1 e da una pompa Na/K-ATPase basolaterale. Quindi l’induzione dell’espressione del gene per la kinasi
sgk-1 attiva una cascata di reazioni le quali permettono l’assorbimento di sodio e di acqua attraverso ENaC e l’escrezione di potassio con conseguente ipertensione (30).
Significato biologico dell’aldosterone
L'aldosterone contribuisce al mantenimento di un complesso meccanismo omeostatico che permette di preservare il bilancio sodico e di conseguenza la stabilità del volume del liquido extracellulare, e il mantenimento della pressione arteriosa (31). In particolare l’aldosterone provoca ritenzione di sodio, cloro, acqua ed escrezione di potassio.
L'effetto dell'aldosterone si esplica principalmente a livello del tubulo contorto distale e del dotto collettore del rene, dove l’ormone aumenta, legandosi ai recettori mineralcorticoidi, la permeabilità allo ione sodio della membrana apicale delle cosiddette cellule "principali", permettendone il riassorbimento combinato con acqua attraverso canali ionici (3).
Inoltre, l’aldosterone determina un aumento dell'esposizione, per esocitosi costitutiva, di canali del potassio a livello del tubulo distale, incrementando quindi la conduttanza dello ione attraverso l'epitelio e una sua maggiore escrezione nelle urine. Le conseguenze a breve termine di una stimolazione indotta dall’aldosterone sono quindi riassumibili con ipopotassiemia e ipersodiemia; a quest'ultima consegue un aumento del volume plasmatico e della pressione arteriosa.
Altri tessuti epiteliali bersaglio dell'aldosterone sono rappresentati dall’intestino e dalle ghiandole salivari e sudoripare. Anche in questi tessuti l'ormone agisce principalmente ritenendo sodio ed eliminando potassio.
Numerosi altri tessuti , non epiteliali, esprimono il recettore mineralcorticoide e sono quindi considerati organi bersaglio dell'aldosterone (cuore, SNC, leucociti, cellule endoteliali, cellule muscolari lisce vasali, spermatozoi).
L’aldosterone può essere sintetizzato anche a carico di tessuti extra-surrenalici quali il tessuto cerebrale, cardiaco e i vasi sanguigni ed esercitare a questi livelli attività paracrine ed autocrine (32). Numerosi dati sperimentali e clinici pubblicati nel corso dell’ultima decade hanno riconosciuto le conseguenze che l’aldosterone ha in particolare a livello cardiaco e vascolare. Nell’animale l’eccesso di aldosterone e sodio implica marcate alterazioni cardiache e vascolari (33) e nell’uomo l’iperaldosteronismo è associato a svariate complicanze cardiache e vascolari. L’aldosterone sembra in grado di indurre processi fibrotici, in particolare a livello cardiaco, che si realizzano attraverso l’attivazione del recettore mineralcorticoide e l’induzione aldosterone–dipendente di stress ossidativi (34).
Utilizzazione clinica dell’aldosterone
Per quanto riguarda gli aspetti clinici, la misura dell’aldosterone nel plasma è raccomandata dalle linee guida internazionali soprattutto per lo screening e la diagnosi dell’iperaldosteronismo primario (o primitivo) (35), che è causato da una ipersecrezione dell’ormone da parte delle ghiandole surrenali per la presenza di un adenoma funzionante (Sindrome di Conn), per iperplasia bilaterale o per alcune sindromi congenite assai rare, come l’aldosteronismo sensibile alla somministrazione di glucocorticoidi (glucocorticoid- remediable
aldosteronism) (35,36).
Recenti ricerche suggeriscono che l’iperaldosteronismo primario sia presente in circa il 10% di pazienti con diagnosi di ipertensione essenziale, specialmente quelli che presentano ipopotassiemia e valori di Attività Reninica Plasmatica
(PRA) soppressi (lowrenin hypertension) e quindi in questi soggetti a rischio è raccomandato il dosaggio dell’aldosterone plasmatico e/o urinario (35,36). Per quanto riguarda gli aspetti analitici della misura dell’aldosterone, il dosaggio di questo ormone steroideo nel siero e nelle urine presenta notevoli difficoltà a causa dei livelli circolanti estremamente bassi (dell’ordine di poche decine di pg/mL) e a causa della presenza contemporanea nelle matrici biologiche di una grande quantità di possibili interferenti.
L'aldosterone circola per lo più legato all'albumina mentre si lega debolmente alla globulina. Pertanto la quota libera di aldosterone ammonta circa al 30-50% della quota plasmatica totale, di conseguenza si tratta di un ormone con un'emivita relativamente breve dell'ordine dei 30 minuti (37). La maggior parte dell'aldosterone viene metabolizzato a livello epatico dove viene trasformato in tetraidroaldosterone; un’altro metabolita l'aldosterone 18-glucuronide viene prodotto a livello renale e rappresenta generalmente il 5-10% dell'aldosterone secreto.
I metodi di dosaggio comunemente utilizzati nei laboratori di analisi cliniche per la misura dell’aldosterone sono immunodosaggi di tipo competitivo. Già negli anni ’70 sono stati messi a punto i primi metodi RIA per il dosaggio dell’ormone (38), che generalmente si avvalevano di un passaggio preliminare di estrazione e/o purificazione cromatografica (gascromatografia o cromatografia su strato sottile o su colonna) per cercare di ridurre le interferenze specifiche e aspecifiche, e di concentrare il campione estratto in modo da aumentare la sensibilità analitica complessiva del dosaggio (39). Negli anni successivi sono stati prodotti antisieri e anticorpi monoclonali a più alta affinità e specificità che hanno permesso la messa a punto di metodi competitivi diretti, sia RIA che EIA (39,40). La disponibilità di metodi diretti ad alta sensibilità ha anche consentito il
dosaggio dello steroide nella saliva, che presenta livelli meno elevati rispetto al siero (41). Le stesse metodiche possono essere utilizzate anche per misurare l’aldosterone nelle urine; in questo caso sono generalmente necessarie delle modifiche ad hoc della procedura analitica (come l’idrolisi acida e/o l’estrazione del campione con un eventuale ulteriore passaggio cromatografico) (42,43). Infine, in questi ultimi anni sono stati sviluppati anche kit commerciali per il dosaggio dell’aldosterone utilizzabili su piattaforme automatizzate (40). Nonostante gli sforzi compiuti in tutti questi anni per migliorarne le prestazioni analitiche, il dosaggio diretto dell’aldosterone nei differenti fluidi biologici con metodi immunologici per competizione presenta tuttora delle criticità per quanto riguarda la sensibilità analitica e la presenza di interferenze specifiche e aspecifiche, per cui si ritiene che la spettrometria di massa, che utilizza anche un preliminare passaggio di purificazione cromatografica, sia la metodica di riferimento (44-46). Tuttavia, tale metodica risulta indaginosa, costosa e non può essere al momento raccomandata per la routine nei laboratori clinici, ma è, invece, utilizzata per la standardizzazione e la validazione dei metodi immunometrici diretti e per la preparazione di campioni di riferimento per il controllo di qualità (45).
SCOPO DELLA TESI
I metodi manuali immunometrici competitivi (RIA e spettrometria di massa) per il dosaggio dell’aldosterone risultano essere laboriosi e costosi e pertanto non sono particolarmente adatti alla routine nei laboratori clinici.
Recentemente, sono stati messi a punto e resi disponibili due nuovi metodi immunometrici competitivi diretti per la misura dell’aldosterone utilizzabili su piattaforme automatizzate (LIAISON e iSYS), che dovrebbero possedere caratteristiche analitiche migliori rispetto a quelli attualmente in commercio.
Pertanto l’obiettivo della tesi è stato:
1) Valutare le caratteristiche analitiche ed i risultati clinici ottenuti con il nuovo metodo di misura dell’aldosterone che si avvale della piattaforma automatizzata LIAISON (DiaSorin, Saluggia – VC).
2) Confrontare i valori di aldosterone misurati con questo nuovo metodo con quelli ottenuti, sugli stessi campioni, con il metodo RIA ALDO-CTK (DiaSorin, Saluggia - VC).
3) Confrontare i valori di aldosterone misurati con questo nuovo metodo con quelli ottenuti, sugli stessi campioni, con il metodo diretto automatizzato che utilizza la piattaforma iSYS (IDS, Boldon, UK - distributore italiano: Pantec srl, Torino).
4) Confrontare i valori ottenuti con questo nuovo metodo con la spettrometria di massa (metodica Perkin-Elmer).
5) Misurare con la piattaforma LIAISON 5 campioni di controllo distribuiti nella VEQ Immunocheck, ciclo 2012 (QualiMedLab srl, Pisa). I valori trovati sono stati confrontati con quelli ottenuti dai laboratori partecipanti con i metodi di dosaggio dell’aldosterone più utilizzati in Italia.
MATERIALI E METODI
Metodi analitici
Le caratteristiche cliniche e i risultati clinici dei due nuovi metodi immunometrici competitivi diretti utilizzabili su piattaforme automatizzate (LIAISON e iSYS) erano eseguiti indipendentemente in due diversi laboratori italiani (Laboratorio della Medicina, Fondazione CNR-Regione Toscana G.Monasterio, Pisa e Laboratorio di Chimica Clinica, Ospedale di San Bortolo, Vicenza).
I risultati clinici del metodo RIA ALDO-CTK (DiaSorin, Saluggia - VC) erano eseguiti nel Laboratorio della Medicina, Fondazione CNR-Regione Toscana G.Monasterio, Pisa) ed è il metodo attualmente utilizzato per la routine clinica del dosaggio dell’aldosterone.
Infine i risultati clinici mediante analisi Liquid Chromatography/Mass-Spectometry (LC/MS) erano eseguiti presso i laboratori della ditta Perkin-Elmer (Monza, Italia). Il metodo per il dosaggio dell’aldosterone eseguito sulla piattaforma LIAISON è un metodo competitivo che utilizza: un anticorpo monoclonale di pecora anti-aldosterone, aldosterone coniugato con un derivato dell’isoluminolo, particelle magnetiche (fase solida) ricoperte con anticorpo che lega l’Ab monoclonale di pecora anti aldosterone. Dopo l’eliminazione della frazione non legata si aggiungono i reagenti starter che danno inizio alla reazione chemiluminescente misurata in valori di unità di luce relativa (RLU), che risultano inversamente proporzionali alla concentrazione di aldosterone presente nel campione da misurare. Il tempo necessario per ottenere il primo risultato (turnaround time, TAT) è inferiore a 60 min.
Il metodo per il dosaggio dell’aldosterone che utilizza la piattaforma iSYS è un metodo competitivo costituito da un anticorpo anti-aldosterone biotinilato,
aldosterone coniugato con acridinio come tracciante e una fase solida, che utilizza particelle magnetiche ricoperte con streptavidina. Dopo una incubazione a 37ºC e un lavaggio per eliminare la quota non legata, viene misurata la luce emessa che è indirettamente proporzionale alla concentrazione di aldosterone presente nel campione da misurare. Il tempo necessario per ottenere il primo risultato (turnaround time, TAT) è inferiore a 60 min.
Il metodo RIA utilizza aldosterone marcato con 125I come tracciante, che compete con l’aldosterone presente nei calibratori, controlli e campioni per il legame all’anticorpo fissato su provette sensibilizzate. Dopo 18-22 ore di incubazione viene eliminato il tracciante non legato mediante aspirazione e poi è misurata la radioattività mediante contatore gamma. La quantità di aldosterone marcato legata è inversamente proporzionale alla concentrazione di aldosterone nei calibratori, controlli e campioni dei pazienti. Il tempo necessario per ottenere il primo risultato (turnaround time, TAT) è cira 18-24 ore.
Infine l’analisi Liquid Chromatography/Mass-Spectometry (LC/MS) eseguita presso i laboratori della ditta Perkin-Elmer utilizzava il metodo CHSTM MSMS Steroids Kit (prodotto da Wallac Oy, Turku, Finland).
Campioni
Nel Dipartimento di medicina cardiovascolare della Fondazione CNR – Regione Toscana “G. Monasterio” (Pisa, Italia) sono stati utilizzati prelievi di pazienti afferenti agli ambulatori, al day-service o ricoverati. Il prelievo di sangue è stato eseguito tra le 08:00 e le 09:00 dopo una notte di digiuno e dopo 15 min in posizione “seduta”. I campioni di sangue (8–10 mL) sono stati raccolti in tubi di polipropilene contenenti EDTA e subito centrifugati per 15 min a 4°C. Il plasma ottenuto è stato poi congelato e conservato a –20 °C in aliquote da 0,5 mL in
provette di polistirene fino al momento del dosaggio. In soggetti apparentemente sani, reclutati tra il personale del laboratorio e volontari inclusi in un programma di medicina preventiva, la presenza di iperaldosteronismo primario (o primitivo) è stata esclusa tramite valutazione della storia clinica, test di laboratorio e funzionali. La maggior parte dei soggetti sani con età > 40 anni sono appartenenti allo studio MELHP. Quest’ultimo è uno studio di screening che ha lo scopo di valutare la presenza di patologie cardiovascolari subcliniche in una popolazione generale asintomatica della comunità di Montignoso (Massa Carrara, Italia). Tutti i soggetti e pazienti hanno fornito il loro consenso informato per partecipare allo studio. Nell’Ospedale San Bortolo (Vicenza, Italia) sono stati utilizzati prelievi di volontari apparentemente sani con età compresa tra 21-65 anni, con normale pressione sanguigna e normali livelli di glucosio a digiuno. I criteri di esclusione erano l’assunzione di farmaci, una dieta ristretta prescritta dal medico, gravidanza e l’uso di contraccettivi orali. Il prelievo di sangue è stato eseguito tra le 07:00 e le 12:00 in soggetti in piedi o posizione “seduta”: nei soggetti in piedi il prelievo è stato effettuato dopo due ore di camminata e nei soggetti in posizione “supina” il prelievo è stato effettuato dopo almeno un’ora di posizione “supina”.
L’analisi Liquid Chromatography/Mass-Spectometry (LC/MS) è stata eseguita presso i laboratori della ditta Perkin-Elmer (Monza, Italia) in 30 campioni di siero conservati in provette di vetro.
Sono stati utilizzati anche 5 campioni di controllo distribuiti nella VEQ Immunocheck (programma Ormoni 2) nel corso del ciclo annuale 2012.
VEQ Immunocheck
Il VEQ Immunocheck, condotto da QualiMedLab CNR (Pisa,Italia) in cooperazione con ProBioQual (Lione, Francia) era stabilito all’inizio degli anni ‘80. QualiMedLab
è uno “spin-off” del Consiglio Nazionale delle Ricerche (CNR) e opera insieme all’Istituto di Fisiologia Clinica e la Fondazione G.Monasterio di Pisa. I dettagli di come QualiMedLab opera possono essere trovati sul sito web (http://www.qualimedlab.it).
Per la preparazione dei campioni coinvolti nello studio, vari prelievi di plasma raccolti in tubi contenenti EDTA sono stati raggruppati insieme in modo d’avere un pool con un volume finale di circa 100 ml, che è stato immediatamente conservato a -20°C. Tutti i campioni sono stati testati per as senza di HBsAg, antiHCV e antiHIV. I pool di plasma sono stati preparati utilizzando residui di plasma raccolti da soggetti apparentemente sani e pazienti con malattie cardiovascolari, raccolti nel laboratorio della Fondazione G.Monasterio.
Ogni campione è stato raccolto da circa 30-50 soggetti / pazienti. I soggetti e pazienti hanno dato il consenso informato per l'uso dei residui del loro plasma. I campioni di studio sono stati inviati per posta come materiali liofilizzati. La procedura di liofilizzazione è stata eseguita da Polymed (Sambuca, Firenze, Italia) entro due settimane dopo la preparazione dei pool. I pool sono stati scongelati, poi distribuiti in approssimativamente 200 fiale (ciascuno contenente un volume di plasma / siero di 3.0 ml), ed infine liofilizzati. Le concentrazioni plasmatiche dell’ aldosterone di tutti i campioni di studio sono stati misurati prima e dopo il processo di liofilizzazione dal laboratorio di riferimento per e i campioni con risultati inaffidabili sono stati scartati.
Analisi statistica
Le analisi statistiche standard sono state eseguite su Macintosh Dual 2.3 GHz PowerPC G5 con il programma Stat-View 5.0.1 (1992-98, SAS Istitute Inc., SSA Campus Drive, Cary, NC, USA).
RISULTATI
Valutazione della sensibilità e riproducibilità analitica del metodo LIAISON
Il limite del bianco (LoB) e di rivelazione (LoD) del metodo per il dosaggio dell’aldosterone con piattaforma LIAISON sono stati determinati in accordo con il protocollo CLSI EPI17-A (47). In particolare, il valore del LoB è stato calcolato valutando l’errore medio nella lettura del segnale (media= 132523 RLU, ds = 9339 RLU) di una soluzione non contenente aldosterone (soluzione fisiologica), considerata come bianco del metodo, misurandola 65 volte in 5 sedute analitiche differenti, utilizzando due differenti lotti di calibratori.
Il valore di LoB è stato poi calcolato sottraendo a questo valore medio il prodotto di 1,645 per la ds 13, ottenendo 117161 RLU, valore che è stato interpolato sulla retta di calibrazione media, ottenuta misurando 125 campioni con valori di aldosterone inferiori a 100 pg/mL (RLU= 131791 - 812 Aldosterone, R= 0,947). Il valore del LoD è poi stato calcolato secondo la formula: LoD = LoB + 1,645 ds 13, dove la ds (7,4 pg/mL) è stata calcolata su un pool di plasma con bassa concentrazione di aldosterone, misurato 20 volte in sedute analitiche differenti con un CV del 31,2% (concentrazione media 23,6 pg/mL). I valori del LoB e del LoD, così calcolati, sono quindi risultati corrispondere rispettivamente a 18,0 pg/mL e 30,2 pg/mL di aldosterone.
La riproducibilità del metodo è stata valutata in accordo con il protocollo CLSI EP5-A2 (48), misurando, due volte al giorno, per 20 giornate lavorative consecutive, 2 campioni di plasma EDTA (in doppio) con concentrazione media di aldosterone di 65,1 pg/mL (campione A) e 139,4 pg/mL (campione B), rispettivamente. I risultati sono riportati in tabella 1.
Tabella 1. Riproducibilità del metodo di dosaggio dell’aldosterone che utilizza la piattaforma
LIAISON.
Campioni Media, pg/mL Imprecisione nel saggio, CV %
Imprecisione totale, CV %
Campione A 65,1 12,9 14,1
Campione B 139,4 8,1 10,1
Il profilo di imprecisione tra saggi (n=20) è stato calcolato prendendo in considerazione i valori di 7 campioni di plasma EDTA con concentrazioni medie di aldosterone da 23,6 pg/mL a 348,8 pg/mL, raccolti da campioni di soggetti adulti sani e pazienti cardiopatici (Fig 5).
Figura 5. Profilo di imprecisione In figura è mostrato il profilo di imprecisione medio (20 ripetizioni
in un periodo temporale di due mesi, utilizzando due differenti lotti di calibratori e tre differenti calibrazioni) del metodo di dosaggio automatizzato dell’aldosterone, che utilizza la piattaforma LIAISON. Sono indicati in figura i valori della concentrazione dell’aldosterone corrispondente rispettivamente ad un errore (limite di quantificazione, LoQ) del 10 CV% e del 20 CV %.
Tale profilo è stato eseguito misurando tali campioni, per 20 giorni lavorativi, utilizzando due lotti di calibratori differenti. I valori del limite di quantificazione (LoQ) al 20% CV e al 10% CV sono risultati corrispondere ad una concentrazione di aldosterone pari a 40,0 pg/mL e 95,0 pg/mL, rispettivamente.
Confronto dei risultati ottenuti
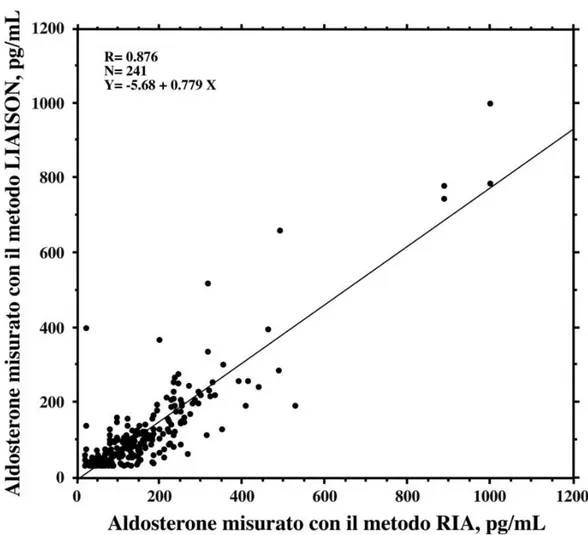
Abbiamo confrontato i risultati ottenuti con il metodo LIAISON con quelli del metodo RIA, attualmente utilizzato nel nostro laboratorio, misurando la concentrazione di aldosterone in 241 campioni plasmatici di soggetti apparentemente sani e pazienti con malattie cardiovascolari (Fig. 6).
Figura 6. Confronto tra i valori ottenuti con la piattaforma automatizzata LIAISON ed il metodo RIA.
Il grafico rappresenta la regressione lineare tra i valori ottenuti misurando l’aldosterone con i due metodi in 241 campioni plasmatici riferentesi a soggetti apparentemente sani e pazienti con malattie cardiovascolari.
I risultati dei due metodi risultano ben correlati; tuttavia il metodo LIAISON presenta una sottostima media rispetto al metodo RIA del -11,2% (ds 118,2%, p<0,0001 con Wilcoxon Signed Rank test) (Fig. 7).
Figura 7. Il grafico rappresenta in ordinata (asse delle Y) i valori della differenza percentuale tra i
risultati ottenuti con i due metodi [(LIAISON-RIA)/RIA x 100] ed in ascissa (asse della X) i valori del metodo RIA. Il valore della differenza media trovata (-11,2%) è anche indicato nella figura con una linea.
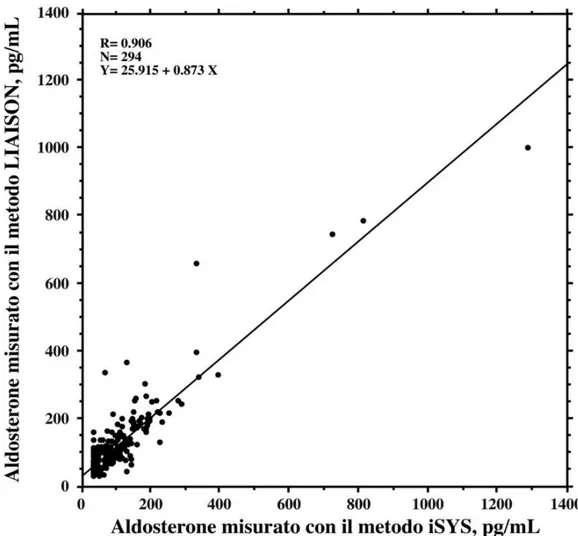
Abbiamo anche confrontato il nuovo metodo che utilizza la piattaforma LIAISON con il metodo che utilizza la piattaforma iSYS, misurando 294 campioni plasmatici di soggetti apparentemente sani e pazienti con malattie cardiovascolari (Fig. 8).
Figura 8. Confronto tra i valori ottenuti con le piattaforme automatizzate LIAISON e iSYS. Il grafico
rappresenta la regressione lineare tra i valori ottenuti misurando l’aldosterone con i due metodi automatizzati in 294 campioni plasmatici riferentesi a soggetti apparentemente sani e pazienti con malattie cardiovascolari.
I due metodi hanno mostrato risultati in buon accordo tra di loro; tuttavia, si rileva un bias significativo (Wicoxon signed rank test p<0,0001) tra i due metodi [(LIAISON - iSYS)/iSYS %], per cui il metodo LIAISON presenta mediamente una sovrastima del 27,5% (ds 59.5) rispetto al metodo iSYS (Fig. 9).
Figura 9. Il grafico rappresenta in ordinata (asse delle Y) i valori della differenza percentuale tra i
risultati ottenuti con i due metodi [(LIAISON-iSYS)/iSYS x 100] ed in ascissa (asse della X) i valori del metodo iSYS. Il valore della differenza media trovata (+27,5%) è anche indicato nella figura con una linea.
Infine, il metodo LIAISON ha mostrato una correlazione significativa anche con il metodo di spettrometria di massa, ottenuta misurando con entrambi i metodi la concentrazione di aldosterone in 30 campioni di soggetti apparentemente sani e pazienti con malattie cardiovascolari (Fig. 10).
Figura 10. Confronto tra i valori ottenuti con le piattaforme automatizzate LIAISON e la
spettrometria di massa (metodica Perkin-Elmer). Il grafico rappresenta la regressione lineare tra i valori ottenuti misurando l’aldosterone in 30 campioni riferentesi a soggetti apparentemente sani e pazienti con malattie cardiovascolari con la metodica della spettrometria di massa (asse delle ascisse) e la metodica automatizzata LIAISON (asse delle ordinate).
Confronto tra i risultati ottenuti in campioni di controllo esterno di qualità
Abbiamo riportato in tabella 2 i risultati del confronto tra i valori ottenuti nel nostro laboratorio con il metodo di dosaggio con la piattaforma LIAISON in 5 campioni di controllo, distribuito nella VEQ Immunocheck nell’anno 2012, e quelli ottenuti dai laboratori partecipanti che utilizzano i più comuni metodi per il dosaggio dell’aldosterone disponibili in Italia. È stata trovata una correlazione significativa (R= 0,936, N= 5, p= 0,0191) tra i valori di aldosterone misurati in 5 campioni di controllo con la piattaforma LIAISON e la media di consenso calcolata con i
risultati ottenuti da tutti i laboratori partecipanti con i metodi immunometrici più utilizzati in Italia (Tab. 2).
Tabella 2. Confronto tra i valori di aldosterone misurati con le piattaforme LIAISON e iSYS nel
laboratorio degli autori e i valori misurati dai partecipantialla VEQ Immunocheck con i metodi immunometrici più diffusi in Italia.
CONSENSUSa ALDO-CTK,
Dia-Sorin, (RIA)a LIAISON® Dia-Sorin b ISYS, IDSb Media Aldosterone (pg/mL) CV% n=649 Media Aldosterone (pg/mL) CV% n=196 Media Aldosterone (pg/mL) CV% n=10 Media Aldosterone (pg/mL) CV% n=10 IH31a 72.1 38.9 92.4 13.2 41.9 8.5 51.5 15.9 IH31b 227.1 33.1 304.1 12.9 201.5 2.3 273.3 11.6 IH32b 242.7 31.9 308.6 12.7 161.6 2.2 239.6 5.3 IH33a 119.1 40.8 163.6 16.7 87.4 3.1 122.1 6.4 IH33b 85.4 44.4 133.7 15.4 88.0 3.8 85.6 8.1
CONSENSUS: media di consenso dei risultati ottenuti da tutti i laboratori partecipanti alla VEQ Immunocheck con tutti i metodi utilizzati
a
Risultati ottenuti dai laboratori partecipanti alla VEQ.
b
Risultati ottenuti nel laboratorio degli autori utilizzando rispettivamente le piattaforme LIAISON e iSYS.
Valutazione dei limiti di riferimento nella popolazione normale
L’aldosterone è stato misurato, con il metodo automatizzato LIAISON, in campioni di plasma ottenuti dopo un riposo di 15 minuti in posizione seduta da 147 soggetti apparentemente sani, di cui 59 maschi (età 48,0 ± 11,7 anni i) e 88 femmine (età 51,0 ± 10,8 anni).
È stata trovata una differenza significativa (p= 0,0059 con il test non parametrico di Mann-Whitney) tra il valore medio osservato nelle femmine (media ± ds = 110,7 ± 59,9 pg/mL, mediana 97,8 pg/mL) e quello misurato nei maschi (media ± ds = 89,0 ± 50,3 pg/mL, mediana 73,68 pg/mL).
Considerando la popolazione totale, la media della concentrazione dell’aldosterone è risultata essere di 102,2 pg/mL, la mediana 88,8 pg/mL e l’intervallo interquartile compreso tra 64,1 e 131,8 pg/mL, mentre il 97,5° percentile è risultato essere di 248,2 pg/mL ed il 2,5° percen tile rispettivamente di 13,0 pg/mL, cioè inferiore al valore del bianco del metodo (LoB). Infine, è stata trovata una correlazione inversa significativa tra i valori dell’età e la concentrazione di aldosterone (Rho= -0,288, p= 0,0005 con il test di correlazione per ranghi di Spearman).
DISCUSSIONE
Il metodo RIA, comunemente usato per il dosaggio dell’aldosterone nei campioni di sangue e di urine, attualmente mostra alcune criticità analitiche:
• tempi lunghi di refertazione anche a causa dell’incubazione overnight (fino a 18 ore).
• necessità di raggruppare parecchi campioni prima di procedere all’analisi in modo da minimizzare i costi.
• ravvicinate date di scadenza per i reagenti radioattivi (di solito meno di 60 giorni).
• inconvenienti inerenti alle procedure di utilizzo e di smaltimento dei rifiuti radioattivi.
Questo studio dimostra che il nuovo metodo immunometrico competitivo per il dosaggio dell’aldosterone, che si avvale della piattaforma automatizzata LIAISON, mostra caratteristiche analitiche superiori rispetto al metodo RIA utilizzato nel nostro laboratorio.
In particolar modo, questo nuovo metodo completamente automatizzato permette di processare pochi campioni in meno di un’ora (TAT circa 40min); inoltre la data di scadenza dei reagenti e dei materiali è superiore ai 9 mesi.
Inoltre i risultati dimostrano che i valori di aldosterone misurati con questo nuovo metodo sono correlati con quelli ottenuti con il metodo RIA attualmente utilizzato per la routine clinica nel nostro laboratorio (Fig. 6 e 7), con un metodo diretto che utilizza la piattaforma automatizzata iSYS (Fig. 8 e 9) e con una metodica che utilizza la spettrometria di massa (Fig. 10).
Infine i risultati ottenuti nel nostro laboratorio con il metodo LIAISON in 5 campioni di controllo, distribuiti nella VEQ Immunocheck, mostrano una correlazione
significativa con quelli ottenuti dai laboratori partecipanti con i metodi di dosaggio dell’aldosterone più utilizzati in Italia (Tab. 2). La misura dell’aldosterone nel plasma o urine è raccomandata dalle linee guida internazionali soprattutto per lo screening e la diagnosi dell’iperaldosteronismo primario (o primitivo) (7), in pazienti ad alto rischio per queste condizioni cliniche. Comunque numerosi dati sperimentali e clinici pubblicati nel corso dell’ultima decade hanno dimostrato un’associazione tra un’eccessiva produzione tissutale di aldosterone e le malattie cardiovascolari.
Infatti studi sia sull’uomo che sull’animale hanno dimostrato un consistente effetto benefico dopo trattamento con antagonisti dell’aldosterone sulla 1) funzione endoteliale, 2) modulazione dei meccanismi infiammatori tra sangue e parete vascolare 3) riduzione della proliferazione tissutale e del rimodellamento caridiaco che portano a diversi gradi di severità di danno cardiaco (49).
Recentemente diversi studi hanno dimostrato l’utilità di un terapia anti-aldosterone nel prevenire l’ipertrofia del miocardio e processi fibrotici cardiaci e vascolari (50,51).
In questi studi però i livelli di aldosterone di solito non erano misurati, probabilmente dato che il metodo RIA era considerato poco adatto per grandi studi clinici.
CONCLUSIONI
In conclusione, il metodo di dosaggio dell’aldosterone che utilizza la piattaforma automatizzata LIAISON sembra essere preferibile al metodo RIA in quei laboratori, che già utilizzano la piattaforma LIAISON per il dosaggio di altri analiti, e che devono eseguire il dosaggio di questo ormone in pochi campioni ogni giorno, fornendo, quindi, al clinico una risposta in tempi rapidi (meno di 60 min).
Inoltre questo nuovo metodo potrebbe essere adatto per monitorare i livelli di aldosterone in pazienti con malattie cardiovascolari.
RIFERIMENTI BILIOGRAFICI
1) Zwemer RL, Sullivan RC. Blood chemistry of adrenal insufficiency in cats. Endocrinology. 1934;18:97–106
2) Simpson SA, Tait JF, Wettstein A, Neher R, Von Euw J, Reichstein T. [Isolation from the adrenals of a new crystalline hormone with especially high effectiveness on mineral metabolism]. Experientia 1953;9:333-335.
3) Williams GH. Aldosterone biosynthesis, regulation, and classical mechanism of action. Heart Fail Rev 2005; 10: 7-13.
4) Orth DN, Kovacs WJ The adrenal cortex. In: Wilson JD, Foster DW, Kronenberg HM, Larsen PR (eds) Williams’ Textbook of Endocrinology 1998. W.B. Saunders Co, Philadelphia, pp517-664.
5) Matthew D. Taves, Celso E. Gomez-Sanchez, Kiran K. Soma. Extra-adrenal glucocorticoids and mineralocorticoids: evidence for local synthesis, regulation, and function. American Journal of Physiology - Endocrinology and MetabolismPublished 1 July 2011 Vol. 301no. E11-E24DOI: 10.1152/ajpendo.00100.2011.
6) Karl T. Weber, M.D. Aldosterone in Congestive Heart Failure. N Engl J Med 2001; 345:1689-1697
7) Akira Nishiyama and Shokei Kim-Mitsuyama. New Approaches to Blockade of the Renin–Angiotensin–Aldosterone System: Overview of Regulation of the Renin–Angiotensin–Aldosterone System. J Pharmacol Sci 113, 289 – 291 (2010).
8) Goodfriend TL, Gibbson GH, Dzau VJ et Al. Interaction of signals influencing rennin release. Annu Rev Physiol 1984; 46:291-308.
9) HimatongKam T, Dluhy RG, Williams GH. Potassium-aldosterone renin interrelationships. J Clin Endocrinol Metab 1975 ; 41 :153-159.
10) Abayasekara DRE, Vazir H, Whitehouse BJ et al. Studies on the mechanisms of ACTHinduced inhibition of aldosterone biosynthesis in the rat adrenal cortex. J Endocrinol 1989;122:625-632.
11) Namita Hattangady, Lawrence Olala, Wendy B. Bollag and William E. Rainey. Acute and Chronic Regulation of Aldosterone Production. Mol Cell Endocrinol. 2012 March 24; 350(2): 151–162. doi:10.1016/j.mce.2011.07.034.
12) Hollenberg NK, Chenitz WR, Adams DF, et al. Reciprocal influence of salt intake on adrenal glomerulosa and renal vascular response to angiotensin II in normal man. J Clin Invest 1974; 54:34-42.
13) Lacroix A, N’Diaye N, Tremblay J, Hamet P. Ectopic and abnormal Hormone Receptors in Adrenal Cushing’s Syndrome. Endo Rev 2001; 22:75-110.
14) Bird IM, Nicol M, Williams BC, Walker SW Vasopressin stimulates cortisol secretion and phosphoinositide catabolism in cultured bovine adrenal fascicolata/reticularis cells. J Mol Endocrinol 1990; 5:109-116.
15) Hinson JP, Vinson GP, Porter ID, Whitehouse BJ Oxytocin and arginine vasopressin stimulate steroid secretion by the isolated perfused rat adrenal gland. Neuropetides 1987; 10:1-7.
16) Guillon G, Grazzini E, Andrez M, Breton C, Trueba M, Serradeil-LeGal C, Boccara G, Derick S, Chouinard L, Gallo-Payet N. Vasopressin: a potent autocrine/paracrine regulator of mammal adrenal functions. Endocr Res 24:703-710.
17) Mazzocchi G, Gottardo G, Nussdorfer GG Catecholamines stimulate steroid secretion of dispersed fowl adrenocortical cells, acting through the ß-receptor subtype. Horm Metab Res 1997; 29:190–192.
18) Lefebvre H, Contesse V, Delarue C, Vaudry H, Kuhn JM. Serotonergic regulation of adrenocortical function. Horm Metab Res 1998; 30:398–403.
19) Hinson JP, Vinson GP, Pudney J, Whitehouse BJ Adrenal mast cells modulate vascular and secretory responses in the intact adrenal gland of the rat. J Endocrinol 1989; 121:253–260.
20) Lefebvre H, Contesse V, Delarue C, Feuilloley M, Hery F, Grise P, Raynaud G, Verhofstad AA, Wolf LM, Vaudry H. Serotonin-induced stimulation of cortisol secretion from human adrenocortical tissue is mediated through activation of a serotonin4 receptor subtype. Neuroscience 1992;47:999– 1007.
21) Lefebvre H, Contesse V, Delarue C, Legrand A, Kuhn JM, Vaudry H, Wolf LM. The serotonin-4 receptor agonist cisapride and angiotensin-II exert additive effects on aldosterone secretion in normal man. J Clin Endocrinol Metab 1995; 80:504–507.
22) Mantero F, Opocher G, Boscrao M, Armanini D. Effect of serotonin on plasma aldosterone in man. J Endocrinol Invest 5:97-99.
23) Nussdorfer GG, Malendowicz LK. Role of VIP, PACAP, and related peptides in the regulation of the hypothalamo-pituitary-adrenal axis. Peptides 1998; 19:1443–1467.
24) Bornstein SR, Haidan A, Ehrhart-Bornstein M. Cellular communication in the neuroadrenocortical axis: role of vasoactive intestinal polypeptide (VIP). Endocr Res 1996;22:819–829.
25) Missale C, Memo M, Liberini P, Spano P. Dopamine selectively inhibits angiotensin IIinduced aldosterone secretion by interacting with D-2 receptors. J Pharmacol Exp Ther 1988; 246:1137–1143.
26) Cherradi N, Brandenburger Y, Rossier MF, Vallotton MB, Stocco DM, Capponi AM. Atrial natriuretic peptide inhibits calcium-induced steroidogenic acute regulatory protein gene transcription in adrenal glomerulosa cells. Mol Endocrinol 1998;12:962–972.
27) Boscaro M, Scaroni C, Edwards CR, Mantero F. Inhibitory effect of somatostatin on the aldosterone response to angiotensin II: in vitro studies. J Endocrinol Invest 1982; 5:173-177.
28) Arizza JL, Weinberger C, Cerelli G, et al. Cloning of human mineralocorticoid receptor complementary DNA: structural and functional kinship with the glucocorticoid receptor. Science 1987; 237:268-275.
29) Aranda A, Pascual A. Nuclear hormone receptors and gene expression. Physiol Rev 2001;81:1269-304.
30) David Pearce. The role of SGK1 in hormone-regulated sodium transport.TRENDS in Endocrinology & Metabolism. Vol.12 No.8 October 2001.
31) Williams G et Al 2003 50th Anniversary of Aldosterone. J Clin Endocrinol Metab88(6):2364-2377.
32) Takeda Y, Miyamori I, Yoneda T, Iki K, Hatakeyama H, Blair IA, Hswih FY, Takeda R. Production od aldosterone in isolated rat blood vessels. Hypertension 1995; 25:170-173.
33) Brilla CG, Maisch B, Rupp H, Funck R, Zhou G, Weber KT. Pharmacological modulation of cardiac fibroblast function. Herz 1995; 20:127-134.
34) Rocha R, Funder JW. The pathophysiology of aldosterone in the cardiovascular system. Ann N Y Acad Sci 2002, 970:89-100.
35) Funder JW, Carey RM, Fardella C, et al. Case detection, diagnosis, and treatment of patients with primary aldosteronism: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2008; 93: 3266-81.
36) Giacchetti G, Mulatero P, Mantero F, et al. Primary aldosteronism, a major form of low renin hypertension: fromscreening to diagnosis. Trends Endocrinol Metab 2008; 19: 104-8.
37) Tait JF, Tait SA, Little B, Laumas KR. The disappearance of 7-H3-d-aldosterone in the plasma of normal subjects. J Clin Invest 1961; 40:72-80.
38) Bayard F, Beitins I, Kowarski A, Migeaon C. Measurement of plasma aldosterone by radioimmunoassay. J Clin Endocrinol Metab 1970; 31: 1–6.
39) Miller M, Sagnella G, MacGregor G. Extraction method and nonex-tracted kit method compared for measuring plasma aldosterone. Clin Chem 1997; 43:1995–7.
40) Schirpenbach C, Seiler L, Maser-Gluth C, et al. Automated chemiluminescence-immunoassay for aldosterone during dynamic testing: comparison to radioimmunoassay with and without extraction steps. Clin Chem 2006; 52:1749–55.
41) Manolopoulou J, Mulatero P, Maser-Gluthc C, et al. Saliva as a medium for aldosterone measurement in repeated sampling studies. Steroids 2009; 74: 853-8.
42) Walsh PR, Wang MC, Turner EA. Non-chromatographic radioimmunoassay procedure for urinary aldosterone. Clin Chem 1979; 25: 1226-9.
43) Al-Dujaili EA, Edwards CR. Development and application of a simple radioimmunoassay for urinary aldosterone. Clin Chim Acta 1981; 116: 277-87.
44) Stöckl D, Reinauer H, Thienpont LM, De Leenheer AP. Determination of aldosterone in human serum by isotope dilution gas chromatography/mass spectrometry using a new heptafluorobutyryl derivative. Biol Mass Spectrom 1991; 20: 657-64.
45) Thienpont LM, Van Nieuwenhove B, Stöckl D, et al. Determination of reference method values by isotope dilution- gas chromatography/mass spectrometry: a five years' experience of two European Reference Laboratories. Eur J Clin Chem Clin Biochem 1996; 34: 853-60.
46) Taylor PJ, Cooper PD, Gordon RD, Michael Stowasser M. Measurement of aldosterone in human plasma by semiautomated HPLC–tandem mass spectrometry. Clin Chem 2009; 55: 1155-62.
47) CLSI EP17-A protocol. Protocols for determination of limits of detection and limits of quantitation; approved guidelines. 2004, Vol. 24, No. 34. Wayne, Pennsylvania.
48) CLSI EP5-A2 protocol. Evaluation of precision performance of quantitative measurement methods; Approved guideline— Second edition. 2004, Vol. 24, No. 25. Wayne, Pennsylvania.
49) Martinez FA. Aldosterone inhibition and cardiovascular protection: more important than it once appeared. Cardiovasc Drugs Ther 2010; 24:345-50.
50) Boccanelli A, Mureddu GF, Cacciatore G, Clemenza F, Di Lenarda A, Gavazzi A, et al. Anti-remodelling effect of canrenone in patients with mild chronic heart failure (AREA IN-CHF study): final results. Eur J Heart Fail 2009; 11: 68-76.
51) Kasama S, Toyama T, Sumino H, Kumakura H, Takayama Y, Minami K, et al. Effects of mineralcorticoid receptor antagonist spironolactone on cardiac sympathetic nerve activity and prognosis in patients with chronic heart failure. Int J Cardiol 2013; 167:244-9.
RINGRAZIAMENTI
Desidero ringraziare anzitutto il Prof. Aldo Clerico per avermi coinvolto in questo studio e per il fatto di essere sempre stato una guida sapiente e un punto di riferimento costante durante tutto il mio percorso universitario.
Un ringraziamento particolare va alla Dott.ssa Concetta Prontera per il suo indispensabile aiuto e la sua gentile disponibilità.
Ringrazio il Prof. Antonio Lucacchini, direttore della scuola di specializzazione e i miei colleghi e compagni di “avventura” con i quali abbiamo iniziato e concluso l'esperienza della scuola di specializzazione: Annalisa, Cecilia, Daria, Luca, Marzia, Monica, Tiziana e Tommaso.
Inoltre vorrei ringraziare con affetto i miei genitori e mio fratello per avermi da sempre sostenuta e incoraggiata non solo nel mio percorso di studi ma in ogni circostanza credendo in me e nelle mie scelte.
Infine ho desiderio di ringraziare di cuore mio marito la cui presenza è stata per me sorgente di forza e coraggio indispensabile per tutti questi anni.

![Figura 7. Il grafico rappresenta in ordinata (asse delle Y) i valori della differenza percentuale tra i risultati ottenuti con i due metodi [(LIAISON-RIA)/RIA x 100] ed in ascissa (asse della X) i valori del metodo RIA](https://thumb-eu.123doks.com/thumbv2/123dokorg/8004090.121237/26.892.221.737.279.811/figura-rappresenta-ordinata-differenza-percentuale-risultati-ottenuti-liaison.webp)
![Figura 9. Il grafico rappresenta in ordinata (asse delle Y) i valori della differenza percentuale tra i risultati ottenuti con i due metodi [(LIAISON-iSYS)/iSYS x 100] ed in ascissa (asse della X) i valori del metodo iSYS](https://thumb-eu.123doks.com/thumbv2/123dokorg/8004090.121237/28.892.200.766.113.636/figura-rappresenta-ordinata-differenza-percentuale-risultati-ottenuti-liaison.webp)
