INDICE GENERALE
ABSTRACT
pag.1RIASSUNTO
pag.31.
INTRODUZIONE
pag. 51.1. DOPAMINA pag. 5
1.2. RECETTORI ACCOPPIATI ALLE PROTEINE G:
STRUTTURA E TRASDUZIONE DEL SEGNALE pag. 7
1.3. RECETTORI DOPAMINERGICI pag. 13
1.3.1 Recettori D1-like (Espressione e funzione) pag. 14 1.3.2 Recettori D2-like (Espressione e funzione) pag. 15 1.3.3 Varianti di splicing dei recettori dopaminergici pag. 19 1.3.4 Polimorfismi dei recettori dopaminergici pag. 21 1.4. DIMERIZZAZIONE TRA RECETTORI ACCOPPIATI
ALLE PROTEINE G pag. 23
1.4.1. Evidenze di dimeri recettoriali pag. 25 1.4.2. Meccanismi di dimerizzazione recettoriale pag. 29 1.5. SISTEMA DOPAMINERGICO: PATOLOGIE,
FARMACI E DROGHE pag. 31
2. MATERIALI E METODI
pag. 342.1 PREPARAZIONE DEI FRAMMENTI RECETTORIALI pag. 35
2.1.1 Preparazione del frammento recettoriale D2trunk (pRc/CMV) pag. 35
2.1.2. Preparazione del frammento recettoriale D2tail (pRc/CMV) pag. 36
2.1.3. Preparazione del frammento recettoriale D3trunk (pRc/CMV) pag. 36
2.1.4 Preparazione del frammento recettoriale D3tail (pRc/CMV) pag. 37
2.3. METODICA UTILIZZATA PER LO STUDIO DI BINDING
DEI RECETTORI pag. 38
2.4. METODICA UTILIZZATA PER DETERMINARE LA FUNZIONE
DEI RECETTORI SULL’ENZIMA ADENILATO CICLASI ([3H]-cAMP) pag. 39
2.5. STATISTICA pag. 39
3. RISULTATI
pag. 413.1 PROFILI DI BINDING SU RECETTORI CHIMERICI FRAMMENTATI D2TRUNK/D3TAIL E D3TRUNK/D2TAIL CONFROMTATI CON I MONOMERI
WILD TYPE D2L E D3 pag. 41
3.2. PROFILI DI BINDING IN MEMBRANE DI CELLULE COS-7 CO-TRASFETTATE CON MONOMERI D2L E D3 PARAGONATI
A QUELLI DI MEMBRANE TRASFETTATE SEPARATAMENTE
CON I RECETTORI D2L E D3 pag. 42
3.3. INIBIZIONE DELL’ATTIVITÁ DELL’AC-V/VI STIMOLATA CON FORSCOLINA IN CELLULE CO-TRASFETTATE CON I RECETTORI
D2L E D3 pag. 45
3.4. INIBIZIONE DELL’ATTIVITÁ DELL’AC-V/VI STIMOLATA CON FORSCOLINA,DA PARTE DEL S32504 SURECETTORI
CHIMERICI FRAMMENTATI D2TRUNK/D3TAIL E D3TRUNK/D2TAIL pag. 48
3.4. INFLUENZA DELLA TOSSINA DELLA PERTOSSE SULLA MODULAZIONE DELL’ATTIVITÁ DELL’AC-V/VI STIMOLATA CON FORSCOLINA DA PARTE DI AGONISTI IN CELLULE
CO-TRASFETTATE CON D2L/D3 pag. 50
4. DISCUSSIONE
pag. 514.1. FORMAZIONE DEGLI ETERODIMERI DOPAMINERGICI D2L/D3 pag. 51
4.2. BINDING DI AGONISTI VERSO ETERODIMERI D2L/D3 RISPETTO AI
MONOMERI E RECETTORI CHIMERICI FRAMMENTATI pag. 51 4.3. ACCOPPIAMENTO FUNZIONALE DEGLI ETERODIMERI D2L/D3 pag. 53 CON LA AC-V/VI
5. CONCLUSIONI
pag. 54ABSTRACT
G-protein-coupled-receptor (GPCRs) are the most commonly used signal transduction system in the animal kingdom and represent the major target for pharmaceutical compounds. In the recent years, biophysical and pharmacological approaches have discovered the existence of new receptor complexes such as homo- or hetero-dimers raising fascinating combinatorial possibilities in the signal transduction system and providing a novel tool for new therapeutic drugs.
Dopamine receptors are members of the GPCRs family and have been shown to exist as homodimers or higher order oligomers in cellular systems. Furthermore, evidence for heterodimerization has recently been provided for dopamine D1 and adenosine A1 receptors, as well as for the dopamine D2
and somatostatin SSTR5 receptors.Alterations in the dopamine system are present in Parkinson’s
disease and contribute to neuropsychiatric illnesses such as psychosis and drug addition; in these pathologies dopamine receptors are targets for therapeutically relevant compounds. Many pharmacological agents for Parkinson’s disease and schizophrenia interact particularly with the D2
-like receptor subfamily such as D2 and D3 receptors. The D3 dopamine receptor, compared to D2, has a
greater affinity for dopamine and several other dopamine agonists, but on the contrary it is weakly coupled to G proteins. Furthermore, D2 and D3 receptors have a high degree of sequence homology
and are often co-expressed in the same neuron in native tissues. These considerations prompted us to study the possibility that D2 and D3 receptors interact functionally by forming receptors heterodimers
combining their pharmacological and functional characteristics.
At first this kind of interaction was proposed to explain dimerization between two chimeric inactive receptors. In particular from 2-adrenergic and M3-muscarinic receptors were created two chimeric
receptors called 2/ M3 and M3/2, in which the 2-adrenergic and M3 muscarinic carbossilic domain
were reciprocally exchanged. Whereas the two chimere couldn’t bind the muscarinic and adrenergic compounds and couldn’t activate the 2nd messenger, when they were co-expressed in the same cells it
was possible to notice the presence of both the wild type receptors 2-adrenergic and M3 muscarinic.
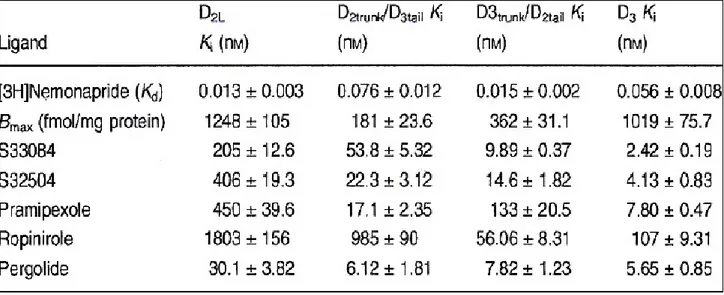
This demostrated the interaction between the tow chimere with themselves domains exchanged. In binding assay with the antagonist [3H]nemonapride, all agonists were potent ligands of D
3 receptors
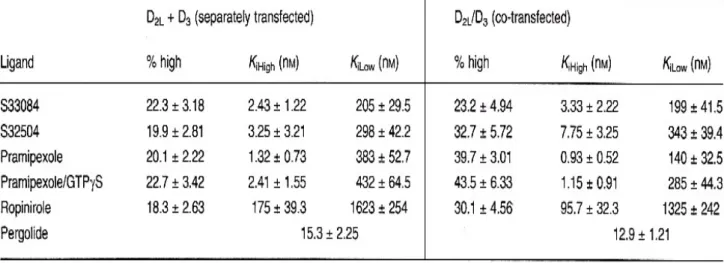
showing, respectively, 100-, 18- and 56-fold lower affinity at D2L receptors, mimicking the selective
D3 receptor antagonist, S33084 (100-fold). At D3trunk/D2tail receptors, except for ropinirole, all drugs
showed lower affinities than at D3 sites, whereas for D2trunk/D3tail receptors, affinities of all drugs were
higher than at D2 sites. The proportion of high affinity binding sites recognized by S32504,
higher than in an equivalent mixture of membranes from cells expressing D3 and D2L sites, consistent
with the promotion of heterodimer formation. In contrast the percentage of high and low affinity sites (biphasic isotherms) recognized by S33084 was identical.
Functional actions were determined by co-trasfetion of a chimeric adenylyl cyclase (AC-V/VI) insensitive to D3 receptors. Accordingly, D3 receptor-trasfected cells were irresposive whereas, in D2L
receptor-trasfected cells, agonists suppressed forskolin-stimulated cAMP production with modest potencies. In cells co-trasfected with D3 and D2L receptors, S32504, ropinirole and pramipexole
potently suppressed AC-V/VI activity with EC50s 33-, 19-, and 11-fold higher than at D2L receptors,
respectively. S32504 also suppressed AC-V/VI activity at split D3trunk/D2tail and D2trunk/D3tail chimeras
trasfected into COS-7 cells.
In conclusion, in this research it was demostrated a farmacological difference when agonists were tested on D2L receptor and on co-trasfected D2L/D3 receptors.
RIASSUNTO
I recettori accoppiati a proteine G (G-protein-coupled receptor o GPCRs) rappresentano il sistema di trasduzione del segnale più diffuso nel regno animale e sono uno dei maggior bersagli in campo farmacologico. Negli ultimi anni studi biofisici e farmacologici hanno dimostrato l’esistenza di complessi recettoriali omodimerici ed eterodimerici, proponendo affascinanti possibilità combinatoriali nel sistema di trasduzione del segnale e fornendo un nuovo punto di partenza per la ricerca di sostanze terapeutiche.
I recettori dopaminergici appartengono alla famiglia dei GPCRs; è stato dimostrato che essi esistono nei sistemi cellulari sia come omodimeri che come oligomeri, inoltre, recentemente sono state fornite evidenze di eterodimerizzazione tra il recettore dopaminergico D1 e quello per l’adenosina A1, così
come tra il recettore dopaminergico D2 e quello per la somatostatina SSTR5. Alterazioni nel sistema
dopaminergico sono presenti nel morbo di Parkinson, nelle psicosi e nei disordini mentali legati all’abuso di sostanze, ed è per questo che i recettori dopaminergici rappresentano un bersaglio importante per la terapia farmacologica di queste patologie. Molti agenti farmacologici, usati nel morbo di Parkinson e nelle psicosi, interagiscono in particolare con i recettori dopaminergici D2 e D3
appartenenti alla sottofamiglia D2-like. Il recettore dopaminergico D3 ha un’affinità per la dopamina,
e per molti agonisti dopaminergici, più elevata rispetto al recettore D2; tuttavia il suo accoppiamento
con la proteina G è più debole rispetto al recettore D2 che risulta invece potentemente accoppiato a
queste proteine e quindi molto attivo.
I recettori D2 e D3 hanno un alto grado di omologia nella loro sequenza aminoacidica e sono spesso
co-espressi nei tessuti nativi. Queste considerazioni ci hanno suggerito di studiare la possibilità che i recettori D2 e D3 interagiscano funzionalmente formando recettori eterodimerici che combinano le
caratteristiche farmacologiche e funzionali dei due recettori.
Un probabile modo di dimerizzazione è il “domain-swapping” dove un riarrangiamento crea due nuovi siti di legame che differiscono sostanzialmente da quelli dei rispettivi monomeri.
Questo tipo di interazione è stato originariamente proposto per spiegare la dimerizzazione tra due recettori chimerici inattivi. In particolare partendo dal recettore α2 adrenergico e M3 muscarinico
sono state costruite due chimere recettoriali chiamate α2/M3 e M3/α2, in cui il dominio
carbossi-terminale dei due recettori α2 adrenergico e M3 muscarinico è stato scambiato reciprocamente.
Mentre nessuna delle due chimere α2/M3 e M3/α2 era capace di legare i vari composti adrenergici e
muscarinici e di attivare il secondo messaggero, quando venivano co-espresse nelle stesse cellule era possibile rilevare la presenza di ambedue i recettori wild type α2 adrenergico e M3 muscarinico, a
Per i nostri esperimenti, inizialmente abbiamo preparato dei frammenti recettoriali tagliando il D2 e il
D3 a livello del terzo loop citoplasmatico, e ottenendo così quattro frammenti: D2-trunk, D2-tail, D3
-trunk e D3-tail. Mentre i frammenti trunk erano formati dalle prime cinque regioni transmembrana dei
recettori D2 e D3, i frammenti tail erano formati dalle ultime due.
In questo lavoro, l’azione degli agenti antiparkinsoniani, S32504, ropinirolo e pramipexolo sull’eterodimeri D2/D3 è stata confrontata con quella sui rispettivi monomeri e sui recettori chimerici
frammentati D2-trunk/D3-tail e D3-trunk/D2-tail. In studi di binding con l’antagonista
[3H]nemonapride, tutti gli agonisti si sono mostrati potenti ligandi verso il recettore D
3. Il rapporto di
affinità tra il recettore D3 e D2 è stato rispettivamente di 100, 18, 56 volte verso i recettori D2,
mimando l’azione del S33084 (100 volte), antagonista selettivo dei D3. Il pergolide invece ha
mostrato solo una leggera preferenza per il D3 rispetto al D2L. Ad eccezione del ropinirolo che ha
mostrato una leggera preferenza per il recettore D3-trunk/D2-tail, gli altri agonisti hanno mostrato
un’affinità intermedia tra D2 e D3 per i recettori chimerici frammentati, ad eccezione del ropinirolo,
tutti i ligandi hanno mostrato una più bassa affinità rispetto ai D3, mentre per i recettori D2-trunk/D3
-tail l’affinità era più alta che verso i D2, compreso il ropinirolo.
Nelle membrane derivate da cellule che co-esprimono i recettori D2 e D3, le percentuali di siti di
legame ad alta affinità riscontrate con il S32504, ropinirolo e pramipexolo sono state più alte che nelle membrane derivate da cellule che esprimevano separatamente i recettori D2 e D3 e dopo
mischiate. Questo aumento è verosimilmente dovuto alla formazione dell’eterodimero D2/D3.
Infine, sono stati eseguiti studi funzionali co-trasfettando i recettori dopaminergici D2/D3 con
un’adenilato ciclasi chimerica (AC-V/VI) insensibile ai recettori D3. Nelle cellule co-trasfettate con i
recettori D2 e D3, S32504, ropinirolo e pramipexolo hanno inibito l’attività dell’AC-V/VI con una
potenza rispettivamente di 33, 19, e 11 volte più alta rispetto a cellule trasfettate con il solo recettore D2L. Inoltre S32504 ha inibito l’attività dell’AC-V/VI anche in cellule co-trasfettate con i recettori
chimerici frammentati D2-trunk/D3-tail e D3-trunk/D2-tail.
In conclusione, in questo lavoro è stata dimostrata una differenza farmacologica quando gli agonisti venivano testati su recettori D2L o su recettori co-trasfettati D2/D3.
1. INTRODUZIONE
1.1. Dopamina
La dopamina è il neurotrasmettitore che nel sistema nervoso centrale (SNC) dei mammiferi ha un ruolo importante in numerose funzioni tra cui l’attività motoria, l’apprendimento, l’emozioni, la gratificazione, la motivazione e la secrezione di alcuni ormoni come la prolattina. Inoltre, possiamo ipotizzare anche una funzione endogena della dopamina nel sistema nervoso periferico (SNP) per la presenza di recettori dopaminergici a livello della muscolatura liscia vascolare a livello renale, a livello del sistema gastroenterico ed infine a livello delle fibre gangliari del sistema simpatico.
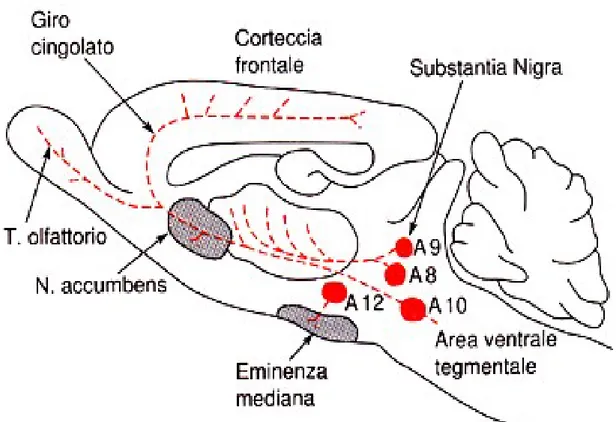
L’importanza del sistema dopaminergico centrale nel controllo dell’attività motoria è chiaramente dimostrata nella malattia di Parkinson dove la degenerazione di neuroni dopaminergici presenti nell’area A9 del mesencefalo (nigra pars compacta ) è la causa principale della malattia.
Alterazioni a carico del sistema dopaminergico sono anche ipotizzate in disturbi psichiatrici di tipo psicotico, come la schizofrenia, dove l’uso di antagonisti dei recettori D2 dopaminergici risulta essere
uno dei trattamenti farmacologici più efficaci.
L’uso invece di antagonisti dopaminergici poco liposolubili, che non passino la barriera ematoencefalica, nel trattamento di disturbi di tipo gastro-enterico o come farmaci antiemetici dimostra l’importanza del sistema dopaminergico anche a livello periferico.
Negli ultimi anni è stato chiaramente indicato come il sistema dopaminergico è anche coinvolto nei meccanismi neurofisiologici che sono alla base delle tossicodipendenze.
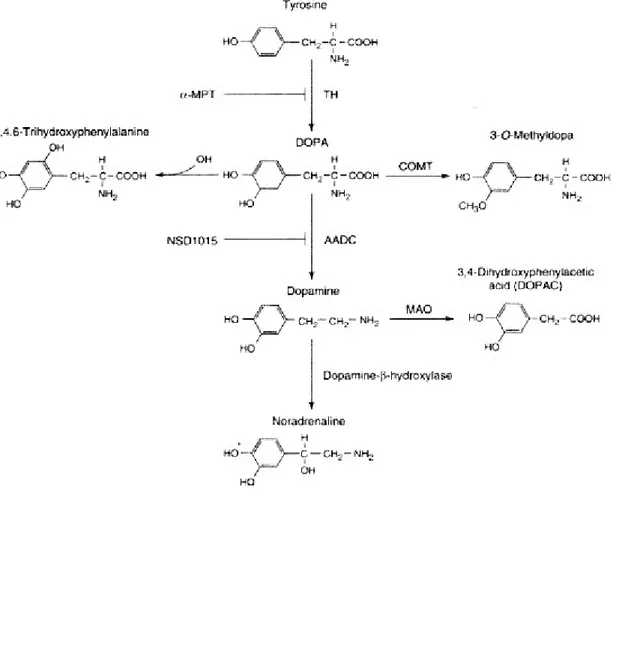
I precursori della sintesi di dopamina nel neurone dopaminergico sono gli aminoacidi tiroxina e fenilalanina che sono assunti con le proteine presenti nella dieta. Questi due aminoacidi essenziali attraversano la barriera emato-encefalica grazie ad un trasportatore di membrana per i L-aminoacidi aromatici e successivamente sono captati all’interno del neurone dopaminergico attraverso lo stesso trasportatore. All’interno del neurone, l’aminoacido fenilalanina è trasformato in tirosina e successivamente questa ultima è convertita dall’enzima tirosina idrossilasi in L-3,4- diidrossifenilalanina (L-Dopa). La tirosina idrossilasi è un marker istologico specifico dei neuroni catecolaminergici e la sua attività è finemente regolata, diventando così l’enzima limitante la sintesi della dopamina.
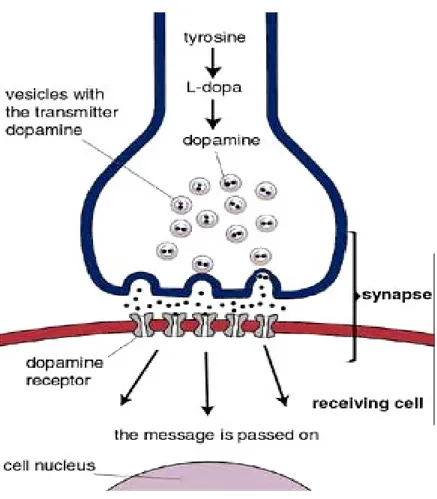
La dopamina sintetizzata ex-novo, è immagazzinata nelle vescicole sinaptiche mediante un trasportatore vescicolare e da qui rilasciata nel vallo sinaptico per esocitosi di Ca++-dipendente in
Fig . 1. Trasmissione dopaminergica
Infine, dopo aver svolto la sua azione legandosi ai recettori specifici, essa è captata dal neurone dopaminergico presinaptico dove può essere nuovamente immagazzinata nelle vescicole o può essere catabolizzata per opera di due isoforme enzimatiche delle monoaminoossidasi (MAO-A e MAO-B). Una via metabolica alternativa di degradazione della dopamina è quella operata dall’enzima catecol-O-metiltransferasi (COMT) all’esterno del neurone presinaptico (Fig. 2). Queste due vie metaboliche avvengono congiuntamente e convergono portando alla formazione dell’acido omovanillico (HVA), il metabolita principale del catabolismo della dopamina (Vedi Testo Farmacologia generale e
La dopamina inoltre può subire una trasformazione non enzimatica per ossidazione e dar luogo a composti potenzialmente neurotossici. Gli eventi cellulari e molecolari coinvolti nella tossicità della dopamina all’interno dei neuroni dopaminergici potrebbero dare origine a fenomeni degenerativi che determinano morte cellulare (Corsini et al., 2002).
Gli effetti di questa catecolamina a livello del sistema nervoso centrale sono mediati dalla sua interazione con i recettori dopaminergici. Questi fanno parte della grande famiglia di proteine di membrana rappresentata dai recettori accoppiati a proteine G (GPCRs o G-protein-coupled receptors).
1.2. Recettori accoppiati alle proteine G: struttura e trasduzione del
segnale
I recettori accoppiati a proteine G (GPCRs) rappresentano il sistema di traduzione del segnale più diffuso nel regno animale.
Essi hanno una struttura tipica che consiste di un core idrofobico rappresentato da sette regioni transmembrana ad α-elica, unite tra loro da tre loops intracellulari e tre extracellulari (Fig. 3), un’estremità amino-terminale extracellulare e una coda carbossi-terminale intracellulare (Hulme et
al., 1990).
10
S u p e rf ic ie e xt ra c e ll u la re
Su perficie citoplas matica
-NH2
= Asparagine (siti di glicosilazione). = Aminoacidi che costituiscono i loops.
= Aminoacidi implicati nel legame con le proteine G.
= Aminoacidi che costituiscono le α−eliche transmembrana. = Treonine e Serine (siti di fosforilazione).
Treonine e Serine (siti di fosforilazione) Asparagine (siti di glicosilazione) Amminoacidi che costituiscono i loops
Amminoacidi implicati nel legame con le proteine G Amminoacidi che costituiscono le α-eliche transmembrana Cisteine altamente conservate
Cisteina palmitoilata
Fig . 3. Rappresentazione schematica della struttura di un GPCR
Il legame con ligandi specifici avviene tramite interazioni multiple tra gruppi funzionali del ligando e aminoacidi altamente conservati presenti nei domini extracellulari e/o nel dominio transmembrana del recettore.
Esistono tre classi di recettori accoppiati a proteine G che tengono conto delle diversità dovute sia alla sequenza aminoacidica sia alla modalità d’interazione con il ligando (Bockaert et al., 1999). La famiglia 1 raggruppa la maggior parte dei recettori, tra cui la rodopsina, ed è ulteriormente suddivisa in tre sottofamiglie. La famiglia 1a comprende i recettori per i ligandi piccoli, come i muscarinici, i dopaminergici o gli adrenergici ed il sito di legame è localizzato all’interno della tasca recettoriale formata dai sette segmenti transmembranali. La famiglia 1b è rappresentata da recettori per i peptidi, il cui sito di legame è presente nella parte N-terminale, nelle anse extracellulari e nella parte superiore dei segmenti transmembrana; nella classe 1c troviamo i recettori per gli ormoni lipoproteici caratterizzati da un’estremità N-terminale lunga che insieme alla parte esterna del primo e secondo loop extracellulare costituiscono il sito di legame.
All’interno della famiglia 2, i recettori accoppiati a proteine G hanno una morfologia simile a quella del gruppo 1c ma non ne condividono la stessa similitudine nella sequenza aminoacidica. I ligandi fisiologici per i recettori di questo gruppo sono ormoni ad alto peso molecolare come il glucagone o la secretina. Infine, la famiglia 3 include i recettori metabotropici al glutammato, i recettori sensibili al Ca++, recettori GABA
b e i recettori per alcuni ferormoni. In questa famiglia, la lunga estremità
N-terminale è determinante per l’interazione con i ligandi endogeni.
S u p e r f ic ie e x t ra c e ll u la r e
Su per ficie citopl as ma tica
-NH2
= Asparagine (siti di glicosilazione). = Aminoacidi che costituiscono i loops.
= Aminoacidi implicati nel legame con le proteine G.
= Aminoacidi che costituiscono le α−eliche transmembrana. = Cisteine altamente conservate.
= C istein a p alm itoilata.
= Treonine e Serine (siti di fosforilazione).
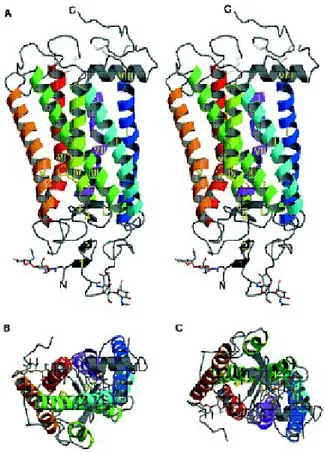
Fig . 4. Struttura tridimensionale del recettore rodopsina vista lateralmente (A) e dal basso (B e C).
Un contributo importante per la comprensione della struttura tridimensionale dei recettori accoppiati alle proteine G è stato dato grazie alla determinazione della struttura cristallina del recettore rodopsina (Palczewski et al., 2000; Fig. 4).
L’interazione ligando-recettore induce un cambiamento conformazionale della proteina recettoriale, in particolare a livello del secondo loop citoplasmatico (Burstein et al., 1998; Kozell et al., 1994), delle estremità N- e C-terminale (che sono le due porzioni adiacenti alla membrana plasmatica) e della coda C-terminale citosolica.
La traduzione del segnale coinvolge, oltre al recettore, due elementi: una proteina G eterotrimerica (costituita da tre subunità: α, β e γ) che lega i nucleotidi guanosinici GDP e GTP, e un bersaglio proteico che funge da effettore.
Il legame con il neurotrasmettitore promuove interazioni allosteriche tra il recettore e la proteina G inducendo lo scambio del nucleotide guanosinico GDP con il GTP sulla subunità α . Questo destabilizza il complesso trimerico αβγ con conseguente dissociazione della subunità α, legata al GTP, dal dimero βγ. La proteina G “attivata” è così in grado di agire sull’effettore (Fig. 5).
La fine del segnale avviene tramite idrolisi del GTP in GDP per merito della stessa subunità α .
Esistono vari tipi di proteine G (almeno una ventina sono note) suddivise in base al tipo di risposta che inducono, come ad esempio:
Gs, attivazione dell’enzima adenilato ciclasi
Gi, inibizione dell’adenilato ciclasi e apertura di canali al K+
Go, inibizione di canali al Ca++ voltaggio-dipendenti Gq, attivazione della fosfolipasi Cβ
Dopo che la proteina G ha interagito con uno dei suddetti effettori, vengono prodotti secondi messaggeri (cAMP, IP3/DAG, acido arachidonico) che sono responsabili della risposta cellulare conseguente allo stimolo recettoriale.
La parte C-terminale della subunità α della proteina G sembra essere determinante nel conferire selettività all’interazione col recettore (Conklin et al., 1993; Conklin et al., 1996), sebbene un ruolo ausiliare può essere svolto anche dal complesso βγ (Florio e Sternweiss, 1985; Butkerait et al., 1995). Nonostante l’interazione recettore-proteina G sia piuttosto selettiva, alcuni recettori sono in grado di attivare più di un tipo di proteina G (Ganze t al., 1990; Eason et al., 1992; Eason e Ligget, 1995). Questa promiscuità nell’accoppiamento è dovuta soprattutto al corredo di proteine G che una determinata linea cellulare esprime, poiché il legame tra un recettore con una bassa selettività per una determinata proteina G può essere forzato se in quella cellula è espresso prevalentemente un tipo di proteina G. Per esempio i recettori dopaminergici possono mostrare alcune proprietà tradizionali in certi tipi cellulari che non sono confermate in altre linee, a dimostrazione della complessità e della varietà di interazione coinvolte tra recettore e proteine G.
Fig . 5. Eventi intracellulari attivati dalle proteine G.
La specificità del recettore verso le varie proteine G è determinata soprattutto dalle parti N- e C-terminale del terzo loop citoplasmatico (Wess et al., 1997). Questi dati sono stati confermati da esperimenti condotti su chimere recettoriali D1/D2 (Kozell et al., 1994) e D2/D3 (Lachowicz et al.,
1997; Filteau et al., 1999). Inoltre, un ruolo importante per l’accoppiamento tra recettore e proteina G è stato dimostrato anche per il secondo loop intracellulare (Kozell et al., 1994).
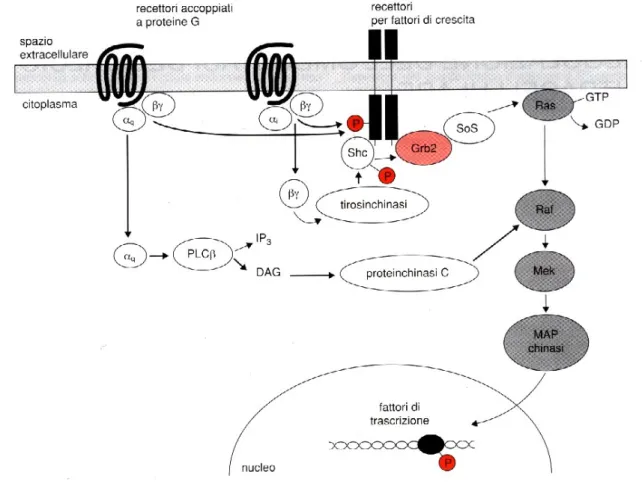
Recenti studi hanno dimostrato come, attraverso la loro capacità di regolare effettori specifici, i recettori accoppiati alle proteine G possono indurre eventi intracellulari simili a quelli attivati dai recettori per i fattori di crescita ad attività tirosina chinasica (Vedi Testo Clementi; UTET, 1999). Una delle più importanti conseguenze di questa stimolazione è l’attivazione di alcune chinasi specifiche chiamata MAP chinasi (Mitogen-activated protein kinases), che svolgono un ruolo fondamentale nel controllo della proliferazione e del differenziamento cellulare. I recettori accoppiati alle proteine G sono in grado di attivare le MAP chinasi con meccanismi molteplici tuttora oggetto di studio. Una prima possibilità, utilizzata soprattutto dai recettori accoppiati alle proteine Gi, sembra coinvolgere il
complesso βγ ed agisce sulle proteine adattatrici Shc. Un’altra possibilità è quella di indurre una fosforilazione nei residui tirosinici dei recettori per i fattori di crescita con un meccanismo ancora da caratterizzare definito “transattivazione”.
I recettori accoppiati a proteine Gi possono stimolare le MAP chinasi grazie anche all’azione sulla
proteina chinasi C, che è in grado di fosforilare la proteina Raf, attivando la cascata di fosforilazioni intracellulari senza interagire con la proteina di membrana Ras (Fig.6).
1.3. Recettori Dopaminergici
La prima evidenza sperimentale, che ha dimostrato l’esistenza dei recettori per la dopamina nel sistema nervoso centrale (SNC), risale a studi biochimici compiuti nel 1972 che rilevarono la capacità del neurotrasmettitore di stimolare l’enzima adenilato ciclasi (Kebabian et al., 1979).
In seguito, sulla base di risultati farmacologici, i recettori dopaminergici sono stati classificati in due classi dette D1 e D2 (Spano et al., 1978).
L’avvento delle nuove tecnologie di DNA ricombinante ha consentito di riconoscere l’esistenza di diversi sottotipi recettoriali dopaminergici che, in base sia alle omologie di sequenza che al profilo funzionale e farmacologico, possono ancora essere suddivisi nelle due classiche famiglie D1 e D2.
Appartengono alla famiglia D1 (D1-like) i recettori D1e D5 e alla famiglia D2 (D2-like) i recettori D2,
D3 e D4.
I recettori D1-like sono sensibili alla dopamina, apomorfina e ad altri agonisti come il fenoldopam e
bloccati da antagonisti specifici come lo SCH23390. I recettori dopaminergici D2 e D3 sono stimolati
da vecchi e nuovi farmaci antiparkinsoniani come bromocriptina, pergolite, apomorfina, pramipexolo e cabergolina, anche se è possibile rilevare una certa preferenza d’affinità verso i recettori D3. Una
buona selettività nei confronti del recettore D3 è mostrata anche da alcuni composti di sintesi come il
quinpirolo e il 7-OH-DPAT. Per quanto riguarda gli antagonisti recettoriali, i neurolettici sulpiride e aloperidolo presentano una preferenza verso il sottotipo recettoriale D2, mentre i recettori D4 sono
molto sensibili alla clozapina (Fig. 7) .
La difficoltà nel differenziare farmacologicamente i vari sottotipi recettoriali D2-like ed è dovuta
soprattutto all’elevata omologia di sequenza aminoacidica.
I recettori D1 e D5 mostrano una elevata omologia nelle sequenze di aminoacidi nei domini
transmembrana (80%), regioni deputate al legame dei farmaci.
Per quanto riguarda le regioni transmembrana dei D2-like, i recettori D2 e D3 mostrano una omologia
di sequenza per il 72%, mentre i D2 e D4 per il 53%. L’estremità amino-terminale consiste di un
numero simile di aminoacidi in tutti i sottotipi recettoriale e presenta una quantità variabile di siti di glicosilazione. La coda carbossi-terminale è circa sette volte più lunga nei recettori D1-like rispetto ai
D2-like ed è ricca di residui di serina e treonina. La difficoltà nel differenziare farmacologicamente i
vari sottotipi recettoriali D2-like ed è dovuta soprattutto all’elevata omologia di sequenza
Al contrario, i recettori D2-like hanno il terzo loop intracellulare più lungo, caratteristico dei recettori
che interagiscono con la proteina Gi, mentre quello dei D1-like è più corto come in molti recettori che
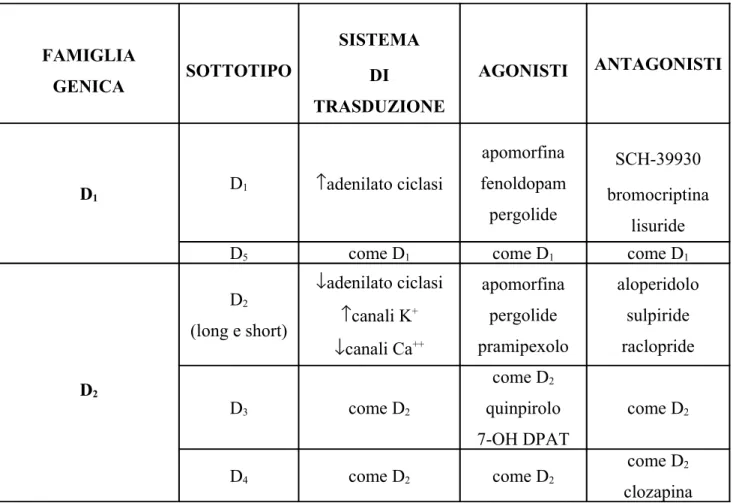
legano la proteina Gs. FAMIGLIA GENICA SOTTOTIPO SISTEMA DI TRASDUZIONE AGONISTI ANTAGONISTI D1 D1 ↑adenilato ciclasi apomorfina fenoldopam pergolide SCH-39930 bromocriptina lisuride D5 come D1 come D1 come D1
D2 D2 (long e short) ↓adenilato ciclasi ↑canali K+ ↓canali Ca++ apomorfina pergolide pramipexolo aloperidolo sulpiride raclopride D3 come D2 come D2 quinpirolo 7-OH DPAT come D2 D4 come D2 come D2 come D2 clozapina
Fig . 7. Classificazione farmacologica dei recettori dopaminergici nel SNC
1.3.1
Recettori D
1-like (espressione e funzione)
Sottotipo D1Il recettore D1 è una glicoproteina con due siti di glicosilazione, uno nella parte N-terminale e l’altro
nel secondo loop extracellulare. Presenta inoltre un sito di fosforilazione cAMP-dipendente nel terzo loop citoplasmatico e un residuo di cisteina nella estremità carbossi-terminale (altamente conservato nei GPCRs) che viene complessato con l’acido palmitico. Questo legame con l’acido palmitico, che àncora la coda C-terminale del recettore alla membrana, forma il quarto loop intracellulare. Ulteriori siti di fosforilazione possono essere i residui di serina e treonina che si trovano all’estremità C-terminale.
Questo sottotipo recettoriale è quello maggiormente espresso tra i diversi recettori dopaminergici a livello del sistema nervoso centrale sia di ratto che di uomo (Missale et al., 1998). La presenza di mRNA del recettore D1 è stata determinata nel nucleo caudato e nel putamen (nuclei del sistema
extrapiramidale), nel nucleo accumbens e nel tubercolo olfattorio (che fanno parte del sistema limbico) ed inoltre è stato identificato in minor quantità nella corteccia cerebrale, nel talamo e nell’ipotalamo.
Da un punto di vista funzionale il recettore D1 è accoppiato alla proteina Gs, per cui attiva l’adenilato
ciclasi. Il recettore D1 sembra essere in grado di modulare i livelli di calcio intracellulare attraverso
differenti meccanismi. In alcuni sistemi cellulari il meccanismo di azione coinvolge la produzione di IP3 grazie alla attivazione della fosfolipasi C, mentre in altri sistemi l’effetto sulla concentrazione di Ca++ intracellulare sembra passare da un meccanismo diverso che consiste nell’attivazione della PKA
attraverso l’aumento di cAMP.
Aumenti dell’attività di alcune MAP chinasi per azione del recettore D1 sono stati riportati su p38 e
JNK in alcune linee cellulari ma non su ERK1-2 (Zhen et al., 1998), anche se l’effetto del cAMP nelle cellule COS sull’attivazione di ERK1-2 lascia pensare che il recettore D1 potrebbe attivare
anche ERK1-2 (Faure et al., 1994). Un effetto del recettore D1 sull’attivazione di ERK1-2 è stata
recentemente riportata in vivo su un modello di parkinsonismo animale, dove la carenza di dopamina nello striato induce una particolare sensibilità ad agonisti D1 selettivi (Gerfen, 2002).
Sottotipo D5
Il recettore D5 è stato isolato e clonato da Sunahara et al. (1991). È omologo per il 50% al recettore
D1 e nelle sequenze transmembrana l’omologia aumenta fino all’80%. Vari agonisti e antagonisti
hanno simile affinità per i due recettori ad eccezione della dopamina che è più affine di circa dieci volte verso il recettore D5 rispetto a quello D1.
Questo recettore è localizzato per lo più nell’ippocampo e nell’ipotalamo, ma in generale i suoi livelli di espressione sono molto inferiori rispetto a quelli del sottotipo D1.
Le caratteristiche funzionali di questo recettore sono simili a quelle del recettore D5, soprattutto per
quanto riguarda la formazione di cAMP.
1.3.2.
Recettori D
2-like (espressione e funzione)
Il recettore D2 presenta i sette domini transmembrana tipici dei GPCRs, all’estremità N-terminale ha
tre siti di glicosilazione, all’estremità C-terminale ha una cisteina per il legame con l’acido palmitico e nel terzo loop intracellulare ha un sito di fosforilazione per una chinasi cAMP-dipendente. Inoltre sul terzo loop citoplasmatico, ci sono altri siti di fosforilazione importanti nella regolazione del turnover recettoriale (Missale et al., 1998).
Esso è presente in due diverse varianti chiamate D2long e D2short che sono originate da uno splicing
alternativo di un esone di 87 bp localizzato tra gli introni 4 e 5. Le proteine D2long e D2short si
differenziano rispettivamente per la presenza o meno di una sequenza di 29 aminoacidi nel terzo loop intracellulare. Per queste due isoforme non è ancora stata identificata una differenza farmacologica, ma solo una lieve diversità funzionale. Esse mostrano un simile pattern di distribuzione, ma la forma D2short è meno abbondantemente rappresentata nei tessuti.
Il recettore D2 è maggiormente localizzato nei nuclei caudato e putamen (quindi a livello dello
striato), nel nucleo accumbens e nel tubercolo olfattorio. Nel 50% circa dei neuroni di media grandezza del caudato, il D2 è coespresso con il D1. Inoltre, è stato dimostrato che la
co-localizzazione D1/D2 porta ad un’azione sinergica dei due recettori (Pomelli et al., 1991).
Il D2 è presente anche nelle cellule lattotrope ipofisarie, dove media l’inibizione dopaminergica della
secrezione di prolattina.
Da un punto di vista funzionale il recettore D2 è accoppiato alla proteina Gi e quindi inibisce la
formazione di AMP ciclico.
In diversi tipi cellulari, come i neuroni mesencefalici o in cellule provenienti dall’ipofisi anteriore, il recettore dopaminergico D2 fa aumentare l’uscita dello ione potassio con conseguente
iperpolarizzazione della cellula, attraverso l’attivazione di proteine G sensibili alla tossina della pertosse. il significato funzionale della iperpolarizzazione neuronale sembra essere l’inibizione del
release di dopamina, un fenomeno che ha dato il nome di autorecettore dopaminergico D2.
Sono stati riportati anche effetti del recettore sulle correnti al Ca++, soprattutto di tipo inibitorio, e
sulla cascata dell’acido arachidonico. Il recettore D2 è in grado di potenziare il rilascio di acido
arachidonico indotto dall’aumento di Ca++ intracellulare (Missale et al., 1998).
Numerose evidenze sperimentali hanno dimostrato come i recettori D2-like, in particolare il recettore
D2, siano coinvolti anche nella mitogenesi e nel differenziamento cellulare. Inoltre, il recettore D2 è
in grado di stimolare l’attività di ERK1-2 in differenti linee cellulari come le CHO, COS e C6. Se il recettore D2 viene espresso in cellule mesencefaliche “immortalizzate”, l’effetto di
dopamino-agonisti è quello di influenzare la vitalità neuronale intesa come numero di neuriti (Swarzenski et
al.,1993), probabilmente grazie all’attivazione delle MAP chinasi. Tuttavia, in uno studio dove sono
state utilizzate colture primarie di neuroni mesencefalici, gli agonisti dopaminergici non hanno avuto effetto sulla sopravvivenza o sul differenziamento di queste cellule (Van Muiswinkel et al., 1993).
Nel modello di emiparkinsonismo di ratto trattato con 6-OH-DA, l’effetto della rotazione controlaterale indotta dall’agonista D2 selettivo è bloccata dall’inibizione di MAP chinasi
dimostrando un ruolo importante di tale proteina nell’effetto comportamentale dovuto alla somministrazione di farmaci antiparkinsoniani (Cai et al., 2000).
Sottotipo D3
Il recettore D3 è stato inizialmente clonato da una libreria di cDNA di ratto usando sonde derivate
dalla sequenza del recettore dopaminergico D2 (Sokoloff et al.,1990). È infatti un recettore molto
simile al D2 sia per quando riguarda la sequenza aminoacidica che per l’organizzazione strutturale
nella membrana..
Anche per il recettore D3 sono state identificate varianti di splicing. Nel topo esistono due varianti
con uno splicing alternativo di 21 amminoacidi a livello del terzo loop citoplasmatico (Fishburn et
al., 1993) mentre nel ratto e nell’uomo esistono altre varianti, forse non funzionali, di cui parleremo
in seguito (Seeman e Van Tol, 1994).
Il recettore D3 di ratto è presente soprattutto nello striato ventrale (tubercolo olfattorio, nucleo
accumbens, isole di Calleja) e nell’ipotalamo a dimostrazione di una sua importanza nelle funzioni limbiche dell’animale. Esso si trova in quantità minore anche in altre aree cerebrali come la
substantia nigra, lo striato dorsale e la corteccia prefrontale. Queste indicazioni sono state date
misurando la quantità di mRNA con la tecnica del Northern- Blot (Sokoloff et al., 1990) e utilizzando un composto selettivo marcato come il [3H]-7-OH-DPAT a basse dosi su un tessuto cerebrale
(Levesque et al., 1992). Se la misurazione di un mRNA del recettore D3 è piuttosto specifica, le
indicazioni di binding con il [3H]-7-OH-DPAT lasciano adito a qualche dubbio poiché potrebbero
essere influenzate dall’interazione del ligando radiomercato con il recettore D2 (Landwehrmeyer et
al., 1992).
Nel ratto e nel topo la quantità del recettore D3 rispetto al D2 misurato con la tecnica del binding è
notevolmente inferiore. Per esempio se consideriamo lo striato dorsale la differenza è di circa cento volte, mentre nello striato ventrale la differenza si riduce a venti volte. Queste misurazioni non escludono comunque la possibilità che in alcuni sottogruppi neuronali le differenze di espressione tra D3 e D2 siano minori, come è stato indicato per esempio nello shell del nucleo accumbens dell’
animale.
Da notare che l’espressione del recettore D3 aumenta in modo rilevante nello striato dorsale
denervato per trattamento con L-Dopa (Borden et al., 1997 e 2000). Tale aumento evidenziato in un modello di parkinsonismo sperimentale di ratti trattati con 6-OH-DA, è stato invocato come possibile causa del fenomeno della sensibilizzazione alla L-Dopa, comportamento paragonabile alle discinesie nei primati.
Se passiamo dalla specie dei roditori a quella dei primati, come l’uomo per esempio, assistiamo ad un drastico aumento della quantità di recettore D3, tanto che è stato stimato che nell’uomo la sua
espressione possa essere inferiore rispetto al D2 di solamente 3-5 volte circa (Suzuki et al., 1998;
Joyce et al., 1999). Inoltre nell’uomo misurando la quantità di mRNA, è stato osservato come la
distribuzione del recettore D3 sia diffusa anche in regioni corticali, nel nucleo caudato e putamen, nel
Fig . 8. Espressione di mRNA del recettore D3 nell’uomo
Da un punto di vista funzionale il recettore D3 condivide in parte le caratteristiche del recettore D2 e
pertanto inibisce la formazione di AMP ciclico attraverso l’attivazione della proteina Gi. Tuttavia in
molti sistemi cellulari, il recettore D3 è incapace di inibire l’adenilato ciclasi (Tang et al., 1994;
Freedman et al., 1994) e quindi mostra, in generale, d’accoppiarsi più debolmente alla proteina Gi
rispetto al recettore D2 (Vanhauwe et al.,1999). Un fattore determinante per la funzionalità del
recettore D3 è probabilmente il tipo di adenilato ciclasi con la quale interagisce. Nelle cellule COS,
per esempio, la presenza dell’adenilato ciclasi V permette al recettore D3 di funzionare correttamente,
mentre esso risulta debolmente accoppiato all’adenilato ciclasi di tipo II (Caron et al., 1997).
Questo recettore dopaminergico sembra anche modulare le correnti uscenti di ione potassio, come dimostrato in colture cellulari mesencefaliche (Tang et al., 1994). Tale effetto iperpolarizzante è probabilmente responsabile dell’effetto inibitorio del recettore sul release di dopamina nelle cellule mesencefaliche.
Il recettore D3, come gli altri recettori D2-like, è coinvolto probabilmente nella mitogenesi e nel
differenziamento, come dimostrato in alcuni linee cellulari osservando l’incorporazione di [3
H]-timidina (Griffon et al., 1997). Il meccanismo attraverso cui il recettore D3 induce l’aumento
dell’attività di sintesi del DNA potrebbe essere quello della fosforilazione delle MAP chinasi, attraverso la stimolazione di una isoforma di protein chinasi C (Cussan et al., 1999).
Sottotipo D4
L’ultimo recettore ad essere stato clonato è il recettore D4 (Gelernter al., 1991). Questo ha una
struttura molto simile agli altri due recettori D2-like. È localizzato principalmente nella corteccia
frontale, nel mesencefalo e nell’amigdala, ma si trova in tracce anche nello striato e nel tubercolo olfattorio. I suoi livelli di espressione nel sistema nervoso centrale comunque, così come per il sottotipo D3, sono in misura minore rispetto al D2.
Una caratteristica di tale recettore nell’uomo è la presenza di un polimorfismo genetico a livello del terzo loop citosolico che consiste nella ripetizione di 16 aminoacidi (Van Tol et al.,1992). Tra le varie isoforme genetiche non sono state riscontrate differenze funzionali.
Le caratteristiche funzionali sono paragonabili al recettore D2.
Analizzando la sequenza genica codificante dei recettori dopaminergici D2-like (D2, D3 e D4)
possiamo osservare che tali geni contengono numerosi introni che interrompono la sequenza, al contrario dei recettori D1-like (D1 e D5) che non hanno introni che non hanno introni nella sequenza
dopo il codone di inizio (ATG) e quindi non producono isoforme recettoriali per splicing alternativo (Wong et al., 2000).
In realtà esiste un introne anche nella sequenza genica dei recettori D1-like, ma si trova a monte del
segnale d’inizio nella regione 5’ che non viene tradotta in proteina.
La complessità della struttura genica dei recettori D2-like suggerisce come esista la possibilità della
formazione di diversi trascritti di mRNA attraverso meccanismi differenti di splicing alternativo. Il gene del recettore D2 umano è localizzato sul cromosoma 11 e consiste di otto esoni separati da
sette introni (Grandy et al., 1989). Lo splicing alternativo di 29 aminoacidi a livello del terzo loop intracellulare è responsabile della formazione delle due isoforme D2long a D2short (Dal Toso et al.,
1989).
Sulle differenze funzionali e farmacologiche delle due isoforme recettoriali sono stati eseguiti numerosi studi, tuttavia una chiara differenza non è stata ancora dimostrata. Solo recentemente, grazie all’utilizzo di animali transgenici privati dell’una e dell’altra isoforma proteica è stato ipotizzato che il recettore D2short sia soprattutto presinaptico e controlli l’attività elettrica del neurone
dopaminergico, mentre il recettore D2long sia postsinaptico e responsabile della catalessia indotta da
aloperidolo nell’animale da esperimento (Borrelli et al., 2000).
Il sottotipo recettoriale dopaminergico D3 è sicuramente quello che offre le varianti di splicing più
numerose e più interessanti. La sequenza genica del recettore D3 umano è localizzata sul cromosoma
3 e contiene sei esoni interrotti da 5 introni (Le Coniat et al., 1991).
Una sequenza simile esoni-introni è stata caratterizzata nel ratto, mentre nel topo la presenza di un sesto introne in più, che corrisponde al terzo loop intracellulare nella struttura del recettore, è responsabile della formazione di due isoforme D3long a D3short (Fu et al., 1995). Nonostante questa
variante di splicing del topo non sia stata trovata nel ratto e nell’uomo, altre isoforme recettoriali troncate sono state caratterizzate in queste due specie.
Nel cervello di ratto utilizzando la tecnica della RT-PCR sono state determinate due varianti più corte rispetto al recettore wild-type (Giros et al., 1990). Un trascritto codifica per una proteina troncata di circa 100 aminoacidi formata praticamente solo dai primi due segmenti transmembrana del recettore D3, mentre nell’altro trascritto viene perso parte del secondo loop extracellulare e parte del V
segmento transmembrana. In questa seconda variante di splicing tuttavia la delezione mantiene il codice di lettura in fase senza slittamento nella trascrizione, pertanto la traduzione della proteina arriva fino alla fine del proprio corso.
In entrambi i due casi, queste proteine anomale hanno perso le proprietà sia di legare vari ligandi dopaminergici sia di agire sull’effettore adenilato ciclasi. Se risulta facile interpretare il non
funzionamento del frammento recettoriale costituito solo da due segmenti transmembrana, per quanto riguarda la seconda variante recettoriale il risultato si può spiegare costatando la perdita nella sequenza aminoacidica di un residuo di serina importante per il legame con i composti testati. Questa seconda variante recettoriale è stata studiata nelle cellule CHO stabilmente trasfettate, dove nonostante la presenza del mRNA di tale proteina nessuna attività recettoriale è stata determinata. Differenti varianti di splicing sono state caratterizzate anche nella specie umana. Per esempio, il frammento formato dai primi due segmenti transmembrana scoperto nel ratto è stato identificato anche nell’uomo (Snyder et al., 1991).
1.3.4. Polimorfismi dei recettori dopaminergici
Molti studi genetici hanno posto l’attenzione sulla possibile relazione tra recettore dopaminergici e malattie neuropsichiatriche; all’interno di questo vasto campo, la farmacogenomica è invece quella disciplina recente che cerca di individualizzare la terapia farmacologica in bade al corredo genico d’ogni individuo.
Polimorfismi di geni codificanti i recettori dopaminergici potrebbero influenzare la suscettibilità verso alcune patologie o potrebbero essere responsabili, almeno in parte, del successo di una terapia farmacologica rispetto ad un’altra.
Per quanto riguarda il recettore D1 sono stati caratterizzati due polimorfismi tra questi due il più
studiato è quello nella regione 5’ a monte del segnale di inizio che non viene tradotto in proteina. Uno studio a dimostrato che non esiste associazione tra tale polimorfismo e il rischio si sviluppo della schizofrenia o del disturbo bipolare (Cichon et al., 1996). Questa indicazione è stata confermata da un altro studio eseguito su 148 pazienti schizofrenici (Kojima et al., 1999). Indagini di farmacogenomica scarseggiano sul recettore D1 per la mancanza di terapie farmacologiche che
chiaramente coinvolgano questo recettore.
La struttura genica del recettore D5 presenta numerosi polimorfismi, ma finora non sono state
riportate correlazioni significative.
Sono stati anche identificati diversi polimorfismi relativi al recettore D2, tre dei quali sono
caratterizzabili a livello molecolare dalla lunghezza di frammenti di restrizione di DNA diferto con l’enzima TaqI (Fig. 9). Il primo polimorfismo (TaqIA) è nella regione fiancheggiatrice 3’ dopo 10 Kb dall’ottavo esone, il secondo (TaqIB) è localizzato vicino alla zona di giunzione tra il primo introne ed il secondo esone ed infine il terzo (TaqIC) è situato all’interno dell’introne 2 (Wong et al., 2000).
La letteratura sul polimorfismo D2 TaqIA si è interessata soprattutto su possibili associazioni legate
all’uso di sostanze d’abuso, con particolare attenzione al consumo di alcool. Diversi studi clinici hanno dato delle indicazioni positive su tale associazione, ma altri non hanno confermato il dato. Un’associazione tra il polimorfismo TaqIA del recettore D2 e il rischio di complicanze motorie,
come le fluttuazioni, in pazienti parkinsoniani trattati con L-Dopa è stata riportata (Wang et al., 2001); tuttavia questo studio necessita di conferme su altre popolazioni con un maggior numero di soggetti.
Un altro studio su pazienti parkinsoniani in trattamento farmacologico ha trovato una correlazione tra un polimorfismo all’interno dell’introne 2 su una sequenza short tandem repeat e presenza di discinesie (Olivieri et al., 1999).
Altri tre polimorfismi risultano nella sostituzione di un singolo aminoacido nella sequenza del D2 e
queste varianti hanno dimostrato di possedere simili proprietà funzionali in colture cellulari.
Tra i pochi polimorfismi finora identificati del recettore D3, sicuramente quello che è stato
maggiormente studiato è quello localizzato in posizione nove nella sequenza polipeptidica e sostituisce l’aminoacido serina con l’aminoacido glicina (Ser9Gly; Fig. 10). Questa mutazione crea un sito di restrizione Bal I (o MscI), consentendo una facile analisi genica del polimorfismo dopo amplificazione del DNA genomico attraverso la PCR (Crocq et al., 1992).
Queste due forme recettoriali, diverse per un solo aminoacido, sembrano condividere proprietà funzionali e farmacologiche. L’unica diversità tra i due recettori è stata determinata confrontando le affinità per la dopamina, dove la presenza dell’aminoacido glicina al posto della serina conferisce una maggiore affinità verso il recettore in un sistema eterologo come la linea cellulare CHO. Come questa disparità di affinità per la dopamina possa influenzare la suscettibilità ad una patologia o al successo di una terapia farmacologica rimane da scoprire.
Molti studi di correlazione genica sono stati fatti sul polimorfismo Ser9Gly del recettore D3 e esordio
della schizofrenia, dove alcuni di questi hanno dimostrato un’associazione tra la presenza dell’allele serina-9 e la malattia, concludendo che tale allele conferisce un piccolo aumento della suscettibilità alla schizofrenia (Wong et al., 2000).
Contrariamente a questi lavori, altri hanno trovato associazione tra il polimorfismo Bal I del recettore D3 e schizofrenia mettendo in discussione il ruolo di questo polimorfismo nella suscettibilità alla
malattia neuropsichiatrica.
Per quanto riguarda la farmacogenetica sono stati fatti molti studi di correlazione, in pazienti psicotici, tra il polimorfismo Bal I e suscettibilità ad effetti collaterali ad effetti collaterali per uso di neurolettici. In particolare, diversi lavori hanno trovato una associazione tra il polimorfismo recettoriale D3 (BalI) e lo sviluppo di discinesie tardive in pazienti schizofrenici. Addirittura una
recettore D3 contribuisce alla suscettibilità per le discinesie tardive (Lerer et al., 2002). Tuttavia,
questa importante indicazione non è stata confermata da altri studi.
Il gene del recettore dopaminergico D4 contiene diverse regioni di siti polimorfici. In particolare,
esiste una regione ipervariabile che corrisponde al terzo loop intracellulare della struttura proteica. Non sembra esserci differenze funzionali e farmacologiche tra queste varianti polimorfiche.
Gli studi che hanno esaminato la possibilità di correlazioni tra i polimorfismi sul recettore D4 e
schizofrenia non hanno trovato indicazioni positive (Wong et al., 2000).
1.4. Dimerizzazione dei recettori accoppiati a proteine G
esempi che dimostrano l’esistenza di recettori accoppiati alle proteine G in forma omodimerica o eterodimerica stanno emergendo con una velocità considerevole (Bouvier et al., 2001).
Numerose evidenze sperimentali di tipo biofisico e biochimico hanno confermato la presenza di numerosi complessi recettoriali in cellule “viventi” supportando l’idea che la dimerizzazione possa essere un processo importante per la biogenesi e la funzione dei recettori accoppiati alle proteine G. Se da una parte l’omodimerizzazione apre nuove questioni sui meccanismi molecolari coinvolti nella trasduzione del segnale evocato dal neurotrasmettitore, la presenza di eterodimeri potrebbe portare alla formazione di nuove strutture recettoriali con un profilo funzionale e farmacologico, contribuendo in tal modo all’interazione tra diversi sistemi neurotrasmettitoriali.
Tenendo conto che i recettori accoppiati a proteine G sono il maggior “target” nel campo farmaceutico, l’esistenza di dimeri potrebbe avere delle implicazioni per lo sviluppo di nuovi farmaci.
D’altronde il concetto di dimerizzazione come fenomeno coinvolto nell’attivazione di recettori transmembrana è stato dimostrato per molte proteine recettoriali e costituisce spesso una tappa decisiva per un’appropriata risposta biologica. Un esempio importante è rappresentato dai recettori tirosin-chinasi per i fattori di crescita (EGF-R, PDGF-R e FGF-R) che trovano nella dimerizzazione il proprio meccanismo di attivazione.
Per quanto riguarda i recettori accoppiati a proteine G, essi sembrano essere particolarmente versatili e dinamici all’interno della propria struttura proteica e ciò potrebbe consentire una più facile interazione recettore-recettore.
Diversi esperimenti hanno dimostrato che i GPCRs sono complessi proteici costituiti da più subunità indipendenti che interagiscono tra loro. È possibile infatti frammentare questi recettori in due parti in grado di riconoscersi e ricongiungersi sulla membrana cellulare per ricostituire il recettore originale.
Questo fenomeno è stato dimostrato per diversi recettori, come per esempio il recettore per la rodopsina (Ridge et al., 1995), quello β2-adrenergico (Kobilka et al., 1998), i recettori muscarinici M2
e M3 (Maggio et al., 1993), il recettore per la vasopressina V2 (Shoneberg et al., 1995), quello per
l’ormone del rilascio delle gonadotropine (Grosse et al., 1997), quelli alle neurochinine NK1 (Nielsen et al., 1998) e il recettore D2 per la dopamina (Scarselli et al., 2000).
Il taglio effettuato a livello del terzo loop intracellulare dà luogo a due distinti frammenti recettoriali: il frammento “trunk” contenente l’estremità N-terminale, i domini transmembrana da VI e VII e l’estremità C-terminale del recettore.
I frammenti recettoriali ottenuti sono capaci di riconoscersi e riassociarsi fra di loro ricostituendo il recettore wild-type dal quale sono derivati. Proprio per questo meccanismo di riconoscimento ed interazione tra le due subunità potrebbe essere alla base di uno dei meccanismi di interazione recettore-recettore.
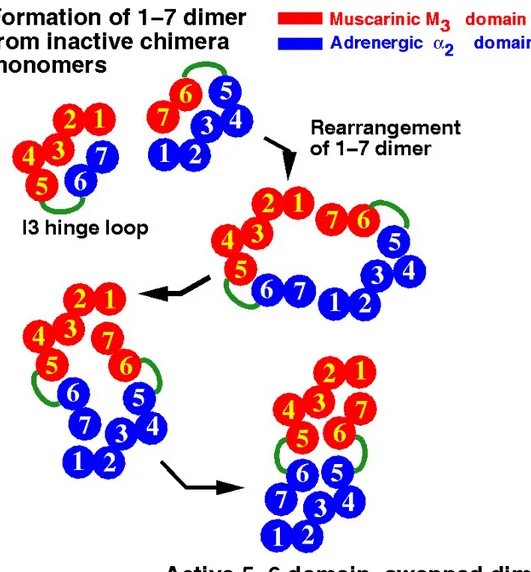
Questo modello di dimerizzazione recettoriale proposto è il cosiddetto “domain swapping”(scambio di domini), in cui la parte trunk di uno dei due monomeri interagisce con quella tail dell’altro. Il risultato è un dimero recettoriale con una struttura proteica tetramerica, a quattro subunità, stabilizzata da un numero d’interazioni chimiche praticamente doppio rispetto a quello presente nel recettore monometrico.
Questo tipo di interazione è stato proposto per spiegare la dimerizzazione tra due recettori chimerici inattivi formati da parte del recettore muscarinico M3 e parte dal recettore adrenergico α2 (Maggio et
al., 1993). Tale lavoro è particolarmente importante perché ha dimostrato per la prima volta la possibilità di un’interazione diretta a livello molecolare tra due recettori accoppiati alle proteine G. In particolare, la chimera M3/α2 era formata da i primi V segmenti transmembrana del recettore M3 e
dal VI-VII segmento del recettore α2, mentre la chimera α2/M3 risultava costruita in modo
complementare (Fig. 9).
Le due chimere recettoriali erano incapaci di legare i vari composti adrenergici e muscarinici ed inoltre erano inattive funzionalmente. Invece, la loro co-espressione permetteva di rilevare l’attività sia del recettore M3, sia del recettore α2 dimostrando che le due chimeriche inattive interagivano per
ripristinare la funzione dei recettori da cui provenivano. Questo tipo di interazione indicava anche il probabile meccanismo da cui provenivano. Questo tipo di interazione indicava anche il probabile meccanismo con cui si formava il dimero recettoriale, dove si ricostituivano il recettore M3 e α2.
Questo meccanismo è suffragato da evidenze sperimentali ma anche da modelli computazionali (Gouldson et al., 1998).
1.4.1 Evidenze di dimeri recettoriali
Negli ultimi anni un numero crescente di pubblicazioni scientifiche ha descritto e analizzato la possibile dimerizzazione ed eterodimerizzazione dei recettori accoppiati alle proteine G.
Il primo esempio di eterodimero recettoriale evidenziato è stato il recettore GABAb. In questo caso sono state individuate e clonate due differenti sequenze geniche del recettore GABAb nel cervello di ratto, GABAbR1 e GABAbR2, dimostrando che per ottenere una piena attività recettoriale fossero entrambe fondamentali (Jones et al., 1998). La presenza di una sola delle due subunità nella cellula non era sufficiente per ottenere la funzione del recettore GABAb, mentre la co-espressione delle due consentiva di ottenere un recettore completamente funzionante. Questo fu il primo esperimento che dimostrava come l’interazione tra le due subunità di un recettore fosse un requisito indispensabile per il corretto funzionamento della trasduzione del segnale di un neurotrasmettitore a livello sinaptico. È stato anche dimostrato, utilizzando la microscopia elettronica, come le due subunità recettoriali GABAbR1 e GABAbR2 fossero colocalizzate in vivo nel ratto a livello delle spine neuronali delle cellule di Purkinje del cervelletto (Kaupmann et al., 1998), suggerendo come l’interazione tra i due recettori possa veramente essere un fenomeno fisiologico estendibile nel regno animale.
Studi successivi hanno confermato la necessità della presenza di entrambe le subunità per un corretto funzionamento del recettore GABAb (Mitrovic et al., 2001; Gelvez et al., 2001; Havlikova et al., 2002), indicando anche gli aspetti molecolari di questa interazione. In particolare è stato dimostrato come la presenza di entrambe le subunità sia fondamentale per il corretto “traffincking” recettoriale ed inoltre sono state individuate le funzioni dei sottotipi recettoriali. Se la subunità GABAbR1 è fondamentale per l’iterazione con i ligandi gabaergici, la subunità GABAbR2 è essenziale per l’accoppiamento con le proteine G e per il raggiungimento dell’espressione su membrana. Tuttavia, questa netta distinzione di ruoli delle due subunità non è stata ancora del tutto dimostrata dato che alcuni studi hanno evidenziato come nella struttura eterodimerica anche il recettore GABAbR1 contribuisca all’effetto funzionale mentre il recettore GABAbR2 aumenti l’affinità verso alcuni agonisti gabaergici.
Oggi gli studi eseguiti sulla presenza dell’eterodimero GABAbR1/GABAbR2 sono quelli maggiormente convincenti, confermati e difficilmente confutabili, che incoraggiano fortemente a proseguire su questo filone di ricerca con la speranza di scoprire nuovi eterodimeri recettoriali.
Se lo studio sul complesso eterodimerico gabaergico ha aperto la strada nel campo della dimerizzazione dei GPCRs, gli esperimenti sui recettori oppiodi μ, δ e κ, hanno indicato come questo fenomeno molecolare di interazione fra recettori possa dare origine alla formazione di complessi proteici con caratteristiche funzionali e farmacologiche distinte dai recettori che li formano (Devi et al., 2000).
L’interazione molecolare diretta di tipo eterodimerico tra i recettori δ e κ porta alla formazione di un complesso proteico con caratteristiche funzionali e farmacologiche distinte. Inoltre, l’eterodimero δ/κ è capace di legare sinergicamente due ligandi oppiodi selettivi potenziando il segnale di trasduzione della fosforilazione di MAP chinasi (Jordan et al., 1999).
La farmacologia di questo sito eterodimerico è differente da quella dei recettori δ e κ che lo compongono, mentre risulta molto vicina a quella del sottotipo recettoriale precedentemente caratterizzato come recettore κ2. tali indicazioni sperimentali danno conferma all’ipotesi che la
formazione di eterodimeri potrebbe davvero,in alcuni casi, dare origine a nuovi siti recettoriali con caratteristiche farmacologiche proprie.
Esperimenti analoghi sono stati fatti sui recettori μ e δ, ottenendo risultati simili. La farmacologia del sito eterodimerico μ/δ sembra molto vicina a quella del sottotipo recettoriale δ2 (Gomes et al., 2000).
Dal punto di vista funzionale sono state rilevate nuove caratteristiche del sito eterodimerico, addirittura in alcuni casi opposte rispetto ai recettori μ e δ che lo compongono (Charles et al., 2003). La scoperta di recettori eterodimerici oppiodi ha portato ad un notevole interesse per eventuali applicazioni cliniche. Per esempio è stato dimostrato che somministrando in vivo contemporaneamente agonisti selettivi per i recettori μ e δ si ottiene un effetto sinergico antidolorifico dovuto ad un potenziamento della funzione recettoriale, senza conoscere il meccanismo di questa cooperatività farmacologica. La morfina, un potente antidolorifico, è un agonista μ e può indurre dipendenza e tolleranza; se viene somministrato congiuntamente un agonista δ, quest’ultimo potrebbe potenziare l’effetto analgesico della morfina consentendo una diminuzione della sua dose. Una possibile spiegazione dell’effetto sinergico ottenuto, somministrando contemporaneamente un μ agonista e un δ agonista, è che entrambi siano in grado di attivare congiuntamente il recettore eterodimerico.
La formazione di un nuovo sito recettoriale è stata evidenziata anche peri recettori muscarinici M2 e
M3. la co-espressione dei due recettori muscarinici porta alla formazione di un sito eterodimero con
caratteristiche farmacologiche simili a quelle di un recettore chimerico formato dalla parte trunk del recettore M3 e dalla parte tail del recettore M2, indicando come meccanismo possibile quello del
“domain swapping” (Maggio et al., 1999).
Finora abbiamo trattato dell’interazione tra sottotipi recettoriali che fanno parte dello stesso sistema neurotrasmettitoriale, tuttavia esempi d’interazione tra recettori che rispondono a differenti neurotrasmettitore non mancano.
Nel caso particolare è stato dimostrato come i recettori dopaminergici D2 e i recettori alla
somatostatina SSTR5 interagiscano fisicamente attraverso l’eterodimerizzazione creando un nuovo recettore ad alta affinità capace di legare contemporaneamente somatostatina e agonisti dopaminergici (Rocheville et al., 2000). L’aumento di affinità di tale complesso eterodimerico è circa
30 volte e l’interazione tra i due recettori è stata determinata in cellule viventi utilizzando la tecnica della FRET.
Dati di questo tipo sono estremamente interessanti, perché potrebbero contribuire alla spiegazione del fenomeno della cotrasmissione. Cotrasmettitori come la somatostatina o altri possono influenzare l’attività di sistemi neurotrasmettitoriali classici, come quello della dopamina per esempio, il meccanismo d’interazione potrebbe almeno in parte passare dalla formazione di eterodimeri recettoriali in grado di captare la presenza di due ligandi diversi.
l’eterodimerizzazione di recettori accoppiati a proteine G, oltre ad influenzare le funzioni e le affinità dei recettori, potrebbe svolgere un ruolo importante nei fenomeni di internalizzazione e desensitizzazione dei recettori sulla membrana cellulare. Se vengono coespressi, per esempio, nella stessa cellula recettori oppiodi δ e recettori adrenergici, osserviamo che l’agonista adrenergico internalizza entrambi i recettori (Jordan et al., 2001). La presenza dell’eterodimero δ/β2 sensibile ad
entrambi gli agonisti potrebbe spiegare questo fenomeno di cooperazione.
D’altra parte il fenomeno sopra descritto risulta specifico considerando che in cellule che esprimono sia il recettore κ che il recettore β2 non si verifica tale interazione.
Indicazioni della stessa natura sono state suggerite per i recettori eterodimerici SSTR2a/μ (Pfeiffer et al., 2002). In questo caso la stimolazione con somatostatina o con un ligando oppiode del recettore eterodimerico non solo influenza l’internalizzazione di entrambi i recettori, ma anche il grado di fosforilazione e desensitizzazione di entrambi.
Quindi l’eterodimerizzazione tra recettori accoppiati a proteine G si presenta come un fenomeno biologico funzionale importante almeno nei sistemi cellulari sperimentali; rimane da confermare tale indicazione negli organismi animali viventi come l’uomo per esempio.
Dati sperimentali sull’uomo del fenomeno della eterodimerizzazione in realtà sono stati ottenuti, ma non come meccanismo di una funzione fisiologica quanto come possibile causa di patogenesi. Questo non significa che l’eterodimerizzazione in vivo abbia solamente un significato fisiopatologico, ma dimostra come tale meccanismo biologico sia estremamente diversificato a seconda del sistema recettoriale di cui ci stiamo occupando.
È stato dimostrato come nelle gestanti che soffrono di una patologia come la preeclampsia si si osserva una risposta esagerata agli effetti pressori dell’angiotensina II e tale effetto potrebbe passare dalla presenza dell’eterodimero formato tra il recettore all’angiotensina II AT1 a il recettore alla bradichinina B2 (Abdalla et al., 2001). l’eterodimerizzazione tra AT1 e B2 è correlabile con un aumento di circa cinque volte della quantità del recettore B2; inoltre, l’espressione dell’eterodimero AT1/B2 fa aumentare la risposta all’angiotensina II e conferisce resistenza del recettore AT1 ai normali processi di disattivazione indotta delle specie reattive dell’ossigeno.
Gli esperimenti sono stati eseguiti sulle piastrine e sui vasi del cordone ombelicale nelle donne affette dalla patologia, confrontando con quelli ottenuti in gestanti sane.
Se finora sono state analizzate interazioni tra recettori accoppiati alle proteine G, uno studio ha evidenziato come sia possibile un’interazione diretta anche tra recettori accoppiati alle proteine G e recettori canale. Tale interazione è stata dimostrata tra il recettore dopaminergico D5 e il recettore
canale GABAa (Liu et al., 2000). La formazione dell’eterodimero D5/GABAa potrebbe spiegare in
parte alcune interazioni funzionali tra il sistema neurotrasmettitoriale dopaminergico e quello gabaergico.
Da questi esempi di eterodimerizzazione, dal significato così diverso, emerge come questo meccanismo biologico debba ancora essere ben caratterizzato e studiato in dettaglio soprattutto in sistemi nativi; tuttavia dalle indicazioni finora ottenute possiamo ipotizzare che il fenomeno possa essere importante e costituisca un ulteriore meccanismo di regolazione e modulazione nel complesso sistema d’interazione tra neurotrasmettitori e recettori.
1.4.2. Meccanismi di dimerizzazione recettoriale
Per quanto riguarda la struttura tridimensionale dei dimeri recettoriali, l’unica evidenza diretta proviene da studi cristallografici sui recettori metabotropici al glutammato mGluR1 (Kunishima et al., 2000). In questo studio è stata determinata la struttura tridimensionale cristallina della parte extracellulare N-terminale sia in presenza che in assenza di glutammato. La struttura cristallina ha dimostrato che un ponte di solfuro tra le due cisteine (Cys-140) è responsabile della connessione tra i due monomeri, anche se interazioni tra vari segmenti proteici ad α-elica contribuiscono alla stabilità del dimero. Il complesso omodimerico mostra una certa flessibilità e dinamicità conformazionale ed il ligando stabilizza la struttura attiva del recettore.
L’omodimerizzazione di alcuni recettori metabotropici al glutammato e di recettori Ca++-sensibili
avviene quindi con un meccanismo di formazione di un ponte disolfuro, ma probabilmente coinvolte anche interazioni di tipo idrofobico tra differenti segmenti proteici ad α-elica (Fig. 10)
Un altro meccanismo di dimerizzazione è stato messo in luce nell’interazine tra due i due sottotipi recettoriali GABAbR1 e GABAbR2. un’interazione tra le due code recettoriali (Coleid-coil) a livello
del C-terminale è stata ipotizzata nella formazione dell’eterodimero grazie a studi di mutagenesi (Margeta et al., 2001). Questi studi hanno anche dimostrato che, sebbene l’interazione “coleid-coil” sia importante per la corretta espressione recettoriale in membrana, essa non è necessaria per la formazione del dimero.
Il terzo meccanismo di dimerizzazione tra recettori monomerici è quello che prevede un’interazione soprattutto di tipo idrofobico a livello dei segmenti transmembrana come dimostrato da studi di mutagenesi sul recettore β2 adrenergico e D2 dopaminergico.
Insieme a questi studi, analisi di simulazione computazionale hanno supportato l’idea che siano soprattutto i domini transmembrana V e VI che creino l’interfaccia di interazione tra i due monomeri (Gouldson et al., 1998).
In realtà il meccanismo di interazione tra le parti transmembrana dei due recettori potrebbe avvenire con due meccanismi diversi, uno che prota alla formazione di “Contact Dimeri” e l’altro che forma i “Swapped Dimers”.
Nel meccanismo del “domain swapping” (scambio di domini), la parte trunk di uno dei due monomeri interagisce con quella tail dell’altro monomero e viceversa. Il risultato è un dimero recettoriale con una struttura proteica tetramerica, formata da quattro ipotetiche subunità che generano due siti recettoriali, stabilizzata da un numero d’interazioni chimiche praticamente doppie rispetto a quello presente nel recettore monometrico.
Questo scambio è reso possibile dalla libertà di movimento che le due porzioni hanno all’interno dello stesso monomero recettoriale, dovuta sia alla lunghezza del terzo loop intracellulare, sia alla fluidità del doppio strato fosfolipidico di membrana.
![Fig. 14. Spiazzamento del [ 3 H]nemonapride da parte del S33084, antagonista selettivo dei D 3 , su](https://thumb-eu.123doks.com/thumbv2/123dokorg/5693936.72859/48.892.200.751.68.524/fig-spiazzamento-h-nemonapride-parte-s-antagonista-selettivo.webp)