9
INTRODUZIONE
1. IL CANCRO DEL COLONRETTO
1.1.
Epidemiologia
Il cancro del colon retto (Colon rectal Cancer, CRC) è una tra le neoplasie maligne più diffuse al mondo. Con un trend d’incidenza in aumento, tale neoplasia rappresenta, in entrambi i sessi, il terzo tumore per frequenza negli USA; in Europa, dove costituisce l’8% di tutte le nuove diagnosi di neoplasia maligna in età adulta, è al terzo posto per il sesso maschile (12.8% di tutti i tumori) ed al secondo per quello femminile (13.1%) (1).
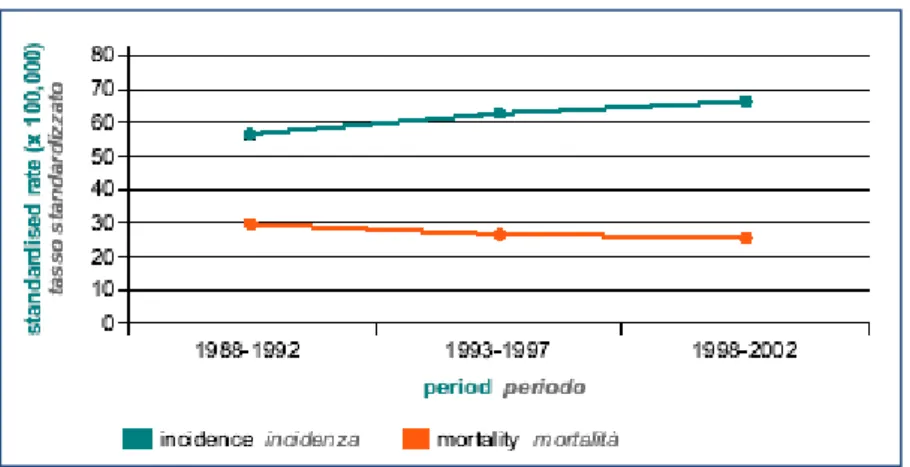
In Italia ogni anno vengono diagnosticati oltre 20 mila nuovi casi con una maggiore incidenza nelle fasce di età più elevate: dai 2-3 casi ogni 100 mila soggetti di età inferiore ai 45 anni, ai 200 casi su 100 mila abitanti oltre i 75 anni. L’età media al momento della diagnosi è di circa 60 anni. Esiste una variabilità geografica nella incidenza del CRC in Italia: i tassi più elevati si registrano nell'Italia centro-settentrionale con una incidenza quasi doppia rispetto all'Italia meridionale e insulare. Nonostante l’aumento dell’incidenza osservato negli ultimi anni, è stata registrata una contemporanea riduzione della mortalità, dovuta principalmente alla maggiore capacità di individuazione della neoplasia in stadi sempre più precoci, ed al miglioramento dell’efficacia del trattamento terapeutico (Figura 1). La principale causa di morte del paziente con CRC rimane, ad ogni modo, legata alla presenza di disseminazione a distanza della neoplasia, che si registra alla
10
diagnosi, a carico del fegato nel 20-70% dei pazienti e del polmone nel 10-20% dei casi.1
Figura 1. Tassi di incidenza e mortalità dei CRC1.
Un ruolo fondamentale nell’insorgenza dei CRC è da attribuire a quelli che genericamente vengono definiti fattori ambientali, che instaurandosi su di un quadro di suscettibilità genetica individuale, sono indispensabili nella progressione del processo di cancerogenesi; tra questi, la dieta ricopre un ruolo di primaria importanza. Abitudini dietetiche che potenzialmente elevano il rischio di sviluppare malattia sono rappresentate dallo scarso apporto di frutta, vegetali e fibre e dall’eccessivo consumo di carni rosse e grassi saturi. Inoltre un elevato apporto di alcool (30 g/ die), in particolare birra, aumenta il rischio in entrambi i sessi (2).
Più recentemente, condizioni patologiche predisponenti, come malattie infiammatorie croniche intestinali, sono state riconosciute come fattori di
11
rischio per l’insorgenza del CRC. Infatti, l’infiammazione facilita la fase d’iniziazione delle cellule normali, la loro crescita e la progressione verso la malignità, attraverso la produzione di citochine pro-infiammatorie e diverse specie radicaliche dell’ossigeno (3).
12
1.2.
Caratteristiche istopatologiche dei CRC
Il CRC si manifesta con una differente percentuale di distribuzione nei vari segmenti del grosso intestino: 16% a livello di cieco e colon ascendente, 8% trasverso e flessura splenica, 6% colon discendente, 20% sigma e 50% retto. Ogni sede di insorgenza presenta una propria specificità clinica, terapeutica e prognostica. Nelle ultime decadi è stato registrato un progressivo aumento delle diagnosi di CRC a localizzazione prossimale (cieco, colon ascendente e trasverso)(4).
Le dimensioni variano da pochi millimetri a più di 10 cm di diametro. Dati clinici ed istopatologici suggeriscono che la maggior parte dei carcinomi colon-rettali deriva da polipi inizialmente di piccole dimensioni che si ingrandiscono dando luogo ad adenomi, tumori benigni, che gradualmente progrediscono attraverso un aumento nelle dimensioni, nel grado di displasia e nell’acquisizione di una morfologia villosa, passando per gli stadi di adenoma precoce, intermedio e tardivo, fino a divenire tumori maligni, carcinomi. L’adenoma rappresenta, quindi, la lesione pre-neoplastica su cui insorge la quasi totalità dei CRC. Gli adenomi colon-rettali vengono classificati, in base all’istotipo ed al grado di displasia secondo la classificazione istologica WHO (World Health Organization Classification of Tumours), in:
tubulare (componente tubulare > 80%) villoso (componente villosa > 80%)
tubulo-villoso (entrambe le componenti presenti in misura compresa tra 20% e 80%).
La displasia viene graduata in basso grado (lieve o moderata) ed alto grado (grave), in base all’entità delle alterazioni architetturali (conformazione delle
13
ghiandole e dei villi) e citologiche (muco secrezione, stratificazione, polarità, ipercromasia e polimorfismo nucleari, attività mitotica). Non tutti i polipi tendono a degenerare e la probabilità di trasformazione neoplastica aumenta nei cosiddetti “adenomi ad alto rischio” che presentano, cioè, caratteristiche microscopiche specifiche (componente villosa, displasia grave) e dimensioni superiori a un centimetro; si stima che circa il 25% degli adenomi ad alto rischio si trasformi in tumore maligno (5).
La caratterizzazione istologica del CRC comprende la valutazione di variabili morfologiche la cui importanza è legata alla prognosi. Per questo motivo, tali variabili devono essere ricercate e valutate accuratamente attraverso un attento esame macroscopico e microscopico del pezzo operatorio. Esse possono essere suddivise in:
variabili morfologiche associate alla neoplasia primitiva: dimensioni e/o estensione parietale della neoplasia, istotipo, grado di differenziazione, indice mitotico, angiogenesi tumorale, ecc.
valutazione dell’assetto linfonodale: valutazione del numero, della sede e dello stato reattivo.
variabili morfologiche associate a sedi extranodali.
L’istotipo più frequente di tumore del grosso intestino è rappresentato dall’adenocarcinoma, che rappresenta il 90-95% di tutte le neoplasie maligne del colon e si sviluppa a carico delle ghiandole della mucosa del colon, in cui le cellule neoplastiche tendono a riprodurre formazioni tubulari pseudoghiandolari, le quali mostrano una certa irregolarità architettonica. Gli adenocarcinomi possono essere suddivisi, in base al loro grado di differenziazione, in:
ben differenziati (20%). Sono carcinomi che presentano ghiandole ben formate. I nuclei hanno forma e grandezza uniformi e localizzazione basale.
14
moderatamente differenziati (60%). Le ghiandole sono meno regolari, ma ancora distinguibili. I nuclei sono ingranditi e perdono la localizzazione basale.
poco differenziati (20%). Le ghiandole sono altamente irregolari e difficili da distinguere.
Esistono delle varianti dell’adenocarcinoma con specificità istologiche e prognostiche: variante mucinosa e variante a cellule ad anello con castone. La variante mucinosa viene definita dal riscontro di una percentuale di mucina superiore al 50% del volume tumorale complessivo. L’adenocarcinoma mucinoso, più frequente nel sesso maschile, si localizza di preferenza nel colon destro, viene diagnosticato in stadio più tardivo ed è stato ipotizzato che possa avere una prognosi peggiore rispetto alle forme non mucinose. L’abbondante quantità di mucina determina, infatti, lo scollamento degli strati della parete intestinale favorendo la progressione in profondità (6). L’istotipo a cellule ad anello con castone è una variante più rara, in cui la mucina si dispone in sede intracellulare attorno al nucleo determinandone un suo decentramento. Altrettanto rari il carcinoma squamoso, adenosquamoso (o adenoacantoma) e quello a piccole cellule che al pari del corrispettivo polmonare è gravato da una cattiva prognosi a seguito della precoce disseminazione ematica. I carcinomi squamosi ed adenosquamosi si ritrovano solo nella parte distale del colon-retto. I CRC possono diffondere localmente per continuità, contiguità e per via endocavitaria, e a distanza per via linfatica ed ematica. La propagazione per continuità avviene per infiltrazione neoplastica nella parete intestinale con estensione lungo la parete dell’organo stesso. Il superamento della sottomucosa aumenta enormemente le possibilità di disseminazione metastatica della malattia, con peggioramento della prognosi all’aumentare della profondità di invasione. La diffusione per contiguità può, a seconda della sede, coinvolgere organi differenti, potendosi manifestare con la formazione di fistole nelle anse del
15
tenue, nello stomaco, nella parete vaginale e nella vescica. Tumori del cieco o del colon destro possono determinare un coinvolgimento del duodeno o del rene di destra, quelli del colon trasverso dello stomaco e dell’omento; la propagazione per via endocavitaria comporta l’insorgenza di carcinosi peritoneale con colonizzazione ovarica. La via seguita dalla diffusione linfatica dipende strettamente dalla sede tumorale, potendo interessare i linfonodi epicolici addossati alla parete intestinale, paracolici situati sul margine mesenterico, intermedi lungo il decorso delle arterie coliche e principali. La disseminazione ematica per le neoplasie del colon e del retto superiore avviene in massima parte con la corrente del sangue portale. Pertanto l’organo principalmente interessato da metastasi è il fegato anche se in alcune situazioni caratterizzate da anastomosi porto-cavali le cellule possono raggiungere direttamente la vena cava. Il retto medio e quello inferiore, invece, metastatizzano più frequentemente al polmone, in quanto attraverso le vene emorroidarie medie ed inferiori, le cellule neoplastiche passano direttamente nella cava inferiore. L’exitus del paziente con CRC avviene spesso come conseguenza della massiva compromissione di organi vitali, quali fegato, polmone od encefalo. In circa la metà dei casi il decesso sopraggiunge per complicazioni ostruttive intestinali o ureterali, per perforazioni od emorragie.
Il primo sistema di stadiazione del carcinoma del colon-retto fu introdotto da Cuthbert Dukes nel 1932, successivamente lo stesso venne modificato, prima da Astler-Coller nel 1954 e poi da Turnball nel 1967. Il sistema attualmente utilizzato, in vigore dalla metà degli anni ‘80 e raccomandato dall’American Joint Committee on Cancer (AJCC), si basa su 3 parametri: il parametro T, che indica il grado di invasione della parete intestinale; il parametro N, che indica il grado di coinvolgimento dei linfonodi; il parametro M, che misura il grado di metastatizzazione. Tale sistema di stadiazione è universalmente accettato. Nei CRC gli esami di stadiazione preoperatori sono mirati
16
principalmente alla ricerca di eventuali metastasi negli organi a distanza più frequentemente coinvolti. A tale scopo si eseguono l’ecografia dell’addome per lo studio del fegato e la radiografia del torace per quello del polmone. Nei tumori rettali, invece, l’attenzione viene rivolta soprattutto verso i parametri T ed N, in quanto è da tali aspetti che dipende la decisione di effettuare un trattamento preoperatorio. Gli esami praticati sono quindi una TC spirale pelvica, l’ecografia transrettale, per comprendere al meglio la profondità di infiltrazione della parete intestinale e la fissità tumorale, ed eventualmente, quale complemento stadiativo, una ecoendoscopia rettale ed una risonanza magnetica nucleare pelvica (RMN pelvica).
17
1.3.
Forme ereditarie e forme sporadiche
Diversi studi epidemiologici hanno messo in evidenza che almeno il 15% dei CRC ha un ben definito pattern di trasmissione ereditaria di tipo autosomico dominante e, più raramente, recessivo. La familiarità gioca, in tutti questi casi, un ruolo rilevante; individui nella cui famiglia si sia già verificato questo tipo di patologia, sono considerati soggetti a rischio che devono pertanto essere costantemente monitorati.
Sono conosciute due forme di CRC ereditario che si distinguono tra loro per l’associazione o meno a poliposi. Al primo gruppo appartiene la poliposi adenomatosa familiare (FAP, Familiar Adenomatous Polyposis) e le sue varianti, la sindrome di Gardner e la sindrome di Turcot. Nel secondo gruppo si riconosce, invece, la sindrome di Lynch o sindrome del carcinoma del colon-retto non associato a poliposi (HNPCC, Hereditary NonPoliposis Colorectal Cancer). La FAP è responsabile dell’1% circa dei CRC. Si tratta di una malattia a trasmissione autosomica dominante (1 caso ogni 8000 nati vivi), determinata dalla mutazione del gene APC posto sul braccio lungo del cromosoma 5. È caratterizzata dall’insorgenza di polipi adenomatosi in numero variabile da poche decine ad alcune migliaia, costituiti da epitelio iperproliferativo della mucosa (7).
La sindrome di Lynch (varianti I e II) è una malattia autosomica dominante con una penetranza dell’80%, più comune della FAP, determinata da mutazioni nei geni del mismatch repair (MMR) e caratterizzata da una maggiore incidenza di carcinomi del colon destro spesso multipli e sincroni in pazienti con età media più giovane. Risulta responsabile dell’insorgenza del 5% di tutti i carcinomi colici. Mentre nella variante Lynch I si diagnosticano solo tumori del colon prossimale, nella Lynch II vi è un rischio associato ad altre malattie neoplastiche quali il carcinoma dell’endometrio, neoplasie del tratto urinario e di quello biliare (8).
18
Tra i criteri sviluppati per porre diagnosi di HNPCC quelli di Amsterdam sono i più utilizzati (9):
tre familiari affetti da CRC
un parente di primo grado rispetto agli altri due cancro diagnosticato prima dei 50 anni
due o più generazioni affette esclusione della FAP
Più dell’80% delle neoplasie maligne del colon retto è rappresentato da quelle forme che non seguono un pattern di trasmissione ereditaria e si manifestano in seguito ad alterazioni genetiche multiple, i CRC sporadici.
19
1.4.
Tumorigenesi del cancro del colon retto
La cancerogenesi colon rettale, come tutti i processi neoplastici, è il risultato di una serie di singole alterazioni geniche che, accumulandosi in un ben preciso ordine cronologico, danno luogo al processo neoplastico. Nell’ultimo ventennio grazie al miglioramento delle metodiche di biologia molecolare si è riusciti a comprendere il ruolo delle principali mutazioni che partecipano al processo di “multistep carcinogenesis”. L’accumulo di cambiamenti, piuttosto che l’ordine con cui si presentano, è importante nella determinazione delle proprietà biologiche del tumore. L’intero processo, che sta alla base della carcinogenesi del colon-retto, richiede un periodo di circa dieci anni ed almeno sette eventi genetici per il suo completamento, durante questo periodo di tempo l’instabilità genetica ha un ruolo determinante (10). Sia nelle forme sporadiche che in quelle ereditarie del CRC, sono state identificate due tipologie di instabilità: l’instabilità cromosomica (Chromosomal Instability, CIN) e l’instabilità dei microsatelliti (Microsatellite Instability, MSI). L’85% dei carcinomi del colon retto presenta un numero anomalo di cromosomi (aneuploidia) dovuto ad un tasso accelerato di perdita o acquisizione di interi cromosomi (o di larghe porzioni di essi), denominato instabilità cromosomica (CIN). Circa il 15% dei carcinomi del colon-retto presenta un’instabilità genetica caratterizzata dall’inefficienza della riparazione degli errori di appaiamento (MMR, mismatch repair), questo tipo di instabilità colpisce sequenze di DNA ripetute, i microsatelliti, ed è stato quindi denominato instabilità dei microsatelliti (MSI). I geni MMR sono coinvolti nel cancro del colon ereditario non associato a poliposi (HNPCC). Le cellule tumorali che presentano MSI hanno un tasso di mutazione a livello nucleotidico dalle 2 alle 3 volte superiore rispetto a quello osservato nelle cellule normali (11).
20
Quindi, ciò che caratterizza le cellule con MSI è una maggiore predisposizione all’acquisizione di mutazioni puntiformi in geni coinvolti nell’equilibrio tra sopravvivenza e morte cellulare (12).
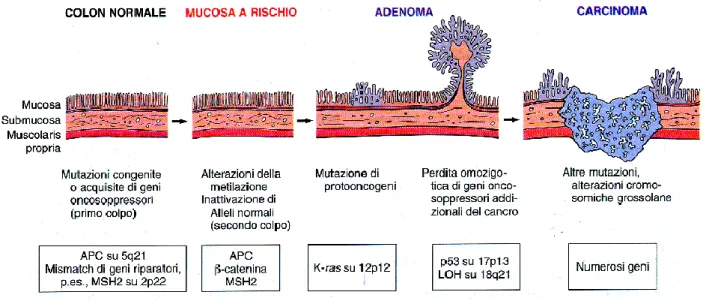
Nel 1990 Fearon e Vogelstein hanno suggerito un modello di tumorigenesi colon-rettale in cui, nello stadio iniziale di formazione del polipo, avvengono mutazioni nel gene oncosoppressore APC, seguite, durante lo stadio di adenoma, da mutazioni nell’oncogene KRas e, all’atto della transizione alla malignità, da delezioni sul cromosoma 18 e da mutazioni di TP53. Tale meccanismo, noto come sequenza adenoma-carcinoma, spiega in parallelo le modificazioni morfologiche e biologiche a carico dell’adenoma (13)
21
1.4.1 Il gene APC (adenomatous polyposis coli): aspetti
biologici e ruolo nella tumorigenesi del CRC
Nella sequenza di alterazioni geniche che caratterizzano i CRC, l’evento iniziale è rappresentato dall’inattivazione del gene soppressore APC (adenomatous polyposis coli) (14). L’85% dei carcinomi del colon-retto presenta una mutazione del gene APC, mentre la metà dei restanti carcinomi presenta la mutazione del gene β-catenina (15). Il gene APC codifica per una proteina citoplasmatica che promuove la degradazione della β-catenina, limitando in questo modo la trascrizione dei geni del ciclo cellulare controllati da Wnt (16). APC è coinvolto in una varietà di processi cellulari oltre alla proliferazione cellulare, quali migrazione cellulare e adesione, è correlato al mantenimento della stabilità cromosomica, nonché dell’organizzazione del citoscheletro. La proteina β-catenina viene quindi regolata dalla proteina APC, pertanto la mutazione di uno dei due geni produce lo stesso effetto fisiologico (17). Nei restanti casi di carcinoma del colon-retto, si pensa siano coinvolte mutazioni di altri geni facenti parte della stessa via di segnalazione.
1.4.2 Il gene KRas: aspetti biologici e ruolo nella
tumorigenesi del CRC
La progressione verso la forma maligna degli adenomi è legata all’acquisizione di mutazioni a livello del gene KRas. La famiglia dei geni Ras codifica per proteine essenziali nei processi di segnalazione delle chinasi
22
che controllano la trascrizione dei geni che poi regolano la crescita e la differenzazione cellulare (18).
I geni codificanti le diverse proteine Ras, dislocati in più punti del genoma, e noti come H-Ras, K-Ras e N-Ras mappano rispettivamente in posizione 11p15.5, 12p12.1 e 1p13 (19). Le proteine RAS sono delle piccole proteine G dette anche p21 che oscillano ciclicamente tra una forma attiva legata al GTP e una forma inattiva legata al GDP; il segnale del primo recettore porta il GTP a legare Ras attraverso un fattore di scambio di nucleotidi guanilici Sos, che penetra nella tasca che lega il nucleotide e la apre, permettendo al GDP di uscire e al GTP di prenderne posto. GTP-RAS trasmette il segnale all’interno della cellula, conducendo all’attivazione di specifiche serina-treonina proteine chinasi (es. RAF) che fosforilano selettivamente bersagli (attivazione via MAP-chinasi e via PI3K/AKT) e che promuovono la crescita cellulare. RAS possiede un’attività GTPasica intrinseca: GTP-RAS è convertito nella forma inattiva GDP-RAS.
23
Questa attività, necessaria per terminare il segnale e ricondurre il segnale allo stato inattivo, è piuttosto lenta se non fosse accelerata e sostenuta da proteine che attivano la GTPasi (GAP proteine attivatrici). I fattori di scambio di nucleotidi guanilici e le proteine che attivano la GTPasi permettono al ciclo delle proteine G di procedere a velocità appropriata a una trasduzione del segnale.
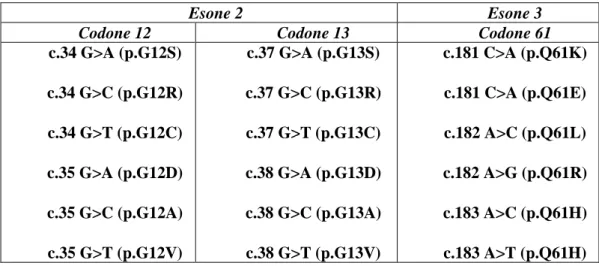
L’attivazione del proto oncogene Ras mediante mutazioni puntiformi rappresenta una delle più frequenti alterazioni genetiche nello sviluppo neoplastico. Per l'oncogene KRas è stata descritta una frequenza di mutazione del 30-40% nei carcinomi del colon-retto (20) (21). Le mutazioni fino ad ora descritte sono mutazioni somatiche puntiformi, e di queste più del 90% sono state riscontrate nei codoni 12 e 13 dell'esone 2, mentre solo l’1-4% delle mutazioni sono state descritte nei codone 61 e 146, che mappano rispettivamente sull’esone 3 e 4. In particolare, tra i quattro codoni sopra citati, quello che è più frequentemente mutato è il codone 12, per il quale sono riportate frequenze di mutazione che raggiungono l’82% (22). E’ stato inoltre osservato che nel CRC il tipo di mutazione più frequente a carico del gene KRas è rappresentato dalla sostituzione di una base nucleotidica guanina con un’adenina (transizione G>A) oppure con una timina (transversione G>T). I codoni 12 e 13 codificano per due residui di glicina adiacenti, presenti nel sito catalitico della proteina Ras. Diverse mutazioni sono state identificate anche a livello del codone 13, in particolare la mutazione G13D rappresenta la maggioranza delle mutazioni riscontrate a carico di tale codone e consiste nella transizione G>A e nella sostituzione, a livello della proteina di un residuo di glicina con un residuo di acido aspartico. Il codone 61 codifica per la glutammina, la mutazione più frequente riscontrata nei CRC è una sostituzione nucleotidica A>G (Tabella 1).
24
Esone 2 Esone 3
Codone 12 Codone 13 Codone 61
c.34 G>A (p.G12S) c.34 G>C (p.G12R) c.34 G>T (p.G12C) c.35 G>A (p.G12D) c.35 G>C (p.G12A) c.35 G>T (p.G12V) c.37 G>A (p.G13S) c.37 G>C (p.G13R) c.37 G>T (p.G13C) c.38 G>A (p.G13D) c.38 G>C (p.G13A) c.38 G>T (p.G13V) c.181 C>A (p.Q61K) c.181 C>A (p.Q61E) c.182 A>C (p.Q61L) c.182 A>G (p.Q61R) c.183 A>C (p.Q61H) c.183 A>T (p.Q61H)
Tabella 1. Principali mutazioni riscontrate a carico dei codoni 12, 13 e 61 del geni KRAS
Tali mutazioni hanno tutte lo stesso significato a livello biologico ovvero quello di determinare l’attivazione costitutiva della proteina, alterando la sua attività GTPasica (23). La mutazione attivante KRas svolge un ruolo fondamentale nella progressione tumorale di CRC, in quanto sembrerebbe essere associata all’acquisizione di un comportamento più invasivo da parte delle cellule tumorali, ed è seguita nella sequenza proposta da Fearon e Vogelstein da delezioni del cromosoma 18q con la perdita di SMAD4, localizzato a valle di TGFß (Transforming Growth Factor-ß), e da mutazioni del gene TP53 nel passaggio da adenoma avanzato a carcinoma.
25
1.4.3 Il gene DCC (Deleted in Colorectal Cancer):
aspetti biologici e ruolo nella tumorigenesi del CRC
Il gene oncosoppressore DCC (Deleted in Colorestal Cancer) è localizzato sul cromosoma 18q2. Il sequenziamento di DCC, mutato nel 70 % dei carcinomi colon-rettali (da cui prende il nome) (24), ha rivelato che questo gene codifica per una proteina trasmembrana di 1447 aminoacidi con quattro domini di tipo immunoglobulinico (Ig-like) e sei di tipo fibronectinico tipo III (FN-III) nella regione extracellulare. La regione intracitoplasmatica che consta di ben 325 residui mostra solo una scarsa omologia con altre molecole conosciute. Si tratta dunque di una molecola di membrana che presenta i caratteri propri di un recettore di adesione di circa 180 Kd molto simile alla molecola NCAM (25). In aggiunta a ciò sembra che DCC sia espresso sulla superficie di assoni periferici ed in alcune cellule intestinali. Nel modello di carcinogenesi proposto da Fearon e Vogelstein mutazioni a carico del gene DCC sono responsabili del passaggio da adenoma intermedio ad adenoma tardivo. Altri geni candidati soppressori tumorali, localizzati sempre sul cromosoma 18, sono SMAD2 e SMAD4, la cui inattivazione somatica è comune in vari casi di cancro al colon-retto. Queste proteine funzionano da trasduttori di segnali e un difetto nella loro espressione risulta nell’incapacità di rispondere a questi segnali.
26
1.4.4 Il gene TP53: aspetti biologici e ruolo nella
tumorigenesi del CRC
Un altro evento molecolare rilevante, ma tardivo, nel processo di cancerogenesi del CRC, è la perdita di funzione del gene TP53; questo è localizzato sul braccio corto del cromosoma 17 ed il suo prodotto è una fosfoproteina nucleare di 53Kd che regola il ciclo cellulare. L’attività antioncogenica della p53 è attivata da vari stress cellulari e si esplica nell’arresto della crescita cellulare, nella riparazione dei danni al DNA e nell’apoptosi. Quest’ultimo meccanismo è cruciale nell’eliminare le cellule potenzialmente tumorali; infatti, la P53 regola direttamente una serie di geni apoptotici. La perdita di entrambe le copie del gene TP53 determina la progressione dell’adenoma di classe III a carcinoma (la forma maligna) che, in seguito, può dare metastasi a distanza (26).
Mutazioni di TP53 sono state identificate nel 50%, o più, dei tumori colo rettali (27)
1.4.5 Altri geni coinvolti nella tumorigenesi dei CRC: il
gene BRAF
Oltre alle alterazioni genetiche descritte da Fearon e Vogelstein nella sequenza adenoma-carcinoma sono state descritte ulteriori mutazioni. In particolare nel carcinoma del colon-retto sono state identificate mutazioni a carico del gene BRAF che, localizzato sul cromosoma 7 in posizione 7q34, codifica per una serina/treonina chinasi che, insieme ad A-RAF e C-RAF, appartiene alla famiglia delle proteine RAF. Le chinasi RAF sono attivate dal
27
legame alle proteine G monomeriche della famiglia RAS. BRAF esercita un’importante funzione di effettore nella cascata di trasduzione del segnale MAP-chinasi. Ci sono diverse evidenze che rilevano il ruolo critico delle proteine RAF nei processi di oncogenesi. Ad esempio, in diversi studi è stato osservato che forme costutivamente attive delle proteine RAF hanno un potere trasformante della cellula comparabile a quello della proteina Ras. Infatti l’attivazione del proto-oncogene BRAF è associata a vari tumori: melanomi maligni (80%), tumori della tiroide (60%) (28), tumori dell’ovaio (14%), tumori colon-rettali (11%) (29), carcinomi polmonari (1-3%) (30). Il gene BRAF è interessato da mutazioni somatiche missenso a carico degli esoni 11 e 15, ristrette alla regione codificante il dominio ad attività chinasica. Circa il 90% delle mutazioni descritte a carico del gene BRAF è rappresentato dalla mutazione V600E, dovuta alla transversione di una timina con un’adenina (T>A) in posizione 1799 che determina la sostituzione, a livello del codone 600 della proteina, di un residuo aminoacidico di valina (V) con un acido glutammico (E). L’inserimento del glutammato, carico negativamente, conferisce una carica negativa in grado di mimare la fosforilazione dei residui di treonina 599 e serina 602 del loop di attivazione necessaria, in condizioni fisiologiche, per l’attivazione della proteina BRAF (31). Nei tumori del colon le mutazioni di BRAF hanno un’incidenza nettamente inferiore rispetto a quella rilevata per le mutazioni di KRas . Tali mutazioni, nella quasi totalità dei casi, sono limitate alla V600E e sono state descritte con una percentuale che può variare del 5-15% (32). In altri studi, è stato osservato che la frequenza di mutazione, in particolare quella relativa alla mutazione V600E, riscontrata in carcinomi caratterizzati da un instabilità a livello dei microsatelliti (MSI) è nettamente superiore rispetto alle frequenze descritte per la stessa mutazione in carcinomi con instabilità cromosomica (33). La maggior parte dei casi mutati per il gene BRAF non
28
presentano mutazioni a carico del gene KRas e, precisamente, meno dell’1% dei casi mutati per BRAF risultano essere mutati anche per KRas, suggerendo che le mutazioni di KRas e di BRAF sono eventi mutualmente esclusivi. Comunque il comportamento delle cellule tumorali mutate per il gene BRAF è risultato essere simile a quello osservato per le cellule con una mutazione a carico di KRas e, sulla base di tali osservazioni, è stato suggerito che le mutazioni di BRAF e KRas sono equivalenti nel favorire i processi cellulari implicati nella progressione del tumore (34).
1.4.6 Altri geni coinvolti nella tumorigenesi dei CRC:
i geni MYC, PTEN e PI3KCA
Uno degli oncogeni a più alta frequenza di mutazione nei tumori solidi è il fattore di trascrizione MYC, che risulta amplificato e sovraespresso nel tumore al colon, alla prostata, al polmone e nel medulloblastoma. I geni attivati da MYC sono coinvolti nel metabolismo cellulare, nella biosintesi delle proteine, nel ciclo cellulare e apoptosi. MYC è a sua volta controllato dal pathway di Wnt/β-catenina, che ne promuovono l’espressione, e per questo motivo gioca un ruolo nella formazione delle cellule staminali tumorali o cancer initiating cells (35).
Associato anche al tumore al colon, il gene tumor-suppressor PTEN, che codifica per una fosfatasi che trasforma il fosfatidil-inositolo-3-fosfato (PIP3) in fosfatidil-inositolo-2-fosfato (PIP2), determina il blocco del segnale di proliferazione cellulare innescato da questo secondo messaggero. Questo gene risulta mutato o deleto in molte forme tumorali e la sua normale attività si esplica determinando il blocco dei segnali proliferazione e l’induzione
29
all’apoptosi (36). Nel tumore al colon in particolare la sua perdita è correlata a forme ereditarie rare associate alla PTEN Hamartoma Tumor Syndrome (PHTS) (37) e alla resistenza farmacologica (38, 39).
Anche altri geni del pathway del fosfatidil-inositolo 3-fosfato sono stati trovati mutati in CRC. Ad esempio, il gene PIK3CA (Phosphoinositide-3-Kinase, Catalytic, Alpha) rappresenta uno dei geni a più alta frequenza di mutazione sia nel tumore al colon-retto che in quello al seno (10), e sue mutazioni attivanti sono associate a resistenza farmacologica.
30
1.5.
Trattamento terapeutico
La tipologia di trattamento del CRC dipende da una pluralità di fattori quali le dimensioni, la localizzazione e l’estensione del tumore, nonché le condizioni generali del paziente. Sono applicabili vari tipi di trattamento che vanno dall’intervento chirurgico alla radioterapia, immunoterapia o chemioterapia. Il trattamento chirurgico riveste da sempre un ruolo essenziale nella cura del carcinoma del colon-retto e negli anni le potenzialità della chirurgia si sono ampliate grazie all’affermazione della tecnica laparoscopica e alla possibilità di resezione delle metastasi epatiche; ulteriori miglioramenti sono stati ottenuti, combinando la tecnica chirurgica con la radioterapia e la chemioterapia. La chemioterapia nel post-operatorio, pur potendo rappresentare un over-treatment in quei pazienti già guariti con il solo intervento chirurgico, permette di ampliare ulteriormente le possibilità di guarigione nel gruppo di pazienti a maggior rischio di recidiva. Attualmente, sono disponibili diversi agenti chemioterapici dotati di effetto citotossico, quali:
le fluoropirimidine come il 5-fluorouracile (5FU) sono inibitori della timidilato sintasi e vengono somministrati insieme con una vitamina, l'acido folinico (leucovorin), che ne potenzia l'azione.
l’oxaliplatino è un analogo del platino che viene spesso associato alla terapia con fluoro pirimidine
l’irinotecano che inibisce la topoisomerasi I.
Al momento della diagnosi il 70-80% dei soggetti con CRC possono essere potenzialmente curati chirurgicamente, anche se, tra questi, circa il 50% andrà incontro alla formazione di metastasi, principalmente epatiche (40).
31
Nella maggior parte dei casi la chemioterapia rappresenta l’approccio terapeutico più adatto, e talvolta l’unico, per il trattamento dei CRC metastatici. Sebbene l’impiego combinato di agenti chemioterapici diversi, quali il 5- fuorouracile (5-FU), l’irinotecano, e l’oxaliplatina, abbia migliorato significativamente i risultati ottenuti dalla monoterapia con 5-FU, il tempo medio di sopravvivenza di tali pazienti supera raramente i 18 mesi a causa dell’insorgenza, ormai sempre più frequente, di fenomeni di resistenza; in particolare meno del 10% dei pazienti raggiunge i 5 anni di sopravvivenza (41) (42).
Grazie al miglioramento delle tecniche usate in biologia molecolare e a linee di ricerca in campo farmacologico sempre più innovative, sono state acquisite nuove conoscenze sulle vie molecolari che caratterizzano la crescita cellulare, il ciclo cellulare, l’apoptosi, l’angiogenesi e l’invasione riuscendo così ad identificare bersagli molecolari specifici contro cui rivolgere farmaci biologici con meccanismo d’azione selettivo al fine di ridurre gli effetti collaterali sistemici. Esistono bersagli a diversa localizzazione cellulare come recettori di membrana, recettore del fattore di crescita epidermico (EGFR), recettore del fattore di crescita vascolare (VEGFR), recettore del fattore di crescita insulino-simile (IGFR) ed altri fattori di crescita solubili come il fattore di crescita endoteliale vascolare (VEGF). Studi recenti hanno permesso di identificare agenti biologici in grado di bloccare le vie di segnalazione in cui sono implicati questi bersagli molecolari hanno fornito nuove opportunità nel trattamento dei pazienti con cancro colon-rettale metastatico.
32
1.5.1
Terapia anti-EFGR: i farmaci biologici
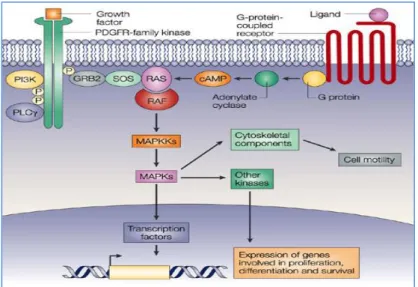
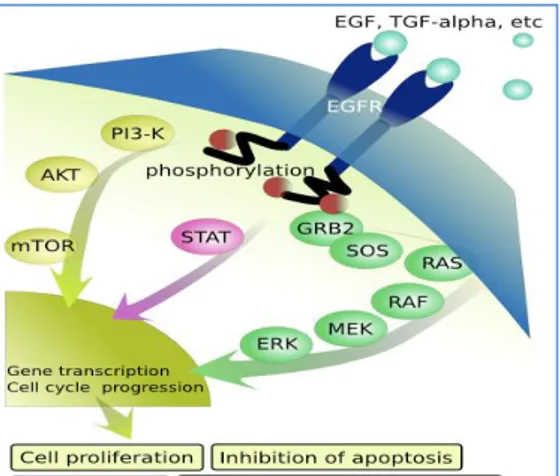
L’EGFR è un membro della famiglia di recettori ErbB, costituita da quattro recettori correlati tra loro, ErbB1, ErbB2, ErbB3 ed ErbB4, che nella loro forma attiva formano omodimeri od eterodimeri i quali vengono stabilizzati dal legame del loro ligando. L’EGFR rappresenta il ponte tra lo spazio extracellulare ed il sistema intracellulare di trasduzione del segnale che regola i processi nucleari coinvolti nella crescita cellulare, differenziamento, sopravvivenza, progressione attraverso il ciclo cellulare, angiogenesi e sensibilità ai farmaci. Sono stati identificati diversi ligandi per l’EGFR, tra cui EGF, TGFα e la neoregulina; il loro legame nella porzione extracellulare del recettore ne determina l’attivazione tramite autofosforilazione del dominio tirosin-chinasico, che a sua volta è responsabile dell’attivazione della cascata di segnali intracellulari. Sono state individuati diversi pathways controllati da questi recettori, tra cui quello di JAK-STAT, PIK3-AKT e la cascata RAS-RAF-MAPKs. Quest’ultima è innescata dall’attivazione di RAS e a successive serie di fosforilazioni in grado di attivare le MAPKs, ERK1 ed ERK2. ERK1/2 regolano la trascrizione di molecole associate alla proliferazione, sopravvivenza e trasformazione.
L’EGFR è frequentemente sovraespresso o iperattivato nei tumori di origine epiteliale, incluso il CRC, e tale sovraespressione è stata spesso associata alla
Figura 4 Vie del segnale regolate dal recettore del fattore di crescita epidermico (EGFR)
33
resistenza dei tumori ai farmaci dotati di attività citotossica, tanto da rappresentare un indicatore di prognosi sfavorevole.
Ad oggi sono disponibili due classi di farmaci che hanno come bersaglio l’EGFR:
a) gli inibitori tirosino-chinasi
b) gli anticorpi monoclonali (mAb) anti-EGFR.
Gli inibitori tirosino-chinasi sono piccole molecole che agiscono bloccando la fosforilazione dei residui di tirosina a livello del dominio intracellulare del recettore tirosin-chinasico. In particolare questi inibitori competono con l’ATP per il sito di legame al dominio catalitico del recettore. Tali molecole non agiscono direttamente con l’EGFR, infatti, esercitano la loro azione inibitoria in maniera aspecifica su tutti i recettori tirosin-chinasici (43). A questo gruppo di farmaci appartengono due molecole che bloccano in modo aspecifico l’attività tirosino-chinasica del recettore EGFR, il gefitinib e l’erlotinib (44). In alcuni trials clinici è stato studiato l’effetto combinato di gefinitib o erlotinib con la chemioterapia tradizionale ed è stato dimostrato che, per il trattamento dell’adenocarcinoma del colon retto e dei tumori polmonari, la somministrazione degli inibitori in combinazione con la chemioterapia determina un grado di risposta migliore rispetto a quella osservata in pazienti trattati con la sola chemioterapia (45) .
L’approccio terapeutico più recente è rappresentato invece da anticorpi monoclonali rivolti contro l’EGFR, in grado di inibire l’interazione tra l’EGFR ed i suoi ligandi naturali nello spazio extracellulare. Il recettore viene internalizzato e degradato portando al blocco del ciclo cellulare, all’inibizione dell’angiogenesi, invasione e metastatizzazione. Dal 2004 ad oggi sono state sviluppate diverse terapie basate su anticorpi monoclonali contro l’EGRF tra cui il Cetuximab (Erbitux) e il Panitumumab (Vectibix). Il Cetuximab è un anticorpo monoclonale IgG1 chimerico uomo/topo e ad
34
ampia azione, che agisce contro il dominio extracellulare dell’EGFR; la modalità di azione del Cetuximab, in qualità di anticorpo monoclonale si distingue dai trattamenti chemioterapici standard non selettivi: il legame comporta l’internalizzazione del recettore causando una diretta inibizione della sua attività tirosin-chinasica. Ciò a sua volta provoca il blocco della trasduzione del segnale attraverso le vie PI3K/AKT e RAS-RAF/MAPKs, inducendo meccanismi proapoptotici ed inibendo la proliferazione cellulare, l’angiogenesi e la formazione di metastasi. Ciò comporta la riduzione sia dell’invasione dei tessuti normali da parte delle cellule tumorali sia dell’espansione del tumore a nuovi siti. Si ritiene, inoltre, che il Cetuximab sia in grado di inibire l’attività riparatoria delle cellule tumorali verso il danno causato dalla chemioterapia e radioterapia, e di impedire la formazione di nuovi vasi sanguigni all’interno dei tumori; ciò si traduce in una globale soppressione della crescita tumorale. Inoltre, quando le metastasi sono limitate al fegato, la diminuzione della massa tumorale in molti casi consente la resezione chirurgica del tumore, con maggiori probabilità di cura. L’effetto collaterale più comune associato alla somministrazione del Cetuximab è uno sfogo epidermico simile all’acne che sembra comunque essere correlato ad una buona risposta alla terapia. L’utilizzo del cetuximab in monoterapia o in combinazione con gli altri chemioterapici standard, è stato approvato, per la prima volta, nel febbraio 2004, dalla US Food and Drug Administration, per il trattamento di pazienti con mCRC, EGFR+, irinotecano refrattario (46). La condizione di irinotecano-refrattarietà viene soddisfatta quando la malattia mostra segni di progressione durante o entro un mese dalla sospensione di un regime chemioterapico contenente irinotecano. I primi risultati incoraggianti, riguardanti l’impiego di cetuximab, provengono da uno studio di fase II non randomizzato, del 2004, condotto con lo scopo di valutare l’efficacia antitumorale ed il grado di
35
tossicità del cetuximab su 57 pazienti con mCRC, irinotecano-refrattario, a cui il farmaco è stato somministrato in ionoterapia. Sei dei 57 (10.5%) pazienti arruolati hanno mostrato una risposta parziale al trattamento e 20 pazienti (35%) hanno presentato, invece, una risposta minore (riduzione tumorale tra il 25 e il 49%) o una stabilizzazione di malattia (47). Successivamente sono stati confermati i risultati ottenuti da Saltz, ma è stata anche sottolineata la maggiore attività del cetuximab in schemi di associazione, grazie allo studio di fase II randomizzato BOND (Bowel Oncology with Cetuximab Antibody), condotto su 329 pazienti con mCRC, EGFR+, provenienti da 56 centri di 11 paesi europei. Questo ha confrontato l’efficacia di uno schema terapeutico con solo cetuximab contro uno con cetuximab + irinotecano. Il tasso di risposta nel regime di combinazione è risultato significativamente più alto rispetto a quello in monoterapia, così come la sopravvivenza mediana ed il tempo a progressione tumorale. Dallo studio è emerso anche una relazione di proporzionalità diretta tra l’efficacia del farmaco e l’entità delle manifestazioni tossiche cutanee; infatti sono stati i pazienti che hanno presentato un grado maggiore di tossicità cutanea a mostrare le migliori risposte al trattamento. Inoltre è emersa la mancanza di correlazione tra il grado di espressione di EGFR e la risposta clinica alla terapia (48).
Il Panitumumab è un anticorpo monoclonale della classe IgG2, ed è il primo anticorpo monoclonale totalmente umano utilizzato in ambito terapeutico; come il Cetuximab, esso agisce inibendo l’attività dell’EGFR, bloccando il legame con l’EGF e il TGF-. Fin dal 2006 è stato approvato il suo utilizzo e ha mostrato una notevole efficacia antitumorale nei pazienti sia da solo che in combinazione con le fluoropirimidine, oxaliplatino e irinotecano. Nonostante l’utilizzo dei farmaci anti-EGFR ha migliorato significativamente la prognosi, è stato dimostrato, mediante analisi
36
trasversali condotte su alcuni dei più importanti trials che hanno valutato l’efficacia degli anti-EGFR, come solo alcuni dei pazienti trattati ricevano un reale beneficio dalla somministrazione del farmaco. In particolare, da attente valutazioni cliniche è emerso che solo il 10-20% dei pazienti, resistenti alla chemioterapia convenzionale, rispondono al trattamento con questi agenti (47) (48). Pertanto è stato necessario comprendere quali siano le caratteristiche dei pazienti “responders”, al fine di evitare la somministrazione di una terapia, costosa e non priva di effetti collaterali, a quei pazienti che sicuramente non ne trarrebbero alcun vantaggio.
1.5.2
KRas e BRAF: ruolo nell’efficacia della terapia
anti-EGFR.
Al fine di giustificare la mancata risposta al trattamento con farmaci inibitori di EGFR, numerosi studi clinici hanno focalizzato la loro attenzione sulle vie di trasduzione del segnale a valle del recettore. Come già accennato, la cascata Ras-Raf-MAPK riveste un ruolo di estrema importanza nel controllo della proliferazione e sopravvivenza cellulare e mutazioni puntiformi a carico di KRAS sono state riscontrate nel 50% dei CRC.
Tra i primi, lo studio RASCAL (50) ha cercato di capire il significato prognostico delle mutazioni di KRas, arrivando a riconoscere un aumentato rischio di recidiva e di morte nei CRC KRas mutati. Attraverso l’analisi di ogni singola mutazione lo studio è giunto alla conclusione che solo quella del codone 12, che determina la sostituzione del residuo amminoacidico glicina in uno di valina, rappresenta un fattore indipendente di aumento del rischio di recidiva (p=0.007) e di morte (p=0.004), correlandosi pertanto ad un comportamento più aggressivo di malattia. Gli stessi risultati sono stati
37
confermati dallo studio RASCAL II, condotto su un campione di pazienti ancora più consistente (51).
Importanti evidenze sul ruolo predittivo di KRas sono emerse da uno studio francese (52) del 2006 che ha valutato la presenza di correlazione tra la risposta del paziente metastatico trattato con cetuximab in monoterapia e lo stato mutazionale del gene. Mutazioni di KRas si sono riscontrate in 13 pazienti su un totale di 30 arruolati nello studio. Le mutazioni sono risultate strettamente associate alla risposta al trattamento, infatti, nessuno dei pazienti mutati ha risposto al cetuximab. Tra i responders nessuno (0/11) ha presentato mutazioni di KRas, mentre le stesse sono state riscontrate nel 68.4% (13/19) dei pazienti non responders. Nell’insieme questi risultati indicano che lo status di KRas è un parametro importante per la selezione dei pazienti da trattare: i pazienti con KRas mutato non trarranno alcun beneficio da terapie anti-EGFR. Sulla base di questi dati, l’EMEA (European Medicine Agency) ha approvato l’uso del cetuximab e del panitumumab per il trattamento del carcinoma colo rettale metastatico solo nei pazienti con il gene KRas wild-type (53).
Tuttavia, da numerosi studi clinici è emerso che non tutti i pazienti KRas wild-type, rispondono come previsto alla terapia con mAb e sono perciò stati presi in considerazione altri componenti della cascata Ras-Raf-MAPKasi che potessero avere, come KRas, un ruolo di marcatore predittivo della risposta al trattamento, ciò per evitare di somministrare inutilmente farmaci inadeguati e comunque costosi, ma anche per poter sviluppare strategie terapeutiche alternative che abbiano bersagli e/o meccanismi di azione differenti (54).
Negli ultimi tempi anche le mutazioni a carico di BRAF, chinasi posta a valle di KRas, nella via di trasduzione del segnale di EGFR, sono state studiate per comprenderne l’eventuale ruolo predittivo di risposta ai farmaci anti-EGFR.
38
Tali mutazioni vengono riscontrate nei tumori del colon retto con una frequenza relativamente bassa, circa il 10% (55); le mutazioni di BRAF e quelle di KRas sono tra loro mutualmente esclusive. Di Nicolantonio e coll. (54), ipotizzando che le mutazioni di BRAF potessero avere, in tumori KRas WT, un ruolo predittivo/prognostico, hanno retrospettivamente analizzato lo stato mutazionale di KRas e BRAF in 113 pazienti con CRC metastatici trattati con cetuximab o panitumumab. Per le mutazioni di KRas è stato confermato il ruolo predittivo di scarsa risposta al trattamento con MoAb, essendo le stesse presenti in 2 (8%) dei 24 pazienti responders ed in 32 (35%) degli 89 nonresponders. La mutazione V600E di BRAF è risultata l’unica presente nella coorte di pazienti analizzata. La sua presenza è apparsa inversamente correlata all’efficacia del trattamento, in modo particolare nessuno dei pazienti mutati ha risposto alla somministrazione del farmaco biologico e viceversa nessuno dei responders ha presentato la mutazione in esame.
Tali risultati sono in accordo con quelli ottenuti nello studio condotto precedentemente da Samowitz nel quale le mutazioni di BRAF sono state associate ad un fenotipo più aggressivo della malattia (56). Alla luce dei risultati ottenuti, l’analisi mutazionale di BRAF, più precisamente dell’esone 15, potrebbe rappresentare uno strumento in più per selezionare i pazienti affetti da mCRC che possono trarre realmente beneficio dal trattamento con mAb. Tuttavia, rimane una percentuale non trascurabile di pazienti wild-type per entrambi i geni (41%) che non rispondono alla terapia con mAb (54), ciò rende necessario individuare ulteriori markers molecolari predittivi della risposta al trattamento al fine di meglio definire i pazienti per i quali la somministrazione di mAb anti-EGFR può risultare realmente efficace.
Lo status mutazionale dei geni KRas e BRAF ha, pertanto, un’enorme rilevanza clinica dovuta proprio all’impatto considerevole sulle decisioni
39
terapeutiche da affrontare in caso di tumore del colon-retto; motivo per cui la genotipizzazione di questi pazienti è, oramai, entrata a far parte della pratica clinica come routine diagnostica.
40
1.6.
Cenni sull’attività di un Laboratorio di patologia
molecolare
Il requisito fondamentale per un laboratorio di patologia molecolare, che si occupa di analisi mutazionale dei geni a valenza diagnostica-predittiva, è quello di fornire all’oncologo dati il più possibile accurati e precisi sullo status mutazionale dei pazienti, al fine di programmare un opportuno trattamento terapeutico. Pertanto, la scelta di quale metodologia utilizzare per la genotipizzazione di questi geni è di fondamentale rilevanza; i parametri di accuratezza e precisione di ciascuna metodologia sono rappresentati dalla specificità e dalla sensibilità.
Si definisce specificità di un esame diagnostico la capacità di identificare correttamente i soggetti sani, ovvero non affetti dalla malattia o dalla condizione che ci si propone di individuare. Se un test ha un'alta specificità, allora è basso il rischio di falsi positivi, cioè di soggetti che pur presentando valori anomali non sono affetti dalla patologia che si sta ricercando. La
sensibilità di un esame diagnostico è, invece, la capacità di identificare
correttamente tutti i soggetti affetti dalla malattia o dalla condizione che ci si propone di individuare. Se un test ha un'alta sensibilità, allora è basso il rischio di falsi negativi, cioè di soggetti che pur presentando valori normali sono comunque affetti dalla patologia o dalla condizione che si sta ricercando.
Il peso di questi due parametri, specificità e sensibilità, assume un significato notevole in tutto l’iter diagnostico; tale iter va dalla presa in consegna del tessuto da analizzare fino alla produzione di un referto sullo status mutazionale, che una volta trasmesso all’oncologo valuterà, per ogni paziente, una terapia individuale. Questo percorso prevedere la
41
collaborazione di diverse figure professionali: il tecnico di laboratorio, l’anatomopatologo e il biologo.
Il materiale di partenza per l’analisi mutazionale è disponibile sottoforma di preparati citologici, biopsie esplorative o di tessuto; negli ultimi due casi il tessuto, prelevato durante l’intervento chirurgico, viene ridotto e sottoposto a campionamento. Il materiale d’archivio è di solito rappresentato da blocchetti di tessuto fissato in formalina ed incluso in paraffina (Formalin Fixed Paraffin Embedded, FFPE); la fissazione del tessuto, mediante formalina, danneggia il DNA, in quanto la formaldeide rompe i legami a idrogeno e destabilizza la doppia elica facilitando reazioni covalenti tra biomolecole, inclusi legami crociati tra acidi nucleici e tra acidi nucleici e proteine (57). L’utilizzo di tessuti paraffinati fornisce DNA di qualità inferiore a quella ottenibile da tessuti freschi o congelati; gli studi di confronto diretto dei tassi d’identificazione delle mutazioni in campioni congelati e inclusi in paraffina, provenienti dallo stesso tessuto, hanno riscontrato un tasso di mutazioni nei campioni FFPE pari a circa la metà di quello rilevato nei campioni congelati (58).
Il campione di tessuto da sottoporre ad analisi molecolare risulta frequentemente eterogeneo: accanto ad aree di carcinoma possono essere presenti aree di necrosi, aree flogistiche e componenti tissutali normali. Dato che la possibilità di individuare mutazioni somatiche è condizionata fortemente dalla percentuale di cellule neoplastiche presenti nel campione, uno dei ruoli fondamentali dell’anatomopatologo è quello di scegliere il prelievo più rappresentativo del tumore dal quale devono essere allestite almeno 4-5 sezioni da 10 micron adese su vetrino. Su queste sezioni verrà eseguita, tramite l’ago di una siringa, la dissezione manuale, previa selezione da parte del patologo delle aree del campione più ricche di cellule tumorali.
42
La qualità e la quantità del DNA estratto dal campione è di notevole importanza per le successive analisi molecolari; un DNA di qualità scadente può inibire l’amplificazione e inficiare il risultato dell’analisi generando falsi positivi o negativi. Il metodo di estrazione pertanto deve essere molto affidabile e deve avere una resa, in termini di quantità totale di DNA estratto, piuttosto elevata. Una volta estratto, il DNA viene risospeso in tampone adeguato, valutato sotto il profilo qualità/quantità mediante lettura spettrofotometrica e quindi conservato.
La scelta del metodo da utilizzare per la determinazione delle mutazioni deve tener conto di 2 variabili:
a. Quantità, in termini di cellule neoplastiche, del campione da analizzare (biopsia vs pezzo operatorio)
b. Qualità e quantità del campione estratto
L’estrazione rappresenta il primo passo nel percorso diagnostico molecolare alla quale, nella maggior parte dei casi, segue l’amplificazione del DNA, e successivamente la determinazione delle mutazioni. Di seguito si riportano i principali metodi utilizzati per la rilevazioni delle mutazioni, ciascuno con il proprio livello di sensibilità (% mutati/wildtype):
Il Sequenziamento genomico diretto - Metodo Sanger (15-20 %)
- Pirosequenziamento (5 %)
Saggi allele-specifici in real time PCR - PCR con sonde allele-specifico (10 %) - ARMS/ sonde scorpion (1-5 %)
Saggi basati sulla real time PCR e curva di melting - High Resolution Melting Analysis (5 %)
43
- Ibridazione inversa con oligonucleotidi allele-specifico (5 %) Tecnologia MALDI TOF
- Sistema Sequenom MassARRAY (5 %)
Nel nostro laboratorio, tenuto conto delle caratteristiche del materiale di partenza, l’analisi mutazionale a scopo diagnostico e di ricerca, viene effettuata mediante sequenziamento genomico diretto secondo il metodo Sanger e mediante pirosequenziamento. Il primo si basa sul metodo della terminazione della catena, sviluppato da Frederick Sanger; il principio di questa tecnica presuppone l’utilizzo di nucleotidi modificati, i dideossinucleotidi (ddNTPs), marcati radioattivamente o con fluorofori, che sono in grado di interrompere la reazione di sintesi del DNA in posizioni specifiche della sequenza. Il pirosequenziamento invece, più innovativo, si basa sul sequenziamento mediante sintesi e permette di caratterizzare a livello molecolare le alterazioni delle sequenze nucleotidiche. La tecnica consente il monitoraggio della sintesi di DNA mediante il rilevamento della bioluminescenza prodotta al termine di una cascata di reazioni enzimatiche. Nonostante il sequenziamento genomico diretto secondo il metodo di Sanger mostri una buona sensibilità (15-20 %), con il pirosequenziamento è stata dimostrata una sensibilità migliore (5%). Per questo motivo, tale metodica è utilizzata nella routine diagnostica del nostro laboratorio per l’analisi mutazionale dei codoni 12, 13, 61 del gene KRas e dell’esone 15 del gene BRAF ed è stata scelta per questo progetto di tesi.
Tuttavia, accanto a fattori di ordine metodologico, che abbiamo precedentemente analizzato, vi sono dei fattori di ordine biologico che riguardano la natura del carcinoma del colon retto, le quali potrebbero rappresentare un ostacolo nella corretta determinazione dello status
44
mutazionale dei pazienti affetti da CRC e di conseguenza nell’impostazione di un trattamento terapeutico opportuno.
A tal proposito, evidenze scientifiche hanno dimostrato l’eterogeneità dello stato mutazionale dei geni KRas e BRAF a diversi livelli, in particolare: tra aree diverse dello stesso tumore del colon-retto
tra tumori sincroni del colon-retto
tra tumori primitivi e la metastasi corrispondente.
Di seguito verrà preso in esame ciascun aspetto.
Nel nostro laboratorio, e precisamente in un precedente progetto di tesi, è stato condotto uno studio con l’obiettivo di verificare se l’analisi mutazionale dei codoni 12 e 13 del gene KRas e dell’esone 15 del gene BRAF condotta su un unico prelievo fosse sufficiente a determinare lo stato mutazionale del tumore nel suo complesso. Nello specifico, l’analisi mutazionale è stata eseguita su prelievi effettuati in tre regioni differenti dello stesso tumore. Da questo studio è emerso che nell’86% dei casi tutti e tre i prelievi mostravano lo stesso stato mutazionale, mentre in due casi (13,3%) è stato osservato un pattern di mutazione differente nei tre diversi prelievi, nello specifico un caso è risultato essere wild-type, mutato per l’esone 12 (G12V) e l’esone 13 (G13D) rispettivamente, mentre nell’altro caso è stato descritto lo stato wild-type in un prelievo e la mutazione G12V negli altri due. Per l’esone 15 del gene BRAF non è stata riscontrata l’eterogeneità in nessun caso. Questo studio, in accordo con i dati presenti in letteratura (59), ha messo in evidenza l’eterogeneità dello stato mutazionale del gene KRas tra i diversi prelievi effettuati sullo stesso tumore del colon-retto suggerendo che l’analisi mutazionale condotta su un unico prelievo può rivelarsi non rappresentativa del tumore nel suo complesso.
45
Un ulteriore fattore biologico, che può risultare in una complicanza a livello diagnostico, è il cosiddetto sincronismo neoplastico del colon; termine con il quale si definisce la presenza simultanea di duplici o multiple neoformazioni tumorali maligne a carico del colon riscontrate al momento della diagnosi. In letteratura è riportata un’incidenza che varia dallo 0,6% al 14% (60) ma negli ultimi tempi si è registrato un aumento dei nuovi casi dovuto principalmente al miglioramento della diagnostica radiologica ed endoscopica e all’allungamento della vita media. Secondo i criteri anatomo-patologici il tumore sincrono esclude l’estensione loco-regionale della malattia e la sua metastatizzazione endoluminale (61). In uno studio epidemiologico, sono state valutate l’incidenza e le caratteristiche dei CRC sincroni, al fine di determinare se i pazienti affetti da tali tumori differivano dai pazienti affetti da CRC solitari, e identificare così, i possibili fattori prognostici (62). Dai dati rilevati è emerso che l’insorgenza di CRC sincroni è correlata con il sesso e l’età dei soggetti affetti. Infatti, i CRC sincroni sono più frequenti negli uomini rispetto alle donne (P<0,001) e nei soggetti con età compresa fra i 65-74 anni (P=0,026). Inoltre, nello stesso studio, le analisi isto-patologiche hanno dimostrato che la percentuale dei tumori sincroni che si sviluppano da precedenti lesioni adenomatose è maggiore rispetto a quella dei tumori singoli. Anche per ciò che concerne l’eterogeneità dello stato mutazionale dei tumori sincroni è stato condotto uno studio all’interno del nostro laboratorio al fine di valutare se nei pazienti affetti da CRC sincroni sia sufficiente eseguire l’analisi mutazionale su uno solo dei tumori o su tutti quelli presenti al momento della prima diagnosi. Sono stati analizzati 31 pazienti affetti da CRC sincroni, selezionati da una casistica consecutiva di 500 pazienti, per un totale di 70 tumori; l’analisi mutazionale eseguita per i codoni 12 e 13 dell’esone 2 del gene KRas. Nei 31 casi analizzati è stata osservata una distribuzione di mutazione omogenea in 14 casi (45%, 14/31),
46
che presentavano tutti i tumori wild-type; mentre, è stata osservata una distribuzione di mutazione eterogenea in 17 casi (55%, 17/31), di cui, 14 hanno riportato sia tumori mutati che wild-type, e 3 in cui i tumori presentavano mutazioni diverse. Per quanto riguarda l’analisi mutazionale eseguita per l’esone 15 del gene BRAF è risultato che dei 31 casi analizzati, 2 (6%) hanno mostrato una distribuzione di mutazione eterogenea per la presenza contemporanea di tumori mutati V600E e wild-type, e 29 (94%) una distribuzione mutazionale omogenea. Tale eterogeneità, dimostrata in questo studio, indica che da un punto di vista clinico, per poter definire lo stato mutazionale di questi pazienti, l’analisi mutazionale deve essere eseguita su tutti i tumori presenti al momento della prima diagnosi.
Riguardo l’eterogeneità dello stato mutazione dei geni KRas e BRAF tra il carcinoma primitivo del colon-retto e la relativa metastasi esistono attualmente in letteratura dei dati contrastanti, ed abbiamo ritenuto interessante, quindi, come oggetto di questo progetto di tesi, approfondire tale aspetto. Di seguito viene riportato una tabella riassuntiva dei dati presenti in letteratura (63):
47
Cinque studi hanno dimostrato una concordanza del 100% dello stato mutazionale di KRAS in carcinomi primari e nelle corrispondenti metastasi (Losi et al,1992) (64); (Suchy et al, 1992) (65); (Zauber et al, 2003) (66); (Weber et al, 2007) (67); (Etienne Grimaldi et al, 2008) (68).
In contrasto con questi dati, altri autori hanno riportato una discordanza dello stato di mutazione di KRas tra la neoplasia primaria e quella metastatica, osservando una discordanza complessiva nel 4-32% dei pazienti. (Oudejans et al, 1991) (69); (Al-Mulla et al, 1998 (70) ; Albanese et al, 2004 (71); Oliveira et al, 2007 (72); Artale et al, 2008 (73); Santini et al, 2008 (74); Cejas et al, 2009 (75); Garm Spindler et al, 2009 ; Loupakis et al, 2009 (76); Molinari et al, 2009 (77); Perrone et al, 2009 (78); Baldus et al, 2010 (79); Italiano et al, 2010 (80).
Seppur in minor numero rispetto a KRas, anche per BRAF esistono dati in contrasto per quanto riguarda l’omogeneità dello stato mutazionale tra la neoplasia primitiva e la sua metastasi (79).
È necessario quindi, ai fini di una corretta determinazione dello stato mutazionale dei pazienti che devono essere sottoposti ad un trattamento terapeutico, indagare e chiarire ulteriormente l’etereogeneità dei suddetti geni.