Sezione 3 – Capitolo IV
Caratterizzazione morfologica e molecolare di
Sonderia cfr. vorax Kahl, 1928
e dei simbionti ad essa associati
Parte Prima
Introduzione
IV.1.1: Caratteristiche generali dei ciliati plagiopilidi
I primi ciliati descritti come appartenenti al genere Sonderia KAHL 1928 furono trovati, al pari di molti altri plagiopilidi, in ambienti acquitrinosi salmastri (“salt marshes pools”, Kirby, 1934); alcune specie vi sono segnalate come molto comuni (Kirby, 1934). Tali ambienti stagnanti sono spesso caratterizzati dalla variabilità dei parametri chimico-fisici e biologici (cfr. Sezione 1: Introduzione). Caratteristica comune alla maggior parte di essi è la periodica insorgenza di crisi eutrofiche, dovute al continuo percolamento di sostanze nutrienti dal terreno circostante ed all’assenza di termoclini stagionali (cfr. Sezione 1: Introduzione). Durante tali crisi, il tenore di ossigeno disciolto nella colonna d’acqua può scendere sino a livelli di forte anossia, consumato dai processi metabolici dei batteri decompositori; contemporaneamente, il mezzo viene acidificato da organismi utilizzanti lo zolfo come accettare terminale di elettroni. Tutto ciò è particolarmente vero per quanto concerne l’ambiente interstiziale, all’interno del quale il tenore di ossigeno rappresenta in generele un fattore abiotico limitante (Santangelo and Lucchesi, 1995). Gli organismi saprobi (viventi cioè in ambiente acquatico ricco di materiale organico in decomposizione) hanno sviluppato pertanto specifici adattamenti per resistere a queste condizioni-limite. I protozoi ciliati appartenenti alla classe Plagiopylea SMALL AND LYNN 1985, assieme ad alcune specie di eterotrichi ed ai ciliati dell’ordine Odontostomatida, sono considerati come tipici componenti della “sulfide fauna” anaerobia di tali ambienti (Fenchel et al., 1977). Questi organismi sono accomunati dal fatto di non possedere attività citocromo-ossidasica e di mancare di strutture riconducibili ai mitocondri dei ciliati anaerobi (Fenchel et al., 1977; in part. per il gen. Sonderia, cfr. Embley and Finlay, 1994); sono invece presenti strutture
citoplasmatiche sferiche o irregolari, a matrice granulare omogenea, privi di cristae, descritte da Fenchel et al. (1977) come “microbodies”.
La classe Plagiopylea, contenente l’unico ordine Plagiopylida SMALL AND LYNN 1985, comprende attualmente otto generi (fra cui Parasonderia FAURÉ-FRÉMIET 1973 nomen nudum), divisi in tre famiglie (Plagiopylidae SCHEWIAKOFF 1896; Sonderiidae KAHL 1928; Trimyemidae KAHL 1926) (Lynn, 2006). Strutture paragonabili a microbodies sono state riscontrate in tutte le specie di plagiopilidi sinora analizzate, fra cui Sonderia vorax (Fenchel et al., 1977). In Plagiopyla nasuta furono inizialmente descritti “mitocondri senza creste, a matrice densa” (De Puytorac et al., 1985); tali organelli sono stati in seguito riconosciuti come microbodies-simili, e ne è stata verificata la stretta associazione con batteri simbionti metanogeni (Goosen et al., 1988). In P. frontata non furono immediatamente individuati organelli microbodies-simili (Fenchel et al., 1977): furono tuttavia descritti peculiari “impacchettamenti” composti di bastoncelli e corpuscoli elettrondensi. Queste strutture sono state in seguito identificate come associazioni fra batteri metanogeni e microbodies, analogamente a quanto riscontrato in P. nasuta (Goosen et al., 1988). La stessa associazione è stata verificata anche per P. minuta (Berger and Lynn 1992) e Trimyema sp. (Finlay et al., 1993). Il fatto che tali organelli prendessero sovente rapporto con organismi carbonio-riduttori, e che possedessero attività idrogenasica ha consentito di identificarli come idrogenosomi (Goosen et al., 1988): l’idrogeno da essi rilasciato come sottoprodotto dei processi fermentativi sarebbe utilizzato dai batteri carbonio-riduttori per produrre metano; alcuni metaboliti batterici (o i batteri stessi) sarebbero quindi sfruttati dall’ospite, in un perfetto quadro di simbiosi mutualistica (Fenchel and Finlay, 1991; Berger and Lynn, 1992) 1. Ciò indica la presenza di pattern metabolici di tipo fermentativo nei plagiopilidi dotati di idrogenosomi, come accade in altri protozoi saprobionti: tale caratteristica non preclude la possibile, contemporanea presenza di adattamenti per la vita in ambienti non anossici (es. altri ciliati, appartenenti ai genn. Paraspathidium e Prorodon, dotati di microbodies e privi di attività citocromo-ossidasica sono in grado di sopravvivere indefinitamente in ambiente aerobio: Fenchel et al., 1977). Tale adattamento sarebbe compatibile con le condizioni ambientali in cui tali ciliati vengono sovente ritrovati. Non è chiaro se i plagiopilidi siano da considerarsi strettamente anaerobi o soltanto microaerofili. Studi condotti su Plagiopyla nasuta hanno stabilito che tale specie è estremamente tollerante alla presenza di solfuri nel mezzo, e che la concentrazione degli stessi non rappresenta un fattore limitante per la crescita (Goosen et al., 1988); il medesimo studio ha però fissato nel 7,3% il valore massimo di ossigeno disciolto che il protista può tollerare, al di la del quale esso muore. Tali risultati
1 Il metabolismo dei ciliati anaerobi è generalmente basato sulla conversione dei carboidrati a lattato, acetato e/o butirrato, impiegando protoni come accettori terminali di equivalenti riducenti; la reazione è catalizzata dall’enzima idrogenasi (Görtz, 2003). I batteri metanogeni, utilizzando l’idrogeno molecolare così generato per la formazione di metano, eliminano l’eccesso di gas derivante da tale metabolismo, che altrimenti inibirebbe l’attività dell’enzima idrogenasi.
conducono ad ipotizzare che questa specie sia da considerarsi anaerobia obbligata. Allo stesso modo, sono considerate anaerobie le specie P. frontata (Fenchel and Finlay, 1991), P. minuta, Lechriopyla mystax (Berger and Lynn, 1992; queste due ultime specie sono state descritte come endosimbionti del tratto intestinale rispettivamente degli echinodermi regolari Strongylocentrotus dröbachiensis e S. franciscanus : Dale Beers, 1935, Kahl, 1930-35; Berger and Lynn, 1992) e Trimyema sp. (Finlay et al., 1993). Nelle ultime tre specie è riportata la presenza di endosimbionti metanogeni (Berger and Lynn, 1992; Finlay et al., 1993).
- Batteri simbionti in Sonderia
Il genere Sonderia si differenzia dagli altri plagiopilidi per il fatto di ospitare, sulla superficie esterna, batteri episimbionti. Questo tipo di simbiosi appare piuttosto comune fra i ciliati saprobi, o comunque viventi in habitat microaerofili-anaerobi, quali alcune specie appartenenti ai genn. Parablepharisma e Metopus e la specie Caenomorpha capucina (Fenchel et al., 1977). Sulla base del fatto che rapporti di tipo episimbiotico fra ciliati e procarioti erano stati descritti soltanto in ciliati viventi in habitat microaerofili, era stata inizialmente formulata l’ipotesi che tale simbiosi riguardasse esclusivamente organismi specificamente adattati a questo tipo di ambiente (Fenchel e Riedl, 1970; in Fenchel et al., 1977). La successiva individuazione di episimbionti obbligati, con funzione probabilmente difensiva, in ciliati aerobi del genere Euplotidium (Rosati et al., 1999) indica che tale tipo di simbiosi può presentarsi in ambienti diversi da quelli microaerofili e/o sapropelici, sebbene in essi sia indubbiamente più diffusa. La presenza di ectosimbionti non esclude la presenza di altri simbionti intracellulari, prevalentemente archeobatteri metanogeni (Embley and Finlay, 1994).
La natura dell’associazione fra batteri ectosimbionti e protozoi ciliati microaerofili-anaerobi non è ad oggi stata chiarita, anche se è stato ipotizzato che possano sussistere interazioni di tipo metabolico fra ospiti e simbionti (Fenchel et al., 1977). La notevole diffusione di tali associazioni negli organismi che compongono la cosiddetta sulphide fauna, sia in termini di specie coinvolte che di percentuali di individui infetti (nella maggior parte dei casi il 100%), nonché, per alcune associazioni, la presenza nell’ospite di specifici preadattamenti atti ad accogliere e trattenere i batteri ecto- o episimbionti (es. presenza di rivestimento mucoso, come accade in Metopus spp. e Caenomorpha capucina, o di alloggiamenti corticali, come descritto per Parablepharisma pellitum: Fenchel et al., 1977) contribuisce a rafforzare l’ipotesi che per il ciliato la presenza di simili organismi simbionti possa rappresentare un vantaggio dal punto di vista adattativo.
Se esiste un numero di dati sufficiente a far ipotizzare che tali associazioni simbiotiche abbiano un significato funzionale, probabilmente connesso ai particolari parametri
chimicofisici degli ambienti in cui la specie è presente, e che l’ospite possa trarre un qualche vantaggio dalla presenza di batteri, le conoscenze sulla specificità d’ospite, nonché sul numero di specie batteriche coinvolte in tali associazioni e sulle loro eventuali relazioni filogenetiche sono per contro estremamente limitate. Secondo alcuni autori (Fenchel et al., 1977) è ipotizzabile, sulla base di dati relativi alla morfologia ed alla distribuzione degli organismi episimbionti sinora descritti, che tali simbiosi siano specie-specifiche, verosimilmente coevolute, e che coinvolgano specie batteriche diverse fra loro e non correlate in termini filogenetici. Non sussistono tuttavia prove di tipo molecolare a sostegno di quanto affermato. Una seconda ipotesi prevede invece che, nell’ambiente microaerofilo che costituisce l’habitat della sulphide fauna, possano essere presenti diverse specie di batteri a vita libera provviste di un preadattamento alla vita ectosimbiotica ed in grado di associarsi ad una (o probabilmente più) specie di protozoi ciliati, anch’esse eventualmente preadattate a tale simbiosi. Una volta stabilita l’associazione, il batterio sarebbe in grado di interagire con l’ospite, instaurando probabilmente un rapporto di tipo mutualistico. Questo fenomeno è stato descritto, proprio in ambiente sapropelico, per l’archeobatterio metanogeno Methanobacterium formicicum, organismo a vita libera ma in grado di infettare ed istaurare rapporti endosimbotici di tipo mutualistico con alcune specie di ciliati anaerobi appartenenti ai genn. Metopus, Plagiopyla e Trimyema (Goosen et al., 1988; Van Bruggen et al., 1984, Wagener et al., 1990; in Görtz, 2003). Sebbene sia estremamente improbabile che i batteri ectosimbionti di Sonderia spp. e degli altri membri della sulphide fauna possano essere metanogeni (Fenchel et al., 1977; per analisi relative a Sonderia cfr. vorax vd. oltre), la possibilità che tali associazioni possano risultare simili a quanto descritto per quelle implicanti M. formicicum deve essere tenuta in considerazione.
Sezione 3 – Capitolo IV
Parte Seconda
Risultati dell’analisi
IV.2.1: Mantenimento di popolazioni di Sonderia cfr. vorax
- Isolamento e tentativi di coltivazione
La presenza di ciliati appartenenti al genere Sonderia è stata segnalata inizialmente in tre dei campioni raccolti in data 16-10-2005. La densità di tali organismi all’interno dei campioni era piuttosto bassa, e sembrava decrescere col passare del tempo.
In un secondo momento, alcune cellule sono state prelevate dai campioni del 16-10-2005 per effettuarvi dei tentativi di coltura. Le cellule sono state isolate in acqua di mare artificiale a salinità corrispondente a quella del campione. Tale mezzo si è tuttavia rivelato inadeguato per la conservazione delle cellule: gli esemplari isolati iniziavano a comportarsi in modo anomalo, rallentando i movimenti, a partire dal momento dell’immissione, e cessavano completamente di muoversi dopo circa quattro ore dall’introduzione; contemporaneamente, grandi vacuoli (forse vacuoli contrattili) iniziavano a rigonfiarsi. La lisi cellulare sopraggiungeva fra le quattro e le sei ore dopo l’isolamento. È stata pertanto sperimentata, come possibile mezzo di coltura, la stessa acqua del campione, passata attraverso un filtro sterile da 0,2 μm onde eliminarne il detrito particellato ed abbatterne la carica batterica. In questo modo è stato possibile mantenere i ciliati in buone condizioni (senza cioè alterazioni visibili del comportamento e/o rigonfiamento incipiente dei vacuoli) per circa sei ore: oltrepassato tale limite, i sintomi precedentemente iniziavano a ricomparire.
A causa della assoluta incapacità di mantenere in vita esemplari di Sonderia sp. per il tempo necessario ad effettuare le prove di alimentazione previste dal protocollo adottato, tali test non hanno potuto avere luogo. L’osservazione in vivo e le ibridazioni in situ eseguite successivamente hanno rivelato la presenza, nei fagosomi di tali organismi, di differenti tipi di alimenti, quali alghe verdi, diatomee e batteri; sono stati altresì identificati oggetti inerti, talvolta voluminosi, quali frammenti di legno e granuli inorganici, apparentemente minerali. Non è stato possibile determinare le condizioni ed il nutrimento adeguato per l’allevamento di tale specie in condizioni di laboratorio.
- Conservazione di campioni vitali
La specie identificata come Sonderia cfr. vorax non si è rivelata coltivabile nelle condizioni sperimentali adottate; è stato comunque possibile mantenere ed arricchire le popolazioni inizialmente presenti nei campioni per circa sei mesi.
I campioni in cui tale specie è risultata presente, contenenti alcuni centimetri di sedimento e circa 50 ml di acqua surnatante, sono stati raccolti il 16-10-2005 dall’ambiente di stagno costiero oggetto di studio. Sono stati mantenuti a temperatura ambiente, senza particolari accorgimenti e con il coperchio leggermente sollevato onde permettere la diffusione dell’ossigeno all’interno, per alcune settimane. Il popolamento di ciliati presente in tali campioni, osservato subito dopo il prelievo, si componeva in prevalenza di esemplari di Frontonia salmastra, Frontonia sp., Paramecium calkinsi e, in misura minore, Euplotes parawoodruffi e Spirostomum teres. Erano inoltre presenti altre specie di più difficile identificazione, appartenenti ai generi Caenomorpha, Metopus e Prorodon. Sonderia cfr. vorax era una delle specie meno rappresentate in termini quantitativi, tanto da essere avvistata solo raramente.
Due di tali campioni sono stati quindi sigillati e conservati a temperatura ambiente, al riparo dai raggi del sole ma illuminati per circa 12h al giorno. Non sono stati aperti o disturbati in alcun modo per circa due mesi. Trascorso tale termine, i campioni sono stati aperti ed osservati al microscopio ottico. La maggior parte delle specie inizialmente presenti era scomparsa completamente. Il popolamento era costituito da Sonderia cfr. vorax, Paramecium calkinsi (in proporzione nettamente più bassa di quanto osservato al momento del prelievo) e da alcuni individui di Caenomorpha sp. e Spirostomum teres. La specie Sonderia cfr. vorax costituiva il ciliato più rappresentato; la densità assoluta all’interno del campione appariva tuttavia piuttosto bassa per tutte le specie osservate, e sicuramente minore, eccezion fatta per Sonderia cfr. vorax e Caenomorpha sp., rispetto a quanto osservato inizialmente.
Nel periodo successivo, i campioni sono stati mantenuti nelle medesime condizioni (sigillati, T° ambiente). Ogni due settimane sono stati aperti per consentire il prelievo dei ciliati. Non sono stati aggiunti nutrienti di alcun tipo. La popolazione ha iniziato a declinare dopo circa quattro mesi dall’inizio del prelievo sistematico di individui.
Il terzo dei campioni in cui la specie era stata segnalata è stato invece mantenuto nelle medesime condizioni dei precedenti, ma non sigillato. Anche tale campione si è conservato vitale per alcuni mesi, sebbene la densità media di Sonderia cfr. vorax risultasse apparentemente più bassa rispetto agli altri due.
In data 12-06-2006, con le popolazioni dei due campioni sigillati praticamente estinte, sono state eseguite misurazioni ossimetriche nei campioni stessi. È stata stimata la percentuale di ossigeno disciolto nell’acqua interstiziale, a vari livelli del sedimento (circa a metà e sul
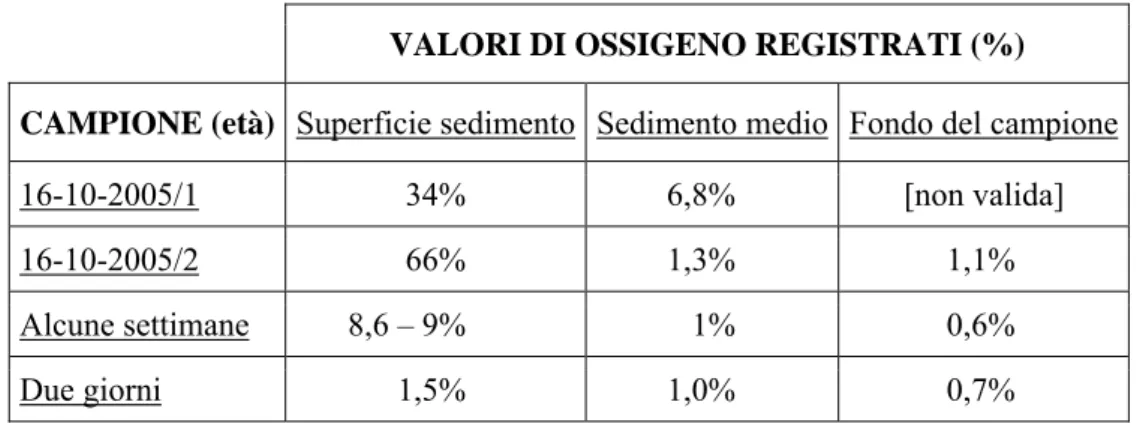
fondo del tubo contenente il campione), e nell’acqua immediatamente a contatto con la superficie del sedimento stesso. Le stesse misure sono state ripetute in parallelo su due campioni, provenienti dal medesimo ambiente e contenenti Sonderia cfr. vorax, mantenuti in laboratorio, non sigillati, rispettivamente da alcune settimane e da due giorni. La Tabella IV.1 riporta l’esito di tali misurazioni.
VALORI DI OSSIGENO REGISTRATI (%)
CAMPIONE (età) Superficie sedimento Sedimento medio Fondo del campione
16-10-2005/1 34% 6,8% [non valida]
16-10-2005/2 66% 1,3% 1,1%
Alcune settimane 8,6 – 9% 1% 0,6%
Due giorni 1,5% 1,0% 0,7%
Tabella IV.1: Misurazioni dell’ossigeno disciolto effettuate in quattro campioni contenenti Sonderia
cfr. vorax. La prima colonna a sinistra indica da quanto tempo il campione è conservato in laboratorio. I primi due campioni (16-10-2005/1 e 16-10-2005/2) sono stati mantenuti sigillati. Le altre colonne riportano le misure registrate a vari livelli del sedimento presente nel campione. I valori presenti nella colonna “Sedimento medio” sono quelli dello strato in cui si concentra la maggior parte degli individui di Sonderia sp. Nel caso del campione 16-10-2005/1, non è stato possibile effettuare una misurazione attendibile dell’ossigeno disciolto sul fondo dello strato di sedimenti in quanto le precedenti misurazioni avevano provocato una eccessiva turbolenza nel substrato, ossigenando l’acqua interstiziale.
Le misurazioni effettuate hanno indicato valori di ossigeno disciolto piuttosto bassi in tutti i campioni misurati. Contrariamente a quanto atteso, tali valori sono risultati più elevati in quelli mantenuti sigillati rispetto a quelli prelevati in tempi più recenti ed esposti normalmente all’ossigeno atmosferico. Simili misurazioni sono state ripetute, in data 22-06-2006, direttamente nell’ambiente di raccolta dei campioni: esse hanno dimostrato l’effettiva condizione di scarsa ossigenazione del sedimento dell’ambiente stesso, che presenta valori simili a quelli registrati nei campioni raccolti di recente (cfr. Sezione 1: Introduzione). È quindi possibile che i campioni “sigillati” si siano via via ossigenati durante le numerose manipolazioni necessarie per prelevarne bisettimanalmente i ciliati. Apparentemente, il livello di ossigeno disciolto nei campioni è inizialmente molto basso, e permane basso all’interno di essi a prescindere dal modo in cui essi vengono conservati, sebbene possa venire influenzato dalla manipolazione del campione all’aria aperta. Il livello di ossigeno nello strato di sedimento “intermedio”, in cui appare concentrato il maggior numero di esemplari di Sonderia cfr. vorax, risulta comunque basso sia nei campioni mantenuti sigillati che in quelli lasciati aperti (in cui probabilmente non diffonde in maniera adeguata nell’acqua interstiziale). Si suppone che l’efficacia del metodo di conservazione dei campioni sin qui esposto consista nel riuscire a mantenere basso il tenore di ossigeno nel sedimento intermedio, indipendentemente dal modo in cui ciò venga ottenuto (per ulteriori considerazioni cfr. Parte Terza: Discussione dei risultati ottenuti, presente capitolo).
IV.2.2: Caratterizzazione morfologica
Come precedentemente affermato, non è stato possibile ottenere colture pure di Sonderia cfr. vorax. La procedura per l’identificazione morfologica della specie è stata pertanto condotta su esemplari prelevati dai due campioni “sigillati” raccolti in data 16-10-2005 (vd. sopra) e da altri, campionati in un secondo momento nel medesimo ambiente e conservati a contatto con l’aria. Non è stato possibile caratterizzare esclusivamente gli individui della popolazione presente nei campioni del 16-10-2005 (definita come NS 21/2) in quanto il numero di cellule richiesto per simili procedure è piuttosto elevato e la popolazione stessa avrebbe corso il rischio di estinguersi. Ad ogni modo, per avere la certezza che i due gruppi di campioni contenessero la medesima specie, entrambe le popolazioni sono state caratterizzate molecolarmente (vd. oltre). Le sequenze del 18S rDNA sono risultate identiche. I dati morfologici ottenuti da entrambe le popolazioni sono quindi stati utilizzati senza discriminazioni. La distinzione è invece stata mantenuta per quanto riguarda l’analisi ultrastrutturale e le ibridazioni in situ, al fine di indagare se le differenti condizioni di mantenimento delle due popolazioni inducessero differenze rilevabili ultrastrutturalmente nel protista e/o delle associazioni simbiotiche.
L’osservazione in vivo ha mostrato cellule di dimensione piuttosto variabili da individuo a individuo (min. 60 μm, max. 120-140 μm), di forma ovoidale od ellissoidale, appiattite dorsoventralmente in modo più o meno marcato. Grandi vacuoli alimentari, contenenti oggetti anche di grandi dimensioni, sono stati osservati in un discreto numero di esemplari. Non sono stati identificate con certezza strutture riconducibili a vacuoli contrattili. L’apertura della cavità vestibulare occupa l’intero bordo anteriore del corpo cellulare, e si apre nel senso di marcia dell’organismo, in posizione quasi frontale (leggermente spostata sul lato ventrale). Tale cavità, conformata grosso modo ad imbuto, va restringendosi rapidamente procedendo verso l’interno, e si estende per meno della metà della lunghezza della cellula (circa un terzo); l’apertura citostomale si apre al termine di tale cavità, lateralmente posta rispetto all’asse anteroposteriore. Come in tutte le specie di Sonderia sinora descritte (Kirby, 1934; Carey, 1992), numerosi batteri ectosimbionti ricoprono la superficie del ciliato. Tali batteri sono collocati negli avvallamenti fra le “creste” che alloggiano le cinezie dorsali: la superficie disponibile appare densamente popolata, tanto da impedire una stima della quantità di batteri presenti su un singolo ciliato.
È presente un unico macronucleo ed un solo micronucleo, molto piccolo e posto a stretto contatto col macronucleo (tale carattere è stato osservato solo in alcuni esemplari).
L’impregnazione argentica ha evidenziato le cinezie dorsali e ventrali dell’organismo (circa 60 in tutto). Quelle dorsali e parte di quelle ventrali decorrono parallelamente ai lati della
cellula, come avviene solitamente in Sonderia spp. (Carey, 1992), e appaiono poste sui margini di “creste” cuticolari ben definite. Quelle ventrali sinistre, invece, sono più lunghe, e presentano una curvatura accentuata nella regione terminale; tale curvatura origina a circa due terzi del corpo cellulare, e si sviluppa verso destra, così che le cinezie ventrali poste più a sinistra finiscono col decorrere quasi parallelamente al margine inferiore della cellula stessa, interrompendo quelle ortogonalmente poste. Non è possibile indicare con precisione il numero di cinezie soggette a curvatura in quanto tale carattere appare variabile da individuo ad individuo e la mancanza di una netta differenziazione dorsoventrale impedisce di distinguere esattamente fra cinezie ventrali e dorsolaterali: approssimativamente, in ciascun individuo si osservano 10-12 cinezie così disposte. Le cinezie dorsolaterali presenti sul lato sinistro decorrono parallelamente al margine, e non sembrano intervallate da brevi “nastri” di cilia ad esse perpendicolari, come avviene ad esempio in S. labiata o in S. mira (Carey, 1992). Tale carattere è però di difficile individuazione, e gli esemplari correttamente impregnati in quella regione sono stati troppo pochi per supportare statisticamente questa osservazione. Un ciuffo di corte cilia è presente sull’apice posteriore delle cellule (la stessa caratteristica risulta osservabile anche in vivo). Tale carattere è presente in gran parte dei plagiopilidi, comprese molte specie di Sonderia (Kirby, 1934): in questo caso, tuttavia, la struttura osservata appare dissimile dal lungo ciuffo composto di “bristle-like cilia” descritta in alcune specie di Sonderia (Kirby, 1934; Carey, 1992).
La descrizione sin qui riportata non corrisponde esattamente a nessuna delle otto specie di Sonderia descritte originariamente da Kahl (1928; 1930) o da altri autori (Kirby, 1934; Fauré-Frémiet and Tuffrau, 1955; in Carey, 1992). La specie presentante maggiori somiglianze con essa è risultata Sonderia vorax KAHL 1928. I pochi dati disponibili sulla morfologia di tale specie non consentono però di verificare tutti i caratteri osservati, necessari per un identificazione non ambigua (per maggiori dettagli cfr. Parte Terza: Discussione dei risultati ottenuti, presente capitolo). Il ciliato in esame è stato ricondotto alla descrizione di Sonderia vorax (indicandone provvisoriamente il nome come Sonderia cfr. vorax).
IV.2.3: Caratterizzazione molecolare
L’estrazione di DNA è stata condotta a partire da 21 cellule di Sonderia cfr. vorax, prelevate direttamente dai campioni raccolti in data 16-10-2005 (popolazione NS 21/2). Gli individui sono stati selezionati su base morfologica, mediante osservazione al microscopio binoculare prima della fissazione (la presenza di una eventuale sibling species all’interno del campione, non distinguibile morfologicamente, avrebbe inficiato tale metodo: tuttavia, la sola altra specie di Sonderia presente nel campione, S. pharyngea, è facilmente distinguibile anche a
basso ingrandimento, e la popolazione di esemplari raccolti per il sequenziamento è risultata monospecifica).
Gli inneschi impiegati per l’amplificazione sono stati F9 (5’
-CTG GTT GAT CCT GCC AG-
3’) ed R1513hypo (5’-TGA TCC TTC YGC AGG TTC-3’). Tali primer sono stati scelti per la loro universalità (R1513hypo presenta una degenerazione in posizione centrale), non essendo disponibili nel data base di riferimento nessuna sequenza di Sonderia sp. in base alla quale ottimizzare la scelta degli inneschi. L’annealing è avvenuto a 50° C; l’estensione è stata prolungata per 2’ a 72° C.La sequenza del 18S rDNA è stata completata sequenziando il prodotto di reazione con i primer R1052, F919 ed R536, in modo da coprire l’intero gene. Essa è stata quindi confrontata con quelle già presenti nel data base utilizzato. Risulta inserita all’interno del gruppo comprendente alcune specie facenti parte dell’ordine Plagiopylida SMALL AND LYNN 1985 (cl. Plagiopylea SMALL AND LYNN 1985). In dettaglio, essa si colloca nel cluster comprendente le sequenze di Plagiopyla sp. e Lechriopyla sp. (fam. Plagiopylidae
SCHEWIAKOFF 1896): Trimyema sp. (fam. Trimyemidae KAHL 1926) costituisce il sister
group di tale raggruppamento. Nel data base non è del resto presente alcuna sequenza appartenente alla famiglia Sonderiidae SMALL AND LYNN 1985, cui il genere Sonderia appartiene, assieme ai genn. Sonderiella KAHL 1928 e Parasonderia KAHL 1928.
In un secondo momento, è stato necessario caratterizzare molecolarmente una seconda popolazione di Sonderia cfr. vorax, presente in campioni raccolti nel medesimo ambiente ma mantenuti in condizioni differenti (vd. sopra), allo scopo di stabilire l’identità molecolare fra le due popolazioni e procedere alla caratterizzazione morfologica utilizzando indifferentemente individui dell’uno o dell’altro gruppo. L’amplificazione del 18S rDNA è avvenuta con le stesse modalità della precedente reazione. È stata caratterizzata una parte del gene, sequenziando il prodotto di reazione con il primer R1052. Le sequenze sono risultate identiche nella regione confrontata. La caratterizzazione dell’intero gene non è stata pertanto completata.
IV.2.4: Indagine ultrastrutturale
Sono stati realizzati alcuni preparati per il microscopio elettronico a trasmissione impiegando, in parallelo, cellule della popolazione NS 21/2 ed esemplari provenienti da campioni raccolti in un secondo momento e conservati a contatto con l’aria. Obiettivo dell’indagine era verificare se le differenti condizioni di mantenimento influissero in qualche modo sulla struttura interna dei ciliati e/o sull’habitus dei batteri ectosimbionti (i risultati di quest’ultima indagine sono riportati alla fine del presente capitolo).
Le cellule di entrambe le popolazioni sono risultate possedere diversi caratteri in comune. Entrambe hanno estrusomi molto allungati, elettrondensi, spesso collocati immediatamente al di sotto della regione corticale: tali strutture sono state interpretate come tricocisti. Numerosi granuli di paraglicogeno, dalla forma curiosamente irregolare, sono presenti nel corpo cellulare. Infine, sono stati individuati numerosi gruppi di piccoli organelli posti sotto la cortex, composti di una matrice elettrondensa, apparentemente omogenea, e privi di cristae di membrana all’interno. Tali oggetti appaiono riconducibili, pur con alcune differenze, agli idrogenosomi segnalati in altri plagiopilidi (es. Berger and Lynn, 1992; Finlay et al., 1993 ).
La popolazione allevata in condizioni di anossia (NS 21/2) si differenzia tuttavia dall’altra per la presenza, in tutti gli esemplari osservati, di voluminosi estrusomi subcorticali contenenti una sostanza elettrondensa; in molti casi, tale sostanza appare essere stata estrusa nello spazio compreso fra la membrana plasmatica e lo strato mucoso contenente i batteri episimbionti. È probabile che tali organelli siano riconducibili a mucocisti. Altro carattere differente fra le due popolazioni è la presenza, in NS 21/2, di corpi rotondeggianti, chiari, identificati come possibili perossisomi, e di oggetti dalla forma irregolare, collocati più in profondità nel citoplasma e circondati da membrana, la cui densità agli elettroni possiede un gradiente centripeto. Tali oggetti sono stati inizialmente interpretati come archeobatteri metanogeni simbionti del ciliato, in analogia con quanto descritto in letteratura per il gen. Trimyema (ord. Plagiopylida: Finlay et al., 1993). Successivi esperimenti di ibridazione in situ con sonde specifiche per tale gruppo hanno però dato risultato negativo (vd. oltre). La popolazione allevata in contenitori a contatto con l’aria non presentava nessuno dei caratteri sin qui esposti. È stato supposto che le tali differenze, nonché il diverso aspetto dei batteri simbionti osservato nei preparati (vd. oltre), dipendessero dal diverso tenore di ossigeno disciolto nell’acqua interstiziale. Successive misurazioni ossimetriche hanno però rivelato che tale diversità non sussiste, in quanto entrambi i campioni presentano una situazione di forte anossia a livello dello strato intermedio del sedimento da cui le cellule vengono prelevate (vd. sopra). Possibili interpretazioni di quanto osservato sono riportate nella Parte Terza: Discussione dei risultati ottenuti, presente capitolo.
IV.2.5: Individuazione e tentativi di caratterizzazione del simbionte
principale
La presenza di batteri ectosimbionti associati a Sonderia spp. è ampiamente riportata in letteratura (es. Fenchel et al., 1977; Carey, 1992). In Sonderia cfr. vorax, tali organismi sono stati osservati durante l’osservazione preliminare in vivo (1000x): essi si collocano nei solchi formati dalle creste, dorsali o ventrali, sulla cui cima sono poste le cinezie; non è possibile stimarne il numero, ma ricoprono quasi completamente la superficie disponibile. Il loro
aspetto non presenta alcuna caratteristica saliente: la forma è leggermente allungata, bastoncellare, e le dimensioni sono comprese fra 2 e 3 μm.
Per una osservazione più fine, sono stati realizzati preparati per il microscopio elettronico a scansione (S.E.M.) utilizzando cellule della popolazione NS 21/2. Le cellule così trattate perdono tuttavia gran parte dei batteri simbionti. Quelli rimasti, posizionati solitamente nelle regioni più profonde dei solchi cuticolari dell’ospite, sono spesso coperti dalla ciliatura somatica e non facilmente osservabili. Tuttavia, è stato ugualmente possibile confermare l’abbondanza di tali organismi sulla superficie dell’ospite nonché la loro peculiare disposizione.
- Ibridazioni preliminari con sonde ad ampio spettro
Sono stati effettuati esperimenti di ibridazioni in situ su individui della popolazione NS 21/2 e su altre cellule prelevate da campioni raccolti successivamente. Sono state impiegate sonde universali (Eub338) e gruppo-specifiche, onde individuare il gruppo tassonomico di appartenenza del simbionte. Paradossalmente, le piccole dimensioni e l’abbondanza del simbionte stesso hanno reso difficile l’interpretazione dei risultati positivi delle suddette ibridazioni: la sonda, legandosi ai ribosomi batterici, evidenziava l’intero solco cuticolare in cui questi ultimi erano collocati, impedendo di osservare i singoli organismi. Inoltre, le cellule di Sonderia cfr. vorax sono risultate autofluorescenti se fissate in formaldeide 4% in PBS (cfr. Sezione 2: Materiali e Metodi). Ciò ha reso inizialmente difficile stabilire se la fluorescenza osservata dipendesse dalla positività dell’ibridazione o da artefatti sperimentali (legame aspecifico della sonda con la superficie della cellula, autofluorescenza del protista ecc.).
Il protocollo è stato ottimizzato mediante l’inserimento di un passaggio in DAPI durante la procedura di ibridazione e l’impiego di osmio tetrossido anziché formammide per la fissazione. In tal modo, l’autofluorescenza cellulare è stata notevolmente ridotta, mentre il DAPI ha permesso di evidenziare in modo non ambiguo il DNA batterico presente sulla superficie cellulare. Come unico inconveniente, non è stato più possibile osservare le zone soprastanti e sottostanti l’apparato nucleare del ciliato in quanto la fluorescenza emessa da quest’ultimo, dovuta al DAPI, schermava ogni altro segnale circostante.
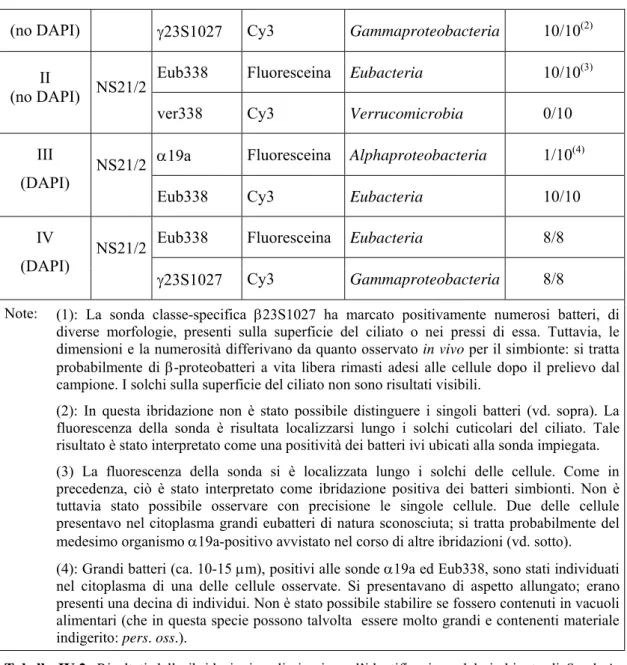
La Tabella IV.2 riporta i risultati ottenuti con le ibridazioni effettuate su cellule della popolazione NS 21/2. Le ibridazioni compiute sulle cellule provenienti da altri campioni sono state effettuate impiegando unicamente la sonda Eub338 (ed includendo nel protocollo il trattamento con DAPI). Esse hanno dato risultato positivo nel 100% delle cellule osservate. Ibridazione Popol. Sonda Fluorocromo Specificità Cellule Positive
(no DAPI) γ23S1027 Cy3 Gammaproteobacteria 10/10(2) Eub338 Fluoresceina Eubacteria 10/10(3) II
(no DAPI) NS21/2
ver338 Cy3 Verrucomicrobia 0/10 α19a Fluoresceina Alphaproteobacteria 1/10(4) III
(DAPI) NS21/2
Eub338 Cy3 Eubacteria 10/10 Eub338 Fluoresceina Eubacteria 8/8 IV
(DAPI) NS21/2
γ23S1027 Cy3 Gammaproteobacteria 8/8
Note: (1): La sonda classe-specifica β23S1027 ha marcato positivamente numerosi batteri, di diverse morfologie, presenti sulla superficie del ciliato o nei pressi di essa. Tuttavia, le dimensioni e la numerosità differivano da quanto osservato in vivo per il simbionte: si tratta probabilmente di β-proteobatteri a vita libera rimasti adesi alle cellule dopo il prelievo dal campione. I solchi sulla superficie del ciliato non sono risultati visibili.
(2): In questa ibridazione non è stato possibile distinguere i singoli batteri (vd. sopra). La fluorescenza della sonda è risultata localizzarsi lungo i solchi cuticolari del ciliato. Tale risultato è stato interpretato come una positività dei batteri ivi ubicati alla sonda impiegata. (3) La fluorescenza della sonda si è localizzata lungo i solchi delle cellule. Come in precedenza, ciò è stato interpretato come ibridazione positiva dei batteri simbionti. Non è tuttavia stato possibile osservare con precisione le singole cellule. Due delle cellule presentavo nel citoplasma grandi eubatteri di natura sconosciuta; si tratta probabilmente del medesimo organismo α19a-positivo avvistato nel corso di altre ibridazioni (vd. sotto). (4): Grandi batteri (ca. 10-15 μm), positivi alle sonde α19a ed Eub338, sono stati individuati nel citoplasma di una delle cellule osservate. Si presentavano di aspetto allungato; erano presenti una decina di individui. Non è stato possibile stabilire se fossero contenuti in vacuoli alimentari (che in questa specie possono talvolta essere molto grandi e contenenti materiale indigerito: pers. oss.).
Tabella IV.2: Risultati delle ibridazioni preliminari per l’identificazione del simbionte di Sonderia
cfr. vorax. La prima colonna riporta il numero della ibridazione, e specifica se il passaggio in DAPI è stato incluso nel protocollo. L’ultima colonna mostra il numero di cellule in cui sono stati osservati batteri positivi alla sonda impiegata: tale numero è espresso come frazione, con al numeratore le cellule positive ed al denominatore il totale osservato.
Le ibridazioni preliminari hanno consentito di ipotizzare l’appartenenza del simbionte di Sonderia cfr. vorax alla cl. Gammaproteobacteria. Tale ipotesi è basata sul fatto che soltanto la sonda γ-proteobatteri-specifica, oltre alla sonda universale Eub338, evidenziava i solchi presenti sulla superficie del ciliato, dove tali batteri risiedono. L’identità fra le regioni evidenziate dalla sonda e quelle con più alta concentrazione di batteri è stata confermata dalla colorazione con DAPI, che, a differenza della sonda oligonucleotidica, permette di individuare le singole cellule. È stato pertanto concluso che la sonda γ23S1027 si sia legata specificamente ai batteri simbionti. La fluorescenza osservata nelle altre ibridazioni appariva invece uniformemente distribuita sulla superficie cellulare: il fatto è stato interpretato come frutto dell’autofluorescenza residua della cellula, e l’ibridazione considerata negativa.
- Tentativi di caratterizzazione molecolare
Come già esposto precedentemente, la similarità a livello della molecola del gene codificante per il 16S rRNA fra γ-proteobatteri e β-proteobatteri non ha sinora consentito la realizzazione di primer classe-specifici al fine di ottenere l’amplificazione selettiva, tramite PCR, del 16S rDNA di una delle due classi, selezionando negativamente l’altra. Non è stato pertanto possibile ottimizzare quantitativamente (es. mediante touchdown PCR) l’amplificazione del gene del γ-proteobatterio simbionte di Sonderia cfr. vorax. È stato pertanto fatto ricorso a procedure molecolari basate sull’amplificazione e clonaggio delle sequenze geniche bersaglio presenti nel campione iniziale (cfr. Sezione 2: Materiali e Metodi).
L’estrazione di DNA è stata fatta a partire da 21 cellule provenienti dalla popolazione NS 21/2. A causa della difficoltà di mantenere vitali tali organismi fuori dal campione, non è stato applicato il protocollo standard, che prevede il digiuno preliminare dei ciliati per almeno 24 ore prima della fissazione: le cellule sono state fissate dopo circa 4 ore dalla raccolta. Avendo inoltre osservato, durante la realizzazione di preparati per S.E.M. (vd. sopra), che parte dei batteri simbionti può andare perduta in seguito a prolungata manipolazione delle cellule e/o a passaggi in mezzi non isosmotici, i passaggi in acqua distillata normalmente effettuati per la pulizia della cellula da contaminanti ambientali sono stati ridotti in numerosità e durata (da tre a uno e da 2’-5’ a pochi secondi). Ciò ha inevitabilmente introdotto una maggior quantità di contaminanti nel campione fissato. Tale procedura è stata tuttavia preferita al protocollo tradizionale in quanto garantiva anche una maggiore rappresentatività del DNA-stampo del batterio simbionte all’interno del medesimo campione (alcuni tentativi di pulizia del ciliato effettuati nei tempi e modi previsti dal protocollo standard hanno permesso di osservare che gli ectosimbionti andavano incontro a lisi cellulare dopo alcuni secondi dall’immissione in acqua distillata; tale lisi coincideva con il distacco di una sorta di muco dalle pareti della cellula ospite, e con l’esplosione di numerose tricocisti, osservabile anche a basso ingrandimento).
La reazione di PCR è stata effettuata con i primer universali F7b ed R1522b. Tale combinazione è stata selezionata dopo aver effettuate quattro reazioni di PCR, a basse condizioni di stringenza, nelle quali sono stati impiegati, in tutte le possibili combinazioni, due inneschi forward universali (F7a: 5’-AGAGTTTGATCCTGGCTCAG-3’; F7b:
5’-AGAGTTTGATCATGGCTCAG-3’) e due reverse universali (R15122b:
5’-GGAGGTGATCCAACCGCA-3’; R1522a: 5’-GGAGGTGATCCAGCCGCA-3’). Delle quattro combinazioni testate, quella riportata ha reso la maggiore quantità di prodotto. L’annealing è avvenuto a 57°C; l’estensione è stata prolungata per 2’.
Il numero di colonie trasformate correttamente è risultato piuttosto basso, rispetto ad altri clonaggi eseguiti con il medesimo procedimento. Cellule provenienti da 48 colonie, risultate
positive allo screening colorimetrico, sono state sottoposte ad amplificazione per verificare la lunghezza dell’inserto ivi clonato: in 14 di esse tale inserto è risultato possedere la lunghezza attesa; tutte le altre si sono rivelate non trasformate o microtrasformate con frammenti oligonucleotidici. Gli inserti di lunghezza attesa sono stati sottoposti a digestione mediante enzimi di restrizione. Alcune delle colonie del gruppo di pattern di restrizione più rappresentato sono state sequenziate. Vengono qui di seguito riportati i risultati ottenuti. GRUPPO Pattern Risultato Sequenziamento Interpretazione Rappresentatività
1 I + II Rheinheimera/Curacaobacter Possibile simbionte 11/14 2 III [non sequenziato] Contaminante
ambientale 2/14 Pattern unici Contaminanti ambientali 1/14 Pattern di dubbia assegnazione [nessuna] 0/14
Digestioni fallite 0/14
La maggior parte degli amplificati sottoposti a digestione (78,6%) ha prodotto due pattern riconducibili ad un unico gruppo (il verso di inserzione dell’amplicone nel vettore influenza il pattern di restrizione: cfr. Sezione 2: Materiali e Metodi). I geni contenuti in due cloni appartenenti a tale gruppo (clone D8 e clone D9) sono stati caratterizzati.
Le sequenze ottenute misurano 1477 pb. Differiscono fra loro per tre nucleotidi, in posizione 393 (C-T), 919 (G-A) e 1065 (G-A) a partire dalla posizione iniziale della sequenza (il primo nucleotide fra parentesi appartiene al gene in D8, il secondo a quello in D9).
Tali sequenze sono state confrontate con quelle presenti nella banca dati di riferimento (NCBI GenBank). Entrambe presentano la maggiore affinità (98%) con la sequenza DQ298025 (Halpern, Landsberg, Raats, Rosenberg 2005) del 16S rDNA di Rheinheimera chironomi ceppo K19414 (Chromatiaceae, Chromatiales, Gammaproteobacteria). Per la sequenza del clone D8, l’identità riportata è 1439/1462 (un gap); per quella del clone D9 è 1442/1462 (1 gap). Una seconda sequenza presentante un’alta affinità con quelle sottomesse (96%) è AJ002006 ((Brettar, Christen, Hofle) Stechinelli, Neumann 2002) di Curacaobacter baltica (precedentemente descritto come Rheinheimera baltica: Brettar et al., 2002). La stessa sequenza era risultata molto affine a quella di un altro γ-proteobatterio ottenuta dai clonaggi effettuati nel tentativo di caratterizzazione del simbionte secondario di Euplotes parawoodruffi ceppo OS 52/1 (cfr. Parte Terza: Discussione dei risultati ottenuti, Capitolo I: Caratterizzazione morfologica e molecolare di Euplotes parawoodruffi e dei simbionti ad esso associati). L’identità di D8 nei confronti di tale sequenza è 1379-1425 (4 gap), quella di D9 è 1382/1425 (4 gap). Data l’appartenenza alla classe cercata ed alla reciproca somiglianza delle due sequenze, è stato ipotizzato che la sequenza di 16S rDNA presente nei
cloni D8 e D9 potesse appartenere al simbionte. L’alta rappresentatività del pattern di restrizione osservata durante lo screening dei cloni, nonché la presenza di specie simbionti all’interno del gen. Rheinheimera (fra cui R. chironomi: Halpern et al., unpubl.) ed il ritrovamento sequenze simili in analoghi esperimenti di caratterizzazione ha rafforzato ulteriormente tale ipotesi.
- Ibridazione con sonde specie-specifiche disegnate sul 16S rRNA
Sulla base delle sequenze dei cloni D8 e D9, nonché su altre possibili sequenze di ectosimbionti di ciliati ottenute durante i tentativi di caratterizzazione dei simbionti di E. parawoodruffi (cfr. Parte Terza: Discussione dei risultati ottenuti, Capitolo I: Caratterizzazione morfologica e molecolare di Euplotes parawoodruffi e dei simbionti ad esso associati), è stata disegnata una sonda oligonucleotidica con cui tentare di confermare l’appartenenza della sequenza trovata al simbionte mediante ibridazione in situ. Le caratteristiche della sonda sono di seguito riassunte:
-Rhei1245: Specifica per batteri del genere Rheinheimera o filogeneticamente correlati ad esso. La sequenza non presenta mismatch con 41 delle 44 sequenze comprese in tale cluster. Differisce per almeno 2 nucleotidi da tutte le altre sequenze presenti in banca dati.
Posizione: 1245 E. coli.
Sono state effettuate le ibridazioni di controllo di seguito riportate (cfr. Tabella IV.3).
Ibridazione Popol. Sonda Fluorocromo Specificità n. Cellule
Positive
Archaea915(1) Cy3 Archaeobacteria 5 100%(2) I
(0% f.a.) (no DAPI)
NS21/2
Rhei1245 Fluoresceina Rheinheimera spp. 5 0%(3) Eub338 Cy3 Eubacteria 7 100% II
(0% f.a.) (DAPI)
NS21/2
Note: (1): Tale sonda è stata utilizzata per confermare o smentire la presenza di archeobatteri simbionti. Tale simbiosi è descritta in letteratura per generi vicini a Sonderia (es. Fenchel et al., 1977; Goosen et al., 1988); dall’indagine ultrastrutturale (vd. oltre) erano inoltre emersi indizi indicanti la possibile presenza di simili organismi in questa specie. L’ibridazione ha però dato un risultato negativo (vd. sotto).
(2): La sonda si è legata a numerosi batteri a vita libera presenti nell’ambiente. La sonda ha evidenziato anche alcuni batteri presenti all’interno delle cellule, contenuti però in vacuoli alimentari o presentanti dimensioni e morfologia tali da escludere l’identificazione con quanto osservato al T.E.M.
(3) L’ibridazione è stata ritenuta negativa in quanto la sonda non evidenziava i solchi cuticolari del ciliato, come avvenuto nelle ibridazioni considerate positive (es. con γ23S1027). Alcuni batteri esternamente posti rispetto alle cellule, presumibilmente a vita libera, sono stati marcati specificamente dalla sonda, dimostrandone la funzionalità alle condizioni di stringenza adottate.
Tabella IV.3: Ibridazioni con sonda specie-specifica (Rhei1245) per l’identificazione del simbionte di
Sonderia cfr. vorax. La penultima colonna a destra riporta il numero di cellule osservate; l’ultima la percentuale di cellule sulle quali siano stati individuati batteri specificamente marcati dalla sonda. La prima colonna a sinistra riporta la condizione di stringenza adottata, espressa come percentuale di formammide nella soluzione di ibridazione; indica inoltre se il passaggio supplementare in DAPI è stato aggiunto al protocollo di ibridazione.
Dalle ibridazioni effettuate risulta che la sonda è in grado di legarsi in modo specifico a cellule batteriche alla condizione di stringenza dello 0% di formammide. Tuttavia, essa non risulta legarsi ai batteri episimbionti di Sonderia cfr. vorax. La sequenza del batterio Rheinheimera-simile caratterizzata tramite clonaggio non appartiene al γ-proteobatterio simbionte del ciliato in questione, bensì ad un contaminante ambientale, probabilmente presente anche nelle colture di E. parawoodruffi (cfr. Parte Seconda: Risultati, presente capitolo).
- Osservazioni dell’ultrastruttura del simbionte
La realizzazione di preparati per il microscopio elettronico a trasmissione finalizzati alla descrizione dell’ultrastruttura dell’ospite è stata illustrata precedentemente (vd. sopra). Durante tale indagine sono stati osservati numerosi batteri episimbionti in individui appartenenti ad entrambe le popolazioni (NS 21/2, mantenuta in campioni sigillati, ed una seconda proveniente in campioni posti a contatto con l’aria). In entrambe le popolazioni, i batteri risultavano presenti in gran numero sulla superficie esterna di tutte le cellule osservate. Essi si collocavano quasi esclusivamente nei solchi presenti sulla superficie del ciliato, disposti in file parallele al verso del solco stesso. Non è stata notata alcuna struttura corticale deputata all’alloggiamento dei batteri (alveoli, cavità ecc.), né sono stati osservati batteri posti a stretto contatto con la membrana o al di sotto della stessa. In alcuni preparati è stato possibile osservare un sottile strato di sostanza mucosa, debolmente elettrondensa, posto fra il simbionte e la membrana plasmatica dell’ospite: è possibile che tale muco venga secreto da peculiari estrusomi mucocisti-simili (osservati però esclusivamente nella
popolazione NS 21/2.). Non sono stati individuati vacuoli alimentari contenenti dei batteri episimbionti in nessuna delle cellule osservate.
L’aspetto dei simbionti è apparso tuttavia profondamente differente negli individui delle due popolazioni osservate. La popolazione proveniente dai campioni a contatto con l’aria possiede batteri dalla conformazione allungata, bastoncellare, leggermente ricurva in alcuni individui, caratterizzati da un citoplasma mediamente elettrondenso, con alcune zone leggermente più scure, e privi di strutture particolari. Nella popolazione NS 21/2 (campioni sigillati) la disposizione e l’aspetto esterno dei batteri appare la medesima: essi presentano però un citoplasma nettamente suddiviso in zone chiare, trasparenti agli elettroni, ed in zone decisamente elettrondense, presenti in numero variabile (da due a sette) e solitamente poste nella regione più interna del corpo cellulare, circondate all’esterno dalle zone trasparenti. La suddivisione fra le regioni è netta: non è stato tuttavia possibile individuare membrane cellulari delimitanti le zone elettrondense. I contorni di tali zone sono lineari; la forma è irregolare. Tutti i simbionti osservati nella popolazione NS 21/2 sono risultati possedere le caratteristiche sin qui esposte. Tale dissimilarità non è stata spiegata.
Sezione 3 – Capitolo IV
Parte Terza
Discussione dei risultati ottenuti
IV.3.1: Considerazioni sull’allevamento di Sonderia cfr. vorax
Il gen. Sonderia comprende sinora otto specie, per la maggior parte descritte da Kahl negli anni 1928-1930. Il genere è fra i meno caratterizzati dell’intero ordine Plagiopylida: informazioni sulla sua distribuzione e sul tipo di metabolismo non sono ad oggi disponibili. In letteratura è segnalato il rinvenimento di Sonderia sinuata in ambienti d’acqua dolce, stagnanti ma non sapropelici (Sola et al., 1989); altri autori ne segnalano tuttavia la presenza in ambiente salmastro sapropelico (Kirby, 1934; Kahl, 1930-35). In generale, ciò può essere esteso alla maggior parte delle specie comprese nel genere, nonché all’intero ordine Plagiopylida.
Il presente lavoro ha evidenziato le problematiche insite nel mantenimento di colture cellulari di Sonderia cfr. vorax. Come la gran parte dei plagiopilidi sin qui descritti, anche questa specie è stata ritrovata in un ambiente che, limitatamente al microclima interstiziale e, più in generale, allo strato del sedimento, presenta alcune delle caratteristiche proprie delle salt marshes pools (basso tenore di ossigeno disciolto, ambiente fortemente riducente, presenza di detrito organico in decomposizione) in cui tali ciliati risultano abbondanti (Kirby, 1934). È quindi possibile che lo stagno costiero oggetto del presente studio rientri in tale definizione.
I risultati di questo studio, relativi al metodo d’allevamento, sembrano indicare che quantomeno Sonderia cfr. vorax e Sonderia pharyngea siano da ritenersi specie fortemente microaerofile, probabilmente obbligate. La sopravvivenza in un mezzo contenente ossigeno in equilibrio a pressione atmosferica e T° ambiente determina la morte dei ciliati in poche ore: la medesima osservazione è riportata da Goosen et al. (1988) per Plagiopyla nasuta, specie considerata anaerobia (il cui optimum di ossigeno disciolto nel mezzo di coltura è però 2,8% e non zero: Goosen et al., 1988). Inoltre, l’arricchimento delle popolazioni di tali organismi si è verificato in contenitori sigillati, o comunque privi di scambi gassosi significativi a livello del sedimento, come dimostrato dalle misurazioni ossimetriche eseguite (cfr. Parte Seconda: Risultati, presente capitolo), laddove altre specie di ciliati dal metabolismo sicuramente aerobio (es. Frontonia spp., Euplotes parawoodruffi) sono
scomparse. L’esperimento condotto in parallelo con un terzo campione lasciato a contatto con l’aria ha dimostrato una leggera diminuzione del tasso di accrescimento della popolazione (comunque presente ed in crescita, poiché una situazione anossica si è venuta a creare anche in questo campione). Tale dato non supporta l’attribuzione della condizione di anaerobionte obbligato a Sonderia cfr. vorax o S. pharyngea, in quanto nei medesimi campioni sono comunque risultate presenti specie notoriamente microaerofile ma provviste di mitocondri e di pattern metabolici aerobi quali Paramecium calkinsi (specie microaerofila secondo Fenchel et al., 1977). È tuttavia da segnalare che il medesimo dato è riportato per Sonderia vorax da Kirby (1934), il quale annota che tale specie “si incontra spesso in piccole quantità, ma in molti casi diviene piuttosto abbondante nelle colture [campioni, N.d.A.] alcuni giorni dopo la raccolta”. Non è però specificato il motivo per cui ciò accade, né quali cambiamenti chimicofisici avvengano nel campione. Nel caso dei campioni raccolti durante il presente lavoro, è stato invece possibile accertare la persistente condizione di anossia-microaerofilia a livello del sedimento, instauratasi e/o aggravatasi dopo il prelievo degli stessi. Infatti, l’ambiente da cui i campioni provengono è di per sé stesso povero d’ossigeno, come verificato dalle misurazioni ossimetriche eseguite in loco; è tuttavia possibile che le condizioni di anossia nei campioni siano maggiori e/o più estese di quelle ambientali, come dimostra la scomparsa di molte delle specie presenti al momento della raccolta. È probabile che tali specie, aerobie o microaerofile facoltative come P. calkinsi, non abbiano più avuto modo di spostarsi in zone ossigenate per effettuare le reazioni metaboliche necessitanti ossigeno molecolare, e conseguentemente siano diminuite di numero a vantaggio di organismi meglio adattati quali Sonderia spp.
Il metodo di mantenimento delle popolazioni di Sonderia cfr. vorax e S. pharyngea (ma verosimilmente applicabile per altri plagiopilidi) consiste pertanto nel mantenimento di bassi livelli di ossigeno disciolto all’interno del campione o, quantomeno, del sedimento. Tale sistema selezione negativamente la maggior parte delle specie di ciliati aerobi o microaerofili presenti nel campione, mentre può selezionare positivamente altri ciliati anaerobi quali Caenomorpha spp. In letteratura non sono descritte tecniche di coltura specifiche per Sonderia spp.: i vari metodi sviluppati per l’allevamento di Plagiopyla spp. in terreni di coltura artificiali (Goosen et al., 1988; Fenchel and Finlay 1991) prevedono in ogni caso la riduzione o l’eliminazione dei residui di ossigeno dal mezzo.
IV.3.2: Caratterizzazione morfologica e molecolare
Le descrizioni relative alle specie del gen. Sonderia sono poco numerose, e piuttosto variabili in dipendenza dai loro diversi autori (Sola et al., 1989). Nel presente lavoro è stato fatto riferimento principalmente ai lavori di Kahl (1930-35) e Kirby (1930), in cui sono descritte per la prima volta sette delle otto specie di Sonderia tradizionalmente riconosciute
(Carey, 1992). Il lavoro di Kahl si compone tuttavia di descrizioni molto sintetiche e non sempre chiare, mentre quello di Kirby descrive, in dettaglio, unicamente la specie S. pharyngea. Il confronto con i dati in nostro possesso è pertanto risultato, in certi casi, difficile o impossibile.
Nella specie in esame, le dimensioni osservate in vivo sono apparse molto variabili da individuo a individuo (60-130 μm). Tale range dimensionale comprende gran parte delle specie di Sonderia sp., ad eccezione delle più piccole S. mira (25-50 μm ) e S. cyclostoma (50-55 μm: per quest’ultima specie tale carattere risulta oltretutto poco variabile: Kahl, 1930-35) (Kahl., 1930-35; Carey, 1992). Fra le altre specie, S. tubigula presenta il citostoma collocato presso l’estremità posteriore del corpo cellulare, collegato all’estremità anteriore da una cavità vestibulare che si estende per l’intera lunghezza del ciliato. Tale carattere, di facile riconoscimento, non è mai stato osservato nella popolazione in esame: ciò ha condotto all’esclusione di questa specie.
Le cinque specie restanti, S. labiata, S. sinuata, S. vorax, S. schizostoma2 e S. pharyngea presentano caratteristiche morfologiche simili fra loro; la discriminazione risulta pertanto meno evidente, anche perché basata su dettagli difficilmente osservabili e, in certi casi, descritti in modo piuttosto sommario. L’ultima delle specie citate, S. pharyngea, è l’unica a possedere una dettagliata ed esaustiva descrizione (Kirby, 1934). Essa presenta un corpo cellulare appiattito dorsoventralmente, con la regione iniziale della cavità vestibulare anteriore dalla lunghezza di circa 35 μm. Il macronucleo è sferico, dal diametro di 15-30 μm, ed è presente un unico micronucleo. È segnalata la presenza di tricocisti. Tali caratteri appaiono riconducibili a quanto osservato nella specie in esame. Il citostoma, tuttavia, si colloca circa a metà del corpo cellulare, cosicché la cavità vestibulare si prolunga in una struttura tubolare che decorre sul fianco dell’organismo, similmente a quanto avviene per S. tubigula (Kirby, 1934). Tale struttura non è riscontrabile nella specie in esame, in cui la cavità vestibulare non si sviluppa per oltre un terzo della lunghezza della cellula. Un secondo carattere che differisce profondamente da quanto osservato è la disposizione, in S. pharyngea, delle cinezie ventrali. Nei sui lavori (1930-35), Kahl descrive un arrangiamento di tali cinezie comune a numerose specie di Sonderia, in cui un certo numero di esse, poste sul lato sinistro, anziché decorrere parallelamente all’asse anteroposteriore del corpo si estendono parallelamente al margine laterale e posteriore; le restanti cinezie decorrono invece normalmente, in senso longitudinale, e si interrompono incontrando quelle diversamente orientate. Questo carattere è stato osservato anche nella specie in esame. In S. pharyngea, invece, tutte le cinezie ventrali decorrono parallele all’asse anteroposteriore, senza presentare curvature (Kirby, 1934). È quindi possibile escludere tale specie; il
2 La specie è indicata con il nome di “Sonderia shizostoma” in Carey (1992). La descrizione di Kahl (1930-35) riporta invece il nome, qui indicato, di “Sonderia schizostoma”.
confronto diretto fra la specie oggetto di studio ed individui di S. pharyngea successivamente individuati nel medesimo ambiente ha permesso di confermare la distinzione (le specie sono risultate distinguibili in vivo anche a basso ingrandimento).
L’analisi della disposizione delle cinezie ventrali è stata utilizzata anche nei successivi tentativi di identificazione con altre specie. Stando ai disegni di Kahl (1930-35), una disposizione delle cinezie ventrali simile a quella di S. pharyngea (e quindi diversa da quanto osservato) è presente in S. schizostoma (osservazione riportata anche in Kirby, 1934; nella breve descrizione della specie fatta da Kahl, 1930-35, questo carattere non viene tuttavia menzionato), mentre S. sinuata e S. labiata presentano la disposizione “classica” (cinezie ventrali sinistre incurvate). Dai disegni non è possibile stabilire il numero di cinezie soggette a curvatura in queste specie. Sola et al. (1989) forniscono tuttavia una descrizione più precisa di S. sinuata: in essa, tale numero è indicato in 10 cinezie, costituenti il “sistema secante ventrale” che intercetta, interrompendole, le 20 cinezie ventrali longitudinali (Sola et al., 1989). Il dato riportato concorda con quanto osservato nel ciliato in esame. Tuttavia, S. sinuata presenta una forma marcatamente ellittica, quasi sferica, indicata come “ovale” in Kahl (1930-35); il macronucleo ha un diametro di 20-30 μm ed è collocato nella parte anteriore della cellula anziché in posizione mediana; infine, è presente un ciuffo di cilia prominenti, a “spazzola”, sull’estremità posteriore (Sola et al., 1989). È possibile che tali caratteri, che costituiscono differenze possibilmente significative con la specie in esame, possano variare a livello intraspecifico (la breve descrizione di S. sinuata presente in Carey, 1992, non fa cenno a tali particolarità, e l’immagine ivi riportata differisce grandemente da quanto illustrato in Sola et al., 1989, ad eccezione del ciuffo posteriore); tuttavia, sono stati considerati ai fini della discriminazione.
S. labiata presenta anch’essa un arrangiamento delle cinezie ventrali simile a quello di S. sinuata (tali specie, assieme a S. vorax, sono indicate come “quasi identiche a prima vista”: Carey, 1992). La sua descrizione appare coincidere con quella della specie in esame, ad eccezione dell’accenno, fatto da Carey (1992), alla presenza di un vacuolo contrattile terminale (Kahl, 1930-35, afferma che tali strutture sono assenti in tutte le specie di Sonderia: è invece possibile notare “lacune citoplasmatiche”, di incerta natura, interpretabili a prima vista come vacuoli contrattili, ma prive di poro e di altre strutture). La stessa cosa è valida per S. vorax, in cui l’accenno al vacuolo non compare. Stando alle illustrazioni riportate (Carey, 1992) è tuttavia possibile che S. labiata possieda un numero di cinezie ventrali incurvate ridotto (5 o 6, a fronte di circa 15 cinezie longitudinali) rispetto a quanto osservato nella specie in esame e a quanto descritto per S. sinuata (Sola et al., 1989).
La morfologia, le dimensioni e la disposizione dell’apparato macronucleare di S. vorax coincidono con quanto osservato (Kahl, 1930-35; Carey, 1992), come del resto avviene per S. labiata e, in parte, per S. sinuata sensu Carey 1992. Dalle illustrazioni e dalle descrizioni
di tale specie non è tuttavia possibile ottenere dati riguardanti la disposizione delle cinezie ventrali, considerate come possibile carattere discriminante fra S. vorax e S. labiata. Un disegno, privo di descrizione specifica, di S. vorax è però riportato in un lavoro di Fenchel et al. (1977): in esso, è raffigurato un “sistema secante” composto di 10 cinezie incurvate, intersecante 19 cinezie ventrali longitudinalmente poste. Ciò coincide in parte con quanto osservato nella specie oggetto di studio. La tavola è originale (o perlomeno non ne viene citata la fonte); non è tuttavia indicato il metodo di colorazione impiegato, né alcun accenno a quanto illustrato, fatto salvo il nome della specie. Ulteriori conferme dell’identificazione della specie ritrovata con S. vorax possono venire indirettamente da quanto accennato da Kahl (1930-35) a proposito della variabilità delle dimensioni in questa specie (tale carattere è detto “fortemente variabile”; il lavoro riporta in effetti un range dimensionale di 120 μm: Kahl, 1930-35). Altre osservazioni sono riferite alla reperibilità e dell’eurialinità di S. vorax: essa è infatti descritta come “da comune a numerosa” nell’ambiente salmastro da lui utilizzato nel campionamento (paludi salmastre di Oldesloe [sic], fra Amburgo e Lubecca: Kirby, 1934), e “marcatamente eurialina”. Nessuna altra specie di Sonderia è descritta come coarse grained per tale fattore (Kahl, 1930-35). Accenni alla facilità di reperimento di questa specie sono presenti anche in Kirby (1934), in cui è riportata anche l’osservazione che la specie aumenta di numero con l’invecchiare dei campioni. Le osservazioni sin qui riportate sembrano corrispondere a quanto osservato per la specie in esame (la cui eurialinità non è stata verificata sperimentalmente, ma che vive in un ambiente sicuramente variabile per tale fattore: cfr. Sezione 2: Materiali e Metodi). In mancanza di descrizioni delle specie di Sonderia più recenti e/o accurate di quelle utilizzate in questa discriminazione, non è tuttavia possibile identificare con certezza l’organismo osservato come Sonderia vorax KAHL 1928. Quest’ultima, sulla base dei dati sin qui raccolti, risulta comunque la specie presentante il maggior numero di somiglianze con il ciliato oggetto di studio, il cui nome è stato pertanto indicato, in via provvisoria, come Sonderia cfr. vorax.
La Tabella IV.4 riassume schematicamente gli esiti del confronto sin qui effettuato.
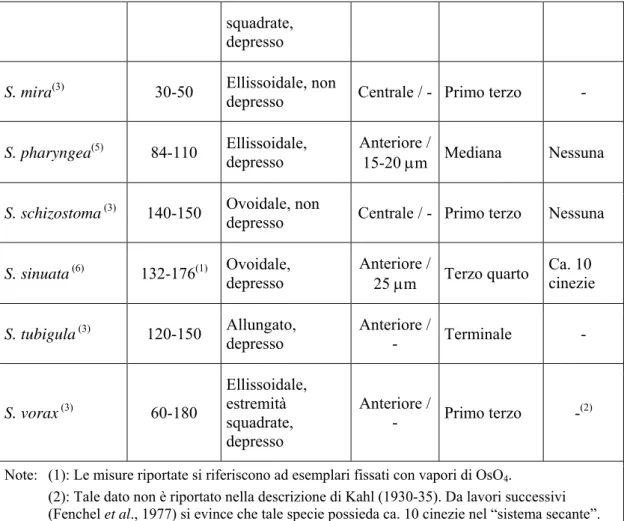
SPECIE Dimensioni (μm) Forma del Corpo Cellulare Posizione / Ø Ma Posizione Citostoma Sistema Secante NS 21/2 [in esame] 60-140 Ellissoidale, estremità squadrate, depresso Anteriore / - Primo terzo Ca. 10 cinezie
S. cyclostoma(3) 50-55 Ovoidale, non depresso - Mediana -
squadrate, depresso
S. mira(3) 30-50 Ellissoidale, non depresso Centrale / - Primo terzo -
S. pharyngea(5) 84-110 Ellissoidale, depresso Anteriore / 15-20 μm Mediana Nessuna
S. schizostoma (3) 140-150 Ovoidale, non
depresso Centrale / - Primo terzo Nessuna S. sinuata (6) 132-176(1) Ovoidale, depresso Anteriore / 25 μm Terzo quarto Ca. 10 cinezie
S. tubigula (3) 120-150 Allungato, depresso Anteriore / - Terminale -
S. vorax (3) 60-180 Ellissoidale, estremità squadrate, depresso Anteriore / - Primo terzo -(2)
Note: (1): Le misure riportate si riferiscono ad esemplari fissati con vapori di OsO4.
(2): Tale dato non è riportato nella descrizione di Kahl (1930-35). Da lavori successivi (Fenchel et al., 1977) si evince che tale specie possieda ca. 10 cinezie nel “sistema secante”. (3): Data from Kahl, 1930-35.
(4): Data from Carey, 1992. (5): Data from Kirby, 1934. (6): Data from Sola et al., 1989.
Tabella IV.4: Confronto fra le specie di Sonderia attualmente descritte e quella oggetto del presente
studio (popolazione NS 21/2). Nella prima colonna sono indicati i nomi di tali specie. La seconda riporta il range dimensionale descritto per ciascuna di esse. La terza fornisce una descrizione sommaria della morfologia della cellula in vivo. Nella quarta è riportata la posizione del macronucleo e, ove indicato, il diametro dello stesso. La quinta colonna indica la posizione nel citostoma: la misura è indicata come frazione rispetto all’asse anteroposteriore del corpo cellulare. L’ultima colonna enumera le cinezie ventrali formanti il cosiddetto “sistema secante” (cinezie non parallele all’asse cellulare, poste alla sinistra dello stesso, che, incurvandosi, intercettano le restanti cinezie ventrali).
Il confronto fra la sequenza del gene codificante per il 18S rRNA ottenuta da cellule della popolazione NS 21/2 e quelle già presenti nel data base di riferimento ha permesso di confermare l’appartenenza di tale organismo all’ordine Plagiopylida. La sequenza caratterizzata risulta infatti filogeneticamente vicina alle quelle di Plagiopyla sp. e Lechriophyla sp.; Trimyema sp. si colloca in posizione basale rispetto a tale gruppo. La mancanza di ulteriori sequenze relative a specie comprese in tale ordine non consente di compiere analisi filogenetiche più approfondite. La caratterizzazione di altri plagiopilidi, possibilmente appartenenti alla famiglia Sonderiidae, consentirà in futuro di stabilire le relazioni filogenetiche fra questi e la specie in esame, nonché le posizioni relative dei vari cladi all’interno di tale ordine.
IV.3.3: Considerazioni sui batteri ectosimbionti di Sonderia cfr. vorax
Come precedentemente affermato, la presenza di ectosimbionti stabilmente associati all’ospite è un carattere comune a tutte le specie comprese nel genere Sonderia (Fenchel et al., 1977; Carey, 1992).
L’associazione fra batterio e ospite è stata osservata in tutti gli esemplari osservati; tale osservazione concorda con i dati sinora disponibili sulle episimbiosi in ambiente microaerofilo (cfr. Parte Prima: Introduzione, presente capitolo). A differenza di quanto accade in altri ciliati (es. Euplotidium itoi, Parablepharisma pellitum; Rosati et al., 1999; Fenchel et al., 1977), Sonderia cfr. vorax non sembra possedere alloggiamenti specifici sulla superficie cellulare per i suoi simbionti, eccezion fatta per i solchi in cui tali organismi si raggruppano: non c’è virtualmente alcun diretto contatto fra ospite e simbionte (la medesima osservazione è riportata in Fenchel et al., 1977, per S. vorax). Tuttavia, le numerose mucocisti osservate nell’atto di estrudere materiale nello spazio compreso fra la membrana cellulare e lo strato di batteri suggeriscono l’ipotesi che questi ultimi siano trattenuti in loco da strati di muco secreto dal ciliato stesso. Strati mucosi contenenti batteri episimbionti sono documentati in ciliati dei genn. Metopus e Caenomorpha, mentre l’esistenza di una simile struttura per Sonderia spp. è stata solo ipotizzata (Fenchel et al., 1977). L’indagine ultrastrutturale compiuta sulla popolazione NS 21/2 e su altre nel corso del presente studio ha confermato quanto riportato in letteratura relativamente alla generale mancanza di contatto diretto fra ospite e batteri, il che implica la presenza di una qualche sostanza vischiosa (es. muco) che trattenga questi ultimi in loco. Non è stato tuttavia possibile osservare direttamente lo strato mucoso, sebbene la presenza delle mucocisti e, in alcune sezioni, di una sostanza debolmente elettrondensa interposta fra alcuni batteri e la membrana plasmatica dell’ospite conducano all’ipotesi che tale strato esista, ma che le tecniche di fissazione adottate non ne abbiano consentito l’osservazione al microscopio.
L’esistenza di un simile adattamento, apparentemente deputato al mantenimento dei simbionti sulla superficie dell’ospite, suggerisce che tale associazione non sia casuale, e che la presenza dei batteri possa risultare vantaggiosa per il ciliato. Non è tuttavia ancora chiaro in quale modo essi possano agevolare l’ospite. Studi compiuti da Fenchel et al. (1977) sui batteri ectosimbionti di ciliati sapropelici hanno dimostrato che non si tratta di metanogeni (spesso effettivamente associati a specie microaerofile o anaerobie, ma presenti all’interno del citoplasma, in associazione con gli idrogenosomi: Fenchel et al., 1977; Görtz, 2003). Del resto, nel presente lavoro non è stata segnalata alcuna autofluorescenza da parte dei simbionti di Sonderia cfr. vorax: tale carattere è invece distintivo dei metanogeni (Görtz, 2003), che emettono fluorescenza se irradiati da sorgenti di luce a corta lunghezza d’onda (blu). Fenchel e Finlay (1991) hanno ipotizzato che tali organismi siano batteri solforiduttori