CAPITOLO I
TUMORI DELLA LARINGE
1.1 EPIDEMIOLOGIA
In Europa i tumori del distretto cervico-facciale rappresentano nel maschio la quarta neoplasia dopo il cancro del polmone, del colon-retto, della prostata (Black et al., 1997) ed il 67% sono di pertinenza delle prime vie aero-digestive superiori (VADS) (Molinari et al., 1989).
Il tumore delle VADS costituisce il 6% dei tumori maligni e ne determina il 5% delle morti in tutto il mondo (Parkin et al., 2005), rappresentando pertanto il sesto tipo di tumore più frequente, con una incidenza di circa 640.000 nuovi casi all’anno.
Le vie aero-digestive superiori includono labbro, lingua, bocca, ghiandole salivari, cavità nasali, rinofaringe, orofaringe, ipofaringe e laringe.
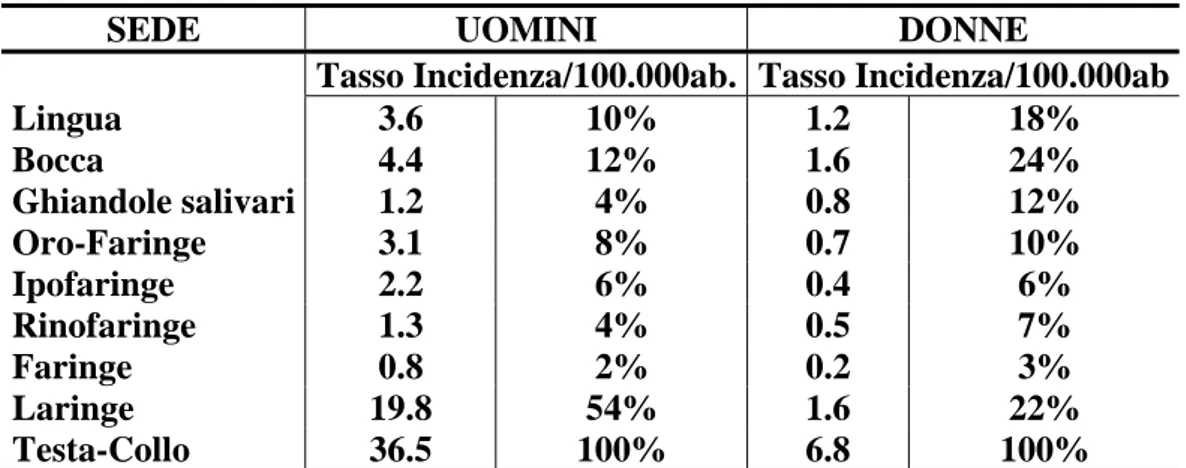
La Tabella 1, relativa ai dati del periodo 1988-1992, permette di confrontare, attraverso tassi di incidenza grezzi, la frequenza relativa di insorgenza delle neoplasie in 8 diverse sedi del distretto testa-collo.
SEDE UOMINI DONNE Tasso Incidenza/100.000ab. Tasso Incidenza/100.000ab
Lingua 3.6 10% 1.2 18% Bocca 4.4 12% 1.6 24% Ghiandole salivari 1.2 4% 0.8 12% Oro-Faringe 3.1 8% 0.7 10% Ipofaringe 2.2 6% 0.4 6% Rinofaringe 1.3 4% 0.5 7% Faringe 0.8 2% 0.2 3% Laringe 19.8 54% 1.6 22% Testa-Collo 36.5 100% 6.8 100%
Tabella 1. Tumori maligni della testa e del collo in Italia, 1988-92.
Fonte: “Linee guida, in ambito clinico, per i tumori epiteliali della testa e del collo”. Feb. 1999.
Il carcinoma della laringe è il più comune tumore del distretto testa-collo (45%); il sesso maschile, in un’età compresa prevalentemente fra i 45-74 anni, con un picco che si assesta sui 65 anni, è nettamente quello più colpito (solo il 5-8% dei casi è riscontrabile nella donna).
Tassi d’incidenza particolarmente alti sono riscontrabili nell’Europa dell’Est (18,8%), soprattutto in Ungheria e Slovacchia. Nel Sud dell’Europa, l’incidenza è del 16,3% (Bray et al., 2002) con percentuali più elevate in Francia (M/F=20/1) (Moriniere, 2006), seguita da Spagna ed Italia. Attualmente si registrano in Italia circa 5500 nuovi casi di cancro della laringe ogni anno, di cui 5000 circa nel solo sesso maschile. Percentuali più basse sono state riscontrate negli Stati dell’Europa dell’Ovest (10,4%) e nel Nord Europa (6,4%) (Bray et al., 2002). Il
riscontro della patologia neoplastica laringea è invece elevata nei Paesi asiatici (India, Taiwan, Malesia ed Hong Kong), nel Nord America e nel Sud Africa.
Negli ultimi anni si registra un decremento dei tassi d’incidenza nella popolazione maschile degli stati del Sud e dell’Est dell’Europa rispetto ai valori elevati osservati nel passato (Bosetti et al., 2006).
Per quanto riguarda la mortalità maschile nell’Unione Europea, essa è diminuita complessivamente dello 0,8% per anno tra il 1980 e il 1989, del 2,8% tra 1989 e il 1995, del 5,3% tra 1995 e il 1998 e del 1,5% negli anni successi (i tassi d’incidenza erano del 5,1/100.000 nel 1980-81 e del 3,3/100.000 nel 2000-01) (Bosetti et al., 2006).
In tutti i Paesi dell’Unione Europea la mortalità dovuta al cancro della laringe è comparativamente più bassa nelle donne, con tassi stabili intorno allo 0,3/100.000 nelle ultime due decadi (Bosetti et al., 2006).
La variabilità d’incidenza e di mortalità di questo tumore, è dovuta alle abitudini dietetiche, al diverso consumo di alcol ed ai fattori virali, spesso confinati in zone geografiche ristrette; se si valuta poi il rapporto esistente tra popolazioni urbane e rurali, si evince che i tumori sono più frequenti nelle prime (Wake, 1993); esiste infine una correlazione negativa tra status socio-economico ed incidenza dei tumori.
Si riscontra una forte variabilità anche all’interno del territorio degli Stati stessi, infatti il tasso di incidenza in Italia, presenta tuttora trend variabili
in rapporto alle sedi di insorgenza, all’età ed alle aree geografiche, con percentuali più elevate nelle regioni settentrionali (nel Piemonte, nell’ Emilia Romagna e in Toscana l’incidenza è superiore ai 10 casi annui ogni 100.000 uomini), rispetto a quelle centro-meridionali e insulari (in Sicilia si registrano 4.9 casi all’anno di tumori della laringe ogni 100.000 uomini) (Tavani et al., 1994).
In Italia, prendendo come modello i dati rilevati dal registro Tumori della provincia di Torino (2004), si evince che l’incidenza dei tumori delle VADS, riferibile al periodo 1998-2001, è pari a 28,1 casi su 100.000 abitanti per anno nel sesso maschile, ed a 6,8 casi su 100.000 abitanti per anno nel sesso femminile, con picchi di incidenza più elevati tra i 50 ed i 70 anni e negli over 80.
Con i medesimi riferimenti, la mortalità corrisponde a 11,1 casi nel sesso maschile ed a 2,1 casi nel sesso femminile. Ad ulteriore titolo conoscitivo, nella provincia di Torino, nel periodo 1993-98, sono stati riscontrati 1061 casi di tumori maligni delle vie aero-digestive superiori, nel sesso maschile, e 260 casi nel sesso femminile; parallelamente la mortalità è stata di 430 casi nel sesso maschile e 101 casi nel sesso femminile.
La Tabella 2 mostra la prevalenza del cancro laringeo nelle varie regioni italiane.
Tumore della laringe (ICD-9 161) Regione1 Popolazione2 Prevalenza
3
per 100.000 Numero di tumori prevalenti Piemonte 4.297.989 139,6 6.000 Valle d'Aosta 118.456 139,6 165 Lombardia 8.910.451 130,8 11.655 Bolzano 449.055 191,7 861 Trento 459.612 191,7 881 Veneto 4.422.290 191,7 8.478 Friuli Venezia Giulia 1.191.248 191,7 2.284 Liguria 1.663.696 172,2 2.865 Emilia Romagna 3.922.604 160,9 6.312 Toscana 3.526.031 176,2 6.213 Umbria 822.480 176,2 1.449 Marche 1.441.031 176,2 2.539 Lazio 5.193.233 56,2 2.919 Abruzzo 1.267.694 56,2 712 Molise 332.155 56,2 187 Campania 5.745.761 56,2 3.229 Puglia 4.075.802 66,5 2.710 Basilicata 610.699 66,5 406 Calabria 2.076.128 66,5 1.381 Sicilia 5.082.697 66,5 3.380 Sardegna 1.659.466 66,5 1.104 Totale 57.268.578 – 65.729
1 Per il calcolo dei casi prevalenti per Regione sono stati utilizzati i tassi di prevalenza nei
seguenti registri: TO (Piemonte, Val d'Aosta), GE (Liguria), VA (Lombardia), Veneto (Bolzano, Trento, Veneto, Friuli VG), PR+MO+Romagna (Emilia Romagna), FI (Marche, Toscana, Umbria), LT (Lazio, Molise, Abruzzo, Campania), RG (Puglia, Basilicata, Sicilia, Sardegna).
2 Popolazione all'1/1/1995, ISTAT. 3 Anno 1992.
Tabella 2: Prevalenza del tumore della laringe in Italia nel 1995 estratto
da: Micheli A, Francisci S, Krogh V, et al. Cancer Prevalence in Italian Cancer Registry Areas: The ITAPREVAL Study. Tumori, 85: 309-369, 1999.
1.2 FATTORI DI RISCHIO
Una serie di fattori esogeni, che agiscono sia singolarmente sia* soprattutto in associazione, sono stati universalmente riconosciuti come fattori di rischio per lo sviluppo delle neoplasie del distretto testa-collo; in particolare, l’abuso di alcol ed il fumo di sigaretta sono i più importanti (Blot et al., 1988; Vokes et al., 1993; Bonnie,Glisson, 2000).
Nella laringe, ma anche nella cavità orale e nella faringe, l’azione combinata di questi fattori di rischio sembra avere un effetto maggiore della somma dei singoli effetti, con un aumento del rischio relativo da 2 a 140 volte (Maier et al., 1992).
Altri fattori di rischio sono quelli:
¾ occupazionali (per chi lavora nell’edilizia, nella metallurgia, nei settori tessile e ceramico, nelle industrie alimentari e nei trasporti ferroviari) (Boffetta et al., 2003);
¾ correlati a particolari abitudini alimentari;
¾ conseguenti ad infezioni virali ed alle lesioni precancerose (Tumino e Vicario, 2004; Dobrossy, 2005).
Altri ancora, secondo recenti studi, devono essere considerati la gastrectomia (Cianci et al., 2003) ed il reflusso gastro-esofageo (Bacciu et al., 2003), che sarebbero associati ad un incremento del rischio di tumori
del tratto aero-digestivo superiore.
In relazione alla predisposizione genetica la ricerca di base, con studi di biologia molecolare, ha compiuto passi importanti al fine di evidenziare alterazioni del corredo genomico, tali da fare ritenere assai probabile, per alcuni tumori, una predisposizione genetica (Bodnar et al., 1998).
Nella donna, secondo un recente studio, è stato ipotizzato ma non comprovato, che i fattori ormonali hanno un ruolo come fattore di rischio per il cancro della laringe e per quello della cavità orale, della faringe, dell’esofago, dello stomaco e del colon-retto (Gallus et al., 2003).
FUMO DI SIGARETTA
Numerosi studi epidemiologici hanno evidenziato la stretta relazione di causalità esistente tra fumo ed insorgenza di neoplasie. Il fumo di sigaretta, causa ben documentata del cancro del polmone e della vescica, rappresenta anche la causa principale dei tumori maligni del distretto cervico-facciale nei paesi più sviluppati.
La cancerogenicità è attribuibile alla presenza, nella fase corpuscolata e gassosa del fumo di tabacco, di centinaia di sostanze chimiche (IARC, 2003): tra i cancerogeni forti, che sono in grado d’indurre la formazione del tumore in animali da laboratorio, dopo trattamento con dosi
relativamente basse dell’ordine dei microgrammi o milligrammi, si annoverano gli idrocarburi policiclici (es. benzopirene, benzoantracene, e fluoroantracene), le N-nitrosamine e le amine aromatiche che sono presenti in minore quantità (1-200 ng per sigaretta) rispetto ai cancerogeni deboli, come ad esempio l’acetaldeide (vicino a 1 mg per sigaretta) (Wogan et al., 2004). Tali sostanze possono interagire direttamente con il DNA, legandosi specificamente ad alcune basi per formare degli “addotti” di DNA; lo rendono perciò molto instabile, facendo aumentare sia il rischio di rotture cromosomiche in “siti fragili”, sia la comparsa di mutazioni in oncogeni e onco-soppressori (Slebos et al., 1991). Quando queste mutazioni intervengono in regioni cruciali di oncogeni, come RAS e MYC, o in geni soppressori tumorali, come TP53 e CDKN2A (che codifica per p16) (Pfeifer et al., 2002), il risultato è la perdita dei normali meccanismi di controllo della crescita cellulare e dello sviluppo del tumore (Osada et al., 2002).
Il rischio di sviluppare un carcinoma squammoso delle prime vie aero-digestive nei forti fumatori (almeno 20 sigarette al giorno) è stato stimato da 5 a 25 volte superiore rispetto ai non fumatori (Rothman et al., 1980), con una relazione quasi lineare con il numero di sigarette fumate ed il periodo di abitudine al fumo (Franceschi et al., 1990); tale rischio, tuttavia, declina sostanzialmente dopo 3 anni o più dalla sospensione del fumo ma, soltanto dopo circa 10 anni, il rischio si avvicina a quello di chi
non ha mai fumato (Altieri et., 2002).
E’ stato altresì dimostrato che i fumatori di sigarette con filtro presentano un rischio minore (Tuyns et al., 1988) e che, per coloro che fumano il sigaro o la pipa, il rischio è simile o poco più basso per il cancro della laringe, mentre è più elevato per quello del cavo orale, dell’orofaringe e dell’ipofaringe (IARC, 1986).
Anche la masticazione di tabacco costituisce un fattore di rischio, soprattutto per i tumori del cavo orale, seppure in associazione con altri fattori (edentulia, assenza di una corretta igiene dentale, presenza di protesi dentarie). Il tabacco masticato ha un ruolo oncogeno preponderante nei Paesi in via di sviluppo, in particolar modo nel sud-est Asiatico e nell’India, dove è in uso l’abitudine di masticare una mistura di foglie di Betel e di tabacco (Gupta e Ray, 2003; Johnson, 2001).
ALCOL
Dopo il tabacco, il secondo agente responsabile delle neoplasie del distretto cervico-facciale, è il consumo elevato di bevande alcoliche (Poschl e Seitz, 1998, 2004).
La dimostrazione del ruolo cancerogeno del consumo di alcol, come fattore di rischio indipendente, è più complessa di quella del fumo, poiché
l’abitudine all’alcol spesso si associa con il fumo.
Tuttavia, anche se i tumori maligni della testa e del collo in soggetti che non hanno mai fumato sono rari, aumenti modesti di rischio sono stati dimostrati in forti bevitori non-fumatori e che il rischio di tumore è proporzionale alla quantità di etanolo assunta, indipendentemente dal tipo di bevanda alcolica consumata (vino, birra, liquori) (Brugere et al., 1986; Seitz et al., 1998, 2004; Doll et al., 1999; Garavello et al., 2006).
E’ possibile, comunque, considerare soggetti a rischio coloro che assumono ≥500cc di vino al giorno o ≥1000cc di birra al giorno (la metà di queste dosi per le donne) (Scafato, 2004).
E’ stato osservato che, solo dopo vent’anni o più dall’astensione dall’abuso degli alcolici, si ha un decremento del rischio dello sviluppo del cancro della laringe (Bosetti et al., 2002).
L’azione combinata (consumo di alcol e abitudine al fumo) sembra avere un effetto maggiore nel determinare un aumento del rischio di sviluppare queste neoplasie e, soprattutto per il cavo orale e la faringe, l’interazione moltiplicativa tra fumo e alcol, porta nei soggetti che fumano e bevono, a rischi elevatissimi (50-100 volte) (Schoettenfield et al., 1979).
L’alcol è coinvolto in molteplici meccanismi patogenetici che possono condurre allo sviluppo del cancro: in particolare può avere un effetto locale e agendo come solvente sulle mucose, facilita l’ingresso dei composti cancerogeni, specialmente quelli prodotti dalla combustione del
tabacco.
In aggiunta il consumo cronico di alcol è responsabile dell’atrofia del parenchima delle ghiandole parotidi e sottomascellari, che porta alla diminuizione funzionale del flusso salivare e all’aumento della sua viscosità; la superficie delle mucose di conseguenza, non più sufficientemente umidificata, è quindi esposta ad una più alta concentrazione di cancerogeni e per un tempo più prolungato (Maier et al., 1994).
In passato inoltre, vari tipi di bevande alcoliche contenevano composti cancerogeni come idrocarburi policiclici, fibre di asbesto e nitrosamine, che ora sono stati completamente eliminati (Seitz et al., 1998)
Altri meccanismi cancerogenetici includono l’effetto dell’acetaldeide (AA), l’induzione del citocroma P4502E1 (CYP2E1), la modulazione della rigenerazione cellulare e le carenze nutrizionali (Poschl et al., 2004). Il più importante tra questi meccanismi cancerogenetici riguarda l’acetaldeide, il primo metabolita dell’ossidazione dell’etanolo, altamente tossico, mutageno e cancerogeno, che si forma ad opera dell’enzima alcol-deidrogenasi-NAD-dipendente nel citoplasma degli epatociti.
L’acetaldeide interferisce in molti punti della sintesi del DNA e dei processi di riparazione e può, di conseguenza, portare allo sviluppo del tumore. Diversi esperimenti in vitro ed in vivo dimostrano la sua capacità mutagena: causa mutazioni puntiformi a livello del locus genetico della
ipoxantina-guanina fosforibosil-transferasi dei linfociti umani, induce scambi tra cromatidi fratelli e gravi aberrazioni cromosomiche (Obe et al., 1986; Dell’arco, 1988; Helander et al., 1991).
Il suo legame al DNA, nella formazione degli addotti instabili, rappresenta uno dei meccanismi attraverso i quali l’acetaldeide potrebbe iniziare l’evento di replicazione degli errori e/o delle mutazioni in oncogeni o geni soppressori tumorali (Fang et al., 1995).
L’acetaldeide, inoltre, inibisce l’O6-metalguanosina-metil-transferasi, un enzima importante per la riparazione degli addotti, prodotti da agenti alchilanti (Espina et al., 1988).
Infine il consumo cronico di alcol porta all’induzione del citocromo P4502E1, che non solo metabolizza l’etanolo ad acetaldeide, ma è coinvolto anche nella generazione di specie reattive dell’ossigeno e nel metabolismo di vari xenobiotici inclusi i procancerogeni ( nitrosamine, aflatossina, idrocarburi policiclici, idrazine) (Seitz et al., 1998).
Per quanto riguarda lo stato nutrizionale, esso risulta essere, negli alcolisti, seriamente danneggiato: il deficit di vitamine (Seitz et al., 2002), di acido retinoico, di folati (Crabb et al., 2001; Poschl et al., 2004), di ferro, di zinco e di selenio (Seitz et al., 1998) potrebbe contribuire al processo di cancerogenesi. In particolare la mancanza di folati, dovuta ad una minore assunzione di cibo e alla loro distruzione ad opera dell’acetaldeide, è comune nei forti bevitori di alcolici e contribuisce
all’inibizione della transmetilazione: un importante fattore nella regolazione dei geni implicati nella cancerogenesi.
L’alcol ha un notevole impatto sulla capacità di metilazione del DNA, come risulta dalla diminuzione dei livelli di S-Adenosilmetionina, importante donatore di gruppi metile, con conseguente ipometilazione e sovraespressione di oncogeni.
FATTORI VIRALI
Mentre non sussiste alcun dubbio sul ruolo causale dell’infezione da papilloma virus umano (HPV) nella patogenesi dei carcinomi squammosi dell’area genitale, risulta ancora da definire il suo contributo nella cancerogenesi del distretto cervico-facciale.
Circa il 99% dei carcinomi della cervice uterina ed il 20% dei carcinomi laringei risulta associato ad infezione da HPV (Poljak et a., 1997).
Se la prevalenza stimata di infezione da HPV della mucosa orale di individui adulti non affetti da neoplasia è del 40-45%, solo una quota molto bassa degli HPV infetti svilupperà una neoplasia del cavo orale (Jenison et al., 1990). La presenza di HPV di siero-tipo 16 e 18, ad alto rischio oncogeno, è stata dimostrata nei carcinomi squamocellulari del cavo orale, della lingua, della faringe, della tonsilla e del seno mascellare.
Studi in vitro hanno mostrato la capacità dell’HPV, tipo 16, di immortalizzare cheratinociti orali umani (Park et al., 1991); tramite la tecnica di amplificazione genica (PCR), è stato possibile dimostrare la presenza di DNA dell’HPV nel 95% dei campioni di tumore del cavo orale (Woods et al., 1993) e della laringe (Almadori et al., 1995; Sugar et al., 1997).
Inoltre studi recenti dimostrano che l’HPV risulta essere un carcinogeno necessario ma, fra tutti coloro che sono affetti da tumore della testa e del collo e risultano positivi all’HPV, solo pochi casi esprimono gli oncogeni virali (E6 e E7); si deduce pertanto che l’HPV risulta essere un carcinogeno solo per una piccola proporzione di carcinomi del distretto testa-collo (Ragin et al., 2007).
FATTORI DIETETICI
Sebbene il fumo di sigaretta e l’abuso di alcol siano i due fattori di rischio determinanti nel favorire l’insorgenza del cancro della laringe (IARC 1986; IARC 1988), è stato supposto un ruolo importante anche per la dieta (Soler, 2001).
Dati epidemiologici suggeriscono un possibile ruolo protettivo dei carotenoidi, della frutta fresca e dei vegetali introdotti con la dieta e
un’associazione inversamente proporzionale tra consumo di frutta e verdura ed incidenza di neoplasia del distretto testa-collo.
Secondo uno studio condotto, tra il 1992 ed il 2000, in Italia (provincie di Milano e Pordenone) e Svizzera (cantone Vaud), si è visto che la dieta di fibre può proteggere contro il cancro della laringe, a seconda dell’età, del sesso, della quantità di fumo di sigaretta inalato, della quantità di alcol assunta, dell’eccessiva assunzione di calorie e del BMI (Body Massa Index) (Bosetti et al., 2003).
Attraverso vari possibili meccanismi biologici, le fibre vegetali possono ridurre l’assorbimento glicemico e migliorare la sensibilità all’insulina, influenzando favorevolmente quest’ultima come fattore di crescita (IGF-1), che è un promotore del processo di carcinogenesi nei vari stadi (Garavello et al., 2006).
E’ stata osservato un ruolo ridotto di protezione delle fibre del grano nel rischio del cancro laringeo, che potrebbe essere spiegato per la maggiore raffinazione di questo cereale, altamente consumato dalla popolazione presa in esame. I cereali raffinati sono poveri di fibre (particolarmente di fibre insolubili) (Slavin e Potter, 1999) e questo può essere correlato direttamente al rischio di sviluppo tumorale: l’azione potenziale promossa dall’amido (Giovannucci, 1995) potrebbe sopprimere qualsiasi azione protettiva delle fibre vegetali. Lo stesso studio ha rilevato anche un’associazione positiva per le proteine di origine animale e colesterolo,
mentre al contrario è stata osservata una relazione inversa per gli zuccheri.
Non è stata osservata una relazione significativa con l’assunzione totale di grassi, sebbene ci fosse un'indicazione che i grassi monoinsaturi, principalmente acido oleico (Lipworth et al., 1997), potrebbero favorire il rischio di cancro della laringe, in percentuale maggiore rispetto ad altri tipi di acidi grassi.
FATTORI OCCUPAZIONALI
Molti studi sono stati eseguiti per stabilire se esiste una compartecipazione di fattori lavorativi nella determinazione della patologia neoplastica.
E’ stato rilevato che, fra le categorie più a rischio, devono essere inclusi gli addetti ai trasporti stradali e ferroviari, i lavoratori d’industrie siderurgiche, metalmeccaniche, tessili, chimiche, conciarie, cartiarie perché soggetti all’esposizione di sostanze come nickel, amianto, asbesto, polveri del legno, olii grassi, arsenico, cromo, ferro, gas, amine aromatiche, mostarde azotate, alcol isopropilico, fumi di motori a combustione interna (Moffetta et al., 2003).
le amine aromatiche e con il legno (duro); é utile ricordare che nella regione Piemonte, unica in Italia dove esiste un Osservatorio sui tumori professionali, dal 1995 al 2001 sono stati rilevati circa 18.000 casi di tumori maligni professionali e, per quanto attiene le vie aero-digestive superiori, risultano, ad esempio, 700 casi in sede laringea, 600 nel cavo orale ed oltre 400 localizzati a livello naso-sinusale.
LESIONI PRECANCEROSE
Con il termine di “precancerosi” si definiscono alcune alterazioni morfologiche delle mucose delle vie aero-digestive superiori (leucoplasia cordale, displasia, papillomatosi, pseudopolipi), che presentano un rischio di degenerazione maligna superiore a quella della mucosa “normale”(Frangez et al., 1997).
Il concetto di “precancerosi” presuppone che le forme invasive siano precedute, attraverso varie fasi, talora clinicamente asintomatiche, da un graduale processo di trasformazione cellulare in senso maligno, sotto l’azione degli agenti carcinogenetici.
In effetti la carcinogenesi è un processo a scalini, con differenti tappe di trasformazione, prima di giungere alla condizione di carcinoma francamente invasivo: molte delle trasformazioni che si verificano in
questo processo sarebbero controllabili ed addirittura reversibili, rimovendo i presunti fattori promuoventi (ad es.: astensione da fumo e alcol, dieta equilibrata) e grazie all’ausilio di prodotti inibitori della carcinogenesi (chemoprevenzione).
1.3 CLASSIFICAZIONE
A livello laringeo, l’istotipo tumorale maligno più frequente (97% dei casi) è il carcinoma a cellule squammose, che può presentarsi nella forma:
¾ vegetante, con aspetto esofitico, spesso facilmente sanguinante;
¾ infiltrante, con tendenza ad interessare in profondità i tessuti laringei;
¾ ulcerata, di cui costituisce, in un certo senso, l’inevitabile evoluzione;
meno comuni sono invece l’adenocarcinoma e i sarcomi (fibrosarcoma, rabdomiosarcoma, condrosarcoma, leiomiosarcoma, emangiosarcoma e linfoma).
Le localizzazioni metastatiche di neoplasie insorte in altri distretti come rene, prostata, ghiandola mammaria, melanomi cutanei o mucosi sono occasionali; più frequente è la diffusione-invasione della laringe da parte di carcinomi insorti nella ghiandola tiroide.
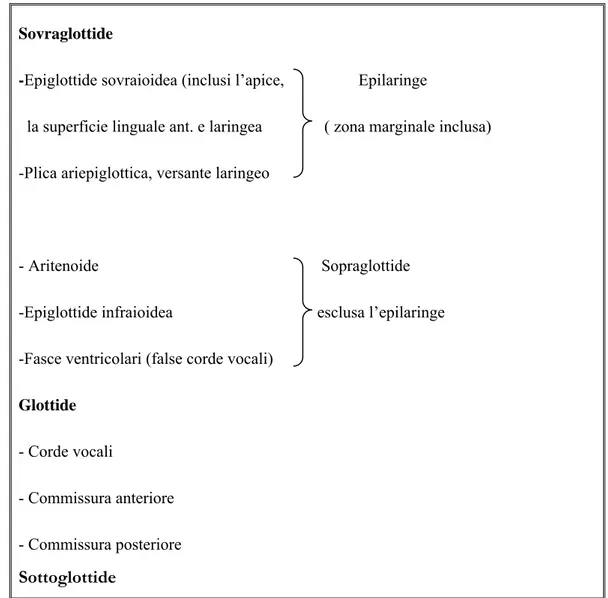
Da un punto di vista topografico la laringe viene suddivisa in sedi e sottosedi (Tabella 3).
Sovraglottide
-Epiglottide sovraioidea (inclusi l’apice, Epilaringe
la superficie linguale ant. e laringea ( zona marginale inclusa) -Plica ariepiglottica, versante laringeo
- Aritenoide Sopraglottide
-Epiglottide infraioidea esclusa l’epilaringe -Fasce ventricolari (false corde vocali)
Glottide - Corde vocali
- Commissura anteriore - Commissura posteriore Sottoglottide
Tabella 3. Suddivisione topografica della laringe secondo l’Organizzazione Mondiale della Sanità.
La laringe è uno degli organi, cui meglio si applica la classificazione TNM dei tumori maligni, formulata dalla Unione Internazionale Contro il Cancro (UICC); la cui più recente revisione (VI edizione, 2002), presenta delle differenze rispetto a quella precedente (1997) relative a T3 e T4 della regione sovraglottica (tabella 4).
La classificazione UICC si è rivelata di estrema utilità per i confronti tra le diverse casistiche cliniche, per la formulazione di una prognosi e per la pianificazione di protocolli terapeutici.
Tabella4. CLASSIFICAZIONE TNM DEI TUMORI EPITELIALI MALIGNI DELLA LARINGE SECONDO UICC. AJCC Cancer Staging Manual, Sixth Edition
(2002)
Tumore primitivo (T)
TX Il tumore primitivo non può essere identificato T0 Non evidenza di tumore primitivo
Tis Carcinoma in situ
Sovraglottide
T1 Tumore limitato ad una sottosede della sovraglottide con normale motilità cordale
T2 Tumore che invade la mucosa di più di una sottosede adiacente della sovraglottide o della glottide o di regione al di fuori della sovraglottide (ad es.,mucosa della base lingua, vallecula, parete mediale del seno piriforme) senza fissità della laringe
T3 Tumore limitato alla laringe con fissità della corda vocale e/o che invade una delle seguenti: area retrocricoidea, tessuti pre-epiglottici, spazio paraglottico, e/o erosione minore della cartilagine tiroidea (ad es., pericondrio interno)
T4a Tumore che invade la cartilagine tiroidea e/o che invade tessuti vicini alla laringe (ad es., trachea, tessuti molli del collo compresa la muscolatura estrinseca profonda della lingua, i muscoli prelaringei, tiroide, esofago)
T4b Tumore che invade lo spazio prevertebrale, infiltra l’arteria carotide o invade strutture mediastiniche
Glottide
T1 Tumore limitato alla/e corda/e vocale/i (può interessare la commissura anteriore o posteriore) con normale motilità cordale
T1a Tumore limitato ad una corda vocale
T1b Tumore che coinvolge entrambe le corde vocali
T2 Tumore esteso alla sovraglottide e/o sottoglottide, e/o con motilità cordale compromessa
T3 Tumore limitato alla laringe con fissità della corda vocale e/o che invade lo spazio paraglottiide e/o erosione minore della cartilagine tiroidea (ad es., pericondrio interno)
T4a Tumore che invade la cartilagine tiroidea e/o che invade tessuti vicini alla laringe (ad es., trachea, tessuti molli del collo compresa la muscolatura estrinseca profonda della lingua, i muscoli prelaringei, tiroide, esofago)
T4b Tumore che invade lo spazio prevertebrale, infiltra l’arteria carotide o invade strutture mediastiniche
Sottoglottide
T1 Tumore limitato alla sottoglottide
T2 Tumore esteso alla corda/e vocale/i con motilità cordale normale o compromessa
T3 Tumore limitato alla laringe con fissità della corda vocale
T4a Tumore che invade la cartilagine cricoidea o tiroidea e/o che invade tessuti vicini alla laringe (ad es., trachea, tessuti molli del collo compresa la muscolatura estrinseca profonda della lingua, i muscoli prelaringei, tiroide, esofago)
T4b Tumore che invade lo spazio prevertebrale, infiltra l’arteria carotide o invade strutture mediastiniche
Linfonodi regionali (N)
NX I linfonodi regionali non possono essere identificati
N0 Non evidenza di metastasi linfonodali regionali
N1 Metastasi in un singolo linfonodo omolaterale, di dimensioni inferiori o uguali a 3 cm.
N2 Metastasi in un singolo linfonodo omolaterale, di dimensioni comprese tra 3 6 cm., o in più linfonodi ipsilaterali di dimensioni inferiori a 6 cm., o in linfonodi bilaterali o controlaterali di dimensioni inferiori a 6 cm.
N2a Metastasi in un singolo linfonodo omolaterale, di dimensioni comprese tra 3 e 6 cm
N2b Metastasi in più linfonodi ipsilaterali di dimensioni inferiori a 6 cm.
N2c Metastasi in linfonodi bilaterali o controlaterali di dimensioni inferiori a 6 cm.
N3 Metastasi in un linfonodo di dimensioni superiori a 6 cm.
Metastasi a distanza (M)
MX Le metastasi a distanza non possono essere identificare
M0 Non evidenza di metastasi a distanza
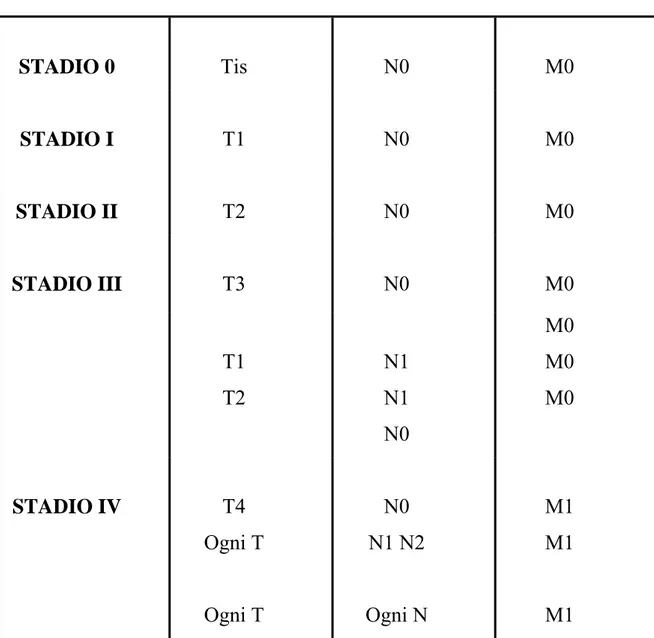
La combinazione del grado di T e del grado di N e M permette successivamente di classificare i tumori laringei in stadi da I a IV
(tabella 5) STADIO 0 Tis N0 M0 STADIO I T1 N0 M0 STADIO II T2 N0 M0 STADIO III T3 N0 M0 T1 T2 N1 N1 N0 M0 M0 M0 STADIO IV T4 Ogni T Ogni T N0 N1 N2 Ogni N M1 M1 M1
1.4 CLINICA
La sintomatologia del cancro laringeo, che può essere precocissima o molto tardiva, è in rapporto inizialmente con la sua sede di insorgenza e successivamente con il suo accrescimento e con le modalità di diffusione. Esistono casi molto rari in cui il primo sintomo è rappresentato da un’adenopatia metastatica; di solito la sintomatologia iniziale è costituita dalla disfonia e/o dalla dispnea.
La disfonia, espressione della pertubazione della funzione fonatoria, è spesso il primo sintomo a comparire; nelle forme cordali, insorge con carattere ingravescente e persistente non appena il cancro comincia a farsi evidente e si traduce nell’emissione di una voce con timbro legnoso, duro, che fa definire questo tipo di disfonia come sclerofonia.
Il meccanismo che porta a questa disfunzione può variare da caso a caso e può dipendere da:
¾ un incompleto affrontamento dei margini liberi delle corde vocali per la presenza di neoformazioni a questo livello;
¾ parziale occupazione del lume glottico, per lo più da parte di vegetazioni neoplastiche che scendono dalla regione sopraglottica; ¾ infiltrazione neoplastica del muscolo vocale oppure della articolazione crico-aritenoidea;
di una massa neoplastica sopraglottica che si appoggia per gravità sul piano glottico, senza comprometterne l’integrità anatomica.
Nelle neoplasie sopra o sottoglottiche invece, la disfonia si manifesta solo nelle fasi tardive e quasi sempre come espressione della diffusione neoplastica a livello cordale oppure dell’ingombro meccanico della glottide.
La dispnea, al contrario della disfonia, è un sintomo tardivo, espressione dell’ostruzione del lume laringeo, operato dalla massa tumorale stessa e dall’accumulo di secrezioni, oppure dall’immobilizzazione delle corde vocali. La dispnea può costituire il primo sintomo delle neoplasie a sede ipoglottica.
La dispnea provocata dal carcinoma laringeo, in genere, è a lungo tollerata dal paziente, poiché l’ostruzione delle vie aeree si realizza in modo lento e progressivo; non di rado però, la situazione può scompensarsi rapidamente, dando origine ad una sintomatologia dispnoica acuta, in particolare a seguito dell’intervento di processi infiammatori edemigeni oppure di manipolazioni strumentali effettuate sulla laringe.
La disfagia è tutt’altro che costante nel carcinoma laringeo, rappresentando spesso il primo sintomo delle neoplasie che si sviluppano
nelle regioni marginali della laringe. Tale sintomo è invece specifico delle lesioni interessanti la base della lingua, la regione retrocricoidea, i seni piriformi e la regione faringea posteriore.
Secondo i casi, il paziente potrà lamentare sensazione di difficoltà alla deglutizione dei cibi, oppure dolore associato all’atto della deglutizione stessa (odinofagia, spesso associata ad otalgia riflessa). In quest’ultimo caso il sintomo può esprimere l’avvenuto interessamento di strutture extralaringee (base linguale, regione retrocricoidea) oppure l’andamento infiltrativo-ulcerativo della neoplasia. Non di rado l’odinofagia si sovrappone ad una costante faringodinia, di entità di volta in volta variabile dalla semplice sensazione di “ripienezza della gola”, al dolore trafittivo ed intenso.
Tra i sintomi precoci del carcinoma laringeo, deve essere inclusa anche la comparsa di linfoadenopatie laterocervicali, che possono precedere l’insorgenza dei più caratteristici sintomi.
Tra i sintomi tardivi delle lesioni ipoglottiche e dei voluminosi tumori sopraglottici dobbiamo infine includere l’emoftoe.
La tosse, il calo ponderale e l’alitosi completano l’elenco delle possibili manifestazioni sintomatologiche del carcinoma della laringe (Alajmo, 1995).