3. EMBRIOGENESI
3.1 EMBRIOGENESI ZIGOTICA
3.1.a Ciclo ontogenetico e differenziazione del gametofito
femminile
Nelle piante il più comune ciclo ontogenetico è quello con meiosi intermedia (organismi aplodiplobionti). Lo zigote, che rappresenta il prodotto della fusione dei gameti, da inizio alla generazione diploide e, per mitosi, origina l’embrione ovvero lo sporofito. Quest’ultimo, per meiosi, produce le spore aploidi, che formano per mitosi l’aplofito definito comunemente gametofito (D’Amato et al., 1987; Gerola, 1995). Il passaggio evolutivo dalle pteridofite alle fanerogame ha determinato il mantenimento sullo sporofito delle macrospore e dei loro prodotti. Questo cambiamento ha permesso l’indipendenza del processo fecondativo dall’ambiente liquido e lo sviluppo dell’embrione nel seme, organo di propagazione e conservazione (Cappelletti, 1975; Ray et al., 1983; Raven et al., 1984; Gerola, 1995). Il macrosporangio delle fanerogame è l’ovulo che si trova all’interno di cavità ovariche originate dalla fusione dei margini di foglie carpellari. L’ovulo è costituito da tessuti vegetativi quali la nocella e i tegumenti. La nocella contiene la cellula madre delle megaspore che per meiosi produce quattro megaspore. Di norma, soltanto la più profonda germina e forma, con tre successive divisioni nucleari, il gametofito femminile, ottonucleato, frequentemente chiamato sacco embrionale anche se tale definizione è filogeneticamente impropria (Cappelletti, 1975) (Fig 3.1).
a)
b)
Fig 3.1: Sviluppo del sacco embrionale (a) e del seme (b) in una Angiosperma.
Una volta formato, il gametofito si espande a spese della nocella mentre i nuclei assumono una dislocazione spaziale ben precisa. Quattro nuclei migrano verso il micropilo e formano l’apparato ovarico, all’estremità opposta (calaza) i restanti nuclei danno origine all’apparato antipodale. Dopo che i due apparati si sono formati, avviene il processo di cellularizzazione. A livello dell’apparato ovarico, ben presto si distinguono le due sinergidi e, poco più in basso, l’oosfera. Dei quattro nuclei originari, l’unico intorno al quale non si forma la parete cellulare si sposta verso il centro della cavità per dare il nucleo polare superiore. Alla calaza i processi sono perfettamente speculari e producono tre cellule antipodali, ed al centro il nucleo polare inferiore. I due nuclei polari (superiore ed inferiore) generalmente si fondono a formare il nucleo secondario diploide (2n) dell’endosperma.
3.1.b Fecondazione e sviluppo dell’embrione
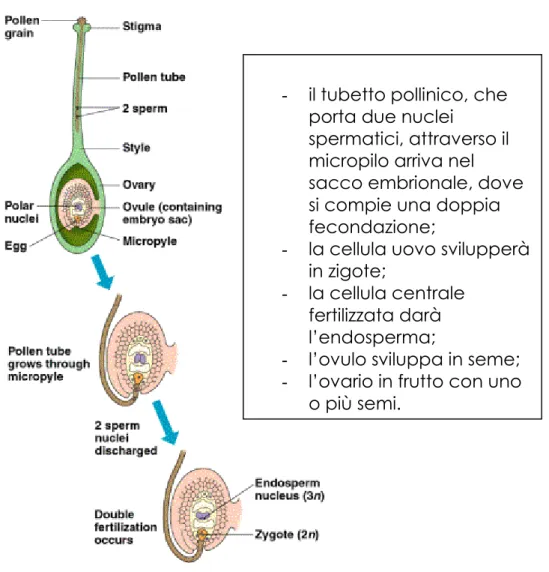
Le Angiosperme sono caratterizzate da una doppia fertilizzazione che origina contemporaneamente lo zigote e l’endosperma (Fig. 3.2). Il gametofito maschile è costituito da due nuclei aploidi che al momento della fecondazione si uniscono rispettivamente alla oosfera ed al nucleo secondario dell’endosperma (Cappelletti, 1975; Ray et al., 1983; Gerola, 1995).
- il tubetto pollinico, che porta due nuclei
spermatici, attraverso il micropilo arriva nel sacco embrionale, dove si compie una doppia fecondazione;
- la cellula uovo svilupperà in zigote;
- la cellula centrale fertilizzata darà l’endosperma;
- l’ovulo sviluppa in seme; - l’ovario in frutto con uno
o più semi.
Fig. 3.2 : Doppia fertilizzazione nelle Angiosperme.
La cellula zigotica diploide (2n) va incontro ad una serie di divisioni controllate e ad eventi di differenziamento che portano alla formazione
di un embrione. L’endosperma secondario ha una natura triploide (3n) e una funzione essenzialmente trofica. La fertilizzazione comporta, di norma, la trasformazione dell’ovulo in seme e dell’ovario in frutto. Da un punto di vista descrittivo l’embriogenesi può essere suddivisa in tre principali fasi:
(i) postfertilizzazione;
(ii) transizione dallo stadio globulare a quello a cuore;
(iii) espansione degli organi fino a maturazione (Goldberg et al., 1994; Purves et al., 2001; Srivastava, 2001; Lo Schiavo, 2003).
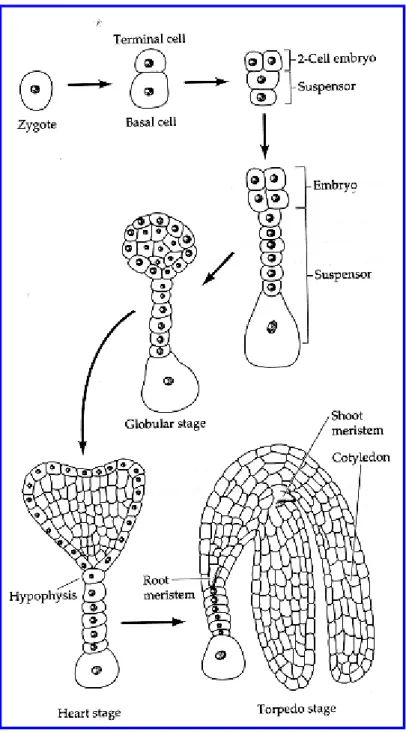
Nello zigote appena formato, così come nella oosfera, si nota una distribuzione asimmetrica dei componenti cellulari. Nella regione superiore della cellula ritroviamo il nucleo e la maggior parte del citoplasma, mentre nella regione inferiore è contenuto un largo vacuolo. A questa polarizzazione cellulare fa seguito una prima mitosi asimmetrica che determina la formazione di una cellula basale più grande ed una apicale più ridotta nelle dimensioni (Hyman e Stearns, 1992). La prima cellula è destinata a formare il sospensore, mentre dalla seconda differenzierà l’embrione (Fig. 3.3).
Fig 3.3: Successione delle divisioni e distensioni cellulari che portano alla formazione dell’embrione partendo dallo zigote, attraversando gli stadi globulare, a cuore, a torpedine e cotiledonare.
Il sospensore, che si forma attraverso divisioni cellulari trasversali, è un cordone di cellule trofiche che degenera con il tempo. Dalla piccola cellula apicale mediante successive divisioni mitotiche si differenzia un embrione che attraversa i seguenti stadi di sviluppo: globulare, a cuore, a torpedine e cotiledonare. Nel corso di questa successione di stadi,
progressivamente acquisire una simmetria bilaterale lungo l’asse apicale-basale per effetto dello sviluppo dei due cotiledoni. Il primo evento di differenziazione cellulare si verifica allo stadio embrionale di 16 cellule con la comparsa del protoderma e, successivamente, del procambio nella zona interna e del meristema fondamentale in posizione intermedia (Cary et al., 2002). Lo sviluppo morfologico, che conduce allo stadio cotiledonare, presuppone una serie di mitosi differenziali e distensioni cellulari, ma non prevede eventi di migrazione cellulare, essenziali invece nell’embriologia animale. In seguito, si ha la vera e propria fase di maturazione nella quale s’instaurano eventi istologici e biochimici che portano all’accumulo di proteine e lipidi, e successivamente alla dormienza (Bewley et al., 2003). Quest’ultima evita la precoce germinazione dell’embrione e comporta sia una drastica riduzione della trascrizione genica, sia la disidratazione dei tessuti. A maturità, nell’embrione si distingue una zona radicale inferiore, una centrale che darà l’ipocotile ed una terminale caratterizzata dai cotiledoni. All’accrescimento dell’embrione di norma si accompagna il progressivo esaurimento dell’endosperma e la digestione degli strati nocellari.
3.1.c Regolazione genica ed embriogenesi zigotica
Gli embrioni delle piante sono morfologicamente semplici, ma molecolarmente molto complessi considerando che una sorprendente quantità di geni è coinvolto nel loro sviluppo. E’ stato stimato che in Nicotiana tabacum circa ventimila geni sono trascritti negli embrioni, numero analogo ai geni attivi anche in organi di piante ben differenziate (Howell, 1998). I geni che sono trascritti con modalità stadio-dipendente non sono, quantitativamente elevati, ma il loro ruolo appare estremamente importante (Srivastava, 2001). Questa caratteristica è propria del mondo vegetale poiché negli animali il “pattern” di espressione diventa progressivamente più complesso man
mano che procede lo sviluppo. Studi molecolari sul sistema modello Arabidopsis thaliana hanno fornito informazioni sugli specifici programmi di trascrizione genica associati ai vari stadi di sviluppo dell’embrione zigotico. A tale proposito, particolarmente utili sono risultate alcune categorie di mutanti tra cui i letali e i difettivi per la specificazione dell’asse di sviluppo apicale-basale e/o radiale (Howell, 1998). Nelle piante, a differenza di quanto accade negli animali, cellule somatiche possono originare in vivo e/o in vitro nuovi embrioni e questa potenzialità ha fatto ipotizzare una scarsa importanza del ruolo materno nel processo embriogenetico. Viceversa, una serie di dati sperimentali avvalora l’importanza dell’eredità materna (Laux et al., 2004). Ad esempio, mutanti caratterizzati dalla deficienza del gene DICER-LIKE1 (DCL1) non sono capaci di sviluppare embrioni zigotici vitali (Golden et al., 2002). Questo gene ha sede nucleare e codifica per piccole molecole di RNA con un ruolo di silenziamento genico. Si ritiene che queste molecole, prodotte nei tessuti materni, siano implicate direttamente o indirettamente nello sviluppo embrionale. E’ stato inoltre accertato che il gene MEDEA (MEA), il quale codifica per una proteina di tipo “polycomb”, ha un ruolo essenziale per una normale embriogenesi soltanto quando è trasmesso per via femminile. Si ritiene che il ruolo di questo gene sia la repressione della trascrizione di geni di tipo “MADS box” (Kohler et al., 2003). Un aspetto essenziale della regolazione genica dell’embriogenesi zigotica è il controllo che alcuni geni hanno nello specificare la formazione dell’asse apicale basale (Leyser e Day, 2003). E’ importante sottolineare che l’origine dell’asse apicale-basale può essere ricondotta allo zigote e, addirittura, all’oosfera poiché in entrambe i due tipi cellulari sono presenti mRNA codificanti fattori di trascrizione quali HOMEOBOX2 (WOX2) e WOX8 (Haecher et al., 2004). Il primo determina il destino del dominio apicale mentre il secondo ha un ruolo specifico per la parte basale dell’embrione; la divisione asimmetrica dello zigote sembra servire anche alla separazione spaziale dei relativi mRNA. Essenziali per la formazione dei meristemi apicali
caulinari e radicali che definiscono l’asse embrionale risultano i geni SHOOTMERISTEMLESS (STM) e SHORT ROOT (Dilaurenzio et al., 1996; Long et al., 1996; Mayer et al., 1998; Helariutta et al., 2000).
I diversi processi di embriogenesi nelle piante condividono un controllo ormonale basato su tre classi principali: auxina, acido abscissico (ABA) e gibberelline (GA). In particolare, la determinazione di domini polarizzati di accumulo dell’auxina risulta fondamentale per la morfogenesi embrionale (Steinmann et al., 1999; Geldner et al., 2003). In tale ambito i geni della famiglia PIN-FORMED (PIN), che codificano per proteine di trasporto in uscita dell’auxina, svolgono un ruolo chiave determinando la polarità del flusso ormonale nelle cellule dell’embrione in formazione (Friml et al., 2002, 2003; Dhonukshe et al., 2008). Fra di essi, PINFORMED7 (PIN7), espresso in modo asimmetrico nelle cellule figlie dello zigote, si ritiene che abbia il compito di favorire il movimento auxinico verso la cellula apicale. E’ dunque probabile che WOX2 e PIN7 siano fondamentali per definire, in un momento estremamente precoce, l’identità apicale (Laux et al., 2004). Successivamente, a partire dalle prime fasi dello stadio globulare, è evidente la localizzazione polarizzata di PIN1 nelle cellule basali (Steinmann et al., 1999). Queste specifiche localizzazioni delle proteine PIN correlano con un massimo di concentrazione dell’auxina nella cellula apicale dopo la prima divisione dello zigote e una rilocazione dell’ormone nelle cellule basali nello stadio globulare.
La mutazione del gene GNOM, che codifica per una brefeldina A richiesta per il riciclo di PIN1 fra la membrana plasmatica e l’endosoma, determina una divisione simmetrica dello zigote e ciò ha considerevoli conseguenze per lo sviluppo dell’embrione. Infatti, mentre la cellula figlia basale produrrà un sospensore di aspetto normale, la cellula apicale si divide in modo non coordinato e l’embrione risulta variamente deforme (Howell, 1998). Nelle fasi più tardive dello stadio globulare, PIN4 localizzandosi nella cellula più apicale del sospensore determina un massimo di accumulo di auxina indispensabile per la corretta formazione
dell’apice radicale (Friml et al., 2002, 2003). Con la perdita dell’attività di membri della famiglia PIN si può generare la comparsa di fenocopie del mutante gnom risultando alterato il meccanismo di endocitosi con accumulo di auxina nella regione apicale dell’embrione e cambiamento del destino delle cellule deputate allo sviluppo dei cotiledoni (Dhonukshe et al., 2008).
Ai fini di una corretta polarità apicale-basale, è successivamente essenziale la specificazione di una identità meristematica in posizione apicale tra i due cotiledoni. Probabilmente, il primo segnale molecolare è l’attivazione del gene WUSCHEL (WUS) in quattro cellule subepidermiche di embrioni globulari allo stadio di 16 cellule (Mayer et al., 1998). Entrando in mitosi questo piccolo gruppo di cellule garantisce un dominio di espressione di WUS necessario per l’attività, nell’embrione maturo, sia di CLAVATA3 (CLV3), sia di STM. I tre geni sono intimamente correlati nel mantenere perfettamente funzionale il meristema del germoglio per l’intera vita della pianta (Leyser e Day, 2003). Nel passaggio dallo stadio globulare a quello di cuore, la simmetria radiale dell’embrione è sostituita dalla simmetria bilaterale e a livello molecolare è fondamentale l’espressione dei geni CUP-SHAPED COTYLEDON1 (CUC1), CUC2 e CUC3 che hanno lo scopo di reprimere le divisioni mitotiche nella zona centrale e al contempo, di consentire la separazione dei due primordi cotiledonari (Aida et al., 1999). E’ interessante sottolineare che l’area precocemente interessata dall’espressione di CUC1 e CUC2 è una sottile banda di cellule che divide la porzione apicale dell’embrione in un dominio mediano e due domini laterali ove si verificherà la differenziazione dei cotiledoni (Laux et al., 2004). Le caratteristiche istologiche di espressione dei geni CUC e la loro funzione dipende comunque dai geni MONOPTEROS (MP) e PIN1, entrambi implicati nella risposta cellulare all’auxina (Aida et al., 2002). Per quanto riguarda la determinazione del dominio basale dell’embrione, possiamo ricordare che, allo stadio globulare, l’ipofisi subisce una divisione cellulare asimmetrica che determina la formazione
di una cellula superiore di aspetto lenticolare ed una cellula più basale. La prima cellula è destinata a formare il centro di quiescenza del futuro apice meristematico radicale mentre la seconda produrrà le cellule della columella. A livello molecolare è stato accertato che l’espressione dei geni SCARECROW (SCR) e WOX5 sono i marcatori della prima fondamentale divisione asimmetrica dell’ipofisi (Haecker et al., 2004). Nel mutante hobbit (hbt) l’ipofisi si divide in modo abnorme e questo si riflette in un difettivo sviluppo dell’apice meristematico radicale (Leyser e Day, 2003). Il ruolo dell’auxina è importante anche per la localizzazione spaziale dell’apice radicale: in particolare, l’esatto posizionamento sembra dipendere dal punto di massimo accumulo di auxina. Nel mutante mp il mancato sviluppo dell’apice radicale dipende proprio da un deficiente flusso di auxina secondo l’asse apicale-basale (Howell, 1998). Nelle fasi tardive dell’embriogenesi si attiva un complesso programma di maturazione che deve preparare l’embrione alla dormienza e poi allo sviluppo post-embrionale (Bewley et al., 2003). In questa fase, l’ABA ha un ruolo essenziale ed, i genotipi incapaci di sintetizzarlo o insensibili all’ormone non completano la maturazione e sviluppano embrioni non dormienti.
- I geni LEAFY COTYLEDON (LEC) sono regolatori centrali dell’embriogenesi
Una caratteristica distintiva dei geni LEAFY COTYLEDON (LEC) tra cui LEC1, LEC1-LIKE (L1L), LEC2 e FUSCA3 (FUS3) è di essere attivi sia nella fase morfogenetica sia nella fase di maturazione, dimostrandosi quindi regolatori chiave dell’embriogenesi zigotica. In Arabidopsis, la funzione di alcuni di questi geni, LEC1, LEC2 e FUS3, è stata definita attraverso l’analisi fenotipica di mutanti. Durante la fase morfogenetica, i geni LEC sono richiesti per mantenere l’identità cellulare del sospensore, una struttura embrionale transiente che spinge l’embrione all’interno
dell’endosperma e che si ritiene serva come condotto per i nutrienti e per i fattori di crescita (Meinke e Yeung, 1993). Nei mutanti lec di Arabidopsis, il sospensore, che in questa specie normalmente consiste di una singola fila di sei-otto cellule va incontro ad una serie di divisioni cellulari anomale originando una struttura a più strati cellulari estesi (Lotan et al., 1998). Il sospensore anormale può continuare a proliferare originando embrioni secondari. Sono note altre mutazioni che interferendo con l‘identità cellulare del sospensore conducono a fenomeni di embrionia secondaria (Shwartz et al., 1994; Veron e Meinke, 1994; Yadegari et al., 1994). Sempre nella fase morfogenetica, un’altra funzione dei geni LEC sembra essere il mantenimento dell’identità dei cotiledoni. Le foglie embrionali dei mutanti lec presentano, sulla superficie adassiale, tricomi che, in Arabidopsis, sono caratteristici delle foglie adulte assumendo un fenotipo intermedio tra foglia embrionale normale e foglia adulta (Meinke 1992; Baumlein et al., 1994; Keith et al., 1994; Meinke et al.,1994; West et al., 1994). Tutto ciò avvalora l’ipotesi di un coinvolgimento dei geni LEC nella specificazione dell’identità cotiledonare: in assenza della loro attività i cotiledoni sono specificati in maniera incompleta e tendono ad assumere un fenotipo fogliare.
Altre caratteristiche dei mutanti lec suggeriscono un ruolo di questi geni anche durante la fase di maturazione. Tutti gli alleli conosciuti delle mutazioni lec1 e fus3 causano letalità precoce poiché gli embrioni non sopravvivono alla disidratazione nella fase tardiva di sviluppo del seme, difettando peraltro nella sintesi e nell’accumulo di sostanze di riserva (Keith et al., 1994; Meinke et al.,1994). Gli embrioni lec mostrano alcune caratteristiche tipiche delle plantule e ciò influisce sullo sviluppo post-germinativo che avviene precocemente. Inoltre l’apice meristematico caulinare, che negli embrioni di Arabidopsis è poco attivo, nei mutanti lec si attiva durante l’embriogenesi e lo fa assomigliare molto di più allo stadio post-germinativo che a quello embrionale. L’analisi fenotipica mostra la natura pleiotropica di tali mutazioni, è perciò plausibile che tali
geni controllino molti aspetti distinti e fondamentali dell’embriogenesi (Harada, 1997; 1999; 2001).
Il mutante lec1-1 è revertito al fenotipo normale se ingegnerizzato con HAP3 di “tipo- LEC1”. L’utilizzo di proteine chimeriche in genotipi omozigoti lec1-1, ha inoltre confermato il ruolo nell’embriogenesi del dominio LB e ha permesso di identificare aminoacidi specifici, critici per
la sua attività. La soppressione della mutazione lec1, in piante transgeniche di A. thaliana, si ha solo con l’espressione di costrutti che codificano proteine contenenti il dominio LB, mentre le piante con
proteine chimeriche con i domini A e/o C sempre di “tipo-LEC1” non sono in grado di germinare, esplicitando quindi, che il recupero del fenotipo selvatico nei mutanti avviene solo e soltanto grazie al dominio LB. In particolare, mediante la sostituzione di specifici aminoacidi del
gene LEC1 con quelli conservati nelle medesime posizioni delle HAP3 di “tipo non-LEC1”, è emerso che l’aspartato in posizione 55 è essenziale per l’attività embriogenica dei geni LEC e sufficiente a conferire una parziale attività di tipo LEC ai domini B di “tipo non-LEC1” (Lee et al., 2003).
Il fenotipo delle piante transgeniche che sovraesprimono il gene LEC1 è caratterizzato da una limitata vigoria che si manifesta sia nella parte epigea, che in quella ipogea: le foglie non si espandono, sono prive di tricomi e non hanno un normale complemento in apparati stomatici, mantenendo in pratica caratteristiche tipiche embrionali (Lotan et al., 1998). E’ sorprendente come l’espressione ectopica di LEC1 sia sufficiente ad indurre la formazione di embrioni somatici a partire da cellule vegetative (Lotan et al., 1998). Si può concludere che LEC1 è un gene richiesto per la maturazione dell’embrione e per l’identità cotiledonare, ed è un gene NF-YB con un pattern unico di espressione confinato all’embrione (Lotan et al 1998).
LEC1 presenta l’83% di omologia di sequenza con un altro peptide codificato dal gene LEAFY COTYLEDON1-LIKE (L1L), che in Arabidopsis risulta allo stesso modo necessario per il normale sviluppo embrionale
(Lee et al., 2003; Kwong et al., 2003). L’accumulo dell’mRNA del gene L1L è paragonabile a quello di LEC1, ma presenta alcune importanti peculiarità. L’espressione del gene LEC1 si evidenzia soprattutto in stadi precoci dell’embriogenesi vegetale a livello dell’embrione, del sospensore e dell’endosperma, mentre elevati livelli di mRNA di L1L si riscontrano in stadi più avanzati. Prima dello stadio a torpedine, L1L si esprime a bassi livelli, nell’embrione, nel sospensore e nell’endosperma; la sua espressione, nell’embrione e nei tessuti cellulari più esterni, diviene simile alla distribuzione dei trascritti di LEC1 solo allo stadio cotiledonare (Lotan et al., 1998; Kwong et al., 2003). Contrariamente a LEC1, il gene L1L, anche se a bassi livelli, si esprime in tessuti al di fuori dell’embrione. Dall’analisi fenotipica di mutanti l1l è emerso come questo gene sia essenziale per lo sviluppo embrionale. Il suo silenziamento, mediante tecniche di interferenza ad RNA, causa l’arresto dello sviluppo dell’embrione zigotico già allo stadio globulare (Kwong et al., 2003). Studi funzionali hanno inoltre evidenziato che sebbene i livelli endogeni di mRNA di L1L non possano sostituire completamente la funzione di LEC1, la sua espressione ectopica è sufficiente a complementare la mutazione lec1, inducendo la formazione di embrioni tolleranti alla disidratazione ed in grado di germinare. Il fenotipo delle piante che sovraesprimono L1L, sebbene sia paragonabile a quello descritto nelle piante transgeniche per il gene LEC1, non è tuttavia caratterizzato da fenomeni di epifillia (Kwong et al., 2003).
I dati raccolti in A. thaliana dimostrano che le singole proteine di tipo LEAFY COTYLEDON non hanno in vivo un ruolo del tutto ridondante ed è quindi probabile che ciascuna proteina, pur essendo implicata in modo diretto nella embriogenesi zigotica, presenti anche altri ruoli peculiari. Ciò trova conferma nella presenza di trascritti al di fuori dell’embrione. Al momento sono poco conosciuti i ruoli non direttamente riconducibili all’embriogenesi (Kwong et al., 2003). Alla loro comprensione potrebbe contribuire in modo decisivo l’identificazione delle sequenze bersaglio visto che, complessivamente, i geni citati codificano per fattori di
trascrizione sebbene di diversa natura molecolare (Lotan et al., 1998; Stone et al., 2001; Kwong et al., 2003).
Il gene PICKLE (PKL), che codifica per la subunità di un complesso “Chromodomain Helicase DNA-binding protein 3" (CHD3) (Ogas et al., 1997; Henderson et al., 2004), reprime l’espressione dei geni LEC nei tessuti al di fuori dell’embrione (Ogas et al., 1999); mentre membri della famiglia dei fattori di trascrizione Viviparous1 (VP1)/ABSCISIC ACID INSENSITIVE (ABI3)-LIKE (VAL) funzionano come repressori di LEC1/B3 nei semi in germinazione (Suzuki et al., 2007).
Anche il gene ABI3 risulta fondamentale per lo sviluppo del seme interferendo soprattutto con le fasi finali dello sviluppo embrionale. Nel mutante abi3, caratterizzato da una insensibilità all’ABA, gli embrioni risultano difettivi nella sintesi di specifici mRNA legati ai processi di maturazione e disidratazione (West et al., 1994; Bewley et al., 2003). La sintesi proteica ABA-dipendente è fondamentale per l’acquisizione della tolleranza alla disidratazione, infatti, estremamente importante sembra essere la funzione protettiva che le proteine LEA hanno a carico dei costituenti di parete in condizioni fortemente disidratate quali quelle di un seme maturo. Le proteine codificate dai geni LEA hanno la caratteristica comune di avere elementi di regolazione con sequenza centrale “G-box” (CACGTG), direttamente controllati dall’ABA (Bewley et al., 2003).
3.1.d Embriogenesi zigotica in girasole: alcune peculiarità
Per quanto concerne gli eventi di post-fertilizzazione in Helianthus annuus, possiamo ricordare quanto osservato da Newcomb nel 1973. In stadi molto precoci, la degenerazione di una sinergide segnala l’inizio dello sviluppo dell’embrione e dell’endosperma. Al contrario, l’altra sinergide è persistente fino a quando l’embrione ha raggiunto lo stadio globulare. Il nucleo dell’endosperma primario entra in divisione prima dello zigote formando una struttura cenocitica. Quando sono presenti
circa otto nuclei (stadio globulare dell’embrione) le pareti si differenziano e l’endosperma appare cellularizzato all’estremità del micropilo. Allo stadio pro-embrionale, il sospensore consiste di una grande cellula basale e nel complesso la sua degenerazione ha inizio nello stadio a cuore. L’indagine istologica ha chiarito che, a partire dallo stadio a cuore, una zona adiacente all’embrione appare vuota in seguito alla digestione dell’endosperma. Sulla base di tale osservazione l’autore ritiene che dopo questo stadio di sviluppo l’embrione di girasole è probabilmente indipendente dalla presenza dell’endosperma. Più recentemente, Yan e collaboratori (1991) hanno individuato in girasole una interessante peculiarità: questa specie è, al momento, l’unica a presentare uno zigote che inizia a dividersi ancora prima di essere completamente avvolto dalla parete. Per quanto concerne gli stadi avanzati dell’embriogenesi possiamo infine ricordare che, a differenza di quanto accade in specie come Capsella bursa pastoris, l’asse apicale-basale non assume la tipica curvatura a U capovolto (Bracegirdle e Miles, 1971; Seiler, 1997). Inoltre, l’embrione maturo a livello dei cotiledoni è ricco in sostanze nutritive di riserve sotto forma di triacilgliceroli e tre diverse classi di proteine: eliantinine, albumine ed oleosine (Mazhar et al., 1998).
3.2 EMBRIOGENESI SOMATICA
3.2.a Aspetti generali e ruolo degli ormoni
Lo sviluppo avventizio di embrioni a partire da cellule somatiche è definito embriogenesi somatica. Questo tipo di sviluppo è indipendente dai fenomeni di gamia e produce embrioni che analogamente a quelli zigotici, hanno un asse di sviluppo bipolare delimitato ai due estremi rispettivamente dall’apice vegetativo e da quello radicale. L’embriogenesi avventizia è un fenomeno importante che caratterizza le piante superiori. Questa caratteristica aumenta la plasticità dei sistemi
riproduttivi ed è evidente nei processi di apomissia ed epifillia (Koltunow e Grossniklaus, 2003; Taylor, 1967). In natura, l’esempio migliore è rappresentato dall’apomissia sporofitica a localizzazione nocellare come la poliembrionia del genere Citrus (Nogler, 1984). Quando l’ontogenesi avventizia si sviluppa a partire dalle cellule del gametofito femminile, come le sinergidi o le antipodi, si possono differenziare embrioni somatici con assetti cromosomici aploidi. Inoltre, è stato frequentemente descritto in vivo lo sviluppo avventizio di embrioni direttamente da cellule di embrioni zigotici o del sospensore. Più rari i casi di embrioni somatici che si originano dalle cellule dell’endosperma come in Brachiaria setigera. E’ noto da tempo che l’embriogenesi somatica può essere indotta in modo artificiale anche in sistemi vegetali che non la presentano spontaneamente, attraverso l’espianto e la coltura in vitro di tessuti, organi o singole cellule. L’applicazione di tali tecniche offre quindi l’opportunità di ottenere la rigenerazione di nuove piante e questa possibilità ha una serie di interessanti applicazioni sia per la ricerca di base, sia per innumerevoli finalità biotecnologiche. Verso la fine degli anni ’50 sono stati effettuati in Daucus carota i primi studi volti all’induzione in vitro di embriogenesi somatica (Reinert, 1958; Steward et al., 1958). Queste esperienze sono state successivamente applicate con successo in molte specie vegetali spontanee o coltivate.
L’embriogenesi somatica può manifestarsi attraverso uno schema di sviluppo diretto o indiretto (Sharp et al., 1982). Nel primo caso, le nuove strutture morfogenetiche si differenziano dalle cellule somatiche dell’espianto. Nel secondo caso invece, gli embrioni si originano soltanto dopo una fase intermedia di proliferazione cellulare di tipo non organizzato, il callo. L’embriogenesi somatica rappresenta un significativo esempio di piano di sviluppo alternativo che presuppone l’acquisizione e l’espressione dello stato di competenza embriogenica da parte di alcune cellule in coltura. Questo processo è influenzato da una serie di fattori ambientali ma anche da alcuni fondamentali parametri endogeni come il bilancio ormonale e l’attività di specifici
fattori di trascrizione (Williams e Maheswaram, 1985; Harada, 1999; Chugh e Khurama, 2002; von Arnold et al., 2002). Nei casi di embriogenesi diretta esistono nell’espianto di partenza cellule preembriogeniche (“PEDC: Pre-embryogenic determined cells”) che possono realizzare lo schema di sviluppo alternativo semplicemente mediante il loro trasferimento in terreni sintetici. La modalità di rigenerazione diretta è di norma la più frequente quando la coltura viene iniziata con espianti caratterizzati da cellule poco differenziate ed in molte circostanze, l’embrione zigotico immaturo è risultato il miglior materiale vegetale di partenza. Analogamente, vanno incontro al processo di embriogenesi diretta anche gli espianti prelevati da plantule come ad esempio gli ipocotili (Ammirato, 1983, 1987). L’embriogenesi indiretta presuppone l’assenza, nell’espianto di partenza, di cellule competenti alla rigenerazione. Questa è la condizione di base che si verifica soprattutto quando sono coltivati in vitro organi con tessuti ben differenziati (ad esempio, una porzione di foglia matura). In questi casi, la morfogenesi avventizia è preceduta da una fase iniziale di callogenesi durante la quale, in alcune cellule, viene acquisita la competenza embriogenica (“IEDC: Induced embryogenic determined cells”) mediante un processo di riprogrammazione epigenetica del destino cellulare (Parrot et al., 1991). Nella rigenerazione indiretta si assiste spesso alla comparsa in coltura di masse proembriogeniche (“PEM: Pro-Embryogenic Masses”), simili ai centri meristematici essendo caratterizzate da cellule con citoplasma molto denso, con un grande nucleo, piccoli vacuoli e parete sottile (Halperin e Jensen, 1967). Analisi istologiche hanno accertato che all’origine di tali aggregati cellulari può risiedere una divisione cellulare asimmetrica per vari aspetti simile a quella che interessa l’oosfera fecondata (Williams e Maheswaran, 1986). In un tessuto, dove sono presenti cellule di tipo “PEDC”, il processo di embriogenesi somatica si attiva con la semplice stimolazione della divisione cellulare e questa può avvenire anche in assenza di ormoni esogeni attraverso il semplice trasferimento dell’espianto in vitro
(Ammirato, 1987; von Arnold et al., 2002). Quando non sono presenti nell’espianto cellule “PEDC”, l’ottenimento della rigenerazione è un processo complesso poiché è necessario fornire dall’esterno appropriati stimoli fisico-chimici attraverso una messa a punto spesso empirica. A tale proposito un elemento chiave può essere la composizione ormonale del terreno di coltura. Sebbene sia problematico effettuare generalizzazioni circa il fabbisogno ormonale esogeno, possiamo ricordare che l’auxina (acido indolacetico; IAA) è l’ormone fondamentale per indurre la comparsa in coltura di cellule “IEDC”. Nel sistema carota (Daucus carota) è stato dimostrato che l’acido 2,4-diclorofenossiacetico (2,4-D) è il composto auxinico, analogo di sintesi, più efficiente nel processo di induzione (Dudits et al., 1991). E’ importante sottolineare che per ottenere la differenziazione di embrioni somatici di carota, dopo un primo trattamento con dosi elevate di 2,4-D è necessario trasferire le cellule in un terreno privo di auxina. Infatti, si ritiene che l’apporto esogeno di auxina sia importante soltanto per indurre la competenza embriogenica mentre una prolungata esposizione delle cellule in vitro al 2,4-D reprime la differenziazione di strutture morfogenetiche. Il controllo che l’auxina determina sull’embriogenesi in vitro non deve sorprendere perché questo ormone ha un ruolo chiave nel regolare lo sviluppo dell’embrione zigotico (Leyser e Day, 2003). Inoltre, sempre in carota, è stato dimostrato che, dopo il processo di fertilizzazione in vivo, si verifica un aumento del livello endogeno di auxina prima nell’ovulo fecondato, e poi nei primi stadi di embriogenesi. Questo picco ormonale è di fatto transitorio in quanto, dopo lo stadio a cuore, il contenuto endogeno di auxina crolla di quasi cento volte (Ribnicky et al., 2001).
Sebbene l’auxina abbia un ruolo molto importante nel processo di embriogenesi è sicuramente riduttivo ricondurre la rigenerazione in vitro unicamente ad un problema di bilancio ormonale endogeno. Recentemente è stato proposto che la transizione in vitro da una cellula somatica ad una embriogenica sia associata alla risposta biochimica
nei confronti della condizione di stress fisiologico che si crea durante la coltura artificiale (Fehér et al., 2003; Ikeda-Iwai et al., 2003). Infatti, le cellule trasferite in vitro sono esposte ad innumerevoli fattori di stress come le ferite, la presenza di nutrienti a livelli non fisiologici, lo sviluppo di forme attive di ossigeno, lo shock chimico causato dalle alte concentrazioni di regolatori di crescita ed, infine, la presenza di sostanze che innalzano il potenziale osmotico. Pertanto, durante la coltura in vitro è molto difficile disgiungere, a livello cellulare, gli effetti degli ormoni rispetto a quelli elicitati dagli altri fattori artificiali imposti durante la coltura.
3.2.b Espressione genica ed embriogenesi somatica
L’embriogenesi somatica presuppone un cambiamento del destino di sviluppo in alcune cellule somatiche. E’ dunque evidente la necessità di un profondo riassetto dell’espressione genica. L’applicazione di metodologie di indagine molecolare quali le librerie sottrattive a cDNA e l’analisi bioinformatica della espressione genica hanno evidenziato che, nel processo embriogenico, sono coinvolti membri di diverse classi di geni: costitutivi, a controllo ormonale, per molecole che traducono il segnale biochimico, implicati nella biosintesi ormonale, attivati da fattori di stress, per fattori di trascrizione e per proteine segnale a sede extracellulare (De Klerk et al., 1997; Fambrini et al., 2001; Chugh e Khurama, 2002; Ezhova, 2003; Fehér et al., 2003). Nel complesso, durante l’embriogenesi, è risultato piuttosto variabile il numero di geni espressi in modo differenziale, dato comunque condizionato dal sistema vegetale studiato. Indicativamente, possiamo ricordare che l’ordine di grandezza emerso è di 500-1000 geni attivi (Howell, 1998, Thibaud-Nissen et al., 2003). A fronte di un quadro così complesso è problematico effettuare una trattazione esauriente della materia e al contempo, evidenziare il ruolo di un gene preso singolarmente. Si ritiene quindi opportuno analizzare alcuni dei più significativi risultati ottenuti relativamente a due
categorie di geni: sequenze ad espressione inducibile attraverso la manipolazione dei livelli ormonali e geni che codificano per proteine coinvolte nei meccanismi molecolari della trasduzione del segnale. Questa scelta ha una duplice giustificazione: da un lato gli ormoni sono il principale strumento chimico che può essere modulato dall’esterno per indurre il processo embriogenico, dall’altro, la competenza delle cellule somatiche alla rigenerazione avventizia, dipende soprattutto dalla corretta percezione degli specifici mediatori molecolari coinvolti. L’auxina è probabilmente l’ormone più utilizzato per ottenere l’induzione del processo morfogenetico e, quindi, i vari autori si sono interessati a valutare a livello molecolare le conseguenze dell’apporto di auxina esogena. E’ stato osservato che organi excisi trattati con auxina modificano in modo sostanziale il profilo di espressione genica (Chugh e Khurama, 2002). Inoltre inducendo embrioni somatici in ipocotili di carota trattati per 2 ore con 450 µM di 2,4-D, è stata osservata l’espressione differenziale dei geni Dchsp-1 e Dcarg-1. Il primo codifica una proteina appartenente al gruppo delle “Heat Shock Proteins”. L’espressione di Dcshp-1 è auxino-dipendente e prosegue anche dopo il trasferimento degli espianti di ipocotile sul terreno privo di 2,4-D. Il gene Dcarg-1 è anch’esso caratterizzato da sequenze regolative che rispondono all’auxina, ma la sua espressione termina precocemente e non accompagna le successive fasi di sviluppo embrionale.
Per quanto concerne i geni implicati nella trasduzione dei segnali, l’attenzione si è concentrata sulla classe di geni SERK (“Somatic Embryogenesis Receptor Kinase”) che isolati da embrioni somatici di diversi sistemi vegetali, risultano codificare per un recettore di membrana di natura chinasica ricco in leucina (“plant receptor-like kinases” RLKs) (Mordhorst et al., 1997). Il primo gene SERK è stato isolato nel 1997 dal gruppo di Sacco de Vries (Schmidt et al., 1997) utilizzando una sospensione cellulare di carota in terreno liquido. Questo gene ha destato interesse poiché la sua espressione di fatto si associa alle singole cellule competenti a dare masse pro-embrionali. Il suo mRNA si
accumula sia nell’embriogenesi somatica che in quella zigotica e la trascrizione termina precocemente dopo lo stadio globulare (Schmidt et al., 1997). La caratterizzazione molecolare della proteina SERK in vitro ha evidenziato la sua localizzazione a livello del plasma lemma; la sua interazione con una fosfatasi proteica di tipo “KAPP” è necessaria per il processo di endocitosi (Shah et al., 2002). Il gene è stato isolato anche in Arabidopsis dove è presente come piccola famiglia di cinque membri (Hecht et al., 2001) per i quali è stato confermato il coinvolgimento nei processi di embriogenesi somatica. Piante transgeniche, caratterizzate da una espressione costitutiva di AtSERK rigenerano in vitro embrioni somatici con percentuali quattro volte superiori al controllo. Come nella carota, in Arabidopsis questo gene si esprime anche negli ovuli non fecondati e durante le prime fasi della embriogenesi zigotica (Hecht et al., 2001). Il ruolo della famiglia dei geni SERK è stato analizzato anche in altre specie vegetali come Dactylis glomerata (Somleva et al., 2000), Zea mays (Baudino et al., 2001), Medicago truncatula (Nolan et al., 2003), Helianthus annuus (Thomas et al., 2004). In Dactylis glomerata l’espressione di DgSERK si attiva precocemente in vitro soltanto nelle cellule capaci di sviluppare embrioni somatici risultando un marcatore molecolare idoneo per la competenza embriogenica (Somleva et al., 2000). Lo studio di questa famiglia genica in una monocotiledone è stato affrontato per la prima volta in Zea mays. Tuttavia i due geni identificati ZmSERK1 e ZmSERK2 non si sono dimostrati efficaci nel marcare la competenza embriogenica in vitro poiché la loro espressione è stata accertata anche in calli non morfogenetici. In vivo, inoltre, ZmSERK1 è espresso principalmente nei tessuti riproduttivi mentre ZmSERK2 è trascritto in un ampio spettro di organi (Baudino et al., 2001). I risultati ottenuti in Medicago truncatula da Nolan e collaboratori (2003) hanno dimostrato per la prima volta in modo evidente che l’espressione dei geni della famiglia SERK è influenzata dall’attività ormonale. L’auxina esogena è in grado di indurre l’espressione di MtSERK mentre non è stato riscontrato il ruolo di induttore per la citochinina, anche se la
contemporanea presenza dei due tipi di ormoni induce un maggiore incremento del trascritto (Nolan et al., 2003). Gli stessi autori hanno infine dimostrato che l’espressione di MtSERK si verifica non soltanto nelle cellule competenti a dare embriogenesi somatica ma anche durante l’induzione avventizia di radici. Le indicazioni raccolte in Helianthus annuus hanno sostanzialmente messo in evidenza una situazione analoga a quella di Medicago truncatula. L’espressione di HaSERK può essere modulata negli espianti in coltura attraverso il ricorso ad ormoni esogeni ed è individuabile sia nelle cellule competenti per l’embriogenesi, sia in quelle coinvolte direttamente nella organogenesi (Thomas et al., 2004). In conclusione, dai risultati ottenuti nei diversi sistemi vegetali sebbene siano emerse alcune differenze specie-specifiche, si conferma valida la possibilità di utilizzare i geni SERK per identificare precocemente a livello molecolare le cellule competenti a dare rigenerazione in vitro. Anche da un punto di vista applicativo, possiamo ricordare che esiste un interesse sui geni SERK in quanto questi potrebbero essere utilizzati per incrementare le percentuali di trasformazione genetica in specie di interesse agrario (Zuo et al., 2002).
3.3 ANALOGIE E DIFFERENZE TRA EMBRIOGENESI ZIGOTICA E
SOMATICA
La comparazione tra embriogenesi zigotica ed embriogenesi somatica ha offerto l’opportunità di accertare che nelle piante una struttura complessa come un embrione può essere specificato attraverso diverse soluzioni di sviluppo. L’embrione somatico è molto più accessibile di quello zigotico per le indagini morfologiche essendo privo di rivestimenti tissutali esterni. Ciò ha fatto assumere all’embriogenesi somatica il ruolo di modello semplificato sul quale condurre studi di embriologia (Zimmermann, 1993; Mordhorst et al., 1997; Dodeman et al., 1997). Inoltre, a partire dallo stadio globulare, l’embrione somatico si sviluppa solitamente secondo un piano morfologico molto simile a quello
specifico per l’embrione zigotico. Nelle fasi più precoci le indagini sono invece più complesse e per questo sono disponibili un minor numero di dati. Tuttavia, possiamo sottolineare che l’acquisizione della competenza embriogenica è uno stadio critico soltanto nel processo somatico perché nello zigote la totipotenza è di per sé implicita. Eventi analoghi all’acquisizione di una polarità cellulare e alla successiva divisione asimmetrica della cellula zigotica si ritrovano anche nell’embriogenesi somatica, come dimostrato in medica (Dudits et al., 1991) e in carota (Komamine et al., 1990). Dobbiamo però considerare che in altri sistemi vegetali sono state osservate prime divisioni perfettamente simmetriche (Mordhorst et al., 1997). Dopo questi primi eventi, il piano di sviluppo segue una successione di stadi che è analoga nei due tipi di embriogenesi (Steeves e Sussex, 1989), anche se, in generale, la morfologia degli embrioni somatici è tendenzialmente più variabile per forma, numero di cellule, precoce vacuolizzazione, alterazione dell’indice mitotico e tipo di organelli citoplasmatici (Ammirato, 1987; Mordhorst et al., 1997). Tra le differenze di maggior rilievo è necessario sottolineare che gli embrioni somatici si distinguono da quelli zigotici per la mancanza del sospensore sebbene sia possibile la differenziazione di strutture rudimentali in prossimità dell’estremità radicale (Natesh e Rau, 1984). In tre diverse specie (vite, medica e soia) è stato accertato che una consistente frazione di fenotipi anormali dipende dall’alterazione o dall’assenza di meristemi embrionali principali. Ciò, almeno in parte, può giustificare anche la carente potenzialità di germinazione, spesso presente negli embrioni somatici (Dodeman et al., 1997). Non sono disponibili dati certi sulla causa di queste alterazioni di sviluppo, tuttavia, è stato ipotizzato che siano implicati la mancanza di un sospensore e l’apporto ormonale esogeno (Goebel-Tourand et al., 1993). Completato lo sviluppo morfologico, si verificano differenze per quanto concerne il processo di maturazione (Thomas, 1993). Evento essenziale durante questa fase è l’accumulo di proteine di riserva. In medica è stato accertato che negli embrioni
somatici la sintesi proteica è qualitativamente analoga a quella presente negli embrioni zigotici e le peculiarità riguardano le cinetiche di sintesi ed i singoli livelli di concentrazione. Allargando l’analisi ad altri sistemi vegetali si può sottolineare che di norma, gli embrioni somatici non diventano dormienti: questo è da ricollegare al tipo di ambiente esterno all’embrione. In vitro l’embrione somatico che non si forma nella cavità dell’ovulo e quindi in assenza di endosperma, non viene a contatto con l’ABA materno e non subisce un processo di disidratazione (Dodeman et al., 1997). Esistono evidenze che dimostrano come negli embrioni somatici sia possibile indurre un processo di maturazione attraverso la somministrazione di ABA direttamente nel substrato di coltura (Srivastava, 2001).
Nonostante queste differenze morfologiche e’ probabile che il controllo genetico dei primi stadi di embriogenesi zigotica, apomittica, o indotta in vitro, sia fondamentalmente analogo (Koltunow e Grossniklaus, 2003; Fambrini et al., 2006; Braybrook e Harada, 2008). Ciò risulta evidente se si considera che l’attività dei geni LEC1, L1L, LEC2 e FUS3 è richiesta durante le fasi di morfogenesi e maturazione dell’embrione zigotico ma al contempo, la loro espressione ectopica in cellule differenziate può essere sufficiente per indurre la formazione di embrioni somatici (Lotan et al., 1998; Stone et al., 2001). Analogamente la trascrizione di SERK1, si attiva non soltanto nell’embriogenesi zigotica ed in quella somatica, ma anche nella nucella di Poa pratensis apomittica (Hecht et al., 2001; Albertini et al., 2005).
E’ da notare che l’induzione di embrioni avventizi mediata dai geni LEC non richiede un apporto esogeno di auxina in quanto probabilmente il fabbisogno auxinico del sistema è coperto dal positivo effetto che LEC2 ha sull’attivazione dei geni della biosintesi ormonale quali YUCCA2 (YUC2) e YUC4 (Stone et al., 2008). In alcune specie del genere Helianthus il concomitante accumulo di auxina e trascritti dei geni LEC a livello di specifici domini cellulari è tra i più precoci segnali associati all’induzione degli embrioni somatici, (Thomas et al., 2002; Chiappetta et
al., 2009). Anche l’apomissia risulta influenzata dall’auxina: in Hieracium piloselloides alterazioni nella risposta cellulare all’auxina determinano variazioni nella frequenza degli eventi apomittici (Koltunow et al., 2001). Oltre all’auxina, anche ABA e GA intervengono nel controllo fisiologico dell’embriogenesi soprattutto nella fase di maturazione dell’embrione e di germinazione del seme (Hays et al., 2002). Nell’embriogenesi zigotica è attiva una regolazione a feed-back positivo tra ormoni e fattori di trascrizione: l’ABA ha un effetto positivo sulla sintesi delle sostanze di riserva attraverso l’attivazione di LEC1 e FUS3 mentre la trascrizione di FUS3 stimola la sintesi di ABA. E’ stato ipotizzato che i rapporti reciproci di ABA e GA siano importanti anche nella fase di morfogenesi dell’embrione e, addirittura, nell’induzione di un nuovo destino cellulare grazie ad un meccanismo di regolazione che include i geni LEC (Braybrook e Harada, 2008).
Molti studi hanno chiarito aspetti fondamentali della regolazione delle ultime fasi dell’embriogenesi somatica, ma il quadro complessivo dei meccanismi molecolari, cellulari e biochimici che sono alla base dell’omeostasi delle cellule pluripotenti e del cambiamento del destino cellulare è tuttora incompleto (Vogel, 2008, Zhao et al., 2008). Ha quindi destato interesse la scoperta che la semplice espressione ectopica di alcuni fattori di trascrizione [ad es. LEC1, BABY BOOM (BBM), WUS e AGAMOUS-LIKE15 (AGL15)] può determinare l’induzione di embrioni somatici in tessuti differenziati (Laux et al., 1996, Lotan et al., 1998; Stone et al., 2001; Zuo et al., 2002; Boutilier et al., 2002; Harding et al., 2003). Un aspetto comune di tali geni è la loro capacità di promuovere l’iniziazione di un programma embriogenico in assenza di trattamenti esogeni con auxine o sostanze che attivano processi di stress, usualmente utilizzate in vitro per ristabilire la totipotenza. Considerando che il loro meccanismo d’azione a livello molecolare è diverso, appare evidente che sistemi di regolazione indipendenti sono sufficienti per l’acquisizione di un nuovo destino cellulare. La sovraespressione di WUS appare reprimere l’attività di LEC1, mentre AGL15, che è attivato
dall’espressione ectopica di LEC2, è in grado a sua volta di regolare SERK1. Tuttavia rimane ancora da dimostrare che questi geni agiscano in concerto nel promuovere in modo specifico l’acquisizione della totipotenza embriogenica (Verdeil et al., 2007). In realtà alcuni risultati suggeriscono che l’espressione ectopica di questi fattori di trascrizione è legata ad un cambiamento più generalizzato del destino cellulare. La caratterizzazione del profilo di espressione di BBM ha recentemente evidenziato un ruolo di questo gene sia nelle prime fasi di sviluppo embrionale che nella specificazione del meristema radicale (Passarihno et al., 2008). Allo stesso tempo, la sovraespressione di WUS è stata associata all’embriogenesi somatica (Zuo et al., 2002) ma anche alla proliferazione ectopica di meristemi fiorali (Xu et al., 2005). E’ interessante notare che WUS funzioni in maniera “non-cell autonomous” per mantenere l’identità delle cellule pluripotenti nel centro di organizzazione del meristema, mentre sembra funzionare in maniera “cell-autonomous” quando espresso ectopicamente in cellule somatiche che acquisiscono la totipotenza embriogenica (Mayer et al., 1998; Zuo et al., 2002). E’ evidente che il contesto cellulare nel quale WUS è espresso è fondamentale per determinare l’abilità di una cellula a diventare pluripotente o totipotente. L’espressione dei geni LEC1, LEC2, BBM, WUS e AGL15 nella cellula uovo o nello zigote non è ancora stata dimostrata con certezza e rimane tuttora da valutare se l’espressione ectopica di questi geni possa causare qualche tipo di stress ed attivare una risposta tale da indurre indirettamente un cambiamento del destino cellulare (Feher et al., 2003; Koltunow e Grossniklaus, 2003). Si avverte inoltre l’esigenza di indagare le basi della totipotenza ad un livello superiore di controllo allo scopo di identificare i meccanismi che regolano a monte i fattori di trascrizione coinvolti (Verdeil et al., 2007; Birnbaum e Sánchez Alvarado, 2008). E’ evidente che la conversione di una cellula da somatica ad embriogenica richiede una generale revisione del profilo di espressione e quindi, di un consistente cambiamento della struttura cromatinica. Negli ultimi anni sono stati
identificati fattori di rimodellamento della cromatina, importanti ai fini degli eventi di sviluppo (Reyes, 2006), tra cui tutte le modificazioni post-trascrizionali degli istoni, (Loidl, 2004). Alcune evidenze sperimentali suggeriscono un controllo epigenetico sulla totipotenza cellulare ed è stato dimostrato che il processo di sdifferenziazione presuppone la modificazione dei rapporti tra eucromatina ed eterocromatina (Grafi, 2004). Altrettanto importante in questo codice epigenetico che agisce a monte della funzione della cromatina è il processo di metilazione del DNA. E’ noto che trattamenti chimici in grado di modificare i livelli di metilazione del DNA possono influenzare la rigenerazione in vitro (Finnegan et al., 2000), ed è stato accertato che l’uso di sostanze de-metilanti, possa influenzare l’embriogenesi modulando la trascrizione del gene LEC1 (Yamamoto et al., 2005). Che modificazioni della cromatina siano alla base della riprogrammazione del destino cellulare è avvalorata dalla caratterizzazione in Arabidopsis del mutante pickle la cui capacità di formare spontaneamente embrioni somatici sulle radici è da ricollegare alla mancata repressione di una serie di geni coinvolti nelle fasi di morfogenesi e maturazione dell’embrione zigotico.
Alcuni risultati suggeriscono un ruolo chiave delle proteine polycomb (PcG) nella riprogrammazione dell’espressione genica che sottointende al cambiamento del destino cellulare (Guitton and Berger, 2005). Analogamente a quanto accade in altri eucarioti, nelle piante la soppressione della trascrizione dei geni PcG ha notevoli effetti nel controllo dello sviluppo. In generale, le PcG hanno la capacità di silenziare i geni tramite il controllo della struttura cromatinica e delle dinamiche di metilazione degli istoni (Schubert et al., 2005; Guitton e Berger, 2005). E’ interessante sottolineare che mutazioni a carico di geni PcG possono anche associarsi a fenotipi caratterizzati da uno sviluppo dell’endosperma (fie) o del seme (fis), in assenza di fertilizzazione (Baroux et al., 2007). Ciò dimostra che in condizioni normali, un meccanismo di controllo basato sulla struttura della cromatina reprime il programma embrionale fino al compimento della fertilizzazione. E’ quindi evidente
che la modificazione del profilo di espressione di geni direttamente implicati nel controllo epigenetico del trascrittoma ha importanti conseguenze per la manifestazione della totipotenza.