I.
L' Influenza Aviare
Generalità sull’ Influenza Aviare
L'influenza aviare, un tempo denominata "Peste aviare", è una malattia infettiva contagiosa sostenuta da un Influenzavirus Tipo A, appartenente alla Famiglia Orthomyxoviridae; nella stessa Famiglia rientrano anche i virus dell'Influenza del suino, degli equidi e dell'uomo.
E' inserita nella "Lista A" dell' OIE, ossia “malattie trasmissibili che hanno la potenziale capacità
di diffondere in modo grave e rapido, senza rispettare i confini nazionali, con gravi conseguenze socio-economiche o di sanità pubblica e che rivestono un ruolo preminente nel commercio di animali e prodotti di origine animale”.
Nei secoli scorsi “Peste Aviare” o “Peste Lombarda” erano le denominazioni di una gravissima malattia del pollame di allevamento oggi riconducibile all'Influenza aviare. "Peste" stava ad indicare la gravità della malattia e la sua insorgenza improvvisa. “Peste Lombarda” comprendeva anche una importante indicazione geografica. Le prime osservazioni, infatti, risalgono alla fine del '700 e inizio '800, nel Regno Lombardo Veneto, in un territorio coinvolto in frequenti conflitti, movimenti di truppe e conseguenti razzie di pollame. La Peste aviare viene segnalata e descritta per la prima volta da Edoardo Perroncito nel 1878, in volatili di allevamento, nelle campagne circostanti Torino. Particolarmente interessante è la descrizione della malattia, “che si manifesta inizialmente con sintomi modesti e solo in seguito assumere i caratteri di una vera "Peste", con la morte di quasi tutti i volatili presenti nella zona”. Nel 1901 Centanni e Savonuzzi riproducono sperimentalmente l'infezione con filtrati di organi prelevati a pollame colpito.
Nella prima metà del '900 la “Peste Aviare” viene segnalata più volte nel nostro Paese senza però che vi sia una sufficiente distinzione fra episodi di malattia sostenuti dai virus influenzali e dal virus della Pseudopeste Aviare o Malattia di New Castle (NDV). Solo a partire dalla fine degli anni '50 i virus Influenzali aviari, isolati da focolai di malattia, sono identificati sierologicamente. Da allora il Laboratorio di Referenza Comunitario di Weybridge (UK) svolge un ruolo fondamentale nello studio e nella caratterizzazione dei Virus Influenzali aviari isolati nel mondo.
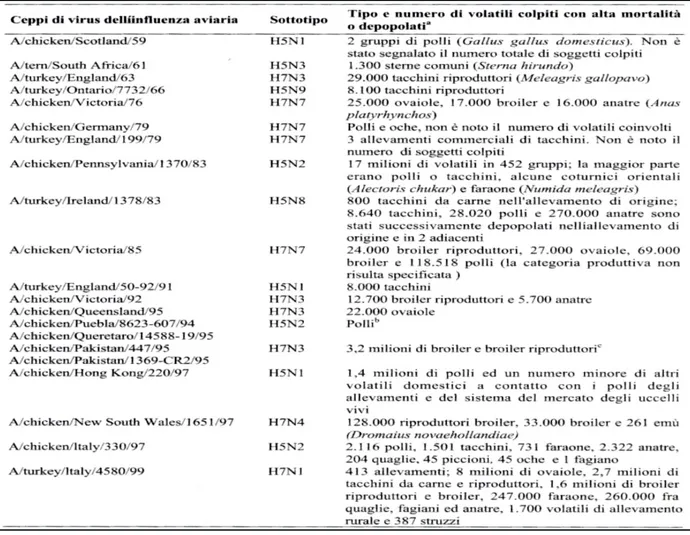
1. STORIA DELLA COMPARSA DEI VIRUS INFLUENZALI HPAI E LPAI
1.1.I virus influenzali aviari HPAI
I virus HPAI sono responsabili delle forme che in passato erano definite "Peste aviare"; sono caratterizzate da tassi di attacco, diffusibilità e indici di mortalità elevati.
Nella figura 1 sono riportati i Focolai di Influenza Aviare sostenuti da Virus HPAI, dal 1959 alla fine del secolo scorso.
Figura 1. Focolai di Influenza Aviare sostenuti da Virus HPAI, dal 1959 al 1999
Da questa si evince che tutti i virus Influenzali aviari HPAI hanno antigeni solo di Tipo A e appartengono ai sottotipi H5 o H7; l'unico focolaio segnalato in uccelli selvatici nel loro ambiente naturale, nel secolo scorso, era sostenuto dallo stipite A/stern/South Africa/61(H5N3).
Negli anni '70 compaiono solo tre focolai, tutti sostenuti da virus H7N7, prima in Canada nel 1976, poi in Germania e Inghilterra nel 1979; negli anni '80 compare in USA il primo episodio sostenuto da H5N2 A/chicken/Pennsylvania/1370/83, che interessa 17 milioni di volatili di allevamento, prevalentemente polli e tacchini, ma anche faraone e pernici.
In particolare negli anni '90 si segnala la ricomparsa di H5N2 (A/chicken/Pennsylvania/1370/83), dopo 11 anni in Messico A/chicken/Puebla/8623-607/94 e, a distanza di 3 anni, questo virus viene
segnalato anche in Italia A/chicken/Italy/330/97; la ricomparsa di un virus H5N1 (A/chicken/Scotland/59), dopo 32 anni in Inghilterra A/turkey/England/50-92/91 e, successivamente, nel 1996, ad Hong Kong A/chicken/Hong Kong/220/97; la ricomparsa, dopo 29 anni di H7N3 (A/turkey/England/63) in Canada A/chiken/Victoria/92 e, dopo 3 anni da quest’ultimo, anche in Pakistan A/chicken/ Pakistan/447/95 e A/chicken/ Pakistan/1369-CR2/95;
la comparsa di due episodi in Italia sostenuti rispettivamente da A/chicken/Italy/330/97(H5N2) e
A/turkey/Italy/4580/99(H7N1).
Il virus A/chicken/Hong Kong/220/97 H5N1 compare nella Provincia di Guang Kong nel 1996 in allevamenti di oche e ad Hong Kong in polli nell'anno successivo.
1.2. I virus influenzali aviari LPAI
Il maggior numero di virus dell'influenza aviare è stato isolato come LPAI dagli uccelli selvatici ed in particolare da volatili acquatici appartenenti agli ordini Anseriformi e Charadriformi.
Il Germano reale (Anas platyrhynchos) costituisce il più importante serbatoio d'infezione, come portatore a livello di mucosa cloacale ed eliminatore di virus con le feci, consentendo quindi la persistenza dei virus dell'Influenza aviaria in natura e la sua diffusione negli ambienti acquatici frequentati, sia nelle aree di riproduzione che in quelle di svernamento e/o di sosta migratoria. Il gregarismo che caratterizza molte delle specie responsabili, soprattutto anatidi e rallidi, oltre che la promiscuità con altri frequentatori dell'ambiente acquatico, favoriscono la diffusione dei virus LPAI, soprattutto nel corso delle migrazioni ed in particolare lungo le più importanti rotte migratorie.
Gli allevamenti avicoli rurali o intensivi sono a rischio di contagio in relazione alla distanza da ambienti acquatici frequentati da anatidi selvatici. Polli e tacchini risultano altamente recettivi a virus influenzali LPAI che possono causare una sindrome influenzale di modesta gravità così come una forma molto grave, del tutto simile a quella causata da virus HPAI. Solo il test di patogenicità sperimentale è pertanto in grado di distinguere i virus LPAI da quelli HPAI. Con il passaggio dal portatore selvatico al pollame di allevamento si può avere la cambiamento di un virus LPAI in HPAI e ciò comporta sia un notevole aggravamento della malattia in polli e tacchini (come già evidenziato da Perroncito in Piemonte alla fine dell'800) che il coinvolgimento di molte altre specie domestiche o selvatiche di allevamento.
2. Eziologia
2.1. I Virus Influenzali Aviari
I virus influenzali sono classificati mediante una sigla composta da: a) Tipo dell’antigene capsidico (tipo A, B, C);
b) Specie da cui il virus è stato isolato (tale indicazione non compare negli stipiti isolati dall’uomo);
c) Paese o Regione in cui è avvenuto l’isolamento;
d) Numero assegnato al ceppo, ossia il numero di laboratorio (facoltativo); e) Anno in cui si è avvenuto l’isolamento;
f) Caratteri antigenici H e N, relativi al tipo di antigene emoagglutinante e neuroaminidasico;
g) Indice di patogenicità sperimentale: LPAI o HPAI
Esempio: A/Pollo/Scozia/199/59 (H5N1) HPAI
↑ ↑ ↑ ↑ ↑ ↑ ↑ a b c d e f g
2.2. Morfologia del virus
Il virus si presenta pleomorfo o sferico (∅ 80-120nm) o filamentoso ( ∅ 80-120nm e lunghezza variabile fino a 500nm) (Fig. 2).
Il genoma virale è rappresentato da ssRNA a polarità negativa, diviso in 8 segmenti veicolanti 10 geni codificanti per 10 proteine virali (NP, PB1, PB2, PA, M1, M2, H, N, NS1, NS2).
Il capside è a simmetria elicoidale, formato da una nucleoproteina (NP) che avvolge strettamente ogni segmento di RNA; alla NP è associato inoltre, un complesso di 3 proteine (PB1, PB2 e PA) che hanno funzione di RNA-polimerasi.
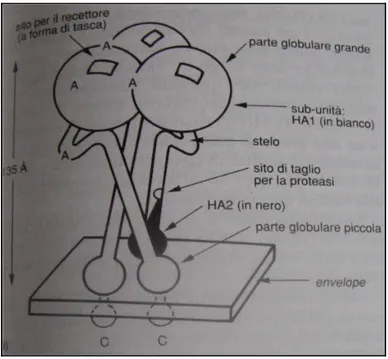
Il virus è provvisto di envelope (derivato dalla membrana plasmatica della cellula ospite), il quale presenta proiezioni superficiali o peplomeri (lunghezza 10-12 nm.), rappresentate dalle glicoproteine emoagglutinina (HA o H) e neuraminidasi (NA o N) in rapporto H/N 4-5/1 (Fig. 3).
Figura 3. Modello schematico della struttura di un virus influenzale
2.3. Funzione dei polipeptidi virali
Proteina NP o nucleoproteina: avvolge i segmenti di RNA formando il capside a simmetria
elicoidale (Fig. 3)..
Proteine di matrice M1 e M2: la proteina strutturale M1 avvolge il nucleocapside e funge da
proteina di trasporto durante l'assemblaggio virale; la proteina strutturale M2 invece, è una proteina transmembrana che forma dei pori, ed è importante durante la fase di svestimento del virus (Fig. 3).
Proteine PB1, PB2 e PA: complesso peptidico, strettamente associato alla NP, ad attività RNA
Figura 4. Struttura schematica di un segmento di RNA che mostra il complesso polimerasico e la nucleoproteina NP
Proteina H o Emoagglutinina: l’emoagglutinina è un trimero di un polipeptide composto a sua
volta da due subunità, HA1 glicosilata, e HA2; le due subunità sono separate tra loro al momento della penetrazione del virus nella cellula. Ciascun monomero ha un'estremità globosa con un sito recettoriale a forma di "tasca", ad alta affinità per gli acidi salici (Fig. 5).
Induce la formazione di anticorpi neutralizzanti, quindi protezione dall’infezione nei confronti di qualsiasi ceppo che contenga quella determinata proteina H.
L’emoagglutinina è responsabile dell'attacco del virus ai recettori di superficie cellulari (rappresenta il sito di adsorbimento del virus) oltre all'attività emoagglutinante.
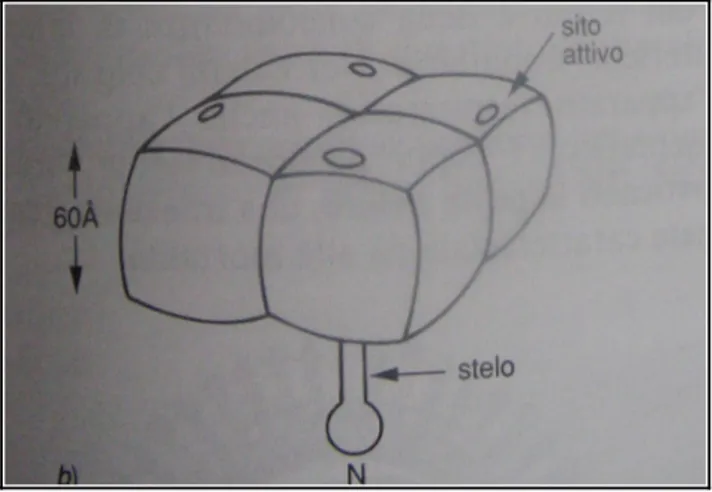
Proteina N o Neuraminidasi: la molecola della Neuroaminidasi è un tetramero in cui ciascuna subunità è a sua volta composta da una parte terminale di forma cubica, una regione aminoterminale (N) che ancora il complesso all'envelope e una parte intermedia, lo stelo. Ogni monomero della N possiede un sito enzimatico attivo sulla sommità (Fig. 6).
La distribuzione delle molecole di N sulla superficie del virus non è uniforme, ma sono raggruppate a formare delle placche isolate le une dalle altre. La neuroaminidasi è responsabile della liberazione di nuove particelle virali dalla cellula mediante la sua azione sull’acido neuraminico nei recettori.
Figura 6. Struttura di una neuroaminidasi Antigeni virali
Antigeni NP e M1: antigeni profondi che determinano la specificità di tipo (Tipo A, B e C) e attivano l’immunità cellulo-mediata ma non inducono la formazione di anticorpi neutralizzanti; sono tipici e costanti in ciascuna specie virale, mentre sono molto diversi nelle differenti specie.
Antigeni H e N: antigeni superficiali che determinano la specificità di subtipo. Negli Influenzavirus
di TIPO A sia le H che le N sono molto variabili: sino ad oggi si conoscono 16 diversi tipi di H e 9 tipi di N, che possono associarsi tra loro in molte combinazioni conferendo un disegno antigenico peculiare. Dato che una nuova conformazione antigenica può formarsi per riassortimento genetico (antigenic shift), tutte le combinazioni HN sono teoricamente possibili.
L’antigenic shift si verifica quando due virus appartenenti a sierotipi diversi, infettano contemporaneamente la stessa cellula. Al momento della sintesi degli acidi nucleici e dell’assemblaggio virale, per la presenza di RNA segmentato, si può osservare lo scambio di segmenti, con cambiamenti sostanziali di H e/o N e formazione di un sierotipo virale diverso rispetto ai due originari.
Oltre al riassortimento genetico, che condiziona la comparsa improvvisa di un sierotipo con caratteristiche anche molto diverse dai precedenti, le H e N possono andare incontro anche mutazioni puntiformi nel genoma di un virus che coinvolgono solo pochi aminoacidi (antigenic drift). Tali cambiamenti modificano leggermente le molecole H e/o N, portando nel tempo alla
formazione di nuove varianti antigeniche di H e N.
Conseguenza del Drift antigenico è la comparsa di varianti epidemiche, mentre la conseguenza dello Shift antigenico è la formazione di varianti pandemiche con la trasmissione all'uomo di virus influenzali circolanti in animali domestici e selvatici.
2.4. Replicazione virale
Con l’adsorbimento del virus ai recettori cellulari (glicoproteine contenenti acido sialico) tramite l’emoagglutinina, si ha la penetrazione nella cellula per endocitosi della intera particella virale. La formazione dell’endosoma determina l’esposizione dell’emoagglutinina ad un pH acido che ne comporta la scissione a opera di un enzima tripsino-simile presente in sede endosomiale, attivo a pH 5. il clivaggio e l’attivazione della H consente la fusione dell’envelope con la membrana endosomica e il rilascio del nucleocapside nel citoplasma (svestimento). Si osserva successivamente la migrazione del nucleocapside nel nucleo cellulare e la trascrizione del genoma grazie alla RNA-polimerasi virale. La HA e NA prodotte sono glicosilate nel reticolo endoplasmatico, separate nell'apparato di Golgi e trasferite sulla superficie della membrana della cellula. Segue la traduzione delle altre componenti proteiche e del genoma virale.
Il processo di replicazione si conclude con la maturazione (assemblaggio) e il rilascio delle particelle virali per “budding” o gemmazione (Fig. 7).
Figura 7: Schema delle diverse fasi della replicazione dei virus influenzale
3. EPIDEMIOLOGIA
3.1. Spettro d’ospite
Numerose sono le specie di volatili domestici e selvatici suscettibili d’infezione; tra le specie domestiche risultano essere recettive pollo, tacchino, faraona, quaglia, fagiano, piccione, anatre e oche. Episodi di Influenza aviare sono state segnalate anche nello struzzo, parrocchetto, pappagallino ondulato e altri psittacidi, mentre la tabella 1 mostra le specie selvatiche colpite dal virus influenzale aviare ad alta patogenicità H5N1.
Negli ultimi anni sono stati descritti anche nei mammiferi casi di influenza aviare ad alta patogenicità da sierotipo H5N1. Sono stati infettati gatto, tigre, leopardo, faina, zibetto, visone, suino e cane.
Larus ridibundus Black-headed Gull
Egretta garzetta Little Egret
Ardea cinerea Grey Heron
Ardea bulophotes Chinese Egretta
Phoenicopterus ruber Greater Flamingo
Colombi Pigeon
Passer montanus Tree Sparrow
Anatidi Waterfowls
Falco peregrinus Peregrine Falcon
Ardea cinerea Grey Heron
Psittacidi
Corvidi Crows
Pica pica Magpie
Anastomus oscitans Open-billed Storks
Phalacrocorax niger Little Cormorant
Streptopelia tranquebarica Collared Dove
Lonchura punctulata Scaly-breasted Munia
Dicrurus macrocercus harterti Black Drongo
Ardeola bacchus Chinese pond Heron
Anser indicus Bar-headed Goose
Cygnus cygnus Whooper Swan
Larus brunnicephalus Brown-headed Gull
Larus marinus Greater black-backed Gull
Tadorna ferruginea Ruddy Shelduck
Phalacrocorax carbo Great Cormorant
Sterna hirundo Common Tern
Podiceps spp. Grebes
Mergus merganser Common Merganser
Casmerodius albus Great white Egret
Anas penelope Eurasian Wigeon
Grus nigricollis Black-necked Cranes
Gufi Owls
Condor Condor
Aquile Hawks
Tabella 1. Specie selvatiche colpite da virus dell’influenza aviare ad alta patogenicità da sierotipo H5N1nel mondo
La tabella 2 evidenzia invece solo le specie colpite dal virus in Europa e nell’area del Mediterraneo.
Aix sponsa Wood duck
Amazonetta brasiliensis Brazilian teal
Anas acuta Northern pintail
Anas bahamensis White-cheeked pintail
Anas castanea Chestnut teal
Anas platalea Red shoveler
Anas platyrhynchos Mallard
Anas sibilatrix Chiloe wigeon
Anas versicolor Silver teal
Anser anser Greylag goose
Anser erythropus Lesser white-fronted goose
Anser indicus Bar-headed goose
Aythya ferina Pochard
Aythya fuligula Tufted duck
Aythya marila Greater scaup
Branta canadensis Canada goose
Callonetta leucophrys Ringed teal
Chenonetta jubata Maned duck
Coscoroba coscoroba Coscoroba swan
Cygnus cygnus Whooper swan
Cygnus melanocoryphus Black-necked swan
Cygnus olor Mute swan
Dendrocygna viduata White-faced whistling duck
Melanitta nigra Common scooter
Mergellus albellus Smew
Mergus merganser Common merganser
Nesochen sandvicensi Hawaiian goose
Netta peposaca Rosybill pochard
Netta rufina Red-crested pochard
Larus argentatus Herring gull
Larus brunnicephalus Brown-headed gull
Larus ichthyaetus Great black-headed gull
Larus ridibundus Black-headed gull
Accipiter gentilis Northern goshawk
Buteo buteo Common buzzard
Buteo lagopus Rough-legged hawk
Ardea cinerea Grey heron
Egretta garzetta Little egret
Columba livia Rock pigeon
Streptopelia decaocto Eurasian collared-Dove
Falco peregrinus Peregrine falcon
Acridotheres cristatellus Crested myna
Fulica americana America coot
Fulica atra Eurasian coot
Corvus corone Carrion crow
Corvus macrorhynchos Large-billed crow
Corvus pica Common magpie
Corvus splendes House crow
Passer montanus Tree sparrow
Zosterops japonicus Japanese white-eye
Phalacrocorax carbo Great cormorant
Phoenicopterus ruber American flamingo
Podiceps cristatus Great crested grebe
Bubo bubo Eurasian eagle-owl
Tabella 2. Principali specie colpite da virus dell’influenza aviare ad alta patogenicità da sierotipo H5N1 in Europa e nell’area mediterranea
3.2.Caratteristiche di resistenza del virus
Il virus, essendo provvisto di envelope, è rapidamente inattivato da alcool, calore, solventi organici e comuni disinfettanti (ipoclorito di sodio 2%, sali quaternari di ammonio 4%, idrato di calce 3%, fenoli sintetici 2%, formalina associato a permanganato).
Il virus può conservare la sua infettività per alcuni giorni, se mantenuto a 4°C in condizioni particolari (umidità e presenza di sostanze stabilizzanti) o per lungo tempo a -80°C.
Negli animali infetti il ritmo elevato di replicazione bilancia la velocità di termoinattivazione del virus.
Schematicamente le caratteristiche di resistenza del virus si possono così riassumere:
• resistenza nelle feci 7 giorni a 28°C e 35 giorni a 4°C;
• resistenza nelle feci liquide 105 giorni in inverno;
• resistenza nel materiale organico 11 giorni a temperatura ambiente;
• resistenza nelle acque dolci stagnanti in autunno-inverno 4 giorni a 22 °C e 30 giorni a 0°C;
• rapidamente inattivato dai raggi UV;
• resistente a pH 7, labile a pH acido;
• resistente a 56°C dai 15 minuti alle 6 ore, meno di 15 minuti a 60 °C;
3.3.
Modalità di trasmissioneI volatili infetti eliminano il virus attraverso l'apparato respiratorio, la congiuntiva e le feci.
Le modalità di trasmissione comprendono sia il contatto diretto, tra uccelli infetti e sensibili, sia il contatto indiretto, tramite l’aerosol o il contatto con feci e/o materiali contaminati. Non è dimostrata la trasmissione verticale, anche se si è comunque osservata la presenza del virus sul guscio delle uova deposte da animali infetti. Sperimentalmente sono state dimostrate vie d’infezione tramite: aerosol, intranasale, intrasinusale, intratracheale, orale, intravenosa, intracranica.
Considerato che i soggetti infetti possono eliminare grandi quantità di virus tramite le feci, la diffusione è ottenuta facilmente attravarso qualsiasi veicolo contaminato da materiale fecale (alimento, acqua, attrezzature, indumenti, mezzi di trasporto, ecc).
La diffusione dei virus influenzali, e del sierotipo H5N1 in particolare, può essere stratificata su 3 livelli: locale, internazionale e intercontinentale.
La diffusione locale avviene tramite operatori di settore; letame contaminato o rifiuti originati dal pollame; aerosol e polveri; uccelli che vivono a stretto contatto con l'uomo.
La diffusione internazionale avviene mediante il commercio di pollame, veicoli, ceste, containers, mostre e mercati internazionali, uccelli migratori stagionali; mentre per la diffusione intercontinentale rivestono importanza il trasporto del pollame vivo, carne di pollo congelata, uova rotte non trattate, prodotti derivati dal pollame, uccelli migratori.
Secondo Easterda et al., le principali modalità di diffusione dell’infezione nel pollame sono da ricondurre ad altre specie di volatili domestici, uccelli esotici in cattività e uccelli selvatici, nonché specie come il suino.
Gli allevamenti di selvaggina in particolare, sono maggiormente esposti al contagio da agenti patogeni aviari di diversa natura (virus, batteri, protozoi, parassiti), soprattutto per il fatto che le strutture di allevamento, e le voliere in particolare, costituiscono un forte richiamo per uccelli selvatici di molte specie diverse.
Passeri e storni frequentano l'interno delle voliere perché attraversando facilmente la rete di contenimento, trovano disponibilità di alimento e rifugio dai predatori.
Gazze e corvi sono spesso presenti nei dintorni dell'allevamento perché frequentano "la discarica" dello stesso, trovando scarti di incubazione e carcasse di animali morti; è evidente come tale presenza risulta correlata alla scarsa igiene nella gestione degli scarti di incubazioni e dei residui di lavorazione.
Piccioni e tortore dal collare frequentano gli allevamenti di selvaggina sia per la disponibilità di alimenti che di siti di nidificazione.
La situazione, per quanto riguarda i virus Influenzali aviari, risulta essere particolarmente a rischio in relazione alla dislocazione dell'allevamento, in particolare alla vicinanza di zone umide frequentate da uccelli acquatici ed alla stagione. La distanza dagli ambienti e dagli uccelli acquatici è correlata alla specie che frequenta le strutture dell'allevamento; ad esempio storno e piccione risultano particolarmente pericolosi perché possono assicurare un collegamento fra i due siti anche quando sono distanti alcune migliaia di metri.
Per quanto riguarda la stagione il fattore rischio risulta correlato alla densità di allevamento ed al flusso migratorio degli uccelli selvatici; pertanto si avrà un rischio massimo in primavera-estate con voliere piene al massimo della capienza e con forte promiscuità di allevamento (in voliere attigue possiamo trovare soggetti di poco più di 4 settimane e soggetti di oltre 3 mesi di età); e un rischio modesto in tardo autunno-inverno quando nelle voliere la densità di allevamento è molto inferiore e la promiscuità assente perché sono presenti solo i riproduttori e gli ultimi animali allevati, tutti adulti, non venduti.
4. PATOGENESI
Il virus dopo un primo ciclo di replicazione a livello della mucosa dell’ apparato digerente, nel caso di contagio per ingestione o delle mucose dell’apparato respiratorio, quando il virus venga inspirato, passa in circolo e si replica all’ interno delle cellule endoteliali dei vasi e da qui diffonde agli organi bersaglio primari degli apparati : respiratorio, digerente e nervoso. ( Castrucci, 1980)
5. SINTOMATOLOGIA
Il periodo d'incubazione può variare da poche ore a 3 giorni per i soggetti singoli e fino a 14 giorni per un allevamento. Ciò dipende dalla dose del virus, dalla via di esposizione, dalla specie interessata e dalla capacità di riconoscere precocemente sintomi clinici. Nei volatili domestici colpiti dai virus influenzali HPAI si sono riscontrati abbattimento (Fig.8), pallore di cresta e bargigli (Fig.9), anoressia, accresciuta tendenza alla cova nelle galline ovaiole e diminuita ovodeposizione, sintomi nervosi, (Easterday et al, 2001).
Figura 8 Ovaiole che manifestano depressione e riluttanza al movimento (Capua et al, 2001.).
Figura 9: Grave depressione nella fase acuta. Notare le creste pallide e flaccide. (Capua et al, 2001.)
La sintomatologia respiratoria può presentarsi sia in forma lieve che evolvere in una forma con tosse, starnuti, rantoli, eccessiva lacrimazione, tendenza ad accalcarsi, penne arruffate, sinusite, edema alla testa e alla faccia; inoltre si può riscontrare cianosi della cute non ricoperta da penne, sintomi nervosi come il torcicollo (Fig.10) e la diarrea (emorragica o urine verdi con ingente presenza di urati) (Fig 11). (Capua et al.,2001 e Easterday et al, 2001)
Figura 10. Giovane struzzo con grave sintomatologia nervosa. (Capua et al, 2001.)
Figura 11. Feci e urine emorragiche in uno struzzo colpito da virus influenzale HPAI (Capua et al, 2006).
I sintomi possono manifestarsi da soli o in varie combinazioni. Comunque con l'aumentare della patogenicità del virus, si hanno problemi nuovi, a partire dalla percentuale di morbilità e mortalità che aumenta arrivando anche al 100% nei ceppi altamente patogeni. In alcuni casi la malattia è fulminante e i soggetti vengono trovati morti senza sintomi premonitori. Nei volatili selvatici le infezioni da virus influenzali sono inapparenti con assenza di sintomi chiari di malattia. ( Easterday,2001)
6. LESIONI ANATOMOPATOLOGICHE
Le lesioni anatomopatologiche sono molto variabili, e quelle riportate in letteratura sono state osservate in infezioni naturali o sperimentali. Nell’infezione da virus altamente patogeni come H5N1, le lesioni possono anche essere poco marcate perché i soggetti colpiti possono morire in tempi rapidi, prima che le lesioni siano manifeste. Nei casi in cui la morte non sia così repentina, si può riscontrare inizialmente un interessamento della testa con edema (Fig.12), sinusite (da catarrale, a fibrinosa, sierofibrinosa, o muco-purulenta e caseosa), congestione e cianosi di cresta e bargigli, emorragie a livello delle zampe (Fig. 13) (Capua et al.,2001, Easterday et al, 2006)
Figura 12. Pollo con edema della testa, gonfiore ai seni e edema periorbitale ( Capua et al, 2001.)
Figura 13. Pollo: congestione, emorragie e gonfiore dei tarsi. (Capua et al, 2001.)
A livello degli organi interni si possono osservare emorragie sulla muscolatura (Fig.14), edema e tracheite sierosa o fibrinocaseosa (Fig.15), polmonite congestitio-emorragica, ispessimento dei
sacchi aerei che possono essere e ricoperti di essudato fibrinocaseoso ( Easterday et al,2006).
Figura 14. Pollo: petecchie ed ecchimosi ai muscoli pettorali (Capua et al.,2001)
Figura 15. Tacchino: Tracheite con presenza di materiale fibrinoso nel lume. ( Moreno,IZS,Brescia)
A carico dell’apparato digerente si possono riscontrare petecchie sulle sierose e sulla mucosa del proventricolo e a livello dell’istmo (Fig.16), a carico dei cechi e dell’intestino, soprattutto nel tacchino. Si può osservare inoltre enterite da catarrale a fibrinosa, da necrotica a congestitio-emorragiche, petecchie e focolai di necrosi a carico di fegato, milza e pancreas (Fig 17) ed emorragie nel grasso addominale ( Easterday et al,2006).
Figura 16. Pollo: petecchie sulla mucosa del proventricolo. (Moreno,IZS,Brescia)
Figura 17. Enterite necrotico-emorragica, associata a pancreatite (Rose et al, 2006)
Inoltre si può rilevare necrosi dei tessuti linfoidi (Fig.18), peritonite catarrale o fibrinosa e peritoniti da uova (Fig.19), oltre a focolai necrotici o lesioni congestizio-emorragiche a carico renale con depositi di urati negli ureteri, emorragie puntiformi sulla superficie dell’epicardio e degli atri. (Easterday et al,2006).
Figura 18. Pollo: necrosi linfoide a livello delle valvole ileocecocoliche
7. LESIONI ISTOPATOLOGICHE
Istologicamente in corso di infezioni da virus dell’influenza aviare causate da ceppi HPAI possiamo riscontrare edema, iperemia, emorragie e manicotti perivascolari a carico di miocardio, milza (Fig. 20), polmoni, cervello, fegato e reni. a livello cardiaco si rileva miocardite e necrosi accompagnata da gravi alterazioni dell' ultrastruttura del tessuto miocardico (Fig. 21). Inoltre si possono osservare processi degenerativo-necrotici a carico di milza, fegato, reni, pancreas e muscoli scheletrici soprattutto i muscoli esterni dell’occhio e degli arti (Capua et al.,2001).
Figura 20. Necrosi fibrinoide della parete delle arteriole spleniche, E-E. (Capua et al, 2001.)
Figura 21. Piccoli foci d’infiammazione non suppurativa con degenerazione delle cellule miocardiche. (Chen et al,2006)
A livello cerebrale si possono rilevare focolai di necrosi, manicotti perivascolari, focolai gliali, proliferazione vascolare e alterazioni neuronali, encefalite non suppurativa diffusa o encefalite
diffusa caratterizzata da diffusi manicotti perivascolari, con cellule mononucleate, necrosi delle cellule nervose con edema e emorragie(Fig.22).
A carico dell'occhio si può riscontrare necrosi e flogosi della congiuntiva, infiltrazioni di linfociti a
livello del nervo ottico o nel tessuto perivascolare dell’iride (Fig.23).
Figura 22. Cervello: foci d’infiammazione non suppurativa caratterizzati da manicotti perivascolari costituiti da cellule mononucleari. ( Chen et al,2006)
Figura 23. Infiltrazione linfocitaria e presenza di alcune plasmacellule nel tessuto perivascolare dell'iride. (Capua et al, 2001.)
8. L’INFLUENZA AVIARE NEI MAMMIFERI
8.1.La malattia nel cane
Nel cane in seguito all'ingestione di pollo infetto si son riscontrati sintomi quali: febbre alta, dispnea, letargia e morte dopo 6 giorni. Le lesioni erano caratterizzate da secreto nasale emorragico, congestione ed edema polmonare, congestione e necrosi di milza, rene e fegato (Fig.24 A). istologicamente si osserva grave edema polmonare, polmonite interstiziale con infiltrazione di cellule infiammatorie, emolisi con corpi inclusi scuri nel parenchima polmonare (Fig.24 B), fegato con aree focali di necrosi (Fig.24 C). Inoltre il rene mostra una leggera nefrite con degenerazione tubulare, mentre non è evidenziabile nessuna altra alterazione microscopica a carico di altri organi (Songserm et al, 2006).
Figura 24. Congestione epatica con aree necrotiche in cane affetto da H5N1. (SONGSERM et al, nov.2006)
8.2.La malattia nel gatto
Un caso di influenza aviare nel gatto è stato descritto nel 2004 in Thailandia. Il caso riportava di un gatto maschio di 2 anni rinvenuto morto. Dall’anamnesi risultò che l’animale 5 giorni prima aveva mangiato un piccione e nei giorni seguenti aveva presentato febbre (41°C), dispnea, depressione, convulsioni e atassia. All’esame autoptico si è evidenziato, congiuntivite, congestione cerebrale,
edema polmonare, grave polmonite, congestione renale ed emorragie sulla sierosa intestinale. Istologicamente si può riscontrare una encefalite e una gliosi non suppurative, infiltrazioni mononucleari negli spazi di Virchow-Robin, delle vasculiti e con congestione sia del cervello che del cervelletto; inoltre a carico del polmone si hanno lesioni per grave edema polmonare, polmonite interstiziale e congestione (Fig.A), nel fegato una necrosi multifocale (Fig.B), nel rene una tubulonefrite e una deplezione linfocitaria della milza. (Songserm et al, Aprile 2006)
(Songserm et al, Aprile 2006)
8.3.La malattia nella tigre e nel leopardo
In alcuni casi descritti nella tigre e nel leopardo si è potuto osservare febbre alta, dispnea, morte improvvisa. La necroscopia effettuata su questi animali ha evidenziato grave compromissione polmonare ed emorragie multifocali in molti organi, inclusi polmoni, cuore, timo, stomaco, intestino, fegato e linfonodi. Sul piano microscopico si è rilevato perdita dell'epitelio bronchiolare e alveolare, ispessimento delle pareti alveolari, riempimento del lume alveolare per l'essudato misto a fibrina, eritrociti, neutrofili e macrofagi. Nella metà dei casi osservati si è riscontrata encefalite caratterizzata da infiltrazione multifocale di neutrofili e macrofagi. (Keawcharoen et al,2004.)
9. LA MALATTIA NELL’ UOMO
Nei casi umani di Influenza aviare si è rilevato febbre superiore a 38 °C, faringodinia, tosse grassa, infezioni oculari, polmonite, mialgia e diarrea. Nei casi ad evoluzione fatale si è osservato distress respiratorio secondario alla polmonite virale (ha interessato in particolare i soggetti più deboli). Le complicazioni sono state nel 75% dei casi insufficienza respiratoria, insufficienza cardiaca (42%), insufficienza renale (33%), e morte tra la 8° e 23° giornata (33-100%). Radiograficamente si son potuti osservare infiltrati irregolari a carico dei lobi polmonari (Fig 25) (Chotpitayasunondh, 2004).
Figura 25. Reperto rx che evidenzia radiopacità irregolari a carico dei polmoni
Istologicamente si sono riscontrate membrane ialine che coprono gli spazi alveolari del polmone con congestione vascolare e qualche infiltrato linfocitario nell’interstizio, con fibroblasti reattivi (Fig.A); un’ area con proliferazione di fibroblasti reattivi nell’interstizio con pochi linfociti e non sono visibili inclusioni nucleari del virus (Fig.B); lo spazio alveolare contiene emorragie e presenta un essudato fibrinoso (Fig.C); a carico della milza vi sono numerose cellule linfoidi atipiche intorno alla polpa bianca ma non vi sono inclusioni nucleari virali (Fig.D). (Chotpitayasunondh, 2004)
10. DIAGNOSI
10.1.Prelievo di campioni e materiale patologico
Per l’accertamento diagnostico è possibile effettuare tamponi cloacali, tamponi tracheali, non che la raccolta di feci e altri secreti/escreti. Come tamponi si possono utilizzare batuffoli in cotone asciutto, dacron o tamponi alginati di varie dimensioni (Fig 26).
I tamponi una volta raccolti devono essere immersi in terreni sterili da trasporto (1-2 ml) contenenti antibiotico per ridurre la crescita batterica (Easterday et al, 2001, K. Rose et al,2006).
Il Materiale Patologico, organi e/o tessuti, può essere posto in tubi o barattoli di plastica sterili (Fig 27). Il materiale raccolto deve essere mantenuto a 4°C e saggiato entro 48 ore dal prelievo. Per tempi maggiori di conservazione i campioni devono essere stoccati a -70°C o temperature inferiori
(K. Rose et al,2006).
Figura 27. Contenitori sterili per la raccolta dei campioni biologici (Capua et al, 2001.)
10.2.Diagnosi diretta
La diagnosi diretta permette la dimostrazione diretta del virus in organi e tessuti. Test diagnostici rapidi sono l’immunofluorescenza, l'immunoperossidasi, l’ELISA e l’ibridazione in situ. La precisa caratterizzazione e tipizzazione dei virus influenzali è data però dall’isolamento e identificazione.
11.2.1 Isolamento e Identificazione virale
Il materiale patologico prelevato prima di essere seminato deve essere omogeneizzato, diluito al 10% in soluzione fisiologica sterile, chiarificato mediante centrifugazione e successivamente aggiunto di antibiotici. Per l’isolamento si utilizzano uova embrionate di pollo SPF di 9-11gg d’incubazione, anche se possono essere utilizzate colture cellulari in linea primaria o continua. Le uova sono inoculate in cavità allantoidea o amniotica con 0,1-0,2 ml di sospensione. Dopo 72 ore PI, i liquidi amniotici e allantoidei sono raccolti e saggiati con eritrociti di pollo per la valutazione dell’attività emoagglutinante. La replicazione del virus è dimostrata dall'attività emagglutinante dei liquidi allantoidei. Il liquido allantoideo positivo alla emagglutinazione è sottoposto successivamente al test di Inibizione dell’emoagglutinazione (IH) per la identificazione virale. A tal fine per l’identificazione dell’emoagglutinina il campione è sottoposto ad una serie di antisieri per le 16 distinte emagglutinine dei virus influenzali. Il sottotipo di NA può essere identificato dal test di Inibizione della Neuraminidasi (IN) con antisieri per le nove neuraminidasi conosciute.
È da tener conto che anche altri virus sono emoagglutinanti (Paramixovirus). A tal fine è appropriato saggiare il campione in esame per l’antigene NP, che identifica l’antigene tipo specifico dei virus influenzali mediante il test della immunodiffusione doppia. Per la valutazione della
patogenicità è utilizzato l’Indice di Patogenicità Intravenosa (IPIV) e il Sequenziamento nucleotidico della HA.
10.3.Diagnosi indiretta
La diagnosi indiretta si basa sulla evidenziazione della presenza di anticorpi in circolo.
Le odierne tecniche sierologiche sono in grado di rilevare la presenza di anticorpi già 7-10 giorni post infezione. I test più comunemente utilizzati sono l'Inibizione dell’emoaggluinazione per la ricerca degli anticorpi anti-HA e l'Immunodiffusione doppia per la ricerca degli anticorpi anti-NP. Altri test sierologici impiegati sono la Sieroneutralizzazione, la Fissazione del Complemento. Più recentemente il test ELISA è stato sviluppato per la ricerca di anticorpi verso il virus dell'influenza aviare. Nei programmi di sorveglianza sierologica, un test per la ricerca degli anticorpi anti-NP è frequentemente usato, dato che consente di rivelare anticorpi verso antigeni cross-reagenti presenti in tutti i virus influenzali di tipo A. Nei saggi sierologici è importante rendersi conto che esiste una considerevole variazione nella risposta immunitaria nelle varie specie aviare. Ad esempio, gli anticorpi anti-NP sono generalmente prevalenti nei tacchini e nei fagiani, ma possono essere non svelabili nelle anatre con infezione riconosciuta. Inoltre gli anticorpi possono essere stimolati sia nelle anatre sia in altri volatili ma possono anche non essere evidenziati con i test convenzionali. Nei polli invece, la presenza di anticorpi anti-HA e anti-NA, è da considerare indicativa di infezione recente. È da tener presente che i sieri di molte specie contengono degli inibitori aspecifici, che possono interferire con la specificità sia del test HI che di altri test. Poiché tali inibitori sono specialmente attivi nei confronti di alcuni virus, rappresentano un grosso problema nella realizzazione di saggi sierologici e nella identificazione del virus. Perciò i sieri devono essere trattati in modo da ridurre o distinguere tale attività, anche se deve essere ancora dimostrata la possibilità che simili trattamenti possano abbassare i titoli di anticorpi specifici. Due sono i trattamenti che vengono impiegati più frequentemente e sono: l'impiego dell'enzima che distrugge il recettore (RDE) ed il periodato di potassio. Oltre agli inibitori aspecifici della emagglutinazione, i sieri di volatili, come tacchini e oche, possono provocare l'agglutinazione degli eritrociti di pollo. Tale effetto può mascherare la presenza degli anticorpi specifici se i titoli sono bassi. Questo tipo di attività emagglutinante può essere rimossa con un pretrattamento del siero con gli eritrociti di pollo. Questo problema può talvolta essere evitato impiegando nel test HI gli eritrociti della specie omologa. (Easterday et al, 2001)
11. Diagnosi differenziale.
paramyxovirosi per la sintomatologia nervosa, enterica e respiratoria; le infezioni da Clamydia per la congiuntivite, l’edema delle palpebre,la diarrea, il calo della deposizione, la rinite, la dispnea e i sintomi nervosi; le infezioni da Mycoplasma per i sintomi respiratori e la congiuntivite,il calo della deposizione ed altre infezioni ad eziologia batterica. (Asdrubali G.,1996)
12. Profilassi
Il controllo dell’ influenza aviare si effettua con l’ applicazione di una profilassi diretta che prevenga il contatto dei soggetti sensibili con quelli portatori del virus, soprattutto uccelli selvatici ed esotici. Si può attuare anche una profilassi indiretta utilizzando vaccini inattivati in emulsione oleosa, tenendo comunque conto che la diversità antigenica tra i vari ceppi rende questa procedura poco praticabile, perché nella stessa zona possono esservi più sottotipi. In zone in cui si riscontrano casi d’ influenza aviare ad alta patogenicità non si dovrebbe procedere alla vaccinazione ma allo stamping out per l’ eradicazione della malattia. (Asdrubali G.,1996)