Chirurgia del Trapianto renale
Il rene trapiantato viene solitamente allocato in fossa iliaca destra, in sede extra-peritoneale. Il polo vascolare venoso viene creato per mezzo dell’ anastomosi tra vena renale del donatore e vena iliaca esterna del ricevente, mentre il polo arterioso sottende l’unione dell'arteria renale del donatore, con l'arteria iliaca esterna del ricevente. Alcuni centri preferiscono utilizzare l’arteria iliaca interna del ricevente, con anastomosi termino-terminale. L'uretere viene suturato alla vescica mediante un’uretero-neocistostomia, che prevede la creazione di un tunnel con la mucosa e gli strati muscolari vescicali, atto ad impedire la risalita delle urine dalla vescica al rene trapiantato (76,77).
Nell’impossibilità di poter utilizzare la vescica del ricevente, può essere creata un’uretero-ureterostomia.
La tecnica chirurgica prevede tre tempi:
-il primo che riguarda l’espianto da donatore,
-il secondo che riguarda le operazioni da banco del rene prelevato, -il terzo che riguarda l’impianto del ricevente.
Primo tempo
Donatore cadavere. Al paziente, posto in posizione iperestesa , gli viene
praticata un'incisione cruciforme (Fig.1).
Fig.1 incisione per trapianto renale
Superati i piani muscolari e separato dal retroperitoneo il pacchetto intestinale, vengono legate l’arteria e la vena mesenterica inferiore, le arterie iliache
comuni ed vengono identificati ed isolati gli ureteri.
Devono essere sezionate e legate anche l’arteria gonadica, l’arteria mesenterica superiore e il tronco celiaco. Inserito un catetere, a livello della biforcazione aortica e viene sospinto verso l'alto e bloccato con il gonfiaggio del palloncino al di sopra dell'origine delle arterie renali. Questo è necessario per perfondere l’organo con soluzione perfrigerata. Invece un altro catetere, posto nella vena cava, permette il deflusso della soluzione. Quest’ultima può essere iperosmolare ad alto contenuto di glucosio (Collins), oppure idroelettrolitica contenente macromolecole (Belzer), e si rende necessaria, per evitare il rigonfiamento cellulare che l’ischemia, a causa dell’acidosi , dell’alterazione delle pompe Na/K e dell’aumentata permeabilità di superficie, tende a determinare.
Fig.2 perfusione in situ
Dopo l’incisione della fascia di Gerota, viene mobilizzato e quindi prelevato il rene, con la preservazione del grasso perirenale. I vasi renali vengono asportati completamente, fino alla loro origine. La milza e linfonodi invece, vengono utilizzati per la tipizzazione tissutale.
Donatore vivo. Generalmente la scelta del rene da trapiantare viene lasciata al
chirurgo. Il rene sinistro, rispetto al rene destro, offre una vena renale più lunga ed un’arteria più corta, mentre il rene destro ha una situazione vascolare, che è esattamente l’opposto di quella sinistra. Inoltre a fronte di una migliore accesso al
rene destro per la ptosi di cui è caratterizzato , la stessa situazione anatomica espone ad un maggiore rischio di complicanze chirurgiche. Tendenzialmente il prelievo del rene sinistro dal donatore, prevede l’allocazione in fossa iliaca destra del ricevente per la possibilità di creare delle anastomosi più semplici. In presenza di una differente funzionalità renale nel donatore, tra i due organi deve essere asportato il rene con funzionalità peggiore e nel caso esistano arterie renali multiple, deve essere prelevato il rene con irrorazione arteriosa singola o irrorato da un inferiore numero di rami arteriosi.
Il paziente posizionato in decubito "semi-laterale" deve formare, tra la sua schiena e il letto operatorio , un angolo acuto di 30°-45° (Fig.1,2).
Fig. 3 posizione del paziente
L’ incisione che origina dalla linea ascellare posteriore, deve prolungarsi oltre la l’estremità della XII costa fino al margine laterale del muscolo retto dell'addome, fino a circa 3-5 cm al di sotto dell'ombelico. L'uretere viene sezionato e legato il più vicino possibile alla vescica , l'arteria renale vicino all’origine in aorta e la vena renale in prossimità della vena cava inferiore. Dopo l’incisione della fascia di Gerota, deve essere iniziata la mobilizzazione del rene e del grasso perirenale, procedendo dal polo inferiore in senso prossimale.
Secondo tempo
Donatore cadavere. Il confezionamento dei poli vascolari del rene prelevato
Fig. 4 preparazione poli vascolari
Dopodiché i reni vengono riposti in sacchetti di plastica, ripieni di soluzione conservante che verranno a loro volta immersi in ghiaccio e quindi posti in contenitori pronti per il trasporto.
Donatore vivente. È a questo punto che avviene la perfusione dell’organo prelevato, dopo averlo adagiato su un letto di ghiaccio,
fig. 5 perfusione del rene prelevato
Terzo tempo
Il rene viene allocato in sede extraperitoneale, in una delle fosse iliache. Nel ricevente viene preparata la vena iliaca esterna sezionata ed irrorata con soluzione eparinata che viene poi anastomizzata alla vena renale del rene prelevato. L’anastomosi arteriosa prevede una sutura termino-terminale tra l'arteria renale e l'arteria iliaca interna (Fig.10).
Dopodiché si esegue l’uretero-neocistostomia .Questa può essere eseguita con due tecniche, la prima intra-vescicale modificata secondo Paquin, per mezzo della quale dopo l’identificazione del trigono viene creato un tunnel sottomucoso, in prossimità del meato originale , che rappresenta il neo-orifizio ureterale.
Fig. 6 tecnica intravescicale secondo Paquin
La seconda invece è rappresentata dall’ uretero-neocistostomia con tecnica extra-vescicale in analogia alla tecnica ci Gregoir-lich, che prevede il riempimento della vescica con soluzione fisiologica, attraverso un catetere trans-uretrale ed una incisione del detrusore vescicale, evidenziando così la mucosa vescicale e permettendo l’anastomosi dell’uretere.
Fig.7 tecnica extravescicale
L’anastomosi uretero-ureterale deve essere riservata nell’impossibilità di utilizzare la vescica e nei casi in cui sia necessaria la preservazione dell’uretere.
Postoperatorio
In questo periodo vengono rimossi tutti i drenaggi, comprendenti quello para-vescicale e quello proprio della cistostomia sovrapubica e il catetere trans-uretrale.
Chirurgia del trapianto di pancreas e rene
Dopo il prelievo del pancreas, da donatore cadavere, devono essere ricostruiti i peduncoli vascolari. Il polo arterioso prevede l’anastomosi tra il moncone dell'arteria splenica e dell'arteria mesenterica superiore con un graft iliaco ad Y prelevato dallo stesso donatore , mentre il polo venoso viene garantito dalla vena porta, con la vena mesenterica superiore legata al bordo inferiore del pancreas e la vena splenica legata alla fine della coda del pancreas.
Le principali varianti riguardano la scelta del tipo di drenaggio venoso e dei tipo di secrezione esocrina e constano del:
1.drenaggio sistemico - vescicale 2.drenaggio sistemico - enterico. 3.drenaggio portale - enterico
Drenaggio sistemico vescicale
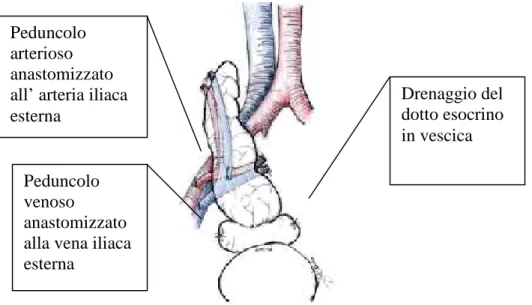
Il rene viene collocato in fossa iliaca sinistra e viene creata un’anastomosi tra arteria iliaca interna e arteria renale, mentre il pancreas allocato in fossa iliaca destra, attraverso l’anastomosi del suo peduncolo venoso alla vena iliaca esterna del ricevente ottiene un deflusso nel sistema cavale del ricevente. Il polo arterioso invece viene suturato all’arteria iliaca esterna del ricevente. La tecnica procede con la creazione del drenaggio del dotto esocrino in vescica attraverso una sutura tra duodeno del donatore, seconda porzione, e vescica , parete posteriore (78). Questo tipo di drenaggio non solo permette il monitoraggio della funzione pancreatica, con il dosaggio dell'amilasuria , garantendo un’identificazione precoce di rigetto acuto, ma facilita anche il prelievo bioptico del pancreas che può avvenire attraverso una cistoscopia (Fig.1).
Figura 1-Trapianto di pancreas con drenaggio sistemico vescicale
La tecnica non è priva di complicanze che infatti comprendono, le pancreatiti da reflusso, particolarmente nelle vesciche neurologiche, le cistiti e le uretriti chimiche, le infezioni urinarie, le duodeniti del segmento di connessione, i tumori vescicali, la calcolosi vescicale, le stenosi uretrali, le erosioni uretrali, le epididimiti, le prostatiti e gli ascessi prostatici. Inoltre a livello sistemico può insorgere un’acidosi metabolica o una deplezione di liquidi extracellulari, a causa delle perdite, in urina, di secrezioni pancreatiche ricche in bicarbonato di sodio. Le complicanze urologiche hanno una frequenza del 50 - 77% e raramente portano alla perdita del graft (79).
Drenaggio sistemico enterico
L'organo pancreatico allocato in fossa iliaca destra, ha la testa posizionata verso la pelvi e mantiene le stesse anastomosi dei poli vascolari, descritte precedentemente. Il dotto pancreatico viene suturato all’intestino tenue, usando un piccolo segmento di duodeno (Fig. 2) (80). Con questa tecnica viene perso il parametro indiretto di funzionalità pancreatica rappresentato dall'amilasuria e viene ridotto notevolmente il rischio di cistiti ricorrenti ed infezioni più aggressive. I trapianti di rene e pancreas eseguiti con drenaggio vescicale o drenaggio enterico, a parità di sopravvivenza del graft pancreatico, incidono differentemente sull’emivita del graft renale, che risulta essere migliore nel drenaggio sistemico - enterico.
Peduncolo arterioso anastomizzato all’ arteria iliaca esterna
Peduncolo venoso anastomizzato alla vena iliaca esterna
Drenaggio del dotto esocrino in vescica
Fig.2 trapianto di pancreas con drenaggio sistemico-enterico
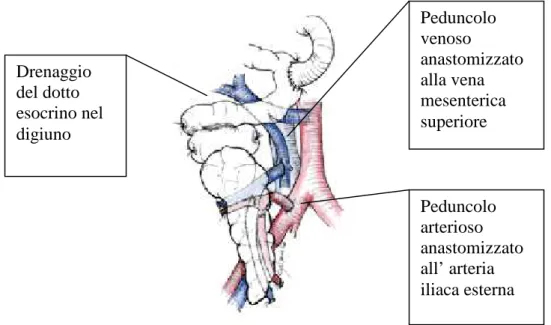
Drenaggio portale-enterico
Questo tipo di drenaggio prevede il posizionamento del pancreas all'interno della cavità peritoneale, in doccia parietocolica destra, con la testa orientata verso il fegato. L'anastomosi termino-laterale tra la vena porta dell'organo e la vena mesenterica superiore del ricevente viene confezionata per prima, mentre conseguentemente viene realizzata l'anastomosi arteriosa tra il peduncolo arterioso e l'arteria iliaca comune del ricevente. L'anastomosi duodenodigiunale prevede la sutura della seconda porzione del duodeno del donatore con un'ansa dell’intestino tenue, ad Y alla Roux , precedentemente esclusa dal transito. (Fig.3)(80). Il drenaggio portale enterico è una tecnica che riproduce la normale fisiologia dell'organo e permettendo all‘insulina di entrare nel sistema portale riesce ad evitarne l’iperinsulinemia, frequente nelle altre tecniche di drenaggio. Inoltre riesce a ridurre l’ incidenza di rigetto acuto, con un meccanismo che attualmente è ancora inspiegabile. La tecnica ha dimostrato di avere una sopravvivenza analoga a quella degli altri tipi di intervento. Per quanto riguarda il rene, esso viene trapiantato in fossa iliaca sinistra, attraverso un accesso extraperitoneale, con la creazione delle consuetudinarie anastomosi. L'uretere viene suturato sulla parete anterolaterale della vescica secondo la tecnica di Grégoire-Lich, intubandolo con un catetere di Bracci , fatto risalire fino alla pelvi renale. Grazie all’
Peduncolo arterioso anastomizzato all’ arteria iliaca esterna Peduncolo venoso anastomizzato alla vena iliaca
esterna Drenaggio del
dotto esocrino nell’intestino
ottimizzazione delle procedure chirurgiche ed ai farmaci immunosoppressori di nuova formulazione , l'incidenza di rigetto, per trapianto di pancreas isolato o rene e panceras, attualmente dall'80% dei primi anni '90 è sceso al 20%.
Figura 3-Trapianto di pancreas con drenaggio enterico portale.
Peduncolo arterioso anastomizzato all’ arteria iliaca esterna Peduncolo venoso anastomizzato alla vena mesenterica superiore Drenaggio del dotto esocrino nel digiuno
Chirurgia del trapianto di isole pancreatiche: Il metodo Ricordi
Le isole di Langerhans, contengono le cellule in grado di secernere l'insulina (betacellule), e costituiscono solo il 2-5% dell'intero tessuto pancreatico. Il trapianto di queste isole si pone l'obiettivo di trapiantare solo quella parte del pancreas, che deve essere sostituita nel paziente affetto da diabete mellito insulino-dipendente. Camillo Ricordi, del Diabetes Research Institute di Miami, è l’inventore di una macchina che isola e purifica la parte pancreatica di interesse.
“The Ricordi Chamber” consta dei seguenti steps:
- la preparazione del pancreas attraverso l’ iniezione di agenti chimici digestivi e la sua frammentazione,
- il passaggio di porzioni pancreatiche inferiori a mezzo millimetro, - la fase ricircolatoria con l’ aumento della temperatura della soluzione ,
- la dissoluzione del tessuto limitrofo alle isole, attraverso il circolo di una soluzione contente enzimi digestivi portati a 37° C,
- l’interruzione della fase precedente riportando la soluzione ad una temperatura di 10° C,
- la raccolta delle insule mediante un gradiente di densità.
Le insule migliori ottenute dopo l’intero processo rimangono in superficie e dopo aver superato un attento controllo vengono coltivate.
Una volta purificate con successo, le isole vengono trasferite nel fegato del paziente ricevente sotto guida ecografia. La procedura necessita di un catetere, che inserito nel lume della vena porta permette alle isole di raggiungere il fegato seguendo la direzione del flusso sanguigno e di impiantarsi , generando una
rete di supporto vascolare propria.
Nella sede di arrivo del fegato, prima ancora dello sviluppo della rete vascolare, generalmente si attiva una reazione locale infiammatoria aspecifica, che può portare a distruzione anche il 50% delle stesse cellule infuse. L’unico parametro suggestivo di morte delle insule, è la glicemia, ma quando si verifica il suo aumento, la situazione di danno è già in una fase di non recupero e un’ulteriore infusione di insule
risulta essere inefficace (Fig.1). Inoltre gli attuali regimi immunosoppressivi hanno normalmente un effetto di indebolimento del funzionamento delle isole e/o dell’azione dell’insulina (81).
Attualmente il trapianto di isole viene eseguito in pazienti diabetici, che abbiano già ricevuto il trapianto di rene oppure, seppur con maggiore difficoltà, contemporaneamente al trapianto renale, dopo aver purificato le isole dal pancreas dello stesso donatore di rene. La tecnica però è ancora in via sperimentale , limitata non solo dalla capacità di prelevare isole realmente vitali e ritenute idonee al trapianto ma anche per la necessità di utilizzare , per singolo intervento, isole provenienti da più donatori. Le complicanze connesse a questa tecnica sono la tossicità intrinseca della terapia immunosoppressiva, le emorragie intraddominali post-intervento e la trombosi della vena porta.
Chirurgia del trapianto di fegato
Dal punto di vista chirurgico, il trapianto di fegato può essere diviso in tre fasi: -la prima che prevede il prelievo,
-la seconda che consta nella chirurgia da banco, -ed una terza in cui avviene il trapianto.
Prima fase
Il prelievo da donatore cadavere può essere eseguito con due tecniche, la prima che presuppone l’isolamento ed il prelievo degli elementi dell’ilo epatico prima della perfusione fredda, la seconda invece , che prevede il prelievo dopo aver effettuato la perfusione. La più utilizzata è la seconda, in cui il fegato viene bagnato con soluzione a 4 °C , per via retrograda lungo l’aorta (82).
Fig.1 incisone per l’esecuzione del trapianto di fegato
Seconda fase
Dopo aver prelevato l’organo, questo viene adagiato sopra un letto di ghiaccio, e sottoposto alle procedure da banco, che consistono in un attenta analisi e nella preparazione dei peduncoli vascolari, arteriosi e venosi e di quello portale. Al termine delle procedure, poi l’intero organo viene riposto all’interno di sacchetti sterili contenenti ringer lattato e ghiaccio .
L’incisione segue il margine dell’arcata costale destra e talvolta si prolunga sull’emiarcata sinistra.
Terza fase
Questa fase procede in circolazione extracorporea (CEC) ed è a questo punto che vengono create le anastomosi tra i vasi del donatore e del ricevente, per ristabilire una continuità della vena cava sovraepatica, della vena cava sottoepatica, della vena porta e dell’arteria epatica (Fig. 1). La tecnica più utilizzata di confezionamento della anastomosi cavale, è quella che prevede il collegamento termino-terminale tra vena cava del donatore e quella del ricevente. Questa procedura permette di lasciare in situ la vena cava inferiore retroepatica del donatore. L’intervento viene completato dalla colecistectomia profilattica e dalla anastomosi biliare coledo-coledocica su drenaggio di Kehr, oppure epatico-digiunale su ansa esclusa alla Roux.
Fig 1 trapianto ortotopico di fegato
Split liver
La tecnica di split liver consente di ottenere due organi trapiantabili, solitamente in un ricevente adulto ed in un bambino, da un unico donatore cadavere. La procedura di divisione può essere effettuata in situ, nel donatore cadavere a cuore battente o al termine dell’espianto ex situ, durante la chirurgia da banco in condizioni di ipotermia. Nella variante classica il fegato viene suddiviso nel settore laterale sinistro, comprendente i segmenti II e III, trapiantabile in un bambino e nel lobo destro per ricevente adulto, consistente nei segmenti V - VI - VII - VIII, associati al segmento IV ed I (Fig. 1).
Fig. 1 suddivisione in segmenti del fegato
Per quanto riguarda il distretto vascolare, le strutture comuni vengono lasciate per il graft rappresentato dal lobo destro, mentre vengono ricostruite per l’altro graft .
Una tecnica innovativa prevede la creazione di due graft trapiantabili entrambi in pazienti adulti, costituiti uno dai segmenti I - II - III - IV e l’altro dai segmenti V- VI -VII - VIII (83).
Fegato parziale da donatore vivente
In generale la porzione di fegato trapiantabile deve essere almeno l'1% del peso corporeo del ricevente e nella maggior parte dei casi il lobo epatico destro ha un volume che riesce a soddisfare questo requisito. Oltre alle difficoltà tecniche insite dell’intervento chirurgico, assume ruolo determinante anche il mismatch donatore-ricevente. La parte di fegato sufficiente per il ricevente pediatrico è rappresentato dal segmento laterale sinistro, mentre per il ricevente adulto è necessario il lobo destro.
Trapianti domino
Questo intervento consiste nel trapiantare un fegato proveniente da donatore
cadavere, in un primo paziente affetto da epatopatia metabolica, il cui fegato nativo precedentemente asportato, viene trapiantato in un secondo paziente, affetto
anch’esso da una epatopatia, molto più grave (84). Il fegato impiantato nel primo paziente riesce a determinare una condizione libera da malattia mentre quello affetto da deficit metabolico trapiantato nel secondo paziente ha lo scopo di aumentare la sopravvivenza al paziente in condizioni cliniche più gravi con segni di deficit
metabolico a distanza di tempo.
Fegati ausiliari
Si intende per fegato ausiliario un fegato parziale, trapiantato senza precedente epatectomia del fegato malato. I pazienti candidati a questo tipo di intervento sono tutti quelli affetti da epatite fulminante o sub-fulminante.
Il fegato ausiliario riesce a sostenere temporaneamente le funzioni del fegato malato, in attesa del suo recupero, momento in cui, verrà prelevato dallo stesso paziente ricevente con sospensione della terapia immunosoppressiva. Il primo di questi trapianti è stato eseguito da Gubernatis nel 1991, ad Hannover, ma attualmente si tratta di una tecnica poco utilizzata.