1. INTRODUZIONE
1.1 Generalità sulle membrane
Gran parte dei fenomeni che caratterizzano il mondo biologico è controllata da sistemi a membrana: la respirazione degli animali, la trasmissione degli impulsi nervosi, l’assorbimento dell’acqua nelle piante sono alcuni dei tanti esempi di processi dove le membrane biologiche hanno un ruolo fondamentale e di controllo.
Negli ultimi decenni, l’attenzione degli scienziati si è allargata alla possibilità di riprodurre in sistemi artificiali alcune delle operazioni a membrana identificate nei sistemi naturali. Nasce così la scienza delle membrane (membranologia) e la tecnologia delle operazioni a membrana, oggi una realtà in rapido sviluppo, anche di tipo industriale, che vede impegnati chimici ed ingegneri accanto a biologi, biofisici, medici, ecc. La dissalazione delle acque saline e salmastre via osmosi inversa, il trattamento dei sieri via ultrafiltrazione, la produzione d’azoto puro dall’aria via membrane selettive all’ossigeno, e le celle a membrana per la produzione di cloro-soda sono solo alcuni esempi delle centinaia di processi realizzati su larga scala a livello mondiale.
I risultati fino ad ora raggiunti sono dovuti alla gran mole di ricerca fondamentale ed applicata che, a partire dagli anni ‘70, ha coinvolto numerosi ricercatori di diversa estrazione in studi sui fenomeni di trasporto in membrane, sulla preparazione (a partire da materiali polimerici, ceramici, metallici, ecc.) di membrane in diverse configurazioni (piane, capillari, tubolari, ecc.) e sugli aspetti fluodinamici ed ingegneristici che caratterizzano il loro impiego in numerose operazioni di separazione e di conversione chimica.
sotto adatte forze spingenti, da materia o energia1. Tale definizione mette in evidenza la sostanziale differenza che esiste tra membrane biologiche e membrane artificiali: mentre queste ultime sono fasi, in genere solide, caratterizzate da una struttura ben definita, quelle biologiche sono fasi non ben definite dove specie diverse sono in continuo movimento, somigliando più ad una fase liquida che ad una solida. Inoltre, la complessità delle loro funzioni è notevolmente maggiore di quella delle membrane artificiali.
Le membrane possono essere omogenee e uniformi sia nella composizione che nella struttura, oppure chimicamente e fisicamente eterogenee con pori di dimensioni finite. Il trasferimento di massa può verificarsi per diffusione di singole molecole o ioni attraverso un flusso convettivo indotto dalla presenza di un campo elettrico o di un gradiente di concentrazione, pressione o temperatura.
Le membrane artificiali possono essere suddivise secondo diversi criteri quali: la morfologia, il meccanismo di separazione e la natura chimica. Una classificazione basata, ad esempio, sul tipo di materiale che le compone le suddivide nelle seguenti classi principali1:
- membrane polimeriche di tipo organico (non cariche); - membrane polimeriche a scambio ionico (cariche); - membrane inorganiche (ceramiche e polimeriche); - membrane liquide.
Le membrane polimeriche organiche sono le più utilizzate nei principali processi separativi (osmosi inversa, microfiltrazione, ultrafiltrazione, pervaporazione, separazioni di gas, ecc.) e possono essere preparate con struttura simmetrica, asimmetrica o composita. I polimeri più utilizzati per la loro sintesi sono polisolfoni, politetrafluoroetilene, triacetato di cellulosa, cellulosa rigenerata, poliammidi, polivinilidenfluoruro, poliacrilonitrile, poliisoprene, policarbonati e poliimmidi.
elettrica (negativa per le membrane cationiche e positiva per quelle anioniche) compensata da ioni di segno opposto (contro-ioni). Esse trovano applicazione principalmente nei processi di elettrodialisi, elettrolisi, osmosi inversa e nei dispositivi elettrochimici quali batterie e celle a combustibile1-3.
Le membrane inorganiche possono essere di tipo ceramico, polimerico, eterogeneo, carico, o non carico a seconda della loro natura chimica. Rispetto a quelle organiche esse risultano più stabili alle alte temperature, alle radiazioni ionizzanti e ai forti agenti ossidanti e/o riducenti; per questo motivo trovano impiego in quei processi in cui le condizioni di esercizio risultano particolarmente drastiche (es. separazione di He e H2 da altri gas, separazione di isotopi gassosi, processi catalitici, ecc.). I materiali più utilizzati per realizzare membrane inorganiche sono: γ-allumina, α-allumina, vetro borosilicato, carbonio pirolizzato, zirconio/acciaio, zirconio/carbonio.
Sulla base della loro morfologia, le membrane simmetriche si possono suddividere in membrane porose e membrane dense. Le membrane porose hanno una struttura rigida con un elevato numero di pori interconnessi aventi vari tipi di forma ed una distribuzione casuale, per cui il materiale che le costituisce occupa solo una piccola parte del volume totale. Sono molto simili in struttura e funzione ad un filtro convenzionale. La separazione di materia, indotta dalla presenza di un gradiente di pressione, concentrazione o potenziale elettrico, dipende, infatti, dalla dimensione e dalla distribuzione dei pori all’interno della membrana, nonché dalle caratteristiche del permeato.
Le membrane dense sono costituite da un sottile film polimerico attraverso cui i permeati sono trasportati per diffusione da un’adeguata forza spingente. La separazione dei componenti di una miscela è direttamente legata alla loro diffusività e solubilità nel materiale che costituisce la membrana, per cui risulta possibile separare permeati con dimensioni simili quando essi hanno una diversa solubilità all’interno della membrana. Le membrane asimmetriche sono invece costituite da due strati
ed uno strato poroso più spesso (sublayer, 0.1-0.5 mm) che ha funzione di supporto al primo.
Infine, per membrana liquida s’intende un sottile strato liquido che separa due liquidi miscibili o due gas ed è in grado di controllare il trasferimento di massa da una fase all’altra. Questo tipo di membrana viene generalmente impiegato nella separazione degli ioni metallici (rame, uranio, cromo, zinco, cadmio, ecc.) da soluzioni acquose e nella purificazione delle miscele gassose (es. separazione di CO2, H2S, NOx, idrocarburi insaturi, ecc.).
L’oggetto di studio di questa tesi è stato la ricerca di membrane polimeriche innovative a scambio anionico per applicazioni nelle celle a combustibile. Pertanto, nel seguito, la trattazione si concentrerà su tale classe.
1.2 Le membrane polimeriche a scambio ionico
1.2.1 Cenni storici
Le origini degli studi sulle membrane a scambio ionico risalgono al 1890, quando W.Ostwald, esaminando le proprietà delle membrane semipermeabili, postulò il concetto di “potenziale di membrana” per spiegare il gradiente di concentrazione che si viene a creare in una soluzione di elettroliti in prossimità della membrana4. Nel 1911 Donnan confermò l’esistenza di tale fenomeno e sviluppò un’equazione matematica in grado di descriverne lo stato di equilibrio5 per mezzo del potenziale di Donnan, che corrisponde al moderno concetto di potenziale di membrana in condizioni di equilibrio. Ebbe inizio così la ricerca di base sulle membrane a scambio ionico. Le prime membrane utilizzate a tale scopo furono membrane omogenee acide di tipo colloidale6, poi nacque l’idea delle cosiddette membrane a mosaico o anfoteriche7 e a partire dal 1940 vennero sviluppate le prime membrane a scambio ionico sintetiche (per policondensazione di fenolo-formaldeide) per applicazioni industriali8. Nello stesso periodo fu messo a punto il primo processo di elettrodialisi9 mediante l’uso di membrane anioniche e cationiche disposte in serie alternata a formare un gran numero di scomparti paralleli tra due elettrodi. Tale processo ebbe però alcune difficoltà ad avere applicazioni nell’industria, poiché all’epoca non si disponeva di membrane commerciali con adeguate proprietà, in particolare con bassi valori di resistenza elettrica. Tale inconveniente fu superato nel 1950, quando vennero sviluppate delle membrane a scambio ionico stabili, altamente selettive e con una bassa resistenza elettrica10,11. Da quel momento l’elettrodialisi e le membrane a scambio ionico divennero protagonisti di numerosissimi processi industriali. Il primo impianto per la produzione di sale da acqua marina fu realizzato nel 1960 dalla Asashi
deposizione e accumulo di sale sulla superficie della membrana e degli elettrodi, rendendo così possibile la realizzazione di impianti in continuo13. Nei primi anni ‘70, la DuPont realizzò una membrana commerciale cationica altamente stabile che risultò rivoluzionaria: il Nafion®14. A base di materiale polimerico perfluorosolfonico, tale membrana ebbe, ed ha tuttora, numerosissime applicazioni, industriali e non, tra cui il processo di produzione cloro-soda e la realizzazione di sistemi per lo stoccaggio o la conversione dell’energia (celle a combustibile). Nel 1976 vennero messe a punto le prime membrane bipolari15 che hanno avuto un importante ruolo nello sviluppo dei moderni processi di elettrodialisi16.
Da allora, il crescente interesse rivolto alle membrane a scambio ionico ha portato alla realizzazione di nuovi materiali con l’intento di ottenere valori più bassi di resistenza elettrica, maggiore selettività e migliori proprietà termiche, meccaniche e chimiche. Di conseguenza, si sono realizzate applicazioni industriali sempre più innovative in numerosi settori: alimentare, farmacologico, chimico, biotecnologico, trattamento delle acque di scarico, ecc. 17-22.
1.2.2 Classificazione
Le membrane a scambio ionico, dette anche membrane cariche, vengono comunemente classificate in base al tipo di carica che portano i gruppi ionici legati alla loro matrice strutturale. Le più comuni sono quelle di tipo mono-ionico (Figura 1.2.1), contenenti cioè un solo tipo di carica elettrica; le membrane cationiche hanno gruppi con carica negativa come ad esempio –SO3-, -COO-, -PO32-, ecc., e permettono il passaggio selettivo dei cationi, mentre le membrane anioniche hanno gruppi con carica positiva, come ad esempio –NR3+, -PR3+, -SR2+, ecc., e permettono il passaggio selettivo degli anioni.
Figura 1.2.1 L’azione selettiva delle membrane mono-ioniche
Esistono poi le cosiddette membrane anfotere, caratterizzate dalla presenza di gruppi ionici in grado di scambiare sia anioni che cationi, le membrane mosaico, nelle quali si hanno aree ben separate di scambio cationico e di scambio anionico, e le membrane bipolari, ottenute dalla sovrapposizione di due strati mono-ionici di segno opposto (Figura 1.2.2).
Figura 1.2.2 Distribuzione delle cariche in membrane “bi-ioniche”
Un’ulteriore classificazione delle membrane a scambio ionico può essere effettuata sulla base del tipo di legame che esiste tra la matrice polimerica e i gruppi carichi: se il legame è di tipo chimico si parla di membrane omogenee, se invece il gruppo carico è mescolato fisicamente con la matrice si parla di membrane eterogenee.
Le membrane fin qui descritte sono generalmente costituite da matrici polimeriche
⏐⏐⏐⏐⏐⏐⏐⏐⏐⏐⏐⏐ ⏐⏐⏐⏐⏐⏐⏐⏐ ⏐⏐ + — — — — + + + + + + + + + — — — + — — — — — — + + + + + + + — — — + ⏐⏐⏐⏐⏐⏐⏐⏐⏐⏐⏐⏐ ⏐⏐⏐⏐⏐⏐⏐⏐ ⏐⏐ ⏐⏐⏐⏐⏐⏐⏐⏐⏐⏐⏐⏐ ⏐⏐⏐⏐⏐⏐⏐⏐ ⏐⏐ + + — — — — — — — — + + + + + + + + + + + + + + + + + + — — — — — — + + — — — — — — — — — — — — + + + + + + + + + + + + + + — — — — — — + + +++ +++ + +++ ++ ++ + — — — — — — — — — — — — + + + + + + + + + + — — — — — — + — — + —+++ +++ + +++ ++ ++ +++ +++ + +++ ++ ++ + + — — — — — — — — — — — — — — — — — — — — — — — — + + + + + + + + ++ + + + + + + + + + + —— — — —— — — — — — — + + — — — — + + — — ANIONICA CATIONICA
tipo inorganico. L’attenzione nei confronti di tali membrane è in costante crescita soprattutto perché, rispetto ai polimeri organici, presentano una maggiore stabilità alle alte temperature, alle radiazioni ionizzanti e ai forti agenti ossidanti e/o riducenti. Oltre a questo, negli ultimi anni, si è avuto un crescente interesse per l’uso di elettroliti solidi come separatori o diaframmi in dispositivi elettrochimici a stato solido. Sfortunatamente però, se è vero che il materiale inorganico risulta più stabile di quello organico, avviene anche che membrane sottili e flessibili sono molto più difficili da ottenere con una sostanza inorganica rispetto ad una organica. Per questo motivo sono in fase di studio alcuni polimeri inorganici e inorganico-organici, come ad esempio allumino-silicati, fosfati e fosfonati di metalli tetravalenti, poliorganosilani, polisilani, poliorganofosfazeni, etc1. L’interesse per questo tipo di polimeri risiede nel fatto che a seconda della natura dei gruppi organici contenuti, essi possono risultare amorfi o cristallini, idrofobici o idrofilici e possono essere idonei alla preparazione di film o fibre. Le membrane inorganiche risultano tuttavia più difficili da preparare rispetto a quelle organiche e questo le rende altamente costose, ma rappresentano comunque una valida alternativa alle membrane organiche in quei processi in cui queste ultime non sono utilizzabili o lavorano male. In conclusione si può affermare che le membrane inorganiche non risultano antagoniste rispetto a quelle organiche, bensì complementari.
1.2.3 Metodi di preparazione
Le membrane a scambio ionico più diffuse sono quelle omogenee, costituite da polimeri organici a base idrocarburica o fluorocarburica. In particolare, la classe dei polimeri aromatici risulta la più utilizzata perché poco costosi e di facile reperibilità commerciale. Per di più essi risultano resistenti alle ossidazioni grazie al fatto che
l’energia del legame C-H aromatico è di 435 kJ/mol, mentre quella del legame C-H alifatico è di 350 kJ/mol.
Le strategie più comuni con cui sono preparate le membrane ioniche si differenziano in base al materiale di partenza: monomero, polimero o film polimerico. Partendo da un monomero, il materiale polimerico funzionalizzato necessario per la preparazione della membrana viene ottenuto attraverso una reazione di polimerizzazione. Il monomero di partenza può già contenere il gruppo precursore della funzionalità ionica23-25, oppure acquisirlo in un secondo tempo. La realizzazione di omopolimeri ionici non risulta però conveniente, in quanto è stato dimostrato che la presenza di un elevato numero di gruppi ionici dello stesso segno all’interno di una matrice polimerica rende il materiale particolarmente fragile per effetto repulsivo delle cariche fisse26. Di conseguenza può risultare più conveniente effettuare una copolimerizzazione tra un monomero polare ed un monomero che ha caratteristiche tali da “diluire” le cariche fisse dei gruppi ionici e conferire così una buona stabilità meccanica all’intera membrana. Un esempio di preparazione di membrana anionica a partire da monomero è rappresentato dalla sintesi del copolimero vinilbenzilcloruro-co-divinilbenzene (VBC-co-DVB) e successiva amminazione con ammina terziaria (Figura 1.2.3). Il divinilbenzene rappresenta il monomero che distanzia le cariche fisse presenti nel materiale polimerico finale e, grazie al suo ruolo di reticolante conferisce anche un buon grado di resistenza meccanica alla membrana.
CH CH2 CH CH2 CH CH2
+
CH CH CH2 NR3 CH2Cl CH CH2 CH2Cl CH CH CH2 CH CH2 CH2NR3+Cl-Figura 1.2.3 Preparazione di una membrana a scambio anionico a partire da vinilbenzil cloruro e divinilbenzene27
Come monomero non funzionalizzato è spesso utilizzato lo stirene, anch’esso copolimerizzato con il divinilbenzene, che può essere poi funzionalizzato per dare un materiale polimerico a scambio anionico o cationico a seconda del gruppo ionico che viene introdotto. Generalmente la funzionalità anionica si ottiene attraverso una reazione di clorometilazione e successiva amminazione con un’ammina terziaria, mentre quella cationica è introdotta attraverso solfonazione (Figura 1.2.4).
Il metodo di preparazione di membrane anioniche o cationiche a partire da polimero prevede l’uso di uno o più polimeri commerciali (come polieterechetone, PEK, polistirene, PS, polieteresolfoni, PES), che tal quali, o miscelati tra loro, vengono sottoposti a reazioni chimiche in grado di introdurre gli opportuni gruppi ionici, o loro precursori. La funzionalizzazione può essere effettuata sul polimero in soluzione, in massa o allo stato fuso. Le reazioni comunemente impiegate sono copolimerizzazioni radicaliche ad innesto (graft polymerization), promosse da una radiazione (es. luce ultravioletta) oppure da iniziatori chimici (es. perossidi), in grado di inserire all’interno della catena principale del polimero una quantità variabile di unità monomeriche ioniche o polari.
Si possono ottenere membrane ioniche anche realizzando le suddette funzionalizzazioni direttamente su un film polimerico con adatte caratteristiche di stabilità meccanica, termica e chimica. In questo caso la copolimerizzazione ad innesto viene realizzata mediante l’uso di una radiazione ad alta energia (es. raggi γ), in grado di promuovere la formazione di centri attivi all’interno, o più spesso sulla superficie, del film.
I film polimerici più utilizzati sono solitamente di natura idrocarburica (polietilene, PE; polipropilene, PP) o fluorocarburica (politetrafluoroetilene, PTFE; esafluoroetilene), FEP; poli(tetrafluoroetilene-co-perfluorovinil etere), PFA; poli(etilene-co-tetrafluoroetilene), PETFE; poliviniliden fluoruro, PVDF). Si tratta di materiali polimerici insolubili, con ottime proprietà di stabilità termica, meccanica e chimica, che possono essere facilmente funzionalizzati
attraverso l’innesto di monomeri già recanti il precursore del gruppo ionico oppure da funzionalizzare in un secondo stadio.
Figura 1.2.4 Preparazione di una membrana a scambio anionico e di una a scambio cationico a partire da stirene e divinilbenzene28
1.2.4 Principali applicazioni
Le membrane a scambio ionico attualmente disponibili trovano numerose ed importanti applicazioni, non soltanto in campo industriale. Le più rilevanti sono nei processi di separazione, nei dispositivi elettrochimici e in campo biologico e biomedico.
CH CH2 CH CH2 CH CH2 + CH CH CH2 NR3 CH CH2 CH CH CH2 CH CH2 CH2Cl CH CH CH2 CH CH2 SO3- H+ CH CH CH2 CH CH2 CH2NR3+Cl -H2SO4 ClCH2OCH3 ZnCl2, THF Scambio Cationico Scambio Anionico
I più importanti processi separativi basati su fenomeni di trasporto ionico all’interno di una membrana polimerica sono la dialisi, l’elettrodialisi e il processo cloro-soda1,3 (Figura 1.2.5).
Figura 1.2.5 Schematizzazione di un processo cloro-soda3
La dissalazione dell’acqua con il processo di Osmosi Inversa rappresenta un altro campo di applicazione delle membrane a scambio ionico. In questo processo le membrane costituiscono una barriera selettiva sotto l’azione di un gradiente di pressione. Esse possono essere di tipo neutro, anionico o cationico e vengono generalmente preparate mediante innesto di monomeri (es. acido acrilico e metacrilico, vinil acetato e acrilammide) su adatti film polimerici (es. PE, PTFE e FEP).
Le membrane a scambio ionico, soprattutto quelle cationiche, sono largamente utilizzate anche in dispositivi elettrochimici quali batterie e celle a combustibile. In particolare, quelle acido-solfoniche sono maggiormente impiegate nelle celle a combustibile ad elettrolita polimerico (PEM) mentre quelle acido-carbossiliche nelle batterie.
Le batterie sono dispositivi elettrochimici in grado di sfruttare una reazione di ossido-riduzione per immagazzinare corrente elettrica da erogare in un secondo momento. L’elettrolita, che rappresenta il separatore fisico degli elettrodi (anodo e catodo), fornisce i cationi e gli anioni necessari al bilanciamento delle reazioni redox. Il materiale di tale separatore deve quindi essere chimicamente stabile e durevole nel
impiegate membrane in cellophane, ottenute dalla cellulosa rigenerata, ma tale materiale risultava possedere una scarsa durabilità. Successivamente è stato quindi rimpiazzato da membrane polimeriche ottenute mediante copolimerizzazione ad innesto di acido acrilico, acrilonitrile, o acido metacrilico su film di PE e PETFE (es. nelle batterie ad ossido d’argento e batterie nichel-cadmio). Membrane costituite da α-metilstirene aggraffato e solforato su film di PTFE sono state invece utilizzate in batterie zinco/ferrocianuro, in cui mostrano valori di efficienza molto elevati (∼83%) e nessuna degradazione chimica per almeno 700 cicli.
Una cella a combustibile è molto simile ad una batteria in quanto è in grado di generare elettricità sfruttando una reazione di ossido-riduzione. Tuttavia, un’importante caratteristica le rende differenti: la cella a combustibile consuma sostanze provenienti dall’esterno ed è quindi in grado di funzionare, senza interruzioni, fino a quando al sistema viene fornito combustibile (generalmente idrogeno) ed ossidante (ossigeno o aria).
Per tutte le applicazioni menzionate le membrane devono possedere i seguenti comuni requisiti:
- elevata permeoselettività: devono in pratica essere permeabili ai controioni e impermeabili ai co-ioni;
- bassa resistenza elettrica: per rendere massima la permeabilità dei contro-ioni che si muovono per la presenza di un gradiente di potenziale elettrico;
- buona resistenza meccanica e alla deformazione: devono cioè risultare resistenti ed avere un basso grado di rigonfiamento o restringimento nel passaggio dalla soluzione ionica diluita a quella concentrata;
- elevata stabilità chimica: secondo il tipo di applicazione devono essere stabili nell’intero intervallo di pH (0-14), all’azione di agenti ossidanti e non si deve verificare il distaccamento dei gruppi ionici dalla matrice polimerica principale.
cariche fisse in esso presenti. Dal substrato polimerico dipendono principalmente la stabilità chimica, meccanica e termica della membrana. In alcuni casi può risultare conveniente effettuare delle reticolazioni sulla matrice polimerica del substrato. Con un adeguato grado di reticolazione il materiale può infatti migliorare la sua stabilità chimica, termica o le sue capacità di rigonfiamento. Occorre tuttavia ricordare che un’eccessiva reticolazione può influire negativamente sulla resistenza elettrica e quindi sulla permeoselettività della membrana.
Il tipo e la concentrazione delle cariche ioniche fisse influiscono in larga misura sul grado di permeoselettività e sulla resistenza elettrica della membrana, ma possono avere effetti negativi sulla loro stabilità meccanica e/o sulla loro tendenza al rigonfiamento.
Il numero dei gruppi ionogenici per grammo o per cm3 di membrana idrata è definito come capacità di scambio ionico (IEC), ma dal momento che il grado di idratazione può variare con le condizioni sperimentali, e il peso può variare con il tipo di contro-ione presente, si preferisce adottare una definizcontro-ione di capacità che dipende soltanto dalle caratteristiche del materiale costituente la membrana. Tale capacità, detta capacità scientifica, è definita in milliequivalenti per grammo (meq/g) di membrana secca in forma H+, per le membrane cationiche, e in forma Cl- per quelle anioniche.
In altri casi si preferisce esprimere il grado di acidità o basicità di una membrana a scambio ionico mediante il peso equivalente (“Equivalent Weight”, EW), che corrisponde al rapporto tra il peso (in grammi) del polimero secco e il numero (in moli) di unità a scambio ionico in esso presenti.
La stabilità meccanica è uno dei parametri più importanti per le membrane a scambio ionico. Infatti spesso si verifica il caso di polimeri che, pur possedendo appropriate caratteristiche di scambio ionico, danno luogo a membrane con scarse proprietà meccaniche per il tipo di applicazione cui sono destinate, soprattutto in quelle che prevedono temperature di esercizio elevate. In questi casi si ricorre generalmente ad uno dei seguenti metodi di “rinforzo”:
- deposizione (casting) del film polimerico su un adatto supporto microporoso; - polimerizzazione in situ su un adatto supporto microporoso;
- impregnazione del polimero all’interno di una membrana porosa ospite;
- copolimerizzazione di un monomero con buone caratteristiche ioniche con uno avente buone proprietà meccaniche;
- miscelazione di un polimero con buone proprietà meccaniche con resine ioniche o polimeri ionici;
- Reticolazione delle catene polimeriche ioniche.
I primi tre metodi portano all’ottenimento di membrane composite29-32, che rappresentano una classe di membrane caratterizzate da struttura non omogenea e in alcuni casi a strati multipli. Un esempio è rappresentato da polimeri come il poliacetilene, il polipirrolo33, il politiofene e la polianilina34 che, pur mostrando un’elevata conducibilità elettrica, hanno una scarsa resistenza meccanica. Nel caso del polipirrolo, si può realizzare una membrana composita mediante polimerizzazione del monomero sulla superficie di particelle di polivinilcloruro (PVC) disperse in una soluzione acquosa di cloruro di ferro.
Una tecnica che in alcuni casi può risultare più efficace è invece quella di deporre il polimero conduttore all’interno di un substrato polimerico microporoso35,36. Nei sistemi microporosi, infatti, è possibile realizzare una struttura polimerica conduttrice continua. I substrati microporosi più utilizzati sono in policarbonato, polipropilene, polietilene, oppure in polistirene reticolato.
1.2.5 Membrane polimeriche per celle a combustibile
Nella società moderna la domanda di energia è in continua crescita e la necessità di limitare l’inquinamento ambientale implica che le fonti energetiche siano più efficienti e che abbiano emissione zero. In questo contesto nasce l’idea dell’utilizzo dell’idrogeno e delle celle a combustibile.
Una cella a combustibile37-40 è un dispositivo in grado di convertire l’energia libera di un combustibile generalmente gassoso in elettricità in presenza di un gas ossidante (ossigeno o aria). Essa quindi funziona in modo analogo ad una batteria, in quanto produce energia elettrica attraverso un processo elettrochimico; tuttavia, a differenza di quest’ultima, consuma sostanze provenienti dall’esterno ed è quindi in grado di funzionare, senza interruzioni, fino a quando al sistema vengono forniti combustibile (generalmente idrogeno) ed ossidante (ossigeno o aria).
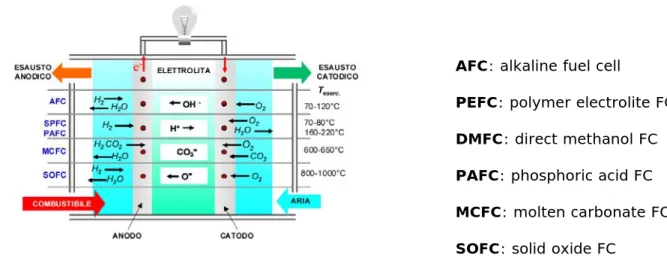
Esistono diverse tecnologie di cella, con diverse caratteristiche e gradi di sviluppo. Normalmente esse vengono classificate sulla base dell’elettrolita utilizzato (celle alcaline (AFC), ad elettrolita polimerico (PEFC), ad acido fosforico (PAFC), a carbonati fusi (MCFC), ad ossidi solidi (SOFC)) (Figura 1.2.6) o della temperatura di funzionamento (celle a bassa e alta temperatura). Il tipo di elettrolita utilizzato determina, o condiziona fortemente:
- l’intervallo di temperatura operativo;
- il tipo di ioni e la direzione in cui diffondono attraverso la cella; - la natura dei materiali di costruzione;
- La composizione dei gas reagenti;
- le modalità di smaltimento dei prodotti di reazione; - le caratteristiche di stabilità meccanica e di utilizzo; - la vita della cella.
catalitici per le reazioni di cella. L’elettrolita ha la funzione di condurre gli ioni prodotti dalla reazione anodica e consumati da quella catodica, chiudendo il circuito elettrico all’interno della cella. Le reazioni di cella consumano fondamentalmente idrogeno ed ossigeno, producendo acqua, passaggio di corrente elettrica nel circuito esterno e calore (Figura 1.2.6).
Figura 1.2.6 Classificazione delle celle a combustibile in base all’elettrolita e alla temperatura di esercizio40
Una singola cella produce normalmente una tensione di circa 0.7 V e correnti comprese tra 300 e 800 mA/cm2, quindi per ottenere la potenza e il voltaggio desiderato più celle vengono disposte in serie, mediante piatti bipolari, formando il cosiddetto “stack” (Figura 1.2.7). Gli stack a loro volta sono assemblati in moduli, per ottenere generatori della potenza richiesta.
AFC: alkaline fuel cell PEFC: polymer electrolite FC DMFC: direct methanol FC PAFC: phosphoric acid FC MCFC: molten carbonate FC SOFC: solid oxide FC
Tra i vari tipi di celle a combustibile, le PEFC sembrano essere le più promettenti, soprattutto nell’industria dei trasporti veicolari, grazie alla loro temperatura di esercizio (70°C÷110°C) e alla possibilità di usare aria come ossidante. Esse sono in grado di produrre energia elettrica attraverso la reazione elettrochimica che consiste nell’ossidazione del combustibile all’anodo e nella riduzione dell’ossigeno al catodo:
Reazione all’ ANODO:
-2 4H 4e
2H → + +
Reazione al CATODO: O2 + 4H+ +4e- →2H2O
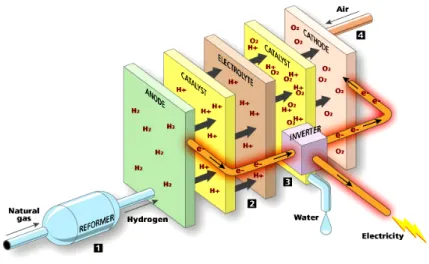
I protoni generati all’anodo attraversano la membrana polimerica a scambio protonico (Figura 1.2.8) e raggiungono il catodo dove reagiscono con l’ossigeno per formare acqua. La membrana polimerica rappresenta quindi sia il mezzo di trasporto dei protoni che la barriera di separazione tra i due settori di cella.
Figura 1.2.8 Sezioni principali di una cella a combustibile ad elettrolita polimerico (PEFC)
L’ossidazione del combustibile è promossa da un catalizzatore a base di Pt (o sue leghe), particolarmente sensibile al CO (il tenore tollerato deve essere < 10 ppm), per cui è molto importante che il combustibile sia esente da tale sostanza e che la
temperatura di esercizio sia prossima ai 100° C per limitare e ritardare al massimo l’avvelenamento del catalizzatore.
Le celle possono essere alimentate oltre che da idrogeno puro anche da altri combustibili (gas naturale, metanolo, singas prodotti dalla gassificazione del carbone, biogas) che vengono convertiti in un gas di sintesi contenente idrogeno con un grado di purezza adeguato mediante processi di steam-reforming, ossidazione parziale, o autothermal reforming. Gli idrocarburi leggeri vengono generalmente sottoposti a reforming catalitico con vapore, seguito da conversione dell’ossido di carbonio secondo le reazioni:
CnHm + n H2O n CO + (m/2 + n) H2
n CO + n H2O n CO2 + n H2
L’idrogeno di alimentazione proveniente da combustibili riformati, però, presenta inevitabilmente tracce di CO, per cui risulta preferibile, ove possibile, alimentare le celle con combustibili alternativi come metanolo.
Le celle a combustibile alimentate direttamente con metanolo (DMFC), come le PEFC, utilizzano un elettrolita polimerico e le reazioni di ossido-riduzione in questo caso sono: Reazione all’ANODO: -2 2 3 CO 6H 6e CH OH + H O→ + + + Reazione al CATODO: O2 6H 6e- 3H2O 2 3 → + + +
Sia le PEFC che le DMFC operano a temperature comprese tra 70 e 100° C ed hanno un’efficienza del 35-40%. Rispetto agli altri tipi di celle presentano i seguenti vantaggi:
- relativa semplicità costruttiva;
- rapidità di partenza a freddo (dell’ordine del minuto).
La bassa temperatura operativa è tuttavia fonte di alcuni svantaggi rispetto alle altre tipologie, come ad esempio:
- avvelenamento più rapido del catalizzatore (Pt) da parte di CO;
- una più difficile integrazione termica tra sistema di trattamento del combustibile e stack.
Per ovviare a questi svantaggi sono in atto ricerche orientate allo sviluppo di membrane polimeriche in grado di lavorare a temperature più elevate (fino a 200° C).
L’elettrolita polimerico, che rappresenta il separatore fisico tra anodo e catodo e fornisce i cationi e gli anioni necessari al bilanciamento delle reazioni di ossido-riduzione, deve essere costituito da un materiale chimicamente stabile e durevole nel tempo. I requisiti fondamentali che devono possedere i materiali polimerici per poter essere usati come membrane nelle PEFC ad alte temperature sono:
- adeguata stabilità meccanica;
- stabilità chimica ed elettrochimica nelle condizioni operative di cella; - elevata temperatura di transizione vetrosa (Tg);
- elevata conducibilità ionica (per sopportare elevate correnti con minime perdite di carico) e conducibilità elettrica nulla;
- bassissima permeabilità del combustibile (“crossover”) e dell’ossigeno per massimizzare l’efficienza della cella;
- costo di produzione compatibile con il tipo di applicazione.
La prestazione di una membrana dipende naturalmente dalla sua conducibilità ionica, che a sua volta però dipende in larga misura dal grado di idratazione: un’elevata conducibilità è supportata da un elevato grado di idratazione. Tuttavia, lavorando con
conseguente rallentamento della reazione di ossidazione. Un modo per limitare tale problema è quello di diminuire lo spessore della membrana, mantenendo in ogni caso inalterate le prestazioni generali della cella. Così facendo si ottengono anche i seguenti vantaggi:
- riduzione della resistenza della membrana; - aumento della conducibilità;
- abbassamento dei costi; - idratazione più rapida.
Ciò nonostante, per le membrane esiste un limite minimo di spessore sotto il quale si riducono i tempi di vita medi e aumenta il crossover.
1.2.6 Materiali utilizzati come elettroliti polimerici nelle PEFC
La prima generazione di elettroliti polimerici (a scambio protonico), per celle a combustibile, sviluppata negli anni ’60, era a base di polistireni solfonati, ma tali polimeri risultavano avere vita breve, soprattutto per via della tendenza mostrata dai legami C-H terziari della catena polimerica ad essere ossidati dall’ossigeno. Dal momento che il legame C-F (485 kJ/mol) ha un’energia superiore rispetto a quella del legame C-H (350-435 kJ/mol) e del legame C-C (350-410 kJ/mol), sono stati sviluppati polimeri contenenti legami C-F che hanno mostrato una migliore stabilità termica e chimica rispetto a quelli idrocarburici.
I diversi materiali attualmente utilizzati nella preparazione di membrane per celle a combustibile possono essere raggruppati nelle seguenti classi:
- ionomeri perfluorurati;
- polimeri parzialmente fluorurati;
- miscele acido-base a basso peso molecolare.
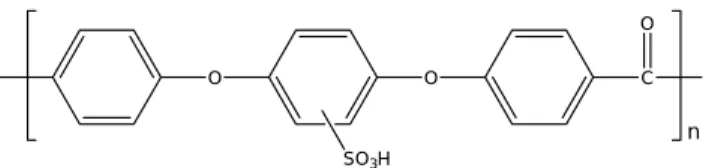
La tecnologia PEFC maggiormente sviluppata è quella basata su membrane polimeriche acide perfluorosolfoniche (PFSA). Tali membrane sono composte da una catena principale di carbonio fluorurato e catene laterali perfluorurate che portano gruppi solfonici acidi (Figura 1.2.9). Questo tipo di struttura chimica conferisce al materiale una particolare morfologia caratterizzata dalla presenza di zone discrete a carattere idrofobo ed altre a carattere idrofilo. Le zone idrofobe sono dovute alla presenza di catene fluorurate (tipo poli-tetrafluoroetilene, PTFE), mentre quelle idrofile sono dovute ai gruppi solfonici presenti nelle catene laterali. Il materiale risulta quindi in grado di farsi attraversare efficacemente dall’acqua grazie ai “canali idrofili” che favoriscono così un’elevata velocità di trasporto dei contro-ioni solvatati e, nello stesso tempo, sfavoriscono il passaggio ai co-ioni41.
Questa importante caratteristica, associata all’elevata inerzia chimica dovuta alla struttura perfluorurata simile al Teflon, ha promosso l’utilizzo di questi materiali in applicazioni ad alta densità di corrente.
Le più diffuse membrane commerciali di questo tipo sono il Nafion®, prodotto dalla DuPont, l’Aciplex®, prodotto dall’Asashi Chemicals Co., il Dow, prodotto dalla Dow Chemical, e il Flemion®, prodotto dall’Asashi Glass Co.; questi materiali sono costituiti da una stessa matrice polimerica e differiscono tra loro solo per il numero di unità ripententi presenti nelle catene (Tabella 1.2.1).
Tabella 1.2.1 Alcune membrane perfluorosolfoniche commerciali42
Una membrana fluorocarburica solfonata acida può essere preparata mediante copolimerizzazione radicalica ad innesto di unità stireniche su un film di poli(tetrafluoroetilene-esafluoropropilene) (FEP) e successiva solfonazione degli anelli aromatici. In alternativa lo stesso innesto può essere effettuato su film di polivinilidenfluoruro (PVDF), politetrafluoroetilene (PTFE) e polimeri parzialmente
preparate combinano le caratteristiche di buona stabilità fisica e resistenza chimica dei polimeri con quelle di buona conducibilità dei gruppi stirenici solfonati.
I principali vantaggi offerti dalle membrane commerciali “tipo-Nafion” sono:
- tempi di vita medi superiori alle 60000 ore nelle condizioni operative delle celle commerciali;
- alta conducibilità protonica, 0.10 S⋅cm-1 in condizioni di idratazione completa; - bassa permeabilità ai gas (ossigeno e idrogeno);
- ottime proprietà meccaniche (per T ≤ 80° C).
Tuttavia gli svantaggi sono rappresentati da: - costi troppo elevati;
- bassa conducibilità per bassi valori di idratazione;
- proprietà meccaniche relativamente basse alle alte temperature; - alto crossover del metanolo (10-6 mol·cm-2·s-1).
Il primo tra questi, l’alto costo (Nafion® > 800 U.S.$/m2)43, è dovuto principalmente al prezzo e alla difficile disponibilità dei comonomeri perfluoroeterei, ed è quello che in maggior misura impedisce alle tecnologie PEFC di diventare competitive sul mercato. Gli svantaggi relativi alle caratteristiche chimico-fisico-meccaniche delle membrane sono invece legati alla necessità di sviluppare celle a combustibile operanti ad alte temperature, per evitare, o limitare al massimo, i problemi di avvelenamento del catalizzatore da parte del CO, e garantire così alle celle tempi di vita maggiori.
Nel corso degli ultimi anni la ricerca si è quindi rivolta allo studio e allo sviluppo di nuovi materiali polimerici alternativi, di facile processabilità e con migliori prestazioni in condizioni di scarsa idratazione ed alte temperature. Sono così state sperimentate nuove membrane PFSA modificate42 ottenute mediante l’introduzione di ossidi igroscopici (es. SiO2 e TiO2) per incrementare l’igroscopicità della membrana. Ad esempio, con un contenuto in SiO2 del 3% in peso, si ottiene una capacità di
Sono state inoltre preparate membrane PFSA con una percentuale di particelle bifunzionali in grado di migliorare non soltanto l’igroscopicità della membrana ma anche la sua conducibilità protonica. A questo scopo sono stati utilizzati fosfati di zirconio ( Zr(RXO3)2⋅H2O), eteropoliacidi e solfati acidi di metalli. Sono state infine sviluppate membrane acido-solforate a partire dai seguenti polimeri42:
- polisilossani;
- polimeri idrocarburici aromatici; - polibenzimidazoli.
I polisilossani costituiscono una classe di polimeri particolarmente resistenti alle alte temperature. Essi sono caratterizzati dalla presenza di legami Si-O, che hanno un’energia di 445 kJ/mol, ed hanno la seguente struttura:
dove R può essere un metile o un gruppo metilbenzenico mentre R’ può essere un gruppo alcossidico (-OR’’) che, attraverso un’idrolisi, realizza una reticolazione per condensazione. Normalmente le strutture (network) ceramiche Si-O si ottengono con processi ad alte temperature, ma con il processo sol-gel è stato possibile preparare questi polimeri inorganici a temperature più basse in soluzioni acquose o di solventi organici. Operando in tali condizioni si è reso possibile l’inserimento di gruppi organici all’interno della matrice silicea. I polimeri ottenuti prendono il nome di silicati organico-modificati (ORMOSIL) oppure ceramiche organico-modificate (ORMOLYTE) e sono principalmente utilizzati come membrane elettrolitiche nelle batterie al litio. Per le celle a combustibile sono stati invece sviluppati polisilossani contenenti gruppi aril- e/o alchil-solfonici, come ad esempio il poli(acido benzil solforico silossano) (Figura
Si O
R R'
temperatura ambiente, di 10-2 S⋅cm-1 ed una buona stabilità termica e chimica fin oltre i 200 °C.
Figura 1.2.10 Unità ripetente di un poli(acido benzil solforico silossano)
Numerosi altri tentativi sono stati condotti con polimeri aromatici: il poli-p-fenilene ad esempio, costituito interamente da anelli benzenici, mostra una straordinaria resistenza agli agenti ossidanti, ma ha una struttura troppo rigida per poter essere impiegato come membrana. Sono state così sviluppate delle sue strutture aromatiche modificate al fine di ottenere materiali con un maggior grado di flessibilità, su cui sono stati inseriti i gruppi solfonici mediante solfonazione. Le strutture di alcuni polimeri così ottenuti vengono riportati in Figura 1.2.11.
Infine, per la preparazione di membrane cationiche, sono stati studiati polimeri “dopati” con acidi anfoteri42: questi, infatti, potendosi comportare sia come donatori che come accettori di protoni, favoriscono la migrazione protonica all’interno della membrana.
Alcuni esempi sono:
- poli(benzimidazolo) (PBI) /H3PO4; - poli(etilenimmina) (PEI)/H3PO4/SiO2; - Nylon/H3PO4 (o H2SO4)/SiO2. Si O CH2 R' n SO3H
Figura 1.2.11 Alcune strutture polimeriche aromatiche a struttura fenilenica42
Oltre ai numerosi tentativi effettuati per trovare delle valide alternative alle membrane acide perfluorosolfoniche, la ricerca scientifica ha recentemente rivolto una crescente attenzione nei riguardi delle membrane anioniche, per la loro applicazione nelle celle a combustibile alimentate direttamente con metanolo (Direct Methanol Fuel Cell, DMFC)44 o nelle celle alcaline (Alkaline Fuel Cell, AFC)45. Tale attenzione risulta direttamente legata al maggior interesse che oggi viene rivolto alle DMFC: la possibilità, infatti, di utilizzare un combustibile liquido, invece di uno gassoso, renderebbe più convenienti le operazioni di stoccaggio e rifornimento, garantendo così a questa tecnologia maggiori opportunità di successo. Fino ad oggi la tecnologia DMFC ha utilizzato elettroliti polimerici a scambio protonico, come ad esempio il Nafion®, che però hanno fornito prestazioni non del tutto soddisfacenti, soprattutto per quanto
S SO3H n Polifenilensolfuro (PPS) solfonato SO3H O n
Poli(2,4-difenil-4-fenilene ossido) solfonato
O O C
O
n SO3H
Polieteroeterochetone (PEEK) solfonato
O C CH3 CH3 SO3H O S O O n Polisolfone (PSF) solfonato
membrana a scambio anionico, invece, introdurrebbe un duplice vantaggio: favorirebbe un’ossidazione più veloce del metanolo (perché è cineticamente più favorita in ambiente alcalino47-49) e ne limiterebbe efficacemente la diffusione verso il catodo (in quanto la direzione del flusso anionico si opporrebbe a quella di permeazione del metanolo nella membrana). Nasce così la tecnologia delle celle alcaline a metanolo diretto (Direct Methanol Alkaline Fuel Cell, DMAFC) (Figura 1.2.12). Anodo: CH3OH+6OH− → CO2 +5H2O+6e− Catodo: O +3H O + 6e−→ 6OH− 2 3 2 2
Figura 1.2.12 Schema dei processi di trasporto in una DMAFC e relative reazioni di ossido-riduzione
Il crescente interesse nei confronti delle membrane a scambio anionico proviene anche dalla possibilità di utilizzarle nelle celle a combustibile alcaline che normalmente utilizzano un elettrolita liquido (KOH acquoso). Le celle alcaline sono state ampiamente utilizzate già nei primi voli spaziali della NASA negli anni ’60 e ’70, e tutt’oggi vengono impiegate nelle missioni dello space shuttle50. Recentemente sono state utilizzate anche nella realizzazione di sistemi per la veicolazione terrestre a zero
inconvenienti: la carbonatazione del sistema, che risulta sensibile alla CO2, e l’inondazione degli elettrodi, che comporta il blocco della cella. L’uso di un elettrolita solido, invece, consentirebbe non solo di evitare l’inondazione degli elettrodi ma anche di avere una maggiore densità volumetrica di energia. Le membrane anioniche presentano un ulteriore vantaggio legato alla versatilità offerta dal sale d’ammonio quaternario (NR4+) che rappresenta la carica fissa positiva. La ricerca moderna è quindi rivolta all’individuazione di appropriati gruppi -R che possano garantire, e coniugare insieme, una buona stabilità meccanica ed un’elevata capacità di scambio anionico.
1.3 Scopo della tesi
L’obbiettivo di questo lavoro di tesi è stato lo studio e la preparazione di un nuovo materiale polimerico avente buone capacità di scambio anionico ed un’adeguata stabilità chimica e meccanica, da impiegarsi nella realizzazione di membrane per celle a combustibile ad elettrolita polimerico (PEFC).
Le capacità di scambio anionico di un materiale sono dovute alla presenza di cariche positive fisse all’interno della sua struttura molecolare. Per inserire tali cariche all’interno di una catena polimerica è stata quindi adottata una metodologia, già nota in letteratura3,27,31,52-58, che prevede la preparazione di un sale d’ammonio quaternario per reazione di un’ammina terziaria con gruppi clorometilenici appartenenti alla struttura macromolecolare (Figura 1.3.1):
Figura 1.3.1 Amminazione quaternaria del gruppo clorometilenico
D’altro canto, le doti di resistenza e stabilità meccanica di un materiale polimerico traggono solitamente origine dalla presenza di una o, contemporaneamente, più caratteristiche molecolari e microstrutturali quali: un elevato grado di cristallinità (es: HDPE, poliammidi), la presenza in catena centrale o laterale di gruppi ad alto ingombro sterico (es: polistirene, polivinilcloruro, poliesteri) o un certo livello di reticolazione (es: resine poliestere o epossidiche, elastomeri vulcanizzati). Dunque, allo scopo di coniugare la necessità di disporre di gruppi clorometilenici con una certa stabilità meccanica è stato scelto quale monomero di partenza il 4-vinilbenzilcloruro (VBC) (Figura 1.3.2), che presenta anche il vantaggio di possedere un doppio legame stirenico.
CH2Cl
+
NR3CH2NR3
Figura 1.3.2 4-vinilbenzil cloruro (VBC)
La presenza di tale funzionalità offre infatti la possibilità di condurre polimerizzazioni del VBC con le stesse modalità utilizzate per lo stirene, come ad esempio reazioni di polimerizzazione a catena, portando con sé i gruppi clorometilenici necessari alla realizzazione del sale d’ammonio quaternario.
Per ottenere il nuovo materiale desiderato sono state individuate due strategie di preparazione già note in letteratura: una copolimerizzazione radicalica del VBC con un adatto comonomero26,27,31,53,58,59, e l’inserimento di unità VBC all’interno di una matrice polimerica preformata, attraverso una polimerizzazione radicalica ad innesto3,35,57,58,60. Oltre a tali metodologie è stata vagliata anche la possibilità di realizzare una membrana anionica attraverso la miscelazione del polivinilbenzilcloruro con un elastomero termoplastico. Il motivo risiede nel fatto che, da quanto risulta dalla letteratura, una tale strategia non è stata ancora utilizzata nella preparazione di membrane a scambio ionico e potrebbe pertanto risultare innovativa.
In una prima fase, la copolimerizzazione con un comonomero come il terz-butilstirene è stata giudicata idonea a studiare le proprietà di materiali prevalentemente basati sul VBC, in quanto consente di realizzare una diluizione dei siti reattivi alla reazione di quaternizzazione26 senza, allo stesso tempo, alterare eccessivamente le proprietà generali di una matrice con tale struttura molecolare.
Tuttavia, partendo anche dalla volontà di utilizzare materiali a basso costo e facilmente reperibili sul mercato, è stato ritenuto più promettente operare l’inserimento di unità VBC all’interno di matrici polimeriche di natura stirenica, poiché
anche l’ottenimento di prestazioni superiori in termini di tenacità se accoppiate a monomeri elastomerici quali il butadiene, come ad esempio avviene nell’SBS.
Per lo stadio di attivazione delle capacità di scambio anionico è stata prevista la possibilità di condurre, sul polimero clorurato sintetizzato, la reazione di quaternizzazione per trattamento con un’ammina terziaria altamente reattiva e potenzialmente in grado di creare un certo livello di reticolazione all’interno del materiale. Tale trattamento potrebbe essere effettuato prima o dopo la preparazione di un film sottile, una volta accertata la possibilità di allestirlo.
Infine, un’esauriente caratterizzazione degli intermedi di reazione e dei prodotti finali dovrebbe consentire di attestare la validità di ciascuna metodologia adottata per la preparazione del nuovo materiale ricercato.