Capitolo 3
Conteggio di individui biologici
La fase successiva alla loro individuazione, è il conteggio dei pattern evidenziati dalle precedenti elaborazioni. In questo capitolo verranno inizialmente evidenziate alcune delle tecniche attualmente in uso in laboratorio. Successivamente si passerà a descrivere i metodi adottati nel programma sviluppato.
3.1 Misura della crescita microbica e batterica
La crescita di una popolazione batterica viene misurata seguendo nel tempo la variazione del numero di cellule o della massa cellulare (anche detta biomassa). Esistono diversi metodi per contare il numero delle cellule o per stimare la massa cellulare; la scelta del metodo da utilizzare dipende tipicamente dal tipo di microrganismo e dal problema che si intende affrontare.
3.1.1 Conta totale
Il numero di cellule di una popolazione può essere misurato contando le cellule al microscopio, un metodo chiamato conta diretta. Sono possibili due tipi di conta diretta: con campioni essiccati su un vetrino o con campioni in liquido. Nel secondo caso, vengono utilizzate delle speciali
camere dette camere di conta. I tipi più diffusi utilizzano il vetrino di Thomas-Zeiss o quello di Petroff-Hausser: sulla superficie è inciso un reticolo quadrettato in cui, di ogni sezione, è nota l'area unitaria. Comunemente questo tipo di dispositivo viene anche indicato come “Camera di Burker “ .
Esso trova applicazione anche in campo medico per il conteggio dei globuli rossi; in figura 3.1 è evidenziata la camera standard di un emocitometro. E’ costituita da un quadrato di lato 1 mm a sua volta suddiviso in 20 sottoparti in verticale, ed altrettante in orizzontale. Questi quadratini sono organizzati in quadrati più grandi, che ne contengono 16, ed ognuno è diviso da quelli adiacenti da tre linee molto ravvicinate invece che da una sola. Al microscopio ottico vengono contati i globuli rossi presenti in un numero sufficientemente grande di quadratini unitari
Fig. 3.1
Esempio di camera standard di un emocitometro
(circa 80); applicando poi fattori di correzione si risale al numero di oggetti per centimetro cubo ( 1 ml ) presenti nella camera.
Infatti, dato che lo spessore tra il reticolo e il vetrino copri-oggetto è noto (dell’ordine del decimo di millimetro), è possibile conoscere il volume di sospensione contenuta in ogni riquadro.
Esistono regole pratiche da seguire durante la fase di conteggio. In particolare risulta interessante la gestione dei bordi. Tipicamente si fissano a priori i due lati che verranno presi in considerazione; successivamente nel caso di oggetti sui bordi, si considerano quelli che toccano o intersecano la linea mediale ( vedi figura 3.2).
Ad oggi, le principali case costruttrici di microscopi, mettono a disposizione dei software che consentono di eseguire la conta direttamente al microscopio. Anche in questo caso però è l’operatore che deve selezionare punto per punto gli oggetti da contare, ed è il programma che tiene memoria delle selezioni effettuate aumentando progressivamente un contatore.
Fig. 3.2
Ingrandimento di una cella standard. Convenzionalmente si contano le cellule in alto e sulla sinistra che toccano la linea centrale mentre non si contano le cellule che toccano la linea centrale in basso e a destra.
Come si può intuire, la conta diretta al microscopio, sia essa eseguita manualmente su un vetrino con camera di Burker, sia essa eseguita direttamente su microscopio attraverso un software, se da una parte è un modo rapido per stimare il numero di cellule, dall’altro presenta sicuramente alcuni limiti:
• E’ ripetitivo per l’operatore.
• Non è possibile distinguere le cellule vive dalle cellule morte.
• E’ difficile distinguere cellule di dimensioni molto piccole, pertanto un certo numero di cellule potrebbero non venire contate.
• E’ difficile ottenere stime precise.
• Quando il campione non è stato colorato è necessario utilizzare un microscopio a contrasto di fase.
• Il metodo è inadatto per sospensioni a bassa densità cellulare; se la sospensione contiene meno di 106 batteri per millilitro nel campo del microscopio si osserveranno pochissime cellule o addirittura nessuna.
3.1.2 Conta vitale
Nel metodo appena descritto si contano sia le cellule vive che le cellule morte. In alcuni casi si è invece interessati a contare solo le cellule vive; a questo scopo sono stati sviluppati i metodi per la conta vitale. Si definisce vitale (‘viable’) una cellula capace di dividersi e dare progenie; il metodo usuale per ottenere una conta vitale consiste nel determinare il numero di cellule presenti In un campione capaci di formare colonie su un opportuno terreno agarizzato, cioè reso adatto alla vita ed alla riproduzione. Per questo motivo la conta vitale viene anche chiamata conta in piastra o conta delle colonie. Il presupposto di questo tipo di procedura è che ogni colonia sia originata da una singola cellula vitale. Vi sono due metodi per attuare una conta in piastra: il piastramento in superficie e il piastramento per inclusione .
Nel piastramento in superficie, un volume noto, di solito 0,1 ml o meno, di una coltura opportunamente diluita viene distribuito sulla superficie di una piastra di terreno agarizzato con una spatola di vetro sterile. La piastra viene incubata fino alla comparsa delle colonie, che vengono quindi contate. E’ importante che la superficie della piastra sia piuttosto asciutta in modo che il liquido si adsorba. Solitamente si evita di usare volumi maggiori di 0,1 ml per evitare che il liquido in eccesso non si adsorba e possa provocare la fusione di colonie diverse rendendo difficile il conteggio.
Nel piastramento per inclusione, un volume noto (di solito 0,1 -1,0 ml) di coltura viene iniettato con una pipetta in una capsula di Petri sterile; viene poi aggiunto il terreno agarizzato fuso e il tutto viene mescolato facendo ruotare delicatamente la piastra sul piano del tavolo.
Poiché il campione viene mescolato con il terreno agarizzato fuso è possibile utilizzare un volume maggiore di quello utilizzato in precedenza; tuttavia usando questo metodo è necessario essere certi che l'organismo che deve essere incluso nell'agar sia in grado di sopportare per breve tempo la temperatura dell'agar fuso, 45ºC.
In entrambe le tecniche è importante che il numero di colonie che si sviluppano su una piastra non sia troppo elevato, poiché un eccessivo affollamento impedisce ad alcune cellule di formare colonie e il conteggio sarebbe quindi sottostimato. Inoltre è anche essenziale che il numero di colonie non sia troppo piccolo, altrimenti la significatività statistica del numero di cellule così calcolato sarebbe troppo bassa. La pratica corrente, che è quella statisticamente più valida, consiste nel contare le colonie solo nelle piastre che ne contengono un numero compreso tra 30 e 300.
Per ottenere un numero di colonie appropriato per il conteggio, il campione che deve essere contato deve quasi sempre venire diluito. Poiché raramente si conosce in anticipo, anche approssimativamente, il numero delle cellule vitali, è solitamente necessario effettuare più di una diluizione. Comunemente, vengono utilizzate una serie di diluizioni scalari in base dieci (Figura 3.3).
Per ottenere una diluizione di dieci volte (10-1) si possono mescolare 0,5 ml di campione con 4,5 ml di diluente, oppure 1,0 ml di campione con 9 ml di diluente. Se è necessaria una diluizione di cento volte (10-2), si possono mescolare 0,05 ml di campione con 4,95 ml di diluente, oppure 0, 1 ml di campione con 9,9 ml di diluente. Alternativamente, è possibile ottenere una diluizione per cento (10-2) facendo due successive diluizioni per dieci. Nella maggior parte dei casi è necessario effettuare diluizioni seriali di questo tipo per ottenere la diluizione finale desiderata. Per ottenerne una di un fattore 10-6 (1/10-6) si possono quindi fare tre diluizioni successive 10-2 oppure sei diluizione successive 10-1 .
Per definire più chiaramente il tipo di risultato, la conta vitale viene spesso espressa come numero di unità formanti colonia (cfu, colony-forming units) ottenute, piuttosto che come numero di cellule vitali
Fig. 3.3 Esempio di diluizione
contate (in quanto una unità formante colonia può essere costituita da una o più cellule).
Nonostante le imprecisioni intrinseche implicite, questa tecnica permette di trarre, relativamente al numero di cellule vitali, molte informazioni ed è quindi ampiamente utilizzata. Nella microbiologia alimentare, casearia, medica e delle acque, viene usata di routine. Il metodo ha il vantaggio di essere molto sensibile: dato che possono essere contati campioni contenenti pochissime cellule è possibile individuare anche una contaminazione microbica di piccola entità nei materiali in esame. Inoltre, utilizzando terreni colturali altamente selettivi è possibile contare solo particolari gruppi di microrganismi all'interno di una popolazione mista.
3.1.3 Conteggio attraverso la determinazione della massa cellulare
In alcuni casi, risulta interessante stimare la massa delle cellule di una coltura oltre che il loro numero (determinazione della biomassa). Alcune tecniche utilizzate sono la determinazione del peso secco, la metodologia colorimetrica, l’analisi dei prodotti da attività metabolica.
Peso secco
La massa netta può essere misurata centrifugando le cellule e pesando la massa cellulare privata del terreno. Il peso secco si misura disidratando la massa cellulare ottenuta per centrifugazione prima di pesarla; di solito la disidratazione viene ottenuta ponendo la massa cellulare In una stufa a 100-105ºC per una notte. Generalmente il peso
secco delle cellule batteriche si aggira Intorno al 10-20% del peso umido della massa cellulare.
Colorimetria
Un metodo semplice e molto utile per ottenere una stima relativa della massa cellulare consiste nel misurare l’intensità di luce assorbita dalla sospensione (opacità o torbidità). Essa infatti appare scura rispetto all’ambiente circostante perché ogni cellula costituisce un ostacolo al passaggio della luce. Quanto maggiore è il numero di cellule presenti, tanto più questo fenomeno è evidente. L’intensità di questo fenomeno viene misurata con uno strumento chiamato colorimetro o con uno spettrofotometro.
Con lo spettrofotometro questa caratteristica viene espressa come unità di assorbanza. Per gli organismi unicellulari l'assorbanza è (entro certi limiti) proporzionale sia al numero delle cellule che alla massa cellulare e quindi una determinazione della assorbanza può essere usata in sostituzione del conteggio. Per ottenere il numero delle cellule in questo modo, è necessario avere a disposizione una curva standard per ogni microrganismo studiato, che metta in relazione il numero di cellule (ottenuto per conta diretta al microscopio o per conta vitale) con la massa cellulare o con l'assorbanza. Questa tecnica è meno sensibile della conta vitale, necessita la conoscenza a monte di un certo numero di dati, ma ha il vantaggio di essere un metodo rapido, facile e che non danneggia o distrugge il campione. Questo tipo di misurazioni sono largamente utilizzate per seguire la crescita di una coltura in quanto lo stesso campione può essere misurato ripetutamente.
Attività metaboliche
Lo sviluppo microbico è sempre in relazione alla produzione e/o variazione di alcuni composti presenti nel terreno colturale o prodotti dal microrganismo stesso. Alcuni parametri misurati sono il rate di consumo dell’ossigeno disciolto nel substrato da parte di microrganismi aerobi, la produzione di anidride carbonica da parte dei lieviti vinari, il consumo di elementi nutritivi come il glucosio, la produzione di prodotti di scarto come i composti acetati.
3.2 Tecniche di conteggio adottate
All’interno del programma sviluppato sono presentate tre tecniche di conteggio:
• Conteggio manuale da parte dell’ operatore.
• Conteggio medio con campione unitario assegnato.
• Conteggio per correlazione con campione unitario assegnato.
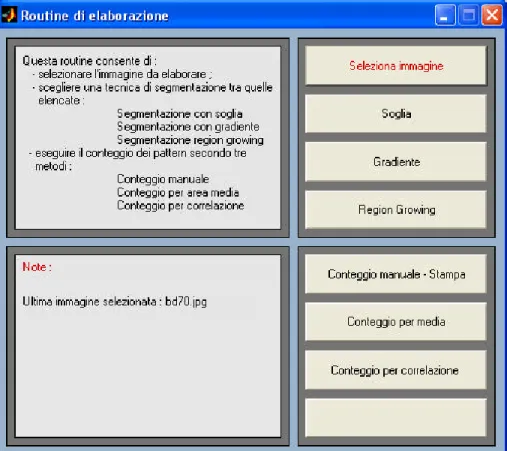
Una volta eseguita almeno una delle tre operazioni di segmentazione, vengono abilitati i tasti relativi alla sezione di conteggio, precedentemente non visibili, come mostrato in figura 3.4.
Fig. 3.4 Interfaccia principale
3.2.1 Conteggio manuale - stampa
Questa tecnica trova ancora oggi applicazione in molte procedure di conteggio in laboratorio. Le maggiori case costruttrici di microscopi, infatti, forniscono (spesso a pagamento) insieme alla macchina un software: esso consente all’operatore di selezionare manualmente e di marcare gli oggetti su cui si sta focheggiando; un contatore viene aggiornato progressivamente ad ogni selezione. E’ evidente che questa è una operazione ripetitiva e diviene piuttosto gravosa se il numero degli oggetti da contare è elevato.
La routine, una volta selezionata l’immagine da sottoporre a conteggio, attiva la procedura. La relativa funzione chiama l’ esecuzione del driver di stampa, attraverso il quale è possibile settare i principali parametri: orientamento della carta, eventuali note, stampa a colori, etc. Viene
Fig. 3.5
Conteggio manuale assistito da calcolatore
selezionata, consentendo un contenuto informativo maggiore.
3.2.2 Conteggio medio con campione unitario assegnato
Questo metodo di conteggio prevede inizialmente che l’operatore selezioni un pattern dal database (vedi figura 3.6); esso verrà successivamente considerato come l’elemento base unitario rispetto agli oggetti sotto indagine.
Nel caso esemplificato (una coltura batterica di E. Coli in evoluzione), l’utente deve selezionare il pattern che egli considera corrispondente al ‘tipico’ batterio in coltura. Intervengono chiaramente a questo livello problematiche legate alla scelta soggettiva di tale unità; si deve però considerare che la scelta dovrà essere eseguita sulla base di indicazioni specifiche che l’operatore (un tecnico, non necessariamente un medico od un biologo) dovrà ricevere da personale specializzato, che peraltro ha richiesto e sta guidando l’elaborazione. Questa pratica è molto diffusa in tutti i laboratori in cui ingegneri e medici lavorano fianco a fianco, e questo è il caso del laboratorio di Risonanza Magnetica in cui questa tesi è stata elaborata.
Fig. 3.6 Interfaccia principale
Una tecnica che può contribuire a superare eventuali incertezze è costituita dalla taratura dello strumento a disposizione.
Essa consiste nell’eseguire il conteggio medio sulle immagini a disposizione che contengono un numero di individui relativamente piccolo e per questo determinabile attraverso una rapida ispezione visiva. Grazie alle caratteristiche interattive della funzione, non è difficile per l’utente andare a fissare opportunamente le dimensioni del campione unitario, in modo che i risultati che si ottengono dal conteggio automatico corrispondano a quelli dedotti per ispezione.
L’ individuazione dell’ elemento unitario passa attraverso la selezione di una delle immagini a disposizione; una volta aperta, premendo il tasto ‘Selezione pattern’ si attiva la funzione di visualizzazione nel titolo delle coordinate e del livello di grigio corrispondenti al pixel corrente. La pressione del mouse in uno di questi attiva la visualizzazione di un ingrandimento (figura 3.8). L’operatore può a questo punto proseguire premendo ‘Seleziona livello ’ oppure ripartire da capo, o selezionare una nuova zona.
Le modalità di proseguimento sono analoghe a quelle relative alla segmentazione con soglia.
Si seleziona un pixel all’interno dell’ingrandimento appartenente all’oggetto individuato. Tipicamente la selezione avviene sul bordo in quanto all’interno i pixel assumono un livello più vicino al nero (corrispondente al livello 0), e pertanto una loro scelta causerebbe l’esclusione di buona parte dei pixel limitrofi ( a livello di grigio maggiore). Le figure seguenti mettono a confronto due differenti scelte di pixel all’interno del medesimo oggetto.
Fig. 3.7
Ingrandimento
Figg. 3.8 e 3.9
Si può notare come i risultati possano essere molto diversi tra loro.
E’ però evidente che è sufficiente eseguire un certo numero di prove prima di acquisire una buona dimestichezza nella selezione.
Come evidenziato nelle figure riportate, nel titolo è indicato il numero di pixel (a livello basso) corrispondenti al ‘presunto’ pattern unitario.
Per semplificare l’operazione, si è introdotta anche a questo livello la possibilità di correggere la selezione ottenuta: la si attiva cliccando sul tasto ‘Ritocco’.
La figura che segue evidenzia come, conseguentemente alla correzione, venga aggiornato anche il titolo, che riporta il numero di pixel a livello basso. Ciò è utile in quanto dà una indicazione delle dimensioni effettive del campione. (Figura 3.10)
Una volta ottenuto l’elemento base, la pressione del tasto ‘OK’ provoca le seguenti due azioni:
Fig. 3.10
- la sua memorizzazione insieme al numero di pixel che lo compongono
- la visualizzazione nel campo ‘Note’ del numero di pixel (Figura 3.11).
Questa ultima indicazione è importante perché è in base a questo dato che verrà eseguita l’ elaborazione successiva.
A questo punto si è invitati a scegliere l’ immagine su cui operare il conteggio (Figura 3.12).
La tecnica di conteggio per media prevede la scansione dell’ immagine selezionata per rilevare il numero di pixel a livello zero, e la successiva divisione per il numero di pixel costituenti l’elemento base unitario. Se ne ottiene il numero medio di oggetti, di dimensione pari a quelle fissate, presenti nell’immagine scelta (precedentemente sottoposta a segmentazione). Fig. 3.11 Aggiornamento campo note Fig. 3.12 Selezione immagine da elaborare
L’ indicazione del risultato viene direttamente riportata nel campo ‘Note’ come in figura 3.13.
L’ operazione di conteggio medio può essere ripetuta su ciascuna immagine sottoposta a segmentazione in precedenza.
3.2.3 Conteggio per correlazione con campione unitario assegnato
La trasformata di Fourier può essere utilizzata per realizzare una valutazione della correlazione esistente fra una immagine ed un soggetto in essa contenuto. Può inoltre essere utilizzata anche per verificarne o meno la presenza ed eventualmente conteggiarne il numero di ricorrenze. In questo contesto la correlazione prende il nome di ‘Template Matching’. In pratica questa operazione si realizza eseguendo la convoluzione bidimensionale fra l’immagine in esame e la selezione Fig. 3.13
Campo ‘Note’ aggiornato
seguente:
ImageCorr = real(ifft2(fft2(Imm) .* fft2(rot90(Selezione,2),alt,larg)));
Successivamente si sottopone il risultato ad una elaborazione per soglia.
Il fatto di utilizzare un calcolatore suggerisce di realizzare la trasformata di Fourier attraverso la sua forma discreta denominata DFT (‘Discrete Fourier Trasform’). Due sono i punti fondamentali che spingono verso questa soluzione:
1. Dati in ingresso e risultati sono direttamente elaborabili e rappresentabili dal calcolatore senza la necessità di una loro discretizzazione
2. E’ stato sviluppato un algoritmo di calcolo particolarmente efficace per ambienti di calcolo discreti denominato FFT (‘Fast Fourier Trasform’)
Nella relazione precedente, la trasformazione fft2 è eseguita attraverso la trasformata discreta di Fourier (DFT) bidimensionale sfruttando l’algoritmo veloce FFT.
Vale la relazione infatti la relazione
espressione è:
dove N è la dimensione della matrice X e
L’algoritmo FFT è particolarmente veloce per matrici di dimensione N potenza di 2.
La trasformata discreta di Fourier bidimensionale può essere espressa attraverso le relazioni
I valori F(p,q) sono i coefficienti secondo la DFT della funzione discreta
f(m,n). In particolare, il coefficiente a frequenza nulla F(0,0)
rappresenta la componente continua, spesso indicata con ‘DC
component’
.La relazione che intercorre tra i coefficienti della DFT bidimensionale e quelli della trasformata continua di Fourier bidimensionale è la seguente: i coefficienti della DFT sono i campioni della FT valutati alle pulsazioni ?1 e ?2, come indicato di seguito
Descritta la parte teorica, passiamo alla descrizione della relativa sezione di programma.
finestra di dialogo come in figura 3.14.
La routine inizialmente va infatti a verificare se in memoria è gia presente il campione unitario. In questo caso avverte l’utente e verifica l’intenzione o meno di modificare i dati memorizzati.
In caso affermativo, la procedura inizialmente prosegue come in precedenza, guidando l’operatore verso la selezione di un nuovo pattern unitario.
In caso negativo, si passa direttamente alla selezione dell’ immagine segmentata su cui operare il conteggio per correlazione.
Esso avviene andando a ‘far scorrere’ il pattern unitario sull’immagine: viene eseguita punto per punto una correlazione tra le due matrici corrispondenti ed il risultato sottoposto a soglia, così da evidenziare solamente le zone in cui la somiglianza (di cui la correlazione è indice) è maggiore.
Successivamente l’elemento unitario viene ruotato rispetto al suo baricentro di un angolo fissato a programma (pari a 360/8 = 45°, modificabile intervenendo direttamente sulla relativa funzione), ed i precedenti passi ripetuti.
Fig. 3.14 Finestra di dialogo
l’elemento unitario assume ed il conteggio avviene andando a sovrapporre i risultati ottenuti.
Ancora una volta il risultato ottenuto viene visualizzato nel campo ‘Note’ come in precedenza.
Fig. 3.15