CAPITOLO IV
Modelli bioingegneristici del sistema vascolare.
4.1 Modellizzazione del sistema cardiovascolare.
P
er un approccio allo studio del flusso sanguigno nel sistemacardiocircolatorio bisogna considerare che tale fenomeno è caratterizzato da vari aspetti ed influenzato da vari fattori; si tratta dunque di un problema complesso ed articolato che, in sintesi, può essere schematizzato nei seguenti punti:
• Studio del flusso di un fluido in un condotto.
• Studio delle proprietà elastiche e viscoelastiche del muscolo cardiaco e delle pareti dei vasi.
• Studio delle proprietà del sangue (viscosità, componente cellulare, coagulazione, etc.)
• Studio della propagazione delle onde nel sistema circolatorio. • Studio delle proprietà del microcircolo.
• Studio della trasmissione del calore nei fluidi.
Tutte queste componenti, unite ad una serie di sistemi di regolazione controllati da fattori ambientali, psicologici o legati all’attività del soggetto, danno un’idea della difficoltà che si presenta nell’analisi di questo apparato e del suo funzionamento. D’altronde, difficoltà di questo genere si incontrano ogniqualvolta si affrontano fenomeni biologici, enormemente più complessi di qualsiasi fenomeno di interesse ingegneristico.
Il primo approccio che possiamo fare nei confronti del problema è quello di schematizzare un apparato complesso quale è il sistema cardiocircolatorio, separando le varie proprietà che abbiamo sopra elencato e creando una serie di modelli, che saranno applicati nelle diverse circostanze. Ovviamente, tali modelli saranno parziali
e non esatti, ma, nella maggior parte dei casi, questa si rivelerà la scelta migliore (se non l’unica proponibile dal punto di vista analitico) per lo studio del problema.
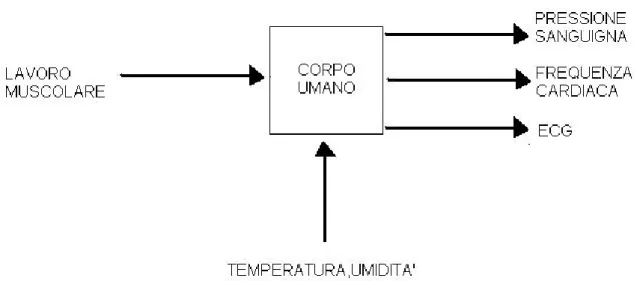
Una schematizzazione generale del sistema cardiovascolare può essere data dallo studio delle relazioni tra i fattori esterni di influenza e alcuni parametri misurabili sul soggetto[8] (fig 4-1).
Fig 4- 1 Diagramma schematico delle relazioni tra fattori esterni e parametri cardiovascolari.
Questa semplice rappresentazione mette in evidenza che alcuni dei parametri fisiologici (che si possono prelevare in maniera semplice e non invasiva) danno una prima stima dell’adattamento dei sistemi dell’organismo (quello circolatorio in particolare) al mondo esterno.
Si può inoltre entrare nello specifico della struttura del sistema cardiovascolare con una seconda schematizzazione che considera parametri ed elementi propri del sistema stesso.
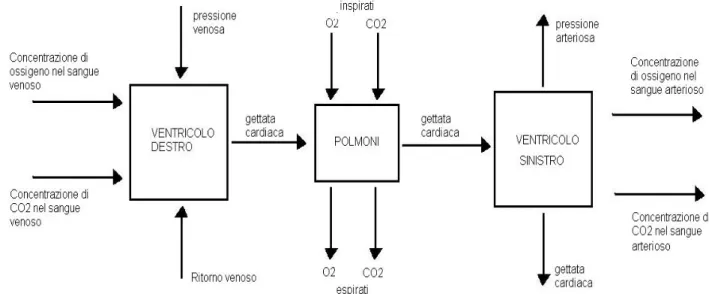
In figura 4.2 è visibile questa rappresentazione relativamente al cuore e ai polmoni: i parametri evidenziati sono le quantità di gas (ossigeno ed anidride carbonica) scambiate nei polmoni e portate in circolo dal sangue, la gettata cardiaca e le pressioni sanguigne arteriosa e venosa; tutti questi parametri sono fondamentali nella valutazione del funzionamento della circolazione[8]. In particolare si può notare la schematizzazione del cuore come una doppia pompa che spinge il sangue nei due circoli (sistemico e polmonare) e dei polmoni come una semplice area di scambio: questo è un esempio di modellizzazione delle varie parti del corpo come unità a sé stanti di cui bisogna formulare relazioni costitutive e funzionali che faranno parte del modello globale.
Fig 4- 2 Schema a blocchi del sistema cardiocircolatorio con evidenziati alcuni parametri di interesse.
Questi modelli sono tuttavia del tutto generali e non considerano le varie peculiarità del sistema in esame; il nostro passo successivo sarà un’analisi più accurata (anche se di tipo introduttivo) del sistema cardiovascolare con l’ausilio di modelli meccanici, chimici e termodinamici, che sono in larga parte modelli formulati per problemi di natura non bioingegneristica e successivamente adattati.
In primis, consideriamo l’approccio puramente fluidodinamico, studiando il flusso sanguigno come quello di un fluido (con caratteristiche che andremo ad esaminare) che scorre in un sistema di condotti, che nel nostro caso sono i vasi sanguigni.
4.2 Fluidodinamica
cardiovascolare.
Come già accennato (cap. II), il sistema cardiovascolare può essere schematizzato come due circuiti separati, costituiti da una serie di condotti, nei quali il sangue viene fatto fluire da una doppia pompa (cuore destro e cuore sinistro). I due circuiti sono la circolazione sistemica, che viene sostenuta dalla contrazione del ventricolo sinistro e provvede al rifornimento di sangue ossigenato ai tessuti, e la circolazione polmonare, sostenuta dal ventricolo sinistro e deputata a riossigenare il sangue.
Dal punto di vista strettamente fluidodinamico, ciascun circolo (noi porremo la nostra attenzione principalmente sul grande circolo) può essere rappresentato da un condotto e da una pompa: i parametri che caratterizzeranno questo modello saranno la lunghezza ed il diametro del condotto, la caduta di pressione ai capi dello stesso, la quantità e le caratteristiche del fluido circolante[8].
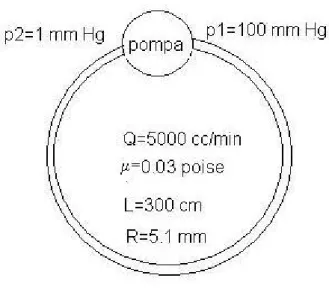
Fig 4- 3 Modello schematico del sistema cardiovascolare rappresentato da un singolo condotto.
Lo schema riportato in fig. 4-3 è una semplice rappresentazione ottenuta con i criteri suddetti: i valori di lunghezza (L) e raggio (R) del tubo sono parametri equivalenti del sistema reale, mentre la portata (Q) e le pressioni di ingresso ed uscita (P1,P2) della pompa sono valori medi delle grandezze reali. La grandezza µ è la viscosità dinamica del fluido (nel nostro caso il sangue), che qualitativamente può essere vista come una “resistenza” del fluido allo scorrimento. Per definire più approfonditamente il comportamento di un fluido in un condotto in un modello siffatto, facciamo l’ipotesi di regime stazionario, cioè trascuriamo la pulsatilità del cuore, e consideriamo il condotto come un tubo rigido cilindrico.
Senza addentrarci in un’analisi fluidodinamica esaustiva, possiamo considerare che, all’interno del condotto, la velocità del fluido avvenga per strati concentrici di spessore infinitesimo: sulla parete del tubo la velocità w del fluido è nulla, mentre ad una distanza sufficientemente grande raggiunge un valore massimo (w∞) perché il
moto non risente delle forze di attrito con la parete stessa. Esiste quindi uno strato limite di velocità (dove w=0.99 w∞) che divide il fluido in due regioni: la regione di
strato limite, dove sono rilevanti gli effetti viscosi e la velocità varia, e la regione di moto non viscoso, con velocità praticamente costante. Gli strati adiacenti esercitano una forza d’attrito tra loro e si definisce sforzo di taglio (τ) la forza di trascinamento per unità di superficie, misurata in N/m2. Esiste una relazione[2] che lega, nella maggior parte dei casi, lo sforzo di taglio al gradiente di velocità:
;
r
w
∂
∂
=
µ
τ
(4)in cui r è la coordinata radiale del tubo. Questa relazione definisce analiticamente la grandezza prima indicata come viscosità dinamica, che si misura quindi in N⋅s/m2;
un’altra unità di misura adottata per la viscosità è il poise, misurato in dyn⋅s/cm2 e,
tipicamente, le viscosità di fluidi simili all’acqua sono dell’ordine del centipoise (cp). All’interno del condotto possono verificarsi due situazioni di flusso: il moto del fluido può essere laminare, cioè per strati concentrici ordinati con distribuzione (profilo) di velocità descritto dalla (4), oppure, ad una certa distanza dalla parete, può accadere che la mancanza di forze di attrito agenti sul fluido renda il moto turbolento, ovvero irregolare e disordinato. È ovvio che, dal punto di vista analitico, la condizione di flusso laminare è decisamente preferibile. La transizione dal moto laminare al moto turbolento dipende da vari fattori: geometria e rugosità della superficie, velocità e tipo di fluido. Una grandezza adimensionale che sintetizza la condizione di moto del fluido è il numero di Reynolds:
ν
D
⋅
=
w
∞Re
; (5)in cui w∞ è la velocità di corrente libera (m/s), D è il diametro del tubo e ν è la viscosità cinematica del fluido, definita come µ/ρ (cioè il rapporto tra la viscosità dinamica e la densità). Si può affermare che la condizione di flusso laminare all’interno di un tubo si verifica se Re < 2300.
Ritornando al nostro modello fluidodinamico (fig. 4-3) per il sistema cardiocircolatorio, sostituendo i valori di portata (Q), diametro, lunghezza, densità e viscosità, otteniamo che la condizione di moto laminare è verificata. Per i vari distretti dell’apparato, la condizione andrà valutata in base ai valori delle grandezze.
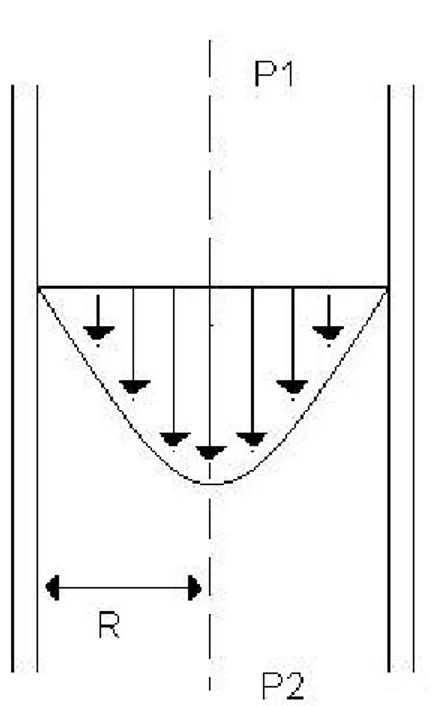
Una ulteriore semplificazione nello studio del moto è ottenibile considerando idealmente il tubo infinito e il flusso non influenzato dall’effetto della pompa o da transitori nello sviluppo del profilo di velocità. In questo caso si rientra nella condizione di flusso di Poiseuille [8], in cui il profilo di velocità è parabolico (fig. 4-4), descritto dall’equazione detta appunto legge di Poiseuille:
− ⋅ ⋅ ∆ = 2 2 1 4 R r R L P V
µ
; (6)dove V è la velocità del fluido in funzione della distanza r dal centro del tubo, delle dimensioni del condotto e della differenza di pressione (∆P) ai capi dello stesso.
La portata del condotto, in questa condizione, può essere definita come:
;
8
4L
R
P
Q
µ
π
⋅
⋅
∆
=
(7)Fig 4- 4 distribuzione della velocità del fluido con profilo parabolico all’interno di un condotto di raggio R; la caduta di pressione ∆P è data da P1-P2.
Si può quindi verificare che esiste una relazione diretta tra portata e differenza di pressione che si presenta analoga alla relazione tensione-corrente nei circuiti elettrici (legge di Ohm); è immediato definire una resistenza idraulica Ridr tale che:
;
idr
R
P
Q
=
∆
(8)con Ridr ricavabile facilmente dalla (7). Nel caso specifico della circolazione
sanguigna esiste una unità di misura di questa grandezza detta unità di resistenza periferica (PRU), definita come il rapporto tra una pressione di 1 mm Hg e una portata di 1 cc/min.
I modelli fluidodinamici così enunciati possono essere applicati, oltre che al corpo umano nella sua interezza, anche ai vari organi ed apparati. Riportiamo in tabella 4-A varie caratteristiche di diverse parti dell’organismo dal punto di vista del modello fluidodinamico equivalente.
Analogamente si può pensare di scomporre il nostro modello nelle varie tipologie dei vasi sanguigni presenti nel corpo: abbiamo visto in precedenza che i vasi si differenziano a seconda della posizione nell’albero circolatorio per proprietà costitutive e funzionali; parimenti presentano caratteristiche diverse dal punto di vista fluidodinamico (tab. 4-B).
Si possono notare, dai valori in tabella, le caratteristiche proprie di ogni distretto del sistema cardiovascolare: la scarsa capacità e grande resistenza idrodinamica delle arterie denotano la loro funzione di trasporto e controllo del flusso sanguigno, la piccolissima capacità e grandissima resistenza della rete capillare sono dovute invece
alla loro funzione di scambio, mentre nel caso delle vene la resistenza è molto bassa e la capacità aumenta per la funzione di accumulo e regolazione del sangue che fluisce al cuore.
Organo o tessuto Flusso sanguigno (ml/min) Resistenza relativa (%) PRU (dyn⋅sec/cm5) Fegato 1375 3.6 2.9 Reni 1150 4.3 3.4 Muscoli scheletrici 750 6.6 5.3 Cervello 700 7.1 5.7 Pelle 300 16.6 13.3 Ossa 250 20.0 16.0 Muscolo cardiaco 200 25.0 20.0 Altri 275 18.1 14.5 Corpo umano 5000 100 80
Tab 4- A Parametri fluidodinamici dei principali organi e tessuti del corpo umano.
Tipo di vaso Diametro medio Sezione totale appross. (cm2) % del volume sanguigno contenuto Capacità relativa (%) Resistenza relativa (%) Aorta 2.5 cm 4.5 3 4.5 4 Arterie 0.4 cm 20 8 12.0 21 Arteriole 30 µm 400 3 4.5 27 Capillari 6 µm 4500 4 6.0 41 Venule 20 µm 4000 4 6.0 4 Vene 0.5 cm 40 12 18.0 1.5 Vena cava 3 cm 18 33 49.0 1.5
Tab 4- B Parametri strutturali e fluidodinamici (basati sul modello di Poiseuille) dei vasi sanguigni distinti per tipologia.
Una nota importante sulla struttura dell’albero circolatorio riguarda le sue ramificazioni: in generale, ogni volta che si ha una diramazione del vaso si ha una diminuzione della sezione e della lunghezza media ed un aumento del numero di vasi. Possiamo osservare, da rilevazioni effettuate sul sistema circolatorio di un cane[8], che l’aorta, di diametro 1 cm e lunghezza 40 cm si dirama man mano in 40 milioni di arteriole lunghe mediamente 2 mm, che a loro volta generano 1.2 miliardi di capillari lunghi 1 mm. Esiste una relazione empirica abbastanza semplice che lega la sezione del ramo alla i-esima diramazione alla sezione del vaso originario A0 :
Questa trattazione si rivela di grande utilità per l’analisi del sistema cardiovascolare anche per la relativa semplicità analitica, ma deve considerarsi un’approssimazione applicabile solo nel caso siano verificate le ipotesi introdotte precedentemente. In particolare, abbiamo trascurato completamente la pulsatilità della pompa cardiaca; inoltre abbiamo considerato le pareti delle arterie come condotti rigidi cilindrici, mentre in realtà sappiamo che possiedono proprietà diverse a seconda del tipo di vaso (ad esempio le arterie hanno comportamento notevolmente elastico); infine, abbiamo considerato il sangue un fluido newtoniano1 con caratteristiche ideali e vedremo che le cose non stanno proprio così. Nei successivi paragrafi daremo alcuni accenni alle problematiche che si incontrano considerando queste ipotesi non verificate e ai possibili modelli compatibili con le reali caratteristiche del sistema cardiocircolatorio.
4.3 Proprietà del sangue.
Il sangue è una sospensione di particelle in una soluzione acquosa di componenti variabili. La soluzione acquosa, detta plasma, serve come veicolo di trasporto per le cellule che rappresentano circa il 50% del volume totale. I tre tipi principali di cellule presenti nel sangue umano sono i globuli rossi (eritrociti), i globuli bianchi (leucociti) e le piastrine (trombociti). Il plasma, che occupa quindi circa la metà del volume sanguigno, è costituito per il 90% d’acqua e per il resto di proteine e sostanze varie (ormoni, anticorpi, enzimi, etc.). Dal punto di vista fluidodinamico, ha quindi caratteristiche abbastanza simili a quelle dell’acqua, cioè densità 1.03 g/cm3 (valore simile a quello del sangue nel complesso), viscosità 1.2 centipoise e pH tra 7.3 e 7.5. Si osserva quindi che il comportamento del solo plasma non differirebbe molto da quello dell’acqua; in realtà le proprietà del sangue derivano dalla componente cellulare e da alcune sue caratteristiche. Esaminando separatamente le cellule presenti, ci accorgiamo (vedi tab. 4-C) che i leucociti, in condizioni non patologiche, sono in numero esiguo rispetto alle altre cellule, quindi si possono trascurare nella determinazione delle proprietà ricercate. Per le piastrine, invece, risulta trascurabile la dimensione ed il loro effetto è rilevante solo nei fenomeni di coagulazione.
Quindi l’unica componente cellulare effettivamente da considerare nella nostra analisi è quella dovuta agli eritrociti, che sono presenti in numero elevato e hanno dimensioni considerevoli; si noti che la dimensione maggiore della singola cellula è confrontabile (se non addirittura superiore) al diametro dei vasi nei distretti periferici.
Tipo di cellula Concentrazione media (cellule/ml)
Dimensioni
medie (µm) cellulare totale % sul volume
Leucociti 9000 7-20 5
Linfociti 2730 Monociti 540
Eritrociti 5⋅106 1.9 x 8.0 91
Piastrine 3⋅105 3 4
Tab 4- C Valori tipici per la componente cellulare nel sangue umano.
Il globulo rosso può essere rappresentato (fig. 4-5) come una cellula costituita da una membrana molto flessibile riempita con una soluzione concentrata di emoglobina2, che rappresenta circa 1/3 del peso della cellula: questa proteina ha una densità di 0.14 g/ml e una viscosità di 6 cp (5 volte maggiore di quella del sangue). Si capisce che le proprietà estremamente diverse dal plasma di questa sostanza, così abbondante nel sangue, siano fondamentali per determinare le reali caratteristiche di questo particolare fluido. A causa del ruolo predominante degli eritrociti per quanto riguarda le proprietà meccaniche del sangue, è importante conoscerne l’esatta concentrazione: si definisce ematocrito la concentrazione in volume di tali cellule ed il suo valore di solito varia tra il 42 ed il 45% in soggetti sani.
Fig 4- 5 Rappresentazione di un globulo rosso con indicate le dimensioni medie.
Questa complessa struttura del sangue fa sì che esso non possa essere considerato sempre come un fluido newtoniano. A complicare le cose interviene anche il comportamento particolare degli eritrociti in determinate situazioni: nel caso di vasi di piccole dimensioni, queste cellule tendono a formare, in caso di bassi valori di flusso, delle catene strettamente impacchettate (dette rouleaux) che si muovono
come un'unica macrocellula. Se il diametro del vaso è ridotto ulteriormente, i globuli rossi possono deformarsi, assumendo forme idrodinamiche (ad esempio la tipica conformazione “a paracadute”).
Bisogna quindi considerare un modello di fluido che contempli queste anomalie del sangue dal punto di vista della viscosità. In generale, la relazione (4) ha validità per i soli fluidi newtoniani, ma esiste una vasta classe di fluidi, detti pseudoplastici, per cui la relazione assume la forma:
n
r
w
K
∂
∂
⋅
=
τ
; (10)il valore di n può essere maggiore o minore di 1 a seconda del fluido ed il caso n=1 si riconduce ai fluidi newtoniani. Trascuriamo, nella nostra analisi, fluidi con proprietà plastiche (con “memoria”) o con valori del gradiente di velocità che si annulla per sforzi di taglio non nulli.
Per studiare i fluidi viscoelastici, che per noi saranno in generale fluidi non-newtoniani, ricorreremo ad una linearizzazione della (10) in un intorno dei valori di interesse. In particolare si definisce una viscosità apparente µapp tale che:
;
∂
∂
⋅
=
r
w
appµ
τ
(11)il valore della viscosità apparente dipende da alcuni parametri del fluido, oltre che ovviamente dalle condizioni di sforzo di taglio presenti; i parametri che influenzano la viscosità apparente del sangue possono essere riassunti in:
• Valore dell’ematocrito.
• Concentrazione delle proteine nel plasma.
• Concentrazione dei globuli bianchi (solo in casi patologici).
• Concentrazione di piastrine(solo in presenza di fenomeni di aggregazione). • Presenza di componenti estranei (anticoagulanti o simili).
• Diametro del vaso.
Trascureremo in questa sede l’effetto dei leucociti, delle proteine e delle sostanze estranee, come pure il complesso fenomeno di aggregazione piastrinica che può portare alla formazione di trombi.
Esistono varie leggi empiriche che legano la µapp all’ematocrito, più o meno
complesse a seconda dei modelli adottati. Una relazione semplice e di largo utilizzo è data da:
;
1
1
bH
H
p app−
+
⋅
=
µ
µ
(12)in cui µp è la viscosità del plasma, H è l’ematocrito e b è un parametro di valore
compreso tra 1.5 e 2 che tiene conto delle interazioni tra gli eritrociti.
L’effetto delle dimensioni del vaso sanguigno si manifesta con una diminuzione progressiva della µapp per vasi di dimensioni minori di 0.4 mm e prende il nome di
effetto Fahraeus-Lindquist. La riduzione di viscosità apparente che si nota al restringersi del vaso può essere spiegata con la tendenza degli eritrociti a concentrarsi nella parte centrale dei vasi stessi: questa situazione alza apparentemente il valore di viscosità apparente nei grandi vasi. Si può definire un’altra relazione empirica in funzione dello strato marginale libero (δ), che è la zona esterna del vaso, in cui si assume che scorra solo plasma:
;
1
'
2 −
+
⋅
=
R
app appδ
µ
µ
(13)per valori di R grandi l’equazione coincide con la (12), mentre tende a ridursi per i piccoli vasi.
Per modelli più approfonditi ed ulteriori precisazioni sulle proprietà del sangue si rimanda a testi specifici[8].
4.4 Cenni sulla propagazione delle onde nei vasi sanguigni.
Abbiamo esaminato in precedenza la diversa struttura dei vasi sanguigni a seconda della loro posizione all’interno dell’albero circolatorio, distinguendo la composizione tissutale degli stessi in base alla funzione svolta.
Ricordiamo che le tipologie di tessuti costituenti i vasi sanguigni sono:
• Endotelio – costituisce la parte più interna della parete del vaso ed è importante per la sua permeabilità selettiva alle sostanze disciolte nel sangue. Non ha proprietà elastiche.
• Collagene - è la proteina responsabile del sostegno meccanico dei vasi. • Elastina - è anch’essa una proteina, ma con deformabilità maggiore del
collagene: è meccanicamente simile alla gomma e conferisce le proprietà elastiche ai vasi.
• Muscolatura liscia - è responsabile dei meccanismi di controllo dei vasi (vasocostrizione e vasodilatazione).
In tabella 4-D indichiamo la composizione dei principali tipi di vaso sanguigno con il diametro e lo spessore della parete degli stessi.
Notiamo da questi dati che i vasi dotati di proprietà spiccatamente elastiche sono le grandi arterie: questa caratteristica serve per propagare l’onda di pressione generata
dal cuore ai distretti successivi e, dal punto di vista analitico, complica particolarmente la valutazione del profilo di velocità all’interno del vaso.
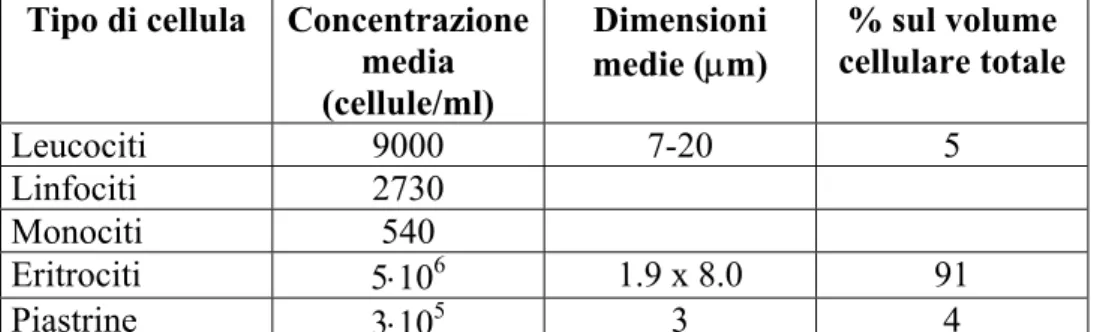
Qualitativamente è possibile descrivere la situazione creata dalla pulsatilità del cuore e dalla diversa elasticità dei vasi come una fluttuazione della velocità all’interno dei vasi stessi; questa fluttuazione viene man mano smorzata fino ad annullarsi nel letto capillare, per riattivarsi con ampiezza ridotta nella circolazione venosa. Un grafico che rappresenta sinteticamente quanto detto è visibile in fig. 4-6.
Tipo di vaso Diamet ro Spessore parete % endotelio % elastina % collagene % muscoli Aorta 2.5 cm 2mm 10 50 30 20 Arteria media 0.4 cm 1 mm 10 40 40 10 Arteriola 30 µm 20 µm 10 20 60 10 Capillare 8 µm 1 µm 100 0 0 0 Venula 20 µm 2 µm 50 0 0 50 Vena 0.5 cm 0.5 mm 20 25 25 30 Vena cava 3 cm 1.5 mm 10 20 30 40
Tab 4- D Dimensioni, spessore della parete e composizione tissutale dei principali tipi di vaso sanguigno. Risulta evidente il comportamento elastico delle arterie, specialmente dell’aorta e delle grandi arterie, in cui il profilo di velocità non può essere più descritto semplicemente in funzione della coordinata radiale, ma varia spostandosi lungo la lunghezza del vaso, assumendo le caratteristiche proprie della propagazione delle onde meccaniche.
Esistono complessi modelli analitici che studiano le modalità di propagazione, che tengono conto delle proprietà elastiche dei condotti attraversati dal sangue (modulo di Young3, estensibilità massima, etc.) e delle proprietà del fluido prima descritte. Incideranno anche sul reale andamento dei profili di velocità le interferenze con le componenti di onda “riflessa”, causate, oltre che dal ritorno elastico del vaso, dalla presenza di biforcazioni o stenosi dei vasi.
Noi ci limiteremo ad osservare che, per condotti che si possono considerare “moderatamente” elastici (soprattutto le piccole arterie), sarà proponibile l’approssimazione di tubo rigido: per tali vasi l’andamento del profilo di velocità sarà composto dal profilo di velocità calcolato per il caso stazionario, “modulato” da un’oscillazione sinusoidale con frequenza legata a quella cardiaca. Un’esemplificazione della situazione esposta è data dalla fig. 4-7, in cui si è fatta l’approssimazione di condotto rigido e flusso pulsatile.
3 Si definisce modulo di Young (E) il rapporto tra forza per unità di superficie (stress) e deformazione per unità di lunghezza (strain).
Fig 4- 6 Distribuzione della velocità media del sangue e delle fluttuazioni di velocità nelle varie arterie e vene. Un altro dato degno di nota è l’andamento dei valori di pressione all’interno del sistema circolatorio in presenza di proprietà elastiche dei vasi e pulsatilità del flusso.
Fig 4- 7 Profili di velocità in flusso generato da una pressione sinusoidale in funzione della posizione (misurata in frazioni di lunghezza d’onda). Le 4 situazioni corrispondono, nell’ordine a vasi di raggio decrescente: 1 cm, 0.5 cm, 0.1 cm, 0.05 cm.
Le pressioni che comunemente indichiamo con i termini “massima” e “minima”, corrispondenti a quella diastolica e sistolica, sono i valori rilevati in prossimità del cuore; quindi essi corrispondono alla massima ampiezza dell’onda di pressione generata dalla pompa cardiaca. La differenza tra pressione sistolica (Psist) e diastolica
(Pdiast), che possiamo indicare come ∆Pvent è l’incremento della pressione nelle grandi
arterie imposto dalla contrazione del ventricolo sinistro. Si può definire una pressione media data da Psist - Pdiast o, per essere più rigorosi, dalla media temporale della
pressione, cioè:
3
2
diast sist mediaP
P
P
=
+
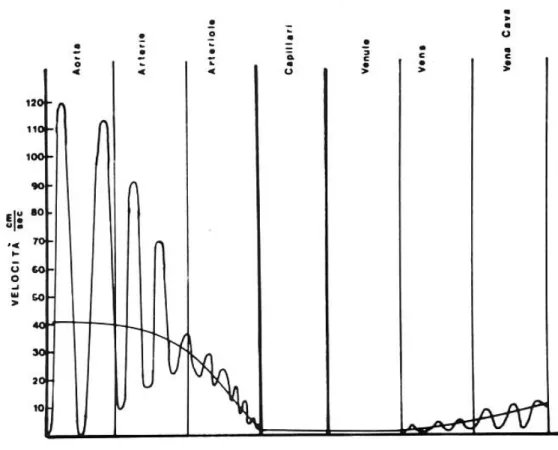
; (14)L’andamento della pressione nei vari distretti del sistema vascolare è dato in fig. 4-8. Si nota che l’onda di pressione, evidente soprattutto nell’aorta, ha un tipico andamento dovuto alle caratteristiche di elasticità dei vasi.
Fig 4- 8 Valori tipici dell’onda di pressione nei vari segmenti del sistema circolatorio.
4.5 Trasmissione del calore nel sistema cardiovascolare.
Lo studio dei fenomeni di trasmissione del calore nel sistema cardiovascolare presenta, ancora una volta, enormi difficoltà connesse alla complessa struttura del sistema stesso ed alla molteplicità di fattori da considerare. In un analisi modellistica, ci troviamo di fronte ad una rete di condotti, in cui scorre un fluido “caldo”, che attraversano vari tessuti, dando origine ad interazioni termiche con gli stessi.
In generale, come osservato nel cap. II, i fenomeni di trasmissione del calore possono essere di tre tipi: irraggiamento, conduzione e convezione. Nel caso del sistema vascolare, limitandoci ai soli vasi sanguigni, possiamo considerare i tre contributi come:
• Trasporto di calore per convezione all’interno del vaso.
• Conduzione del calore attraverso la parete del vaso e dalla parete ai tessuti adiacenti.
• Irraggiamento della parete del vaso verso l’esterno.
Il fenomeno dell’irraggiamento è stato già discusso nella trattazione dei principi base della termografia ed è regolato dalle relazioni (1), (2), (3). Va sottolineato che la componente di energia irradiata dai vasi è, nella maggior parte dei casi, schermata dai tessuti circostanti: quindi una rilevazione significativa di questa componente si può ottenere solo per vasi superficiali (ad esempio nella circolazione periferica, vedi fig. 2-5 ), oppure per vasi esposti chirurgicamente, come negli interventi di rivascolarizzazione coronarica.
La conduzione del calore è invece un fenomeno di grande importanza per i vasi sanguigni, che, proprio grazie a questo meccanismo, svolgono anche l’importantissima funzione di propagare calore nei distretti periferici. La relazione che regola questo tipo di fenomeno lega la potenza termica trasmessa alla differenza di temperatura, con un’analogia di tipo elettrico:
;
cond
R
T
Q ∆
•=
(15)il termine Rcond si definisce resistenza conduttiva della parete e dipende dal
materiale e dalla geometria della parete stessa.
La componente di convezione è quella che presenta maggiori difficoltà dal punto di vista analitico per la complessità del fenomeno, in cui entrano in gioco le proprietà del fluido e le modalità di generazione del flusso: in particolare si può definire una situazione di convezione forzata (in contrapposizione a quella “naturale”) nei casi in cui il moto del fluido sia imposto, ad esempio, da una pompa attraverso un condotto. Nel nostro caso, avremo quindi fenomeni di convezione forzata in un fluido con proprietà particolari esposte precedentemente.
In generale, la legge che regola i fenomeni di convezione (legge di Newton) è del tipo:
);
(
T
sT
fA
h
Q
•=
⋅
−
(16)in cui A è la superficie di scambio termico, Ts è la temperatura della superficie
del condotto, Tf è la temperatura del fluido ad una distanza sufficiente dalla parete e h
è un coefficiente (detto coefficiente di convezione, W⋅m-2 ⋅°C-1) che tiene conto di
tutti i fattori presenti nel fenomeno e molte volte viene determinato empiricamente. A volte si preferisce considerare la potenza termica per unità di superficie eliminando l’influenza dell’area A.
Nel caso di convezione forzata, si possono definire alcune variabili adimensionali solitamente usate nella trattazione[2]. La prima di queste è il numero di Reynolds, già descritto in precedenza nella (5).
Si può introdurre il numero di Nusselt (Nu), che rappresenta una misura dell’incremento di potenza termica trasmessa per convezione attraverso uno strato di fluido rispetto a quella trasmissibile, nelle stesse condizioni, per sola conduzione:
;
λ
D
h
Nu
=
⋅
(17)in cui h è il coefficiente di convezione prima definito, D è il diametro del tubo e λ è la conduttività termica.
L’ultima grandezza di interesse è il numero di Prandtl, definito come il rapporto tra la diffusività molecolare della quantità di moto e la diffusività molecolare del calore e dà una misura dello spessore dello strato limite termico: al pari dello strato limite di velocità, si può definire uno strato limite termico in cui:
);
(
99
.
0
lim s f s strT
T
T
T
=
+
−
(18)lo strato limite termico delimita quindi la zona del tubo in cui il fluido scorre libero a temperatura praticamente costante Tf. Il numero di Prandtl (Pr) può essere
espresso:
;
Pr
λ
µ
⋅
c
p=
(19)in cui cp è il calore specifico del fluido. Il numero di Prandtl può variare tra 0.01
ed oltre 100000 (per l’acqua si hanno valori di 1.7-13.7) ed i valori di Pr>>1 corrispondono agli oli pesanti, che presentano uno strato limite di velocità molto sottile.
È immediato osservare che l’unica espressione in cui compare il coefficiente di convezione è quella relativa al numero di Nusselt; quindi per studiare la convezione dovremo cercare comunque di ricondurci a questa grandezza.
A tal proposito è possibile definire per un condotto a sezione circolare, per vari valori del numero di Reynolds e, quindi, per diverse condizioni di flusso, alcune relazioni empiriche per ottenere il numero di Nusselt[2]. La forma generale dell’espressione è:
;
Pr
Re
B CA
Nu
=
⋅
⋅
(20)Re A B C
0.4-4 0.989 0.33 0.33 4-40 0.911 0.385 0.33 40-4000 0.683 0.466 0.33 4000-40000 0.193 0.618 0.33
Tab 4- E Relazioni empiriche per il numero di Nusselt in un condotto cilindrico.
4.6 Modelli per la circolazione coronarica.
Poniamo ora la nostra attenzione sull’oggetto specifico della nostra analisi: la circolazione coronarica. In quest’ambito noi andremo a considerare specificamente la parte relativa alle grandi arterie coronariche e alle loro principali ramificazioni, per motivi di vario genere. In primo luogo, questi vasi sono quelli visibili con facilità mediante tecniche di imaging infrarosso (o con qualsiasi tecnica di imaging, come l’angiografia digitale coronarica). Inoltre, dal punto di vista strettamente termico, questi vasi sono gli unici a presentare una differenza apprezzabile di temperatura rispetto ai tessuti circostanti (epicardio). Infine, per valutare la perfusione del miocardio è sufficiente conoscere il flusso dei rami arteriosi maggiori, data la scarsità di anastomosi nella circolazione coronarica (cap. I).
Esiste una specifica modellistica della circolazione coronarica, che descrive dettagliatamente struttura e funzione di questo distretto vascolare, cui faremo brevemente riferimento per affinare i nostri modelli[9].
Innanzitutto, si può definire una struttura ad “albero”, in cui ogni ramo si divide in rami di dimensioni inferiori, distribuendo in essi il suo flusso. Si suddivide l’albero coronarico in vari “ordini”, partendo dal primo che rappresenta i piccoli capillari. Lavorando nelle ipotesi che il flusso dei vasi dipenda solo da loro diametro (e non da fenomeni elastici o di vasocostrizione) e che sia valido il modello di Poiseuille, si possono ottenere interessanti relazioni.
La portata di un ramo di ordine m, generato da uno di ordine n è data, in accordo con la (7), da:
(
)
;
128
4 m m m n mnL
P
P
D
Q
µ
π
−
=
(21)quindi, la portata totale dei rami di ordine m è:
;
)
,
(
∑
>⋅
⋅
=
n m n mn mTOTQ
C
m
n
N
Q
(22)in cui C(m,n) è la matrice di connettività, il cui elemento di riga m e colonna n corrisponde al rapporto tra rami di ordine m derivati da quelli di ordine n ed i rami totali di ordine n (quest’ultimo dato corrisponde ad Nn).
I valori degli elementi della matrice di connettività (come quelli di altre matrici che danno indicazioni circa la direzione dei vasi) si ricavano da osservazioni sperimentali. Un esempio di queste osservazioni è data da uno studio effettuato sulla circolazione coronarica di un maiale[10]. Si può osservare in tab. 4-F la composizione dell’albero arterioso coronarico con le lunghezze (L), i diametri (D) ed il numero dei vasi, suddivisi in 11 ordini di grandezza: i rami più grandi corrispondono all’arteria coronaria destra (RCA) e ai due rami principali della sinistra, l’arteria sinistra anteriore discendente (LAD) e l’arteria circonflessa sinistra (LCX). La struttura è caratterizzata da scarsissime anastomosi e da biforcazioni dei rami nel 98% dei casi.
LAD LCX RCA Ordine D (µm) L (mm) Numero elementi D (µm) L (mm) Numero elementi D (µm) L (mm) Numero elementi 1 9.0 0.115 368554 9.0 0.115 149386 9.3 0.125 393294 2 12.3 0.136 140293 12.3 0.136 56915 12.8 0.141 138050 3 17.7 0.149 44456 17.7 0.149 17820 17.7 0.178 51915 4 30.5 0.353 17985 27.5 0.405 7554 28.6 0.253 20074 5 66.2 0.5 6386 73.2 0.908 2148 63.1 0.545 7354 6 139 1.31 1385 139 1.83 638 132 1.64 1458 7 308 3.54 348 279 4.22 144 256 3.13 403 8 462 4.99 113 462 6.98 51 428 5.99 114 9 714 9.03 37 961 21.0 10 706 9.06 35 10 1573 20.3 7 2549 47.5 1 1302 16.1 10 11 3171 45.9 1 3218 78.1 1
Tab 4- F Diametro, lunghezza e numero (valori medi) degli elementi dei tre rami principali dell’albero arterioso coronarico di un maiale, suddivisi per ordine di grandezza.
Si può così ottenere la matrice di connettività C(m,n) sopra citata (si riportano i valori medi dei coefficienti per m>n) :
= 5 1 . 0 9 33 . 3 121 . 0 2 5 . 2 5 . 2 061 . 0 2 00 . 2 3 . 1 09 . 2 116 . 0 0 17 . 1 48 . 1 58 . 1 5 . 2 155 . 0 0 667 . 0 36 . 1 56 . 1 91 . 1 5 . 2 238 . 0 0 167 . 0 303 . 0 428 . 0 380 . 0 425 . 0 25 . 2 143 . 0 0 0 03 . 0 092 . 0 120 . 0 098 . 0 381 . 0 14 . 2 074 . 0 0 0 0 0 023 . 0 094 . 0 063 . 0 50 . 1 24 . 2 094 . 0 0 0 0 0 0 0 0 071 . 0 630 . 0 04 . 2 144 . 0 0 0 0 0 0 0 0 0 148 . 0 675 . 0 18 . 3 ) . ( nm C ; (23)
Dalla conoscenza di tutti questi dati è possibile creare un modello di flusso per la circolazione coronarica che tiene conto della ripartizione del flusso totale nei vari segmenti di ordine decrescente. L’equazione (21) si può assumere valida per condizioni di flusso laminare e fluidi newtoniani: se calcoliamo il numero di Reynolds per velocità ragionevoli (dell’ordine dei cm/s), ci accorgiamo che l’ipotesi di flusso laminare, nelle arterie di medio calibro e nelle arteriole è garantita da un numero di Reynolds sufficientemente basso; per l’ipotesi di fluido newtoniano rimandiamo alle considerazioni sulla viscosità apparente nel paragrafo 4-3.
Quindi è possibile definire un coefficiente di conduttanza equivalente, che è concettualmente l’inverso della resistenza idraulica Ridr della (8):
;
4 ij ij ij ij ij eqL
D
N
G
µ
=
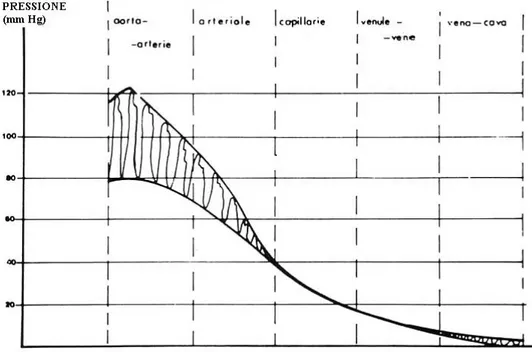
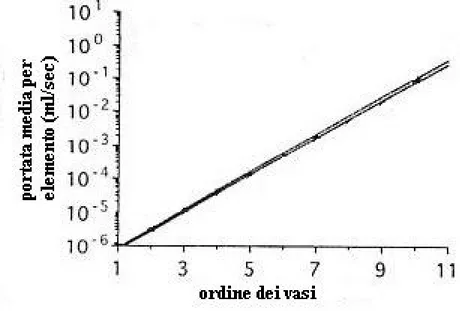
(24)che definisce la conduttanza che presenta un nodo che collega rami di ordine i e j, con significato dei simboli analogo a quello di (21) e (22). Si possono graficare inoltre gli andamenti della caduta di pressione media, del flusso medio per elemento e del volume di sangue contenuto in funzione dell’ordine dei vasi, per avere un’idea della distribuzione del sangue stesso ai vari livelli dell’albero coronarico.
Fig 4-9 Caduta media di pressione su un elemento dell’albero arterioso coronarico, in funzione dell’ordine dell’elemento.
Un ultimo accenno merita l’andamento del flusso coronarico durante il ciclo cardiaco: avevamo accennato nel par. 1-3 una descrizione qualitativa del fenomeno, con un flusso abbondante in corrispondenza della sistole e ridotto in fase di diastole[11].
Fig 4-10 Portata media per elemento in funzione dell’ordine del vaso.
Fig 4-11 Volume sanguigno totale in funzione dell’ordine dei vasi nell’albero coronarico.
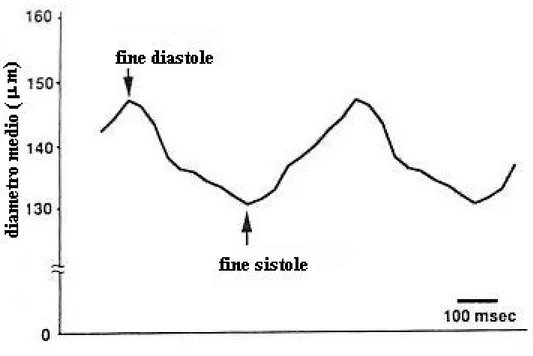
Conseguentemente a questo fenomeno, si riscontra un cambiamento del diametro dei vasi nel corso del ciclo cardiaco stesso; tale variazione non si presenta nella stessa misura per tutti i vasi: quelli più superficiali (detti subepicardici) restano praticamente invariati, mentre quelli più interni al muscolo cardiaco (detti subendocardici) mostrano variazioni anche del 24%. Tali dati sono stati ottenuti mediante misurazioni in vivo, effettuate con una sonda, inserita tramite catetere direttamente nei vasi[9]. Una rappresentazione di quanto detto, limitatamente alle arteriole della circolazione coronarica, è data dalla figura 4-12.
Fig 4- 12 Esempio della variazione del diametro delle arteriole coronarie subendocardiche nel corso del ciclo cardiaco. Sono indicati in figura i punti corrispondenti alla fine delle fasi di sistole e diastole.
Con questo si conclude la trattazione dei modelli che descrivono il sistema cardiovascolare, che ci servono per comprendere l’approccio ingegneristico allo studio del sistema stesso e che utilizzeremo come base per gli algoritmi che andremo a formulare nei capitoli successivi.