I
NDICE
INTRODUZIONE...1
1 LA COMBUSTIONE DEL POLVERINO DI CARBONE...4
1.1 IL CARBONE...4
1.2 LA COMBUSTIONE DEL CARBONE...6
1.2.1 Essiccamento e riscaldamento ...7
1.2.2 Devolatilizzazione ...9
1.2.3 Ossidazione dei volatili...11
1.2.4 Ossidazione del char ...12
1.2.5 Formazione di inquinanti ...16
1.3 LA COMBUSTIONE DEL CARBONE IN SISTEMI INDUSTRIALI...17
2 CFD APPLICATA AI SISTEMI REATTIVI MULTIFASE ...18
2.1 INTRODUZIONE ALLA FLUIDODINAMICA COMPUTAZIONALE MULTIFASE...18
2.2 DESCRIZIONE DELLA FASE CONTINUA: EQUAZIONI DI CONSERVAZIONE...21
2.2.1 Risoluzione delle equazioni di conservazione ...22
2.2.1.1 Equazioni di Navier-Stokes mediate secondo Favre (FANS) ...23
2.2.2 Modelli di turbolenza...26
2.2.2.1 Modello k-ε e sue varianti...27
2.2.3 Modelli di combustione ...29
2.2.3.1 Modello Eddy Dissipation (EDM)...31
2.2.3.2 Modello Finite Rate Chemistry (FR) ...32
2.2.4 Modelli di radiazione ...33 2.2.4.1 Modello DTRM ...34 2.2.5 Modelli spettrali...36 2.2.5.1 Modello Gray...36 2.2.5.2 Modello WSGG ...36 2.2.5.3 Modello multiband...37
2.3.1 Bilancio di quantità di moto...37
2.3.2 Trasferimento di calore...39
2.3.3 Trasferimento di materia...40
2.4 ACCOPPIAMENTO TRA LE FASI...40
2.4.1 Tracking Lagrangiano...42
3 IMPIANTO SPERIMENTALE FOSPER...44
3.1 INTRODUZIONE...44
3.2 DESCRIZIONE DEL SISTEMA FOSPER...46
3.2.1 Fornace IFRF n°1...46
3.2.2 Bruciatore AASB (Aerodynamically Air Staged Burner) ...48
3.2.3 Misurazioni ...52
4 DEFINIZIONE DELLE SIMULAZIONI NUMERICHE...54
4.1 DOMINIO E GRIGLIA DI CALCOLO...54
4.2 MODELLO FISICO...56
4.2.1 Modello per la fase gas ...56
4.2.1.1 Modello di turbolenza...57
4.2.1.2 Modello di radiazione e modello spettrale...57
4.2.2 Modello per la fase dispersa ...58
4.3 SCHEMA DI REAZIONE E MODELLO DI COMBUSTIONE...59
4.3.1 Reazioni eterogenee...60
4.3.1.1 Devolatilizzazione ...60
4.3.1.2 Ossidazione del char ...61
4.3.2 Reazioni omogenee...63
4.3.2.1 Ossidazione dei volatili...63
4.3.2.2 Ossidazione della CO...66
4.3.2.3 Formazione degli NO...66
4.3.3 Soot model ...69
4.3.3.1 Formazione della soot...69
4.3.3.2 Combustione della soot...73
4.5 PARAMETRI NUMERICI DEL SOLUTORE...75
4.6 CARATTERISTICHE DELLE SIMULAZIONI SVOLTE...77
5 RISULTATI DELLE SIMULAZIONI ...78
5.1 RISULTATI DEL MODELLO DI RIFERIMENTO...78
5.1.1 Campo di moto...78
5.1.2 Campo di temperatura...84
5.1.3 Campo di concentrazione delle specie chimiche ...86
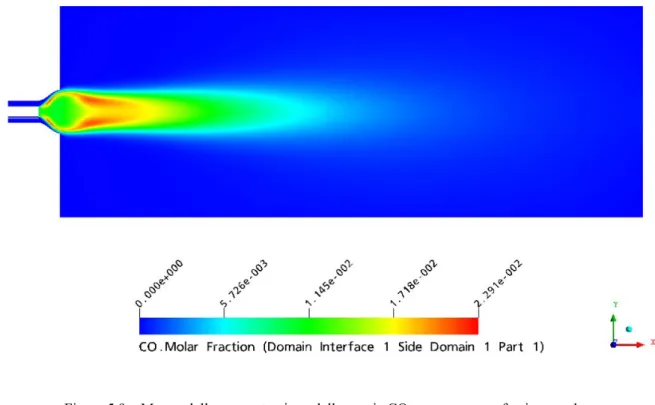
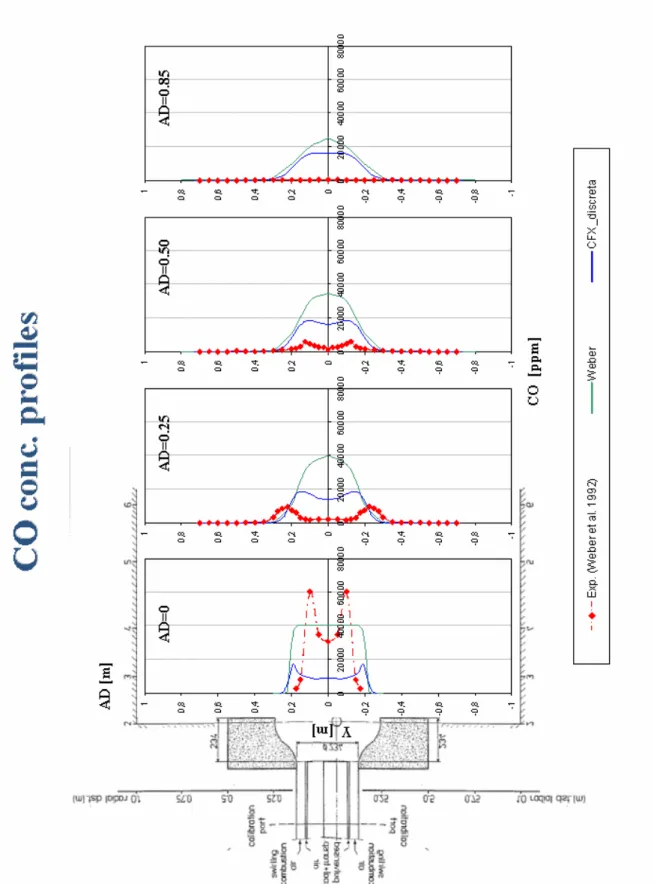
5.1.3.1 CO...86
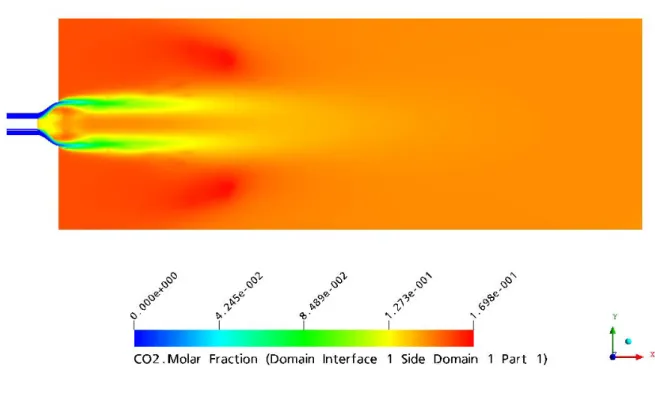
5.1.3.2 CO2...89
5.1.3.3 O2...91
5.1.3.4 NOx...93
5.1.4 Risultati all’interno del quarl (AD=-0.1 m) ...96
5.1.5 Risultati alle distanze assiali AD=1.25 m e AD=1.95 m ...98
5.1.6 Traiettorie delle particelle...101
5.2 ANALISI DI SENSITIVITÀ DEL MODELLO AL VARIARE DEI SUB-MODELS...103
5.2.1 Effetto del modello di turbolenza ...103
5.2.2 Effetto del modello dei volatili ...108
5.2.3 Effetto del numero di punti di iniezione ...111
5.2.4 Effetto del modello di radiazione delle particelle...117
5.3 RISULTATI CON IL “SOOT MODEL”...120
CONCLUSIONI...123
BIBLIOGRAFIA ...126
APPENDICE A – VALUTAZIONE DELLA PREDIZIONE DI TAR DA DEVOLATILIZZAZIONE DEL CARBONE TRAMITE CPD ...128
APPENDICE B – DISCRETIZZAZIONE DELLA DISTRIBUZIONE ...133
APPENDICE C – MODELLO PETERS E WEBER (1997)...135
APPENDICE D – EFFETTO DEL MODELLO DI TURBOLENZA ...137
Introduzione
L’interesse sociale verso problemi ambientali e la necessità di sostenere ed incrementare lo sviluppo industriale ed economico, hanno indirizzato la ricerca verso la maturazione di tecnologie “pulite” per la produzione di energia da carbone e da fonti rinnovabili.
Di recente si è assistito ad una rinnovata attenzione nei confronti del carbone come fonte di energia a causa sia dell’aumento del prezzo del petrolio e derivati, che per la maturazione di tecnologie che rendono pulita la combustione del carbone. Di recente il carbone è tornato ad essere estensivamente utilizzato nelle centrali termoelettriche, tanto che si parla di riconversione degli impianti (ad es. da olio combustibile a polverino di carbone) al fine di ottimizzare bruciatori e fornaci esistenti. E’ quindi necessario migliorare la comprensione dei complessi fenomeni che contraddistinguono il processo di combustione di carbone all’interno di sistemi su scala industriale.
Purtroppo, la sperimentazione è quasi sempre condotta su scala di laboratorio, e quindi per l’applicazione a sistemi industriali si ricorre a modelli di scale-up. Tuttavia, soprattutto in presenza di molteplici fenomeni tra loro correlati, come nel caso della combustione del carbone, il trasferimento di conoscenza da piccola a grande scala pone non poche problematiche.
Uno strumento che potrebbe aiutare lo studio di sistemi di combustione di larga scale è la Fluidodinamica Computazionale (CFD).
La CFD richiede la formulazione di modelli numerici per la simulazione termofluidodinamica della combustione di interesse: dalla “bontà” di tali modelli dipende la capacità del codice numerico di descrivere in modo corretto bruciatori, fornaci, ecc.. Lo sviluppo dei modelli alla base della CFD è quindi di interesse sia per il mondo industriale che per quello accademico. D’altronde la combustione coinvolge molti processi chimici e fisici i cui principi fondamentali non sono ancora completamente noti: questo porta inevitabilmente ad effettuare approssimazioni sui modelli numerici utilizzati per rappresentarli, limitandone l’accuratezza.
Inoltre vi sono anche dei vincoli computazionali dovuti principalmente ai limiti della tecnologia hardware e software dei computers, per cui per sistemi turbolenti e reagenti si ricorre ad approcci tipo FANS (Favre-Averaged Navier-Srokes) che forniscono indicazioni delle proprietà medie (velocità, temperatura, concentrazioni, ecc…) del sistema.
Di consequenza, allo stato attuale, la CFD applicata a sistemi di combusitone richiede delle procedure di validazione attraverso confronto con dati sperimentali, ossia non può essere utilizzata in maniera completamente predittiva.
Tuttavia la fluidodinamica computazionale è vista con grande interesse, in quanto può fornire nuove informazioni a costi piuttosto ridotti rispetto ai tradizionali metodi sperimentali, “quanto però questa informazione è utile per risolvere i problemi che si presentano nell’ambito industriale dipende ancora dall’abilità dell’utilizzatore di questi strumenti che ha il compito di porre la giusta domanda ed interpretare la giusta risposta utilizzando tutte le informazioni ottenute dalla simulazione” (Smith and Kertamus, 1995). Un punto fondamentale è che la CFD, contrariamente alla sperimentazione, può essere applicata alla scala industriale, evitando quindi problemi di scale-up.
E’ quindi opportuno verificare le capacità predittive della CFD anche su sistemi di combustione complessi su larga scala, e questo costituisce parzialmente un obiettivo della presente lavoro di Tesi di Laurea.
Al tal proposito, è stata considerata una fornace a 2.5. MW (fornace sperimentale n°1 della IFRF1) equipaggiata con un bruciatore a polverino di carbone nel quale all’aria comburente viene fornita una componente tangenziale della velocità tramite dispositivi di swirl (bruciatore AASB, Aerodynamically Air Staged Burner). Tale fornace è stata caratterizzata sperimentalmente in termini di profili di velocità, temperature e concentrazione delle specie (Weber et al., 1992), costituendo un buon e raro banco di prova per la comprensione di fenomeni su larga scala nell’ambito della combustione eterogenea.
Nel presente lavoro di Tesi di Laurea viene sviluppata la modellazione e simulazione della fornace attraverso il codice commerciale CFX 5.7.1 della Ansys Inc., prendendo a riferimento il lavoro fatto in passato con il codice FLUENT da R. Weber e F. Peters,
1 International Flame Research Foundation
(Peters e Weber, 1996). In tal modo saranno anche evidenziate differenze e analogie tra modelli disponibili in passato e attualmente per la combustione eterogenea.
Il sistema di combustione risulta essere complesso: in particolar modo devono essere considerate sia una fase gassosa continua che una dispersa (polverino di carbone). Tali fasi sono fortemente accoppiate tra loro per scambio di massa, quantità di moto ed energia. Particolare attenzione deve essere inoltre rivolta ai fenomeni che interessano le particelle di carbone, quali devolatilizzazione e combustione del char.
In una prima fase del lavoro sono utilizzati dei modelli classici per la combustione del carbone (devolatilizzazione, ossidazione dei volatili, ossidazione del char, ossidazione della CO, formazione di NOx) e le predizioni sono state confrontate sia con le misure sperimentali che le simulazioni di Peters e Weber (1996).
In un secondo momento, il modello numerico è stato modificato per tener conto della formazione e combustione della soot (fuliggine).
Infine, è effettuata un’analisi di sensitività del modello numerico al variare dei sub-models, quali la scelta del modello di turbolenza, del modello dei volatili, del numero di punti di iniezione e distribuzione dimensionale del polverino di carbone, così come del modello di radiazione.
1
La combustione del polverino di carbone
1.1 Il carbone
Il carbone è un combustibile fossile (come il petrolio), è estratto in miniere e non è rinnovabile, cioè non si rigenera e tende ad esaurirsi su una scala di tempo percepibile dall’uomo. Molto usato in passato come fonte di energia, poi parzialmente surclassato da petrolio e derivati, attualmente è tornato ad essere utilizzato nelle centrali termoelettriche (per cui si parla di riconversione degli impianti, cioè di far funzionare gli impianti esistenti, concepiti per olio combustibile, con polverino di carbone).
Questo è dovuto essenzialmente a due fattori:
• maggior costo del petrolio (mentre il costo del carbone è rimasto in questi anni più
o meno lo stesso);
• minor impatto ambientale, dovuto allo sviluppo di nuove tecnologie per rendere le
emissioni delle centrali a carbone più compatibili con l’ambiente.
Il carbone è un combustibile solido organico, non omogeneo, formato dalla decomposizione e metamorfosi di materiale di origine vegetale. È un combustibile compatto (alto rapporto energia/volume), è facilmente trasportabile in grandi quantità ed è facilmente stoccabile.
Esso può essere caratterizzato in vari modi:
• analisi petrografica: si determinano le componenti petrografiche mediante analisi al microscopio ottico (vitrinite, clarinite, fusinite, inertinite, etc.)
• analisi elementare: con opportune metodologie si valutano le frazioni in peso dei diversi elementi che lo costituiscono.
• analisi immediata: si determinano carbonio fisso, volatili, ceneri ed umidità (ad esempio mediante analisi termogravimetrica).
Il grado di conversione (fossilizzazione) subito dalle sostanze originarie è relazionato con il contenuto di carbonio e serve per una classificazione dei carboni fossili per tipologia. Con riferimento alle utilizzazioni dei carboni fossili, le proprietà che assumono maggiore
importanza sono il tipo di carbone, generalmente legato all’età e coinvolgente molte proprietà tra le quali il tenore di sostanze volatili, il potere calorifico e la tendenza al rammollimento e alla cokificazione. Altre proprietà importanti sono la facilità di macinazione, il contenuto di ceneri e quello di zolfo.
La maggior parte del carbone fossile prodotto è impiegato come combustibile per produrre vapore per la generazione di energia elettrica. A tal fine, ovviamente, il potere calorifico è la più importante delle proprietà da considerare. Tuttavia, anche altre caratteristiche del carbone sono di grande interesse per la definizione delle condizioni migliori da adottare per la combustione.
In generale, i carboni più vecchi si incendiano più difficilmente e richiedono camere di combustione di maggior volume per bruciare completamente. I carboni più giovani presentano una maggior reattività e possono essere bruciati velocemente in forni a ciclone. Le sostanze volatili rivestono grande importanza ai fini della facilità di ignizione. Le antraciti, con basso tenore di volatili, bruciano lentamente e con fiamma corta. Si prestano per quelle applicazioni per le quali il calore è trasferito direttamente dal letto di carbone. Per le combustioni in fornace si preferiscono invece i carboni a fiamma lunga. La tendenza al rammollimento e alla formazione di coke non è importante quando si brucia polverino di carbone, mentre la facilità di macinazione diviene una caratteristica critica.
Il contenuto di ceneri e le loro caratteristiche termiche (tendenza alla fusione e alla formazione di scorie) rivestono una notevole importanza. Se il contenuto di ceneri è molto alto, le scorie fuse (slags) asportano una quantità notevole di calore sensibile abbassando la resa termica delle fornaci. Le ceneri possono depositarsi sulle pareti delle fornaci dando luogo ad incrostazioni (slagging) o sulle superfici dei tubi con conseguente loro sporcamento (fouling). La tendenza allo slagging e al fouling delle ceneri dipende dalla loro composizione chimica e, in particolare, dal loro contenuto di ossidi acidi e basici, di sodio, di calcio e magnesio, e di zolfo.
Gli impieghi principali dei carboni fossili consistono nella combustione (dopo eventuale desolforazione), nella carbonizzazione per l’ottenimento del coke da usare soprattutto nell’industria metallurgica, nella gassificazione e nella liquefazione.
1.2 La combustione del carbone
Il carbone è il combustibile solido maggiormente utilizzato. La combustione diretta ne assorbe la maggior parte del consumo. La combustione diretta può avvenire sostanzialmente in tre tipi di sistema:
¾ a polverino di carbone (particelle 10-100 µm) ¾ a letto fluido (particelle 1-5 mm)
¾ a letto fisso (particelle 1-5 cm)
Nel caso di bruciatori a polverino, si alimenta il combustibile tramite un getto di aria di trasporto: le particelle di carbone, che devolatilizzano mentre si scaldano, rendono il getto molto simile ad uno spray.
Ogni singola particella è sottoposta in genere a tutta una serie di fenomeni che possono avvenire contemporaneamente e/o in serie: riscaldamento, devolatilizzazione, combustione dei volatili, ignizione e ossidazione del char, etc.
La rilevanza relativa dei processi suddetti dipende sia dalla natura chimico-fisica del combustibile, sia dalla interazione fisica (fluidodinamica e/o termica) della particella con flussi di aria comburente o dei prodotti gassosi di combustione.
Nel caso di un bruciatore a carbone polverizzato, l’interazione del getto contenente il polverino di carbone con i flussi di aria che assicurano la stabilità della fiamma e il completamento della combustione, è un fenomeno che non può essere descritto in modo deterministico. Si ha a che fare con un campo di moto tridimensionale turbolento, con notevole aliquota di ricircolazione, il cui accoppiamento con il getto di polverino disperso determinerà la “struttura” della fiamma.
La descrizione completa della combustione del carbone richiede la modellazione di almeno due fasi distinte:
• la devolatilizzazione del carbone
• l’ossidazione del char
L’umidità viene rilasciata a bassa temperatura (100° C), mentre gas e tar sono rilasciati a temperature più elevate (a partire da 350-400° C). La particella può rammollire (softening), rigonfiare (swelling), e subire dei cambiamenti strutturali (area superficiale e distribuzione dimensionale della porosità).
Ciò che rimane dopo il processo di devolatilizzazione è il char: la particella di char è in genere molto porosa, con caratteristiche che variano a seconda del carbone parente e delle condizioni di devolatilizzazione. In definitiva la fase di devolatilizzazione è importante, ai fini della combustione, per i seguenti motivi:
- controlla la distribuzione dei prodotti (tar, gas, char).
- il tar è la sorgente primaria della fuliggine (soot): controlla quindi lo scambio termico per irraggiamento nella zona di fiamma dei volatili.
- la combustine del char (stadio lento) dipende dalla quantità e dalle caratteristiche del char formatosi durante il processo di devolatilizzazione.
Quindi, i prodotti che si formano dalla devolatilizzazione sono molteplici: tar, idrocarburi, CO, idrogeno, vapor d’acqua, HCN, etc. Questi prodotti reagiscono con l’ossigeno nelle vicinanze della particella di char, aumentandone la temperatura e consumando ossigeno. Si forma una fiamma simile a quella che circonda le gocce di combustibile liquido che evapora (fiamma a diffusione). La combustione dei volatili non è determinante ai fini della velocità globale del processo (anch’essa è molto veloce) ma è importante per i seguenti motivi:
- formazione di NOx - formazione di fuliggine - stabilità della fiamma - ignizione del char
1.2.1 Essiccamento e riscaldamento
In generale, i combustibili solidi alimentati nei comuni combustori sono caratterizzati da una percentuale di umidità variabile che, per effetto del calore fornito dai sistemi di riscaldamento, evapora e viene liberata dalla struttura porosa della particella.
Già in questa fase la particella subisce delle variazioni strutturali non trascurabili: in funzione della quantità di umidità liberata la particella è soggetta ad una riduzione del diametro globale e può aver luogo la creazione di fessure di dimensioni comprese tra 5-10 Å. Queste microcricche possono degenerare nella perdita di integrità della particella stessa se le pressioni che si creano all’interno della matrice solida sono troppo elevate o se il
vapore prodotto non riesce a fuoriuscire. Questo fenomeno è evidenziabile soprattutto nei forni ad alta temperatura caratterizzati da elevate velocità di riscaldamento.
Il riscaldamento e l’essiccamento delle particelle sono dei processi limitati dal trasferimento di calore, che dipende da numerose variabili: il contenuto di umidità e di ceneri del combustibile, le dimensioni e la porosità delle particelle, le proprietà legate al trasferimento di calore, la temperatura dell’ambiente di reazione. In generale, comunque, il trasferimento del calore radiativo e convettivo dal forno al boundary layer gassoso e alla superficie della particella sono fenomeni abbastanza veloci, mentre l’evaporazione dell’umidità avviene in base al trasferimento di calore di tipo conduttivo all’interno del combustibile, quando la temperatura del solido supera i 105°C.
Il calore necessario per portare l’umidità contenuta dalla temperatura ambiente al punto di ebollizione e per permetterne il cambiamento di stato deve prendere in considerazione anche:
• l’aumento di pressione nei pori, che comporta una ulteriore variazione nel profilo
di temperatura interno;
• il locale raffreddamento del solido dovuto alla sottrazione del calore latente del
vapore.
Per la valutazione del tempo di essiccamento si può fissare un valore del calore fornito dal sistema di riscaldamento, tenendo però presente che la temperatura sulla superficie della particella subisce delle forti variazioni.
Per particelle di dimensioni inferiori a 30 mm e con temperature del forno intorno a 1000°C, l’essiccamento è talmente rapido da poter assumere che la devolatilizzazione avvenga ad uno stadio completamente separato da questa prima fase, anche per combustibili caratterizzati da un contenuto di umidità superiore al 50%.
1.2.2 Devolatilizzazione
La devolatilizzazione del carbone comporta il riscaldamento in assenza di ossigeno con la produzione di tre classi di prodotti:
− Volatili (H2O, CO2, H2, CO, CH4, C2H6, CH2O,…): i prodotti gassosi possono essere
condensabili o meno a temperatura ambiente ma nelle condizioni di reazione rimangono in fase gassosa.
− Tar: costituito generalmente da sostanze come idrocarburi pesanti con un rapporto H/C>1.0.
− Char: un residuo solido poroso, ricco di materiale carbonioso, con basse frazioni di idrogeno e ossigeno, contenente tutti gli eteroatomi presenti nel combustibile di partenza.
Le temperature alle quali ha inizio la devolatilizzazione sono diverse in base al combustibile considerato, generalmente intorno ai 450-500°C per il carbone e a 350°C per il biofuel.
Sono stati sviluppati numerosi schemi per la descrizione della devolatilizzazione, che tengono conto della complessità delle reazioni che hanno realmente luogo.
In particolare, il tar non è un prodotto finale nei processi di combustione reale e, generalmente, subisce reazioni secondarie dovute all’intimo contatto tra i volatili leggeri che si liberano e attraversano come bolle lo strato di composti idrocarburici liquefatti. Nel corso del trasporto dei volatili all’interno della struttura porosa, se il tar impedisce il flusso o se i pori sono effettivamente chiusi, l’incremento di pressione interna può essere tale da provocare la frammentazione della particella solida, riducendone le dimensioni e incrementando la superficie disponibile per la reazione. In realtà, durante la devolatilizzazione, alcuni combustibili solidi (Figura 1.1) possono subire trasformazioni di tipo plastico, con rigonfiamento del volume e formazione di particelle internamente vuote, note come cenosfere.
a) b)
Figura 1.1 - Immagini al microscopio a scansione di una particella di carbone non reagita a) e dopo parziale devolatilizzazione b).
Si può supporre, come fanno numerosi autori, che il processo di devolatilizzazione avvenga seguendo una cinetica globale del primo ordine, uniformemente all’interno della particella. La velocità di devolatilizzazione è espressa, secondo una comune relazione tipo Arrhenius, come: ⎟ ⎠ ⎞ ⎜ ⎝ ⎛− ⋅ ⋅ − = ∞ RT E K V V dt dV exp ) (
dove V è la frazione in massa dei volatili liberata al tempo t. V∞ è il valore di V per t → ∞ che si differenzia dal contenuto di volatili ottenuto dall’analisi immediata dal momento che quest’ultimo è ottenuto in condizioni operative standard. La devolatilizzazione ha una dipendenza forte dalla temperatura della particella. Uno dei limiti di questo approccio è l’ipotesi di uniformità della particella, non solo rispetto alla temperatura interna, ma anche relativamente alla dimensione, al diametro, alla porosità, all’area superficiale, al rapporto superficie/massa e alle altre caratteristiche del combustibile.
Un ulteriore sviluppo del modello cinetico per lo stadio di devolatilizzazione prevede uno schema a due reazioni in parallelo:
) ( 2 Re ) 1 ( ) ( 2 ) ( 1 Re ) 1 ( ) ( 1 ) ( 2 2 2 2 1 1 1 1 2 1 R sidue V Volatile R sidue V Volatile C Coal k k α α α α − + ⎯→ ⎯ − + ⎯→ ⎯
dove k1 e k2 sono del primo ordine rispetto a C e α1e α2sono le frazioni in massa dei volatili, rispettivamente a basso e ad alto peso molecolare, prodotti secondo le due reazioni.
(1.1)
Le espressioni della velocità di reazione per il modello di devolatilizzazione sopra riportato sono:
(
)
(
)
⎪ ⎪ ⎩ ⎪ ⎪ ⎨ ⎧ ⋅ + − = + ⋅ + − = C k k dt dV dt dV C k k dt dC 2 2 1 1 2 1 2 1 α αA basse temperature di devolatilizzazione si suppone che sia dominante la reazione di produzione dei volatili leggeri, mentre all’aumentare della temperatura la seconda reazione diventa più veloce della prima.
Questo modello fornisce una correlazione dei dati sperimentali migliore di quella fornita dal modello di devolatilizzazione a reazione unica, ma necessita di informazioni relative ai parametri cinetici sulle due reazioni per le varie tipologie di combustibile.
A riguardo, attualmente, esistono 3 modelli di tipo strutturale che sono in grado di predire la composizione dei prodotti di devolatilizzazione del carbone sulla base dei processi che coinvolgono la rottura della sua struttura macromolecolare di partenza: il modello Flashchain (Niksa e Kerstein, 1991), il modello FG-DVC2 (Solomon et al., 1993) ed il modello CPD3 (Fletcher et al., 1992).
1.2.3 Ossidazione dei volatili
I volatili liberati nel corso della devolatilizzazione subiscono una serie di reazioni di ulteriore frammentazione, con formazione di specie radicaliche reattive che a loro volta regiscono con l’ossigeno contenuto nell’aria comburente per produrre CO2, H2O e altri
composti che possono costituire emissioni inquinanti. I meccanismi di ossidazione radicalica dei volatili, essendo simili a quelli di combustione di miscele idrocarburiche, sono largamente sviluppate in letteratura.
2 Functional Group, Depolymerization, Vaporization, Cross-linking 3 Chemical Parcolation Devolatilization
Nel presente lavoro di Tesi di Laurea, l’ossidazione dei volatili è stata modellata con una reazione single step che porta alla formazione di CO, CO2, H2O e N2 (solo se è presente
una frazione di N nella composizione dei volatili). Per maggiori dettagli si veda il Paragrafo 4.3.2.1.
1.2.4 Ossidazione del char
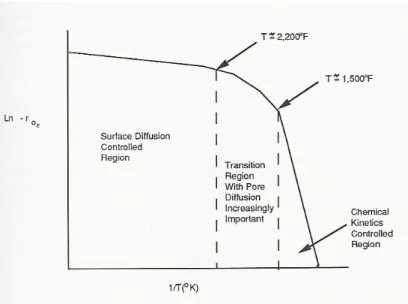
L’ossidazione del char comporta l’introduzione di fenomeni relativi al trasporto delle specie gassose dall’ambiente di reazione, attraverso il boundary layer, fino alla superficie del solido. Poiché però il char è caratterizzato da una struttura porosa, le reazioni di ossidazione avvengono prevalentemente all’interno di questa e, di conseguenza, la velocità di ossidazione è determinata (Figura 1.2) dagli effetti combinati delle resistenze diffusive interne ed esterne e dalla cinetica intrinseca di reazione sulla superficie.
In base alle diverse condizioni operative di temperatura, reattività, dimensione delle particelle, concentrazione degli agenti ossidanti, l’ossidazione del Char può presentare delle caratteristiche distinte che sono state schematizzate (Figura 1.3) in quattro regimi di combustione:
• Regime I: Reazione cineticamente controllante: le velocità di reazione sono basse, la
concentrazione nei pori è uguale a quella nell’ambiente di reazione e tutta l’area superficiale contribuisce in modo uniforme alla reazione.
• Regime II: Poiché la velocità di reazione è tale da non avere una concentrazione
uniforme all’interno dei micropori, si ha un minimo di concentrazione dell’ossigeno in corrispondenza del centro della particella di char. La velocità complessiva del processo è controllata da un effetto combinato della cinetica di ossidazione alla superficie e della diffusione dell’ossigeno nei pori.
• Regime III: All’ulteriore aumento della velocità di reazione, corrisponde un
incremento della resistenza diffusiva dell’ossigeno nello strato limite intorno alla particella.
• Regime IV: Il processo diventa fortemente dipendente dai fenomeni di resistenza alla
diffusione nella fase gassosa, perché la reazione è estremamente veloce e si ha consumo dell’ossigeno immediato non appena arriva alla superficie del char.
Figura 1.3 - Andamento della concentrazione dell’ossigeno al variare delle condizioni operative di combustione
In maniera molto semplificata, si può assumere di avere una combustione secondo il I e il II regime nei reattori a letto fisso e a letto fluidizzato, in quanto questi reattori operano su particelle di dimensioni grandi e a temperature relativamente basse. La combustione di particelle piccole, condotta ad elevate temperature, corrisponde a cinetiche chimiche veloci per cui si può pensare ad un processo in regime III o IV. Ovviamente, la struttura porosa gioca un ruolo fondamentale per cui, i modelli che descrivono la combustione presentano sempre una stretta connessione tra ipotesi sull’evoluzione della struttura porosa e regime di combustione della particella.
Si riportano ora gli schemi semplificati di reazione proposti comunemente per l’ossidazione del char:
C + O2→ CO2
C + ½ O2→ CO
La reazione di produzione del monossido di carbonio è seguita dall’ossidazione dello stesso in fase gassosa a CO2, che comporta un incremento notevole della temperatura sulla
superficie della particella. All’aumentare della temperatura operativa aumenta il rapporto CO/CO2 perché si rientra nel regime III-IV di combustione e l’apporto di ossigeno non è sufficiente per la totale ossidazione del monossido di carbonio all’interno della particella. In effetti si hanno due reazioni in serie, con l’ossidazione del CO a CO2 che, in queste
condizioni, ha luogo nello strato limite intorno alla particella o nel bulk gassoso.
Nel complesso schema cinetico delle reazioni che hanno realmente luogo, bisogna considerare anche l’influenza sul processo complessivo delle reazioni di gasificazione del materiale carbonioso non reagito:
C + CO2→ 2CO
C + H2O → CO + H2
Queste reazioni sono endotermiche e sono quindi termodinamicamente favorite a temperature superiori a 700°C, ma sono considerate di minore importanza, rispetto a quelle tra il carbonio e l’ossigeno, fino a temperature intorno ai 1600°C.
(1.4)
1.2.5 Formazione di inquinanti
Poiché tutti i combustibili solidi sono caratterizzati da una percentuale di composti inorganici, nel corso della combustione si ha la formazione di componenti inquinanti tipici come materiale particolato, composti dello zolfo, ossidi di azoto, tracce di elementi metallici elementari, specie gassose in tracce, idrocarburi policiclici aromatici, ecc.. Si riporta di seguito una breve rassegna delle caratteristiche di formazione di queste specie inquinanti, senza la pretesa di completezza:
• Il materiale particolato si può dividere in smoke e polveri. La prima classe, che
comprende fuliggine e gocce di tar condensato, si forma a causa dell’incompleta combustione dei componenti che costituiscono il tar, nel corso della devolatilizzazione della particella. Le polveri sono invece costituite quasi totalmente dal materiale inorganico, già presente nel combustibile solido di partenza.
• L’emissione di composti dello zolfo, principalmente ossidi (SOx), durante la
combustione non è causa soltanto di inquinamento atmosferico a seguito del rilascio dei gas, ma provoca anche gravi danni sulle apparecchiature dovuti a corrosione acida. Gli SOx si formano tramite una serie di reazioni che coinvolgono
sia i legami organici sia i legami inorganici dello zolfo. Il prodotto di combustione predominante è l’anidride solforosa SO2, con piccole quantità di anidride solforica
SO3, mentre una considerevole quantità di zolfo resta nel residuo solido inorganico. • Tra gli ossidi di azoto, generalmente identificati come NOx, il monossido NO
rappresenta circa il 95% in volume dell’emissione globale di NOx, mentre una
frazione decisamente minore è imputabile al biossido (NO2) e solo in tracce è
presente l’ossido nitroso (N2O). Questi ossidi non sono prodotti solo dall’azoto
organico presente nei combustibili, ma anche dall’azoto atmosferico, alimentato nell’ambiente di reazione con l’aria comburente. Come gli ossidi di zolfo, anche gli ossidi di azoto giocano un ruolo determinante nell’impatto ambientale e necessitano di trattamenti specifici per la rimozione.
• Accanto alle emissioni di CO2, SOx ed NOx, bisogna poi considerare anche
cianidrico e solfidrico, solfuro di carbonio e altri composti idrogeno-carboniosi di peso più elevato.
• Gli idrocarburi policiclici aromatici (PAH) sono emessi dalle particelle di carbone
durante la devolatilizzazione ad alta temperatura e la loro concentrazione deve essere rigidamente tenuta sotto controllo in quanto sono composti altamente cancerogeni.
1.3 La combustione del carbone in sistemi industriali
La combustione del polverino di carbone è già di per se un fenomeno molto complesso, e la difficoltà nel descrivere e modellare tale processo aumenta notevolmente se si considerano sistemi di combustione a livello industriale.
Vi sono, infatti, altri fenomeni da considerare, come:
- modalità di iniezione sia del polverino che dell’aria comburente, talvolta resa più complessa dalla presenza di dispositivi tipo swirl, quarl e bluff-body.
- interazione/scambio di calore con le pareti della fornace - influenza dei fenomeni radiativi
- formazione della fuliggine
- problemi di incrostazioni (slagging) e sporcamente (fouling)
L’analisi e lo studio dei fenomeni che coinvolgono la particella di carbone sono quindi solo il punto di partenza per uno studio accurato sulla combustione del polverino di carbone in sistemi industriali.
Una trattazione completa richiede uno sforzo per modellare tutti (o per lo meno i più rilevanti) fenomeni coinvolti.
2
CFD applicata ai sistemi reattivi multifase
2.1 Introduzione alla fluidodinamica computazionale multifase
La fluidodinamica computazionale (CFD) è uno strumento che permette lo studio di sistemi che coinvolgono moto dei fluidi, scambi termici e fenomeni associati come reazioni chimiche. L’analisi numerica di tali sistemi avviene con l’ausilio di avanzati codici di calcolo, che permettono di risolvere l’equazioni di Navier-Stokes per un sistema di interesse per il quale siano definite le condizioni al contorno ed iniziali.
La fluidodinamica computazionale costituisce uno strumento predittivo versatile, in quanto consente di fare analisi e previsioni su di un’ampia gamma di possibili scenari senza le caratteristiche limitazioni della sperimentazione.
Può ad esempio essere impiegata per l’ottimizzazione del design di apparecchiature, per la comprensione di fenomeni che avvengono in impianti operativi, per lo studio di condizioni di flusso difficilmente riproducibili in laboratorio oppure di sistemi operanti in condizioni pericolose (analisi di rischio e scenari ambientali).
Il ricorso alle simulazioni numeriche, consente di ottenere risultati ad alta risoluzione in tempi molto minori e con costi ridotti rispetto alla classica pratica sperimentale; la CFD inoltre non da problemi di scale-up.
La modellazione CFD è diventata, quindi, uno strumento indispensabile per lo sviluppo di idee nuove e tecnologie avanzate. Sono disponibili, in letteratura, esempi di applicazione a sistemi eterogenei reagenti, in particolare a sistemi di combustione del carbone e, recentemente, anche di biomasse.
Per tali sistemi la CFD deve descrivere diverse fasi e fenomeni, quali lo scambio di quantità di moto, di energia, ecc…
Generalmente i sistemi multifase possono essere descritti con due modelli:
• Il modello Euleriano-Euleriano (E-E), indicato per flussi multifase “densi”;
Nel primo approccio si fa riferimento alla frazione volumetrica di ciascuna fase che viene trattata come un continuo.
Per ciascuna fase, viene scritto il set di equazioni di conservazione di tipo Euleriano che vengono poi risolte contemporaneamente, dopo aver modellato i fenomeni di scambio all’interfaccia tra le varie fasi.
Il secondo approccio è in genere usato per descrivere il moto di fasi disperse, come in presenza, all’interno di un flusso continuo, di gocce, bolle e particelle solide.
A differenza del modello Euleriano-Euleriano, in queste applicazioni viene impiegato un modello di trasporto delle particelle di tipo Lagrangiano e un modello Euleriano per la fase continua.
Il modello Lagrangiano considera infatti tutte le forze che agiscono sulla particella al tempo ti, fornendo una migliore stima del comportamento e della traiettoria delle particelle (vedi Figura 2.1).
Figura 2.1 – Metodi E-E ed E-L a confronto
Vantaggi e svantaggi dei due modelli sono riassunti in Tabella 1:
Metodo Euleriano-Lagrangiano Metodo Euleriano-Euleriano
Tabella 1 – Vantaggi e svantaggi dei due modelli
Metodo Euleriano-Euleriano Metodo Euleriano-Lagrangiano
Vantaggi Vantaggi
meno complicato
minori costi computazionali
possibilità di trattare entrambi le fasi con uno
schema e una griglia di calcolo meno dettagliate
tiene conto della distribuzione dimensionale
delle particelle
modellazione dettagliata dei processi fisici
elementari su scala della particella ( collisioni tra particelle, agglomerazione, ecc…)
Svantaggi Svantaggi
difficile descrizione dei fenomeni sulla
particella
richiesta di un maggior numero di nodi maggiori costi computazionali
difficoltà e problematiche di calcolo se il
volume della particella è maggiore del volume medio del fluido
Generalmente non è computazionalmente possibile seguire tutte le particelle ed effettuare un bilancio su di esse, per cui il comportamento della fase dispersa è determinato seguendo la traccia di uno o più campioni di particelle (particle tracking) attraverso il flusso. I risultati ottenuti su questi campioni sono utilizzati, quindi, per descrivere il comportamento medio della fase discreta.
Come emergerà nei seguenti paragrafi, la CFD si basa su modelli e rappresentazioni semplificate delle realtà fisiche, e come tali non garantiscono la validità assoluta dei risultati. Si rende dunque necessario affiancare a tale strumento un adeguato studio sperimentale, al fine di accertare l’accuratezza del modello utilizzato, e verificare infine la validità dei risultati ottenuti.
2.2 Descrizione della fase continua: equazioni di conservazione
Con riferimento ad un sistema di coordinate cartesiane, e utilizzando secondo la consuetudine tensoriale la notazione di sommatoria4, le equazioni di conservazione per flussi reagenti si possono esprimere in notazione Euleriana come segue:
• Equazione di conservazione della massa totale:
0 = ∂ ∂ + ∂ ∂ i i x u t ρ ρ
• Equazione di conservazione della massa delle singole specie chimiche:
k i k i i i k k w x J x u Y t Y & + ∂ ∂ − = ∂ ∂ + ∂ ∂ρ ρ k =1,2,...,NC
• Equazione di conservazione della quantità di moto:
j i ij j i i j j g x x p x u u t u ρ τ ρ ρ + ∂ ∂ + ∂ ∂ − = ∂ ∂ + ∂ ∂ j=1,2,3
• Equazione di conservazione dell’entalpia specifica5
rad i j ij i i i i Q x u Dt Dp x q x hu t h & + ∂ ∂ + + ∂ ∂ − = ∂ ∂ + ∂ ∂ρ ρ τ
Le equazioni di conservazione della massa e della quantità di moto, sono note come equazioni di Navier-Stokes. Nelle equazioni riportate, l’indice i indica la componente di
un vettore tridimensionale
(
i=1,2,3)
, mentre k denota una specie chimica presente nel sistema(
k =1,2,...,NC)
.Gli altri termini presenti nell’equazioni, hanno il seguente significato: - ρ è la densità del fluido;
- u è la velocità del fluido, i.e. u u= + + ; 1 u2 u3
4 La notazione di sommatoria sottintende una sommatoria su tutti gli indici ripetuti. 5 Equazione ottenuta ritenendo trascurabili gli effetti delle forze di volume.
(2.1)
(2.2)
(2.3)
- Y è il vettore delle frazioni massiche delle specie chimiche; - h è l’entalpia specifica del fluido;
- N è il numero di specie chimiche; C
- p è la pressione statica del fluido;
- g rappresenta una forza di volume per unità di massa; - τ è il tensore degli sforzi viscosi;
- J è il flusso diffusivo della specie chimica k k; - q è il flusso diffusivo di calore;
- w& è la velocità di reazione massica del componente k k;
- Q& rappresenta il flusso di calore radiante. rad
2.2.1 Risoluzione delle equazioni di conservazione
La risoluzione diretta (DNS6) delle equazioni di conservazione è possibile solo nel caso di flussi con bassi numeri di Reynolds, condizione che si verifica raramente nei casi di studio. La DNS necessita di una discretizzazione spaziale e temporale molto fine, tale da risolvere completamente anche le più piccole scale dei fenomeni in gioco. Il livello di dettaglio ottenuto è massimo e non vi sono perdite sostanziali di informazioni.
Tuttavia, all’aumentare del numero di Reynolds si riducono le dimensioni delle strutture vorticose più piccole ed il costo computazionale delle simulazioni risulta, pertanto, proibitivo.
Inoltre, anche se la risoluzione delle equazioni fosse possibile, l’elevato grado di dettaglio spaziale e temporale ottenibile avrebbe scarso interesse pratico, dato che nell’ambito delle applicazioni ingegneristiche, l’attenzione è posta sui valori medi delle grandezze in gioco, come ad esempio la velocità media di consumo del combustibile o il tasso medio di formazione delle specie inquinanti.
6 Direct Numerical Simulation
Le equazioni di conservazione vengono quindi mediate nello spazio e nel tempo (RANS7 o FANS8) utilizzando una descrizione statistica del flusso turbolento (Pope, 2001).
Esiste un terzo approccio per la risoluzione delle equazioni di conservazione, la Large Eddy Simulation (LES).
In tale approccio le scale più grandi (energetiche) sono rappresentate direttamente, mentre quelle più piccole (universali) sono modellate.
L’approccio LES riesce a fornire un’accuratezza migliore delle RANS in quanto la diretta modellazione delle strutture vorticose maggiori riesce a catturare vari fenomeni di instabilità presenti (ad esempio, in flussi su bluff-bodies).
Il costo computazionale di una simulazione LES di un flusso turbolento e reattivo, è notevolmente maggiore della RANS, anche se più basso di quello necessario per una DNS, ma comunque tale da richiedere necessariamente l’utilizzo di piattaforme di calcolo parallele.
Di seguito è riportato l’approccio FANS, in quanto di interesse nel presente lavoro di tesi di Laurea.
2.2.1.1 Equazioni di Navier-Stokes mediate secondo Favre (FANS)
Un flusso turbolento, caratterizzato da forti fluttuazioni di tutte le proprietà locali, risulta un processo di carattere caotico e quindi difficilmente descrivibile in termini di grandezze globali.
Considerando la variabile dipendente Φ , è possibile definire due differenti tipologie di media: la media secondo Reynolds e la media secondo Favre.
La media secondo Reynolds decompone la generica variabile Φ ,variabile nel tempo, in una componente fluttuante Φ′ ed una componente media Φ definite come:
( )
∫
Φ ≡ Φ T dt t T 1 e Φ≡Φ′+Φ 7 Reynolds-averaged Navier-Stokes 8 Favre-averaged Navier-Stokes (2.5)Dove T è il tempo di integrazione che deve essere sufficientemente grande rispetto alle scale temporali turbolente, ma nello stesso tempo sufficientemente piccolo in modo da non perdere informazioni riguardanti il moto medio del fluido nel tempo.
Dalle relazioni descritte sopra, risulta che Φ′=0
La definizione (2.5) è conosciuta come decomposizione di Reynolds ed è impiegata prevalentemente nell’analisi fluidodinamica di sistemi non reagenti per derivare le equazioni di trasporto delle quantità medie, note come equazioni di Navier-Stokes mediate secondo Reynolds (RANS).
Molti flussi, come ad esempio nei processi di combustione, sono caratterizzati da forti variazioni di densità.
Per tali flussi, l’approccio classico utilizzato per descrivere il flusso turbolento con medie temporali deve essere modificato, per tener conto dell’effetto della densità non costante. La media di Favre decompone la variabile Φ in una componente fluttuante Φ ′′ ed una componente media Φ pesate secondo la densità, come:
( ) ( )
( )
ρ ρ ρ ρ Φ ≡ Φ ≡ 〉 Φ 〈∫
∫
T T dt t dt t t Φ ′′ + 〉 Φ 〈 ≡ ΦQuesto tipo di media viene utilizzata nell’analisi di flussi reagenti, come nei processi di combustione, i quali sono caratterizzati da forti variazioni di densità.
Dall’equazione (2.6) moltiplicando per la densità e mediando si ha:
(
〈Φ〉+Φ ′′)
= 〈Φ〉+ Φ ′′= 〈Φ〉+ Φ ′′≡
Φ ρ ρ ρ ρ ρ
ρ
Dalla definizione (2.7) si ottiene: 0
= Φ ′′ ρ
Adesso è possibile applicare la relazione (2.7) alle equazioni di conservazione (1.1)-(2.4) e mediando nel tempo si ottiene:
(2.7)
(2.6)
(2.8)
• Equazione di conservazione della massa totale: 0 = ∂ 〉 〈 ∂ + ∂ ∂ i i x u t ρ ρ
• Equazione di conservazione della massa delle singole specie chimiche:
k i k i i i k i i k k w x J x u Y x u Y t Y & + ∂ ∂ − ∂ 〉′ ′ 〉〈 ′′ 〈 ∂ − = ∂ 〉 〉〈 〈 ∂ + ∂ 〉 〈 ∂ρ ρ ρ C N k =1,2,...,
• Equazione di conservazione della quantità di moto:
j i ij j i j i i i j j g x x p x u u x u u t u ρ τ ρ ρ ρ + ∂ ∂ + ∂ ∂ − ∂ 〉 ′′ ′′ 〈 ∂ − = ∂ 〉 〉〈 〈 ∂ + ∂ 〉 〈 ∂ 3 , 2 , 1 = j
• Equazione di conservazione dell’entalpia specifica
rad i j ij i k i i i i i Q x u Dt p D x J x u h x u h t h + & ∂ ∂ + + ∂ ∂ − ∂ 〉′ ′ ′′ 〈 ∂ − = ∂ 〉 〉〈 〈 ∂ + ∂ 〉 〈 ∂ρ ρ ρ τ
Le equazioni (2.10)-(2.13) prendono il nome di equazioni di Navier-Stokes mediate secondo Favre (FANS).
Nel presente lavoro di tesi si utilizzano le equazioni mediate secondo Favre (FANS) in quanto più adatte alla trattazione di flussi reagenti turbolenti.
Tali equazioni sono risolvibili nelle variabili medie di Favre eccetto che per i termini:
• 〈ui′′u′′j〉 denominati Stress di Reynolds
• I flussi turbolenti di calore 〈h′′ui′〉′, di materia 〈Yk′′〉〈ui′〉′
• I flussi molecolari di materia Jk e di calore q
• La velocità di reazione delle specie chimiche w&k • Il flusso di calore radiante Q&rad
Questi termini rappresentano delle nuove incognite per il sistema di equazioni che per essere risolto necessita dunque di ulteriori espressioni dette appunto equazioni di chiusura.
(2.10)
(2.11)
(2.12)
Per quanto riguarda i termini del calore radiante Q&rad e della velocità di reazione delle specie chimiche w&k , sono valutabili rispettivamente attraverso modelli di radiazione (Modest, 2003) e modelli di combustione (Poinsot e Veynante, 2001).
Per elevati numeri di Reynolds i termini per il flusso di materia Jk e per quello di calore
q sono trascurabili rispetto a quelli di trasporto turbolento.
I flussi turbolenti di materia 〈Yk′′〉〈u′i〉′ e di calore 〈h′′u′i〉′ possono essere modellati utilizzando l’ipotesi del trasporto del gradiente9:
i k kt t i ku Sc Yx Y ∂ 〉 ∂〈 − = 〉′ ′ ′′ 〈 µ ρ i t t i xh u h ∂ 〉 ∂〈 − = 〉′ ′ ′′ 〈 Pr µ ρ
dove µt è la viscosità turbolenta, valutata attraverso il modello di turbolenza, mentre Sckt
e Pr rappresentano rispettivamente il numero di Schmidt per la specie k ed il numero di t Prandtl turbolento.
Il termine 〈ui′′u′′j〉 (Stress di Reynolds) può essere espresso utilizzando modelli di turbolenza.
2.2.2 Modelli di turbolenza
Le equazioni di conservazione mediate contengono come già detto alcuni termini aggiuntivi da modellare opportunamente per rendere determinato il problema.
I modelli di turbolenza, che permettono di esprimere il tensore degli sforzi di Reynolds in funzione delle variabili mediate nel tempo, si dividono in due classi principali:
- modelli di diffusione per gradiente (Eddy viscosity models); - modelli diretti.
Per una trattazione più dettagliata di tali modelli si rimanda ad altro (Pope, 2001).
9 Vedi lavoro di Tesi Parente 2003-2004
(2.15) (2.14)
Qualche cenno sarà dato sul modello k-ε che appartiene ai modelli di diffusione per
gradiente ed è stato utilizzato nel presente lavoro di tesi.
2.2.2.1 Modello k-ε e sue varianti
I modelli di diffusione per gradiente si basano sull’approssimazione di Boussinesq (1977), secondo la quale, gli stress di Reynolds sono espressi in funzione del gradiente di velocità media del fluido attraverso la relazione:
ij i j j i t j i k x U x U u u µ ρ δ ρ 3 2 − ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ ∂ ∂ + ∂ ∂ = − dove: -
∑
= = 3 1 ' ' 2 1 i j iu uk è l’energia cinetica turbolenta
- µt è il coefficiente di viscosità turbolenta
- ⎟ρk ⎠ ⎞ ⎜ ⎝ ⎛ 3 2
è introdotto per recuperare il valore esatto della traccia del tensore degli sforzi.
Introducendo l’approssimazione nelle equazioni RANS, le ipotesi del trasporto del gradiente e di Boussinesq pongono sempre un problema di chiusura delle equazioni. E’ richiesta infatti la determinazione della viscosità turbolenta che non dipende solo dal tipo di fluido, ma anche dal campo di moto: µt determina infatti l’entità degli stress di Reynolds e quindi le caratteristiche della turbolenza.
Uno dei modelli più diffusi per la chiusura del problema è il “modello k-ε”, sviluppato da Launder (1972), che comporta due equazioni aggiuntive per la determinazione della viscosità turbolenta valutata tramite la seguente relazione:
ε ρ µt = Cµ k2
(2.16)
L’energia turbolenta k e la sua dissipazione ε , sono ottenute mediante la risoluzione delle equazioni di trasporto.
L’equazione di trasporto per l’energia cinetica turbolenta k è la stessa dei modelli ad una equazione: ε − + ∂ ∂ − = ∂ ∂ + ∂ ∂ k j i j P x T x kU t k ' dove ij i i j j iu u u p u s u T ' ' ' 1 ' ' 2 ' 2 1 ' ρ µ ρ − + =
Per la dissipazione dell’energia turbolenta ε , si ha invece la seguente equazione differenziale: k C P k C x x x U t i k t i i i 2 2 1 ε ρ ε ε σ µ ε ε ε ε ε − + ⎥ ⎦ ⎤ ⎢ ⎣ ⎡ ∂ ∂ ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ ∂ ∂ = ∂ ∂ + ∂ ∂
Il modello necessita quindi di cinque costanti delle quali si riportano di seguito i valori standard: 09 . 0 = µ C , σk =1, 3σε =1. , 44Cε1 =1. , 92Cε2 =1. .
Il modello k-ε, è spesso utilizzato nell’analisi numerica di processi di combustione,
nonostante presenti alcune limitazioni:
- le equazioni sono ricavate nell’ipotesi di elevati numeri di Reynolds, e non può essere impiegato per flussi con forte vorticità o anisotropia della turbolenza;
- il trattamento del flusso alla parete è realizzato a mezzo di espressioni algebriche; - il modello deve essere modificato in caso di fluidi comprimibili;
- è un modello che tende a sovrastimare la dispersione di getti circolari (Morse, 1972; Launder et al., 1972; Pope, 1978).
Per l’ultimo problema riscontrato, in letteratura, sono proposte diverse correzioni da apportare al modello, che spesso si riducono ad agire sulla costante C . ε1
(2.18)
(2.19)
Tra le diverse varianti del modello k-ε classico si distingue, per la sua robusta base teorica,
il cosiddetto modello “RNG10 k-ε”, che trova i fondamenti nella complessa teoria dei gruppi di normalizzazione (Yakhot e Orszag, 1986) e si riduce a esprimere la costante C ε1
diversamente. 3 0 0 , 1 , 1 1 1 βη η η η ε ε + ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ − − = RNG RNG C C con µ ε η = k Pk dove 0 , 1 RNG
Cε è assunto pari al valore della costante C del modello standard. ε1
I valori delle altre costanti sono i seguenti: 015 . 0 − = β , 4η0 ≈4. , 0845Cµ,RNG =0. , 72σk,RNG =0. , 72 . 0 ,RNG = ε σ , 68Cε2,RNG =1. .
2.2.3 Modelli di combustione
Problema chiave nella modellazione dei flussi reagenti è il termine che compare nell’equazione di conservazione della massa delle singole specie chimiche, la velocità di reazione delle specie chimiche w& . In generale, le reazioni chimiche sono descritte in k
termini di M reazioni elementari che comprendono N componenti: C
k Nc k kj k Nc k kjR
∑
R∑
= = ⇔ 1 '' 1 ' ν ν j =1,2,...,Mdove νkj, è il coefficiente stechiometrico del componente R , nella reazione elementare j-k
esima, definito come: ' '' kj kj kj ν ν ν = −
Per ogni componente che partecipa alla reazione, il termine di sorgente presente nell’equazione di conservazione delle specie chimiche può essere valutato come:
10 Re-Normalization Group (Gruppo di rinormalizzazione)
(2.21)
(2.22)
(
)
j M j kj kj k k W Q w =∑
− ⋅ =1 ' '' ν ν &dove W è il peso molecolare del componente k-esimo e k Q il grado di avanzamento della j
reazione j esprimibile come:
'' ' 1 1 kj kj Nc k k k rj Nc k k k fj j W Y k W Y k Q ν ν ρ ρ
∏
∏
= = ⎟⎟⎠ ⎞ ⎜⎜ ⎝ ⎛ − ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ =I termini k e fj k , rappresentano rispettivamente la costante cinetica diretta e inversa della rj
reazione j , mentre
(
ρY /k Wk)
è la concentrazione molare della specie k. Le costanti cinetiche sono generalmente espresse utilizzando la relazione di Arrhenius e la costante di equilibrio k : eq ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ − = RT Ea j fj fj j e T A K β eq fj rj k k k =dove A rappresenta il fattore pre-esponenziale, fj βj l’esponente della temperatura e Ea j
l’energia di attivazione.
Dalle espressioni riportate per il calcolo della velocità di reazione, si deduce che il termine
k
w& è fortemente non lineare e non può essere semplicemente espresso in funzione delle frazioni massiche medie Yk , della densità media ρ e della temperatura media T . I modelli di combustione sono utilizzati proprio per esprimere w&k nello studio di fiamme premiscelate e diffusive. Si faccia riferimento a Poinsot e Veynante (2001) o Peters (2000). Concettualmente, il grado di avanzamento di una reazione dipende dall’efficienza di miscelamento dei reagenti e dalla cinetica di reazione vera e propria.
L’importanza relativa dei due fenomeni, è valutabile tramite il numero di Damkhöler:
turb chem Da τ τ = (2.24) (2.25) (2.26) (2.28) (2.27)
dove τturb e τchem sono rispettivamente i tempi del miscelamento turbolento e della cinetica chimica. Fornisce una misura di quanto è importante l’interazione tra chimica e turbolenza: - numeri di Damkhöler elevati
(
Da>>1)
corrispondono a reazioni chimiche molto veloci rispetto agli altri processi;- numeri di Damkhöler piccoli
(
Da<<1)
portano a considerare una velocità di reazione globale controllata dalla chimica delle reazioni di ossidazione, mentre i reagenti sono ben miscelati per effetto del moto turbolento.Tra i modelli più utilizzati per la valutazione di w&k vi sono:
- Modello Eddy Break-up (EBU), per lo studio delle fiamme premiscelata - Modello Eddy Dissipation (EDM), applicato allo studio delle fiamme non
premiscelate
- Modello Finite Rate Chemistry (FR)
- Modello combinato Eddy Dissipation/Finite Rate Chemistry
In questa Tesi di Laurea sono stati utilizzati i modelli EDM e FR che verranno descritti di seguito.
2.2.3.1 Modello Eddy Dissipation (EDM)
Magnussen e Hjertanger (1976) hanno sviluppato il modello (Eddy Dissipation), che è un estensione del modello Eddy Break-up applicato alle fiamme non premiscelate.
Nelle fiamme non premiscelate, la turbolenza provoca un lento mescolamento/convezione dei reagenti freddi con i prodotti caldi all’interno della reazione dove la combustione avviene rapidamente. In questi casi risulta controllante per il sistema, il grado di mescolamento (lento) rispetto alla velocità di reazione (veloce), e le velocità cinetiche di reazione spesso sconosciute possono essere trascurate.
Il modello in questione, assume che la velocità di reazione può essere direttamente collegata al tempo richiesto per il mescolamento dei reagenti a livello molecolare, tempo dominato dalle proprietà dei vortici.
Secondo questo schema, il grado di avanzamento medio della reazione elementare j-esima è valutato tramite la frazione molare media dei reagenti o dei prodotti:
[ ]
[ ]
⎟ ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎜ ⎝ ⎛ =∑
∑
P k kj P k P k kj R k MIX j W W R B R k A Q min min ' , '' ν ν εcon A e B costanti del modello. Il grado di avanzamento Q , è pertanto limitato dalla j
specie chimica presente in difetto all’interno del sistema.
L’EDM si applica per flussi turbolenti, quando la velocità di reazione chimica è veloce rispetto ai processi di trasporto nel flusso.
Non c’è però controllo da parte della cinetica dei processi di reazione, quindi ignizione e processi dove la cinetica chimica può limitare la velocità di reazione sono predetti difficilmente.
2.2.3.2 Modello Finite Rate Chemistry (FR)
Il modello Finite Rate considera come parametro controllante la cinetica ( Da<1).
Quindi definendo Rk il grado di avanzamento della reazione, si ottiene:
[ ]
[ ]
⎟⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ − =∏
∏
= = '' 1 ' 1 ,... , ,... , k C k C N r B A I k r N B A I k k F I B I Rdove
[ ]
I è la concentrazione molare del componente I, Fk e Bk sono rispettivamente le costanti di velocità diretta e inversa, r rappresenta l’ordine di reazione del componente I nella reazione elementare k.Per le reazioni elementari, l’ordine di reazione è uguale al coefficiente stechiometrico, mentre nel caso di reazioni globali può essere diverso.
La relazione per le costanti di velocità diretta e inversa assume una dipendenza dalla temperatura secondo l’equazione di Arrhenius:
⎟ ⎠ ⎞ ⎜ ⎝ ⎛− = RT E T A F k k k k exp β ⎟ ⎠ ⎞ ⎜ ⎝ ⎛− = RT E T A B k k k k exp β (2.29) (2.30) (2.31) (2.32)
dove:
k
A è il fattore pre-esponenziale
k
β è l’esponente della temperatura (adimensionale)
k
E è l’energia di attivazione
T è la temperatura assoluta
k
R può essere anche specificata direttamente senza l’uso di relazioni.
Il modello Finite Rate è applicato correttamente in situazioni dove la chimica è il parametro limitante, ossia lenta rispetto al miscelamento.
Questo modello può essere usato sia per flussi laminari che per flussi turbolenti.
2.2.4 Modelli di radiazione
Il termine che compare nell’equazione di conservazione dell’entalpia specifica Q&rad , rappresenta il flusso di calore radiante, che può essere assorbito ed emesso da una fiamma. Risulta particolarmente importante nella simulazione numerica della combustione turbolenta, dato che la radiazione costituisce il meccanismo di scambio termico dominante nelle applicazioni di combustione a causa delle elevate temperature in gioco.
In teoria, Q&rad potrebbe essere calcolato dalla conoscenza della distribuzione di temperatura nel sistema in esame. Ma dato che la temperatura costituisce un’incognita del problema, e viene fornita come risultato delle simulazioni numeriche, il calcolo dello scambio termico radiativo deve risultare accoppiato alla risoluzione dell’equazione di bilancio energetico.
L’equazione di trasporto dell’energia termica radiante (Radiative Transfer Equation - RTE) può essere espressa come:
( ) ( )
i i i s b I I s s s d I K ds dI Ω Φ + − =∫
ˆ ˆ,ˆ 4 4π λ λ λ λ λ λ λ λ π σ β dove: - λ è la lunghezza d’onda; (2.33)- Kλ è un coefficiente di assorbimento del mezzo;
- Ibλ è l’intensità della radiazione emessa dal corpo nero;
- βλ è il coefficiente di estinzione
(
βλ =Kλ +σsλ)
;- Iλ è l’intensità della radiazione emessa in corrispondenza della lunghezza d’onda λ ;
- σsλ è il coefficiente di scattering;
- Φ indica la probabilità che la radiazione sia riflessa dalla direzione λ sˆi a sˆ;
- sˆ è il vettore direzione unitario; - Ω è l’angolo solido11
L’equazione
(
2.24)
è un’equazione integro-differenziale del primo ordine, funzione delle coordinate spaziali, della direzione e della lunghezza d’onda. La sua risoluzione analitica è pertanto complessa, risolvibile solo in casi molto semplici. In generale, si ricorre quindi a modelli e semplificazioni che permettono di approssimare la dipendenza direzionale e spettrale della RTE:- Modello delle armoniche sferiche
- Modello DTRM (Disrete Transfer Radiation Model) - Modello DO (Discrete Ordinates)
- Modello a zone - Modello Monte Carlo
Per una trattazione più dettagliata di tali modelli si rimanda ad altro (Modest, 2003).
Qualche cenno sarà dato sul modello DTRM che è stato utilizzato nel presente lavoro di tesi.
2.2.4.1 Modello DTRM
Il modello DTRM (Discrete Transfer Radiation Model), o modello SN, è basato sulla dipendenza angolare dell’intensità della radiazione emessa.
11 L’angolo solido con cui una superficie dA
j è vista da certo punto P è definita come la proiezione della
superficie su un piano normale al vettore direzione, divisa per la distanza tra il punto P ed il piano elevata al quadrato. Se la superficie dAj è proiettata su una superficie di raggio unitario, allora l’angolo solido Ω, è dato
Questo approccio, a differenza del modello delle armoniche sferiche, discretizza l’intero angolo solido Ω , utilizzando un numero finito di direzioni, a ciascuna delle quali è associato un fattore peso. Gli integrali sull’angolo solido, per il calcolo del flusso di calore radiante e delle sorgenti di radiazione, sono valutati tramite opportune formule di quadratura. Il numero di direzioni utilizzate fornisce l’ordine e il nome relativo al modello. Si hanno ad esempio, approssimazioni S2 o S4 (quelle di ordine pari sono generalmente usate per disporre di direzioni e pesi simmetrici, invarianti rispetto a rotazioni di 90°). La tecnica, sviluppata da Shah (1979), si basa proprio sulla discretizzazione dell’equazione di trasferimento lungo dei raggi. Il percorso lungo un raggio è suddiviso in modo tale che all’interno degli elementi il campo di radiazione sia ragionevolmente omogeneo, per l’accuratezza del risultato.
Per tale modello, l’equazione della variazione dell’intensità radiante dI lungo il raggio per un tratto ds, è la seguente: π σT4 a aI ds dI + = dove:
- a è il coefficiente assorbimento gas; - I indica l’intensità della radiazione; - T è la temperatura locale del gas;
- σ rappresenta la costante di Stefan-Boltzmann
(
5.62×10−8W/m2K4)
. In questo modo, l’indice di rifrazione è considerato unitario.Il modello impiegato integra l’equazione
(
2.24)
lungo una serie di raggi. Se il coefficiente di assorbimento a è costante lungo il raggio, il risultato dell’integrale sarà come segue:( )
s T(
e as)
I e as I = 4 1− − + 0 −π σ
dove I0 è l’intensità di radiazione all’inizio del tratto ds, determinata con opportune condizioni al contorno. La sorgente di energia dovuta alla radiazione è calcolata poi, sommando la variazione di intensità lungo i tratti di ciascun raggio.
Il costo computazionale inizia ad essere elevato quando sono molti i volumi attraversati da raggi. Tale modello, è in grado di fornire un’approssimazione sufficientemente accurata (2.34)
della RTE, nel caso di ordini N elevati
(
N >8)
. In presenza di sorgenti radianti localizzate, il metodo può risentire di errori significativi dovuti alla discretizzazione angolare e spaziale.2.2.5 Modelli spettrali
L’equazione di trasporto dell’energia radiante evidenzia che l’intensità della radiazione Iλ
varia nello spettro delle lunghezze d’onda.
La valutazione della dipendenza spettrale di Iλ costituisce uno dei problemi più complessi nella risoluzione della RTE e richiede pertanto il ricorso ad un modello spettrale.
2.2.5.1 Modello Gray
Il modello Gray, considera le proprietà radiative costanti in tutto lo spettro delle lunghezze d’onda ed elimina pertanto la dipendenza dell’intensità di radiazione dalla lunghezza d’onda. Nel caso di combustione, ci saranno errori nel calcolo del flusso termico radiativo, in quanto certi gas assorbono in determinate regioni dello spettro.
2.2.5.2 Modello WSGG
Il modello Weighted Sum of Gray Gases (WSGG) assume che le proprietà radiative di un gas non grigio siano ottenibili come somma pesata dei contributi di un certo numero di gas grigi, che hanno proprietà radiative costanti.
I coefficienti di assorbimento ed i fattori peso sono correlati in letteratura per una certa varietà di gas (Modest, 2003).