5 Reazione'di'CassarHHeck'
Il! crossDcoupling! di! alogenuri! arilici! ed! alchini! terminali! è! un! utile! strumento! per! la! sintesi!di!acetileni!alchilDaril!e!diarilDsostituiti.!Gli!alchini!funzionalizzati!sono!importanti! building! blocks! per! la! sintesi! di! molecole! biologicamente! attive! e! composti! naturali! isolati!da!piante,!organismi!marini,!etc.!121,122,123!
Il! metodo! più! pratico! e! dal! più! ampio! ambito! di! impiego! per! la! formazione! di! legami! C(sp2)–C(sp)!è!oggi!rappresentato!dalla!reazione!di!Sonogashira,!che!prevede!l’impiego!
quale!sistema!catalitico!di!palladio!e!di!sali!di!rame!(Schema!5D1).!
!
Schema 5-1 Reazione di Sonogashira
Il!protocollo!originale!prevedeva!l’uso!di!un!catalizzatore!omogeneo!come![Pd(PPh3)4]!o!
[PdCl2(PPh3)2],! ioduro! di! rame(I),! una! base! azotata! (trietilammina,! dietilammina,!
diisopropilammina)! in! un! solvente! organico! come! benzene,! toluene,! THF,! DMF! o! diossano.! Data! l’importanza! della! reazione,! risulta! facile! capire! come! la! ricerca! abbia! spinto! verso! la! semplificazione! delle! condizioni! impiegate! cercando! al! contempo! di! eliminare! o! ridurre! la! formazione! di! coprodotti! non! desiderati.! In! particolare,! nel! tentativo! di! sopprimere! la! formazione! di! prodotti! di! omocoupling! dell’alchino! causati! dalla!presenza!dei!sali!di!rame!e!da!una!non!perfetta!deossigenazione!della!miscela!di! reazione,!sono!state!sviluppate!procedure!alternative!che!prevedono!la!sola!catalisi!del! palladio.!124!
Questa!reazione!è!comunemente!chiamata!“copperDfree”!Sonogashira,!anche!se!in!questo! caso!sarebbe!più!opportuno!chiamarla!reazione!di!CassarDHeck!perché!sono!stai!questi! due! studiosi! a! pubblicare! per! primi! questo! protocollo." 125,126! Il! termine! “reazione! di!
Sonogashira”! tuttavia,! è! oggi! usato! per! indicare! reazioni! di! coupling! di! alogenuri! con! atomi! di! carbonio! ibridati! sp2! o! sp3! ed! alchini! terminali,! indipendentemente! dalla!
presenza!di!sali!di!rame.!
+ R2-X cat. [Pd
0L n]
cat. CuX, base R1 = alchil, aril, vinil
X = Br, Cl, I, OTf R2 = aril, benzil, vinil
H
La!ricerca!industriale!è!attualmente!focalizzata!sulla!versione!senza!rame,!che!permette! l’impiego! di! basi! inorganiche! e! solventi! benigni! per! l’ambiente! come! acqua! e! alcoli,! e! consente! un! coupling! efficiente! anche! in! ambienti! di! reazione! non! rigorosamente! deareati.!
A! differenza! di! molti! altri! coupling! CDC! catalizzati! da! palladio,! uno! dei! due! reagenti,! l’alchino!terminale,!non!ha!bisogno!di!essere!attivato!con!un!alogenuro!o!un!metallo.!La! reazione! è! favorita! quando! l’alogenuro! è! attivato,! ovvero! è! elettronDpovero.! I! bromuri! disattivati! reagiscono! con! difficoltà,! mentre! i! cloruri,! meno! costosi,! non! reagiscono! a! meno!di!non!essere!fortemente!attivati.!La!reazione!si!completa!di!solito!entro!le!otto! ore!e!spesso!nell’arco!di!trenta!minuti.!I!carichi!di!palladio!possono!variare!largamente;! generalmente!vengono!impiegati!rapporti!da!0.5!a!5%!di!metallo!in!moli.!Al!meglio!delle! nostre! conoscenze! sono! ancora! in! corso! studi! volti! a! determinare! il! meccanismo! di! reazione!in!caso!di!catalizzatori!eterogenei!in!assenza!di!alogenuri!di!rame.!
!
I! casi! di! impiego! di! catalizzatori! eterogenei! di! palladio,! in! particolare! palladio! su! carbone,! riportati! in! letteratura! non! sono! elevati,! nonostante! l’importanza! della! reazione,!ma!sono!comunque!importanti!in!ottica!industriale!in!quanto!le!reazioni!sono! svolte!senza!sali!di!rame!e!senza!leganti!e!spesso!in!solventi!acquosi.!
Köhler! e! collaboratori! riportano! l’uso! di! Pd/C! in! una! reazione! di! coupling! tra! iodobenzene! e! fenilacetilene! senza! aggiunta! di! CuI! o! PPh3! lavorando! insolventi! polari!
aprotici!come!DMA,!NMP,!piperidina!o!pirrolidina!(! ! Schema! 5D2).! 127! Le! rese!
da! loro! ottenute! risultano! discrete,! ottenendo! conversioni! fino! al! 70%! in! mezz’ora! lavorando!con!un!carico!catalitico!basso,!pari!a!0.125!mol!%.!L’aggiunta!di!sali!di!rame! non! solo! non! migliorava! la! reattività! o! la! selettività,! ma! anzi,! oltre! una! certa! concentrazione,!dava!un!peggioramento!delle!stesse.!
!
!
Schema 5-2 Coupling catalizzato da Pd/C tra iodobenzene e fenilacetilene
Molto! più! interessante! dal! punto! di! vista! industriale! è! il! lavoro! svolto! da! Sajiki! e! collaboratori,!i!quali!hanno!messo!a!punto!una!procedura!che!non!richiede!leganti,!sali!di! rame! e! ammine.! 128! In! queste! condizioni,! che! prevedeno! l’impiego! di! una! soluzione!
+ Pd/C, base
solvente, 100°C I
acquosa!di!isoDpropanolo!(1:1)!come!solvente!e!fosfato!di!sodio!come!base!(Schema!5D3),! sono! stati! fatti! reagire! una! vasta! gamma! di! ioduri! aromatici! con! alchini! alifatici! ed! aromatici,!usando!come!catalizzatore!Pd/C!commercialmente!disponibile.!!
!
!
Schema 5-3 Coupling in assenza di ammine e rame tra ioduri arilici e alchini terminali catalizzato da Pd/C
Gli! alogenuri! con! gruppi! elettronDattrattori! (NO2,! Ac)! hanno! dato! rese! pressoché!
quantitative,!mentre!negli!altri!casi!hanno!ottenuto!rese!più!basse;!anche!impiegando!i! substrati!più!attivi,!non!sono!riusciti!a!riciclare!il!catalizzatore!più!di!una!volta.!
In! letteratura! esiste! un! numero! limitato! di! applicazioni! di! catalizzatori! magnetici! a! reazioni! di! crossDcoupling! con! alchini.! Wang! riporta! l’impiego! del! catalizzatore! sopra! descritto! (pag.! 60)! con! vari! reagenti! attivati! e! disattivati,! ottenendo! rese! maggiori! del! 70%!in!sei!ore,!lavorando!in!DMF!a!100°C!ed!impiegando!carbonato!di!potassio!come! base."118!I!carichi!di!palladio!applicati!sono!bassi!(1%!mol)!e!riescono!nel!riciclo!almeno!
otto!volte!senza!perdite!significative!di!attività.!
Jin! riporta! l’applicazione! di! sistemi! nanostrutturati! composti! da! un! core! magnetico,! costituito!da!magnetite!commerciale,!ricoperto!di!silice!attraverso!un!processo!solDgel,!a! cui! è! stato! legato! un! complesso! di! palladio! grazie! ai! gruppi! chelanti! presenti! sulla! superficie.!129!Lo!schema!del!processo!è!riportato!in!Schema!5D4.!
!
Schema 5-4 Sintesi di complessi di palladio (b-oxoiminato)(phosphanyl) supportati su nanoparticelle di magnetite
Questo! catalizzatore! ha! dato! ottimi! risultati! impiegando! vari! cloruri! arilici,! con! rese! maggiori!del!75%!con!vari!substrati!con!tempi!di!4D8!ore,!lavorando!in!acqua!a!60°C!con! un! carico! catalitico! di! 0.5! mol%.! Il! sistema! è! stato! efficace! anche! con! alogenuri!
+ Pd/C (0.2 mol %) Na3PO4·12H2O (2 equiv) i-PrOH, H2O, 80°C R' I 37-98% R' R R R = NO2, Ac, OMe, H R' = CH2CH2OH, Ph, 2-CF3-Ph, 4-MeO-Ph
disattivati,! risultando,! a! detta! degli! autori,! il! primo! caso! di! reazione! eterogenea! con! cloruri!arilici!in!solvente!acquoso.!! ! La!magnetite!risulta!essere!un!supporto!con!caratteristiche!di!acido!di!Lewis,!e!quindi! può!prendere!parte!ad!alcune!reazioni!e!non!agire!solamente!da!supporto.!Firouzabadi!e! collaboratori!hanno!verificato!se!anche!la!magnetite!nanometrica!avesse!una!possibilità! di! impiego! in! questo! tipo! di! reazioni! ed! hanno! riportato! per! primi! una! reazione! tra! fenilacetilene! e! ioduri! o! bromuri! in! etilenglicole! a! 125°C,! impiegando! carbonato! di! potassio!come!base!ed!ottenendo!rese!maggiori!del!75%!in!tempi!compresi!tra!le!20!e!le! 72!ore.!129!Abbiamo!quindi!provveduto!ad!eseguire!delle!prove!in!bianco!per!verificare!
che,!nelle!nostre!condizioni!di!reazione,!la!magnetite!da!noi!impiegata!risultasse!inerte! (Tabella!5D1,!prova!6).!!
Per! stabilire! quali! fossero! le! condizioni! migliori! per! il! nostro! catalizzatore! abbiamo! effettuato! alcune! prove! prendendo! a! riferimento! i! catalizzatori! eterogenei! usualmente! impiegati.!
Sajiki! riporta! l’impiego! di! Pd/C! in! una! soluzione! isopropanolo/acqua! 1:1,! impiegando! fosfato! di! sodio! come! base." 128! Abbiamo! provato! a! impiegare! come! solvente! DMF,! in!
accordo!alle!condizioni!riportate!da!Wang,!ma,!date!le!rese!paragonabili!e!la!necessità!di! impiegare!tempi!più!lunghi!e!temperature!più!alte,!oltre!a!dover!impiegare!un!solvente! meno! appetibile! dal! punto! di! vista! industriale,! abbiamo! deciso! di! mantenere! le! condizioni!provate!inizialmente"130.!
La!reazione!può!essere!quindi!rappresentata!come!nello!Schema!5D5! !
!
Schema 5-5 Reazione di Cassar-Heck scelta come modello
È! riportato! in! Tabella! 5D1! lo! studio! dell’effetto! delle! condizioni! di! reazione! sulle! prestazioni!catalitiche:!
! ! ! !
Tabella 5-1 Effetto delle condizioni di reazione sulle prestazioni catalitiche
Prova" Catalizzatore" Carica"cat."[mol"%]" Resa"[%]a"
1! A! 0.4! 30! 2! B! 0.4! 23! 3! A! 1! 41! 4! A! 5! 40! 5b! A! 1! 45! 6c! Fe3O4! D! D! 7! Pd/C! 0.4! 17! 8! Pd/C! 1! 27! 9! Pd/Al2O3! 1! 11! 10! D! 1! 8! 11! E! 1! D! 12! A*! 1! 33! 13d! A! 1! 17! Prove!effettuate!con!1!mol!%!di!Pd,!catalizzatore!A,!1!mmol!di!pDiodoanisolo,!1.2!mmol!di!fenilacetilene,!2!mmol!di!K3PO4,!5!ml!di%iPrD OH/H2O!1:1,!80°C,!1!h.! a!resa!GLC! b!reazione!condotta!in!DMF,!base!K2CO3,!temperatura!100°C,!durata!6!h! c!la!quantità!di!magnetite!impiegata!è!pari!a!20!mg,!pari!alla!quantità!introdotta!aggiungendo!1!mol!%!di!catalizzatore!al!5%!di!Pd! d!filtrazione!a!caldo! *!idrogenato,!20!atm!H2,!50°C,!6!h! ! Abbiamo!svolto!alcune!prove!per!verificare!il!carico!catalitico!necessario,!impiegando!la! miscela! iDPrOH/H2O! e! lavorando! a! 80°C.! Dai! dati! riportati! in! Tabella! 5D1! è! possibile!
notare!che,!passando!da!0.4!a!1!mol!%!(prove!1,!3)!si!osservi!solo!un!piccolo!aumento!di! resa,!che!rimane!invariata!aumentando!ulteriormente!il!carico!a!5!mol!%!(prova!4).!Si!è! quindi! proceduto! applicando! un! carico! catalitico! dell’1%! in! moli,! in! quanto! è! stato! ritenuto!il!migliore!compromesso!tra!concentrazione!di!metallo!nobile!impiegato!e!resa! finale.!
!
Il!catalizzatore!è!stato!confrontato!con!Pd/C!al!5%!della!Engelhard,!Pd/Al2O3!al!5%!della!
Aldrich,!palladio!impregnato!su!magnetite!nanometrica!commerciale!della!Aldrich!(D)!e! successivamente! con! catalizzatori! bimetallici! preparati! con! differenti! metodologie! (intercalato!sigle!A,!B,!impregnato!su!magnetite!E).!
Com’è!possibile!vedere!dai!dati!ottenuti!il!catalizzatore!costituito!da!palladio!impregnato! su!carbone!risulta!essere!moderatamente!attivo!(prove!7,!8),!mentre!quando!viene!usata! allumina!come!supporto!la!reazione!procede!solo!in!maniera!limitata!(prova!9).!!
Per!quanto!riguarda!i!catalizzatori!oggetto!di!questo!lavoro!di!Tesi,!notiamo!come!quelli! ottenuti! per! impregnazione! (sigle! D! e! E)! diano! risultati! insufficienti,! con! il! palladio! su! magnetite! commerciale! a! dare! risultati! più! simili! all’allumina,! mentre! quello! su! magnetite!idrotermale!a!risultare!del!tutto!inattivo.!Il!catalizzatore!bimetallico!prodotto! per! via! idrotermale! (sigle! A! e! B)! ha! mostrato! un’attività! superiore! a! quella! dei! catalizzatori! tradizionali! commerciali,! ma! non! elevata! in! senso! assoluto! in! quanto! si! è! limitato!al!40%!di!resa!che,!pur!essendo!stata!ottenuta!con!un!substrato!disattivato,!è! comunque!un!valore!non!elevato!per!questo!genere!di!reazioni.!Notiamo!inoltre!come!il! catalizzatore!A,!caricato!al!5%!in!peso!con!palladio,!abbia!dato!risultati!migliori!del!B,! caricato! al! 10%! (prove! 1,! 2).! Questa! minore! attività! è! stata! attribuita! alla! minore! dispersione!del!palladio!in!superficie!per!il!sistema!a!più!alto!carico,!con!formazione!di! nanostrutture!metalliche!meno!attive!del!metallo!libero!sul!supporto.!
Per!quanto!riguarda!questa!reazione,!neanche!l’idrogenazione!del!catalizzatore!(prova! 12)! ha! migliorato! le! prestazioni,! lasciando! pensare! che! l’attività! del! catalizzatore! non! dipenda! dallo! stato! di! ossidazione! del! metallo! in! superficie,! ma! probabilmente! sia! più! funzione! dell’organizzazione! della! dispersione! e! dell’accessibilità! del! palladio! sul! supporto.!
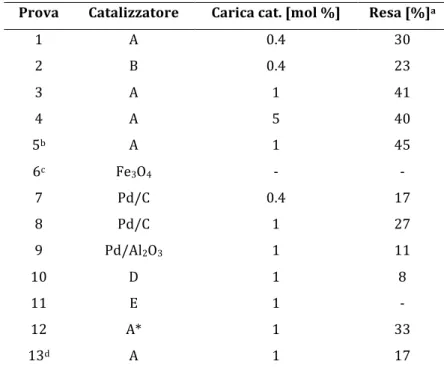
L’analisi! della! curva! cinetica! riportata! in! Figura! 3! mostra! un! andamento! simile! alla! reazione!di!Suzuki,!dando!a!pensare!che!il!periodo!d’induzione!sia,!anche!in!questo!caso,! breve!o!nullo.!Sono!però!necessari!ulteriori!studi!per!confermare!l’ipotesi!in!questo!caso! particolare.!
!
!
Figura 3 Cinetica della reazione di Cassar-Heck 0! 10! 20! 30! 40! 50! 60! 70! 80! 90! 100! 0! 10! 20! 30! 40! 50! 60! 70! Resa"[%]" Durata"[min]"
Sono! state! eseguite! alcune! prove! per! verificare! in! quale! fase! avvenga! la! reazione,! impiegando! alcune! tecniche! note! in! letteratura.!131! In! primo! luogo! abbiamo! proceduto!
ad! un! test! di! filtrazione! a! caldo:! questo! test! consiste! nel! filtrare! su! setto! poroso! la! miscela! di! reazione! lavorando! in! ambiente! inerte! e! verificare! se,! ed! in! che! modo,! prosegua!la!reazione!del!filtrato.!Seguendo!la!reazione!tramite!analisi!GLC!(prova!13)!è! stato! confermato! che! la! reazione! prosegua! allo! stesso! modo! anche! dopo! eliminazione! della!parte!eterogenea!del!catalizzatore!tramite!l’utilizzo!di!un!filtro!a!setto!poroso!e!di! un!magnete.!Questo!può!significare!che!una!piccola!parte!del!metallo!passi!in!soluzione! oppure! che! le! nanoparticelle,! in! particolare! quelle! di! dimensioni! minori,! non! possano! essere!allontanate!efficacemente!dal!mezzo!di!reazione.!!
Anche! se! l’attività! mostrata! non! era! elevata! in! senso! assoluto,! abbiamo! comunque! effettuato! prove! di! riciclo! del! catalizzatore! sperando! che! le! condizioni! più! blande! ed! i! tempi!più!brevi!rispetto!alla!reazione!di!arilazione!in!CD2!dell’imidazolo!permettessero!il! riutilizzo!oltre!che!il!recupero!del!catalizzatore.!Facendo!prove!di!assorbimento!atomico! sulle!soluzioni!di!reazione!nei!vari!ricicli,!abbiamo!osservato!che!nel!primo!stadio,!alla! fine!della!reazione!con!il!catalizzatore!fresco,!la!quantità!di!palladio!in!soluzione!sia!di!2! ppm,!valore!ridotto!alla!metà!nel!secondo!riciclo,!in!cui!si!ottiene!anche!metà!della!resa!e! ridotto!a!concentrazioni!ancora!più!modeste!alla!fine!del!secondo!riciclo,!dal!quale!non!si! ottiene!prodotto!se!non!in!tracce.!
Tabella 5-2 Prove di riciclo Cassar-Heck
Catalizzatore" Ciclo" Resaa"[%]"
A! Carica!iniziale! 34! 1°!riciclo! 18! 2°!riciclo! Tracce! Prove!effettuate!con!1!mol!%!di!Pd,!catalizzatore!A,!1!mmol!di!pDiodoanisolo,!1.2!mmol!di!fenilacetilene,!2!mmol!di!K3PO4,!5!ml!di%iPrD OH/H2O!1:1.! a!resa!GLC! !
Ci! risulta! difficile! spiegare! questo! andamento! considerato! che,! nelle! prove! di! rilascio,! solo! una! piccola! parte! del! metallo! cataliticamente! attivo! viene! persa! in! soluzione.! Riteniamo! che! sia! possibile! che! questa! perdita! di! attività! derivi! piuttosto! dalla! variazione! della! struttura! superficiale,! dato! che! abbiamo! verificato,! tramite! prova! di! filtrazione!a!caldo,!che,!durante!la!reazione,!il!palladio!viene!rilasciato!in!soluzione!dal! supporto!ed!a!fine!reazione!si!deposita!nuovamente!sul!catalizzatore.!
![Figura 3 Cinetica della reazione di Cassar-Heck 0!10!20!30!40!50!60!70!80!90!100!0!10!20!30!40!50! 60! 70!Resa"[%]"Durata"[min]"](https://thumb-eu.123doks.com/thumbv2/123dokorg/7627310.116873/6.892.167.764.800.1141/figura-cinetica-reazione-cassar-heck-resa-durata-min.webp)