3 Reazione'di'SuzukiHMiyaura'
Nel!1979!Suzuki!e!Miyaura!scoprirono!che!composti!organoboro!erano!capaci!di!reagire! con! alogenuri! organici! in! catalisi! di! palladio,! in! presenza! di! una! base! in! ambiente! acquoso.! 88,89! L’impiego! dell’acqua! come! solvente! di! reazione! per! sintesi! organiche! è!
oggetto! di! un! interesse! sempre! crescente.! L’acqua! è! a! basso! costo,! non! ha! problemi! d’infiammabilità! o! di! esplosività,! è! atossica.! Tutte! queste! caratteristiche! ne! fanno! il! solvente!“green”!per!eccellenza.!Un!ulteriore!vantaggio!è!rappresentato!dalla!possibilità! di! separare! facilmente! i! prodotti! di! reazione,! dato! che! la! maggior! parte! dei! composti! organici!non!è!solubile!in!acqua.!!
Questo!protocollo!si!è!rivelato!estremamente!efficiente,!!ed!è!stato!da!allora!applicato!ad! una! vasta! gamma! di! reazioni! di! formazione! di! legami! carbonioDcarbonio! selettive.! I! composti! organoboro! presentano! diversi! vantaggi! rispetto! ad! altri! reagenti! organometallici! quando! applicati! in! ambito! industriale.! Sono! infatti! termicamente! stabili,!rispetto!ai!reagenti!di!Grignard!ed!ai!composti!organozinco!sono!inerti!all’acqua!e! all’aria,! e! a! differenza! dei! derivati! organostagno! danno! luogo! a! coprodotti! di! reazione! non! tossici.! Possono! inoltre! essere! preparati! facilmente! anche! su! larga! scala,! e! maneggiati!senza!particolari!precauzioni.!
Più! in! dettaglio,! il! crossDcoupling! di! SuzukiDMiyaura! (Schema! 3D1)! coinvolge! un! composto! organoboro,! generalmente! un! acido! o! un! estere! boronico,! e! uno! (pseudo)alogenuro! organico,! in! presenza! di! un! catalizzatore,! usualmente! a! base! di! palladio.!!
!
Schema 3-1 Reazione di Suzuki-Miyaura
È! una! delle! reazioni! più! versatili! ed! utilizzate! per! la! formazione! selettiva! di! legami! carbonioDcarbonio,!in!particolare!per!la!formazione!di!sistemi!biarilici.!Dal!punto!di!vista!
R1-X + R2-B TM cat. R1-R2
base R1 = arile, vinile, alchile, alchenile R2 = arile, vinile
gamma! di! molecole! con! proprietà! farmaceutiche! ed! erbicide,! è! presente! in! prodotti! naturali,!polimeri!conduttori!e!cristalli!liquidi."90!
Uno! dei! punti! di! forza! di! questo! processo! è! legato! alla! facilità! con! la! quale! si! possono! preparare! un’ampia! gamma! di! reagenti! organoboro,! che! possono! anche! essere! variamente! funzionalizzati! dal! momento! che! questi! derivati! presentano! un’elevata! chemoselettività.!Questo!consente!anche!di!poter!condurre!la!reazione!di!crossDcoupling! senza!la!necessità!di!ricorrere!a!gruppi!protettivi,!aspetto!molto!importante!soprattutto! in! ambito! industriale! dal! momento! che! ogni! ulteriore! passaggio! sintetico! genera! un! aumento!dei!costi!del!processo!dovuti!sia!ai!costi!dei!materiali!sia!a!quelli!impiantistici.! La! reazione! di! SuzukiDMiyaura! può! essere! condotta! con! alogenuri! o! triflati! vinilici! ed! arilici,!ed!anche!con!alogenuri!allilici!e!benzilici.!L’ordine!di!reattività!segue!la!scala!I!>! OTf!>!Br!>>!Cl,!ma!l’uso!dei!triflati!è!modesto!a!causa!dell’elevato!costo!di!sintesi,!anche! se!rende!possibile!l’utilizzo,!quali!precursori,!di!fenoli!o!di!derivati!carbonilici.!Le!basi! più!frequentemente!impiegate!sono!sali!inorganici!come!carbonati,!fosfati!o!idrossidi!sia! in! fase! organica! che! in! fase! acquosa,! mentre! è! più! raro! l’uso! di! basi! organiche! come! alcolati,!ammine!e!carbossilati.!
Il!ciclo!catalitico!per!la!reazione!di!crossDcoupling!di!SuzukiDMiyaura!prevede!tre!stadi! chiave:! (i)! l’addizione! ossidativa! dell’alogenuro! organico! o! di! un! altro! elettrofilo! al! palladio(0),! per! dare! vita! ad! una! specie! R1–Pd(II)–X;! (ii)! la! transmetallazione! tra! il!
complesso!derivante!dall’addizione!ossidativa!R1–Pd–X!ed!il!derivato!organoboro!R2–B.!
Questo!stadio!è!quello!lento!dell’intero!ciclo!catalitico,!ed!è!necessario!l’apporto!di!una! base.!(iii)!L’eliminazione!riduttiva!di!R1–R2!per!rigenerare!palladio(0)!(Schema!3D2).!!
!
Schema 3-2 Ciclo catalitico della reazione di Suzuki-Miyaura R1-Pd(II)-R2 Pd(0) R1-Pd(II)-X R2B(OH) 2 XB(OH)2 R1-X R1-R2 + base (i) (ii) (iii)
Lo!stadio!di!transmetallazione!(iii)!è!quello!che!distingue!la!reazione!di!SuzukiDMiyaura! dagli! altri! protocolli! di! crossDcoupling! che! prevedono! l’utilizzo! di! differenti! reagenti! organometallici.! Il! ruolo! della! base! è,! infatti,! in! questo! caso! fondamentale! in! quanto! è! stato!osservato!che!la!formazione!di!un!anione!idrossiboronato!([RB(OH)3]D)!accresce!la!
nucleofilicità! del! gruppo! organico! favorendo! lo! scambio! con! [M]–X! attraverso! un! intermedio!a!quattro!centri!(Schema!3D3).!Molti!sono!gli!studi,!anche!recentissimi,!volti!a! determinare! quali! siano! realmente! le! specie! attive! nello! stadio! di! transmetallazione,! e! quindi!il!ruolo!prevalente!della!base,!ma!ancora!non!ci!sono!conclusioni!universalmente! accettate.!
!
Schema 3-3 Processo di transmetallazione
La!reazione!può!essere!condotta!impiegando!vari!catalizzatori,!basi!e!solventi,!e!la!loro! combinazione!può!modificare!significativamente!la!resa!e!la!selettività!della!reazione.! Considerando! il! ciclo! catalitico,! la! capacità! del! palladio! di! ossidarsi! e! ridursi! in! modo! rapido! e! reversibile! nel! corso! della! reazione! è! di! fondamentale! importanza! per! l’efficienza!del!processo.!! L’impiego!di!catalizzatori!supportati,!come!palladio!o!nickel!su!carbone!oppure!palladio! supportato!su!varie!argille,!ha!mostrato!che,!nonostante!il!sistema!sia!multifasico,!le!rese! ottenute,!soprattutto!quando!il!supporto!è!costituito!da!argille,!possano!essere!superiori! a!quelle!di!catalizzatori!omogenei,!in!particolar!modo!per!le!reazioni!lente!con!alogenuri! elettronDricchi.!91! Nei!decenni!passati,!l’arilazione!di!SuzukiDMiyaura!catalizzata!da!Pd/C!è!stata!applicata! largamente! nella! sintesi! di! composti! (etero)biarilici,! e! ha! trovato! impiego! anche! per! il! coupling!di!alcheni,!alchini!o!alcani.!Il!primo!esempio!di!reazione!di!Suzuki!catalizzata!da! Pd/C! è! stato! riportato! nel! 1994,! tra! bromuri! arilici! e! acidi! boronici! elettronpoveri.!92!
Utilizzando!Pd/C,!bromuri,!ioduri!o!triflati!le!rese!sono!generalmente!eccellenti!(Schema! 3D4),! mentre! i! cloruri,! che! danno! più! difficilmente! l’addizione! ossidativa! al! palladio,! risultarono!inerti!in!queste!condizioni.!!
[M]–X B(OH)[M]–R
4
-X
-[M] = Pd(II), Ni(II), Rh(I); X = alogeno B OH OH R OH B O R OH OH [M] X H
!
Schema 3-4 Coupling di Suzuki ligand-free catalizzato da Pd/C
Nel!2001!è!stata!messa!a!punto!una!procedura!efficiente!per!il!coupling!anche!di!cloruri! organici! scarsamente! attivi.! 93! Tali! condizioni! prevedono! l’uso! di! una! miscela!
DMA/acqua! 20:1! a! 80°C! con! il! 5%! mol! di! catalizzatore! (Schema! 3D5).! Tali! condizioni! sono!risultate!applicabili!a!cloruri!arilici!con!gruppi!elettronattrattori,!con!rese!dell’80D 95%.!Rese!modeste,!che!potevano!essere!incrementate!comunque!aumentando!il!carico! catalitico! fino! al! 15%! mol,! furono! invece! ottenute! con! cloruri! arilici! neutrali! o! elettronricchi.!
!
Schema 3-5 Coupling di Suzuki catalizzato da Pd/C di cloruri arilici
Data!l’importanza!industriale!del!possibile!impiego!del!Pd/C!in!assenza!di!leganti,!sono! stati! svolti! importanti! studi! sull’effetto! della! concentrazione! del! catalizzatore! e! della! variazione! delle! condizioni! di! reazione! sull’attività! catalitica,! la! resa! e! la! selettività.! Il! gruppo! di! Köhler! è! riuscito! ad! ottenere,! grazie! all’ottimizzazione! delle! condizioni! di! reazione! (Schema! 3D6),! il! coupling! di! bromoareni! ed! acido! fenilboronico! con! rese! eccellenti!in!tempi!di!reazione!brevi,!impiegando!carichi!di!palladio!estremamente!bassi! (0.005D0.01!mol!%),!raggiungendo!TON!di!20000.!94!Anche!bromoareni!disattivati!come!
il!pDbromoanisolo!sono!stati!fatti!reagire!con!rese!fino!all’83%!in!60!minuti,!senza!dare! luogo!a!dealogenazione,!una!possibile!reazione!parassita.!
!
Schema 3-6 Coupling di Suzuki catalizzato da Pd/C di bromuri arilici ed acido fenilboronico
La!scelta!della!base!è!legata!alla!natura!dell’alogenuro!organico!utilizzato.!Infatti,!se!con!i! bromuri!la!base!migliore!è!Na2CO3,!nel!caso!dei!cloruri!è!l’idrossido!di!sodio!a!garantire!i!
migliori! risultati.! È! da! notare! che! l’impiego! di! quest’ultima! base! con! i! bromuri! porta! invece!a!significativa!protodeboronazione!e!dealogenazione.! R1-X + R2-B(OH) 2 R1-R2 Pd/C (4 mol%), Na2CO3 EtOH, 80°C 80-95% 1-19 h R1 Cl B(OH)2 R2 + R1 R2 Pd/C (5 mol%), K2CO3 DMA/H2O (20:1) 80°C, 24 h R1 Br B(OH)2 R2 + Pd/C, Na2CO3 R1 R2 NMP/H2O 120°C, 1-2 h 83-100%
! Più!recentemente,!è!stato!osservato!che!aumentando!il!carico!del!catalizzatore!a!3.5!mol! %!la!reazione!può!essere!condotta!anche!a!temperatura!ambiente.!In!questo!caso,!è!stata! impiegata!una!miscela!acquaDetanolo!1:1!come!solvente,!e!come!base!ancora!carbonato! di!sodio.!Come!prevedibile!sulla!base!del!meccanismo!di!reazione,!i!bromuri!contenenti! gruppi!elettronattrattori!reagiscono!più!velocemente,!anche!se!le!rese!sono!in!generale! assai!elevate.!95! !
Schema 3-7 Coupling di Suzuki catalizzato da Pd/C di bromuri arilici ed acidi arilboronici a RT R1" R2" Durata"[h]" Resa"[%]" OMe! H! 6! 95! Ac! H! 5! 99! NO2! H! 2! >99! CHO! H! 5! >99! !
Il! Pd/C! utilizzato! può! essere! recuperato! tramite! filtrazione! e! lavaggio.! Il! riuso! è! stato! possibile!fino!a!quattro!volte!senza!significative!perdite!di!attività.!
L’impiego! di! palladio! su! carbone! non! è! limitato! alle! reazioni! condotte! con! tecniche! classiche,! tantoché! è! stato! impiegato! anche! in! procedure! che! prevedevano! il! riscaldamento! tramite! microonde! o! l’utilizzo! di! ultrasuoni! in! modo! da! ridurre,! anche! sensibilmente,!i!tempi!di!reazione."96,97!
!
La! reazione! di! SuzukiDMiyaura! è! stata! ampiamente! studiata! quale! applicazione! per! nanocatalizzatori! magnetici,! sia! con! metallo! coordinato! da! leganti,! sia! assorbito! direttamente!sulla!superficie!dell’ossido!di!ferro.!I!primi!studi!risalgono!al!2005,!anno!in! cui! il! gruppo! di! Gao! preparò! un! catalizzatore! in! cui! complessi! carbenici! del! palladio! erano! stati! fissati! all’ossido! di! ferro! tramite! un! polimero.! 98!Il! catalizzatore! si! era! dimostrato!stabile!e!altamente!attivo!per!quanto!riguarda!la!reazione!di!Suzuki,!dando! rese!maggiori!dell’80%!con!una!vasta!gamma!di!ioduri!e!bromuri!disattivati,!usando!solo! 0.015!mol!%!di!catalizzatore.! R1 Br B(OH)2 + 10% Pd/C (3.5 mol %) R1 Na2CO3, EtOH/H2O (1:1) R2 RT R 2
Yinghuai!et!al.!hanno!ricoperto!la!superficie!di!particelle!commerciali!di!ossidi!di!ferro! magnetici! ricoperti! di! amido! (con! diametro! medio! di! 100! nm)! tramite! assorbimento! dell’acetilacetonato! di! palladio! e! successiva! riduzione! con! glicole! etilenico,! ottenendo! nanoparticelle! di! palladio! del! diametro! di! circa! 1! nm.!99! Il! catalizzatore! è! stato! quindi!
disperso!in!acqua!deionizzata,!dando!luogo!alla!formazione!di!una!sospensione!nera.!!
!
Schema 3-8 Sintesi ed attività catalitica di Pd(0) disperso su magnetite ricoperta di amido modificato con POCl3
Il! catalizzatore! è! risultato! attivo! per! il! crossDcoupling! tra! bromobenzene! ed! acido! fenilboronico!in!ambiente!acquoso,!dando!una!resa!dell’83%!e!permettendo!di!effettuare! almeno!tre!ricicli!senza!perdita!di!attività!catalitica.! Nanocristalli!di!PdDFe3O4!sono!stati!sintetizzati!da!Hyeon!et!al.!attraverso!una!termolisi! oneDpot!di!una!soluzione!formata!da!acetilacetonato!di!ferro!e!di!palladio,!oleoammina! ed!acido!oleico!80.!Il!catalizzatore!ha!mostrato!nella!reazione!di!Suzuki!buona!reattività! per!quanto!riguarda!gli!ioduri,!ma!attività!peggiori!con!i!bromuri.!Il!catalizzatore!è!stato! riciclato! fino! a! dieci! volte! senza! perdita! di! attività! e! con! un! rilascio! molto! basso! al! termine!delle!reazioni.!
!
!
Schema 3-9 Crosscoupling di Suzuki tra aril ioduri/bromuri e acidi fenilboronici
Veinot! e! colleghi! hanno! mostrato! l’utilizzo! di! FexOy/Fe,! costituito! principalmente! da!
Fe3O4!e!FeOOH,!come!supporto!per!l’immobilizzazione!di!palladio!tramite!coordinazione! 2) Glicole etilenico Fe3O4 Fe3O4 1) Pd(acac)2 Fe3O4 + Br B(OH)2 nano-Pd(0) K2CO3, H2O Ar1 X + (HO) 2B Ar2 Ar1 Ar2 (1 equiv) (1.2 equiv) 70-99% Pd-Fe3O4 (1 mol%) Na2CO3, DME/H2O Riflusso, 24 h X = Br, I Ar1 = Ph, p-C
6H4Me, p-C6H4OMe, o-C6H4NO2, p-C6H4NO2, 1-naphthyl
Ar2 = Ph, p-C
di!palladio!(II)!sulla!superficie!dell’ossido!e!successiva!riduzione!in!condizioni!basiche! per! KOH! (pH! 10.5).! L’immobilizzazione! è! ottenuta! attraverso! la! coordinazione! del! palladio! sulla! superficie! dell’ossido! di! ferro! e! seguente! riduzione.! Il! catalizzatore! così! preparato! è! stato! provato! in! un! coupling! di! Suzuki! tra! aril! ioduri! e! bromuri! in! una! miscela!1:1!EtOH!e!acqua!a!temperatura!ambiente!in!presenza!di!aria.!Le!rese!sono!state! elevate!sia!con!alogenuri!con!gruppi!elettronattrattori!che!elettrondonatori.!
!
!
Schema 3-10 Attività catalitica del catalizzatore Pd@FexOy/Fe in reazioni di Suzuki
È! stato! osservato! del! rilascio! quando! il! sistema! catalitico! è! scaldato! in! presenza! di! bromobenzene;! questo! è! stato! interpretato! dagli! autori! come! un! indizio! al! fatto! che! il! supporto! agisca! da! riserva! di! palladio! e! che! la! reazione! avvenga! in! soluzione.! È! stata! studiata! la! possibilità! di! riciclo! impiegando! bromobenzene! e! acido! fenilboronico! e! il! sistema! catalitico! ha! mostrato! un’attività! costante! con! solo! una! leggera! perdita! di! attività!dopo!tre!cicli.!
Phukan!ha!sintetizzato!per!via!coDprecipitativa!un!catalizzatore!PdDCoFe3O4!aggiungendo!
direttamente!nanoparticelle!di!palladio!durante!la!sintesi!delle!nanoparticelle!di!ossido! tramite!ultrasuoni,!senza!uso!di!stabilizzanti!o!leganti.!100!Le!nanoparticelle!di!palladio!
sono! state! preparate! per! riscaldamento! di! Pd(OAc)2! in! PEG,! come! riportato! anche! da!
Wang.!101!Sono!quindi!state!aggiunte!alla!soluzione!acquosa!di!FeCl3!e!CoCl2!e!sonicate.!!
!
X + (HO)2B
(1 equiv) (1.2 equiv) 84-99%
Pd@FexOy/Fe (0,5 mol%) K2CO3, EtOH/H2O
rt, 2-4 h
X = Br, I
R1 = H, o-Me, p-OMe, p-Ac, p-NO 2 R2 = H, o-Ome, m-OMe, p-OMe
R1 R2 R1 R2 X + R B(OH)2 R' Pd-CoFe2O4 MNPs Na2CO3, EtOH riflusso, 6-12 h R R' R: H, Ph, CH3, NO2 X: I, Br
L’attività! catalitica! è! stata! esaminata! tramite! coupling! di! Suzuki! in! etanolo! con! bassi! carichi!catalitici!(1.6!mol!%).!Le!rese!ottenute!sono!state!buone!>80%!con!bromuri!ed! ioduri!sia!attivati!che!disattivati,!riuscendo!a!riciclarlo!almeno!4!volte!con!bassa!perdita! di!attività.!!
Manorama!e!colleghi!hanno!impiegato!un!ossido!misto!di!ferro!(III)!e!nichel!(NiOFe2O3)!
funzionalizzato! con! dopamina! per! il! graffaggio! di! nanoparticelle! di! palladio! (Schema! 3D12).!102!
!
Schema 3-12 Sintesi e attività catalitica di Pd@DA/NiFe2O4 nella reazioni di Suzuki
Il! catalizzatore! si! è! dimostrato! molto! attivo! per! la! formazione! di! legami! CDC! con! una! vasta! gamma! di! alogenuri! arilici,! compresi! i! cloruri.! Le! reazioni! di! Suzuki! tra! cloruri! arilici!e!acido!fenilboronico!in!presenza!di!K3PO4!e!tetrabutilammonio!bromuro!(TBAB)!
condotte! a! 110°C! in! DMF! hanno! dato! alte! rese,! ed! il! catalizzatore! è! stato! separato! magneticamente,! lavato! con! cloroformio,! asciutto! ed! impiegato! di! nuovo! per! tre! volte! dando! rese! analoghe.! Condizioni! analoghe! sono! state! impiegate! per! i! bromuri! e! gli! ioduri,!lavorando!però!con!temperature!più!basse!e!tempi!più!brevi.!!
Varma!e!colleghi!hanno!prodotto!attraverso!una!sintesi!idrotermale!svolta!in!microonde! una! struttura! dendritica! di! αDFe2O3! in! acqua! senza! agenti! riducenti! e! stabilizzanti! a!
partire!da!potassio!esacianoferrato!(II)!(K4[Fe(CN)6]).!103!104!
La! superficie! esterna! è! stata! funzionalizzata! con! dopamina! e! successivamente! si! è! condotta! l’impregnazione! di! sali! di! palladio! in! ambiente! basico.! Il! catalizzatore! ha! mostrato! eccellenti! attività! per! i! coupling! di! Suzuki! e! sono! stati! in! grado! di! riciclarlo! cinque! volte! senza! perdita! di! attività.! Il! rilascio! del! palladio! è! risultato! trascurabile! e! questo! è! stato! imputato! alla! presenza! dei! siti! amminici! sulla! superficie,! che! svolgono! azione!di!leganti.! Fe3O4 NiFe2O4 Na[PdCl4] N2H4, H2O room temp. NiFe2O4 Pd0 = NH2 HO HO Pd@DA/NiFe2O4 R X (HO)2B (1.2 equiv) 45-110°C, 24-36 h R Pd@DA/NiFe2O4 (50 mg) K3PO4 (2 equiv), TBAB, DMF (1.0 equiv) X = Cl, Br, I
R = H, Me, Ac, OMe, NO2
Laska! ha! impiegato! palladio! (0)! e! palladio! (II)! coordinato! da! leganti! su! magnetite! prodotta!attraverso!la!procedura!di!Lyon!a!partire!da!sali!ferrici!e!ferrosi!ed!i!rispettivi! precursori! catalitici! di! palladio."105,106! MNPDPd(0)! è! stato! prodotto! per! assorbimento!
dell’acido! tetracloropalladico(II)! e! riduzione! con! sodioboroidruro,! mentre! MNPD [Pd(OAc)2]! e! MNPD[Pd(TPP)2(OAc)2]! sono! stati! prodotti! per! impregnazione! delle!
rispettive!soluzioni!in!MeOH!e!sonicazione!della!miscela.! !
!
Schema 3-13 Reazione di Suzuki catalizzata da MNP impregnate con diversi precursori
I!catalizzatori!così!preparati!sono!stati!testati!in!varie!reazioni!di!coupling!CDC,!tra!cui!la! reazione!di!Suzuki,!in!cui!hanno!mostrato!alte!conversioni!dei!substrati,!in!particolare! MNPDPd(0)! e! MNPD[Pd(OAc)2].! Questi! due! catalizzatori! sono! stati! anche! riciclati! con!
successo! almeno! quattro! volte! mantenendo! l’attività! inalterata,! mentre! MNPD [Pd(TPP)2(OAc)2]!ha!avuto!un!crollo!di!attività!dal!secondo!ciclo!di!reazioni.!Gli!autori!
ritengono! che! il! rilascio! del! palladio! sia! dovuto! all’alogenuro! e! che,! nonostante! la! conversione!rimanga!alta,!la!cinetica!di!reazione!mostri!un!rallentamento!ad!ogni!riciclo.! !
I!catalizzatori!sintetizzati!de!novo!in!accordo!a!quanto!descritto!nel!Capitolo!2!(Tabella! 2D2),!sono!stati!testati!in!una!tipica!reazione!di!Suzuki!coinvolgente!acido!fenil!boronico! e!bromoanisolo.!Le!diverse!condizioni!di!reazione!adottate!sono!state!selezionate!sulla! base! dei! risultati! riportati! in! letteratura! per! il! Pd/C,! che! è! stato! da! noi! scelto! come! catalizzatore!eterogeneo!di!riferimento.!!
Inizialmente!abbiamo!utilizzato!le!condizioni!riportate!da!Zhang!illustrate!in!precedenza! (Schema! 3D7).! Abbiamo! quindi! provato! altre! condizioni,! come! ad! esempio! quelle! impiegate!da!Phan,!107!che!prevedono!l’impiego!di!dimetilformammide!come!solvente!e!
fosfato! di! potassio! come! base,! oppure! quelle! riportate! da! Ramòn,! che! vedono! l’uso! di! toluene!e!carbonato!di!sodio!a!dare!rese!del!50%!in!72!h!con!i!substrati!da!noi!impiegati.! 108! Wang! invece! riporta! rese! quantitative! ottenute! in! 1.5! h! nella! reazione! tra! acido!
B(OH)2 Br DMF, KOAc, 50°C MNP-Pd cat. (5 mol% Pd) + Catalizzatore MNP-[Pd(OAc)2] MNP-[Pd(TPP)2(OAc)2] MNP-Pd(0) MNP nuda Conversione (%) 85 45 54 0
!
!
Schema 3-14 Reazione di Suzuki tra acido fenilboronico e bromoanisolo
In!Tabella!3D1!sono!riportati!i!risultati!di!queste!prove:!
Tabella 3-1 Confronto condizioni di reazione
Prova" Solvente" Base" Temperatura"[°C]" Durata"[h]" Resaa"[%]"
1! EtOH/H2O!1:1! Na2CO3! RT! 24! Tracce!
2! EtOH/H2O!1:1! Na2CO3! 80! 24! 68! 3! EtOH/H2O!1:1! Na2CO3! 80! 1! 60! 4! DMF! K3PO4! 80! 24! 26! 5! PhMe! Na2CO3! 110! 72! 5! 6! MeOH! K3PO4! 60! 24! 14! La!reazione!è!stata!condotta!impiegando!3.5!mol!%!di!catalizzatore!A,!1!mmol!di!acido!fenilboronico,!1.2!mmol!di!pDbromoanisolo,!3! mmol!di!base,!5!ml!di!solvente.!a:!resa!GLC! !
Come! si! può! evincere! dall’esame! dei! risultati! riassunti! nella! Tabella! 3D1,! le! condizioni! che! prevedono! l’uso! di! una! miscela! 1:1! acqua! etanolo! sono! quelle! che! hanno! dato! i! risultati! migliori.! Non! è! stato! possibile! lavorare! a! temperatura! ambiente! a! causa! della! scarsa!reattività!mostrata;!tuttavia,!lavorando!a!80°C,!è!stato!possibile!accorciare!i!tempi! a! una! sola! ora,! contro! le! 24! impiegate! inizialmente.! La! presenza! dell’acqua! appare! determinante!per!una!buona!riuscita!del!coupling,!come!si!può!vedere!confrontando!le! prove!1D3!con!le!prove!4D6!della!Tabella!3D1.!
!
Schema 3-15 Reazione di Suzuki tra acido fenilboronico e bromoanisolo nelle condizioni da noi impiegate
Appurate! le! migliori! condizioni! per! il! catalizzatore! A! (intercalato,! carico! al! 5%! di! Pd),! siamo! passati! ad! effettuare! prove! di! attività! per! confrontarlo! con! catalizzatori! commerciali!e!con!catalizzatori!preparati!per!metodi!diversi!dalla!via!idrotermale.!
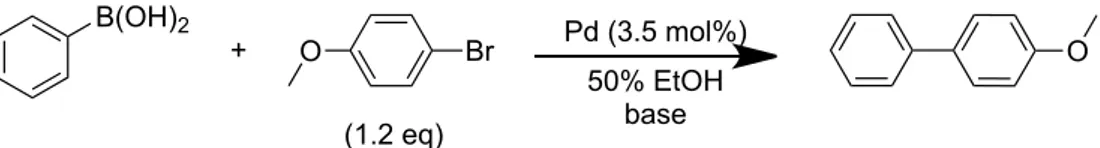
In! particolare! il! catalizzatore! è! stato! confrontato! con! Pd/C! al! 5%! della! Engelhard,! Pd/Al2O3! al! 5%! della! Aldrich,! palladio! impregnato! su! magnetite! nanometrica!
commerciale!della!Aldrich!e!con!altri!catalizzatori!bimetallici!preparati!secondo!diverse! metodologie.! Br O B(OH)2 O + Pd (3.5 mol%) 50% EtOH (1.2 eq) base
Per!semplicità!sono!riportate!in!Tabella!3D2!le!rese!dei!vari!catalizzatori:!
Tabella 3-2 Confronto tra catalizzatori commerciali e prodotti presso il nostro laboratorio
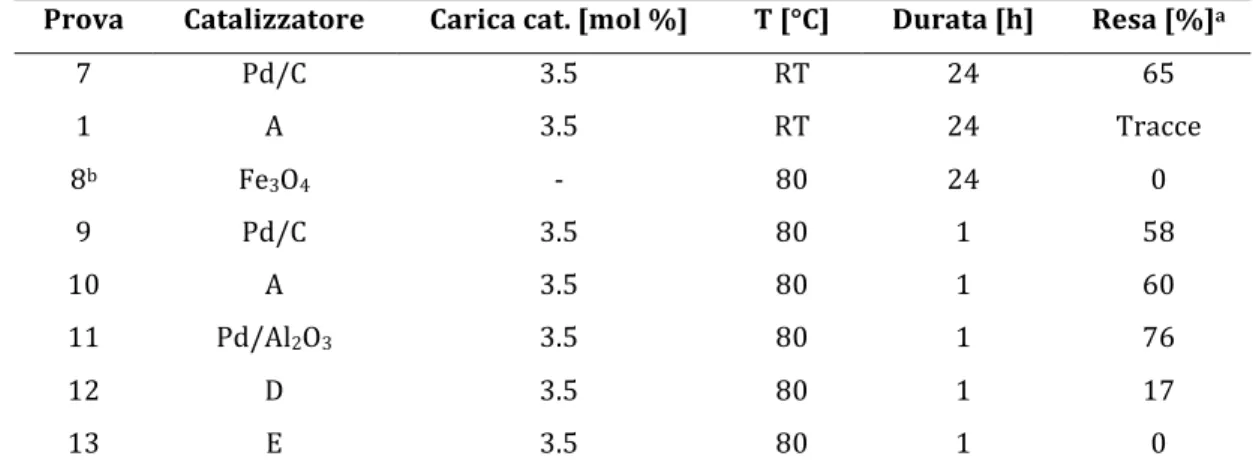
Prova" Catalizzatore" Carica"cat."[mol"%]" T"[°C]" Durata"[h]" Resa"[%]a"
7! Pd/C! 3.5! RT! 24! 65! 1! A! 3.5! RT! 24! Tracce! 8b! Fe3O4! D! 80! 24! 0! 9! Pd/C! 3.5! 80! 1! 58! 10! A! 3.5! 80! 1! 60! 11! Pd/Al2O3! 3.5! 80! 1! 76! 12! D! 3.5! 80! 1! 17! 13! E! 3.5! 80! 1! 0! La!reazione!è!stata!condotta!impiegando!3.5!mol!%!di!catalizzatore,!1!mmol!di!acido!fenilboronico,!1.2!mmol!di!pDbromoanisolo,!3! mmol!di!Na2CO3,!5!ml!di!EtOH/H2O!1:1.!!
a!resa!GLC! b!la!quantità!di!magnetite!impiegata!è!pari!a!70!mg,!pari!alla!quantità!introdotta!aggiungendo!3.5!mol!%!di!catalizzatore!al!5%!di!Pd! ! Il!Pd/C!mostra!la!sua!efficacia!nelle!condizioni!di!reazione!adottate,!risultando!superiore! al!nostro!catatalizzatore.!Infatti,!in!24!h!a!temperatra!ambiente!il!desiderato!prodotto!di! coupling!è!stato!ottenuto!con!una!resa!superiore!al!65%,!mentre!impiegando!il!nostro! catalizzatore! lo! stesso! prodotto! è! stato! rilevato! solo! in! tracce! nella! miscela! grezza! di! reazione!(Prove!7,1!in!Tabella!3D2).!La!prova!8,!effettuata!per!verificare!l’attività!della! magnetite,! ha! mostrato! l’inattività! del! supporto,! nonostante! i! tempi! di! reazione! siano! stati!più!lunghi!di!quelli!impiegati!per!il!resto!delle!prove.!
Il!catalizzatore!costituito!da!palladio!impregnato!su!carbone!risulta!essere!attivo!anche!a! temperatura!ambiente,!seppur!con!tempi!lunghi!(prova!7).!Scaldando!a!80°C!le!rese!però! non!migliorano!(prova!9),!diventano!paragonabili!a!quelle!del!catalizzatore!A!prodotto! da!noi!per!via!idrotermale!(prova!10).!!
Il! buon! risultato! ottenuto! dal! catalizzatore! A,! ci! lascia! pensare! che! con! una! sufficiente! ottimizzazione!della!reazione!si!possano!ottenere!risultati!ancora!migliori,!in!particolar! modo!abbassando!ulteriormente!i!tempi!di!reazione!ed!il!carico!catalitico.!La!reazione!è! proceduta!senza!formazione!di!sottoprodotti!di!omocoupling!o!di!dealogenazione,!dando! quindi!selettività!molto!elevate.!
Questa!reazione!è!l’unica,!tra!quelle!esaminate!nel!corso!di!questa!Tesi!di!Laurea!e!che! verranno! esposte! nei! successivi! capitoli,! nella! quale! il! palladio! su! allumina! ha! evidenziato!risultati!migliori!rispetto!al!palladio!su!carbone;!probabilmente!l’acidità!del!
troppo! acido! l’adsorbimento! dei! reagenti! sarebbe! irreversibile,! se! fosse! troppo! poco! acido!costituirebbe!lo!stadio!limitante!della!reazione.!!
I! catalizzatori! prodotti! per! impregnazione! sul! supporto! magnetico,! sia! quello! commerciale! che! quello! prodotto! per! via! idrotermale! (sigle! D! ed! E! rispettivamente),! hanno!dimostrato!di!essere!poco!o!per!niente!attivi.!
Per! quanto! riguarda! i! catalizzatori! nanostrutturati! bimetallici! (sigle! A,! B! e! C),! si! è! osservato! un! andamento! non! riproducibile! a! causa! delle! prestazioni! dello! strumento;! come!già!affermato!nel!capitolo!di!sintesi!dei!catalizzatori!(Paragrafo!2.5),!un!problema! al! controllo! di! temperatura! ha! causato! una! variazione! delle! caratteristiche! del! catalizzatore!tale!da!modificarne!la!reattività.!Questo!problema!si!presenterà!anche!nelle! altre!reazioni!discusse!in!seguito.!
Sono! infine! state! effettuate! prove! di! cinetica! con! il! catalizzatore! di! tipo! A,! lavorando! nelle! condizioni! riportate! nello! Schema! 3D15.! Queste! prove! hanno! dato! luogo! all’andamento!riportato!in!Figura!3D1.!Dai!dati!ottenuti!risulta!che!il!tempo!di!induzione! sia!molto!ridotto!oppure!assente,!in!accordo!con!quanto!riportato!in!letteratura.!110!La!
reazione!parte!velocemente,!ma!raggiunge!un!plateau!a!circa!il!60%!della!conversione! pur!in!presenza!di!quantità!residue!di!bromuro!e!di!acido!fenilboronico.!Si!rimanda!alla! necessità! di! ulteriori! studi! per! stabilire! il! perché! di! questo! limite! e! alla! ricerca! di! possibili!soluzioni.!
!
Figura 3-1 Andamento cinetico della reazione di Suzuki
! 0! 10! 20! 30! 40! 50! 60! 70! 80! 90! 100! 0! 10! 20! 30! 40! 50! 60! 70! Resa"[%]" Tempo"[min]"