Introduzione
I. IL NEONATO PICCOLO PER ETA’ GESTAZIONALE (SGA)
1. DEFINIZIONE
1.1. Definizione di SGA
Si definisce piccolo per età gestazionale o SGA ( “Small for Gestational Age”) il neonato che presenti delle variabili antropometriche inferiori a un determinato valore soglia, calcolato sulla base di curve di riferimento specifiche per la popolazione cui appartiene.
In particolare, per definire un neonato SGA sono necessari i seguenti presupposti: 1. la conoscenza dell’età gestazionale;
2. la misurazione di peso, lunghezza e circonferenza cranica;
3. un cut-off di riferimento con i dati della popolazione considerata. 1
Questo cutoff è stato fissato da alcuni autori al 10° percentile, da altri al 3° percentile (circa -2DS) della popolazione di appartenenza. 1
Gli autori che hanno fissato il suddetto cut-off al 10° percentile hanno elaborato, mediante l’ utilizzo delle carte antropometriche neonatali, la seguente classificazione dei neonati, in base al peso, nelle diverse età gestazionali:
• SGA (“Small for Gestational Age” o piccolo per età gestazionale): peso inferiore al 10 ° percentile per l'età gestazionale;
• AGA (“Appropriate for Gestational Age” o adeguato per età gestazionale): peso compreso tra il 10 ° e il 90 ° percentile per l'età gestazionale;
• LGA (“Large for Gestational Age” o grande per età gestazionale): peso superiore il 90 ° percentile per l'età gestazionale. 2
La classificazione suddetta può essere effettuata anche in base alla lunghezza corporea o alla circonferenza cranica del neonato. 2
Ciò nonostante, in endocrinologia pediatrica si raccomanda di considerare SGA il neonato con peso e/o lunghezza alla nascita inferiore a -2 DS o al 3° percentile rispetto alla popolazione di appartenenza, sulla base delle specifiche curve di riferimento, dal momento
Introduzione
che questo criterio permette di identificare la maggior parte dei soggetti che richiederanno un follow up auxologico. 1
Esiste inoltre una sottoclassificazione dei neonati SGA in:
SGA per peso (SGAw o
sga for weight
); SGA per lunghezza (SGAl o
sga for length
); SGA per peso e lunghezza. 3
Possono infine essere identificati anche neonati SGA per circonferenza cranica. 1
I suddetti parametri rappresentano degli indicatori oggettivi della qualità e dell’entità della crescita neonatale e vengono valutati con strumenti standardizzati quali le curve antropometriche neonatali. 4
Figura 1.1 Neonato SGA (a sinistra) paragonato a neonato AGA (a destra) della stessa età gestazionale.
Introduzione
1.2. Curve antropometriche neonatali
I grafici neonatali europei sono ritenuti al momento inadeguati per l’utilizzo in Italia. Pertanto, finchè non sarà stabilito uno standard internazionale, nel nostro Paese è raccomandato l'utilizzo di tabelle di riferimento nazionali aggiornate. 5
Il riferimento antropometrico più comunemente utilizzato nella realtà italiana sono ad oggi le “Carte di Bertino” 5 oppure i nuovi grafici INeS (Italian Neonatal Study) per i neonati pretermine (da utilizzare dal momento della nascita fino al termine) e i grafici longitudinali internazionali WHO 2006 o CDC 2002 dal termine fino ai 2 anni di vita, secondo quanto stabilito da la Società Italiana di Neonatologia, la Società Italiana di Endocrinologia e Diabetologia Pediatrica e la Società Italiana di Statistica Medica ed Epidemiologia. 6
1.3. Calcolo dell’età gestazionale
Come accennato, la validità della misurazione auxologica neonatale si basa sul calcolo della corretta età gestazionale, che può essere ottenuta dall’associazione della valutazione ecografica precoce con il conteggio dei giorni di gravidanza, a partire dal primo giorno dell’ ultimo ciclo mestruale. In particolare, l'American Academy of Pediatrics e l'American College of Obstetricians and Gynecologists riconoscono tre gruppi di età gestazionale, con le seguenti definizioni:
• neonati pretermine: nati prima della 37° settimana dal concepimento (meno di 259 giorni)
• neonati a termine: nati tra la 37° e la 41° settimana + 6 giorni (tra 259 e 293 giorni)
• neonati post-termine: nati dopo la 42° settimana (294 o più giorni). 2
1.4. Limiti della definizione di SGA
E’ opportuno precisare come la definizione di SGA non tenga conto di diversi fattori che possono influenzare la crescita fetale, quali BMI (Body Mass Index o indice di massa corporea) materno, origine etnica e parità materna 1, la cui identificazione potrebbe essere utile per riconoscere i neonati che presentino crescita fetale anomala. 7
Introduzione
Quanto detto è vero specialmente per il gruppo di SGA compresi tra il 3° e 10° percentile. Questi fattori potrebbero essere utilizzati per correggere il peso alla nascita, in modo da identificare i neonati con una crescita fetale anormale, distinguendoli da quelli “fisiologicamente piccoli” ma che non presentano alcuna patologia. 1
1.5. Relazione e differenza fra SGA e IUGR
Sebbene l’acronimo SGA sia talvolta utilizzato come sinonimo di IUGR (“intrauterine growth restriction” o “restrizione di crescita intrauterina”), i due termini rinviano a due concetti profondamente diversi. 4
Il termine “piccolo per età gestazionale” (SGA) nasce infatti da una definizione
statistica
, basata su misurazioni auxologiche alla nascita. Pertanto comprende tutti quei neonati che non hanno raggiunto il proprio potenziale di crescita (a causa di fattori materni, uterini, placentari o fetali) ma anche neonati piccoli in buona salute. 4Il termine “ritardo di crescita intrauterino” (IUGR) si riferisce invece ad una condizione
clinica
e funzionale e denota feti che non riescono raggiungere il proprio potenziale di crescita, indipendentemente dal fatto che in seguito, al momento della nascita, siano SGA.
Possiamo quindi affermare che l’accrescimento del feto con IUGR sarebbe stato perfettamente normale se non fossero subentrati fattori ambientali o genetici in grado di comprometterlo. Pertanto il neonato identificato come SGA dalle tabelle antropometriche neonatali non è necessariamente andato incontro a IUGR e, viceversa, un neonato che è andato incontro a IUGR durante il periodo fetale può non essere SGA 4 , come mostrato in figura 1.2.
La velocimetria Doppler può aiutare a distinguere quali, tra i feti SGA, siano andati incontro a IUGR e quali siano costitutivamente SGA. La distinzione è rilevabile attraverso la misurazione del flusso doppler nella circolazione feto-placentare e utero-placentare 21 22 : in caso di IUGR il flusso è solitamente anormale. 2 Pertanto, una valutazione auxologica completa del neonato dovrebbe prendere in considerazione non solo le caratteristiche antropometriche alla nascita, ma anche la biometria fetale ecografia e la velocimetria Doppler. 2
Introduzione
2. EPIDEMIOLOGIA
Secondo dati recenti i neonati SGA sotto le 2 deviazioni standard rispetto alla norma sarebbero circa il 3 – 10% della popolazione. Tuttavia, grazie alle nuove curve di crescita intrauterina, elaborate su una popolazione più numerosa e tenendo conto dell’etnia, è stato messo in luce come molti casi di SGA restino misconosciuti, e molti pazienti siano erroneamente classificati come adeguati per l’età gestazionale (AGA). 8
Figura 1.2. Rappresentazione grafica del verificarsi delle condizioni di SGA con e senza IUGR. 2
Introduzione
3. FATTORI EZIOLOGICI
I principali fattori associati alla nascita SGA possono essere classificati in fattori fetali, utero-placentari e materni. 9
Tra quelli fetali sono fondamentali le anomalie cromosomiche e le patologie di natura genetica o congenita.
I fattori utero-placentari comprendono placenta previa 19, patologie placentari strutturali, insufficiente perfusione placentare, anomalie di impianto della placenta 9 e, in generale, tutto ciò che vada a interferire con il nutrimento e l’ossigenazione fetale. 20
Tra le cause materne le più importanti sono: età (gravidanze in età molto giovane o avanzata), primiparità, ipertensione arteriosa, patologie renali, diabete mellito pre-gestazionale, diabete pre-gestazionale, malattie vascolari, collagenopatie, infezioni (in particolar modo Toxoplasmosi, Citomegalovirus, Herpes virus e Rosolia). Alcuni autori riportano inoltre, fra le cause materne, deficit nutrizionali, bassi livelli materni di vitamina D 10, abuso di alcol 11, patologia asmatica 12, uso di sostanze stupefacenti, assunzione di farmaci e abitudine al fumo di sigaretta.9 Per quanto riguarda il fumo di sigaretta, in particolare, è dimostrata una netta correlazione inversa tra il consumo di sigarette da parte della gestante e peso/altezza del neonato.131415
Per quanto riguarda i farmaci, sono riportati in letteratura studi che dimostrano come alcuni antiepilettici (in particolare valproato e carbamazepina) assunti dalla gestante siano correlati alla nascita di un neonato SGA.16
Ancora, tra le cause materne, oltre a quelle precedentemente elencate, alcuni autori hanno dimostrato l’importanza di fattori di rischio quali: età materna superiore ai 35 anni (a conferma di quanto precedentemente riportato), BMI (BODY Mass Index o indice di massa corporea) materno pre-gravidico nell’ordine del sottopeso 17, primiparità e preeclampsia 1718. Infine si ricordano, fra le cause eziologiche, le gestazioni multiple. 9
Introduzione
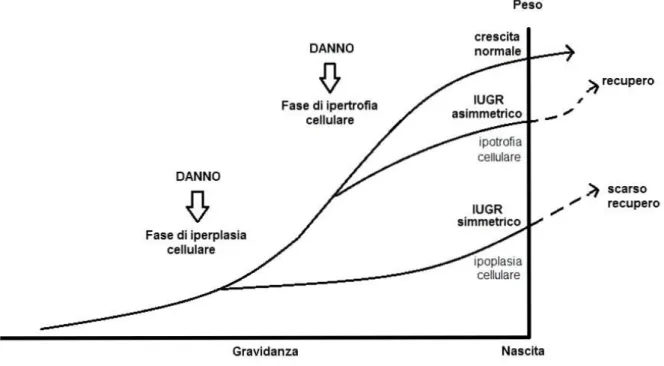
4. IL NEONATO SGA SIMMETRICO E ASIMMETRICO
La stima del peso, della lunghezza corporea e della circonferenza cranica consente un’ulteriore classificazione, all’interno dell’eterogeneo gruppo dei neonati SGA, in due tipologie: SGA simmetrici (proporzionati) o asimmetrici (non proporzionati).2
Gli SGA simmetrici presentano tutti e tre i parametri auxologici (peso, lunghezza corporea e circonferenza cranica) inferiori rispetto alla norma. 2
In questi neonati, l’insulto che porta alla riduzione della crescita si verifica all'inizio della gravidanza, durante la fase della crescita caratterizzata da iperplasia cellulare, con conseguente riduzione del numero di cellule (ipoplasia), il che può limitare il successivo recupero di crescita (catch-up growth) di organi e tessuti. 23
I neonati SGA asimmetrici [figura 1.3] presentano, invece, soltanto una riduzione del peso, mentre lunghezza e circonferenza cranica risultano normali, o ridotte in misura minore, rispetto agli SGA simmetrici. 2
In tali soggetti infatti, l’insulto alla base della restrizione di crescita si verifica più tardi rispetto al caso precedente, e va a interferire con l’ossigenazione cellulare. In particolare, tale insulto si verifica durante la fase di ipertrofia cellulare, con conseguente riduzione della dimensione delle cellule (ipotrofia). Pertanto in questa condizione, a differenza della precedente, è possibile un catch up-growth. 23
Il deficit di peso in quest’ultimo caso è dovuto principalmente ad una riduzione dei depositi corporei di grasso, normalmente accumulati durante il terzo trimestre di gravidanza. La causa della sproporzione risiede nella ridistribuzione del flusso sanguigno durante lo sviluppo fetale, con perfusione preferenziale di organi nobili quali cuore, encefalo e ghiandole surrenali a discapito di altri organi, come fegato, milza, reni, timo e tessuto adiposo. 24
In caso di un insulto tardivo, la maggior riduzione del peso fetale rispetto alla lunghezza corporea può essere anche spiegata col fatto che il picco di velocità di crescita in lunghezza avviene prima (circa alla 20° settimana) rispetto al picco di crescita in peso. 25
Introduzione
Infatti, sei mesi dopo il concepimento, il feto raggiunge il 70% della sua lunghezza potenziale a termine, ma solo il 25% del suo peso. Questi neonati, che in passato venivano definiti "immaturi", sembrano presentare segni clinici di malnutrizione intrauterina, come cute ipoelastica [figura 1.4], facilmente sollevabile in pliche, esiguo tessuto sottocutaneo, massa muscolare poco rappresentata e cordone ombelicale sottile. 2
Figura 1.3 Neonato SGA asimmetrico. Da Buonocore G., Rodolfo B. & Michael W. Neonatology A Practical Approach to Neonatal Diseases. (Springer) 2012
Figura 1.4 Cute ipoelastica nel neonasto SGA amimmetrico. Da Buonocore G., Rodolfo B. & Michael W. Neonatology A Practical Approach to Neonatal Diseases. (Springer) 2012
Introduzione
Tuttavia, grazie al miglioramento della diagnosi prenatale e alla buona gestione della restrizione di crescita fetale, oggi i neonati che presentino tutte queste caratteristiche sono più rari che in passato. 2
I meccanismi di danno che portano alla restrizione di crescita fetale (IUGR) simmetrica e asimmetrica sono rappresentati in figura 1.5.
Alcuni dati suggeriscono che sia la restrizione simmetrica della crescita fetale, sia quella asimmetrica, possono iniziare precocemente durante la gravidanza (17-19 settimane di gestazione). 26 Queste osservazioni hanno portato alla riconsiderazione delle cause, tempi e rischi di restrizione della crescita intrauterina simmetrica o asimmetrica. Il riconoscimento delle cause specifiche di ridotta crescita fetale è più importante rispetto all’esame delle proporzioni corporee alla nascita per prevedere l’outcome a breve e lungo termine dei neonati SGA. 2 Sembra essere importante, inoltre, la crescita del feto rispetto a quella placentare. Infatti, i neonati piccoli per età gestazionale ma con una placenta relativamente grande presentano un ridotto catch-up growth nei 18 mesi dopo la nascita ed un aumento del rischio di ipertensione in età adulta. 27
Introduzione
5. OUTCOME NEONATALE DEL PAZIENTE SGA
I neonati SGA presentano una morbidità e una mortalità maggiori rispetto ai neonati AGA di pari età gestazionale, specialmente se nati pretermine. 28 18 La morbidità perinatale del paziente SGA risulta inoltre più elevata qualora abbia presentato uno IUGR che sia rimasto non diagnosticato durante la gravidanza. 29
5.1. Mortalità
I neonati piccoli per età gestazionale, sia pretermine che a termine, presentano un rischio aumentato di mortalità perinatale.3031 32 Questo rischio, nei neonati cosiddetti “late preterm” (di età gestazionale compresa fra le 34 e le 36 settimane) e appena a termine (37-38 settimane di età gestazionale) persiste anche quando siano state escluse severe anomalie congenite. Oltre alle anomalie congenite, infatti, anche l’ipossia ischemica alla nascita e le infezioni costituiscono un fattore di rischio rilevante di mortalità perinatale. Infine, anche la sindrome della morte improvvisa del lattante contribuisce alla mortalità infantile degli SGA.33
5.2. Asfissia perinatale
l feti con restrizione di crescita presentano una ridotta tolleranza nei confronti delle transitorie riduzioni del flusso placentare. Il neonato SGA presenta inoltre, rispetto a un neonato AGA, un aumento del rischio di tutte le possibili sequele cliniche dovute all’ipossia perinatale, a causa dell’ipossia cronica intrauterina e della limitazione delle riserve di carboidrati causata dall’insufficienza placentare.35
5.3. Infezioni perinatali
Studi recenti suggeriscono una possibile interazione tra la funzione immunologica e lo stato nutrizionale. In neonati SGA e in modelli animali con restrizione di crescita intrauterina sono stati riscontrati un’atrofia timica e un prolungato indebolimento dell’immunità cellulare. Questi soggetti presentano inoltre una pronunciata ipogammaglobulinemia, se confrontati con
Introduzione
neonati AGA. 36 Inoltre, i neonati da madre con preeclampsia presentano spesso una neutropenia. Tutti questi aspetti si traducono in un aumentato rischio di infezioni perinatali. 2
5.4. Difetti della coagulazione
La disfunzione epatica che consegue all’ipossia intrauterina cronica può comportare alterazioni dell’emostasi, rappresentate principalmente da una riduzione dei fattori della coagulazione vitamina k-dipendenti e da trombocitopenia. Si tratta solitamente di anomalie di breve durata rispondenti a semplici misure correttive, per quanto siano riportati in letteratura rari casi di sanguinamenti severi o emorragie intrapolmonari. 37
Alcuni autori hanno condotto uno studio su un gruppo di nati SGA a termine e in buona salute, osservando come in questi neonati vi fosse un aumento del tempo di protrombina (PT) e dell’international normalized ratio (INR), indicando una predisposizione agli eventi emorragici. Tuttavia, i neonati inclusi nello studio in questione non presentavano segni di alterazione dell’emostasi.38
5.5. Ipotermia
I neonati SGA presentano un rischio aumentato di ipotermia rispetto ai neonati adeguati per età gestazionale (AGA), a causa dell’elevato rapporto tra superficie corporea e peso (la superficie corporea subisce una riduzione inferiore rispetto a quella del peso), dei minori depositi di tessuto adiposo sottocutaneo e della riduzione delle riserve di tessuto adiposo bruno: questi fattori limitano la termogenesi.39
5.6. Ipoglicemia
Le riserve epatiche e muscolari di glicogeno sono le principali fonti di glucosio nelle prime ore dopo la nascita: nei neonati SGA queste riserve risultano ridotte, e la compromissione della gluconeogenesi e della glicogenolisi sono le cause principali di ipoglicemia. Inoltre, i neonati con restrizione di crescita intrauterina presentano una riduzione dei depositi di
Introduzione
grasso e una inefficace ossidazione degli acidi grassi liberi e dei trigliceridi, così non riescono a vicariare, mediante l’uso dei lipidi, la necessità di glucosio dei tessuti. Il rischio di ipoglicemia è maggiore durante i primi giorni di vita, durante i quali vengono meno le fonti placentari di nutrienti e deve avvenire un adattamento alla vita extrauterina. Può comunque persistere per diverse settimane. 37
5.7. Policitemia
L’ipossia fetale cronica comporta un aumento della produzione di eritropoietina da parte del rene fetale, causando un aumento della produzione di eritrociti. Inoltre, il passaggio di sangue dal compartimento placentare a quello fetale durante il travaglio fetale rappresenta una causa importante di policitemia nei feti che presentano IUGR. 40
La policitemia, inoltre, comporta il rischio di sviluppare ipoglicemia, iperbilirubinemia ed enterocolite necrotizzante. 2
5.8. Sindrome da distress respiratorio (RDS) e displasia broncopolmonare
I neonati SGA presentano un rischio di RDS uguale o maggiore rispetto ai neonati AGA.3241 E’ inoltre riportato un aumento del rischio di sviluppare malattia polmonare cronica nei neonati pretermine che hanno avuto uno IUGR. 42 43 Alla base della patogenesi della displasia broncopolmonare degli SGA sembrano esservi molteplici cause. Tra queste ricordiamo uno sviluppo intrauterino anormale del polmone 42 , la presenza di radicali liberi dell’ossigeno, che causerebbero un danno in utero, un processo infiammatorio sistemico fetale e/o neonatale dovuto all’ipossia cronica, o una grave patologia polmonare precoce, con conseguente danno polmonare indotto dalla ventilazione meccanica. 44
5.9. Retinopatia del prematuro (ROP)
I neonati SGA pretermine presentano un rischio aumentato, rispetto ai pretermine AGA, di sviluppare la retinopatia del prematuro (ROP). 45 La possibile spiegazione risiede nelle
Introduzione
modificazioni dello sviluppo degli organi. 46Spesso la degenza in ospedale dei neonati SGA risulta più lunga e le cure più intensive rispetto ai neonati AGA: 39 è anche più probabile che necessitino di una supplementazione con ossigeno, che costituisce un rischio ben documentato di ROP. 2 Inoltre, i neonati SGA hanno una più bassa concentrazione sierica di IGF1 (Insulin like growth factor) implicato, insieme al VEGF (vascular endotelial growth factor), nella patogenesi della ROP. 47
5.10. Enterocolite necrotizzante (NEC)
I neonati con IUGR e/o SGA presentano un rischio aumentato di sviluppare enterocolite necrotizzante (NEC) 48. Il meccanismo alla base non è chiaro, ma può essere posto in relazione ad alterazioni del flusso ematico intestinale ed epatico che hanno inizio in epoca fetale e che possono persistere in epoca postnatale, con un certo recupero durante la prima settimana, fornendo una giustificazione alla scelta clinica di una introduzione differita e lenta dell’alimentazione enterale. 49 La valutazione postnatale precoce del flusso in arteria mesenterica superiore è stata considerata uno strumento per identificare i neonati a maggior rischio di sviluppare NEC. 50
6. OUTCOME A LUNGO TERMINE DEL PAZIENTE SGA
6.1. Rischio di ritardo nella crescita staturale e bassa statura da adulto
La maggior parte dei pazienti SGA nati a termine va incontro ad un catch up growth, raggiungendo, da adulto, un’altezza normale, superiore alle -2DS. Circa il 10% degli SGA, invece, non va incontro ad un catch up growth e pertanto presenta un’altezza da adulto inferiore a quella di neonati AGA 1 51. Il catch up growth è tipicamente un evento postnatale precoce, un periodo di crescita lineare accelerata che si realizza durante i primi 12 mesi di vita 52 e che, nella maggior parte dei casi, si completa entro i 2 anni 152. Nei bambini SGA a termine che, all’età di 2−4 anni, non abbiano ancora presentato un catch up growth e la cui altezza risulti inferiore alle –2.5 DS, deve essere effettuata una valutazione endocrinologica e preso in considerazione il trattamento con l’ormone della crescita (GH) 1. Invece, a differenza
Introduzione
dei nati a termine, i neonati SGA pretermine possono impiegare un tempo di 4 o più anni per raggiungere un’altezza nel range della normalità. 2
6.2. Rischio intellettivo e neurologico
Vi sono evidenze sul fatto che la condizione di SGA alla nascita, pur con una funzione placentare normale durante lo sviluppo intrauterino, comporti all’età di due anni uno sviluppo neurologico inferiore alla norma; questo dato metterebbe peraltro in discussione il concetto secondo cui i feti SGA ma con normale doppler dell’arteria ombelicale sarebbero “costituzionalmente piccoli” ma per il resto completamente sani. 53 I bambini nati SGA presenterebbero anche, al momento dell’adolescenza, difficoltà di apprendimento lievi o moderate e, in età adulta, problemi comportamentali e relazionali e capacità intellettive inferiori rispetto ai neonati AGA di pari età gestazionale 54. Il predittore più importante per queste conseguenze è l’assenza di catch-up growth in altezza e/o nella circonferenza cranica 1 35. Studi più recenti confermano come lo sviluppo cognitivo sia associato con la crescita intrauterina (misurata come: peso alla nascita, aumento di peso neonatale precoce e aumento della circonferenza cranica post-dimissione) e come supportare le fasi precoci della crescita neonatale possa favorire un miglioramento dell’outcome nei neonati prematuri. 55 L’allattamento esclusivo al seno sembra prevenire queste sequele neurologiche. Invece, la sovralimentazione con formule arricchite può accelerare la crescita, ma non sembra comportare un miglioramento dello sviluppo intellettivo, mentre rischia (si veda avanti) di incrementare il rischio metabolico e cardiovascolare 5657. L’associazione tra IUGR e paralisi cerebrale, osservata sia negli SGA a termine che pretermine, può essere dovuta all’insufficienza placentare. La riduzione di ossigeno e nutrienti verso il feto può far sì che il neonato presenti diversi effetti avversi sullo sviluppo e sul differenziamento cerebrale 37 54. Infine, a conferma di quanto detto, recenti studi caso – controllo dimostrano come nei nati SGA siano presenti alcune alterazioni encefaliche strutturali. E’ dimostrato infatti come nascere SGA comporti differenze microstrutturali della materia bianca da adulti (probabilmente dovute a un ridotto numero di assoni e ad una ridotta mielinizzazione presenti fin dalla nascita) e differenze anche nello sviluppo della materia bianca stessa. Tali alterazioni sembrerebbero correlate ad un più basso quoziente intellettivo. 58
Introduzione
6.3. Rischio metabolico
Fin dagli anni ’80 diversi studi epidemiologici hanno dimostrato come una compromissione della crescita intrauterina sia associata con il successivo sviluppo di sindrome metabolica o di una delle componenti di tale sindrome (insulinoresistenza, iperinsulinemia, ridotta tolleranza glucidica, diabete mellito di tipo 2, dislipidemia, obesità, ipertensione arteriosa). Risultano inoltre connesse alla sindrome metabolica una serie di condizioni patologiche come: ipercoagulabilità, steatosi epatica non alcolica, sindrome dell’ovaio policistico, disfunzione endoteliale e aterosclerosi; queste ultime comportano un aumento del rischio cardiovascolare. 59 Sono stati proposti diversi meccanismi che spiegassero la predisposizione allo sviluppo di sindrome metabolica nel paziente nato SGA. Una delle ipotesi è che il feto si adatti ad un ambiente intrauterino sfavorevole riprogrammando il proprio status endocrino-metabolico, con benefici per la sopravvivenza a breve termine. Di questo processo fanno parte, sostanzialmente, il realizzarsi di una insulinoresistenza e di una ridotta secrezione insulinica. Come risultato, la concentrazione di glucosio nel sangue può essere mantenuta a livelli tali da consentire uno sviluppo cerebrale a discapito dei tessuti periferici (ad esempio tessuto adiposo e muscolare) che ricevono meno nutrimento. 60 Questa riprogrammazione mantiene l’omeostasi glucidica nel breve termine, quando la quota di glucosio diretto al feto è insufficiente, ma predispone il bambino allo sviluppo della sindrome metabolica nelle fasi successive della vita, quando la disponibilità di nutrienti diviene sufficiente o abbondante 3752. Inoltre, i neonati SGA presentano spesso una velocità di crescita postnatale accelerata, con un rapido aumento del peso e, talvolta, con una successiva obesità, che è di per sé strettamente correlata alla sindrome metabolica 61. Anche i bambini nati SGA che sono in sovrappeso presentano un rischio aumentato di sindrome metabolica rispetto ai bambini nati AGA in sovrappeso. 62 In particolare, è dimostrato come una crescita accelerata durante i primi tre mesi di vita comporti un rischio aumentato di successivi disturbi metabolici nei pazienti nati SGA, in particolare relativamente al metabolismo glucidico 63 e alla insulinoresistenza. 64 D’altra parte, una scarsa crescita postnatale è associata a un peggior outcome neurocognitivo, pertanto questo effetto dannoso deve essere comparato col rischio metabolico che risulta dal promuovere un rapido aumento del peso 65. La prossima frontiera per i nutrizionisti neonatali sarà quella di ottenere, nel nato SGA, un catch up growth tale da promuovere un ottimale sviluppo neurocognitivo,
Introduzione
riducendo al minimo il rischio metabolico a lungo termine e gli effetti cardiovascolari avversi.66
6.4. Patologia renale cronica
In caso di restrizione della crescita intrauterina lo sviluppo renale risulta compromesso, a causa di un deficit di flusso, ossigeno e nutrienti; questo avviene perché probabilmente si verifica una deviazione del flusso ematico verso cuore ed encefalo, a discapito del rene. 24 La ridistribuzione del flusso comporta una riduzione del numero di nefroni, predisponendo questi pazienti ad albuminuria, patologia renale cronica e ipertensione. 2 Inoltre, anche la sindrome metabolica e il diabete mellito di tipo 2 rientrano tra le cause che possono creare complicanze a livello renale. 67
6.5. Pubertà e funzione riproduttiva
Le bambine che risultavano SGA alla nascita presentano un rischio aumentato di pubertà precoce, oppure uno sviluppo puberale che avviene in tempi normali ma con una progressione più rapida rispetto alla popolazione generale 68. Questo può comportare il raggiungimento di una statura definitiva inferiore rispetto a quanto sarebbe avvenuto a seguito di uno sviluppo puberale nei tempi normali. 2
Per quanto riguarda la funzione ovarica e la fertilità, alcuni autori escludono la possibilità di una riduzione della riserva ovarica nelle adolescenti che erano SGA alla nascita. 69
Inoltre, recenti studi condotti su bambine in età prepuberale con adrenarca precoce, che alla nascita erano SGA, hanno riscontrato differenze significative nei livelli ormonali, nella sensibilità all’insulina e nella maturità ovarica rispetto a bambine AGA alla nascita.
Un follow-up longitudinale permetterà di determinare se questi fattori possono contribuire allo sviluppo della sindrome dell’ovaio policistico (PCOS) in bambine SGA alla nascita con adrenarca precoce. 70
Introduzione
Di contro, lo sviluppo puberale dei maschi SGA avviene in tempi normali, anche se da adulti spesso presentano un’altezza media inferiore rispetto ai nati AGA 68.
Sebbene vi siano poche informazioni circa l'influenza della crescita fetale sulla funzione gonadica maschile, la maggior parte degli studi ha dimostrato che il basso peso alla nascita costituisce un fattore di rischio per ipospadia, criptorchidismo e neoplasia testicolare 71. Risultano, invece, ancora insufficienti, i dati a nostra disposizione circa l'influenza della crescita fetale sulla funzione riproduttiva nel maschio adulto. 2
Introduzione
II. IL NEONATO LATE PRETERM
1. DEFINIZIONE
Si definisce “late preterm” il paziente nato tra le 34 e le 36 settimane + 6 giorni di età gestazionale. 72 In passato questa popolazione di neonati era definita “near term” o “vicino al termine”. 73 Per un certo periodo, infatti, i neonati late preterm sono stati considerati e trattati in maniera simile ai nati a termine, così che la notevole mortalità e morbidità di questa popolazione è rimasta inosservata e le relative problematiche sono state trascurate. 2 74 Questo atteggiamento si rifletteva inoltre nella tendenza dei ginecologi all’interruzione della gravidanza a partire dall’età gestazionale di 34 settimane 75, quando vi fossero complicanze materne o fetali, così come al fatto che presso molti reparti di neonatologia questi neonati fossero ricoverati nei cosiddetti “nidi d’infanzia” ( luoghi di degenza di neonati sani, senza particolari rischi clinici) o in rooming-in 76 e dimessi precocemente 77.
La modifica della terminologia utilizzata, volta ad enfatizzare la prematurità piuttosto che la vicinanza al termine, si deve alla comprensione del fatto che questi neonati non sono completamente maturi: esistono infatti molteplici evidenze circa il rischio più elevato di complicanze (morbidità severa e mortalità) dei late preterm rispetto ai nati a termine. Queste nozioni sono di importanza fondamentale per il riscontro che trovano nella pratica clinica. 7378
La nascita, per il tardo pretermine, comporta l’interruzione del processo di maturazione fetale e il venir meno di quella quota di crescita che si sarebbe verificata durante le ultime sei settimane di gestazione, periodo critico per lo sviluppo del sistema nervoso e del polmone fetali, oltre che di altri sistemi e apparati 73 ; per “periodo critico” si intende un momento decisivo, tempo-dipendente, durante il quale la deprivazione del proprio ambiente naturale interrompe il normale processo di maturazione dell’organo o sistema. 79
Introduzione
2. EPIDEMIOLOGIA
Negli Stati Uniti, i neonati pretermine rappresentano una popolazione di neonati in netto aumento. Le ragioni di questo fenomeno sono molteplici; tra queste sembrano importanti i cambiamenti demografici, i sempre più frequenti trattamenti per l’infertilità, che comportano molto spesso l’insorgenza di gravidanze multiple, l’aumento dell’età materna, delle comorbidità materne e del tasso di obesità materna. Una causa ulteriore sarebbe rappresentata dall’aumentata tendenza dei ginecologi a scegliere l’interruzione della gravidanza con espletamento del parto, a partire dall’età gestazionale di 34 settimane, nei casi in cui vi siano complicanze materne o fetali.74
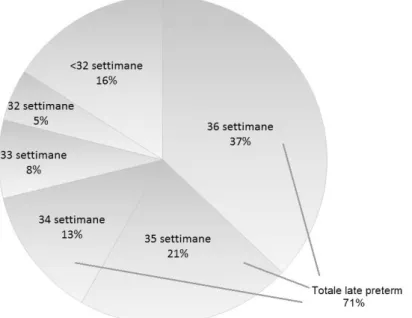
L’American College of Obstetricians and Gynecologists suggerisce che una delle cause dell’aumento delle nascite pretermine, in generale, sia proprio il drammatico aumento dei nati late preterm. 80 A conferma di quanto appena detto, diversi studi riportano come i neonati late preterm comprendano il sottogruppo di neonati con il trend di crescita più elevato, costituendo circa il 74% di tutti i pretermine e circa l' 8% - 9% del totale delle nascite negli Stati Uniti. 78 81 82 Infatti, per quanto la frequenza dei late preterm vari a seconda del tipo di ospedale in cui è stato effettuato lo studio, con tassi più elevati nelle neonatologie di terzo livello, questo gruppo di neonati costituisce in tutti i centri la maggior parte dei nati pretermine 74, come mostrato in [figura 1.6]. 2
Introduzione
Almeno la metà delle nascite dei late preterm avvengono con taglio cesareo. 2 Le decisioni che riguardano il momento del parto, nel caso dei late preterm, devono tener conto dei rischi e dei vantaggi, sia per la madre che per il neonato, nel prolungare la gravidanza. Per questa ragione sono necessari protocolli e norme specifici per i late preterm, piuttosto che l’applicazione di quelli già sviluppati per i nati a termine. 2
3. EZIOLOGIA
Le cause di nascita late preterm sono molteplici; in generale distinguiamo cause fetali e materne. Fra le cause fetali, le più importanti risultano le malformazioni e lo IUGR. In particolare, le malformazioni possono rappresentare una causa di parto pretermine spontaneo, ma anche una indicazione alla scelta da parte dei medici di eseguire un taglio cesareo pretermine; 73 uno studio multicentrico americano mostra infatti come i nati tra le 32 e le 36 settimane di età gestazionale presentassero un rischio più che raddoppiato di malformazioni congenite rispetto ai relativi controlli a termine. 83 Il ritardo di crescita intrauterino (IUGR) costituisce una causa frequente di nascita per i late pretermine ed è inoltre più comune nel gruppo dei neonati late preterm rispetto a quello dei nati a termine. 80 Fra le cause materne ricordiamo: coriamnionite, rottura prematura delle membrane (premature ropture of membrane o PROM), morbidità materna (ipertensione, preeclampsia, diabete) e abitudine della madre al fumo di sigaretta, che sarebbero più comuni nelle madri dei nati late preterm rispetto a quelle dei nati a termine. 84 858687 Inoltre, uno studio recente dimostra un’associazione tra il fatto che la madre sia portatrice del fattore V Leiden e l’incremento del rischio di prematurità del nascituro, ma non ti alta prematurità. Pertanto, questa condzione è probabilmente associata con una parte, pur piccola, di nascita late preterm.88
Introduzione
4. OUTCOME ALLA NASCITA
4.1. Mortalità
Vi sono sempre maggiori evidenze circa il rischio di complicanze, sia precoci che tardive, nei neonati late preterm, tra le quali spicca un tasso di mortalità infantile tre volte superiore rispetto ai neonati a termine (7,7 vs 2,5 ogni 1000 nati vivi). 78 81 82
Nel 2002, il tasso di mortalità neonatale per i late preterm è stato di 4,6 volte più elevato rispetto a quello dei nati a termine (4,8 vs 1,2 per mille nati vivi, rispettivamente). Questa corrispondenza è mantenuta per quanto riguarda la mortalità infantile; infatti, nel 2002 il tasso di mortalità infantile nel primo anno di vita è stato di 7,7 per mille nati vivi nei late preterm, contro il 2,5 per mille nei nati a termine. 8990
Questo è ancora più evidente nei late preterm piccoli per età gestazionale (SGA) che presentano un rischio di morte nel primo anno di vita aumentato di 22 volte rispetto ai nati AGA (adeguati per età gestazionale). La differenza nel tasso di mortalità degli SGA late preterm permane anche escludendo la morte per cause congenite. 33
Alcuni autori identificano le principali cause di morte nel periodo perinatale con le anomalie congenite, le complicanze gravidiche e i problemi respiratori. 91
Un ulteriore studio ha paragonato i dati di 1193 neonati, di cui 8666 erano a termine ed i restanti erano pretermine, la maggior parte dei quali nati a 36 settimane (44%), seguiti dai nati di 35 settimane (29%) e di 34 (27%). Malgrado la bassa mortalità totale (0,8%) i late preterm presentavano un rischio di morte 12 volte più elevato dei nati a termine. L’elevato tasso di mortalità conferma pertanto la condizione di alto rischio dei neonati late preterm. 92
4.2. Morbidità
I neonati late preterm presentano una probabilità sette volte aumentata di morbidità rispetto ai nati a termine (22% verso 3%). A conferma di questo, si stima che circa il 50% dei nati a 34 settimane di gestazione richieda un ricovero in terapia intensiva; questo numero scende
Introduzione
comunque al 15% nei nati a 35 settimane di vita intrauterina e all’8% per i nati a 36 settimane di gestazione. 2 Allo scopo di identificare i neonati che presentino un rischio di morbidità tale da porli in pericolo di vita e coloro nei quali con maggior probabilità si renderanno necessarie cure specialistiche, alcuni autori hanno effettuato il seguente studio, nel quale ciascun neonato veniva classifcato come patlogico qualora fosse presente almeno una delle seguenti condizioni: 1) degenza lunga almeno 5 notti con qualunque patologia che ponesse il paziente in pericolo di vita 2) degenza lunga almeno 5 notti con un trasferimento in una struttura di livello superiore 3) morte del neonato prima della dimissione. I risultati ottenuti sono stati i seguenti: il rischio di morbidità neonatale aumentava di due volte per ogni settimana di gestazione a partire dalla trentottesima, procedendo a ritroso verso la trentaquattresima. Inoltre, quando era presente morbidità materna, il rischio di morbidità alla nascita del paziente late preterm veniva ad aumentare, divenendo particolarmente importante qualora la madre avesse presentato patologia ipertensiva o emorragie. 90
I principali determinanti di morbidità che si verificano nei neonati late preterm includono: tachipnea transitoria del neonato, sindrome da distress respiratorio, ipertensione polmonare persistente, insufficienza respiratoria, apnee, instabilità della temperatura, ittero, ipoglicemia, difficoltà di alimentazione e ricovero prolungato in terapia intensiva neonatale. 93 Altre complicanze perinatali, evidenziate recentemente, sono rappresentate da: emorragia intraventricolare, paralisi cerebrale, 94 necessità di rianimazione al momento della nascita, ipocalcemia, malattia delle membrane ialine, pneumotorace, ipocalcemia, enterocolite necrotizzante (NEC) 74. Questi pazienti presentano inoltre un’elevata incidenza di malformazioni congenite, che possono contribuire all’incremento della mortalità rispetto ai nati a termine. Sono infine maggiormente soggetti allo sviluppo di sepsi. 2
Tutte queste complicanze, ad ogni modo, vanno riducendosi col progredire dell’età gestazionale dei late preterm, ovvero dalle 34 verso le 36+6 settimane di età gestazionale.95
Introduzione
4.3. Riammissioni
Alcuni autori hanno valutato, mediante la consultazione di un ampio database contenente 33276 neonati sopravvissuti al ricovero in terapia intensiva, quale fosse il numero delle riammissioni (successive alla prima dimissione, che segue alla nascita) e l’età gestazionale (EG) dei neonati ricoverati nelle due settimane seguenti la dimissione; i risultati sono stati i seguenti: sono stati riammessi in ospedale il 3% dei neonati di EG < 34 settimane (26/862), il 4,4% dei pazienti di EG = 34-36 settimane (94/2153) , il 2% dei nati di EG > 37 settimane (618/30261). Pertanto, possiamo notare come il tasso di riospedalizzazione dei late preterm sia stato doppio se comparato con quello dei nati a termine; la causa principale di riammissione è stata l’insorgenza di ittero. 96 Altri autori riportano come anche il tasso di riammissioni nel primo anno di vita sia più elevato per i late preterm: 15% verso l’8% dei nati a termine. 97 In particolare, i nati late preterm sarebbero quelli col maggior numero di riammissioni durante i primi 15 giorni successivi alla dimissione (3,8% vs 1,8% dei nati a termine). 97
Alcuni autori riportano come le cause più frequenti di riammissione precoce (entro i primi 15 giorni dalla dimissione) dei late preterm siano: ittero, difficoltà di alimentazione, basso peso alla nascita, disidratazione e apnea. I problemi gastrointestinali e respiratori (inclusa la bronchiolite) rappresentano le ragioni più comuni di riammissione tardiva (dopo 15 giorni dalla dismissione) durante il primo anno di vita. La gran parte dei neonati riammessi almeno una volta durante il primo mese di vita sono nati a 35 settimane di gestazione e il ricovero è dovuto, nella maggior parte dei casi, a patologie respiratorie. Il costo della riammissione in ospedale ammonta, per questo gruppo di neonati, a cento milioni di dollari. 93
4.4. Instabilità della temperatura corporea
Il neonato late preterm risulta sensibile alle basse temperature, per quanto lo sia in misura inferiore rispetto al prematuro di età gestazionale inferiore alle 34. Infatti, nelle ultime settimane di gestazione si ha un incremento del deposito di tessuto adiposo bianco e bruno, che quindi è presente in quantità inferiore nei neonati late preterm. Allo stesso tempo questi pazienti presentano spesso una temperatura corporea instabile, che può erroneamente
Introduzione
condurre al sospetto di sepsi e spesso, nell’attesa dei risultati degli accertamenti per sepsi, all’inizio di una terapia antibiotica. 98
4.5. Tachipnea transitoria del neonato
Una delle più importanti problematiche respiratorie nei nati late preterm è rappresentata dalla cosiddetta “tachipnea transitoria del neonato”, condizione auto-limitantesi che si verifica più frequentemente nei nati con taglio cesareo ed è dovuta verosimilmente al ritardo di attivazione della clearence del liquido polmonare che si ha nei neonati non sottoposti allo stress del parto spontaneo. 2 Alcuni autori hanno mostrato come i late preterm presentino una transitoria diminuzione del trasporto del sodio attraverso i canali amiloride-sensibili dell'epitelio nasale rispetto ai nati a termine 99, supportando la teoria secondo cui alla base di questa condizione vi sarebbe una clearence subottimale del liquido polmonare.
4.6. Sindrome da distress respiratorio
Studi più e meno recenti dimostrano come una delle principali comorbidità del neonato late preterm sia la sindrome da distress respiratorio (RDS o respiratory distress syndrome), che risulta più frequente in questo gruppo di neonati rispetto ai nati a termine.100 Grazie alla maggiore diffusione della terapia con corticosteroidi in epoca prenatale e alla introduzione del surfactante nei primi anni ’90, negli Stati Uniti i decessi neonatali dovuti alla sindrome da distress respiratorio hanno subito una riduzione del 48% dagli anni 1989-1991 al triennio 1995-1997 e successivamente sono diminuite di un ulteriore 18% nel periodo 2002-2004. Questa riduzione è stata evidente per i nati di età gestazionale compresa fra le 28 e le 32 settimane, mentre non lo è stata per i nati tra le 33 e le 36 settimane di gestazione, dal momento che questi neonati non hanno sempre ricevuto la terapia corticosteroidea profilattica in epoca prenatale; questo a causa del fatto che, nonostante l’evidenza di trials randomizzati sulla sicurezza ed efficacia di questa terapia in tali gravidanze, non vi erano indicazioni ottimali per questo gruppo di neonati.2 E’ dimostrato come l’utilizzo di corticosteroidi a 33-34 settimane di età gestazionale possa ridurre la mortalità infantile, ma come tuttavia non vi sia un effetto protettivo oltre le 36 settimane di gestazione. 101 Infine, alcuni autori hanno osservato come, all’interno di una popolazione di 2258 neonati late
Introduzione
preterm, le cause principali di insufficienza respiratoria tale da richiedere l’ECMO (Extracorporeal Membrane Oxygenation) fossero RDS o sepsi. La sopravvivenza complessiva è stata del 74% , non è migliorata nel corso del tempo di studio ed è risultata inferiore per i late preterm rispetto ai nati a termine, nei quali era dell’87%. 102
4.7. Apnee
Le apnee si verificano più frequentemente nei neonati late preterm (4-7%) che nei neonati a termine (1-2%) 103. Nello studio CHIME (Collaborative Home Infant Monitoring), il tasso di eventi di bradicardia e di apnee (ostruttive e centrali) registrato risultava superiore nei late preterm rispetto ai neonati a termine 103 104 Inoltre, i late preterm presentano un rischio aumentato di SIDS (sindrome della morte improvvisa del lattante) rispetto ai neonati a termine. 104
4.8 Difficoltà di alimentazione
I neonati late preterm possono presentare una immaturità nei meccanismi di alimentazione con scarsa coordinazione tra suzione e deglutizione, conseguente difficoltà nell'assunzione dei liquidi per via orale e quindi disidratazione; spesso necessitano infatti di idratazione per via endovenosa. Risulta anche più complicato ottenere un’efficace alimentazione al seno; possono inoltre presentare un reflusso gastroesogafeo più accentuato rispetto ai nati a termine. Per queste ragioni, fra le raccomandazioni della American Academy of Pediatrics (AAP) vi è quella secondo cui prima della dimissione del neonato è essenziale che si sia stabilita una alimentazione autonoma efficace, definita come una coordinazione nella attività di deglutizione, suzione e respirazione durante l'alimentazione. 81 Il calo di peso dopo la nascita (che si verifica durante i primi giorni dalla nascita come evento fisiologico in tutti i neonati) non deve superare il 7% del peso alla nascita. Se il neonato è allattato al seno, dopo la nascita occorre anche che venga effettuata, da parte di personale qualificato, un' attenta verifica della corretta posizione di allattamento e della effettiva assunzione del latte da parte del neonato. 2
Introduzione
4.8. Ittero
L’iperbilirubinemia rappresenta la più importante condizione clinica che comporti riammissioni in ospedale durante la prima settimana di vita postnatale. I neonati late preterm presentano un rischio notevolmente più elevato di iperbilirubinemia rispetto ai nati a termine. Per esempio, i nati a 36 settimane di gestazione hanno un rischio aumentato di almeno 8 volte, rispetto ai nati a termine, di presentare livelli di bilirubinemia totale superiori ai 20 mg/100mL (5,2%)
vs
i nati a 41-42 settimane di età gestazionale (0,7% e 0,6% rispettivamente). 105In generale, è dimostrato come la probabilità di riammissione in ospedale per l’insorgenza di un ittero che necessita di fototerapia può essere dovuta ai seguenti fattori: bassa età gestazionale, allattamento al seno, anamnesi positiva per presenza di ittero durante la prima degenza, come mostrato nella seguente tabella 106 , in cui possiamo notare che al primo posto, con il più elevato OR, si trova una bassa età gestazionale.
Fattori di rischio Odds ratio (
vs
i nati di 40 settimane di EG )EG 35-36 settimane 13,2
EG 37-38 settimane 7,5
Allattamento al seno 4,2
Ittero durante la prima degenza 7,8
Degenza < 72 ore 3,2
Secondo alcuni autori, la maggior parte dei nati da parto spontaneo, compresi i late preterm, sono dimessi a 48 ore di vita, ben prima che si verifichi il picco di bilirubinemia, che si ha tra la terza e la quinta giornata nei nati a termine e più tardi nei nati pretermine. Pertanto, in questi casi il picco di bilirubinemia si verifica a casa. E’ pertanto necessario controllare i livelli di bilirubinaprima della dimissione e provvedere ad un follow-up a domicilio o in ospedale, per impedire una elevazione preoccupante dei livelli di bilirubina sierica. Le decisioni mediche vengono prese sulla base del livello di bilirubina e all’età in ore del neonato, secondo il normogramma di Buthani. 107108
Introduzione
5. OUCOME A LUNGO TERMINE
Fino a poco tempo fa si riteneva che i neonati late preterm presentassero un rischio minimo di morbidità a lungo termine. Diversi studi hanno confutato questa ipotesi dimostrando come, per molti aspetti, i nati late preterm abbiano un outcome a distanza peggiore rispetto ai nati a termine.
5.1. Aspetti neurocognitivi
Alcuni autori hanno valutato l'outcome di bambini (in età pre-asilo/asilo ) nati late preterm e a termine. I risultati sono stati corretti per 15 potenziali variabili confondenti, di natura materna e infantile. Hanno così osservato come il rischio di ritardo nello sviluppo o di disturbi relativi a quest'ultimo fosse più alto del 36% tra i neonati late preterm rispetto ai nati a termine.109 Inoltre, il rischio che questa disabilità permanesse al momento dell'asilo con la necessità di un insegnamento di sostegno è stata superiore per i neonati late preterm. Diversi bambini non sono stati ritenuti in grado di iniziare la scuola elementare in tempi normali. Pertanto, i bambini late preterm in salute, confrontati con i bambini a termine anch'essi sani, presenterebbero un rischio più elevato di problemi dello sviluppo almeno fino all’età di 5 anni110, oltre che di prestazioni scolastiche inferiori. 110111
D’altra parte, altri ricercatori hanno valutato, in un gruppo di bambini nati late preterm, una serie di caratteristiche, fra cui le abilità cognitive e sociali e la presenza di eventuali problemi comportamentali o emozionali, utilizzando il "Woodcock-Johnson Psycho-Educational Battery-Revised" e il "Child Behavior Checklist", somministrati più volte fino all'età di 15 anni; i risultati, a differenza dello studio precedente, non hanno portato al riscontro di differenze significative tra i bambini nati late preterm e i nati a termine. Pertanto, secondo questo studio, in contraddizione col precedente, i late preterm che fossero in salute al momento della nascita, non sembrano avere alcun problema in materia di cognizione, sviluppo, comportamento, e sviluppo socio-emotivo durante l'infanzia e l'adolescenza. 112 Tuttavia, uno studio ancor più recente dimostra come i nati late preterm presentino, rispetto ai nati a termine, un più basso MDI (Mental Index Score) e un minor PDI (psychomotor index score) e una maggior probabilità di ritardo nello sviluppo mentale o fisico. 113
Introduzione
5.2. Patologia asmatica
Alcuni autori hanno riportato una correlazione tra la nascita late preterm e lo sviluppo di patologia asmatica all’età di 6 anni. Nascere late preterm sembra infatti costituire un determinante aggiuntivo fondamentale per lo sviluppo di asma con un effetto genere-specifico, ovvero significativamente maggiori nel sesso maschile rispetto a quello femminile. 114