1
1. INTRODUZIONE
1.1. Caratteristiche generali dei carbeni
I carbeni sono specie chimiche metastabili aventi formula generale R2C, spesso utilizzate nella sintesi organica e metallorganica a causa della loro particolare reattività.1 Essa è una conseguenza del fatto che l’atomo di carbonio carbenico presenta solo 6 elettroni nel proprio guscio di valenza. Tale atomo di carbonio è legato a due sostituenti tramite legami covalenti e possiede due elettroni di non legame, i quali possono dare origine a uno stato di singoletto o di tripletto.
La geometria della specie carbenica può essere piegata o lineare, a seconda del tipo di ibridazione dell’atomo di carbonio stesso. Una geometria lineare implica un’ibridazione sp dell’atomo centrale, con due orbitali degeneri di non legame (px e py). Nel caso invece di geometria piegata (ibridazione sp2), l’energia dell’orbitale py rimane pressoché invariata, mentre px acquista un maggiore carattere di orbitale s (Figura 1.1).2 In questo caso gli orbitali di frontiera sono chiamati e pπ.
Figura 1.1. Relazione tra gli angoli di legame dell’atomo di carbonio di un carbene e la natura dei suoi
orbitali di frontiera.
Come mostrato in Figura 1.2, esistono quattro possibili rappresentazioni della configurazione elettronica, due delle quali (2 e 1p1) possiedono stabilità relativa maggiore: i due elettroni
1
G. Wilkinson, F. Gordon, A. Stone, E.W. Abel , “Comprehensive Organometallic Chemistry” 1982. 2
2 di non legame possono quindi trovarsi in due diversi orbitali con spin antiparalleli occupando lo stesso orbitale (σ2
pπ0, stato 1A1, singoletto) oppure possono avere spin paralleli (σ1pπ1, stato 3
B1, tripletto).
Figura 1.2. Possibili configurazioni elettroniche dell’atomo di carbonio di un carbene.
La reattività delle specie carbeniche dipende dalla molteplicità dello stato fondamentale.3 Infatti, un carbene in stato di singoletto può comportarsi sia da elettrofilo sia da nucleofilo in quanto possiede un orbitale vacante e uno completamente occupato. D’altra parte, un carbene in stato di tripletto ha due orbitali semi-riempiti, quindi la sua reattività sarà prevalentemente di tipo radicalico.
E’ possibile determinare lo stato in cui si trova una specie carbenica dalla misura delle energie relative degli orbitali σ e pπ: quando la differenza di energia è maggiore di 40 kcal/mol, lo stato di singoletto, meno reattivo, risulta favorito.4
In seguito a queste affermazioni, è plausibile che l’elettronegatività dei sostituenti sull’atomo di carbonio carbenico possa influenzare l’energia relativa tra i due stati.5 Gruppi elettron-attrattori favoriscono lo stato di singoletto in quanto stabilizzano in modo induttivo l’orbitale σ, incrementando il suo carattere s e lasciando invariato l’orbitale pπ; gruppi elettron-donatori favoriscono invece lo stato di tripletto più reattivo (Figura 1.3).
3
G.B. Schuster, Adv. Phys. Org. Chem. 1986, 22, 311. 4
R. Hoffmann, G.D. Zeiss, G.W. Vandine, J. Am. Chem. Soc. 1968, 90, 1485. 5
3 (a) (b)
Figura 1.3. La perturbazione degli orbitali mostra l’effetto induttivo dei sostituenti elettron-attrattori
(a) ed elettron-donatori (b).
Anche gli effetti di tipo mesomerico, che consistono nell’interazione tra gli orbitali del carbonio ed opportuni orbitali dei sostituenti, giocano un ruolo importante sul controllo della reattività di specie carbeniche.
In particolare, sostituenti (X) che possono comportarsi sia da σ-accettori che da π-donatori, quali F, Cl, Br, I, NR2, PR2, OR, SR, SR3, conducono alla formazione di un sistema a quattro elettroni e tre centri, favorendo così lo stato di singoletto. In questo modo, il legame C−X acquista un parziale carattere di doppio legame e la specie risulta meglio rappresentata da una struttura di tipo zwitterionico, con una carica negativa sul centro carbenico che ne esalta la nucleofilicità.
La coppia di elettroni carbenica viene quindi stabilizzata per effetto induttivo e per effetto mesomerico, dato che allo stesso tempo si ha una parziale donazione di densità elettronica dagli eteroatomi all’orbitale pπ vuoto del carbonio carbenico. Un esempio di questa stabilizzazione è rappresentato in Figura 1.4.
4
Figura 1.4. Stabilizzazione del centro carbenico per effetto induttivo e mesomerico.
E’ stato possibile sintetizzare una serie di carbeni contenenti eteroatomi e talvolta anche isolarli allo stato solido. E’ questo il caso dei carbeni N-eterociclici, oggetto di studio di questo lavoro di Tesi.
1.1.1. Derivati organometallici contenenti carbeni: carbeni di Fischer e carbeni di
Schrock
Sebbene molti dei primi tentativi di isolare composti contenenti specie carbeniche legate ad un metallo di transizione fallirono, composti di formula generale M-CR2 sono ormai conosciuti da decenni.
A seconda della natura del legame formale metallo-carbonio, essi possono essere classificati in due categorie: complessi carbenici di tipo Fischer (carbeni di Fischer) e complessi carbenici di tipo Schrock (carbeni di Schrock).
La prima categoria fu descritta per la prima volta nel 1964 da Fischer,6 attraverso la sintesi di W(CO)5(C(CH3)OCH3) (Figura 1.5, a).
(a) (b)
Figura 1.5. Esempi di carbeni di Fischer (a) e Schrock (b).
6
5 Il carbene si trova in uno stato di singoletto e il legame metallo-carbonio è il risultato di una formale -donazione del carbonio carbenico verso il centro metallico e di una retrodonazione π da parte del centro metallico verso l’orbitale pπ vuoto del carbonio (Figura 1.6, a). Nei carbeni di Fischer, generalmente il metallo si trova in basso stato di ossidazione e il complesso contiene leganti π-accettori e sostituenti π-donatori sul carbonio carbenico.
Nei complessi di Schrock, il cui primo esempio risale al 1974 (Figura 1.5, b),7 il legame metallo-carbonio deriva da una formale interazione tra il carbene in stato di tripletto ed il centro metallico (Figura 1.6, b). In questo caso, il metallo si trova in genere in alto stato di ossidazione e il complesso è privo di leganti π-accettori e sostituenti π-donatori sul carbonio carbenico.
Sia i carbeni di Fischer sia quelli di Schrock sono comunemente raffigurati con un doppio legame metallo-carbonio.
Figura 1.6. Rappresentazione schematica di (a) legame di tipo Fischer σ-donatore e π-accettore e (b)
legame covalente di tipo Schrock in complessi carbenici.
7
6
1.2. Carbeni N-eterociclici
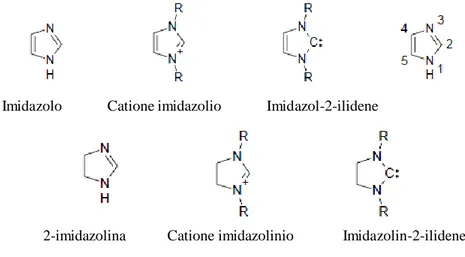
Una categoria speciale di carbeni è rappresentata dai carbeni N-eterociclici (NHC),8,9,10 la cui struttura generale ed i relativi precursori sono riportatati in Figura 1.7.
Imidazolo Catione imidazolio Imidazol-2-ilidene
2-imidazolina Catione imidazolinio Imidazolin-2-ilidene
Figura 1.7. Rappresentazione generale e nomenclatura delle strutture degli imidazoli e carbeni
derivati.
A partire dal 1991, da quando il primo carbene NHC fu isolato e caratterizzato,15 gli studi e le applicazioni di questi composti sono aumentati esponenzialmente. Il grande interesse per gli NHC è dato principalmente dal fatto che essi sono leganti versatili, stabili ed in grado di conferire al complesso metallico di cui fanno parte proprietà notevoli, quali stabilità e attività in catalisi omogenea.
Un esempio è il cosiddetto catalizzatore di Grubbs di prima generazione,11 un complesso di rutenio con due leganti fosfinici (Figura 1.8, a): esso risultò attivo in reazioni di metatesi di olefine. L’introduzione di un legante NHC in sostituzione di una fosfina (catalizzatore di Grubbs di seconda generazione, Figura 1.8, b) determinò un significativo miglioramento delle prestazioni catalitiche.11
8
D. Bourissou, O. Guerret, F.P. Gabbai, G. Bertrand, Chem. Rev. 2000, 100, 39.
9
M.F. Lappert, J. Organomet. Chem, 2005, 690, 5467. 10
P. De Fremont, N. Marion, S.P. Nolan, Coord. Chem. Rev. 2009, 253, 862. 11
7 (a) (b)
Figura 1.8. Catalizzatori di Grubbs di prima generazione (a) e di seconda generazione (b).
L’importanza di questi studi può essere dedotta dal fatto che, nel 2005, Yves Chauvin, Robert H. Grubbs e Richard R. Schrock ricevettero il Premio Nobel per la Chimica per i loro studi sui composti carbenici e "for the development of the metathesis method in organic
synthesis”.12
In questo capitolo, saranno presentate le caratteristiche generali dei carbeni N -eterociclici: saranno illustrate le loro proprietà come leganti in complessi di metalli di transizione e le relative strategie sintetiche. L’attenzione sarà infine rivolta alla possibilità di sintesi di complessi con metalli in alto stato di ossidazione, in particolare niobio.
1.2.1. Generalità
I carbeni N-eterociclici costituiscono un’estensione della categoria dei carbeni di tipo Fischer: il carbonio carbenico è legato a due atomi di azoto come sostituenti ed è generalmente parte di un anello a cinque atomi che contribuisce alla stabilizzazione della specie.
I primi tentativi di isolare questo tipo di composti furono condotti negli anni 60 da parte di Wanzlick:13 l’α-eliminazione termica di cloroformio a partire dalla corrispondente imidazolina determinava tuttavia la formazione di una specie dimera (Schema 1.1). Ulteriori tentativi di isolare composti NHC a partire da imidazoli N,N'-disostituiti insaturi non portarono a risultati soddisfacenti. Ciononostante, l’esistenza di carbeni NHC fu dimostrata grazie alla stabilizzazione della specie libera in complessi di metalli di transizione.14
12
"The Nobel Prize in Chemistry 2005". Nobelprize.org. Nobel Media AB 2013. 13
H.W. Wanzlick, Angew. Chem. Int. Ed. 1962, 74, 129. 14
8
Schema 1.1. Dimerizzazione di carbeni derivati da imidazoline.
Il primo carbene NHC stabile fu isolato nel 1991 da parte di Arduengo e collaboratori mediante deprotonazione del sale di imidazolio A (Figura 1.9). Furono ottenuti cristalli incolori che risultarono termicamente stabili, con un punto di fusione pari a 240 °C.15
Figura 1.9. Catione 1,3-diadamantilimidazolio (A) e relativo carbene NHC (B).
Inizialmente si riteneva che l’eccezionale stabilità di questo carbene potesse essere spiegata soltanto attraverso le proprietà steriche dei gruppi adamantilici che impedivano la dimerizzazione della specie. Effettivamente, questo fattore gioca un ruolo determinante, ma in seguito, sempre da parte di Arduengo, furono isolate altre specie contenenti gruppi meno ingombranti.16,17 Pertanto, fu dimostrato che anche fattori elettronici, quali quelli descritti nella sezione precedente, sono fondamentali per la stabilizzazione dello stato di singoletto.18 Specie NHC sature (prive cioè del doppio legame C=C sull’anello) hanno una maggiore tendenza a dimerizzare, a causa del fatto che la differenza energetica singoletto-tripletto
15
A.J. Arduengo, R.L. Harlow, M. Kline, J. Am. Chem. Soc. 1991, 113, 361. 16
A.J. Arduengo, H.V.R. Dias, R.L. Harlow, M. Kline, J. Am. Chem. Soc. 1992, 114, 5530. 17
A.J. Arduengo, S.F. Gamper, J.C. Calabrese, F. Davidson, J. Am. Chem. Soc. 1994, 116, 4391. 18
9 risulta minore in confronto a quella misurata per le specie insature. A causa di ciò, per ottenere specie sature di carbeni in forma libera, sono sempre necessari sostituenti molto ingombranti come per esempio 2,4,6-trimetilfenile.19,20
Sono stati comunque osservati casi di dimerizzazione anche nel caso di NHC insaturi. Ad esempio, nel caso del benzimidazol-2-ilidene, è stato osservato un equilibrio monomero
dimero che dipende fortemente da fattori sterici.21
La prima specie carbenica in forma libera di questo tipo fu riportata da Hahn et al.22 Come si vede nello Schema 1.2, 1,2-fenilendiammina (A) reagisce con tiofosgene per dare il corrispondente benzimidazol-2-tiochetone (B); quest’ultimo, se trattato con Na/K, genera il carbene libero (D) oppure la specie dimera dibenzotetraazafulvalene (C), a seconda dall’ingombro sterico dei sostituenti sull’azoto.
Schema 1.2. Effetto dell’ingombro sterico dei sostituenti sull’azoto nella formazione di carbeni NHC.
Una panoramica delle altre tipologie di carbeni NHC è mostrata in Figura 1.11. Alcune specie sono state caratterizzate allo stato solido, mentre altre sono tutt’ora oggetto di studio come leganti. L’uso di queste tipologie alternative permette un controllo fine delle proprietà elettroniche dei leganti e dei corrispondenti complessi. Per esempio, NHC con anelli a sei e sette atomi (A, B) mostrano una basicità superiore rispetto ai corrispondenti NHC con anelli a
19
A.J. Arduengo, J.R. Goerlich, W.J. Marshall, J. Am. Chem. Soc. 1995, 117, 11027. 20
M.K. Denk, A. Thadani, K. Hatano, A.J. Lough, Angew. Chem. Int. Ed. 1997, 36, 2607. 21
Y.F. Liu, P.E. Lindner, D.M. Lemal, J. Am. Chem. Soc. 1999, 121, 10626. 22
10 cinque atomi. Inoltre, a causa dell’angolo NCN maggiore, i sostituenti di anelli più grandi risultano più vicini ai centri metallici nei complessi.23
La struttura C (Figura 1.11) può essere ottenuta per reazione di bipiridina con [Ph3AsCH2OTf]+, seguita da deprotonazione, e formalmente può essere descritta come un complesso di bipiridina con un carbonio di singoletto.24
La struttura D (Figura 1.10) è un esempio di come sia possibile portare gruppi ingombranti vicini al centro metallico; utilizzando queste ossazoline è stato possibile preparare una vasta serie di leganti chirali.25
Figura 1.10. Alternative alle comuni tipologie di carbeni NHC.
Infine, è da notare che lo scheletro di NHC non è limitato soltanto agli atomi di carbonio: esistono varianti che includono, per esempio, fosforo (E)26 o boro (F).27
23
M. Iglesias, D.J. Beetstra, J.C. Knight, L.L. Ooi, A. Stasch, S. Coles, L. Male, M.B. Hursthouse, K.J. Cavell, A. Dervisi, I.A. Fallis, Organometallics 2008, 27, 3279.
24
R. Weiss, S. Reichel, M. Handke, F. Hampel, Angew. Chem. Int. Ed. 1998, 37, 344. 25
F. Glorius, G. Altenhoff, R. Goddard, C. Lehmann, Chem. Commun. 2002, 2704. 26 E. Despagnet‐Ayoub, R.H. Grubbs, J. Am. Chem. Soc. 2004, 126, 10198.
27
11
1.3. Complessi metallici con carbeni N-eterociclici
1.3.1. Confronto con fosfine
I leganti NHC sono spesso confrontati con le fosfine (PR3), una classe di leganti molto nota in chimica organometallica.1 Per queste ultime, è possibile prevedere e controllare il comportamento grazie agli studi di Tolman sugli effetti sterici ed elettronici dei loro sostituenti.28
Sulla base di misure spettroscopiche, è stato possibile concludere che i carbeni NHC hanno una struttura elettronica comparabile con le fosfine. In confronto ad esse risultano migliori σ-donatori con caratteristiche di scarsi π-accettori, come si può notare dalle frequenze di stiramento CO di complessi carbonilici di Ni contenenti leganti NHC e fosfinici (Tabella 1.1).29
Tabella 1.1. Frequenze di stiramento carboniliche IR in complessi Ni(CO)3(L).
Il confronto con altri leganti σ-donatori ha indicato che i complessi carbenici NHC possiedono energie di dissociazione di legame generalmente maggiori. Per esempio, calcoli computazionali hanno mostrato che la perdita di PMe3 dal complesso
28
C.A. Tolman, Chem. Rev. 1977, 77, 313. 29
R. Dorta, E.D. Stevens, N.M. Scott, C. Costabile, L. Cavallo, C.D. Hoff, S.P. Nolan, J. Am. Chem. Soc. 2005, 127, 2485.
12 trans‐[PdCl2(PMe3)(NHC)] richiede 38.4 kcal/mol, mentre la perdita del legante NHC (imidazol-2-ilidene non sostituito) richiede 54.4 kcal/mol.30
Un’altra differenza importante tra fosfine e NHC è l’orientazione della struttura ingombrata. Nelle fosfine si trovano tre sostituenti che puntano in direzione opposta rispetto al centro metallico, mentre negli NHC i due sostituenti possono trovarsi nelle vicinanze del metallo stesso. Inoltre, a differenza delle fosfine, i sostituenti degli NHC non sono direttamente collegati all’atomo coordinato al centro metallico: ciò permette, in linea di principio, di modificare indipendentemente i fattori sterici ed elettronici.
La definizione dei parametri sterici degli NHC è oggetto di discussione. Infatti, l’angolo conico Θ, parametro utilizzato da Tolman28 per quantificare le proprietà steriche delle fosfine terziarie adoperate come leganti, non risulta adatto per gli NHC. E’ stato così introdotto un altro parametro, chiamato “buried volume” (%Vbur), calcolato considerando sia l’ingombro dei sostituenti sugli atomi di azoto sia la distanza metallo-carbonio nel complesso (Figura 1.11).31 Il confronto tra le energie di dissociazione del legame M-NHC e %Vbur ha mostrato una correlazione lineare tra i due parametri.
Figura 1.11. Rappresentazione schematica della sfera utilizzata per la determinazione del parametro
sterico %Vbur.
Un’altra caratteristica molto importante dei leganti NHC è il fatto che essi si sono rivelati piuttosto efficaci nella stabilizzazione di complessi metallici in alto stato di ossidazione.
30
J. Schwarz, V.P.W. Bohm, M.G. Gardiner, M. Grosche, W.A. Herrmann, W. Hieringer, G. Raudaschl‐Sieber, Chem.‐Eur. J. 2000, 6, 1773.
31
A.C. Hillier, W.J. Sommer, B.S. Yong, J.L. Petersen, L. Cavallo, S.P. Nolan, Organometallics 2003, 22, 4322.
13 Infatti, inizialmente i NHC erano considerati soltanto σ-donatori puri, grazie alla donazione di elettroni σ da parte del carbonio carbenico nell’orbitale d vuoto del metallo.
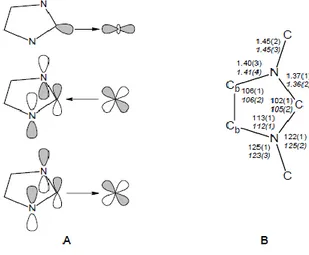
Studi più recenti hanno suggerito che i NHC sono specie elettronicamente flessibili, in quanto gli orbitali π e π* dell’anello possono contribuire alla formazione del legame M-NHC (Figura 1.12, A).32 Centri metallici carenti di elettroni possono quindi essere stabilizzati anche attraverso donazione di elettroni π dal legante.33
La struttura dell’anello a cinque membri subisce modifiche trascurabili in seguito alla coordinazione, come è stato dedotto dal confronto tra le strutture allo stato solido di NHC non coordinato e del corrispondente complesso metallico (Figura 1.12, B).34
Figura 1.12. Contributi di NHC al legame con il centro metallico (A) e confronto tra le medie delle
distanze (Å) e angoli di legame (°) di 13 esempi di NHC non coordinati e 156 complessi contenenti NHC.32,34
Sono stati effettuati numerosi studi per determinare l’energia di dissociazione del legame M-NHC in diversi sistemi, e valutare così il contributo al legame dato degli elettroni π.
Calcoli condotti su complessi NHC di metalli con configurazione elettronica d10, come per esempio Ni(NHC)(CO)2, hanno rivelato che gli elettroni π contribuiscono per più del 25% al legame M-NHC.35 In sintesi è possibile concludere che i leganti carbenici NHC hanno
32
J.C. Garrison, W.J. Youngs, Chem. Rev. 2005, 105, 3978. 33
L. Cavallo, A. Correa, C. Costabile, H. Jacobsen, J. Organomet. Chem. 2005, 690, 5407. 34
E. Baba, T.R. Cundari, I. Firkin, Inor.g. Chim. Acta 2005, 358, 2867. 35
14 proprietà coordinanti simili alle trialchilfosfine, ma i relativi complessi presentano un numero di vantaggi superiore rispetto ai corrispondenti complessi fosfinici, quali:
Elevata stabilità in condizioni drastiche (elevata temperatura e ambiente acido);
Buona stabilità in ambienti in cui le fosfine tendono ad ossidarsi;
Scarsa tendenza a dissociare (in genere, il legame M-NHC è piuttosto forte rispetto a quello M-fosforo).
1.3.2.
Complessi con leganti NHC di tipo chelante
Visto il successo ottenuto con l’uso di fosfine chelanti per la progettazione di complessi di metalli di transizione attivi in catalisi omogenea, sono stati intrapresi numerosi studi sulle proprietà dei corrispondenti leganti NHC chelanti. Inoltre, è da notare che la porzione di legante a ponte tra i due anelli eterociclici fornisce un ulteriore strumento per il controllo delle proprietà del complesso.
Como osservato per le fosfine, l’utilizzo di leganti NHC polidentati rende più stabile il complesso a causa dell’effetto chelante. Per esempio, il complesso A (Figura 1.13), contenente un legante NHC tridentato, può essere mantenuto a riflusso per 24 ore in dimetilacetammide (Teb = 165°C) all’aria, senza che si osservi decomposizione. Al contrario, il complesso B (Figura 1.13), contenente un legante NHC bidentato, decompone producendo Pd(0) dopo 8 ore nelle stesse condizioni sperimentali.36
Figura 1.13. Complessi di Pd con leganti NHC chelanti.
36
15
1.3.3. Complessi NHC di tipo “abnormal” (aNHC)
Per decenni è stato assunto che i NHC possano legarsi ai centri metallici attraverso l’atomo di carbonio carbenico (Figura 1.14, a). In realtà, sono stati sintetizzati complessi in cui tali leganti esibiscono una modalità di coordinazione inusuale: essa consiste nella formazione di legami M-C2 o M-C3, come risultato della migrazione intramolecolare di un atomo di idrogeno (Figura 1.14, b).
(a) (b)
Figura 1.14. Tipico legante NHC (a) e legante NHC “anormale” (b).
Nei complessi metallici contenenti leganti aNHC, il carbonio carbenico è relativamente più elettron-ricco in quanto risulta adiacente a un solo eteroatomo, a differenza di ciò che si osserva nei comuni NHC.37
Carbeni aNHC furono introdotti da Gründemann et al. nel 2001,38 i quali riportarono la reazione del complesso IrH5(PPh3)2 con un imidazolo funzionalizzato a dare il corrispondente complesso metallato (Figura 1.15).39
Figura 1.15. Sintesi di un complesso metallico contenente un legante aNHC.
37
(a) Y. Wang, Y. Xie, M.Y. Abraham, R.J. Gilliard Jr., P. Wei, C.F. Campana, H.F. Schaefer, P.v.R. Schleyer, G.H. Robinson, Angew. Chem., Int. Ed. 2012, 51, 10173.
(b) J. Zhang, J. Fu, X. Su, X. Qin, M. Zhaoa, M. Shi, Chem. Commun 2012, 48, 9625. 38
S. Gründemann, A. Kovacevic, M. Albrecht, J.W. Faller, R.H. Crabtree, Chem. Commun. 2001, 2274.
39
16 Carbeni aNHC sono migliori -donatori dei NHC e ciò ha portato a un notevole incremento dell’uso dei primi in reazioni di interesse catalitico, come per esempio l’idrogenazione di alcheni40 e i coupling di Heck e Suzuki-Miyuara.41
1.3.4. Complessi NHC di tipo “remote” (rNHC)
Questa tipologia costituisce una classe di carbeni scoperta recentemente, nella quale l’eteroatomo non è direttamente legato all’atomo di carbonio carbenico. Sebbene non sia stato isolato ancora alcun carbene rNHC in forma libera, sono stati preparati alcuni complessi42,43 mediante addizione ossidativa a centri metallici d10.
Due esempi di complessi metallici rNHC sono rappresentati in Figura 1.16.
Figura 1.16. Esempi di complessi rNHC.
40
M. Heckenroth, E. Kluser, A. Neels, M. Albrecht, Angew. Chem., Int. Ed. 2007, 46, 6293. 41
(a) X. Xu, B. Xu, Y. Li, S.H. Hong, Organometallics 2010, 29, 6343; (b) H. Lebel, M. Janes, A.B. Charette, S.P. Nolan, J. Am. Chem. Soc. 2004, 126, 5046.
42
O. Schuster, H.G. Raubenheimer, Inorg. Chem. 2006, 45, 7997. 43
S.K. Schneider, C.F. Rentzsch, A. Krueger, H.G. Raubenheimer, W.A. Herrmann, J. Mol. Catal. A
17
1.4. Metodi di sintesi
1.4.1. Sintesi di composti carbenici NHC
Allo scopo di sintetizzare complessi di metalli di transizione contenenti leganti NHC, è spesso necessario disporre preliminarmente del composto carbenico non coordinato. In generale, ciò è realizzabile seguendo tre diverse procedure che verranno descritte di seguito. Tali procedure valgono per composti carbenici basati su anelli saturi, insaturi e benzimidazoli.
Deprotonazione di sale di imidazolio
Schema 1.3. Preparazione di NHC per deprotonazione di un sale di imidazolio/imidazolinio.
La reazione, rappresentata nello Schema 1.3, può essere condotta mediante l’uso di varie basi e solventi. Le basi più comunemente utilizzate sono KOtBu o NaOMe. Nel caso in cui il sale di imidazolio contenga sostituenti sensibili alle basi sopracitate, è possibile utilizzare sec-BuLi o KN(SiMe3)2.44
In alternativa, il NHC può essere generato per aggiunta di NaH o KNH2 a una sospensione del sale di imidazolio in ammoniaca liquida.45 Questa tecnica, che permette di ottenere il NHC in pochi minuti, è particolarmente indicata per la deprotonazione di sali di diimidazolio.
Termolisi (α-eliminazione termica) di alcool o cloroformio
Talvolta, l’addizione a sali di imidazolio di basi quali KOt
Bu e NaOMe procede attraverso la formazione intermedia di un addotto (Schema 1.4),46 il quale genera carbeni NHC a
44
R.E. Douthwaite, D. Haussinger, M.L.H. Green, P.J. Silcock, P.T. Gomes, A.M. Martins, A.A. Danopoulos, Organometallics 1999, 18, 4584.
45
18 temperature più elevate, per perdita di alcol metilico e tert-butilico rispettivamente. Poiché il secondo stadio di reazione non richiede l’utilizzo di una base, questa procedura può essere utilizzata per preparare complessi in cui siano presenti centri acidi.
Schema 1.4. Sintesi di NHC per termolisi.
Desolforazione di imidazol-2-tiochetone
Come rappresentato dello Schema 1.5, è possibile preparare carbeni NHC in forma libera a partire da tiochetoni imidazolici. La desolforazione viene condotta mediante impiego di potassio.47
Schema 1.5. Desolforazione di imidazol-2-tiochetone.
1.4.2. Complessi metallici NHC
Sono state riportate varie strategie per la sintesi di composti di coordinazione contenenti carbeni NHC come leganti. La maggior parte di essi viene ottenuta per sostituzione al centro
46
T.M. Trnka, J.P. Morgan, M.S. Sanford, T.E. Wilhelm, M. Scholl, T.L. Choi, S.D. Ding, M.W. Day, R.H. Grubbs, J. Am. Chem. Soc. 2003, 125, 2546.
47
a) M.K. Denk, A. Thadani, K. Hatano, A.J. Lough, Angew. Chem. Int. Ed. 1997, 36, 2607; b) F.E. Hahn, L. Wittenbecher, R. Boese, D. Blaser, Chem.Eur. J. 1999, 5, 1931.
19 metallico di un legante con il carbene NHC; quest’ultimo può essere ottenuto utilizzando i metodi presentati nella sezione precedente.
In alternativa, il carbene può essere generato in situ per reazione del sale di imidazolio con un legante basico di un precursore metallico adatto. Uno dei primi esempi che illustra questa procedura fu riportato da Wanzlick nel 1968: egli descrisse la reazione di Hg(OAc)2 con un sale di imidazolio, che forniva il corrispondente complesso NHC di mercurio (Figura 1.17).13
Figura 1.17. Sintesi complesso NHC di mercurio.
Altre strategie di sintesi sono descritte di seguito:
Trasferimento dell’unità carbenica da un complesso di argento
Composti NHC a base di argento rappresentano una valida risorsa per la preparazione di numerosi complessi carbenici di metalli di transizione.48 Si ottiene un complesso di argento (I) per reazione di un sale di imidazolio con Ag2O o Ag2CO3, che agiscono come deprotonanti. Successivamente, il legante NHC è trasferito a un altro metallo di transizione, come mostrato nello Schema 1.6.
Più recentemente sono stati sviluppati altri agenti per reazioni di transmetallazione. Per esempio, sono stati ottenuti addotti imidazol-2-ilidene-BEt3 per reazione del corrispondente sale di imidazolio con LiHBEt3.49
48
J.C. Garrison, W.J. Youngs, Chem. Rev. 2005, 105, 3978. 49
Y. Yamaguchi, T. Kashiwabara, K. Ogata, Y. Miura, Y. Nakamura, K. Kobayashi, T. Ito, Chem. Commun. 2004, 2160.
20
Schema 1.6. Transmetallazione per la preparazione di complessi NHC.
Inserzione ossidativa
Intorno al 1970, furono riportate numerose sintesi di complessi carbenici N,S- e N,O-eterociclici mediante addizione ossidativa di legami C−Cl a centri di Ir, Pd, Pt, Ni (Schema 1.7).50,51
Schema 1.7. Inserzione ossidativa di un complesso zerovalente in un legame C-X.
1.5. Applicazioni
Complessi metallici contenenti leganti carbenici N- eterociclici trovano applicazione in diversi settori.
In campo farmacologico, alcuni di questi composti sono noti per le loro proprietà antibiotiche ed antitumorali. Sono stati riscontrati risultati positivi in studi svolti su complessi di Ag(I)-NHC: questi sono attivi nei confronti di cellule tumorali ovariche, uterine o del seno.52 Anche complessi di Au(I) e Au(III) con leganti NHC hanno mostrato proprietà citotossiche nei
50
P.J. Fraser, W.R. Roper, F.G.A. Stone, J. Chem. Soc. Dalton Trans. 1974, 102. 51
A. Furstner, G. Seidel, D. Kremzow, C. W. Lehmann, Organometallics 2003, 22, 907. 52
D.A. Medvetz, K.M. Hindi, M.J. Panzner, A.J. Ditto, Y.H. Yun, W.J. Youngs, Met. Based Drugs
21 confronti di alcune linee cellulari, inibendo la crescita delle cellule tumorali ma non di quelle sane.53
Complessi di metalli di transizione contenenti NHC hanno trovato impiego in reazioni catalitiche in fase omogenea; generalmente, il legante NHC è semplice “spettatore” nel corso del processo. I primi esempi di successo in questo senso includono l’uso di complessi del tipo PdX2(NHC)2 nella reazione di Heck,54 di Rh(NHC)(COD)Cl nell’idrosilazione di alcheni,55 [Pd(NHC)(MeCN)2]2+ nella copolimerizzazione di CO/etilene,56 Ru(NHC)2Cl2(=CHPh) in reazioni di metatesi di olefine.57
1.6. Alogenuri di niobio e tantalio
I pentaalogenuri di niobio e tantalio, MX5 (M = Nb, Ta; X = F, Cl, Br, I), si presentano allo stato solido, così come in solventi non coordinanti, con struttura in cui l’atomo metallico è circondato da un ottaedro distorto di atomi di alogeno, di cui due sono condivisi con uno o più centri metallici. In particolare, MX5 (X = Cl, Br, I) sono dinucleari, mentre MF5 hanno struttura tetranucleare (Figura 1.18).
(a) (b)
Figura 1.18. Struttura molecolare di MX5 [(a) X = F; (b) X = Cl, Br, I].
53
P.J. Barnard, S.J. Berners-Price, Coord. Chem. Rev. 2007, 251, 1889. 54
W.A. Herrmann, M. Elison, J. Fischer, C. Kocher, G.R.J. Artus, Angew. Chem. Int. Ed. 1995,34, 2371.
55
J.E. Hill, T.A. Nile, J. Organomet. Chem. 1977, 137, 293. 56
M.G. Gardiner, W. A. Herrmann, C.P. Reisinger, J. Schwarz, M. Spiegler, J. Organomet. Chem.
1999, 572, 239.
57
T. Weskamp, W.C. Schattenmann, M. Spiegler, W.A. Herrmann, Angew. Chem. Int. Ed. 1998, 37, 2490.
22 La chimica di MX5 non è stata esplorata in modo estensivo in passato: questo fatto probabilmente è dovuto alla notevole ossofilicità di questi composti che determina, tra l’altro, difficoltà di conservazione e manipolazione dovute alla elevata sensibilità all’umidità dell’aria.
Ciononostante, l’uso di MX5 (M = Nb, Ta; X = F, Cl, Br) in sintesi organica è cresciuto negli ultimi anni grazie al loro impiego come promotori in varie reazioni di sintesi organica.58,59 Lo sviluppo di processi catalizzati da specie a base di niobio e tantalio è auspicabile anche sulla base del fatto che questi elementi metallici sono considerati sostanzialmente biocompatibili;60 a questo proposito, vi è da dire che essi sono utilizzati in campo biomedico per la costruzione di protesi e materiale chirurgico.60a
Inoltre, le prestazioni catalitiche mostrate da MX5 sono in alcuni casi singolari e più interessanti rispetto a quelle fornite, per esempio, dai tetraalogenuri degli elementi del gruppo 4, la cui chimica è stata molto più sviluppata.61
Per esempio, è possibile sintetizzare ciclopropani per addizione selettiva di alliltrimetilsilano ed aldeidi (reazione di Sakurai), utilizzando NbCl5 oppure tetracloruri di elementi del gruppo 4. Come mostrato nello schema 1.8, l’impiego di NbCl5 permette di migliorare sensibilmente la selettività del processo.62
58
F. Marchetti, G. Pampaloni, Chem. Commun. 2012, 48, 635. 59
V. Larcerda, D.A. Dos Santos, L.C. Silva-Filho, S.J. Greco, R.B. dos Santos, Aldrichimica Acta
2012, 45, 19.
60
(a) P.F. Gostin, A. Helth, A. Voss, R. Sueptitz, M. Calin, J. Eckert, A. Gebert, J. Biomed. Res. Part B: Appl. Biomater. 2013, 101B, 269; (b) V.D. Cojocaru, D. Raducanu, D.M. Gordin, I. Cinca, J. Alloy Compds. 2013, 246, 260; (c) I. Jirka, M. Vandovcová, O. Frank, Z. Tolde, J. Plšek, T. Luxbacher, L. Bačáková, V. Stary, Mat. Sci. Eng. 2013, C33, 1636; (d) S. Minagar, C.C. Berndt, J. Wang, E. Ivanova, C. Wen, Acta Biomater. 2012, 8, 2875; (e) M. Niinomi, M. Nakai, J. Hieda, Acta Biomater. 2012, 8, 3888; (f) A. Zieliński, S. Sobieszczyk, T. Seramak, W. Serbiński, B. Swieczko-Żurek, A. Ossowska, Adv. Mat. Sci. 2010, 10, 21; (g) G. Maccauro, P. Rossi Iommetti, F. Muratori, L. Raffaelli, F. Manicone, C. Fabbriciani, Rec. Pat. Biotechnol. 2009, 3, 157; (h) T. Miyazaki, J. Ceramic Soc. Jpn. 2008, 116, 260.
61
Q. Guo, T. Miyaji, R. Hara, B. Shen, T. Takahashi, Tetrahedron, 2002, 58, 7327. 62
H. Maeta, T. Nagasawa, H. Yasuhiko, T. Takei, O. Yoshihiro, O.; K. Suzuki, Tethraedron Lett. 1995, 36, 899.
23
Schema 1.8. Reazione di Sakurai promossa da cloruri di elementi del gruppo 4 o da NbCl5.
Un altro esempio è dato dalla reazione tra epossidi e anidride carbonica, che porta alla formazione di carbonati ciclici,63 come carbonato di propilene o etilene (Schema 1.9), i quali trovano numerose applicazioni in ambito industriale. La reazione è stata studiata utilizzando diversi sistemi catalitici costituiti da alogenuri di metalli di transizione dei gruppi 4-6, in combinazione con un cocatalizzatore nucleofilo quale N,N-dimetilamminopiridina (DMAP). Il catalizzatore più attivo risulta il sistema NbCl5/DMAP, con il quale si raggiungono rese di conversione e velocità molto elevate, specialmente in confronto al sistema TiCl4/DMAP.
Schema 1.9. Formazione di carbonato di propilene da CO2 e ossido di propilene.
Nel laboratorio di ricerca nel quale ho svolto il mio lavoro di Tesi, da alcuni anni è in corso uno studio sulla chimica di coordinazione dei pentaalogenuri di niobio e tantalio, allo scopo di migliorare le conoscenze riguardo la reattività di questi composti e, quindi, di sviluppare i processi catalitici relativi.58 Alcuni risultati forniti da questo studio sono presentati di seguito.
63
A. Monassier, V. D’Elia, M. Cokoja, H. Dong, J. D. A. Pelletier, J.M. Basset, F.E. Kühn, Chem. Eur. J. 2013, 5, 1321. MXn 1 2 TiCl4 tracce 91% ZrCl4 47% 35% HfCl4 48% 28% NbCl5 74% 0%
24 La reazione di MCl5 con 1,2-dimetossietano (DME) a temperatura ambiente porta alla formazione di 1,4-diossano e della specie MOCl3(DME) (Schema 1.10).64
È da sottolineare il fatto che la formazione di diossano è il risultato sia della attivazione multipla di legami C−O nella molecola di DME, sia della formazione di nuovi legami C−O; generalmente, la possibile attivazione di eteri e dieteri da parte di alogenuri metallici si limita alla rottura di uno o due legami C−O, e non comporta un successivo accoppiamento.
Schema 1.10. Reazione di MCl5 con DME a T = 25°C.
I pentafluoruri di MF5 sono in grado di ossidare areni monociclici, generando così i corrispondenti radicali-cationi (Schema 1.11).65
Schema 1.11. Generazione di radicali-cationi da MF5 (M = Nb, Ta) e Arene [Arene = 1,4-(OMe)2C6H4, 1,4-F2-2,5-(OMe)2C6H2, 1,4-C6H4Me2, C6H5F, C6H5NO2, toluene, benzene].
Le specie radicaliche ottenute sono sorprendentemente inerti, se paragonate a sali contenenti gli stessi cationi precedentemente riportati.66 L’inerzia è una conseguenza della grande stabilità dell’anione a base di niobio o tantalio; essa ha permesso, tra l’altro, di registrare per
64
F. Marchetti, G. Pampaloni, S. Zacchini, Chem. Commun. 2008, 31, 3651. 65
a) F. Marchetti, G. Pampaloni, C. Pinzino, S. Zacchini, Angew. Chem. Int. Ed. 2010, 49, 5268. b) F. Marchetti, G. Pampaloni, C. Pinzino, Chem. Eur. J. 2013, in press.
66
a) L. Eberson, M.P. Hartshorn, F. Radner, O. Persson, J. Chem. Soc. Perkin Trans. 2 1998, 59; b) B. Fabre, K. Michelet, N. Simonet, J. Simonet, J. Electroanal. Chem. 1997, 425, 67; c) Y. Kita, H. Tohma, K. Hatanaka, T. Takada, S. Fujita, S. Mitoh, H. Sakurai, S. Oka, J. Am. Chem. Soc. 1994, 116, 3684; d) A. Niskenaga, H. Hayashi, T. Matsuura, Chem. Lett. 1973, 141; f) W.F. Forbes, P.D. Sullivan, H.M. Wang, J. Am. Chem. Soc. 1967, 89, 2705.
25 la prima volta lo spettro EPR del radicale-catione del benzene in un comune solvente organico a temperatura ambiente. 67
Gli studi svolti hanno portato ad evidenziare anche buone prestazioni catalitiche di semplici derivati di MX5 in reazioni di polimerizzazione di alcheni68 o di eteri ciclici.67
1.7. Scopo della Tesi
Sulla base di quanto descritto nei paragrafi precedenti, si può affermare che la chimica di coordinazione di leganti carbenici N-eterociclici è relativamente recente e ha conosciuto una crescita impressionante a partire dai primi anni novanta.
D’altra parte, la chimica dei pentaalogenuri di niobio e tantalio risulta interessante e ancora relativamente poco esplorata: una chiara razionalizzazione della reattività di queste specie metalliche porterebbe a numerosi vantaggi per quanto riguarda le possibili applicazioni. In considerazione del fatto che la coordinazione di un legante NHC potrebbe conferire a MX5 (M = Nb, Ta) proprietà particolari e ben diverse da quelle del pentacloruro stesso, in questo lavoro di Tesi è stato intrapreso uno studio sulla reattività di carbeni NHC con pentaalogenuri di niobio.
A questo proposito, è da citare la recente preparazione del composto di vanadio(V) VOCl3(NHC) per reazione di 1,3-bis-{2,4,6-trimetilfenil}imidazol-2-ilidene con VOCl3. Il prodotto rimane invariato dopo oltre due mesi a contatto con l’aria, sia allo stato solido sia in soluzione di diclorometano.69 Questo comportamento è nettamente diverso da quello del precursore VOCl3, il quale è velocemente idrolizzato in presenza di tracce di acqua.
Lo studio è stato esteso anche a pentaalogenuri di tantalio e molibdeno in alto stato di ossidazione, isostrutturali con i corrispondenti alogenuri di niobio, e ad alogenuri di Nb(III).
67
F. Marchetti, G. Pampaloni, T. Repo, Eur. J. Inorg. Chem. 2008, 12, 2107. 68
F. Marchetti, G. Pampaloni, Y. Patil, A.M. Raspolli Galletti, S. Zacchini, J. Pol. Sci. A Pol. Chem.
2011, 49, 1664.
69
26
2. RISULTATI E DISCUSSIONE
2.1. Sintesi di derivati di NbCl
5con leganti carbenici
Seguendo la procedura nota in letteratura,70 sono stati sintetizzati alcuni leganti carbenici NHC stabili, a partire da reagenti commerciali.
Il primo stadio della procedura prevede il trattamento di etandiale con una opportuna anilina sostituita in rapporto molare 1 : 2, in soluzione di metanolo/acido acetico. Si ottiene così un derivato 1,4-diazadiene (Schema 2.1, a) che è stato sciolto in acetato di etile e trattato con una quantità stechiometrica di formaldeide e trimetilsililcloruro, per dare il corrispondente sale di imidazolio (Schema 2.1, b). L’uso di una base forte (KOtBu) come agente di deprotonazione ha permesso infine di ottenere il composto carbenico NHC desiderato (Schema 2.1, c).
70
27
Schema 2.1. Sintesi dei leganti carbenici utilizzati in questo lavoro di Tesi (R = 2,6-iPr; 2,4,6-Me; 2,6-Me).
In generale, i pentaalogenuri dinucleari di niobio e tantalio (MX5, X = Cl e Br) hanno tendenza a reagire con una grande varietà di molecole leganti (L) per dare complessi ottaedrici stabili di formula MX5L.58,71 In considerazione di ciò, sono state provate inizialmente le reazioni di NbCl5 con i composti carbenici NHC, impiegando un rapporto molare 1 : 1; dopo una serie di prove, sono state ottimizzate le condizioni di reazione (temperatura ambiente, solvente toluene). I prodotti NbCl5(NHC), 2a-c (Schema 2.2), sono stati isolati allo stato solido dalle rispettive miscele di reazione, in rese variabili tra 50 e 75%. La formazione di 2a-c è il risultato della rottura simmetrica della struttura dinucleare di NbCl5.
Schema 2.2. Sintesi di derivati di NbCl5 contenenti leganti NHC.
71
a) F. Marchetti, G. Pampaloni, S. Zacchini, Eur. J. Inorg. Chem., 2008, 3, 453; b) F. Marchetti, G. Pampaloni, S. Zacchini, Dalton Trans. 2007, 38, 4343.
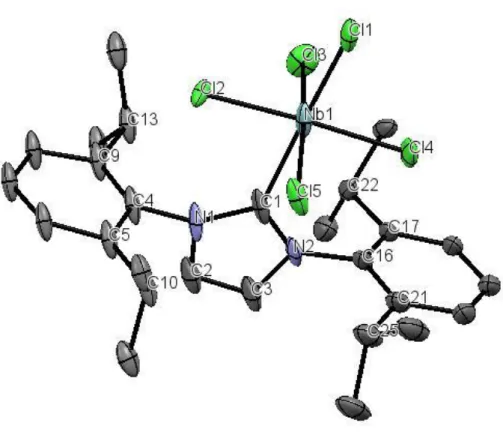
28 I composti 2a-c sono stati caratterizzati mediante spettroscopia IR e NMR (1H, 13C, 93Nb), e analisi del contenuto di cloro. Le attribuzioni dei segnali 1H e 13C NMR sono state confermate da esperimenti 2D NMR (HSQC, HMBC). Inoltre, la struttura molecolare di 2a è stata determinata tramite diffrazione di raggi X su cristallo singolo; la struttura è rappresentata in Figura 2.1, mentre i principali parametri geometrici sono riportati in Tabella 2.1.
29 Distanze (Å) Angoli (°) Nb(1)−Cl(1) 2.363(4) C(1)−Nb(1)−Cl(1) 178.7(3) Nb(1)−Cl(2) 2.235(5) C(1)−Nb(1)−Cl(2) 86.5(5) Nb(1)−Cl(3) 2.336(3) C(1)−Nb(1)−Cl(4) 91.2(3) Nb(1)−Cl(4) 2.304(3) Cl(1)−Nb(1)−Cl(2) 94.8(4) Nb(1)−Cl(5) 2.326(3) Cl(1)−Nb(1)−Cl(4) 87.54(12) Nb(1)−C(1) 2.397(13) Cl(3)−Nb(1)−Cl(5) 167.96(14) N(1)−C(1) 1.389(12) Cl(2)−Nb(1)−Cl(4) 177.1(5) N(1)−C(2) 1.365(17) C(1)−N(1)−C(4) 139.6(15) N(1)−C(4) 1.500(17) C(1)−N(2)−C(16) 132.0(10) N(2)−C(3) 1.372(16) C(4)−C(5)−C(10) 124.9(15) N(2)−C(1) 1.345(16) C(4)−C(9)−C(13) 121.1(18) N(2)−C(16) 1.448(13) C(16)−C(17)−C(22) 122.9(9) C(2)−C(3) 1.328(18) C(16)−C(21)−C(25) 122.6(12) Cl(2)C(1) 3.17(2) N(1)−C(1)−N(2) 104.0(11) Cl(2)N(1) 3.32(2) Nb(1)−C(1)−N(2)−C(16) 4.2(15) Cl(4)C(1) 3.36(1) Nb(1)−C(1)−N(1)−C(4) 11(2) Cl(4)N(2) 3.502(9) Cl(4)−Nb(1)−C(1)–N(2) −1.6(8) Cl(3)C(1) 3.19(1) Cl(5)C(1) 3.14(1)
Tabella 2.1. Principali distanze (Å) e angoli di legame (°) nel complesso 2a.
La coordinazione attorno al centro metallico è approssimativamente ottaedrica, con il niobio che giace al di fuori del piano individuato approssimativamente dagli atomi di cloro equatoriali [Cl(3)−Nb(1)−Cl(5) = 167.96°; Cl(2)−Nb(1)−Cl(4) = 177.1°], allontanandosi dal legante carbenico. Una situazione analoga è stata riscontrata nelle strutture di altri composti ottaedrici del tipo NbCl5(L), L = molecola organica.71b,72 Per esempio in NbCl5 (1,4-diossano)72a gli angoli corrispondenti a Cl(2)−Nb(1)−Cl(3) e Cl(5)−Nb(1)−Cl(6) valgono rispettivamente 171.81(5)° e 167.72(5)°.
Le lunghezze di legame relative all’anello imidazolico, in 2a, sono compatibili con quelle riportate per IPr coordinato in complessi di metalli di transizione.73,74
La distanza Nb(1)−C(1) [2.397(13) Å] è significativamente maggiore rispetto a quanto tipicamente riscontrato in composti alchilidenici di Nb(V). Per esempio, nel complesso cicloesilidenico (silox)3NbC6H10 (silox = tBu3SiO), la distanza Nb−C risulta pari a 1.976(10)
72
a) F. Marchetti, G. Pampaloni, S. Zacchini, Inorg. Chem. 2008, 47, 365; b) F. Marchetti, G. Pampaloni, S. Zacchini, Eur. J. Inorg. Chem. 2010, 5, 767.
73
C. Dash, A. Das, M. Yousufuddin, H. V. Rasika Dias, Inorg Chem 2013, 52, 1584. 74
30 Å.75 Si può dunque concludere che l’unità carbenica in 2a abbia carattere prevalente di legame singolo, in analogia con i classici metallo-carbeni di Fischer.76 La distanza Nb(1)−C(1) in 2a è addirittura maggiore delle tipiche lunghezze di legame Nb(V)-alchile:77 per esempio, nel complesso NbCl2Me3, Nb−C risulta pari a 2.133(5) Å.77a La lunghezza anomala della interazione NbC in 2a potrebbe essere una conseguenza di effetti di ingombro sterico; la presenza di quattro atomi di cloro in posizione equatoriale ostacola presumibilmente l’interazione tra il centro metallico e il legante NHC, già ingombrato dagli anelli aromatici sostituiti.
Inoltre, è da notare che la distanza Nb(1)−Cl(2) [2.235(5) Å]risulta più corta rispetto alle altre distanze di legame NbCl(equatoriale). Inoltre, Cl(2) si trova a una distanza dal carbonio carbenico [3.17(2) Å] inferiore alla somma dei raggi di van der Waals di carbonio e cloro [3.45 Å];78 analoghe considerazioni possono essere valide anche per le distanze CCl(3) e CCl(5).
La principale conseguenza dell’avvicinamento di Cl(2) al carbonio carbenico è una tensione a cui è sottoposto l’anello benzenico adiacente. Infatti, dalla Figura 2.2a si può osservare che l’angolo C(1)−N(1)−C(4) [139.6(15)°] supera abbondantemente il valore teorico di 120°. Una analoga situazione si ha a causa dell’effetto sterico esercitato da Cl(4) sull’anello adiacente, tuttavia in questo caso la tensione é più contenuta (C(1)−N(2)−C(16) = 132.0(10)°). Inoltre, come evidenziato in Figura 2.2b, è presente una leggera torsione dell’anello imidazolico: infatti, l’angolo diedro Cl(4)−Nb(1)−C(1)–N(2) misura −1.6(8)°.
75
K.F. Hirsekorn, A.S. Veige, M.P. Marshak, Y. Koldobskaya, P.T. Wolczanski, T.R. Cundari,E.B. Lobkovsky, J. Am. Chem. Soc. 2005, 127, 4809.
76
R.H. Crabtree, The organometallic chemistry of the transition metals 2005, Fourth Ed. 77
(a) G.S. McGrady, A. Haaland, H.P. Verne, H.V. Volden, A.J. Downs , D. Shorokhov, G. Eickerling, W. Scherer, Chem. Eur. J. 2005, 11, 4921; (b) N.C. Tomson, J. Arnold, R.G. Bergman, Organometallics 2010, 29, 13; (c) M. Schormann, S.P. Varkey, H.W. Roesky, M. Noltemeyer, J. Organomet. Chem. 2001 621, 310.
78
31
(a) (b)
Figura 2.2. Rappresentazioni del complesso 2a.
Una possibile spiegazione del fatto che alcune distanze CCl risultano inferiori alla somma dei raggi di van der Waals è che si stabilisca una qualche interazione interlegame.
Tali interazioni potrebbero essere ricondotte a una forma di retrodonazione π di densità elettronica da parte degli atomi di cloro all’orbitale p vuoto del carbonio carbenico (il centro di Nb(V) é privo di elettroni nel guscio esterno). Interazioni di questo tipo si pensa siano presenti nei complessi di metalli d(0) VOCl3(IMes)69 e TiCl4(IPr)2 (Figura 2.3 e Tabella 2.2).74 Occorre tenere presente che proprio a questo aspetto é stata attribuita la relativa stabilità all’aria del composto carbenico di vanadio rispetto al precursore VOCl3.
32 (b)
Figura 2.3. Strutture allo stato solido (raggi X) di (a) VOCl3(IMes) e (b) TiCl4(IPr)2.
Distanze (Å) NbCl5(IPr) (2a) VOCl3(IMes) TiCl4(IPr)2
C(1)-Cl(1) 2.849(2) 2.907(5) C(1)-Cl(2) 3.17(2) 3.013(5) C(1)-Cl(3) 3.19(1) 2.887(2) C(1)-Cl(4) 3.36(1) C(1)-Cl(5) 3.14(1) M(1)-C(1) 2.397(13) 2.136(2) 2.198(6) M(1)-Cl(eq)(medio) 2.313 2.224 2.249
Tabella 2.2. Confronto distanze C−Cl (Å) nei complessi 2a, VOCl3(IMes), TiCl4(IPr)2.
Allo scopo di capire se l’avvicinamento dei leganti cloruro al centro carbenico, in 2a, sia dovuto effettivamente a una qualche interazione C−Cl, oppure sia il risultato di fattori sterici e/o di impaccamento, sono stati effettuati calcoli DFT. Questi hanno permesso di ottimizzare la struttura più stabile per il composto 2a in toluene, utilizzando i software Spartan 08 e Dmol3 (Figura 2.4) che hanno fornito risultati compatibili. La struttura di 2a calcolata è rappresentata in Figura 2.3.
33
Figura 2.4. Struttura calcolata del composto 2a.
La struttura di minima energia per il composto 2a è in accordo con la struttura ricavata sperimentalmente. Dai dati computazionali, si evince che il legame Nb−C è essenzialmente il risultato di una donazione di tipo dall’atomo di carbonio all’orbitale dz2 del niobio.
L’orbitale molecolare in questione coinvolge anche il legame Nb−Cl in posizione trans rispetto al carbonio (Figura 2.5).
Figura 2.5. Rappresentazione dell’orbitale molecolare alla base dell’interazione Nb−C (superfici corrispondenti a 0.032 a.u.).
34 Al fine di valutare l’impatto dei sostituenti isopropilici sull’ingombro sterico degli anelli aromatici, è stata ottimizzata la struttura del complesso (non ottenuto sperimentalmente)
NbCl5[CN(Ph)CHCHN(Ph)] (Figura 2.6). I principali parametri geometrici calcolati per 2a e
NbCl5[CN(Ph)CHCHN(Ph)] sono confrontati in Tabella 2.3.
35
2a calcolata NbCl5[CN(Ph)CHCHN(Ph)] calcolata
EDF2 PBE EDF2 PBE
Nb−C 2.442 2.344 Nb−C 2.422 2.354 Nb−Clax 2.352 2.425 Nb−Clax 2.341 2.385 Nb−Cl || NHC 2.346 2.350 Nb−Cl || NHC 2.348 2.365 2.348 2.373 2.50 2.371 Nb−Cl NHC 2.364 2.380 Nb−Cl NHC 2.366 2.366 2.368 2.383 2.367 2.378 C−Nb−Clax 178.4 175.0 C−Nb−Clax 179.4 179.2 C−Nb−Cleq (Cl NHC) 90.4 91.2 C−Nb−Cleq (Cl NHC) 88.8 89.7 91.8 92.7 89.4 90.7 C−Nb−Cleq (Cl NHC) 80.7 80.8 C−Nb−Cleq (Cl NHC) 82.2 83.6 82.7 86.7 82.5 83.8 C−N 1.370 1.375 C−N 1.367 1.375 1.370 1.377 1.367 1.375 N−C−N 103.3 103.1 N−C−N 103.2 103.1 N−N−Cleq−Cl eq || NHC 1.1 1.6 N−N−Cleq−Cl eq || NHC 24.9 25.8
Tabella 2.3. Principali distanze (Å) e angoli di legame (°) calcolati per 2a e
NbCl5(CN(Ph)CHCHN(Ph)).
Come si nota dai dati strutturali riportati in Tabella 2.3, la formale rimozione dei sostituenti isopropilici determina una rotazione del frammento NbCl5 rispetto al piano del legante organico di circa 24°. Tuttavia, la variazione della distanza Nb−C nei due casi è contenuta. Nel caso di 2a, è stato individuato un possibile orbitale molecolare responsabile dell’interazione di tipo π (Figura 2.6); esso si estende sia sui leganti Cl posti in cis a C e perpendicolari al piano dell’anello NHC, sia sul legante Cl in trans a C. A tale orbitale molecolare contribuisce scarsamente il sistema π del carbene eterociclico; questa interazione risulta praticamente assente nel sistema privo di isopropili, probabilmente perché la rotazione attorno all’asse Nb−C del frammento NbCl5 impedisce una significativa sovrapposizione degli orbitali dei Cl con quelli del legante NHC (Figura 2.7).
36
Figura 2.7. Rappresentazione dell’orbitale molecolare alla base dell’interazione π Nb−C in 2a e in
NbCl5[CN(Ph)CHCHN(Ph)] (superfici corrispondenti a 0.032 a.u.).
Le distanze di legame non subiscono sostanziali variazioni a causa della assenza di interazione π in NbCl5[
CN(Ph)CHCHN(Ph)
], rispetto a 2a; questo risultato suggerisce che l’interazione di legame Nb-NHC, in 2a, è essenzialmente di tipo . Ciò comporta una lacuna elettronica sull’atomo di carbonio carbenico, evidenziata dalla funzione di Fukui f+(r) (Figura 2.8) come regione privilegiata per un potenziale attacco nucleofilo. La carica elettronica che viene a mancare su tale atomo è compensata dalla condivisione dei doppietti degli atomi di azoto che, insieme al doppio legame C=C, costituiscono un sistema pseudo-aromatico.37 In sintesi, calcoli DFT hanno suggerito che il legame del frammento NHC a NbCl5 è privo della componente di retrodonazione π, coerentemente con la lunga distanza NbC osservata sperimentalmente. D’altra parte, interazioni π sono state osservate, sebbene in misura limitata, in cloro-complessi a base di elementi metallici in elevato stato di ossidazione. Inoltre, i calcoli indicano che la presenza dei sostituenti isopropilici sugli anelli aromatici non costituisce un fattore determinante tale da impedire l’avvicinamento del legante al centro metallico. Piuttosto, il legame è ostacolato dai Cl equatoriali, le cui orientazioni spaziali sembrano la conseguenza di motivi sterici.
L’identità di 2a-c è stata confermata dalle analisi del contenuto di cloro (v. parte sperimentale) e da spettroscopia IR e NMR. L’aspetto saliente degli spettri IR (stato solido) di 2a-c è l’assenza degli assorbimenti C−H (a circa 2750 cm-1) e C=N (a circa 1670 cm-1). Il primo di questi è chiaramente riscontrato nei sali di imidazolio precursori, come per esempio IPr·HCl (Figura 2.9, a), mentre il secondo è caratteristico della specie carbenica non coordinata (Figura 2.9, b).
38
Figura 2.9. (b) Spettro IR di IPr allo stato solido.
I composti 2a-c, una volta isolati allo stato solido, presentano una scarsa solubilità in solventi non clorurati (es. benzene, toluene), e risultano molto sensibili a tracce di acqua in solventi più polari (cloroformio, diclorometano, tetraidrofurano, acetone, acetonitrile).
Pertanto, gli spettri NMR di 2a-c sono stati registrati sulle rispettive miscele di reazione in C6D6 (vedi parte sperimentale per i dettagli). Tali spettri mostrano un unico set di risonanze ed evidenziano la elevata selettività della reazione tra NbCl5 e il composto NHC. Inoltre, essi sono coerenti con la struttura molecolare ricavata allo stato solido per 2a. Nel caso di 2a, i protoni dei gruppi metilici dei sostituenti isopropile risuonano come doppietti a 1.53 e 1.04 ppm. Questo fatto indica che la rotazione di tali sostituenti è inibita in soluzione, analogamente a quanto riscontrato in IPr e IPr·HCl. I nuclei CH dell’anello eterociclico in genere risuonano a frequenze più alte rispetto ai corrispondenti segnali nel carbene libero. Lo stesso andamento è stato osservato anche per il complesso VOCl3(IMes) in soluzione di CDCl3.69
Non è stato possibile osservare la risonanza del carbonio carbenico, probabilmente a causa degli effetti dovuti all’adiacente nucleo di niobio. D’altra parte, gli spettri 93
Nb di 2a-c mostrano una sola risonanza anche se piuttosto allargata (per esempio nel caso di 2a a 320 ppm), che conferma la natura mononucleare dei complessi in soluzione.
Il complesso 2a è il primo composto a base di niobio, contenente un legante NHC monodentato, che sia mai stato caratterizzato strutturalmente. L’unico precedente simile,
39 riportato nel 2006, fu la struttura di un derivato di Nb(IV) coordinato a un legante di tipo “pincer”, costituito da due unità NHC e una unità amminica (Figura 2.10).79
Figura 2.10. Struttura determinata mediante diffrazione di raggi X di un complesso “pincer” di
Nb(IV).
In generale, la serie di complessi NHC di metalli in alto stato di ossidazione ( 5), caratterizzati per via cristallografica, è limitata a pochi casi.69,80
Allo scopo di individuare eventuali intermedi, la reazione di sintesi di 2a è stata condotta anche alla temperatura di 70 °C, in toluene deuterato. L’analisi NMR sulla miscela di reazione ha evidenziato la formazione di una miscela di prodotti non identificati. La soluzione ottenuta è stata riscaldata per 24 ore a 80 °C; la successiva analisi NMR ha mostrato la formazione selettiva di 2a. Questo esperimento suggerisce che la reazione a bassa temperatura di NbCl5 con le specie carbeniche oggetto di studio possa determinare la formazione di più prodotti cinetici, che quindi convertono, a temperatura più elevata, nella specie
79
D. Pugh, J.A. Wright, S. Freeman, A.A. Danopoulos, Dalton Trans. 2006, 6, 775; 80
a) C.A. Dodds, M.D. Spicer, T. Tuttle, Organometallics 2011, 30, 6262; b) Braband, H.; Abram, U. Chem. Commun. 2003, 2436; c) H. Braband, T.I. Zahn, U. Abram, Inorg. Chem. 2003, 42, 6160; d) B. Royo, E. Herdtweck, C.C. Rom o, Eur. J. Inorg. Chem. 2004, 3305.
40 termodinamicamente più stabile. Quest’ultima può essere ottenuta direttamente svolgendo la reazione a temperatura ambiente.
I risultati finora presentati indicano quindi che è possibile ottenere complessi carbenici mononucleari per reazione diretta tra NbCl5 e una specie carbenica. Allo scopo di valutare la possibilità di strategie sintetiche alternative, è stato preparato il complesso mononucleare NbCl5(NCMe) per trattamento di NbCl5 con MeCN in CH2Cl2.81 Questo complesso, già descritto in letteratura, è stato isolato come solido giallo intenso. La successiva reazione di NbCl5(NCMe) con IPr, IXy e IMes, in toluene a temperatura ambiente, porta alla formazione di 2a-c (Schema 2.3). Questo risultato, che può rappresentare una via alternativa alla sintesi dei derivati carbenici sopra descritti, suggerisce la maggiore affinità del centro di Nb(V) per il legante carbenico piuttosto che per il legante N-donatore.
Schema 2.3. Possibili vie di sintesi di complessi NHC di NbCl5: a partire da NbCl5 (dinucleare) o da NbCl5(NCMe) (mononucleare).
2.1.1. Prove preliminari di catalisi
E’ stato recentemente dimostrato che semplici derivati mononucleari di NbCl5, aventi formula NbCl5(L) (L = legante organico neutro), possono essere impiegati efficacemente come precursori catalitici in reazioni di polimerizzazione di alcheni.68 Le prestazioni fornite da NbCl5(L) risultano, in genere, di gran lunga superiori rispetto a quelle del precursore NbCl5, e tra le migliori nell’ambito di quanto riportato in letteratura per composti a base di niobio.82 Al fine di dare una valutazione preliminare sul possibile effetto di un legante NHC sulle prestazioni catalitiche del derivato di NbCl5, é stata effettuata una reazione di
81
G.R. Willey, T.J. Woodman, M.G.B. Drew, Polyhedron 1997, 16, 351. 82
41 polimerizzazione di etilene (C2H4) utilizzando il nuovo complesso 2a come precursore catalitico. Le condizioni sperimentali sono quelle ottimizzate in precedenti lavori per reazioni analoghe;68 esse prevedono, tra l’altro, l’impiego di DMAO come cocatalizzatore (v. parte sperimentale per i dettagli). L’attività ottenuta (178 Kg·mol1 ·h1·bar1) supera di due ordini di grandezza quella di NbCl5 (9 Kg·mol1·h1·bar1) e di poco i migliori risultati ottenuti precedentemente con complessi analoghi.
42
2.2. Sintesi di derivati di MX
5con leganti carbenici (M = Nb, X = F,
Br; M = Ta, X = F, Cl)
I risultati positivi ottenuti per la sintesi di complessi carbenici a partire da NbCl5 hanno incoraggiato l’estensione di questo studio al corrispondente alogenuro di tantalio, TaCl5, e agli altri pentaalogenuri di niobio. Tutte le reazioni sono state effettuate utilizzando condizioni sperimentali analoghe a quelle ottimali impiegate per la preparazione dei complessi 2a-c.
La reazione di TaCl5 con IPr in C6D6 (Schema 2.4) ha portato alla formazione di una miscela di colore rosso scuro. L’analisi NMR della miscela ha permesso di evidenziare la formazione selettiva del composto 2d e di chiarire completamente la sua natura.
Gli spettri IR e NMR di 2d presentano caratteristiche analoghe a quelle degli spettri ottenuti per NbCl5(IPr), 2a; inoltre, è stato possibile osservare la risonanza relativa al carbonio carbenico, a 190.0 ppm. MX5 R R’ Prodotto TaCl5 iPr H 2d NbBr5 iPr H 3a NbBr5 Me H 3b TaBr5 iPr H 3c NbF5 Me Me 4a
Schema 2.4.Sintesi di derivati di pentaalogenuri di niobio e tantalio contenenti leganti NHC.
Si suppone che la specie 2d possieda struttura mononucleare analoga a quella descritta per 2a, sulla base della analoga reattività che i pentaalogenuri di tantalio manifestano, in genere, rispetto alle corrispondenti specie a base di niobio.58
I pentabromuri MBr5 (M = Nb, Ta) possiedono una struttura dinucleare, analoga a quella di NbCl5. Una differenza significativa è data dalle energie di legame metallo-alogeno: l’energia
43 di legame Nb−Cl in NbCl5 in fase gassosa è di 97.5 kcal·mol-1, mentre l’energia di legame Nb−Br in NbBr5(g) risulta 82.7 kcal·mol-1.83 Questa differenza, in linea teorica, potrebbe influenzare la reattività con NHC.
TaBr5 utilizzato è un prodotto commerciale; il pentabromuro di niobio, invece, è stato sintetizzato a partire da NbCl5 commerciale seguendo la procedura riportata in letteratura (Schema 2.5).84
Schema 2.5. Reazione di sintesi di NbBr5.
Sono stati così ottenuti i prodotti 3a-c, in rese elevate, che sono stati caratterizzati mediante analisi del contenuto di bromo, spettroscopia IR e NMR (1H, 13C, 93Nb); le attribuzioni dei segnali 1H e 13C NMR sono state confermate da esperimenti bidimensionali (HSQC, HMBC). I dati suggeriscono in modo concorde la formazione dei complessi mononucleari 3a-c (Schema 2.4).
Gli spettri 1H e 13C NMR del composto 3a (in C6D6) mostrano le risonanze relative ai gruppi CH dell’anello imidazolico a valori di chemical shift simili a quelli osservati nell’analogo composto 2a [in 2a: (1H) = 6.65 ppm, (13C) = 124.1 ppm; in 3a: (1H) = 6.63ppm, (13C) = 124.0 ppm].
Lo spettro 13C NMR di 3c, contenente la risonanza relativa al carbonio carbenico a 188.3 ppm, è mostrato in Figura 2.11.
83
D.V. Drobot, E.A. Pisarev, Russian J. Inorg. Chem. 1981, 26, 3. 84
44
Figura 2.11. Spettro 13C registrato in C6D6 per il complesso 3c.
Per completare lo studio, sono stati considerati i pentafluoruri MF5 come possibili precursori di specie NHC. L’interesse per la sintesi di derivati di MF5 risiede nel fatto che alcuni di essi hanno trovato applicazioni come efficaci promotori di una varietà di processi,85 incluse reazioni di fluorurazione,86 alchilazione87 o polimerizzazione per apertura dell’anello.67 La struttura tetranucleare di MF5 differisce significativamente da quella degli altri alogenuri, e ciò potrebbe comportare una diversa reattività nei confronti delle specie NHC.
Le reazioni di MF5 (M = Nb, Ta) con NHC, in rapporto molare 1 : 1 in toluene, hanno permesso di isolare alcuni prodotti, per cui le analisi IR sono compatibili con la presenza di un legante carbenico coordinato al centro metallico. Tuttavia, studi NMR effettuati in situ hanno mostrato che queste reazioni sono poco selettive, e che i prodotti sono particolarmente sensibili alla presenza di tracce di umidità. Soltanto nel caso di 4a è stato possibile
85
S.S. Kim, G. Rajagopal, Synthesis, 2007, 215. 86
A.E. Feiring, J. Fluorine Chem. 1979, 13, 7; (b) D.E. Bradley, D. Nalewajek, R.L. Bell, U.S. Patent 2007/0118003 A1, May 24, 2007 (to Honeywell International Inc.).
87
(a) J. Sommer, M. Mueller, K. Laali, Nouv. J. Chim. 6 (1982) 3; (b) M. Siskin, G.R. Chludzinski, R. Hulme, J.J. Porcelli, W.E. Tyler III, Ind. Eng. Chem. Prod. Res. Dev. 1980, 19, 379.
45 caratterizzare in maniera soddisfacente il complesso ottenuto ed i risultati sono compatibili con la struttura riportata nello Schema 2.3.
2.2.1. Reattività dei complessi MX
5(NHC)
I pentaalogenuri di niobio NbX5 (X = F, Cl, Br) sono difficilmente manipolabili a causa della forte tendenza a reagire con l’umidità dell’aria. Come già affermato in precedenza, i leganti carbenici N-eterociclici sono generalmente in grado di conferire particolari proprietà o stabilità ai complessi metallici a cui sono legati. Per esempio, il liquido VOCl3, estremamente sensibile all’aria, genera una specie relativamente inerte per addizione del carbene IMes.69 Sulla base di questa considerazione, abbiamo ritenuto opportuno testare la stabilità all’aria dei complessi 2a-c , per mezzo di analisi IR. È stato visto che i complessi risultano inalterati dopo pochi minuti di esposizione all’aria, mentre sono soggetti a parziale degradazione dopo alcune ore (Figura 2.12, a-b).
46
Figura 2.12b. Spettro IR di cristalli di 2a allo stato solido registrato dopo 3 ore all’aria.
Nell’ambito delle prove di solubilità dei nuovi complessi MX5(NHC) (M = Nb, Ta; X = Cl, F; NHC = IPr, IXy, IMes), è stato notato che essi, in solventi clorurati (es. CHCl3, CH2Cl2) subiscono una veloce trasformazione nei corrispondenti sali di imidazolio 5a-d (Schema 2.6), probabilmente come conseguenza della presenza di impurezze di acqua.
Schema 2.6. Formazione di sali di imidazolio a partire da complessi MX5(NHC).
La reazione illustrata nello Schema 2.6 indica che i prodotti carbenici presentano una forte tendenza a catturare ioni H+ dall’ambiente di reazione, in accordo con quanto evidenziato dai calcoli computazionali che evidenziano il carbonio carbenico come sito privilegiato per un potenziale attacco nucleofilo (Figura 2.8).
47 La driving force per la particolarmente favorevole formazione del sale di imidazolio a partire dai corrispondenti derivati carbenici di MF5 (M = Nb, Ta), vedi sopra, é data probabilmente dalla notevole stabilità degli anioni MF6−.65a La stabilità di tale anione e degli anioni dinucleari [M2F11]– ha recentemente permesso l’isolamento di cationi radicali arenici stabili a temperatura ambiente in comuni solventi organici (v. Introduzione). La reazione di TaF5 con IXy ha permesso di isolare il prodotto 5d nella forma di un solido cristallino. E’ stato quindi possibile determinare la struttura tramite analisi di diffrazione di raggi X (Figura 2.13 e Tabella 2.4).


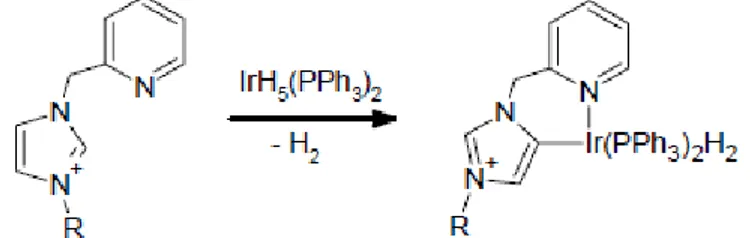
![Figura 1.18. Struttura molecolare di MX 5 [(a) X = F; (b) X = Cl, Br, I].](https://thumb-eu.123doks.com/thumbv2/123dokorg/7630773.117236/21.893.271.667.648.864/figura-struttura-molecolare-mx-x-f-cl-br.webp)