CAPITOLO 2
Il cono di accrescimento: struttura,
funzioni e dinamica del processo di
avanzamento
Intorno al 1890, un grande neurobiologo dello sviluppo il cui nome era Santiago Ramon y Cajal osservò per primo la presenza di una protuberanza all’estremità degli assoni in fase di accrescimento [3]: Cajal decide di definire tale protuberanza “cono di accrescimento” (Figura 2.1), avanzando l’ipotesi che il cono di accrescimento fosse direttamente coinvolto nelle strategie che l’assone mette in atto per individuare quel percorso che gli consentirà di raggiungere il target cellulare specifico.
Figura 2.1: Fotomicrografia di un cono di accrescimento all’estremità di un assone gangliare
sensoriale 7.
7
Nonostante a quel tempo ci fossero a disposizione solo immagini statiche, Cajal riuscì a cogliere molte delle caratteristiche del cono di accrescimento, descrivendolo come “dotato di elevata sensibilità chimica, di rapidi movimenti ameboidi e di una certa forza di progressione, grazie alla quale è in grado di estendersi in avanti e di superare gli ostacoli che incontra lungo il percorso … finchè non raggiunge la sua destinazione”.
Nel tempo, le osservazioni che Cajal aveva fatto hanno trovato riscontro sperimentale: il cono di accrescimento è una struttura sensitiva che percepisce e integra i segnali direzionali che l’ambiente fornisce al neurite ma è allo stesso tempo una struttura motoria che attivandosi in maniera opportuna provoca l’allungamento dell’assone nella direzione di crescita [3].
Nel tentativo di approfondire la comprensione dei meccanismi biologici che stanno alla base dell’accrescimento neuritico, e di conseguenza della formazione di un tessuto nervoso, è necessario dunque includere nell’analisi lo studio della struttura e della dinamica del cono di accrescimento in quanto sistema di guida dell’assone.
2.1 Le funzioni del cono di accrescimento
Il cono di accrescimento ha una natura estremamente complessa: è una struttura altamente dinamica e la comprensione profonda del suo funzionamento è un obiettivo fondamentale da raggiungere per capire meglio sia il processo di polarizzazione neuronale che quello di
axonal pathfinding.
Nel 1995, Kater e Rehder [12] descrissero le funzioni del cono di accrescimento e le classificarono come appartenenti a tre categorie:
• funzione sensoriale, con cui il cono di accrescimento indaga l’ambiente molecolare circostante;
• funzione di signalling, con cui realizza la trasduzione dei segnali multipli esterni;
• funzione motoria, che gli permette di modificare il suo comportamento e di agire direttamente sull’assone a cui fa capo.
Affinché il cono di accrescimento possa funzionare correttamente è necessaria un’azione coordinata di tutte le sue componenti. Le funzioni sensoriale, di signalling e motoria interagiscono continuamente tra loro permettendo al cono di accrescimento di recepire i segnali extracellulari e di convertire queste informazioni in un rimodellamento del
citoscheletro. In questo modo il cono di accrescimento è in grado di avanzare o di deviare dalla sua traiettoria e di esercitare sull’assone forze di trazione tali da riorientare il neurite verso il suo target.
2.2 I sensori del cono di accrescimento: i filopodia
I filopodia sono le strutture a cui sono attribuibili gran parte delle proprietà sensoriali del cono di accrescimento [3]. Proprio per questo motivo si parla spesso dei filopodia in termini di “antenne” che si estendono sulla superficie del cono di accrescimento allo scopo di indagare l’ambiente circostante e di captare i segnali necessari al pathfinding.
2.2.1 Fondamenti biologici sulla struttura dei filopodia
I filopodia sono, insieme ai lamellipodia, protrusioni della membrana cellulare [13] (Figura 2.2).
Il lamellipodium è una struttura piatta le cui dimensioni caratteristiche sono pari a 0.1-0.2
µm; al suo interno uno scheletro di filamenti di actina si intreccia a formare una rete intricata. Il filopodium è una struttura tridimensionale, somigliante ad un bastoncello di dimensioni pari a 0.1-0.3 µm; l’analisi della struttura interna dei filopodia, che possono essere integrati nelle membrane lamellipodiali o emergere da queste, rivela la presenza di fascicoli paralleli di F-actina. I filopodia che emergono dal cono di accrescimento assumono una configurazione a ventaglio che permette all’estremità neuritica di ampliare l’area da campionare per ogni step di movimento.
Figura 2.2: Estremità neuritica in cui sono visibili i filopodia e i lamellipodia che protrudono dal
cono di accrescimento 8.
I filamenti di actina sono polimeri polarizzati [14], come si è gia accennato nel Capitolo 1: nel cono di accrescimento i monomeri di actina vengono aggiunti all’estremità “più”o estremità “a barbigli” e si disassemblano a livello dell’estremità “meno” o estremità “appuntita”, mentre proteine specializzate nella formazione di legami con l’actina trasportano i monomeri verso l’estremità in crescita. Sia nei filopodia che nei lamellipodia le estremità a barbigli dei filamenti di actina sono rivolte verso la membrana plasmatica; il loro allungamento determina così un avanzamento del margine avanzante, caratteristico dei processi cellulari di estensione e migrazione [13].
I filopodia sono soggetti a cicli ripetuti di estensione e retrazione dalla e verso la membrana: ciò conferisce loro un movimento guizzante.
La dinamica, la morfologia e la disposizione dei filopodia possono subire variazioni notevoli a seconda del tipo di cellule considerate; ad esempio nei fibroblasti e nei coni di accrescimento neurali i filopodia raramente eccedono lunghezze di 10 µm mentre i filopodia embrionali del riccio di mare possono estendersi fino a 40 µm.
Nel tentativo di raccogliere informazioni sulla dinamica filopodiale, Myers e Bastiani osservano il comportamento dei filopodia dei coni di accrescimento Q1 in embrioni di cavalletta [15]: i filopodia che protrudono dal cono di accrescimento, in numero pari a 20+5, si estendono e si ritraggono a rate di circa 100 µm/h e persistono per pochi minuti. Le traiettorie che i filopodia percorrono sono di solito rettilinee ma talvolta possono essere curve o in generale molto complesse. Durante la fase di retrazione il filopodium traccia lo
8
Heidemann S.R., Lamoureux P., Buxbaum R.E., “Growth cone behavior and production of traction force”, The Journal of Cell Biology, vol. 111, 1990.
stesso path della fase di estensione, path che rimane il medesimo durante i successivi cicli di movimento.
Le considerazioni di Myers e Bastiani [15] valgono comunque in uno quadro generale: la morfologia e la dinamica dei filopodia possono essere molto differenti a seconda della linea cellulare considerata e del setup sperimentale urilizzato.
2.2.2 Le “antenne” del cono di accrescimento: i filopodia come sensori e
non solo
I filopodia contengono recettori per molecole di signalling e molecole della ECM [13]; il ruolo sensoriale che viene loro attribuito di fatto rimanda proprio al vasto corredo recettoriale che essi posseggono.
In punta ai filopodia e lungo l’albero filopodiale sono localizzate integrine e caderine che sono molecole di adesione cellulare. Durante lo spreading e la migrazione cellulare le integrine dei filopodia sono coinvolte nella formazione dei siti iniziali di adesione: successivamente molecole di talina, chinasi dell’adesione focale (FAK) e paxillina vengono reclutate nel dominio citoplasmatico per formare un’adesione focale matura che, associandosi allo scheletro di actina ancora la cellula al substrato.
Ma non è tutto: nei macrofagi, protrusioni filopodiali si estendono nell’ambiente extracellulare alla ricerca di agenti patogeni; quando avviene il riconoscimento di una delle molecole in questione, il filopodium si lega ad essa e la trasporta verso il corpo cellulare del macrofago dove verrà inglobata.
Oltre ad avere un ruolo sensoriale i filopodia partecipano ai processi di guarigione cellulare, alla formazione di giunzioni cellula-cellula e allo sviluppo embrionale; grazie alla loro estrema flessibilità infatti i filopodia protrudono dal corpo cellulare di cellule vicine consentendo la formazione di un legame solido tra queste e intervenendo in operazioni di allineamento dei fogli cellulari.
Per via delle loro caratteristiche, la percezione sensoriale è da sempre la funzione principale che viene attribuita ai filopodia che sono quindi coinvolti nell’axonal
pathfinding: il riconoscimento delle molecole presenti nell’ambiente extracellulare a livello
filopodiale serve da segnale guida per il cono di accrescimento che decide così la direzione da seguire.
A questo proposito comunque Dwivedy et al. [16] riportano i risultati di un esperimento in cui mostrano come i filopodia non siano necessari in qualunque meccanismo di guida neuritica. L’analisi eseguita considera lo sviluppo del pathway retinotettale in embrioni di
Xenopus in cui l’attività delle proteine della famiglia Ena/VASP, richieste per la
formazione dei filopodia, viene modificata in modo che i coni di accrescimento dei neuroni gangliari retinali siano privi di protrusioni filopodiali.
Dwivedy et al. osservano che, in assenza di filopodia, gli assoni riescono ad individuare il percorso corretto da seguire con pochi errori di navigazione, suggerendo quindi che i filopodia non sono indispensabili all’axon guidance.
Questa conclusione potrebbe essere dovuta al fatto che lungo il pathway retinotettale sono comunque presenti segnali che agiscono a breve distanza e che possono guidare i neuroni per contact-guidance; inoltre in questo studio alcuni assoni pionieri si estendono indisturbati: potrebbero quindi fare da guida ai coni di accrescimento privi di filopodia. Dwivedy et al. verificano infine che quando i filopodia non sono presenti sul cono di accrescimento ad essere danneggiate sono la dinamica assonale (in quanto i neuroni migrano più lentamente che in presenza di filopodia) e la capacità dei neuroni gangliari di formare le terminazioni assonali nel tetto.
2.3 Concetti base sul ruolo del calcio come secondo messaggero
a servizio del cono di accrescimento
Il legame recettore-ligando a livello del cono di accrescimento innesca pathways di
signalling che coinvolgono secondi messaggeri. Tra questi uno dei più importanti è il
calcio [12].
L’attivazione recettoriale può alterare la concentrazione intracellulare di calcio, [Ca2+]i, e
la specificità degli effetti che corrispondono a queste variazioni richiede che i livelli del calcio siano finemente regolati nello spazio e nel tempo.
Gli effetti che si accompagnano ad una variazione della [Ca2+]i sono molteplici. Quando il
[Ca2+]i viene fatto variare sopra o sotto i livelli di riposo in cellule cerebrali granulari, si
assiste a diminuzione della crescita neurita.
Stimolando elettricamente neuroni del ganglio della radice dorsale (neuroni DRG) del topo si verifica un aumento della [Ca2+]i e, in prima istanza, il collasso del cono di
accrescimento; se la stimolazione persiste quello che succede è che i coni di accrescimento riacquistano motilità e diventano resistenti ad un successivo collasso.
L’aumento del [Ca2+]i può essere utilizzato anche nella comunicazione transcellulare, ad
esempio nel signalling della morte cellulare tra i neuroni di sanguisuga connessi mediante
gap junctions.
Le variazioni della [Ca2+]i sono correlabili ancora alla modulazione dell’attività filopodiale
[17-18].
Lau et al. [17] allestiscono una serie di esperimenti utilizzando colture di neuroni del CNS della cavalletta; ad essere indagati sono gli effetti dell’aumento della [Ca2+]i sulla
protrusione dei filopodia. La metodica usata per variare la concentrazione del calcio è la fotolisi locale di composti del calcio in zone vicine al cono di accrescimento. Si osserva che, a seguito dell’applicazione di flash fotolici della durata di 100-200 ms, nella zona illuminata la concentrazione intracellulare di calcio raggiunge un valore di picco nell’arco di 1 s, seguita dall’estensione di nuovi filopodia a partire da assoni nascenti o da assoni già esistenti. Lo stesso fenomeno si verifica sottoponendo a fotolisi porzioni di singoli filopodia. I risultati ottenuti indicano che un aumento della [Ca2+]i è una condizione
sufficiente per indurre la protrusione di nuovi filopodia.
In un quadro più generale, Redher et al. [18] correlano la variazione della [Ca2+]i con la
morfologia dei filopodia di neuroni di Helisoma. Come prima cosa viene aumentata la concentrazione di potassio nel mezzo di coltura, ricco di calcio: l’aumento della [K+] extracellulare induce la depolarizzazione dei neuroni e l’apertura dei canali calcio-dipendenti. L’aumento della [Ca2+]i è seguito da tre eventi consecutivi: l’allungamento dei
filopodia, la loro scomparsa e infine l’adattamento in cui si verifica il recupero dei filopodia. I risultati indicano che sono sufficienti piccoli cambiamenti nella [Ca2+]i per
alterare il comportamento dei filopodia. Inoltre, è il transiente di calcio a contenere l’informazione responsabile dei cambiamenti dei filopodia in quanto il mantenimento di livelli sostenuti di calcio intracellulari è seguito da una fase di adattamento. Quando il livello di calcio è fisso su un valore di plateau, i filopodia si adattano alla nuova condizione, a testimonianza del fatto che esiste un range ampio di valori del calcio intracellulare per cui è possibile una riorganizzazione del citoscheletro.
L’azione dei secondi messaggeri, (calcio, nucleotidi ciclici, etc.) va a modulare l’attività di un gran numero di molecole (protein-chinasi, fosfatasi proteiche, GTP-asi della famiglia Rho) implicate nel controllo della dinamica del citoscheletro [3].
2.4 La dinamica di avanzamento del cono di accrescimento
L’ultimo step del pathway di signalling attivato dal legame recettore-ligando avvenuto sulla superifice del cono di accrescimento si ripercuote sul suo comportamento: il cono di accrescimento viene stimolato ad avanzare, ritrarsi o deviare dalla direzione su cui si stava muovendo precedentemente.
Lowery e Van Vactor [14] indagano i meccanismi molecolari della dinamica di avanzamento del cono di accrescimento, facendo costantemente riferimento alla sua struttura citoscheletrica. Il loro obiettivo ultimo è comprendere le funzioni e i meccanismi di regolazione del cono di accrescimento, offrendo un’ampia prospettiva dei principi biologici alla base di quello che è un sistema di guida capace di condurre il neurite verso uno specifico target cellulare con un livello elevato di accuratezza.
2.4.1 L’organizzazione citoscheletrica del cono di accrescimento
Il cono di accrescimento è in grado di muoversi in avanti e girare attraverso un processo di avanzamento a tre stadi: protrusione, engorgement e consolidamento [14]. Poiché per far questo impiega il suo citoscheletro è importante comprendere i concetti biologici chiave che sottendono il processo di avanzamento.
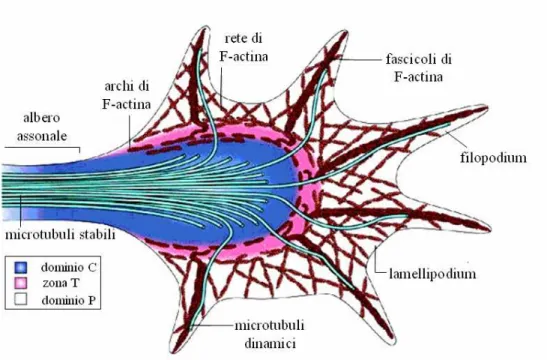
Nel cono di accrescimento possono essere individuati tre domini (Figura 2.3) sulla base dell’organizzazione degli elementi citoscheletrici [14].
Figura 2.3: Struttura del cono di accrescimento 9.
• Il dominio periferico (dominio P) contiene lunghi filamenti di actina avvolti a formare dei fascicoli che costituiscono il framework dei filopodia e strutture ramificate di F-actina che formano i lamellipodia. Singoli microtubuli (MTs) altamente dinamici esplorano il dominio P muovendosi di solito lungo i fascicoli di F-actina.
• Nel dominio centrale (dominio C) sono presenti fascicoli di microtubuli stabili e molti organelli, vescicole e fascicoli di actina.
• La zona di transizione (zona T) si colloca all’interfaccia tra i domini C e P; qui si trovano strutture contrattili di actomiosina chiamate “archi di actina” che giacciono perpendicolari ai fascicoli di F-actina e che sono disposti in modo da disegnare un anello emicirconferenziale.
L’azione combinata di tutti i componenti citoscheletrici sopra elencati determina la forma del cono di accrescimento e caratterizza la dinamica del suo movimento.
9
2.4.2 Il processo di protrusione
Il processo di avanzamento del cono di accrescimento è un processo a tre stadi [14]: protrusione, engorgement e consolidamento (Figura 2.4). La crescita assonale inizia con il contatto tra l’estremità distale del cono di accrescimento e un substrato adesivo (Figura 2.4, pannello A); il contatto adesivo attiva pathways intracellulari di trasduzione del segnale e innesca la formazione di un clutch molecolare che permette al substrato adesivo di interagire con il citoscheletro di actina [19].
Figura 2.4: Stadi del processo di crescita assonale 10.
Mentre il clutch si rafforza, fenomeno a cui si accompagna un’attenuazione locale del flusso retrogrado di F-actina, lo scheletro di actina viene ancorato al substrato [14]: in
10
Lowery L.A., Van Vactor D., “The trip of the tip: understanding the growth cone machinery”, Nature Reviews Molecular Cell Biology, 2009.
questo modo la polimerizzazione di F-actina continua frontalmente al sito di clutch e i filopodia e i lamellipodia protrudono dal dominio P in avanti estendendo il margine avanzante, grazie a un meccanismo di esocitosi che aggiunge nuovi tratti di membrana (Figura 2.4, pannello B).
L’engorgement si verifica contemporaneamente o subito dopo la rottura e la rimozione dell’actina dal corridoio tra il sito di adesione e il dominio C (Figura 2.4, pannello C). Gli archi di F-actina si riorientano nella direzione di crescita e guidano, insieme ai fascicoli di actina del dominio C, i microtubuli del dominio centrale che invadono la zona destinata alla nuova formazione assonale.
Il dominio C appena avanzato si consolida mentre la parte prossimale del cono di accrescimento si compatta formando un nuovo tratto dell’albero assonale (Figura 2.4, pannello D). Gli archi di actina, contenenti la proteina motrice miosina II, intervengono a comprimere i microtubuli del dominio C appena formatosi mentre proteine di stabilizzazione si associano ai microtubuli. I filopodia si ritirano dalla zona di crescita dove l’attività protrusiva dell’F-actina viene soppressa, a seguito anche dell’attività della miosina II. Da ultimo, si assiste al consolidamento dell’albero assonale.
Furono Mitchison e Kirschner nel 1988 ad ipotizzare quale fosse la natura delle interazioni tra il processo di avanzamento del cono e la dinamica dell’actina [19]; la loro ipotesi prende il nome di ipotesi del clutch o “modello di accoppiamento substrato-citoscheletro”. Partendo dall’evidenza sperimentale che le integrine di membrana del cono di accrescimento possono accoppiarsi ai filamenti di actina probabilmente attraverso molecole come la talina, l’ipotesi del clutch suppone che in assenza di accoppiamento col substrato l’azione della miosina (che è ancorata alla membrana) sull’actina (che polimerizza all’estremità “più” e depolimerizza all’estremità “meno”) dà luogo a un flusso retrogrado dell’actina verso la zona prossimale del cono di accrescimento. Quando il complesso molecolare di interazione substrato-actina si forma e l’actina risulta fissa rispetto al substrato, la miosina diventa invece responsabile della protrusione della membrana in avanti .
Evidenze sperimentali dell’ipotesi di clutch vengono da uno studio fatto da Lee et al. [20]: la dinamica dell’actina e quella dei microtubuli vengono monitorate nei coni di accrescimento dell’Aplysia californica che si muovono su un substrato in cui l’adesione è mediata dalla molecola di adesione cellulare di Aplysia (ApCAM).
Alla formazione di un contatto adesivo si assiste alla riorganizzazione locale dell’actina; in particolare, dopo che l’actina si accumula al sito di adesione, il flusso retrogrado rallenta e il cono di accrescimento protrude in avanti. La zona tra il sito di adesione e il dominio centrale viene liberata dai fascicoli di F-actina e gli archi actinici si riorientano verso il sito di adesione, formando un corridoio. Si assiste quindi ad un aumento della tensione nell’area che si trova tra il sito di adesione e la zona occupata dagli archi di actina, associati ai microtubuli. Da ultimo, il dominio C avanza.
2.4.3 L’actina come “motore”del cono di accrescimento
Il processo attraverso cui il cono di accrescimento si muove dipende molto dall’actina e dalle sue proprietà dinamiche [14]. Nonostante ciò, l’actina potrebbe non essere a capo dell’unico meccanismo responsabile dell’allungamento assonale in quanto in sua assenza, e in assenza di polimerizzazione actinica, gli assoni possono ancora avanzare sebbene con morfologia anomala del cono di accrescimento e alterata selettività per il substrato.
La presenza dell’actina è sicuramente importante per controllare gli stadi del processo con cui il cono di accrescimento esplora l’ambiente extracellulare. È il bilanciamento tra il
treadmill e il flusso retrogrado di F-actina a consentire al cono di accrescimento di
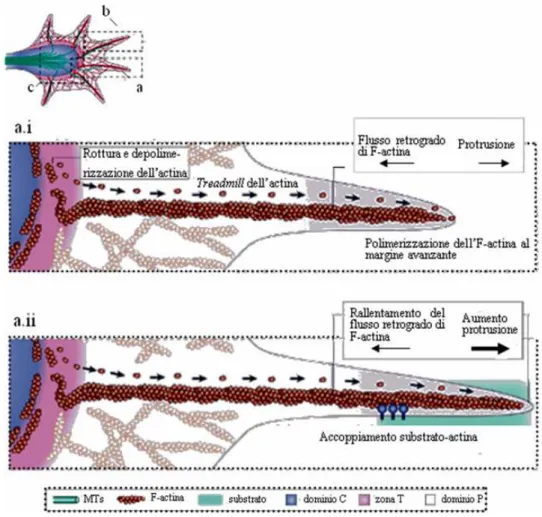
alternare momenti di stasi a comportamenti dinamici in cui rispondere agli stimoli ambientali (Figura 2.5).
Il treadmill dell’F-actina consiste nel disassemblaggio dell’F-actina a livello della zona T, nel riciclaggio delle subunità monomeriche ottenute a livello del margine avanzante e infine nella polimerizzazione actinica al margine avanzante. La situazione di perfetto equilibrio tra il treadmill dell’F-actina e il flusso retrogrado di F-actina (ovvero il movimento delle subunità di actina dal dominio periferico alla zona T) permette al cono di accrescimento di restare in uno stato di inattività apparente in cui non si ha alcuna variazione nel livello di estensione della membrana cellulare (Figura 2.5, pannello a.i).
Figura 2.5: Struttura del cono di accrescimento (pannello superiore) e interazioni tra flusso
retrogrado di actina e treadmill di actina durante gli stadi di stasi (pannello a.i) e protrusione (pannello a.ii) del cono di accrescimento 11.
Quando il cono di accrescimento viene a contatto con un substrato adesivo, quello che succede invece è il verificarsi di una condizione di sbilanciamento tra flusso retrogrado e
treadmill, a favore di quest’ultimo (Figura 2.5, pannello a.ii).
Non bisogna dimenticare infatti i fenomeni che seguono la formazione del clutch molecolare tra i recettori del cono di accrescimento e lo scheletro interno di actina e che sono stati discussi in precedenza. Si ricordi che il clutch ancora lo scheletro di actina al substrato, determinando un’attenuazione del flusso retrogrado di F-actina. Dato che la polimerizzazione di F-actina non subisce invece alcuna interferenza, i due processi sono in disequilibrio e la predominanza della polimerizazione actinica spinge la membrana ad avanzare. Il risultato finale è la protrusione del cono di accrescimento.
11
La dinamica dell’actina è stata analizzata da Medeiros et al. [21] in colture cellulari di neuroni di Aplysia; in particolare viene valutato il ruolo della miosina II. L’inibizione della miosina in seguito a trattamento con blebbistatin produce una riduzione del flusso retrogrado di actina pari circa al 51% e ha effetto sulla dimensione dei fascicoli di actina che si allungano dell’83% rispetto ai controlli. Il primo di questi risultati indica che il flusso retrogrado di actina è guidato in parte dalla forza contrattile della miosina II e in parte dalla polimerizzazione dell’actina al margine avanzante che, dopo inibizione della miosina, è ancora in grado di produrre delle forze di spinta che guidano il flusso retrogrado di actina. Monitorando la zona di transizione del cono di accrescimento risulta inoltre che, in seguito al trattamento con blebbistatin, gli archi di actina non si formano e i processi di frammentazione e riciclaggio dei monomeri di actina subiscono una riduzione notevole, a cui segue l’allungamento dei fascicoli di actina. Questi risultati suggeriscono che la forza contrattile della miosina contribuisce sia alla deformazione dei fascicoli di actina che andranno poi a formare gli archi presenti nella zona T sia alla produzione delle forze necessarie alla scissione dei fascicoli actinici in unità monomeriche.
Haviv et al. [22] riportano inoltre evidenze sperimentali relative al coinvolgimento della miosina II nella depolimerizzazione attiva dei filamenti di actina in vitro. A concentrazioni elevate di miosina la dinamica di formazione dei fascicoli viene alterata notevolmente: se in un sistema privo di miosina i fascicoli sono spessi e rettilinei, quando la miosina viene aggiunta i fascicoli si assottigliano e la densità di monomeri di actina in soluzione aumenta. Quando la concentrazione di miosina è molto alta la formazione dei fascicoli è inibita e fenomeni di defascicolazione e frammentazione dei fascicoli sono osservati, a supporto dell’idea che la miosina II sia attivamente coinvolta nella depolimerizzazione dei filamenti di actina e che potrebbe comportarsi in maniera simile anche in vivo..
2.4.4 Il ruolo dei microtubuli
Nel processo di avanzamento del cono di accrescimento non meno importante è il contributo dei microtubuli che hanno due ruoli fondamentali [14]; da un lato i microtubuli del dominio P fanno da sensori della guida mentre dall’altro i microtubuli del dominio C guidano l’avanzamento del cono di accrescimento.
Figura 2.6: Struttura del cono di accrescimento (pannello superiore) e funzioni dei microtubuli
(pannelli b.i e b.ii) 12.
Prima che avvenga la protrusione del cono di accrescimento, alcuni microtubuli esplorano il dominio P (Figura 2.6, pannello a.i): questo è possibile grazie allo stato di instabilità dinamica in cui si trovano le estremità “più” e che consente ai microtubuli ad alternare stadi di crescita, di retrazione e di stasi.
Si parla di questi microtubuli come di sensori per la guida, ipotizzando per loro il ruolo di
scaffold per il signalling e come agenti di reclutamento di nuovi microtubuli da
coinvolgere nell’interazione con il sito di adesione (Figura 2.6, pannello b.ii).
Il secondo ruolo che viene attribuito ai microtubuli è relativo alla fase di engorgement, dopo che il citoscheletro di actina si è rimodellato rispondendo ad un segnale esterno. Dal dominio C, i microtubuli si muovono nella direzione di accrescimento mentre
12
posteriormente un nuovo tratto dell’albero assonale si consolida, fissando così la direzione assonale.
2.4.5 Analisi delle interazioni dei microtubuli con l’actina
Affinché il processo di guida possa essere realizzato nel modo più corretto, microtubuli e actina dovranno interagire.
Un’ipotesi recente propone che la funzione dell’actina potrebbe essere quella di guidare il cono di accrescimento nella giusta direzione, facendo da guida spazio-temporale per i microtubuli. I risultati sperimentali ottenuti da questi studi [23-25] infatti mostrano coma l’actina intervenga a determinare la localizzazione spaziale dei microtubuli all’interno del cono di accrescimento: essa agisce sia da guida per i microtubuli durante l’avanzamento che da barriera che impedisce ai microtubuli di dirigersi verso zone in cui la loro presenza non è prevista.
2.4.5.1 Dominio periferico: le interazioni dei microtubuli con i fascicoli di
F-actina
All’interno del dominio periferico i microtubuli “esploratori” si muovono solitamente lungo le traiettorie dei fascicoli di F-actina che potrebbero essere usate come guide [14]. Un lavoro di Burnette et al. tuttavia riportano che, in seguito alla rimozione dei filopodia, l’avanzamento dei microtubuli è ancora possibile ma la loro penetrazione nel dominio periferico risulta maggiore e distribuita in modo più random che in presenza dei fascicoli di F-actina, come se il compito di questi ultimi fosse quello di inibire l’ingresso dei microtubuli nel dominio P [23].
Anche Lee et al. [20] analizzano la dinamica di actina e microtubuli nel dominio periferico e lo fanno osservando i coni di accrescimento di neuroni di Aplysia che si muovono su un substrato in cui l’adesione cellulare è mediata da ApCAM. Le osservazioni sperimentali mostrano che i microtubuli che si trovano sul lati del cono di accrescimento sono soggetti per minor tempo a traslocazione retrograda rispetto ai microtubuli centrali. Poiché la traslocazione è soprattutto causata da accoppiamento con i fascicoli di actina [24], Lee conclude che probabilmente i microtubuli laterali hanno un livello più basso di
accoppiamento actinico rispetto a quelli centrali [20]. Questo diverso grado di accoppiamento potrebbe essere dovuto ad una differenza tra i microtubuli centrali e laterali nella quantità o nell’affinità delle proteine di link tra microtubuli e actina.
Di fatto, il grado di accoppiamento dei microtubuli con il flusso retrogrado di actina ha effetti sulla capacità che i microtubuli hanno di fare il loro ingresso nel domio P. Diminuendo questo accoppiamento, i microtubuli riescono ad esplorare con maggiore frequenza le regioni laterali del cono di accrescimento rispetto a quelle centrali.
Lee ipotizza che la diminuzione del grado di accoppiamento potrebbe ad esempio essere causata dalla presenza di segnali attrattivi fuori dall’asse di crescita assonale i quali attiverebbero un pathway di signalling che ha come effetto un minore accoppiamento. In maniera analoga, la percezione di segnali repulsivi off-axis potrebbe agire aumentando il grado di accoppiamento tra actina e microtubuli.
2.4.5.2 Dominio centrale: le interazioni dei microtubuli con gli archi di
actina
Se i fascicoli di actina influenzano la dinamica dei microtubuli del dominio periferico, la stessa considerazione non vale per i microtubuli del dominio centrale in quanto la distruzione dei fascicoli di actina non ne altera le caratteristiche di avanzamento [23]. Spostando l’analisi sugli archi di actina che delimitano la zona T il risultato è differente. Schaefer et al. [24] riportano le conclusioni di un studio su neuroni di Aplysia trattati con un inibitore della chinasi Rho, proteina che regola la contrattilità e la stabilità degli archi di actina nonché la distribuzione dei microtubuli nel dominio C.
L’inibizione della chinasi Rho comporta una riduzione della densità degli archi di actina nei coni di accrescimento esaminati e il mancato consolidamento dei microtubuli in un unico asse durante la protrusione. Di conseguenza il dominio centrale risulta più ampio del solito e il suo tempo di avanzamento si riduce di circa la metà. Queste osservazioni suggeriscono che gli archi di actina formano una sorta di barriera all’avanzamento del dominio C e un corridoio che indica ai microtubuli il percorso da seguire per raggiungere il dominio centrale.
Burnette et al. [25] analizzano le interazioni tra microtubuli e archi di actina in neuroni di
Aplysia. Durante il processo di motilità cellulare, le mappe di flusso dei microtubuli e delle
archi sono responsabili del trasporto dei microtubuli dalle zone laterali del cono di accrescimento al dominio C. La miosina II sembra partecipare attivamente a questo processo, favorendo la stabilizzazione dei fascicoli e probabilmente contribuendo a compattarli fino all’intervento delle proteine associate ai microtubuli (MAP) che realizzano il crosslink. L’inibizione dell’attività miosinica con blebbistatin infatti comporta lo sfaldamento dei fascicoli e lo spreading del dominio centrale del cono di accrescimento.
Dalle considerazioni fatte fin’ora è evidente quindi che strutture actiniche diverse hanno funzioni diverse [14]: se da un lato i fascicoli di actina inibiscono e guidano i microtubuli nel dominio periferico, dal’altro gli archi di actina inibiscono e guidano i microtubuli nel dominio centrale (Figura 2.7, pannello c).
Figura 2.7: Struttura del cono di accrescimento (pannello superiore) e interazioni tra microtubuli e
strutture actiniche nei domini centrale e periferico del cono di accrescimento (pannello c) 13.
13
Lowery L.A., Van Vactor D., “The trip of the tip: understanding the growth cone machinery”, Nature Reviews Molecular Cell Biology, 2009.
L’analisi di Lowery e Van Vactor sulla dinamica di avanzamento del cono di accrescimento è un resoconto dettagliato della biologia del cono di accrescimento e dei meccanismi che ne regolano il movimento. Molto rimane comunque ancora da chiarire vista la straordinaria complessità di questa struttura che Cajal per primo aveva identificato essere uno dei protagonisti principali dell’axonal pathfinding.