INTRODUZIONE
GENERALE
2
1. I CANALI K
ATPI canali al potassio sono canali ionici che appartengono alla famiglia delle proteine multimeriche. Sono pori macromolecolari della membrana cellulare che permettono il trasporto degli ioni potassio. Tra le varie tipologie di canali al potassio, quelli ATP dipendenti (KATP), hanno assunto recentemente una notevole
importanza in quanto siti molecolari di interessanti azioni farmacologiche1. L’apertura dei canali KATP dipende dalle concentrazioni cellulari di ATP ed è
quindi collegata allo stato metabolico della cellula. A concentrazioni intracellulari di ATP superiori a 100 µM siha chiusura del canale, mentre in assenza di ATP, il canale si apre.
1.1 STRUTTURA DEI CANALI K
ATPIl canale KATP è costituito da due subunità proteiche2: una sottofamiglia Kir6x che
costituisce il poro del canale e la subunità SUR che costituisce il sito recettoriale delle sulfaniluree. (Fig.1). Il canale KATP è un complesso etero-ottamerico formato
da quattro subunità Kir6 associate a quattro subunità SUR3,4.
Le subunità Kir presentano tutte la stessa struttura primaria ma si differenziano per il grado di omologia. La subunità Kir6x è costituita da due segmenti transmembranali M1 e M2, connessi ad una regione intracellulare, denominata P, selettiva per il K+. Si conoscono due membri della famiglia dei Kir6x: Kir6.1 e Kir6.2, codificati rispettivamente dai geni KNCJ8 e KNCJ11, che hanno il 70% di identità amminoacidica.
La subunità SUR appartiene alla famiglia delle proteine ABC 5 ( ATP-binding cassette) ed è formata da tre domini transmembranali: TMD0, costituito da 5 segmenti, TMD1 e TMD2, costituiti da 6 segmenti 6. Tra le porzioni carbossiterminali dei domini TMD1 e TMD2 sono presenti due grandi loop
3
intracellulari detti NBF-1 e NBF-2 . La subunità SUR esiste in due differenti isoforme: SUR1 maggiormente localizzata a livello pancreatico e SUR2 che a sua volta si può dividere in SUR2A presente soprattutto nelle cellule cardiache e SUR2B presente nei vasi 8.
4
1.2 LOCALIZZAZIONE DEI CANALI K
ATPQuesta famiglia di canali è assai eterogenea ed è presente a livello di molti tessuti
9,10
tra cui:
Cellule β pancreatiche
Sistema nervoso
Muscolatura liscia vascolare
Muscolatura liscia non vascolare (sistema urinario, tratto gastrointestinale e vie aeree)
Muscolo cardiaco
Essi possiedono ruoli differenti a seconda del tipo di tessuto in cui sono localizzati.
1.2.1 CANALI KATP NEL PANCREAS
I canali KATP sono localizzati a livello del pancreas endocrino, precisamente nelle
cellule β delle isole di Langerhans 11
. Una bassa concentrazione di glucosio nel sangue determina una diminuzione cellulare di ATP con conseguente apertura dei canali KATP e fuoriuscita di ioni K+ che causano ripolarizzazione della membrana
cellulare. I canali del Ca2+ rimangono chiusi. In condizioni di iperglicemia, invece, il glucosio entra nella cellula e va incontro a metabolismo glicolitico, con conseguente aumento di ATP intracellulare. I canali KATP, quindi, si chiudono
determinando depolarizzazione della membrana e apertura dei canali del Ca2+, ne consegue esocitosi di vescicole contenenti insulina. Sostanze attive a livello pancreatico sono le sulfoniluree, una famiglia di farmaci secretagoghi utilizzata per il trattamento del diabete mellito di tipo 2. La loro azione avviene a livello delle cellule insulari del pancreas, che vengono stimolate a produrre maggiori quantità di insulina. Al contrario, farmaci che portano all’apertura dei canali KATP
5
Fig.2 Meccanismo di liberazione dell’insulina nella cellula pancreatica, mediato dalla chiusura dei canali KATP
1.2.2 I CANALI KATP NEL TESSUTO NERVOSO
I canali KATP sono situati in alcune zone del cervello tra cui la sostanza nigra 13, la
neocorteccia 14, l’ipotalamo e l’ippocampo 15. L’attività dei canali KATP del cervello è del tutto simile a quella descritta per i canali delle cellule β pancreatiche: la chiusura dei canali KATP e l’ingresso di ioni Ca2+ tramite i canali
voltaggio-dipendenti porta ad una depolarizzazione della membrana che determina un’attività neuronale.
I canali KATP presenti nelle cellule β pancreatiche e nell’ipotalamo, oltre ad avere
analogie strutturali essendo costituiti entrambi dalle subunità Kir6.2 e SUR1, hanno un’attività correlata nel meccanismo di regolazione dell’omeostasi del glucosio attraverso la regolazione del rilascio ormonale.
6
Fig.3 I canali KATP nel sistema nervoso
1.2.3 I CANALI KATP NELLA MUSCOLATURA LISCIA VASCOLARE
I canali KATP della muscolatura liscia vascolare sono quelli maggiormente studiati,
e attualmente costituiscono il principale bersaglio terapeutico degli agonisti dei canali KATP ( KCOs) 16.
Nel sistema vascolare i canali KATP, regolano il tono muscolare dei vasi e quindi
anche la pressione sanguigna. L’attivazione di questi canali, porta all’iperpolarizzazione della membrana plasmatica che causa rilasciamento muscolare, forse dovuto all’inibizione dei canali Ca2+
7
1.2.4 I CANALI KATP NELLA MUSCOLATURA LISCIA NON VASCOLARE
Vescica urinaria
I canali KATP sono espressi nelle cellule muscolari lisce della vescica, dove
giocano un ruolo chiave nella regolazione del potenziale di membrana delle cellule vescicali, della loro eccitabilità e contrazione 18. La modulazione dei canali KATP rappresenta perciò un potente mezzo per controllare la funzionalità
contrattile della vescica. Grazie al potenziale terapeutico dei canali KATP nel
trattamento dell’incontinenza urinaria, la ricerca si è rivolta allo sviluppo di KCOs selettivi per i canali KATP della vescica.
Tratto gastrointestinale
A livello della muscolatura liscia del tratto gastrointestinale, è stato dimostrato che i canali KATP contribuiscono al ripristino del potenziale di membrana delle
cellule intestinali, e quindi alla regolazione della loro eccitabilità e contrattilità 19. I KCOs sono quindi in grado di provocare un rilasciamento della muscolatura liscia gastrointestinale.
Vie aeree
Sebbene esistono pochi studi sul ruolo fisiologico dei canali KATP nella
muscolatura liscia bronchiale, è tuttavia noto che un’ampia varietà di KCOs risulta capace di rilasciare la muscolatura bronchiale sia in vitro che in vivo, indicando la presenza di una significativa popolazione di canali KATP. Gli
attivatori di questi canali, infatti, rappresentano potenziali farmaci per il trattamento dell’asma e dell’iperattività aerea 20
8
1.2.5 I CANALI KATP NEL MUSCOLO CARDIACO
I canali KATP sono stati descritti per la prima volta nella membrana plasmatica dei
miociti ventricolari cardiaci 21. Studi più recenti hanno permesso la classificazione dei canali KATP cardiaci in sarc-KATP, localizzati nel sarcolemma, e mito-KATP,
presenti nella membrana mitocondriale interna delle cellule. I canali KATP cardiaci
sono inattivati in presenza di concentrazioni fisiologiche di ATP intracellulare, e si aprono quando i livelli di ATP diminuiscono. Nella cellula cardiaca questi canali hanno la funzione di proteggere la cellula da un sovraccarico di calcio durante ipossia prolungata, e pertanto rappresentano potenziali target per agenti terapeutici in grado di proteggere il cuore dal danno ischemico.
9
2. L’ISCHEMIA
L’ischemia è caratterizzato da diminuzione o soppressione dell'apporto di sangue in un determinato distretto corporeo.
I tessuti colpiti da ischemia sono caratterizzati da:
ridotto apporto di ossigeno (ipossia, anossia)
ridotta disponibilità di nutrienti
ridotta eliminazione delle sostanze di rifiuto
Questa situazione si traduce in uno stato di sofferenza tissutale che può compromettere seriamente la funzionalità degli organi colpiti.
10
2.1 PRINCIPALI CAUSE DELL’ISCHEMIA
L’ischemia è dovuta alla parziale o totale occlusione delle arterie ed è legata, principalmente, alla formazione di placche aterosclerotiche che ispessiscono le pareti del vaso così da rallentare il flusso sanguigno. Nel caso del miocardio, quindi di infarto miocardico, l’occlusione colpisce le coronarie impedendo al sangue di alimentare parti del cuore. A livello cerebrale, l’organo colpito dall’occlusione delle arterie è il cervello e si parla di ictus cerebrale. In entrambi i casi i tessuti si necrotizzano con conseguenze invalidanti o decesso.
2.2 ISCHEMIA DEL MIOCARDIO
A livello delle cellule del miocardio, l’ischemia causa cambiamenti biochimici, morfologici e funzionali 22. La prima conseguenza dell’assenza di ossigeno nelle fibre miocardiche ischemiche, è la riduzione della concentrazione di ATP, in quanto solo una piccola quantità di ADP viene trasformata in ATP dalla glicolisi anaerobica. Quest’ultima determina un accumulo di ioni idrogeno e di lattato con conseguente acidosi intracellulare ed ulteriore inibizione della glicolisi 23. Inoltre, a causa della ridotta attività della pompa ionica ATP dipendente, si ha un aumento della concentrazione intracellulare di ioni Ca2+, compromettendo l’integrità della membrana cellulare. La riperfusione che segue il periodo ischemico, causa un rigonfiamento cellulare con possibile distruzione del sarcolemma, contribuendo, così, ad un ampliamento del danno tissutale 23. Nelle fibre cardiache si assiste ad un ulteriore incremento della concentrazione di Ca2+, con conseguente attivazione di enzimi degradativi come proteasi, endonucleasi e fosfolipasi. Infine, anche la formazione di specie radicaliche dell’ossigeno (ROS), contribuisce alla necrosi tissutale.
11
2.3 IL PRECONDIZIONAMENTO ISCHEMICO
Il tessuto miocardico, in seguito a ripetuti e brevi episodi ischemici, è in grado di sviluppare una serie di processi di adattamento che lo proteggono nei confronti di successivi insulti ischemici, anche se prolungati. Questo comportamento autoprotettivo del miocardio è stato definito “precondizionamento ischemico” (IPC)24 da Murry et al., che nel 1986 lo descrissero come un meccanismo di protezione endogena del miocardio al danno ischemico. Questo processo, consta essenzialmente di due fasi: la prima fase detta “classica” che dura da 1 a 3 ore dopo il precondizionamento e da una seconda che va dalle 24 alle 96 ore 25. I meccanismi dell’IPC sono complessi e non sono stati ancora completamente chiariti. Tuttavia possiamo distinguere meccanismi di attivazione recettore-indipendente e recettore-dipendenti 26.
2.3.1 Meccanismi recettori-indipendenti
Gli agenti recettori-indipendenti intervengono nel processo di IPC senza interagire con particolari recettori. Tra questi agenti un esempio è dato dall’ossido di azoto (NO), la cui concentrazione aumenta durante il periodo ischemico. Infatti è stato dimostrato in studi condotti sui ratti che un’inibizione dell’enzima NOS sintetasi, determina una riduzione del precondizionamento ischemico 27, mentre, viceversa, la somministrazione di farmaci donatori di NO riduce il danno miocardico post-ischemico in differenti specie animali.
12
2.3.2 Meccanismi recettori-dipendentiSostanze come adenosina, bradichinina, noradrenalina, oppioidi, sono classificati come agenti recettore-dipendenti e sono capaci di innescare l’effetto cardioprotettivo attraverso l’interazione con specifici recettori a proteina G.
Fig.5 Rappresentazione schematica dei meccanismi coinvolti nel precondizionamento ischemico.
Il legame di questi agenti con i loro recettori provoca l’attivazione della fosfolipasi C (PLC)che a sua volta catalizza l’idrolisi del fosfatidilinositolo
4,5-13
bifosfato (PIP2), generando i secondi messaggeri inositolo 1,3,4-trifosfato (IP3) e diacilglicerolo (DAG) che vanno a stimolare la proteina chinasi C (PKC), la quale è ritenuta mediatore centrale nell’IPC 28
.
L’evento chiave finale dell’IPC, conseguente all’attivazione della PKC, sembra comunque essere l’apertura dei canali ATP-sensibili del potassio (canali KATP) sia
della membrana citoplasmatica sia dei mitocondri. L’apertura di questi canali è mediata dalla fosforilazione delle proteine del canale da parte appunto della PKC che causa una riduzione dell’afflusso di Ca2+
14
3. CANALI SARC K
ATPE MITO K
ATPI canali KATP cardiaci sono localizzati sia nella membrana sarcolemmatica sia in
quella mitocondriale (rispettivamente sarc-KATP e mito-KATP). Il canale cardiaco
sarc-KATP è costituito da una molecola ottomerica composta da quattro subunità
Kir6.2 e da quattro subunità SUR2A 29.
Fig.6 Struttura molecolare del canale sarc- KATP
L’apertura del canale sarc-KATP, che può essere indotta da ipossia, ischemia, o da
agenti farmacologici, accelera la ripolarizzazione delle membrane dei cardiomiociti, riducendo la durata del potenziale di azione e inibendo lo scambio Na+/K+, con conseguente diminuzione dell’ingresso di ioni Ca2+ nella cellula. Ciò previene la saturazione di Ca2+ nella cellula e migliora la conducibilità della
15
cellula stessa, riaggiustando il bilanciamento tra consumo energetico e domanda energetica.
Queste osservazioni farebbero ipotizzare una correlazione tra l’aumento della resistenza al danno ischemico e l’attivazione dei canali sarc-KATP, ma studi recenti
hanno indicato che i maggiori responsabili della protezione antischemica sono i canali mito-KATP, piuttosto che i canali sarc-KATP.30,31 Questa ipotesi è stata
avanzata dall’osservazione che gli agonisti dei canali KATP, come bimakalim e
cromakalim, erano in grado di indurre un effetto cardioprotettivo anche a dosi prive di efficacia sul potenziale di membrana del sarcolemma. Questo effetto protettivo viene annullato dalla glibenclamide, bloccante del canale KATP, che
impedisce inoltre il recupero della funzione ventricolare durante il periodo di riperfusione 32.
Fig.7 Rappresentazione del meccanismo di attivazione correlato del canale mito-KATP e del
sarc-KATP
L’attivazione dei canali mito-KATP permette un netto afflusso di ioni K+
all’interno della matrice e la depolarizzazione della membrana interna che contrasta l’ingresso di ioni Ca2+
all’interno del mitocondrio33. In caso di ischemia, i livelli cellulari di Ca2+ aumentano a causa di una massiccia entrata dello ione Ca2+ nel compartimento extracellulare. Questo innalzamento della concentrazione citosolica di Ca2+ è contrastata dal passaggio di ioni Ca2+ all’interno dei mitocondri attraverso canali Ca2+ selettivi. Ad alte concentrazioni di Ca2+ mitocondriale si ha l’apertura dei pori di transizione della permeabilità
16
mitocondriale (MPTP) che porta un danno irreversibile al tessuto cardiaco a causa del rilascio di proteine pro-apoptotiche, come il citocromo C.
Fig.8 Rappresentazione del poro transitorio di permeabilità mitocondriale (MPTP). In condizioni normali il poro è chiuso, mentre si apre in condizioni di stress ossidativo, causando danni cellulari irreversibili.
Quindi l’attivazione dei canali mito-KATP, potrebbe impedire oltre che l’entrata di
Ca2+ nella matrice mitocondriale, anche l’apertura dell’MPTP nella fase di riperfusione 34. Il ridotto accumulo di Ca2+ nella matrice mitocondriale potrebbe essere responsabile della cardioprotezione anche se questa spiegazione non è del tutto esaustiva. E’ stato comunque dimostrato che, in seguito a somministrazione di agonisti dei canali KATP nei mitocondri isolati, si può osservare una ridotta
produzione di specie reattive dell’ossigeno, attribuita all’alcalinizzazione della matrice 35, indotta dal flusso di ioni K+ e all’aumento di ossidazione degli acidi grassi 36. Questo flusso di ioni K+, è anche accompagnato dall’ingresso di acqua e di ioni nel mitocondrio, provocando un rigonfiamento della matrice, con
17
conseguente diminuizione della permeabilità della membrana esterna ai nucleotidi (ATP e ADP) 37-38. In condizioni normali, infatti, la permeabilità della membrana nei confronti di ATP e ADP è modesta, e lo scambio energetico tra mitocondri e citosol è efficientemente controllato da creatina e fosfocreatina. In condizioni di ipossia, invece, la conduttanza della membrana esterna diminuisce con conseguente contrazione della matrice ed espansione dello spazio tra la membrana esterna ed interna. Tutto ciò comporta un aumento della permeabilità della membrana esterna all’ADP e all’ATP 39,40
18
4. AGONISTI DEI CANALI K
ATPTra gli agonisti dei canali KATP (KCOs), possiamo distinguere quelli di “prima
generazione” che non sono selettivi e agendo anche sui canali sarc-KATP,
producono effetti indesiderati come la vasodilatazione e l’iperglicemia. Essi appartengono a varie classi chimiche, tra cui: benzopirani, ciano guanidine, tioformammidi, tiadiazine, piridilnitrati, pirimidin solfati.
Quelli di “seconda generazione” presentano maggiore selettività verso i canali mito-KATP e includono: ciclobutenedioni, derivati delle diidropiridine, carbinoli
terziari.
4.1 KCOs DI PRIMA GENERAZIONE:
Benzopirani
Il capostipite di questa classe è il cromakalim 41, che è stato sintetizzato la prima volta nel 1980. O CH3 CH3 OH NC N O CROMAKALIM
Il cromakalim contiene 2 carboni chirali e l’attività risiede nell’enantiomero
3S,4R- (levcromakalim). Questo composto è frequentemente usato come farmaco
19
O CH3CH3 OH N O NC LEVCROMAKALIMÈ stato sottoposto a varie modifiche strutturali:
Variazioni strutturali in posizione 4
Il gruppo carbonilico, in posizione 4 della pirrolidina del cromakalim, è stato considerato essenziale per l’attività biologica poiché i lattami sono vasodilatatori più potenti rispetto alle ammine cicliche originarie. Le prime variazioni in posizione 4 comprendono lattami e sostituenti contenenti gruppi carbonilici in posizione α dal punto di attacco sul nucleo benzopiranico, mentre recenti variazioni includono sostituenti contenenti carbonili, ma non in posizione originale. Le modifiche strutturali principali effettuate in posizione 4 comprendono:
sostituzioni di natura ciclica (sostituenti “non a ponte”)
sostituzioni con eteroatomi a loro volta sostituiti con raggruppamenti ciclici (sostituenti “a ponte”)
20
Fig.9 Rappresentazione schematica delle principali modifiche strutturali in posizione 4
Le dimensioni del sostituente ciclico nel carbonio in posizione 4 del nucleo benzopiranico influenzano molto l’attività: gli anelli a 6 termini mostrano una potenza superiore rispetto a quelli a 5 termini, che sono a loro volta più potenti degli anelli a 4, 7 e 8 termini 42. La sostituzione con gruppi biciclici, determina una riduzione della potenza ad eccezione del celikalim.
N O
O
OH F3O
21
Variazioni strutturali in posizione 3La maggior parte dei benzopirani in posizione 3 non sono sostituiti o hanno un gruppo idrossilico, e la sua sostituzione in genere fa diminuire la potenza antiipertensiva.
Composti che, al posto dell’ OH, presentano un gruppo CHO o CH2OH,
mantengono una moderata attività, mentre la sostituzione con un atomo di bromo o con un metile porta a scomparsa dell’attività 43
. Alcuni autori hanno studiato la possibilità di scambiare la posizione 3 con la 4: un esempio è dato dal composto
BRL 49381 che ha una potenza paragonabile al cromakalim.
O O H NH O NH(CH3)3 NC BRL 49381
L’importanza del gruppo OH è tuttavia ambigua. La presenza di tale gruppo nel levcromakalim aumenta la potenza di 15 volte rispetto all’analogo non sostituito
46
,tuttavia composti come KC-399, che mancano del sostituente in C3 sono molto
più potenti del levcromakalim.
O2N O CH2F CH2F S NH CN KC 399
22
Quindi è improbabile pensare che sia il gruppo idrossilico stesso ad interagire con il sito d’azione, ma bensì che serva a stabilizzare la conformazione bioattiva. Infatti solo in presenza dell’idrossile in 3 si osserva un significativo rapporto eudismico nel cromakalim, mentre in assenza di tale gruppo la differenza nell’attività dei due enantiomeri è marginale 44.
Variazioni strutturali in posizione 2
L’influenza sulla potenza dei derivati benzopiranici del sostituente in posizione 2, dipende dalla natura del sostituente in posizione 4.
Per il cromakalim la sostituzione ottimale in posizione 2 è data dal gruppo dimetilico, che risulta migliore rispetto ad un solo metile e molto superiore rispetto al gruppo dietilico. Il diidroderivato risulta praticamente privo di attività
45
. Tuttavia in una serie di benzopiran-4-carbotioammidi, sostituenti più ingombranti risultano positivi: in particolare composti che presentano gruppi spiro-ciclobutilici o ciclopentilici in posizione 2 sono tra i derivati più potenti.
Sostituzioni aromatiche
La posizione e la natura dei sostituenti aromatici hanno una certa influenza sull’attività di questi derivati benzopiranici. L’attività aumenta passando da sostituenti in posizioni 7 a sostituenti in 6, mentre la sostituzione in 5 e in 8 annulla completamente l’attività. Recenti studi attribuiscono l’attività ottimale a piccoli gruppi elettronegativi, con il seguente ordine: -NO2, -CF3, -CN, -OCF3,
-C2F5, - MeCO -CHO,- H. Recentemente è stato osservato che anche gruppi
arilsolfonammidici conferiscono una elevata potenza. Da studi conformazionali e di SAR è stato ipotizzato che questi sostituenti solfonamidici estendono il sito di legame dei KCOs benzopiranici: oltre ad un sito che interagisce con il gruppo parzialmente polarizzato SO2, ci potrebbe essere un piccolo sito che permette
interazioni π favorevoli con la porzione fenilica 46
23
scoperto che i sostituenti più ingombranti, come il fenilsulfonile in posizione 6 del
rilmakalim, sono capaci di conferire un’elevata potenza 47. Sembra che i sostituenti in 6 accrescano l’interazione con il sito di legame.
S O O O OH N O
RILMAKALIM
Trasformazioni del nucleo benzopiranico
Il sito di legame per i benzopirani consente modificazioni sia dell’anello aromatico che di quello piranico. La piridina può sostituire il gruppo cianofenilico, come nel composto A; l’azoto deve essere in posizione 6 o 7, mentre se si trova in posizione 5 o 8 l’attività diminuisce 48
. Un’altra sostituzione favorevole è rappresentata dall’anello tiofenico come nel composto B
O OH N O S O2N B N O OH N O A
24
La sostituzione dell’anello piranico spesso porta a composti solo moderatamente attivi.
L’introduzione di un NH o CH2 riduce l’attività di 10 volte rispetto al
cromakalim, mentre la sostituzione con un carbonile la riduce di 30 volte. Se l’ossigeno viene sostituito con un atomo di zolfo la potenza si mantiene pressoché uguale; l’ossidazione a solfossido o a solfone è deleteria 49.
Sostituzioni vantaggiose dell’anello piranico comprendono sistemi eterociclici come la 1,4-benzossazina, YM 934, che è un potente vasodilatatore, con attività pronunciata particolarmente sulle arterie coronarie 50. La migliore sostituzione dell’anello piranico è stata però trovata con i derivati benzotiazinici (C e D), i quali hanno azione vasorilasciante sia in vitro che in vivo.
N S O O2N C O2N N O N O YM 934 N S NC O D
25
4.2 CIANO GUANIDINE
Il prototipo di questa classe è il pinacidil e la sua attività risiede nell’enantiomero R-(-).I primi studi di SAR sui derivati del pinacidil hanno permesso di dimostrare che i derivati 3-piridinici come P-1075 sono più potenti dei corrispondenti 4-piridinici, ad eccezione del pinacidil stesso. Il composto P-1075 è un attivatore selettivo dei canali sarc-KATP poichè si lega con elevata affinità alle subunità
SUR2A e SUR2B. P-1075, infatti, riduce la disfunzione contrattile e il sovraccarico di calcio in seguito a inibizione metabolica nelle cellule miocitarie del ratto.
Nella porzione centrale, la catena cianoguanidinica si è rivelata migliore della tiourea e molto superiore all’urea. Lo scambio del gruppo ciano con altri gruppi polari porta a composti privi di attività. Nella parte terminale della catena lipofila sono ottimali gruppi alchilici piccoli e ramificati 51.
N N N H CN NH N P-1075 N N NH CN NH tBu PINACIDIL
26
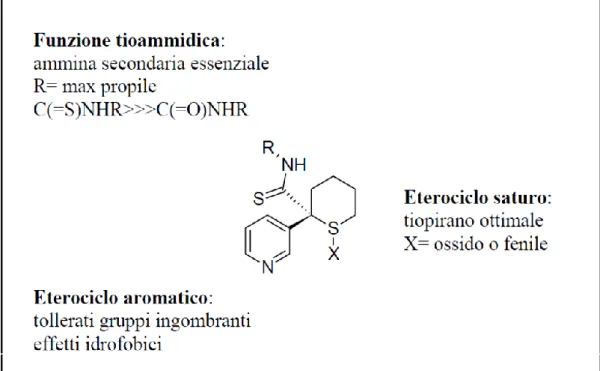
4.3 TIOFORMAMMIDI
Il prototipo di questa classe è rappresentato dall’aprikalim
S O
S
NH N
APRIKALIM
I precursori di questo composto sono i derivati tioammidici di tetraidrotiofene, tetraidrofurano, 1,3-ossatiano o 1,3-ditiano aventi proprietà ulcera e anti-secretorie, e recanti una porzione piridilica in posizione 2.
Gli studi di SAR hanno messo in evidenza che nella regione della molecola corrispondente alla porzione tioammidica 52 sono permesse solo pochissime modificazioni. La preferenza per piccoli gruppi alchilici indica la presenza di una tasca idrofobica ristretta sul sito recettoriale. I gruppi migliori sono l’etile o il propile, ma il butile o il fenile sono ancora di dimensioni accettabili.
L’enorme perdita di attività che si verifica quando si sostituisce la tioamide con un’ammide sottolinea i precisi requisiti strutturali necessari per l’interazione in questa parte della molecola.
Per quanto riguarda il raggruppamento eterociclico 52, la posizione dell’azoto
nell’anello piridinico è molto importante per la potenza, infatti nei derivati sostituiti in posizione 2 e 4 si ha una drastica perdita di attività. Questo può essere compensato da un’adeguata sostituzione con gruppi elettronattrattori: l’attività migliore è mostrata dal derivato 3,4-dicloro sostituito. Particolarmente interessante è il fatto che il gruppo 3-chinolil sia migliore del 3-piridile, e il 2-naftil meglio del fenile. Questo dimostra una buona tolleranza nell’ingombro
27
sterico in questa parte della molecola, e sostiene l’ipotesi di interazioni idrofobiche.
Per quanto riguarda l’altra porzione tioformammidica, l’eterociclo saturo, studi farmacologici 52 hanno dimostrato chiaramente che il gruppo tiopiranico è essenziale per l’attività. Infatti se si sintetizzano derivati analoghi contenenti un solfone, un gruppo tetraidrotiofenico o tetraidrofuranico, si ha un drastico calo dell’attività. E’ stato dimostrato, inoltre, che l’attività viene quasi mantenuta con un cicloesano e per questo si è approfondito lo studio di nuovi composti contenenti la porzione cicloesanica.
28
4.4 BENZOTIADIAZINE
Il prototipo di questa classe di KCOs è il diazossido
N N H S O O DIAZOSSIDO
Il diazossido differisce dagli altri KCOs per molti aspetti. Il suo sito di legame è localizzato in una regione della subunità SUR, diversa da quella di benzopirani e delle cianoguanidine. Esso, inoltre, mostra una buona selettività nei confronti dei canali mito-KATP, che vengono attivati a basse dosi del farmaco; ad alte dosi,
invece, il diazossido agisce sui canali KATP dei muscoli dell’endotelio vasale e
debolmente sui canali sarc-KATP.
4.5 PIRIDILNITRATI
Il prototipo di questa classe è rappresentato dal nicorandil.
N O
NH ONO2
NICORANDIL
Esso, oltre ad agire come donatore di NO, è in grado di stimolare l’attività della guanilato-ciclasi nella muscolatura liscia vascolare. I dati di SAR su questa classe di composti sono pochi, e il numero di analoghi del nicorandil presenti in
29
letteratura è limitato. Tra questi ci sono il composto D, in cui l’anello piridinico è stato sostituito con uno piperazinico, e E e F, che invece presentano rispettivamente un anello pirazinico o tiazolico.
N N N O NH ONO2 D
4.6 KCO
SDI SECONDA GENERAZIONE
I KCOs di seconda generazione sono dei farmaci aventi una maggiore selettività tissutale rispetto a quelli di prima generazione. Questi prodotti innovativi potrebbero, pertanto, apportare importanti vantaggi in molti settori terapeutici. La necessità di sviluppare composti più selettivi nei confronti dei canali mito-KATP è nata dal fatto che i KCOs di prima generazione hanno manifestato effetti
secondari dovuti all’attivazione dei canali KATP in diversi tessuti, ad esempio il
potente vasorilasciamento dovuto all’apertura dei canali KATP presenti nella
muscolatura liscia vascolare.
N S O NH ONO2 F N H N O NH ONO2 E
30
I primi composti ad essere stati sintetizzati possiedono una struttura ibrida tra i benzopirani e le ciano guanidine 53. Tra questi, BMS 180448, ha mostrato scarse proprietà vasorilascianti, mantenendo un potere cardioprotettivo soddisfacente.
O OH N NH NC NH Cl NC
BMS 180448
BMS 180448 presenta un’attività antischemica comparabile a quella del cromakalim, va ad aumentare il tempo di contrazione ( l’arco di tempo necessario durante l’ischemia globale ad aumentare la pressione diastolica finale di 5mmHg), e inoltre diminuisce il rilascio di lattato deidrogenasi (LDH). Al contrario del cromakalim che manifesta un apprezzabile aumento del flusso sanguigno coronarico, BMS 180448 non possiede nessun effetto vascolare rilevante. Inoltre, il cromakalim riduce significatamente l’ADP e l’intervallo QT, al contrario di BMS 180448 che non altera questi parametri.
Sono stati effettuati importanti studi di SAR 54 per ottimizzare le proprietà cardioselettive. Per quanto riguarda le modifiche sull’anello benzopiranico, la sostituzione dell’ossigeno in posizione 1 con un metilene è tollerata, al contrario di quella con l’azoto che è deleteria e conduce a composti privi di attività. I gruppi metilici geminali sono essenziali, infatti gli analoghi demetilati sono inattivi. La presenza del gruppo ossidrilico in posizione 3 non è necessaria ai fini dell’efficacia del farmaco, ma se è presente, l’enantiomero trans risulta più attivo del cis. L’introduzione di un doppio legame 3-4 abolisce l’attività antischemica. Al fine di ridurre ancora di più l’attività vasorilasciante di BMS 180448, alcuni studiosi hanno sintetizzato una serie di benzopirani N-aril sostituiti. All’interno di
31
questa serie di composti spicca BMS 191095, che risulta essere almeno trenta volte più selettivo rispetto al precedente 55.
La sua attività antischemica risiede principalmente nell’enantiomero 3S,4R-, e questa enantioselettività è opposta a quella di BMS-180448. L’attività cardioprotettiva è simile a quella del cromakalim e del BMS 180448, ed è antagonizzata da farmaci come la glibenclamide e il 5-HD. Pur avendo manifestato un miglioramento della funzione post-ischemica, un aumento di contrazione e una diminuizione del rilascio di LDH, studi in vitro e in vivo sul profilo farmacologico di BMS-191095, hanno rivelato che questo composto non può avere un impiego terapeutico vantaggioso a causa delle sua neurotossicità, ma è da considerarsi comunque un valido strumento per la sintesi futura di nuove entità dotate di attività cardioprotettiva 56.
O
N NH Cl
OH
32
4.7 ANTAGONISTI DEI CANALI K
ATPTra gli antagonisti dei canali al potassio i più noti abbiamo la glibenclamide e il
5-idrossidecanoato.
La glibenclamide è una sulfanilurea che agisce sulle subunità SUR1 e SUR2A/2B, espresse rispettivamente a livello delle cellule cardiache e vascolari; Il 5-idrossidecanoato (5-HD) invece, è un inibitore specifico dei canali mito-KATP
ed e quindi utile per effettuare studi farmacologici su composti attivi a livello di questi canali. E’ stato inoltre evidenziato che il 5-HD inibisce il flusso di ioni K+ indotto da diazossido.
La sulfaniltiourea HMR 1098, ottenuta dalla glibenclamide, e un bloccante selettivo dei canali sarc-KATP; per questo e utilizzata in combinazione con un
bloccante non selettivo per investigare sui meccanismi coinvolti nell’IPC.