3. MATERIALI E METODI
3.1 GENERAZIONE DEI TOPI
Tutti i topi che ho utilizzato in questo lavoro di tesi sono stati generati nei laboratori della dottoressa Silvia Nicolis, presso il “Dipartimento di Biotecnologie e Bioscienze” dell’Università Milano-Bicocca.
3.1.1 TOPI Sox2 knock down
Le mutazioni in Sox2 sono state generate per gene targeting in cellule ES derivanti da topi appartenenti al ceppo 129, le chimere ottenute con queste cellule (mediante loro microiniezione in blastocisti) sono state successivamente accoppiate con femmine appartenenti al ceppo C57BL/6 per ottenere la germ
line trasmission (cioè topi interamente eterozigoti per la mutazione, originati
da un gamete ES cell-derived, quindi 129, fornito dalla chimera, e da un gamete fornito da C57).
Successivamente, per ottenere i topi mutanti in entrambe le copie del gene
Sox2 (genotipo null/knockdown), i portatori delle singole mutazioni sono stati
accoppiati tra loro.
I topi Sox2 knock down (genotipo null/knockdown) sono stati confrontati con topi
Sox2 eterozigoti (genotipo Sox2 +/β-GEO) e topi wild tipe (genotipo Sox2 +/+):
entrambi, per tutti gli altri loci, sono una miscela di alleli 129 e C57, cioè possono essere 129/129, 129/C57 oppure C57/C57, in modo non prevedibile per il singolo locus, ma con la stessa probabilità per i mutanti e i controlli.
Ho utilizzato questa coppia di topi non solo per i saggi in vitro, ma anche per i trapianti competitivi su topi riceventi compatibili.
3.1.2 TOPI RICEVENTI PER SAGGI DI RIPOPOLAZIONE
I topi riceventi sono una generazione F1 ottenuta da un incrocio C57/C57 x 129/129, quindi sono eterozigoti 129/C57 per qualsiasi gene (inclusi quelli di istocompatibilità - HLA). Questi topi dovrebbero riconoscere come self gli antigeni di istocompatibilità dei topi donatori.
3.2 ANALISI DEL SANGUE PERIFERICO
I topi sono stati sacrificati per dislocazione cervicale e successivamente è stata eseguita un’apertura toracica per poter accedere all’aorta, da cui vengono prelevati con una pasteur 100μl di sangue e trasferiti in una provetta eparinizzata per evitarne la coagulazione.
I campioni sono sottoposti ad esame emocromocitometrico (contenuto di emoglobina e numero di elementi figurati del sangue per mm3) ed ematocrito (rapporto tra volume del plasma e quello dei globuli rossi) presso il laboratorio di ematologia della Clinica Medica Veterinaria.
3.3 SAGGIO CLONOGENICO IN METILCELLULOSA
Poiché i precursori emopoietici sono rari, morfologicamente indifferenziati e non è stato ancora possibile ottenere una popolazione omogenea sulla base dell’espressione di antigeni di superficie, per lo studio di tali cellule abbiamo
utilizzato un saggio clonogenico in mezzo semisolido (Iscove e Sieber 1975). Tale test permette di studiare la capacità proliferativa e differenziativa dei progenitori ematopoietici in base all’analisi del tipo di cloni da essi derivati. Sono utilizzabili due diversi tipi di mezzi semisolidi: agar e metilcellulosa (Mtc) che presentano caratteristiche proprietà.
L’agar è solubile in acqua ad alte temperature, ed il raffreddamento permette la formazione di un gel che assicura l’immobilizzazione delle cellule, inoltre è facilmente manipolabile con pipette.
La Mtc è invece solubile in acqua ad ogni temperatura ed immobilizza le cellule grazie all’elevata viscosità; proprio per questa caratteristica deve essere manipolata esclusivamente con siringhe. D’altra parte la Mtc offre diversi vantaggi rispetto all’agar: è chimicamente meglio definita, è molto più inerte, non presenta contaminanti mitogeni, e, data la solubilità a temperatura ambiente, è molto più facile recuperare le cellule in coltura per analisi successive (Iscove e Schreler 1979).
3.3.1 PROTOCOLLO DEL SAGGIO CLONOGENICO
Le colture di Mtc sono state eseguite in piastre Petri (diametro 35 mm), in un volume finale di 1 ml.
Le condizioni utilizzate per il test clonogenico sono le seguenti: Fetal Calf Serum (FCS) 5% Bovine Serum Albumin (BSA) 20% Transferrina (Tf) 300ng/ml Lipidi 0.8%
Eritropoietina (Epo) 2U/ml Stem Cell Factor (SCF) 10 ng/ml Interleuchina-3 (IL-3) 10 ng/ml Trombopoietina (TPO) 25 ng/ml Metilcellulosa (Mtc) 60% Iscove’s Modified Dulbecco’s Medium (IMDM) a volume
La percentuale della Mtc è molto importante, perché il mezzo di coltura deve essere sufficientemente fluido da permettere alle cellule di sedimentare in un unico piano entro 24 ore e, allo stesso tempo, abbastanza viscoso da impedire che le colonie formate possano fluttuare.
Le cellule midollari sono prelevate dai femori e dalle tibie dell’animale con siringhe, risospese in IMDM al 5% di FCS e contate in una camera di Burker. Le cellule sono coltivate a diverse concentrazioni: 25.000, 100.000 per ml e ogni test clonogenico viene eseguito in duplicato. Le piastre sono quindi poste in incubatore a 37°C, al 5% CO2 atmosferica.
Al giorno 2 si possono trovare colonie di tipo eritroide CFU-E (colonie formate da piccole cellule compatte rappresentanti precursori tardivi della linea eritroide).
A partire dal 7° giorno si riconoscono colonie di tipo eritroide (formate da piccole cellule che presentano una colorazione rossa per la presenza di emoglobina) originate da precursori unipotenti appartenenti alla linea eritroide (BFU-E); colonie di tipo granulocitico-macrofagico derivate da precursori bipotenti (CFU-GM), colonie miste (formate anche da milioni di cellule, appartenenti a differenti tipi cellulari: eritroidi, granulociti, macrofagi, megacariociti) che derivano da precursori multipotenti (CFU-MIX).
Infine si possono trovare colonie formate da soli megacariociti, derivanti da un precursore unipotenti CFU-Mk, da soli macrofagi o da soli granulociti, le prime derivate da precursori unipotenti CFU-M, le seconde da precursori unipotenti CFU-G e sono distinguibili dalla grandezza delle cellule che le compongono.
3.4 COLTURE SECONDARIE DI PRECURSORI MIDOLLARI
I saggi di replating in vitro vengono utilizzati per valutare la capacità autoreplicativa dei precursori ematopoietici. Le colonie ottenute negli esperimenti primari vengono ripiastrate in mezzo semisolido, e, successivamente, viene valutata la presenza di colonie secondarie.
Le singole colonie CFU-Mix sono state prelevate al giorno 7 dalla piastra primaria e trasferite in un pozzetto di una 96-multiwell contenente 100µl di terreno fresco (con stessa composizione dei saggi clonogenici).
Le piastre sono state quindi poste in incubatore a 37°C, al 5% CO2 atmosferica
per 7-9 giorni, dopo i quali sono stati esaminati il numero e il tipo di colonie secondarie derivanti da una singola CFU-MIX.
3.5 SAGGI DI RIPOPOLAZIONE IN VIVO A LUNGO TERMINE
Poiché le cellule staminali non possono essere isolate e analizzate in vitro, lo studio delle loro potenzialità proliferative e differenziative è possibile attraverso saggi di ripopolazione in vivo a lungo termine.
Questi consistono nel trapiantare cellule midollari in topi letalmente irradiati e quindi depleti delle loro cellule ematopoietiche, ma non di quelle stromali. L’irradiamento viene effettuato presso il reparto di terapia intensiva dell’ospedale S.Chiara di Pisa.
I topi, all’interno di un apposito contenitore di plexiglass, permeabile alle radiazioni, vengono sottoposti a fasci di raggi X. La quantità specifica di radiazione assorbita è pari a circa 800 rad (1 rad=10-2J/Kg), dose necessaria per colpire selettivamente le cellule ematopoietiche di un topo appartenente al ceppo C57 o 129, preservando la funzionalità del microambiente.
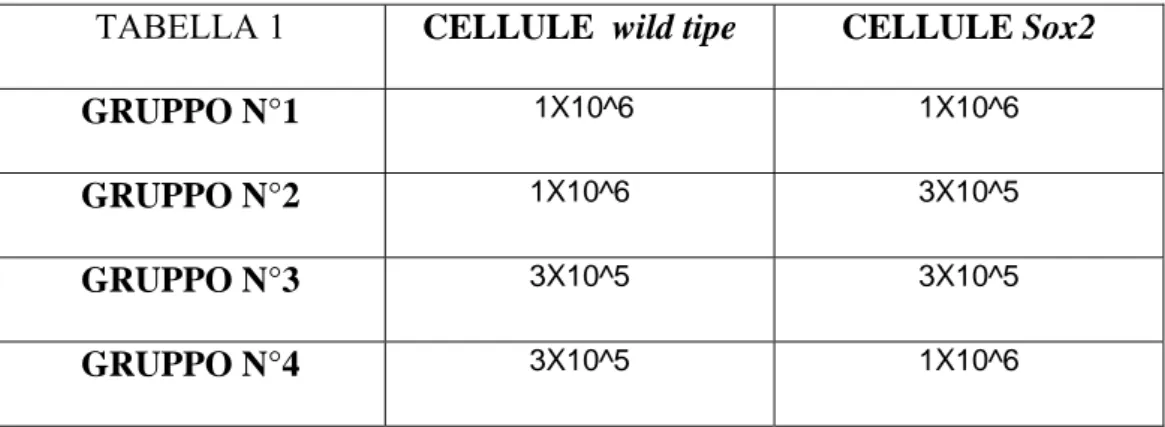
Entro poche ore dal trattamento, gli animali vengono trapiantati con cellule midollari prelevate dai topi donatori Sox2 knock down e wild tipe, secondo proporzioni prestabilite (riportate nella tabella 1), fatta eccezione per alcuni topi usati come controllo dell’irradiamento, che andranno incontro a morte dopo circa dieci giorni.
Dopo quattro mesi dal trattamento, si analizzano gli animali ricostituiti attraverso saggi clonogenici in vitro.
Tale periodo di attesa ci fornisce la sicurezza che l’ematopoiesi del topo trapiantato derivi interamente dalle cellule staminali del donatore, poiché sono le uniche in grado di sostenere la produzione delle cellule del sangue a lungo termine.
TABELLA 1 CELLULE wild tipe CELLULE Sox2
GRUPPO N°1 1X10^6 1X10^6
GRUPPO N°2 1X10^6 3X10^5
GRUPPO N°3 3X10^5 3X10^5
3.6 CITOCENTRIFUGA
Ho utilizzato questa tecnica per valutare la morfologia delle cellule midollari e di quelle ottenute dalle colonie prelevate dalla metilcellulosa.
Dopo aver estratto il midollo dai femori e dalle tibie dell’animale, le cellule vengono risospese in IMDM al 30% di FCS (il siero evita che le cellule siano danneggiate dall’azione della citicentrifuga), contate con una camera di Burker e diluite ad una concentrazione finale di 40x10*4 Cell/ml.
Dalle diluizioni vengono prelevati 200 μl e citocentrifugati per 7 minuti a 900 RPM.
Per quanto riguarda le colonie, le cellule provenienti dai diversi cloni formati nelle colture in terreno semisolido vengono prelevate con una pasteur allungata alla fiamma e risospese in 100μl di IMDM al 30% di FCS. Questo stesso volume viene prelevato e citocentrifugato.
3.7 PREPARAZIONE E COLORAZIONE DEI VETRINI
Per una analisi morfologica, tutti i vetrini (strisci di sangue, citocentrifughe di cellule midollari e di colonie) devono essere fissati, colorati e montati.
Per evitare che le cellule subiscano uno scock ipotonico per l’applicazione di un colorante e, quindi, la loro lisi, i vetrini vengono fissati immergendoli in etanolo assoluto freddo di ghiaccio per 5 minuti.
Dopo averli lasciati ad asciugare, i vetrini vengono prima colorati con May-Grumwald assoluto per 3,5 minuti e successivamente con Giemsa al 15% in tampone Sorensen per 15 minuti.
A questo punto i vetrini sono stati montati con un apposito liquido di montaggio (Biomount).
3.8 MORFOLOGIA
Il riconoscimento morfologico delle cellule del sangue,del midollo osseo e di quelle presenti in coltura è basato sulle descrizioni riportate su un atlante ematologico (Tavole ematologiche Sandoz 1952).
3.9 CONGELAMENTO DELLE CELLULE
Le cellule sono congelate in IMDM in presenza di 10% DMSO (dimetilsulffossido) e 30% di FCS, in un volume finale di 1,5 ml e ad una concentrazione finale pari a 7x106c/vial.
3.10 SCONGELAMENTO DELLE CELLULE
Le cellule vengono scongelate a 37°C per accelerare il processo ed impedire eventuali danni da parte del DMSO, che è tossico. La sospensione cellulare viene immediatamente trasferita in una provetta contenente IMDM al 10% di FCS, per essere poi centrifugata a 1000 giri/minuto per 7 minuti. Il pellet cellulare viene risospeso in IMDM al 10% di siero.
3.11 REAGENTI
3.11.1 IMDM ( Iscove’s modified Dulbecco’s medium)
Una confezione di IMDM (Gibco) viene sciolta in 900ml di acqua bidistillata. A questi sono aggiunti:
- 6,3 μl di α-tioglicerolo;
- penicillina e streptomicina ad una concentrazione finale di 100u/ml; - 50 ml di una soluzione contenente 3,024 gr di NaHCO3.
Infine la soluzione è portata a volume (1 litro) con acqua bidistillata.
Il mezzo viene poi filtrato utilizzando filtri di acetato di cellulosa (diametro dei pori 0.2 μm) e conservato a + 4°C.
3.11.2 PREPARAZIONE DELLA METILCELLULOSA
Ad una beuta sterile e pesata, vengono aggiunti 450 ml di acqua bidistillata che vengono portati ad ebollizione su fiamma bunsen.
Vengono aggiunti all’acqua 20 gr di Mtc e la beuta viene coperta con un foglio di alluminio.
La Mtc viene accuratamente sospesa con un vigoroso scuotimento della beuta e la sospensione è nuovamente scaldata fino ad ebollizione e immediatamente tolta dalla fiamma.
La beuta viene poi raffreddata sotto acqua corrente fino ad una temperatura di 40-50 °C.
Si aggiungono 500 ml di IMDM 2x e acqua distillata fino a raggiungere un peso di 1006 grammi. Dopo ulteriore agitazione, la beuta è posta in ghiaccio per 1-2 ore. Successivamente il preparato viene suddiviso in aliquote da 50 ml e conservate a –20°C. Prima dell’uso le aliquote devono essere scongelate per due giorni a + 4°C.
3.12 GENOTIPO DELLE COLONIE
Le colonie prelevate dai saggi clonogenici sul midollo dei topi trapiantati sono state genotipizzate con una PCR su DNA genomico per valutare se la loro origine fosse wild type o Sox2 knock down.
Per l’estrazione del DNA genomico abbiamo risospeso una singola colonia in una soluzione composta da: 1,7 μL di proteinasi K (30μg/ μL), 10 μL di DTT (ditiotreitolo)(0,1 M), 10 μL di buffer di reazione (10x) e 78,3 μL di acqua. L’estrazione viene effettuata in un Thermal cycler Delphi in un unico ciclo di: 55°C per 45 min,
95°C per 10 min, 4°C per 30 min.
Per effettuare il genotipo abbiamo usato un sistema a due coppie di primers per distinguere il wild type dal Sox2 knock down.
I primers sono stati sintetizzati da Invitrogen con le seguenti sequenze: • primer specifici per Otx1:
5' primer, 5'-AGCAGA CACATGGAAACCTTC-3'; 3' primer, 5'-CACTTGGGATTTTGC ACCCTC-3';
• primer specifici per Sox2, che rappresenta le cellule del transgenico: 5' primer, 5'-GCGTTG GCAATTTAACCGCC-3';
3' primer, 5'-CAGTTTACCCGCTCTGCTAC-3'.
Le condizioni utilizzate per la PCR, eseguita in un Thermal cycler Delphi, sono state:
10 μL di DNA genomico, 1 μL ogni primers (2,5μmol/L), 0.4 μL di dNTP (10 mmol/L) (Euroclone), 0,6 μL di MgCl2 (50 mmol/L), and 2 μL di buffer di
reazione (10x), 0,5 μL di Taq DNA polimerasi (Euroclone) (5 U/μL) e 2,5 μL di acqua.
Le condizioni utilizzate per la PCR, eseguita in un Thermal cycler Delphi, sono state:
95°C per 5 min 95°C per 1 min
60°C per 1 min 35 cicli 72°C per 1 min
72°C per 5 min.
I prodotti della PCR sono stati separati tramite elettroforesi su gel di agarosio all’1.7%. I gel sono stati colorati con bromuro di etidio e osservati sotto i raggi UV di un transilluminatore. Le bande visibili sono:
• i primer specifici per Otx1 generano una banda di 300 basi; • i primer specifici per Sox2 generano una banda di 430 basi.