Capitolo 1
Introduzione
1.1 Tossicità
La crescente attenzione verso i temi ambientali non è altro che una delle conseguenze della profonda crisi che sta attraversando il rapporto uomo-ambiente. Le principali attività umane di questo millennio quali l’agricoltura intensiva, la produzione di energia, la crescita industriale, le attività di trasporto e quelle ricreative, nate allo scopo di migliorare la qualità della vita, hanno provocato, in certi casi, delle gravi alterazioni ambientali come l’immissione nella biosfera di composti inquinanti (ad es. i metalli pesanti).
Si parla di inquinamento di un sistema ambientale quando si ha un effetto tossico, misurabile come danno, a carico di un sistema biologico sia a livello biochimico, cellulare e tissutale sia a livello dell’intero organismo, fino ad arrivare ad alterazioni di popolazione e della comunità biologica (Fossi, 2000).
Il termine tossicità può essere definito come la compromissione di una o più funzioni di un dato sistema biologico (sopravvivenza, crescita, motilità, riproduzione, fotosintesi, ecc.) esposto ad una determinata sostanza.
L’ecotossicologia è quella disciplina rivolta allo studio degli effetti tossici degli agenti chimici e fisici su organismi viventi, popolazioni e comunità, all’interno di definiti ecosistemi. Essa comprende anche lo studio delle modalità di diffusione di questi agenti e le loro interazioni con l’ambiente.
Lo scopo della sperimentazione tossicologica, sia nel campo della tossicologia classica che dell’ecotossicologia, è quello di definire le quantità massime di sostanze potenzialmente pericolose (in termini di dose ammissibile, concentrazione di non effetto, ecc.) che possono essere accettate al fine di una adeguata difesa del bersaglio che si intende proteggere. Questo bersaglio, nel caso della tossicologia classica, è rappresentato dall’uomo.
L’ecotossicologia deve affrontare problemi di natura sostanzialmente diversa. Il bersaglio da proteggere non è rappresentato da una singola specie ma dagli ecosistemi naturali o, più in generale, dalla biosfera nel suo complesso. D’altro canto, per ovvi motivi, la sperimentazione può essere condotta soltanto su un numero ridotto di specie e da queste estrapolata all’enorme numero di specie viventi conosciute. Il problema è ulteriormente complicato dal fatto che la struttura e il funzionamento degli ecosistemi sono regolati dalle complesse relazioni che intercorrono tra le diverse popolazioni di organismi viventi, animali e vegetali, e tra queste ed i fattori ambientali di tipo abiotico. Quindi, una sperimentazione tossicologico-ambientale non si dovrebbe limitare a saggi volti a definire gli effetti tossici sulle singole specie, ma anche le conseguenze dannose su queste relazioni. Il problema può essere affrontato mediante sperimentazione su comunità biotiche o ecosistemi controllati, ricostruiti in laboratorio o ottenuti mediante confinamento di porzioni di sistemi naturali. Si tratta, in ogni caso, di approssimazioni più o meno grossolane di quanto può avvenire negli ecosistemi naturali indisturbati.
Inoltre, l’aumento della complessità sperimentale crea, di norma, notevoli problemi di interpretazione dei risultati. In generale esiste una relazione inversa tra il realismo ecologico di un sistema sperimentale e gli aspetti di semplicità operativa, riproducibilità e ripetibilità dei risultati, semplicità interpretativa.
L’esplicarsi dell’effetto tossico di una sostanza chimica potenzialmente pericolosa è funzione di diversi fattori che dipendono dalle caratteristiche intrinseche della sostanza in esame, dalle caratteristiche del sistema biologico esposto, sia a livello di individuo che a livello superiore di organizzazione (popolazione, comunità, ecosistema), nonché da fattori ambientali che possono alterare l’attività della sostanza.
L’esposizione, ovvero il contatto tra l’elemento tossico e la superficie esterna (ad esempio l’epidermide o la parete cellulare di un’alga monocellulare) o interna (ad esempio la superficie alveolare o la parete intestinale) di un organismo, non è che il primo passo verso una serie di meccanismi più complessi. Infatti, prima che l’effetto tossico si manifesti, la sostanza, o il suo metabolita, deve raggiungere il sito attivo con una dose (o concentrazione) e per un tempo ben determinati. La capacità di compromettere una o più funzioni (tossicità) dipende dalla concentrazione raggiunta nell’organo bersaglio e dal tempo di esposizione.
Infatti la tossicità dipende dalla concentrazione della sostanza (o di un suo metabolita), dal numero di recettori e dall’affinità di legame tra tossico e recettore. A livello molecolare, il bersaglio o recettore è rappresentato da componenti cellulari quali acidi nucleici, proteine, lipidi di membrana, ecc. Alcune interazioni fanno parte di azioni di difesa, ad esempio l’interazione con un gruppo tiolico (–SH) appartenente alla cisteina del glutatione. Altre, invece, se non riparate, possono propagare ed essere alla base di alterazioni biologiche.
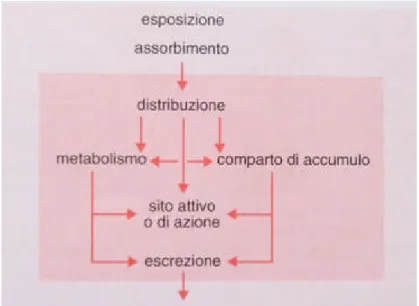
In figura 1.1 è illustrato lo schema del destino di un composto chimico in un sistema biologico. Con quest’ultimo termine si intende sia una singola cellula che strutture più complesse quali un animale o una pianta. Il modello rappresentato, seppure molto semplificato, identifica i processi più importanti da un punto di vista tossicologico, la cui interazione produce o meno l’effetto tossico, ovvero l’ingresso, la distribuzione, l’accumulo, il metabolismo e l’escrezione di una sostanza tossica.
Figura 1.1: Schema generale del destino di un composto chimico in un sistema biologico (singola cellula o intero organismo).
Come è stato detto precedentemente, un sistema biologico può entrare in contatto con un contaminante e, a seconda della maggiore o minore affinità, assorbirlo più o meno efficacemente. Il contatto e l’assorbimento producono l’esposizione che può essere continua e di intensità costante o discontinua e di intensità variabile (esposizione accidentale). Si può dire che l’esposizione e la dose assunta dall’organismo siano direttamente proporzionali. Pertanto, le relazioni risposta/esposizione sono uguali alle relazioni risposta/dose. La misura della risposta biologica (o danno) può avvenire solo dopo l’identificazione dell’effetto dovuto all’esposizione all’agente tossico. Spesso ci si
riferisce, erroneamente, all’effetto come alla quantificazione del danno (risposta) subito da un sistema biologico. Effetto e risposta in ecotossicologia possono essere definiti come segue:
- l’effetto indica il tipo di danno, ovvero la funzione biologica compromessa (come la sopravvivenza, la motilità, la velocità di crescita);
- la risposta è la quantificazione dell’effetto, e viene generalmente espressa come % di incidenza in una certa popolazione (ad esempio un certo numero di animali da esperimento).
Di norma si può assumere che esista un livello di soglia al di sotto del quale una sostanza non produce nessun effetto negativo. Basti pensare a sostanze naturali come alcuni metalli pesanti che esplicano un ruolo di micronutrienti, la cui assenza potrebbe addirittura provocare fenomeni di carenza. Superata tale soglia si entra in una fase nella quale l’organismo mette in funzione i suoi meccanismi di difesa e di detossificazione. Finché questi meccanismi sono sufficienti a contrastare l’azione della sostanza si potrà verificare un maggior dispendio energetico da parte dell’organismo ma non si manifesterà nessun effetto negativo. L’esposizione a sostanze tossiche, in questa fase, può essere messa in evidenza per mezzo di metodi di diagnosi precoce come i biomarkers. Quando i meccanismi di difesa non sono più sufficienti a compensare l’azione tossica, si verifica l’effetto che dà origine inizialmente a manifestazioni croniche e, a dosi più elevate, a fenomeni di tipo acuto (figura 1.2).
Figura 1.2: Relazione tra la risposta individuale ed il grado di esposizione ad un tossico.
La tossicità si può, quindi, distinguere in acuta e cronica.
Per tossicità acuta si intende l’insorgenza di un effetto in un organismo, dopo l’esposizione ad un agente tossico di un organismo in un breve lasso di tempo. L’obiettivo dei test di tossicità acuta è quello di misurare l’effetto dovuto all’esposizione a sostanze o miscele, la cui durata sia compresa tra i 15 minuti e le 96 ore. Una volta acquisiti i dati sulla tossicità acuta, si scelgono livelli di esposizione più contenuti in modo da non compromettere la funzionalità degli organismi per tempi di trattamento più lunghi che, per molti organismi, corrispondono ad uno o più cicli riproduttivi.
Negli studi di tossicità cronica l’obiettivo è il calcolo di una soglia di tossicità, ovvero di quel livello di esposizione massimo che traccia il confine tra livelli efficaci e livelli non efficaci a tempo indeterminato (ad esempio per la durata della vita media degli organismi selezionati per il saggio). Il concetto di soglia è propriamente applicabile solo dopo aver assunto che si è di fronte a danni reversibili, come nel caso di alcune inibizioni enzimatiche, dove i meccanismi di riparazione del danno possono essere efficaci al di sotto di un determinato livello di esposizione (la soglia di tossicità) (Gacci, 1998).
1.2 Interazioni metalli in tracce-organismi nell’ambiente marino
Elementi con una densità maggiore di 5 g cm-3vengono classificati come metalli pesanti (Zenk, 1985). A questa categoria appartengono circa 40 elementi, fra cui rame (Cu), zinco (Zn), ferro (Fe), cadmio (Cd), nichel (Ni), piombo (Pb), cobalto (Co), mercurio (Hg) ed argento (Ag).
Metalli, quali Cu, Zn, Ni, Fe e Co, sono presenti, nei sistemi viventi, in proteine (Emoglobina, Emocianina, fattori di trascrizione) ed enzimi (Anidrasi carbonica, Aconitasi, Superossido dismutasi) con ruoli sia strutturali che catalitici; sono inoltre presenti in vitamine, cofattori e gruppi prostetici (vitamina B12, porfirine, eme). Altri metalli, come Cd, Pb, Hg, Ag, sono invece non essenziali e quando presenti negli organismi, anche in minime quantità, risultano tossici e talvolta letali. D’altra parte anche elevate concentrazioni di metalli essenziali possono essere nocive e determinare inibizione della crescita o morte degli organismi.
I metalli pesanti possono avere sia origini naturali che dovute ad attività antropica. Le fonti naturali sono:
erosione geologica (delle rocce);
eruzioni vulcaniche (sorgenti di alcuni metalli). Le fonti antropiche sono:
effluenti industriali (raffinerie, acciaierie, fertilizzanti, materie plastiche, industria fotografica, concia delle pelli, pitture,…);
scarichi domestici, dilavamento dei suoli;
apporti fluviali.
Per effetto di attività antropiche, la concentrazione di metalli pesanti può aumentare di vari ordini di grandezza e, direttamente o attraverso la catena alimentare, i metalli possono accumularsi nei tessuti degli organismi viventi. Gli organismi fotosintetici sono i principali punti d’ingresso dei metalli nella catena alimentare. La presenza di elementi metallici nei sistemi acquatici, in quantità che superano le concentrazioni naturali, può incidere negativamente non solo sulle singole specie ma anche sull’equilibrio ecologico dell’intera catena trofica. Nella matrice acquosa questi elementi si trovano sotto forma di ioni metallici e/o legati al particolato organico ed inorganico. La composizione chimica e le caratteristiche idrologiche della colonna d’acqua, insieme alla concentrazione di materia organica disciolta e di ossigeno, influenzano fortemente la speciazione dei metalli, la loro biodisponibilità (intesa come attitudine di una sostanza ad essere assorbita) ed il loro eventuale bioaccumulo: i fenomeni di arricchimento di sostanze in tracce negli organismi viventi avvengono attraverso tutte le vie possibili (contatto, ingestione di cibo, respirazione).
I metalli in ambiente acquatico si possono trovare in forma solubile (cioè non sono trattenuti da filtri di 0,45 m di porosità) oppure legati a particelle (in questo caso sono trattenuti da filtri di 0,45 m) (figura 1.3). Tra le forme solubili si trovano metalli in forma di ione idratato e più frequentemente, si trovano complessati con vari composti (figura 1.4):
- possono formare ossidi e questi essere idratati;
- possono essere complessati con molecole organiche, come piccoli amminoacidi; - possono essere complessati con composti inorganici di vario tipo (solfuri,
- possono essere complessati con molecole più grandi, come acidi umici e fulvici, polimeri molto eterogenei che hanno una spiccata attitudine a complessare i metalli (Twiss et al., 2000).
Figura 1.3: Gli ioni metallici tendono ad adsorbirsi alle particelle del sedimento e formano complessi solubili con i ligandi.
La distribuzione dei metalli solubili nella colonna d’acqua, in base alla loro attitudine a formare dei complessi con il materiale particellato, può essere semplificata come segue:
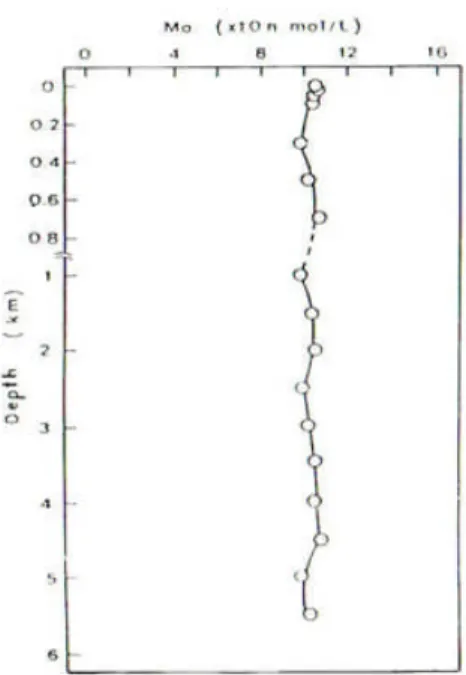
1. la loro concentrazione rimane costante con la profondità (i metalli conservativi). Essi hanno una bassa reattività ovvero una scarsa attitudine a legarsi al particellato e quindi tendono a rimanere in forma solubile e a distribuirsi uniformemente in tutta la colonna d’acqua: si comportano come i costituenti principali dell’acqua di mare.
Figura 1.5: Profilo del Molibdeno nell’Oceano Pacifico
2. con l’aumento della profondità la concentrazione della forma solubile aumenta: un caso interessante è quello di metalli che hanno un comportamento simile ai macronutrienti (N e P). Il fosforo e l’azoto nella colonna d’acqua presentano delle concentrazioni più basse nella zona fotica perché vengono assunti dal fitoplancton; in profondità le concentrazioni sono più alte in seguito alla
mineralizzazione del plancton che cadendo viene degradato dai batteri: NO3- ed
PO4
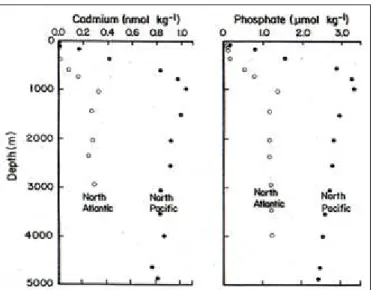
3-sono nuovamente disponibili nella colonna d’acqua in forma solubile. Metalli come il Cd hanno un identico comportamento. La colonna d’acqua nella zona superficiale è povera di Cd ma sotto i 1000 m si arricchisce di questo elemento le cui concentrazioni, da questa profondità, rimangono costanti. La ragione di tale distribuzione sta nel fatto che questo elemento ha un’alta affinità col materiale particellato di origine biologica: il fitoplancton (soprattutto in presenza di un bloom algale) assimila in modo cospicuo il Cd, così come fa con i macronutrienti, e ha una spiccata attitudine a tenerlo legato. In pratica il Cd viene sequestrato all’acqua ed entra a far parte delle cellule. Questo comportamento simile a quello dei macronutrienti determina il fatto che il Cd sia più disponibile nelle zone di upwelling, ovvero dove c’è una risalita delle acque profonde.
Figura 1.6: Profilo del cadmio nel Nord Atlantico e nel Nord Pacifico. Il profilo del fosfato è mostrato per un confronto.
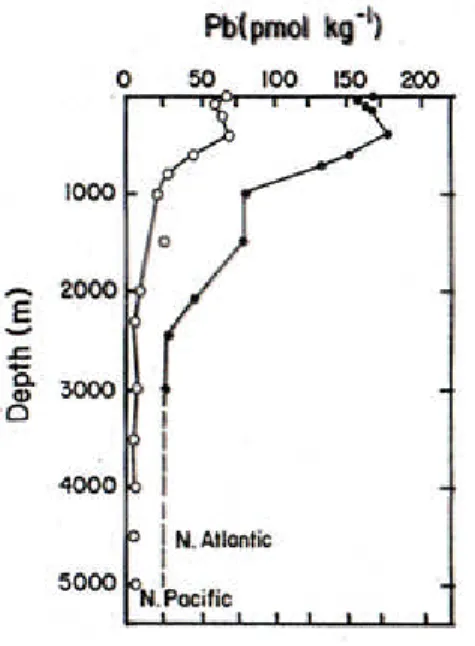
3. con l’aumento della profondità la concentrazione della forma solubile diminuisce: il Pb, per esempio, mostra un’attitudine ad essere più concentrato nella zona superficiale, quindi più vicino alla sorgente di apporto, quali l’atmosfera ed il suolo, questo perchè ha alta affinità per il materiale particellato (). Invece, se si considera la forma solubile, si nota un altro tipo di andamento(○).
Figura 1.7: Profilo del piombo nel Nord Atlantico e nel Nord Pacifico.
La biodisponibilità di un metallo è data principalmente dalla sua attività come ione libero piuttosto che dalla sua concentrazione totale o dei suoi specifici complessi organici.
Inoltre, in ambiente marino l’interazione tra comunità biologiche e metalli in tracce è reciproca, cioè non solo questi ultimi influenzano il biota ma a sua volta il biota può influenzare la composizione chimica del pool dei metalli, generando così un
meccanismo di feed-back. Alcuni effetti dei meccanismi di feed-back riguardano la speciazione dei metalli in tracce, in quanto la loro complessazione con biomolecole escrete dal fitoplancton può portare ad una riduzione della biodisponibilità di metalli tossici o incrementare la disponibilità di micronutrienti, come Fe e Mn. Come già sottolineato, alcuni di essi, come zinco e rame, diventano tossici ad elevate concentrazioni intracellulari, perciò devono essere mantenuti entro un intervallo di concentrazione dello ione libero che consenta la crescita ottimale del fitoplancton. Il rame, ad esempio, nelle acque superficiali marine, si lega a chelanti organici naturali, abbassando la concentrazione dello ione libero fino a livelli non tossici per le comunità fitoplanctoniche (Coale and Bruland, 1990).
Dal momento che la produttività delle comunità algali è la fonte principale di questi leganti organici disciolti la loro produzione si può considerare come un condizionamento biologico dell’ambiente marino, cioè un cambiamento della composizione chimica dei metalli in tracce biologicamente mediato, che aumenta la produttività del fitoplancton.
1.3 Sedimenti
Il sedimento è una matrice di materiali che comprende detriti, particelle organiche ed inorganiche ed è relativamente eterogeneo per quanto riguarda le sue caratteristiche fisiche, chimiche e biologiche. È importante considerare, oltre agli input diretti dovuti a scarichi industriali, civili ed agricoli, le vie indirette o secondarie di contaminazione. Una volta giunti in acqua, i contaminanti tendono ad adsorbirsi parzialmente al particolato sospeso mentre una frazione significativa resta disciolta: dopo un certo
periodo, essi tendono comunque a depositarsi ed accumularsi nel sedimento, che rappresenta quindi il luogo di raccolta e la sorgente della maggior parte del carico inquinante in ogni ecosistema acquatico.
I sedimenti possono accumulare metalli in concentrazioni 10 volte maggiori rispetto alla soprastante colonna d’acqua, costituendo un’importante sorgente di contaminazione e rischio per gli organismi viventi. In particolare le aree marine e costiere sono costantemente soggette all’introduzione di inquinanti naturali ed antropogenici.
Le aree costiere e di estuario servono come area riproduttiva e di nursery per molte specie di invertebrati e pesci e dovrebbero essere preservate. Le specie bentoniche ed epibentoniche sono quelle maggiormente esposte ai contaminanti che provengono dai sedimenti, a quelli che sono adsorbiti alle particelle sedimentarie, come pure a quelli che sono disciolti nell’acqua interstiziale. Gli organismi pelagici sono esposti ai contaminanti legati al sedimento tramite la catena trofica e/o dopo la rimobilizzazione dei contaminanti nell’acqua di mare. La contaminazione della colonna d’acqua avviene per diffusione e per risospensione dei sedimenti mediante fattori naturali come la bioturbazione, le tempeste, il moto ondoso e l’azione delle maree, e mediante le attività umane come le operazioni di dragaggio (Geffard et al., 2007).
Sebbene i sedimenti possano contenere concentrazioni relativamente alte di composti tossici, questi non necessariamente determinano effetti dannosi sugli organismi marini. Il destino dei contaminanti in un sistema acqua-sedimento dipende fortemente dalla capacità adsorbente del sedimento che ne influenza la biodisponibilità e la tossicità. In particolare, i sedimenti a granulometria fine tendono ad accumulare i contaminanti agendo come un importante serbatoio in grado di ridurre la potenziale tossicità dei contaminanti per gli organismi acquatici. Le concentrazioni chimiche misurate in
campioni ambientali non sono degli accurati indicatori dei loro associati effetti biologici ed ecologici perché l’elemento chimico può essere biologicamente disponibile in un range che va dallo 0 al 100% della totale concentrazione: le risposte degli organismi viventi, esposti agli elementi tossici, dimostrano l’effettiva biodisponibilità di tali elementi.
Per quanto riguarda i metalli pesanti, predire come si distribuiscano nei sedimenti è difficile poiché possono essere presenti in molte forme: come ioni solubili liberi, complessi organici solubili ed insolubili, complessi inorganici (Wong et al.,1999). I metalli pesanti di origine antropogenica sono generalmente introdotti nell’ambiente come complessi inorganici o ioni idrati che sono facilmente adsorbiti alla superficie delle particelle di sedimento tramite relativamente deboli legami chimici e fisici. Così i metalli pesanti di origine antropogenica si trovano, nel sedimento, come frazione labile e facilmente estraibile. Al contrario, i prodotti dell’erosione dei minerali di argilla, che sono generalmente molto ricchi di metalli pesanti, contengono tali metalli in forme meno disponibili. Pempkowiak et al. (1999), esaminando due sedimenti con un contenuto totale simile di metalli pesanti, hanno messo in evidenza che una diversa origine di questi metalli ne determina una diversa speciazione. Quindi gli studi sulla biodisponibilità e la frazione solubile dei metalli legati al sedimento sono più importanti rispetto alla conoscenza della concentrazione totale dei metalli nel sistema acquatico (Wong et al.,1999).
Il disturbo del sedimento porta a cambiamenti nelle proprietà chimiche del sedimento (Eggleton and Thomas, 2004). Cambiamenti sia nel potenziale redox che nel pH possono accelerare il desorbimento, la separazione, la degradazione batterica e l’ossidazione dei composti organici. Questi processi sono sia sedimento-specifici che
composto-specifici. Condizioni di flusso più turbolente, associate a diluvi stagionali o tempeste, possono esporre i sedimenti anossici a condizioni ossiche. Anche il biodisturbo, dovuto alle attività degli animali bentonici (alimentazione, movimento e costruzione di tane) può inoltre introdurre acqua ossigenata nei più profondi sedimenti anossici (Eggleton and Thomas, 2004 ).
Lo strato di sedimento ossico spesso si estende per soli 2-5 mm al di sotto dell’interfaccia sedimento-acqua. Le ricerche hanno mostrato che gli ossidi e gli idrossidi di Fe e Mn insieme alla materia organica sono importanti siti di legame per i metalli nei sedimenti ossici e che la formazione di solfuri domina nei sedimenti anossici (Eggleton and Thomas, 2004). Nei sedimenti anossici la presenza di solfuri (prodotti da batteri anaerobi) determina la formazione di complessi stabili Me-S che precipitano e rimangono stabilmente nel sedimento. Poiché la solubilità di Me-S è bassa, i sedimenti ricchi di solfuri contengono pochissimi metalli nell’acqua interstiziale. Infatti l’eccesso di concentrazione di solfuri acidi volatili (AVS) rispetto a quella dei metalli estraibili non permette ai metalli, che si potrebbero liberare durante l’ossidazione del legame Me-S, di rimanere in soluzione in quanto si legano ai solfuri in eccesso e precipitano nuovamente. Durante i processi di rimobilizzazione, la risospensione dei sedimenti anossici nelle acque ossigenate determina l’ossidazione dei solfuri che probabilmente rappresenta la maggiore sorgente di metalli in queste acque.
FeS e MnS sono ossidati rapidamente nelle acque ossigenate, mentre l’ossidazione di CdS, PbS, CuS e ZnS impiega più tempo. È stato ipotizzato che, durante la risospensione di sedimenti anossici nelle acque ossigenate, FeS ed MnS si ossidino prima limitando l’iniziale ossidazione di altri Me-S (presenti in tracce). Infatti i solfuri
liberati dall’ossidazione di FeS e MnS si vanno a legare agli altri metalli come spiega la seguente reazione:
Me2++ FeS(s)↔ MeS(s) + Fe2+ (Simpson et al., 2000).
In seguito al rilascio nella colonna d’acqua, la maggior parte degli ioni metallici precipita nuovamente mentre è stato dimostrato che il Cd rimane in soluzione più a lungo rispetto agli altri metalli, probabilmente in seguito alla complessazione con i cloruri ( Eggleton and Thomas, 2004).
È impossibile campionare sedimenti senza disturbarne la struttura e le caratteristiche chimico-fisiche in quanto il processo di rimozione è distruttivo di per sé. Campionamento, essiccazione, congelamento e conservazione al freddo influenzano la biodisponibilità dei contaminanti. Il tempo di conservazione dei sedimenti può variare da pochi giorni ad un anno e la refrigerazione dopo l’arrivo nei laboratori è generalmente effettuata a 4 C. Si ritiene che i sedimenti non dovrebbero essere congelati ma mantenuti a 4 C sotto vuoto o in atmosfera con N2 per non più di due
settimane prima del saggio. Il congelamento sembra essere implicato nell’aumento della perdita di carbonio organico solubile che potrebbe influenzare, in una certa misura, il comportamento dei contaminanti organici (Miniero et al., 2005).
Cambiamenti temporali significativi nella tossicità di campioni di sedimento contenenti metalli sono stati osservati in sedimenti conservati. Anche la biodisponibilità dei contaminanti organici cambia con il progredire del tempo di conservazione (Miniero et al., 2005).
La manipolazione e la conservazione potrebbe alterare la concentrazione di solfuri acidi volatili (AVS) che potenzialmente influenzano la biodisponibilità dei metalli. Nel caso
dei sedimenti anossici, l’esposizione all’aria potrebbe modificarne in maniera consistente la tossicità a causa dell’ossidazione e della precipitazione delle specie metalliche (Miniero et al., 2005).
1.3 Elutriati
L’elutriato, o fase acquosa estraibile, è una matrice ambientale in grado di replicare i fenomeni di mobilizzazione del sedimento e di predire il rilascio dei contaminanti dal sedimento verso la colonna d’acqua. È stato sviluppato inizialmente per la valutazione dei potenziali effetti di trasferimento del materiale dragato in mare aperto ed ora è applicato alla valutazione della qualità del sedimento in situ.
Brevemente, la procedura di elutriazione consiste in una vigorosa agitazione di una quantità determinata di sedimento con una quantità determinata d’acqua di mare così da permettere il rilascio degli inquinanti adsorbiti. Le analisi dei campioni di elutriato forniscono informazioni sui costituenti solubili in acqua che potrebbero essere rilasciati dal sedimento nella colonna d’acqua.
Sono stati proposti diversi metodi per la preparazione di elutriati. Le principali differenze consistono nel rapporto sedimento:acqua, tecniche di agitazione del sedimento, tempo (che va da 30 min a 24 h), temperatura e tecniche di centrifugazione del sopranatante. Il rapporto 1:4 è la proporzione più comunemente impiegata. Inoltre, si discute sulla possibilità di utilizzare il peso secco o fresco per raggiungere la proporzione sedimento:acqua. Oltre a tutte queste differenze metodologiche, solo limitati studi sono stati condotti per mettere in luce la migliore procedura capace di
stimolare in modo naturale il fenomeno di risospensione del sedimento o per rendere gli inquinanti più biodisponibili.
Il rapporto solido/soluzione influenza l’assorbimento della sostanza nel sistema test e non dovrebbe essere sottovalutato quando si effettuano estrazioni dei sedimenti come la preparazione degli elutriati.
Usando rapporti diversi per la preparazione di elutriati è stato visto che non sempre il rapporto 1:4 ha una maggiore capacità discriminatoria nel rivelare la tossicità del sedimento. Una possibile spiegazione al fatto che si osserva una maggiore tossicità negli elutriati con rapporto 1:20 e 1:50 è che volumi maggiori di acqua potrebbero facilitare il passaggio di sostanze tossiche dalla fase solida a quella liquida rendendo più disponibili i contaminanti per il biota. D’altra parte, eccessivi volumi d’acqua potrebbero produrre effetti di diluizione, impedendo l’identificazione della tossicità del sedimento, come presumibilmente avviene nel caso di un rapporto 1:200 (Arizzi Novelli et al., 2006). Daniels et al. (1989) suggeriscono che il rapporto 1:4, piuttosto che 1:10 e 1:20, è il miglior modo di rendere biodisponibili i contaminanti. Al contrario, Da Ros et al. (1997) riportano che il rapporto 1:50 fornisce informazioni migliori sulla tossicità del sedimento rispetto alle proporzioni 1:5 e 1:200 e che, in accordo con le analisi chimiche, non c’è una diretta proporzionalità tra la risposta biologica ed il volume di sedimento.
Dopo l’agitazione del sedimento nel rapporto e per il tempo prescelto la fase acquosa viene separata dai sedimenti per centrifugazione e successiva filtrazione del sopranatante con filtri da 0,45m (obbligatoria quando devono essere effettuati test con microalghe planctoniche). Anche in questo caso la filtrazione potrebbe significativamente ridurre l’effetto biologico rimuovendo i contaminanti associati al
particolato ed i contaminanti disciolti che si legano ai materiali del filtro. Questo trattamento influenza la speciazione dei metalli, la concentrazione di ammoniaca, il pH e la tossicità.
La naturale presenza dei metalli nell’ambiente complica la stima della potenziale contaminazione del sedimento; la granulometria è probabilmente il più importante fattore che controlla le concentrazioni dei metalli nel sedimento (Mucha et al., 2004). Bisogna inoltre tener presente che gli stessi fattori ritenuti importanti nel controllo delle risposte ecotossicologiche dei saggi classici, come l’alimentazione degli organismi e le condizioni chimico-fisiche, risultano altrettanto importanti nei saggi di tossicità con sedimenti e matrici assimilabili (Miniero et al., 2005).
Malgrado tutte queste incertezze, l’ESTT (elutriate sediment toxicity test) è considerato il miglior metodo per stimare la quantità di contaminanti che si scambiano tra il sedimento e la fase acquosa durante il dragaggio (Mucha et al., 2004).
Alcuni studi hanno dimostrato che gli elutriati sono molto più ricchi, rispetto all’acqua di mare, di metalli pesanti e ligandi organici capaci di legare fortemente i metalli pesanti. A questo proposito sono interessanti i risultati ottenuti da Mucha et al. (2003). Questi autori hanno utilizzato l’ESTT per confrontare la sensibilità di tre specie (Phaeodactylum tricornutum, Dunaliella minuta e Emiliania huxleyi) esposte a due elutriati di sedimenti estuarini, seguendo la crescita microalgale e la speciazione chimica dei metalli (uptake dei metalli pesanti e rilascio di essudati cellulari). I risultati dimostrarono che la quantità di ligandi organici presenti nei sedimenti influenza notevolmente la tossicità dei metalli pesanti, che può risultare ridotta quando prevale il sequestro extracellulare degli ioni metallici, o aumentata per la formazione di complessi metallo-ligando che aumentano la biodisponibilità dei metalli stessi. Infatti la
composizione iniziale degli elutriati era molto ricca di ligandi organici, ed in entrambi gli elutriati, ma non nel controllo, si osservava una notevole diminuzione dei complessi Cu-ligando organico, spiegabile con l’uptake da parte delle microalghe dei ligandi liberi o complessati con i metalli. Quindi i sedimenti devono essere considerati non solo come una sorgente di nutrienti e contaminanti per la colonna d’acqua, ma anche come un importante serbatoio di ligandi organici in grado di influenzare la biodisponibilità dei contaminanti stessi.
L’interpretazione dei dati sperimentali è complessa a causa dei molti e variabili parametri implicati, come il numero delle cellule, la concentrazione di differenti metalli pesanti presenti nel mezzo e la rispettiva speciazione, che dipende dalla concentrazione dei rispettivi ligandi organici come pure dalla costante di stabilità del complesso che si è formato (Mucha et al., 2003).
In sintesi: è noto che la quantità di informazioni ricavabili da un test condotto su un estratto acquoso sia limitata, in parte a causa del metodo di estrazione che permette, per definizione, principalmente il rilascio di contaminanti solubili in acqua, ed in parte a causa della manipolazione stessa del campione che ne altera la chimica (Geffard et al., 2007).
I test di tossicità hanno mostrato che la biodisponibilità dei metalli pesanti negli ESTT può dipendere da diversi parametri come il carbonio organico disciolto o la materia particolata sospesa nell’elutriato, differenze nella granulometria delle particelle che costituiscono la maggior parte del sedimento, i metalli pesanti rilasciati nell’acqua quando il sedimento viene risospeso, la presenza di altre sostanze chimiche che possono inibire o stimolare l’uptake, fattori esterni come la temperatura che influenza il grado di
reazioni chimiche e biologiche, l’interfaccia biologica ed, infine, la capacità di un organismo di metabolizzare i contaminanti ( Eggleton and Thomas, 2004).
Uno dei migliori metodi per valutare la biodisponibilità dei contaminanti associati al sedimento è osservare il loro accumulo negli organismi (Geffard et al., 2003).
Mediante l’ESTT è possibile mettere in evidenza biomarker specifici che possono essere usati, insieme alla determinazione delle concentrazioni interne dei contaminanti, per valutare l’effetto subletale dei metalli. Ad esempio, Geffard et al. (2007) hanno visto che la concentrazione totale di ogni metallo nell’ambiente era correlato in modo significativo alle concentrazioni presenti nella frazione citosolica, specialmente per Cd e Cu. La biodisponibilità del metallo associato al sedimento è dimostrata dall’induzione delle metallotioneine la cui concentrazione è correlata alla quantità di metallo presente nella frazione citosolica e ciò indica che esse sono implicate nei processi di detossificazione. Malgrado la buona correlazione tra la quantità di metallo presente nella frazione citosolica ed i livelli di metallotioneine, significativi effetti biologici (% di larve anormali) sono stati osservati prima dell’induzione delle metallotioneine. Questo può indicare che la contaminazione da metallo non spiega totalmente la tossicità osservata, altre sostanze tossiche probabilmente disturbano lo sviluppo larvale. Ciò è in accordo con altri autori (Pavicic et al., 1994; Pempkowiak et al.,1999; Geffard et al., 2003; Arizzi Novelli et al., 2006).
Altri autori valutano la vitalità delle cellule spermatiche del riccio di mare, Paracentrotus lividus, o la crescita larvale dei molluschi, la sopravvivenza di forme giovanili di pesci e di gamberetti che viene influenzata negativamente in relazione alla tossicità del sedimento (Geffard et al., 2007; Arizzi Novelli et al., 2006; Losso et al., 2007; Cheung et al., 1997; Spencer et al.,2006).
Anche la crescita delle microalghe esposte agli elutriati viene valutata per predire la tossicità del sedimento (Mucha et al., 2003; 2004; Wong et al., 1999; Pardos et al.,1998) ma non è mai stata valutata la produzione di fitochelatine da parte del fitoplancton in funzione della presenza di metalli pesanti presenti nel mezzo di risospensione.
1.5 Biosaggi e biomarkers
Le analisi chimiche caratterizzano i livelli di contaminanti del mezzo (acqua o sedimento) ma sono inadeguate a stimare la qualità biologica di una zona che si sta studiando. Solo i sistemi viventi sono capaci di integrare i vari effetti dei contaminanti che sono realmente biodisponibili (Geffard et al., 2007). Con l’utilizzo di saggi è possibile determinare le correlazioni dose-risposta per sostanze chimiche individuali e miscele chimiche, individuare la specie-specificità d’azione dei contaminanti e le correlazioni causa-effetto, nonché determinare la tossicità cronica e la misura del bioaccumulo (Miniero et al., 2005). Quindi, se la tutela ambientale deve essere intesa non solo come recupero e risanamento ma soprattutto come conservazione e, dunque, prevenzione, ne deriva che con i biosaggi ecotossicologici sia possibile effettuare una stima del rischio ambientale prima che tale rischio si sia effettivamente manifestato (Gacci, 1998).
Nei biosaggi l’organismo in esame assume il contaminante, che si trova in soluzione nel mezzo, attraverso varie vie. Mediante meccanismi di ripartizione di equilibrio tra l’acqua ed i comparti di assorbimento, si ha un progressivo aumento della concentrazione del tossico all’interno dell’organismo (bioconcentrazione). Inoltre, una volta assorbito, il suo destino è legato ai processi di distribuzione, metabolizzazione ed
escrezione. È ovvio quindi quanto sia difficile poter stimare la concentrazione interna della molecola saggiata.
La durata del saggio dipende dal tipo di valutazione di tossicità che si vuole ottenere (acuta o cronica).
Per ottenere un quadro degli effetti da parte dei contaminanti sugli ecosistemi acquatici, certo non esauriente ma, sotto un certo punto di vista, relativamente completo, di norma si opera effettuando saggi su organismi rappresentativi dei principali anelli della catena trofica:
- produttori primari (ad es. microalghe);
- consumatori primari (ad es. microcostacei planctonici); - consumatori secondari (ad es. pesci);
- decompositori (batteri).
Il risultato di un saggio tossicologico può essere influenzato da diversi fattori che ne possono alterare sensibilmente la precisione e la ripetibilità. In primo luogo si deve tener conto di tutti i fattori che possono essere causa di una certa imprecisione in qualunque operazione di laboratorio (fattori legati all’operatore, margini di imprecisione dei sistemi di misura, ecc.). Questi fattori però incidono in maniera relativamente modesta sul risultato dei saggi. Un peso molto maggiore è determinato dai fattori legati alle condizioni ambientali e sperimentali e, soprattutto, dai fattori dipendenti dalla variabilità biologica degli organismi utilizzati.
Per quanto riguarda le condizioni sperimentali, soprattutto in ambiente acquatico, è necessario controllare numerosi parametri di natura chimico-fisica che possono influenzare i risultati. Il mantenimento di tutti questi parametri attorno a valori controllati e pressoché costanti per tutta la durata dell’esperimento non è un problema di
facile soluzione, se si tiene conto che lo stesso metabolismo degli organismi tende a modificare il chimismo dell’acqua.
Ancora maggiori sono gli effetti dovuti alla variabilità biologica che sussiste anche tra organismi di una stessa popolazione. Pertanto, due campioni estratti da una stessa popolazione possono fornire risultati differenti. (La variabilità può essere ridotta aumentando le dimensioni del campione, ma esistono limiti obiettivi ad un aumento indefinito del numero di organismi da saggiare).
Non è facile indicare rigorosamente quale dovrebbe essere un accettabile livello di ripetibilità di un saggio tossicologico, che dipenderà dal livello di complessità e sofisticazione della metodologia. A titolo puramente indicativo, si può affermare che, in semplici saggi standard di tossicità acuta, prove che differiscono per un fattore 2 possono essere ritenute ottime repliche. Una simile variabilità non appare eccessiva se si considera che, ad esempio in tossicità acquatica, l’effetto di sostanze diverse può spaziare in un ambito di 7-8 ordini di grandezza (da alcuni ng/l a g/l) (Gacci, 1998). Per fare dei biosaggi si devono scegliere degli opportuni organismi bioindicatori. Per definizione i bioindicatori sono tutti quegli organismi, animali o vegetali, che mediante reazioni identificabili (biochimiche, fisiologiche, morfologiche, ecc.) forniscono informazioni sulla qualità dell’ambiente (o di una parte di esso) (Bargagli et al., 1998). Gli organismi bioindicatori devono possedere alcune caratteristiche fondamentali quali:
- essere stazionari ed avere un’ampia distribuzione nell’area di studio; - essere di facile identificazione sistematica;
- bisogna avere adeguate conoscenze sull’anatomia, fisiologia ed ecologia della specie;
- essere di facile reperibilità stagionale; - essere facili da raccogliere (o acquistare); - possedere una resistenza a stress ambientali;
- essere in grado di reagire ad un ampio spettro di alterazioni ambientali; - essere adattabili in laboratorio (facilità di maneggiamento);
- devono essere facilmente reperibili degli organismi di controllo in aree pulite. La scelta dell’organismo bioindicatore deve tener conto di una serie di caratteristiche relative alla fisiologia, al tipo di alimentazione, all’habitat ed al generale stile di vita. Tutto questo insieme di caratteristiche si identifica con la nicchia trofica, cioè l’insieme di funzioni della specie nella comunità e le sue interazioni con la componente biotica e abiotica (Bargagli et al., 1998; Cheung et al., 1997).
Un altro elemento fondamentale nella scelta dell’organismo bioindicatore riguarda la sua mobilità: l’informazione che ci fornisce l’organismo bioindicatore è relativa all’area vitale dove l’organismo si muove e si alimenta (nicchia spaziale e trofica) (Fossi, 2000). La bioindicazione rappresenta sicuramente uno strumento diagnostico estremamente valido per definire i livelli ambientali di un determinato contaminante ma risulta del tutto inadeguata nell’assolvere ad uno degli scopi fondamentali dell’ecotossicologia: la valutazione degli effetti che tale contaminante e/o miscela di contaminanti può generare su una comunità ecologica.
La tossicità primaria di un contaminante si esercita in primo luogo a livello biochimico e molecolare (modificazioni delle attività enzimatiche, danni al DNA, alterazione dei prodotti metabolici, ecc.) e solo successivamente gli effetti si possono riscontrare, con un meccanismo a cascata, ai gradini superiori dell’organizzazione gerarchica (organello, cellula, tessuto, individuo, fino a giungere alla popolazione).
Quindi, gli organismi bioindicatori generano, nei confronti degli insulti chimici ambientali, delle risposte biologiche che possono essere:
- risposte omeostatiche: se sono ancora un tentativo di attuare dei meccanismi di difesa (ad es. la produzione di fitochelatine);
- manifestazioni di tossicità: se si presenta un danno molecolare, cellulare o funzionale.
Si è, dunque, pensato di utilizzare le risposte, che un organismo bioindicatore genera nei confronti degli insulti chimici ambientali, come possibili strumentini diagnostici e di prognosi di salute ambientale: nascono così i biomarker (Fossi, 2000).
Il biomarker ecotossicologico si definisce come: “quella variazione biochimica, cellulare, fisiologica o comportamentale, che può essere misurata in un tessuto, in un fluido biologico o a livello dell’intero organismo (individuo o popolazione) la quale fornisce l’evidenza di un’esposizione e/o un effetto ad uno o più composti inquinanti (e/o radiazioni)” (Depledge, 1994).
Il ruolo dei biomarkers nelle indagini ecotossicologiche non è quindi quello di dare informazioni quantitative sui livelli di esposizione di un organismo ad un determinato contaminante, ma quello di fornire indicazioni sul suo stato di salute come segnale potenziale di alterazioni ai più alti livelli ecologici attraverso lo studio delle risposte precoci (induzione di sistemi detossificante, inibizioni delle attività enzimatiche, formazione di prodotti metabolici, alterazioni del DNA, ecc.) e prevedere il verificarsi di effetti negativi a lungo termine anche su scala ecologica (Fossi, 2000). Inoltre i biomarker permettono di fare uno screening, di sgrossare l’indagine ambientale dando delle informazioni sulle categorie di contaminanti presenti nell’ambiente, abbassando i costi dell’indagine.
I biomarker si dividono, in funzione della loro specificità di risposta nei confronti di agenti inquinanti in:
- biomarker specifici: “quelle risposte molecolari e biochimiche che si manifestano in un organismo a seguito dell’esposizione ad una specifica classe di contaminanti” (ad esempio le fitochelatine);
- biomarker generali: “tutte quelle risposte dell’organismo a livello molecolare, cellulare e fisiologico, che non possono essere direttamente ricondotte ad una sola classe di contaminanti, ma che indicano lo stato generale di stress dell’organismo” (ad esempio certi danni sul DNA, disordini immunitari, ecc.) (Peakall & Shugart, 1993).
In ambiente marino gli organismi più usati come bioindicatori sono i bivalvi: gli organismi filtratori si presentano bene come valutatori dei livelli ambientali di determinate sostanze poiché, spesso, i contaminanti tendono a complessarsi con il particellato. Tra i biomarker utilizzati per valutare lo stato di salute dell’area di studio ci sono le metallotioneine.
Le metallotioneine sono molecole caratterizzate da: - basso peso molecolare;
- capacità a fissare elevate quantità di metallo;
- presentano molti residui di cisteina, amminoacido con spiccata capacità a legare metalli pesanti dovuta alla presenza di un gruppo tiolo (-SH);
- hanno la sequenza amminoacidica, Cys-X-Cys (X è un qualsiasi altro amminoacido), molto ripetuta (solitamente la sequenza di una proteina non è mai troppo ripetuta perché questo ne pregiudicherebbe il funzionamento. Questa caratteristica si ritrova solo in proteine che sono localizzate nei semi poiché hanno
solo la funzione di fungere da riserva azotata oppure in proteine che devono svolgere un ruolo particolare come le metallotioneine);
- non contengono amminoacidi aromatici e l’istidina che normalmente si ritrova nelle proteine.
Le metallotioneine si dividono in tre classi che possono essere così raggruppate:
- proteine geneticamente codificate: metallotioneine di classe I, trovate in molti vertebrati, osservati in Neurospora e Agaricus bisporus ma non presenti nei vegetali; e metallotioneine di classe II, identificate in cianobatteri, alghe e piante superiori;
- polipeptidi con una corta catena, sintetizzati enzimaticamente: metallotioneine di classe III, chiamate fitochelatine, ampiamente diffuse nei vegetali (Perales-Vela et al., 2006).
Dato che gli organismi bioindicatori presi in considerazione in questo studio sono microalghe marine ci occuperemo proprio delle fitochelatine.
1.6 Fitochelatine
Nel corso dell’evoluzione i microrganismi acquatici hanno sviluppato specifici ed efficaci meccanismi di tolleranza nei confronti dei metalli pesanti. Sono in grado di controllare il flusso dei metalli attraverso le cellule, diminuendo l’ingresso degli elementi non essenziali o favorendone l’efflusso; alternativamente i metalli possono essere eliminati tramite conversione in specie chimiche volatili, oppure possono essere legati a livello della parete cellulare o chelati nel citosol in complessi innocui per l’organismo ed eventualmente compartimentati nel vacuolo. Un ruolo chiave nella
tolleranza dei metalli negli organismi vegetali è svolto dalle fitochelatine, polipeptidi in gradi di legare il metallo entrato nella cellula.
Il termine fitochelatine è stato adottato per la prima volta da Grill et al. (1985) per caratterizzare peptidi a basso peso molecolare che erano stati isolati in seguito all’esposizione di colture di una pianta vascolare, Rauvolfia serpentina, ad elevate concentrazioni di Cd.
1.6.1 Struttura
Questi peptidi sono sempre caratterizzati dall’avere come residuo ammino-terminale un residuo di acido-glutammico (Glu), legato ad una cisteina (Cys).
Le fitochelatine sono peptidi in cui la sequenza-Glu-Cys si ripete da 2 a 11 volte, ed è legata ad una glicina (Gly) terminale. Queste strutture rispecchiano la sequenza amminoacidica del glutatione (GSH) e sono presenti in tutti gli organismi vegetali.
.
Figura 1. 8: Struttura primaria delle fitochelatine.
Alcune piante contengono composti simili ma non identici alle fitochelatine canoniche. In alcune specie di leguminose è stata trovata una struttura (-Glu-Cys)n--Ala a cui è
stato dato il nome di omofitochelatine (Rauser, 1995); un’altra famiglia costituita da peptidi aventi la struttura (-Glu-Cys)n è stata scoperta come minor costituente di
costituente nel mais (Meuwly et al., 1995); nelle graminacee sono state trovate le idrossimetil-fitochelatine, la cui struttura primaria è (-Glu-Cys)n-Ser (Klapheck et al.,
1994); una famiglia avente struttura (-Glu-Cys)n-Glu è stata isolata nel mais (Meuwly
et al., 1995). In generale, i peptidi che hanno un residuo amminoacidico carbossi-terminale diverso dalla glicina (Gly) si possono indicare come iso-fitochelatine. Attraverso gli studi condotti su numerose specie appartenenti al regno vegetale, è stata ben documentata l’ampia distribuzione delle fitochelatine a partire da specie monocotiledoni e dicotiledoni fino alle alghe rosse, brune e verdi.
1.6.2 Biosintesi
Le fitochelatine rispecchiano la sequenza amminoacidica del glutatione (GSH), tripeptide dato da -Glu-Cys-Gly, per questo motivo è stato suggerito che la via biosintetica del GSH e delle fitochelatine abbia una base comune. A conferma di tutto questo c’è il fatto che questi peptidi non possono essere prodotti da geni primari in quanto i peptidi con legamenon possono essere sintetizzati a livello ribosomiale ma devono avere una via biosintetica particolare che coinvolge due o tre reazioni enzimatiche (due nel caso del GSH, tre o più di tre nel caso delle fitochelatine) perché i ribosomi non sono capaci di effettuare la sintesi del legame(le proteine sintetizzate a livello ribosomiale hanno tutte un legame ). Studi di tipo cinetico su cellule in sospensione di R. serpentina esposte a Cd(NO3)2 hanno mostrato che, dopo l’aggiunta
del metallo, i livelli di GSH calano immediatamente e drasticamente e, contemporaneamente, inizia la sintesi di fitochelatine senza una evidente fase di latenza (Grill et al., 1987). L’assenza della fase di latenza (lag) suggerisce che l’enzima coinvolto nella sintesi di fitochelatine sia costitutivo (Zenk, 1996). Infatti, normalmente
nelle piante l’induzione di enzimi tramite meccanismi di trascrizione e traduzione richiede un intervallo (lag) di 1-3 h. La sintesi immediata di questi peptidi causa un impoverimento del pool intracellulare di GSH, ma questa perdita viene compensata dall’attivazione degli enzimi coinvolti nella sintesi del GSH (Rüegsegger et al., 1990; Rüegsegger e Brunold, 1992).
Il glutatione è sintetizzato enzimaticamente in due momenti:
Figura 1.9: Schema delle reazioni che sono alla base della formazione del glutatione.
Si parte da due amminoacidi, Glu e Cys, in presenza di ATP e di un enzima che prende il nome di-Glutammil-cisteina sintetasi, responsabile della formazione del legame in tra Glu e Cys. Dato che questa sequenza è quella che si ripete nelle fitochelatine si potrebbe pensare che questa reazione sia sufficiente per la fornire i monomeri necessari alla sintesi di fitochelatine. In realtà non è proprio così. Per la sintesi del GSH è necessaria un’altra reazione catalizzata dall’enzima glutatione sintetasi, anch’esso ATP-dipendente, che permette l’aggiunta di una Gly al dimero -Glu-Cys. Viene così sintetizzato il GSH che serve come precursore alla sintesi di fitochelatine. La partecipazione del glutatione nella sintesi delle fitochelatine è confermata dal fatto che la produzione di PC è ridotta drasticamente dalla butionina sulfossimina (BSO), un
potente inibitore della-Glutammil-cisteina sintetasi, che blocca la sintesi del glutatione (Grill et al., 1985; Steffens et al., 1986).
E’ stato possibile ottenere maggiori informazioni sulla biosintesi delle fitochelatine grazie all’isolamento in Silene cucubalus dell’enzima che catalizza tale processo (Grill et al., 1989). Tale enzima, -glutamilcisteina dipeptidil transpeptidasi, è comunemente chiamato Fitochelatina sintetasi. Studi di laboratorio condotti sull’attività enzimatica hanno mostrato che l’enzima è attivato dai seguenti metalli secondo un ordine decrescente di efficacia: Cd2+Ag+Pb2+Cu+Hg2+Zn2+Sn2+Au3+As5+In3+ Tl3+Ge4+Bi3+Ga3+(Rauser, 1995).
La regolazione della Fitochelatina sintetasi è il principale punto di controllo della biosintesi delle fitochelatine. Tale processo ha luogo entro pochi minuti dall’esposizione al metallo ed è indipendente da sintesi proteica de novo: l’enzima è costitutivamente espresso e quindi la sua regolazione avviene a livello post-traduzionale.
La reazione catalizzata dalla Fitochelatina sintetasi, diversamente dal modello proposto originariamente (Loeffler et al., 1989), non dipende dalla chelazione dei metalli pesanti da parte dei prodotti, poiché i complessi delle fitochelatine con tali metalli sono substrati dell’enzima. Il meccanismo d’azione della Fitochelatina sintetasi di Arabidopsis thaliana è stato recentemente chiarito (Vatamaniuk et al., 2000), partendo dall’osservazione sperimentale che l’enzima è attivato anche in assenza di metalli pesanti quando vengono utilizzati come substrati analoghi alchilati del glutatione (S-metil-glutatione, S-etil-glutatione, ecc.). Il modello proposto prevede che una volta che il metallo è entrato all’interno della cellula vegetale per prima cosa si complessa con delle molecole di glutatione. Il complesso Me-GSH va a legarsi all’enzima che nella forma inattiva presenta una forma random coil (come un filamento non avvolto); nel
momento in cui il Me del complesso Me-GSH si lega all’enzima, questo cambia conformazione e passa da una conformazione random coil ad una globulare attiva. A questo punto l’enzima attivo può effettuare la sintesi delle fitochelatine. Nella sintesi il substrato dell’enzima è rappresentato dal glutatione o altre fitochelatine, già preesistenti nella cellula, su cui l’enzima aumenta la lunghezza della catena. In pratica, il donatore (glutatione o altre fitochelatine) si lega a livello del sito attivo e così l’enzima scinde il legame tra Gly e Cys originando il dimero-Glu-Cys. Dopo questa reazione di idrolisi, l’enzima si comporta come una transferasi, cioè lega questo dimero ad un accettore, che può essere un’altra molecola di GSH o una catena di fitochelatina, determinandone l’allungamento. Questa reazione si ripete n volte, fino a che la catena raggiunge la lunghezza richiesta:
[Glu(-Cys)]n-Gly + [Glu(-Cys)] [Glu(-Cys)]n+1-Gly dove n = 1,2,3,…, 11. Il GSH è fondamentale per l’attività di questo enzima e ciò spiega perché mutazioni che coinvolgono la biosintesi del GSH determina l’incapacità di sintesi delle fitochelatine.
Figura 1.10: Modello del meccanismo catalitico della Fitochelatina sintetasi (Tsuji N et al., 2005).
In figura 1.10 si vede che il metallo entra attraverso meccanismi di trasporto all’interno della cellula, qui si complessa con le fitochelatine a basso peso molecolare (nella fase iniziale potrebbero essere anche semplici molecole di GSH).
La terminazione della reazione dipende dall’esaurimento degli ioni metallici liberi nel citosol: in questa situazione, i gruppi tiolici non bloccati del glutatione si trovano a competere coi tiolati per il sito attivo dell’enzima. Infatti le fitochelatine prodotte
complessate coi metalli pesanti vengono sequestrate nel vacuolo, dove non possono fungere da substrati per la fitochelatina sintetasi.
Prove convincenti indicano il vacuolo delle cellule vegetali come sito principale per l’accumulo temporaneo di complessi Cd-fitochelatine (Vögeli-Lange and Wagner, 1990). Inoltre è stata evidenziata l’esistenza di un sistema di trasporto attivo, localizzato sulla membrana vacuolare, che catalizza l’ingresso e l’accumulo di complessi Cd-fitochelatine (Salt and Rauser, 1995). Quindi il vacuolo è molto probabilmente il sito definitivo di immagazzinamento per gli ioni metallici che entrano nella cellula. Tuttavia i complessi metallo-fitochelatine non restano immagazzinati nel vacuolo come tali, ma subiscono un rapido turnover. Grill et al. (1988) riportano che colture di cellule vegetali inoculate in terreni arricchiti in nutrienti subiscono una rapida induzione ed accumulo di fitochelatine, che termina solo quando il terreno si impoverisce di ioni Cu e Zn liberi. L'interruzione della sintesi di fitochelatine e dell'accumulo di metalli, è seguita da un rapido abbassamento della concentrazione cellulare di fitochelatine durante la fase stazionaria di crescita. Questo fenomeno è stato attribuito dagli autori ad un processo di degradazione delle fitochelatine, che può avvenire in seguito al distacco dei metalli dai rispettivi complessi facilitato dall'ambiente acido presente all'interno del vacuolo. I singoli aminoacidi possono rientrare nel citosol per essere riutilizzati, mentre i metalli possono essere legati agli acidi organici presenti all’interno del vacuolo. Un abbassamento dei livelli di metallo e di fitochelatine, accompagnato da una rapida ripresa dei livelli cellulari di glutatione, è stato osservato anche in colture della diatomea marina Phaeodactylum tricornutum, precedentemente esposte al Cd o al Pb, e risospese in un mezzo di coltura privo di metalli, suggerendo l’esistenza di un meccanismo di eliminazione dei complessi metallo-fitochelatine e di degradazione
delle fitochelatine a glutatione. (Morelli e Scarano, 2001). Lee et al. (1996), studiando le cinetiche dei cambiamenti intracellulari di Cd e fitochelatine nella diatomea oceanica Thalassiosira weissflogii, riportano l’esistenza di un processo di escrezione dei complessi Cd-fitochelatine anche durante la fase di esposizione al Cd.
1.6.3 Funzioni
Le fitochelatine, grazie ai numerosi gruppi –SH posseduti, hanno la possibilità di legare i metalli tossici per l’organismo e, quindi, di svolgere un’azione di detossificazione. È un beneficio per le piante possedere meccanismi che mantengono le concentrazioni interne dei metalli essenziali tra limiti di deficienza e di tossicità e lasciano i metalli non essenziali sotto i loro livelli letali. Le fitochelatine, data la loro capacità di sequestrare i metalli, possono contribuire all’omeostasi cellulare degli ioni metallici ed alla detossificazione. L’omeostasi dei metalli richiede la loro complessazione intracellulare, quando presenti in eccesso, ed il loro eventuale successivo rilascio ad apoproteine che necessitano di metalli per la propria funzionalità (Rauser, 1995).
La capacità delle fitochelatine di rilasciare i metalli legati ad apoproteine metallo-dipendenti è stata verificata in vitro (Thumann et al., 1991). L’incubazione di complessi fitochelatine-Zn con l’apoenzima Anidrasi carbonica permette il recupero dell’attività di tale enzima. L’efficienza e la velocità di recupero dell’attività enzimatica correlano con le dimensioni delle fitochelatine presenti nei complessi: tanto minori sono le dimensioni delle catene, tanto più rapido ed efficace è il processo di recupero. Infatti, è stato visto che il recupero dell’attività è più efficiente quando si utilizzano i complessi [(-Glu-Cys)2-Gly]-Zn (PC2-Zn) rispetto a quando si utilizzano i complessi [(-Glu-Cys)7
-Gly]-Zn (PC7-Zn); ciò dipende da differenze nella forza del legame dello ione nei diversi
complessi.
Altro aspetto importante dell’omeostasi è la protezione degli enzimi metallo-sensibili. E’ stato verificato, in vitro, che il cadmio sotto forma di complessi PC-Cd ha un potere inibitorio da 10 a 1000 volte minore rispetto alla forma Cd(NO3)2, per gli enzimi
Rubisco, Nitrato riduttasi, Alcool deidrogenasi, Gliceraldeide-3-fosfato deidrogenasi ed Ureasi (Kneer&Zenk, 1992). L’attività della Nitrato riduttasi avvelenata con cadmio viene completamente recuperata in seguito all’aggiunta di apofitochelatine (-Glu-Cys)3-Gly (PC3), in rapporto molare peptide:cadmio pari a 1:4. Ciò non ha luogo se al
posto delle fitochelatine vengono utilizzati glutatione o citrato.
Prove convincenti sull’importanza delle fitochelatine nella tolleranza al Cd, furono pubblicati da Howden et al. (1995). Questi autori riuscirono ad isolare i mutanti cad1-3 di Arabidopsis thaliana, fitochelatina-deficienti, che risultano sensibili a concentrazioni di cadmio anche inferiori a 0.6 M, non avendo la capacità di produrre complessi fitochelatine-Cd (nonostante la sintesi di GSH fosse normale), ma crescono normalmente in terreni contenenti rame e zinco come micronutrienti.
Studi recenti sull’importanza ed il ruolo nella detossificazione dei metalli delle fitochelatine sono stati condotti su sospensioni cellulari ed espianti tissutali da radice di Vigna angularis (Inouhe et al., 2000). L’ipersensibilità al cadmio di tale organismo è stata messa in relazione con la sua incapacità di produrre fitochelatine. La correlazione fra la produzione di fitochelatine e la resistenza al cadmio è stata verificata anche in Lycopersicon esculentum. Quattro linee cellulari sono state selezionate per la loro capacità di crescere in presenza di elevate concentrazioni di CdCl2 ed è stato osservato
butionina sulfossimina (BSO) e che la capacità di resistere ad elevati quantitativi di metallo è accompagnata da produzione e accumulo di fitochelatine (Gupta et al., 1991). Successivamente si è anche verificato che l’attività specifica della-Glutammil-cisteina sintetasi, nelle linee cellulari tolleranti, è circa doppia rispetto alle linee non tolleranti. Presumibilmente l’incrementata attività dell’enzima permette il mantenimento di un’elevata concentrazione intracellulare di glutatione per poter così facilitare la produzione di fitochelatine, in risposta a stress da metallo (Chen et al., 1994).
Oltre a questa funzione, le fitochelatine sono coinvolte anche nell’omeostasi dei metalli pesanti, cioè nel meccanismo che regola la disponibilità di ioni metallici liberi nella cellula vegetale (Grill et al. 1988). Ioni metallici, come Cu2+o Zn2+, svolgono funzioni fondamentali come cofattori di proteine enzimatiche o come elementi strutturali (ad esempio nelle strutture “zinc finger” di sequenze nucleotidiche). Le fitochelatine possono formare complessi con questi ioni essenziali se si trovano in eccesso nella cellula, e successivamente trasferirli ad apoenzimi neosintetizzati che necessitano di questi ioni per essere attivi.
1.6.5 Induzione delle fitochelatine in alghe fitoplanctoniche
Gli studi sulle fitochelatine e sulla natura dei loro complessi con i metalli hanno riguardato principalmente le piante superiori, ma sono pochi i lavori che riguardano il fitoplancton. Nel 1988 Gekeler et al. valutarono l’ubiquitarietà dell’induzione delle fitochelatine nella divisione Phycophyta: hanno ricercato la presenza di tali peptidi in membri delle più importanti classi di alghe, molte delle quali fitoplanctoniche (Euglenoficee, Crisoficee, Xantoficee, Diatomee, Rodoficee; Feoficee, Cloroficee) coltivate in presenza di cadmio. Tutte le specie analizzate mostravano una sintesi
inducibile di fitochelatine in risposta al trattamento con dosi subletali di cadmio. Come per le piante superiori, anche nelle alghe la quantità di fitochelatine indotte, così come i livelli relativi dei diversi peptidi, variavano a seconda dell’organismo analizzato. In cellule di Chlorella fusca esposte ad una concentrazione 20 μM di Cd(NO3)2 , è stato
isolato un complesso legato al Cd contenente peptidi (γ-Glu-Cys)n-Gly, con n=2-5, in
cui erano presenti anche solfuri (circa il 12% dello zolfo totale intracellulare). Altri lavori hanno evidenziato la produzione di fitochelatine nella diatomea marina Phaeodactylum tricornutum in risposta al Cd (Kawaguchi e Maita, 1990; Morelli e Scarano, 1995).
Importanti ricerche sono state condotte da Ahner et al. nel 1995 sulla produzione di fitochelatine in alghe marine fitoplanctoniche (le diatomee Thalassiosira weissflogii e T. oceanica, le cloroficee Dunaliella tertiolecta e Tetraselmis maculata, le primnesioficee Plerochrysis carterae, Emiliania huxleyi e Pavlova lutheri, il dinoflagellato Heterocapsa pygmaea), esposte a concentrazioni crescenti di Cd. I risultati ottenuti hanno mostrato che la sintesi e il grado di polimerizzazione delle PC varia molto tra gli organismi presi in esame, e che la produzione di questi peptidi è indotta dal Cd anche a concentrazioni molto basse, simili a quelle che si possono trovare in ambienti naturali contaminati. In alcuni casi, è stata trovata produzione di fitochelatine persino quando le alghe non venivano esposte al metallo. Questi risultati implicano che le PC, almeno in queste specie fitoplanctoniche, possano svolgere un ruolo fondamentale nell’omeostasi dei metalli, oltre alla funzione di detossificazione.
I complessi con il cadmio sono stati studiati in maggiore dettaglio, poiché questo metallo è un induttore molto efficace per la sintesi di peptidi γ-Glu-Cys (Rauser, 1995), sono pochi gli studi che hanno preso in considerazione altri metalli.
Quello che si sa è che non tutti i metalli sono capaci di indurre allo stesso modo la produzione di fitochelatine negli organismi vegetali. Ciò è stato verificato da Ahner e Morel (1995) che hanno valutato la sintesi di PC nella diatomea Thalassiosira weissflogii, in risposta all’esposizione a diversi metalli in tracce (Cd, Pb, Ni, Cu, Zn, Co, Ag e Hg), a concentrazioni simili a quelle che si possono trovare nell’ambiente marino. Il Cd è risultato essere il più efficace induttore nell’intervallo di concentrazioni considerato; gli altri metalli, in particolare Cu, Pb e Hg, inducono piccole quantità di fitochelatine, mentre Co e Ag non hanno praticamente alcun effetto.
Esperimenti a breve termine condotti su tre alghe marine (Thalassiosira weissflogii, T. maculata, Emiliania huxleyi) con aggiunte relativamente alte di Cd, Cu, Zn e Pb hanno messo in evidenza che per tutte le specie la più grande induzione di fitochelatine era ottenuta con il cadmio, seguita da rame, zinco e piombo (Ahner e Morel, 1995). Un’eccezione è data dalla specie Emiliania huxleyi, in cui la produzione di fitochelatine in risposta al rame uguaglia quella del cadmio. Gli stessi autori riportano che questa alga è insolitamente resistente ad entrambi i metalli e concludono che, ai livelli naturali, la produzione di fitochelatine è dipendente, oltre che dal metallo presente nel mezzo, dalla specie fitoplanctonica esaminata.
Pochi lavori sono stati condotti per valutare l’effetto dell’interazione dei metalli. Kawakami et al. (2006) hanno messo in evidenza che P. tricornutum produce fitochelatine in seguito alle singole aggiunte, nel mezzo di coltura, di Cd e Cu ma l’aggiunta di Zn non ha alcun effetto. Se nel mezzo sono aggiunti Cu e Zn la produzione di fitochelatine è simile a quella ottenuta dalla sola aggiunta del Cu; invece, la combinazione del Cd con lo Zn ha un effetto antagonistico sulla produzione di PC che è probabilmente dovuto alla competizione per i siti di legame sulla membrana cellulare.
Infatti, come mostrato da Sunda e Huntsman (1996), l’uptake del Cd da parte di T. pseudonana utilizza gli stessi canali dello Zn e del Mn; la stessa cosa viene osservata per Dunaliella tertiolecta (Wei et al., 2003): Zn e Mn possono inibire competitivamente la tossicità del Cd (e, quindi, l’induzione di PC da parte del Cd).
Per T. pseudonana l’interazione del Cd con il Cu ha un effetto sinergico sulla produzione di PC. Per Skeletonema costatum quando i metalli sono aggiunti in coppia no si hanno effetti sinergici o antogonistici sulla produzione di PC: le concentrazioni di PC aumentano in modo additivo. Comunque l’aggiunta combinata di tutti e tre i metalli determina una forte riduzione della produzione di PC rispetto alle colture in cui è presente solo il Cd, similmente a quanto osservato per T. pseudonana e D. tertiolecta (Wei et al., 2003).
Possiamo quindi concludere che la produzione di PC dipende dalle specie fitoplanctoniche, dal grado di tossicità degli ioni metallici e dalle interazioni tra i metalli (Ahner e Morel, 1995; Ahner et al., 1995; Knauer et al., 1998; Wei et al., 2003).