CAPITOLO 1
PROCESSI DI PRODUZIONE DI IDROGENO
1.1 Introduzione
L’idrogeno è un elemento presente sulla terra in quantità pressoché illimitate (principalmente sottoforma di acqua) ed un processo che permetta la produzione di H2 puro
su scala industriale e con prezzi competitivi risolverebbe il problema dell’esauribilità delle fonti energetiche.
L’idrogeno è l’elemento più comune presente nell’ambiente (circa il 18% a livello atomico) ma a causa del suo basso peso molecolare, in termini di peso il valore si riduce a meno dell’ 1%. La quantità di idrogeno molecolare presente sulla terra è praticamente insignificante; esso è presente principalmente nell’acqua e negli idrocarburi. L’acqua contiene circa il 12% in peso di H2, il carbone il 4-6%, il gas naturale il 25% e le benzine circa il 12%.
L’idrogeno è considerato come il vettore energetico del futuro, alternativa all’uso delle benzine, dei gasoli e del gas naturale, non solo nel settore dei trasporti.
L’utilizzo di idrogeno come futura fonte energetica per la produzione di energia elettrica, termica ed un suo eventuale utilizzo nel settore dei trasporti, può portare ad un enorme incremento della sua domanda e può consentire di ridurre la dipendenza dai combustibili fossili. Il fattore ambientale pesa notevolmente sul possibile sviluppo della produzione di idrogeno da utilizzare come combustibile “pulito”, infatti il suo impiego, nelle celle a combustibile (utilizzate come fonte di energia nei mezzi di trasporto) contribuisce all’abbattimento delle sostanze inquinanti prodotte dai motori attualmente in circolazione. L’uso di idrogeno liquido come combustibile per i veicoli di trasporto consente, infatti, di eliminare i prodotti di combustione inquinanti e di non aumentare la quantità di CO2
immessa nell’atmosfera responsabile del surriscaldamento atmosferico (si sostituisce la combustione interna al motore con un motore elettrico associato ad una cella a combustibile). Le sostanze inquinanti, come l’NOx, possono essere evitate, in fase di
produzione, se il processo di reforming viene condotto a basse T e su catalizzatori con elevate attività.
Grazie all’assenza di carbonio, le emissioni dei processi di combustione dell’idrogeno sono costituite solamente da acqua.
Al maggiore interesse che suscita questo nuovo tipo di combustibile bisogna aggiungere il fatto che le riserve di combustibile fossile sono in via di esaurimento quindi c’è la necessità di trovare nuove fonti per l’approvvigionamento energetico.
L’idrogeno è un vettore energetico secondario che può essere prodotto da fonti energetiche primarie come; carbone, gas naturale, biomasse, rifiuti, energia solare, eolica o nucleare. Un futuro con impiego di idrogeno come fonte principale di energia è la soluzione ideale nel medio lungo periodo per risolvere i problemi ambientali e quelli di sicurezza molto discussi al giorno d’oggi.
Nonostante gli indiscutibili vantaggi ottenibili impiegando l’idrogeno come vettore energetico, esistono ancora molte problematiche da risolvere riguardanti le tecnologie relative all’intero ciclo di vita del prodotto, in particolar modo per quanto riguarda le fasi relative alla produzione, il trasporto, lo stoccaggio e l’utilizzo. Le infrastrutture per la distribuzione di idrogeno su larga scala attualmente non esistono per cui la loro costruzione richiederà investimenti ingenti.
In figura 1.1 è presentato un ipotetico scenario futuro del ciclo di vita dell’idrogeno in cui questi viene utilizzato come vettore energetico principale:
L’idrogeno è un’importante materia prima nelle industrie chimiche, ed è utilizzato principalmente per la produzione di ammoniaca, metanolo e per la raffinazione del petrolio. C’è anche una crescente domanda di idrogeno nelle industrie di raffinazione del petrolio, in quelle di lavorazione del carbone, ed in particolare in quelle per il trattamento di combustibili contenenti alti tassi di zolfo, azoto e metalli, che possono essere rimossi mediante il processo di idrogenazione.
Nonostante la produzione, lo stoccaggio e la distribuzione dell’idrogeno siano attualmente utilizzate nel settore chimico e petrolchimico, tali tecnologie sono ancora troppo costose per un vasto impiego nel settore energetico e le politiche economiche attuali non promuovono approcci che considerano anche i risparmi ottenibili dal punto di vista ambientale e della sicurezza, rendendo attualmente sfavorevole l’impiego dell’idrogeno.
Lo sviluppo di una mentalità collettiva che consideri l’idrogeno come una reale opzione energetica per il futuro, necessita di un supporto ed un impegno che dovrà coinvolgere tutte le varie classi della società a partire da quella politica.
1.2 Principali Processi Commerciali attualmente in uso per la
Produzione di Idrogeno [0]
Sebbene l’idrogeno sia l’elemento più abbondante sulla terra non esiste allo stato molecolare in grandi quantità o concentrazioni; deve essere prodotto partendo da altre sostanze come i combustibili fossili, l’acqua, le biomasse, ecc.
Allo stato attuale la produzione di idrogeno risulta fattibile solamente partendo da combustibili fossili, mentre a lungo termine è prevedibile l’impiego di quote sempre più rilevanti di fonti rinnovabili in sostituzione dei combustibili fossili stessi.
Attualmente la produzione globale di idrogeno si aggira attorno ai 500*10^9 Nm³/anno ma le tecnologie disponibili oggi presentano ampi margini di miglioramento dal punto di vista della resa energetica e dell’impatto ambientale.
Le principali tecnologie sviluppate per la produzione di idrogeno sono [35]:
• Reforming termochimico di gas naturale con vapore ad elevate temperature
• Ossidazione parziale di combustibili fossili come carbone, petrolio e derivati (processi Sheel, Texaco, ecc.)
• Reazione con vapore di coke derivato da carbone o petrolio, per ottenere gas di sintesi a basso contenuto energetico
• Pirolisi del carbone
• Gasificazione del carbone con aggiunta di sorbenti per l’assorbimento del CO2
• Cracking termico, pirolisi o decomposizione di idrocarburi o ammoniaca • Elettrolisi dell’acqua
• Altri metodi: reazione tra metalli fortemente elettronegativi (es. Na) ed acqua; reazioni tra alcuni ossidi (es. V2O3) ed acqua; reazioni di ibridi (es. CaH2) con acqua
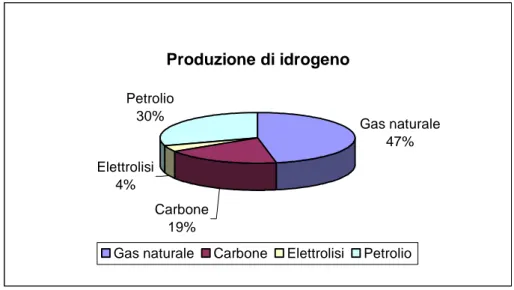
L’idrogeno, come detto, deve essere generato partendo da fonti di energia primarie. Circa il 50% della produzione mondiale deriva dal gas naturale mediante il processo di reforming, la restante parte viene prodotta; per un 30% dal petrolio, per il 19% dal carbone e per il rimanente 4% dal processo di elettrolisi.
Produzione di idrogeno Gas naturale 47% Carbone 19% Elettrolisi 4% Petrolio 30%
Gas naturale Carbone Elettrolisi Petrolio
Figura 1.2: Principali fonti di produzione di idrogeno
La maggior parte della produzione industriale di idrogeno avviene mediante Steam Reforming del gas naturale e solo una piccola quantità viene prodotto mediante Steam Reforming della Nafta e dalla parziale ossidazione del petrolio.
Procedendo dal gas naturale agli idrocarburi liquidi fino alle materie prime solide la difficoltà di lavorazione ed i costi di fabbricazione aumentano.
I processi di Parziale ossidazione e di Gasificazione del carbone richiedono maggiori investimenti rispetto agli impianti di Steam Reforming perché sono richiesti: un impianto di
separazione dell’aria, un maggiore shift, una maggiore facilità di rimozione della CO2 e la
pulizia del gas.
Il costo degli impianti di elettrolisi dell’acqua è comparabile a quelli di steam reforming di piccola capacità ma il loro costo in termini di potenza elettrica è quasi proibitivo. Negli impianti ad elevata capacità il costo effettivo dei processi di elettrolisi supera in modo significativo quello degli altri processi.
La maggior parte dell’idrogeno viene impiegato nella sintesi dell’ammoniaca, che assorbe il 49% della produzione, il 37% viene impiegato nei processi di raffinazione del petrolio, l’ 8% per la produzione di metano e circa il 6% per la produzione di altre sostanze.
Negli Stati Uniti è stata fatta una stima della necessità di idrogeno necessaria per soddisfare le esigenze energetiche di 25 milioni di abitazioni o di 25 milioni di auto alimentate con celle a combustibile (fuel cell), quantificando un fabbisogno di 40 milioni di tonnellate annue. Tali quantità potrebbero essere prodotte ipotizzando diversi scenari [36]:
• Gasificazione carbone/biomasse: 140 impianti ad alte potenzialità (con tecnologie attuali)
• Separazione dell’acqua per via nucleare: 100 impianti che producono solamente idrogeno
• Raffinerie di petrolio e gas naturale: 20 impianti, di media potenzialità che utilizzano i combustibili in gasificatori e reformer.
1.3 Approfondimento sui principali sistemi di produzione
dell’Idrogeno
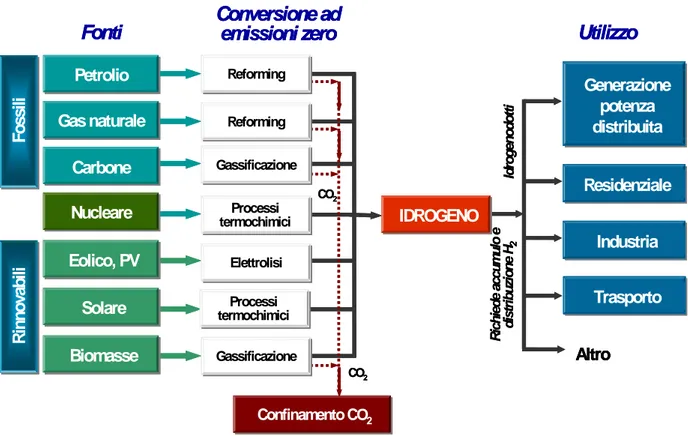
I principali sistemi attualmente in uso per la produzione ed il consumo di idrogeno sono riassunti nel seguente schema:
Confinamento CO2 Eolico, PV Solare Biomasse Carbone Nucleare Petrolio Gas naturale Fo ss ili R inno vabili Gassificazione Reforming Reforming Elettrolisi Gassificazione Processi termochimici Processi termochimici
Fonti
Conversione ad
emissioni zero
Utilizzo
CO2 CO2 Residenziale Altro Industria Generazione potenza distribuita IDROGENO Id ro ge no do tti Ri chi ed e a cc um ulo e di str ibu zi on e H 2 Trasporto Confinamento CO2 Eolico, PV Eolico, PV Solare Solare Biomasse Biomasse Carbone Nucleare Petrolio Gas naturale Fo ss ili R inno vabili Gassificazione Gassificazione Reforming Reforming Reforming Reforming Elettrolisi Elettrolisi Gassificazione Gassificazione Processi termochimiciProcessi termochimici Processi termochimiciProcessi termochimici
Fonti
Conversione ad
emissioni zero
Utilizzo
CO2 CO2 ResidenzialeResidenziale Altro Altro Industria Industria Generazione potenza distribuita Generazione potenza distribuita IDROGENO IDROGENO Id ro ge no do tti Ri chi ed e a cc um ulo e di str ibu zi on e H 2 Trasporto Trasporto
Figura 1.3: Schema dei principali processi di produzione di idrogeno
Allo stato attuale le tecniche maggiormente sviluppate a livello industriale sono quelle collocate nella parte superiore dello schema; buona parte dell’intera produzione di idrogeno viene realizzata con processi di conversione che partono da combustibili di tipo fossile. Per questo motivo, gli studi attualmente in corso nella comunità scientifica si concentrano principalmente sull’utilizzo di fonti energetiche rinnovabili.
Riportiamo di seguito una breve descrizione dei principali processi per la produzione di idrogeno attualmente utilizzati a livello industriale.
1.3.1 Steam Reforming Catalitico
In questo processo l’alimentazione idrocarburica viene convertita in gas di sintesi (H2, CO,
CO2) mediante reazione con vapore su un catalizzatore. Questo processo viene condotto
solitamente in un range di T che va dai 650°C ai 1000°C ed a Pressioni di 0,79-4,93 MPa. Catalizzatori a base di Ni sono utilizzati per lo steam reforming di gas privi di zolfo o frazioni leggere di idrocarburi liquidi, mentre catalizzatori a base di una combinazione di Ni, Co, e terre rare sono stati sviluppati per lo steam reforming di alimentazioni più pesanti. Siccome l’alimentazione idrocarburica deve essere priva di zolfo è prevista una
desolforazione, in fase gassosa, a monte dello steam reformer; la prima fase di desolforazione consiste nel far passare l’alimentazione idrocarburica contenente zolfo su un catalizzatore al Co-Mo in presenza del 5% di H2 per convertire tutti i composti solforati in
H2S, i gas in uscita, che contengono 25 ppm di H2S, vengono raffreddati e puliti con una
soluzione di Monoetanolammina (MEA). Il contenuto di solfuri è ridotto a 0,5 ppm attraverso l’assorbimento su catalizzatori ZnO a 340-370°C. Il gas può poi essere introdotto nel reformer primario, che è una camera a combustione diretta di forma tubolare. Il catalizzatore contiene il 16-20% di Ni sotto forma di NiO supportato su alluminato di calcio, allumina o titanato alluminato di calcio. Per aumentare la conversione del reforming la frazione vapore/carbonio rientra solitamente nel range di 3,5-4,5, la T del gas in uscita è di 870-885°C e la P è di 2,34-2,51 MPa.
Di solito si raggiungono, nel reformer, conversioni del CH4 superiori al 95%.
Il gas che lascia il primo reformer ha una composizione di circa il 76% H2, 12% CO, 10%
CO2 e 1,3% CH4.
Nella fase successiva il CO è convertito in CO2 più idrogeno mediante Water Gas Shift
Reaction (WGSR):
CO + H2O = H2 + CO2 38,4 MJ/mol CO (9200 Kcal/mol CO) a 371°C
Questa reazione è condotta su un catalizzatore a base di ossido di Fe-Cr a 340-455°C. Questi catalizzatori sono solitamente sottoforma di “tablets” di 6*6 mm o 9,5*9,5mm.
I gas convertiti sono raffreddati fuori dal reattore, producendo vapore o riscaldando il boiler dell’acqua di alimentazione, per poi essere inviati al convertitore di shift a circa 200-215°C per completare la WGSR sui catalizzatori a bassa T; catalizzatori a base di Zn-Cu supportati su allumina (Al2O3) sottoforma di “tablets” di 6*3 mm che operano a 200-230°C. Il
contenuto di CO nei gas è solitamente dello 0,2-0,25% su base secca. Il catalizzatore di shift a basse T è molto sensibile all’avvelenamento da zolfo, deve essere quindi protetto da un letto di ZnO. Il catalizzatore deve essere separato in 2 letti con la possibilità di poter bypassare il primo che contiene il 20% del volume totale e viene sostituito annualmente, mentre il letto catalitico principale dura 5 anni. Il gas adesso contiene circa: 86% H2, 22%
CO2, 0,25% CO e 1,3% CH4 su base secca. Il gas viene poi raffreddato con il maggior
recupero di calore possibile e la CO2 viene lavata via mediante (MEA) o altri processi quali
Selexol, Sulfinol, Rectisol ecc. Il gas lavato contiene: 98,2% H2, 0,3% CO, 0,01% CO2 e
nuovamente riscaldati a 315°C su un catalizzatore a base di ossido di Ni con circa il 35% Ni supportato su silice o su altri materiali refrattari (il contenuto di Ni può variare dal 15 al 48%). Su questo catalizzatore CO e CO2 sono idrogenati a CH4.
Il catalizzatore è solitamente in “tablets” di 6*6 mm e la velocità spaziale è di circa 6000 (vol/h-1).
I gas in uscita sono raffreddati con recupero di calore ed il vapore residuo viene rimosso in un separatore a goccia. Il gas prodotto, ora è composto dal 98,2% H2 e dall’1,8% di CH4.
Con lo Steam Reforming del Metano viene prodotto il 48% dell’idrogeno a livello mondiale. Tale processo prevede la reazione di metano e vapore in presenza di un catalizzatore.
Tale metodo può essere applicato anche ad altri idrocarburi leggeri, come la nafta. Lo steam reforming catalitico a partire dalla nafta è oggi svantaggioso a causa dell’eccessivo prezzo della nafta stessa, quindi il gas naturale rappresenta la migliore materia prima disponibile da utilizzare in questo tipo di processo.
Se si utilizzano idrocarburi pesanti c’è bisogno di un processo di depurazione spinto e tali idrocarburi potrebbero facilmente crackizzare, con conseguente occlusione dei siti attivi del catalizzatore e relativa diminuzione della loro attività catalitica.
Tale processo, su scala industriale, in genere viene realizzato adottando condizioni operative
di T=800÷900 C° e P=25÷30bar.
La reazione prevede 2 fasi successive:
- prima fase: consiste nella decomposizione dell’idrocarburo in idrogeno e monossido di carbonio: CH4 +H O2 →CO+3H2 n m 2 2 m C H nH O nCO n H 2 ⎛ ⎞ + → +⎜ + ⎟ ⎝ ⎠
- seconda fase detta “Shift Reaction”: il monossido di carbonio e l’acqua si trasformano in biossido di carbonio e idrogeno:
2 2 CO+H O→CO +H2 2 2 2 2 nCO+nH O→nCO +nH
Complessivamente, quindi, la reazione di Steam Reforming è la seguente:
4 2 2 CH +2H O→CO +4H n m 2 2 2 m C H 2nH O nCO 2n H 2 ⎛ ⎞ + → +⎜ + ⎟ ⎝ ⎠
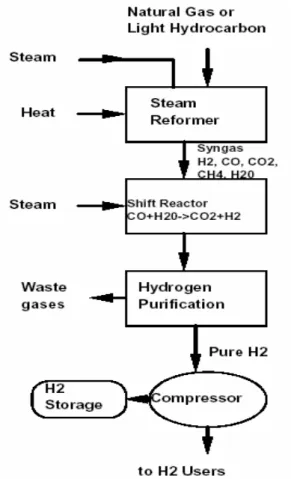
Figura 1.5: Schema dello steam reforming
Il contenuto energetico dell’idrogeno prodotto è più elevato di quello del metano o dell’idrocarburo di partenza, come possiamo vedere confrontando i loro poteri calorifici inferiori:
Composto PCI (kWh/kg) PCI (kWh/mol)
Idrogeno 33.33 0.06666 Metano 13.9 0.2224
Tabella 1.1: Poteri calorifici di idrogeno e metano
Quindi, partendo da 1 mole di CH4, che equivale a 0.2224 kWh, sulla base della
stechiometria di reazione possiamo ottenere fino a 4 moli di H2, equivalenti a
. Ciò è reso possibile dall’introduzione nel sistema di ulteriori quantità di calore sotto forma di vapore. Il processo di steam reforming è complessivamente endotermico, quindi è necessario introdurre ulteriore combustibile per mantenere il sistema alla temperatura desiderata. In genere, circa
4 0.06666⋅ =0.266 kWh
per fornire il calore necessario; di conseguenza, il rendimento del processo si abbassa fino a un valore di circa il 65%.
Il gas in uscita dalla sezione di reforming è una miscela composta principalmente da H2 e
CO2; quest’ultima deve essere separata, ed in genere la sua rimozione viene effettuata per
mezzo di assorbimento in solventi specifici o separazione con membrane.
Uno degli obiettivi delle ricerche attualmente in corso è quello di migliorare il processo tradizionale tramite la tecnica del Sorption Enhanced Reforming (SER). Il vantaggio di una tecnologia di questo tipo consiste nell’abbinare alle reazione di reforming un processo selettivo di assorbimento della CO2 prodotta, modificando quindi le condizioni di equilibrio
tramite l’eliminazione di uno dei prodotti. Ciò permette di adottare temperature di lavoro notevolmente più basse e di ottenere direttamente dei flussi separati, estremamente puri, sia di idrogeno che di anidride carbonica, senza ricorrere ai costosi sistemi di separazione adottati nello steam reforming tradizionali. Le attività di ricerca sono volte principalmente all’individuazione dei materiali più idonei all’assorbimento di CO2 e alla dimostrazione della
validità tecnica dei sistemi sperimentali sinora individuati.
Lo steam reforming è una tecnologia ormai consolidata e comporta inoltre un ridotto impatto ambientale, con emissioni di inquinanti secondari molto modeste. Il principale svantaggio consiste nell’utilizzo come materia prima di un combustibile pregiato come il gas naturale; quindi, in genere gli impianti attualmente esistenti si limitano alla produzione di idrogeno per uso diretto per la produzione di particolari composti chimici come l’ammoniaca e il metanolo.
1.3.2 Elettrolisi dell’Acqua
Quando una corrente elettrica diretta passa attraverso una soluzione acquosa di un elettrolite, si sviluppa idrogeno in un elettrodo, ed ossigeno sull’altro elettrodo. L’elettrolisi è l’inverso della combustione dell’idrogeno. L’acqua si dissocia in uno ione idrogeno H+ il quale migra al catodo ed uno ione idrossido OH- che migra all’anodo. Per produrre 100 m3 di H2 è
richiesta un’energia teorica di 332 kWh di cui 279 kWh fornita come energia elettrica, la differenza dovrebbe essere calore. L’acqua si dissocia in uno ione idrogeno H+ il quale migra al catodo ed uno ione idrossido OH- che migra all’anodo. Per produrre 100 m3 di H2 è
richiesta un’energia teorica di 332 kWh di cui 279 kWh fornita come energia elettrica, la differenza dovrebbe essere calore. Teoricamente una cella potrebbe operare come un refrigeratore e fornire un’efficienza del 100%. Il voltaggio teorico necessario a 25°C è di
1,47V per il cambiamento di entalpia e 1,23V per il cambiamento di energia libera. All’aumentare della T operativa diminuisce il voltaggio per la decomposizione dell’acqua (si ha un vantaggio a T più elevate poiché il processo procede più velocemente). Aumentando la P operativa di un fattore 10 aumenta il voltaggio richiesto di circa 43 mV. Questa differenza uguaglia l’aumento di energia potenziale contenuto nell’idrogeno ad alta P.
Per la produzione di idrogeno ad alta P, superiore a 2,8 MPa (27 atm), si ha il 100% di efficienza nell’uso dell’energia (nelle celle a bassa P si ha un’efficienza del 98%).
Una cella di elettrolisi è formata da un contenitore, due elettrodi, una soluzione elettrolitica ed un separatore. Gli elettrodi devono essere conduttori elettrici ed avere una superficie adatta per rilasciare ioni H+ ed OH-. L’elettrolita deve avere un’elevata conducibilità ionica, deve essere chimicamente stabile e non volatile (acido forte, base forte).
Il separatore, che impedisce il contatto fra gli elettrodi ed il mescolamento di idrogeno ed ossigeno, deve essere permeabile alla soluzione elettrolitica, resistente alla corrosione e meccanicamente stabile. Gli elettrolizzatori sono; o di tipo cisterna con elettrodi in parallelo, o di tipo filtro-pressa con elettrodi in serie. Quest’ultimo richiede spazi minori, opera a P e T maggiori e solitamente ha efficienze più elevate. Le celle che usano elettroliti polimerici solidi, che non richiedono circolazione di liquidi, sono solitamente di tipo filtro-pressa. Il raffreddamento delle celle si ottiene per ricircolazione e raffreddamento dell’elettrolita, per circolazione dell’idrogeno o per circolazione di acqua attorno alla cella.
Il processo richiede il passaggio di corrente elettrica attraverso l’acqua, in maniera da far avvenire la seguente reazione:
2
1 H O energia elettrica H O
2
+ → 2 + 2
La corrente entra nella cella attraverso un elettrodo caricato positivamente (catodo), attraversa l’acqua ed esce attraverso un elettrodo caricato positivamente (anodo). La differenza di potenziale che viene stabilita tra i 2 elettrodi è in grado di scindere la molecola di acqua.
L’elettrolisi è il modo più semplice per produrre idrogeno, ma allo stesso tempo è anche quello meno sviluppato (si stima che circa il 4% della produzione mondiale di H2 provenga
dall’elettrolisi) data la limitata quantità di gas prodotta, la difficoltà nella separazione ed i costi elevati dovuti all’uso di energia elettrica.
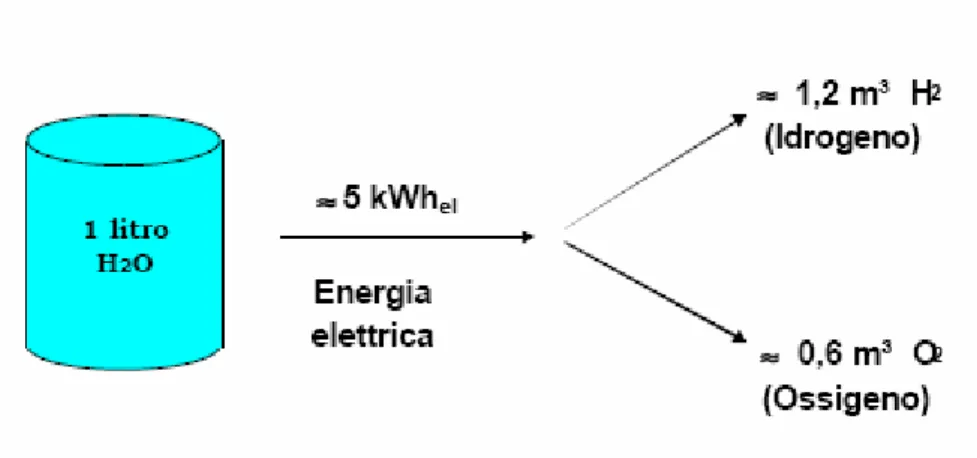
Figura 1.7: Rendimenti del processo di elettrolisi
Le celle elettrolitiche attualmente in commercio permettono di ottenere 1 Nm3 di H2 con un
consumo medio di 4 kWh.
Considerato che il potere calorifico dell’idrogeno è pari a 3 kWh/Nm3, risulta evidente come il processo non sia applicabile per la produzione di idrogeno come combustibile, in quanto il contenuto energetico del gas prodotto è inferiore alla quantità di energia elettrica consumata. Per risolvere questi inconvenienti sono attualmente allo studio tecniche di applicazione dell’elettrolisi con vapore ad alta temperatura (800-900°C). Ciò consentirebbe di rendere le reazioni più veloci e di ridurre le perdite energetiche dovute alla polarizzazione degli elettrodi, accrescendo quindi l’efficienza complessiva del sistema.
1.3.3 Ossidazione Parziale, non Catalitica, di Idrocarburi
Per quanto riguarda la produzione di Idrogeno (e gas di sintesi contenenti Idrogeno) mediante un processo di ossidazione parziale, non catalitico, di idrocarburi sotto pressione, i processi commerciali attualmente più sviluppati sono:
Processo Texaco (1954) Processo di Gasificazione Shell (1956)
Il sistema di gasificazione del carbone Texaco è uno di quelli usati per la generazione di gas grezzo. Usando altri gasificatori pressurizzati ad alta T come quello Shell-Krupp si ha una sequenza di processo simile e si ottengono risultati simili. Ad elevate T la formazione di metano è minima e non si formano né oli né catrame. L’energia richiesta dal sistema di gasificazione della Texaco è di 108,000 kJ/mol H2 (25,812 kcal/mol H2) che corrisponde ad
una efficienza termica del 50,7%. Questa efficienza di conversione è circa il 20% maggiore di quella riportata per i sistemi di gasificazione a Patm.
Il processo di gasificazione Shell-Koppers opera a P di 3,08 MPa (30,5 atm) ed è adatto per l’uso di qualsiasi tipo di carbone macinato fino ad avere dimensioni di circa 90*10-6 m. L’ossidazione mediante vapore, ossigeno o aria converte più del 98% del carbonio in carbone. I gas lasciano il gasificatore a 1500°C con l’85-90% di H2 e CO combinati.
Entrambi i processi conducono l’ossidazione parziale bruciando idrocarburi con ossigeno o miscele gassose ricche di ossigeno, per produrre un gas che contiene idrogeno e CO, con piccole quantità di CO2, vapore acqueo e metano.
Il vantaggio principale del processo di ossidazione parziale non catalitica sotto pressione (rispetto allo steam reforming) è quello di poter operare su qualsiasi materia prima idrocarburica che può essere compressa o pompata; dal gas naturale al petrolio greggio, dall’olio residuo agli asfalti, e non è richiesta nessuna operazione di desolforazione prima della fase di ossidazione parziale.
Lo svantaggio principale è la necessità di rifornirsi di ossigeno puro al 95-99% ottenuto attraverso un impianto di separazione dell’aria che aumenta sia il costo di impianto che il costo di gestione. Questo processo converte idrocarburi liquidi in prodotti gassosi, essenzialmente H2 e CO, con piccole quantità di CO2 e CH4 (quando si usa come ossidante
un ossigeno ad elevata purezza). Il gas prodotto può essere convertito in idrogeno ad elevata purezza. La frazione H2/CO nel gas di sintesi, prodotto dall’unità di ossidazione parziale, è
una funzione del contenuto di idrogeno e di carbonio nella materia prima utilizzata. Il gas di sintesi prodotto dal processo di gasificazione viene trattato per la rimozione dello zolfo. L’unità di shift del CO include un catalizzatore di shift ad alta T seguito da un catalizzatore di shift a bassa T. Il calore, rilasciato durante la reazione di shift esotermica del CO, viene recuperato ed utilizzato per fornire vapore o per fornire calore alle fasi gassose intermedie. Quasi tutti gli idrocarburi liquidi possono essere adatti come materia prima di alimentazione
per questo tipo di processi (gas naturale, gas di raffineria, nafta, oli combustibili, residui pesanti, asfalto e petrolio greggio) fra cui i più usati sono gli oli combustibili pesanti ed i vapori degli oli residui di raffineria. L’alimentazione deve avere una viscosità sufficientemente bassa da atomizzare alla T di preriscaldamento. Il processo viene condotto mediante l’iniezione di idrocarburi, ossigeno e vapore, pre-riscaldati, in un bruciatore, all’interno di un recipiente di combustione chiuso, dove l’ossidazione parziale avviene a 1290-1400°C con una quantità di ossigeno inferiore a quella stechiometrica per la completa combustione.
La reazione generale è la seguente:
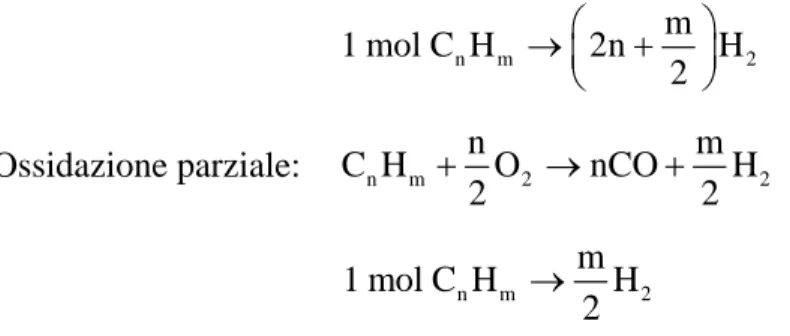
CnHm + n/2 O2 = n CO + m/2 H2
La composizione finale dei prodotti gassosi è stabilita mediante la WGSR:
CO + H2O = H2 + CO2
all’uscita del reattore o all’ingresso dello scambiatore di calore, dove avviene un rapido raffreddamento della corrente.
L’idrogeno può essere ottenuto tramite un’ossidazione parziale non catalitica di idrocarburi pesanti, come la nafta. L’operazione viene compiuta ad una temperatura di 1300-1500 °C. L’efficienza complessiva del processo si aggira attorno al 50%, quindi sensibilmente più bassa di quella dello Steam Reforming. Inoltre, il processo richiederebbe in via preferenziale l’uso di ossigeno puro. Se infatti forniamo al sistema l’ossigeno contenuto nell’atmosfera, i prodotti di reazione sono fortemente diluiti a causa dell’azoto alimentato, ed è complicato andare a concentrare l’idrogeno così ottenuto.
In sostanza, con questo processo si fa avvenire una reazione controllata tra ossigeno e combustibile, che porta allo sviluppo di CO, H2 e grandi quantità di calore. L’idrogeno che
può essere ottenuto è al massimo pari a quello contenuto nel combustibile di partenza; quindi, a parità di materia prima, le rese sono sensibilmente più basse rispetto a quelle dello Steam Reforming. Partendo da 1 mole di un generico idrocarburo di formula CnHm,
otteniamo:
Steam Reforming: C Hn m 2nH O2 nCO2 2n m H2 2
⎛ ⎞
+ → +⎜ + ⎟
1 mol C Hn m 2n m H2 2
⎛ ⎞
→⎜ + ⎟
⎝ ⎠
Ossidazione parziale: C Hn m nO2 nCO H2
2 2
+ → +m
1 mol C Hn m mH2 2 →
Lo schema di processo è analogo a quello dello Steam Reforming, con l’unica differenza che l’agente ossidante utilizzato è l’O2 invece dell’H2O.
Figura 1.8: Schema di ossidazione parziale
1.3.4 Gasificazione del Carbone
Il processo di gasificazione consiste nella parziale ossidazione non catalitica del carbone per dare un combustibile gassoso, formato principalmente da idrogeno, monossido di carbonio e metano.
La reazione può essere condotta in diversi tipi di reattore: a letto fisso, a letto fluido o a letto trascinato. Tutti questi metodi prevedono l’uso di vapore assieme ad aria per ossidare parzialmente il carbone secondo la reazione:
2
A seconda del tipo di reattore adottato, operiamo a temperature più o meno elevate e il prodotto finale ha diversa composizione.
I principali tipi di reattore sono i seguenti:
- reattori a letto fisso: lavorano a basse temperature (400-650°C), il gas prodotto contiene principalmente prodotti devolatilizzati; si ottiene inoltre anche un flusso di idrocarburi liquidi contente nafta, catrame, oli e fenili.
- reattori a letto trascinato: si produce gas ad alta temperatura (>1250°C); le energiche condizioni di lavoro permettono di far reagire quasi interamente i prodotti devolatilizzati e gli idrocarburi liquidi prodotti; quindi il gas ottenuto è composto principalmente da idrogeno, oltre naturalmente ai prodotti di ossidazione CO e CO2.
- reattori a letto fluido: lavorano a temperature intermedie di 900-1050°C; agendo opportunamente sulle condizioni operative è possibile indirizzare il sistema verso il prodotto desiderato.
Il calore necessario alla gasificazione è fornito dall’ossidazione parziale del carbone. Generalmente l’operazione di gasificazione nel suo complesso è esotermica, per questo motivo al reattore viene abbinata una caldaia a recupero per la produzione di vapore, eventualmente da usare all’interno del sistema stesso. I gasificatori producono correnti gassose fortemente inquinate da ceneri, ossidi di zolfo e di azoto; è quindi necessario un successivo sistema di abbattimento delle polveri e degli acidi volatili prodotti.
1.3.5 Pirolisi e Gasificazione delle Biomasse
Analogamente a quanto avviene con la gasificazione del carbone, si tratta di un processo endotermico in 2 stadi in cui un combustibile solido viene convertito in un gas a basso o medio potere calorifico, in genere compreso tra 4000 e 14000 KJ/Nm3.
Il primo stadio consiste in una pirolisi del materiale di partenza; l’applicazione di calore in assenza di ossigeno fa sì che i componenti più volatili vengano vaporizzati a temperature inferiori a 600°C, per effetto di una serie complessa di reazioni. Tali componenti volatili sono composti da idrocarburi leggeri, idrogeno, CO, CO2.
Va fatto notare che i combustibili ottenuti dalla biomassa hanno un contenuto di sostanze volatili superiore rispetto a quello del carbone (rispettivamente 70-85% e 30% su base secca); per questo motivo la pirolisi ricopre un ruolo fondamentale nella gasificazione delle biomasse piuttosto che in quella del carbone.
Nel secondo stadio le sostanze carboniose e la cenere, che sono prodotti non vaporizzabili, devono essere gasificate in una reazione con ossigeno ed acqua sotto forma di vapore, secondo la reazione già vista in precedenza:
2
C+H O→CO+H2
La parte incombusta delle sostanze carbonizzate viene bruciata per fornire il calore necessario alle reazioni endotermiche di gasificazione.
La gasificazione viene generalmente realizzata a bassa pressione, in reattori a letto fisso o fluido.
Un metodo alternativo per la produzione di idrogeno dalle biomasse è la combinazione di pirolisi e dello steam reforming. Tramite una pirolisi condotta a 400-800°C in atmosfera inerte o leggermente ossidante le biomasse vengono decomposte termicamente; i prodotti di reazione possono essere solidi, liquidi e gassosi, in proporzioni che dipendono dai metodi di pirolisi e dai parametri di reazione. In genere, comunque, si formano sostanze gassose che possono essere convertite: a idrogeno ed ossidi di carbonio, in ambiente catalitico, e ad una sostanza liquida, il “bio-olio”, composta per l’85% da sostanze organiche ossigenate e per il 15% da acqua.
Il bio-olio così ottenuto può essere sottoposto ad un tradizionale processo di steam reforming per ottenere, infine, idrogeno.
Questo tipo di processo è di grande interesse e possiede notevoli possibilità di sviluppo tra i processi che usano fonti rinnovabili di energia ma al momento presenta ancora molti svantaggi:
- il basso contenuto di idrogeno della biomassa (6-6.5%), rispetto al gas naturale - i costi elevati della biomassa; a causa della mancanza di un’economia di scala
- l’elevato contenuto di umidità della biomassa (fino al 50% nel materiale grezzo), il che rende necessario un trattamento preliminare di essiccamento
i vantaggi invece sono:
- la materia prima è una fonte rinnovabile di energia
- il processo è a impatto nullo per quanto riguarda l’emissione di anidride carbonica, uno dei gas responsabili dell’effetto serra: la quantità di CO2 rilasciata in atmosfera
dal processo di conversione delle biomasse è la stessa utilizzata dalla biomassa durante la crescita
- basso impatto ambientale anche per quanto riguarda le emissioni di SOx
- possibilità di adottare sistemi integrati di produzione, con impianti decentralizzati di produzione di bio-olio ed un unico impianto centralizzato di reforming
1.3.6 Processi ad Energia Solare
La produzione di idrogeno ottenuta con processi termochimici o termofisici, utilizzando come fonte energetica l’energia solare ad alta o altissima temperatura, rappresenta una risorsa di grande valenza in termini di risorse energetiche disponibili, di compatibilità ambientale e di potenziale riduzione dei costi di produzione, dato l’alto rendimento complessivo del processo di trasformazione.
L’energia solare, opportunamente raccolta e concentrata, può essere utilizzata direttamente in sistemi di tipo fotovoltaico in grado di realizzare la scissione della molecola di H2O,
oppure essere utilizzata come fonte energetica in grado di sostenere l’intero processo di conversione.
Riportiamo a titolo di esempio due cicli che al momento attuale appaiono promettenti dal punto di vista applicativo.
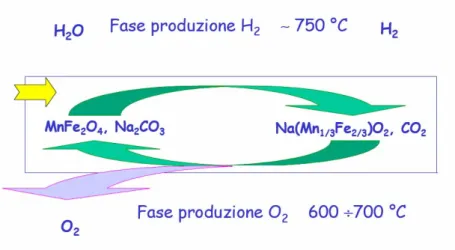
Ciclo a ferriti miste
Tale ciclo si basa su due reazioni il cui risultato netto consiste nella dissociazione dell’acqua in idrogeno ed ossigeno:
(
)
2 4 2 3 2 1 3 2 3 2 2 2 2 MnFe O +3 Na CO +H O→6 Na Mn Mn O +3 CO +H (~750°C)(
1 3 2 3)
2 2 2 4 2 3 2 1 6 Na Mn Mn O 3 CO 2 MnFe O 3 Na CO O 2 + → + + (600~700°C)Figura 1.9: Schema del ciclo a ferriti miste
Nella prima reazione, da ferrite di manganese, carbonato di sodio ed acqua, a circa 750°C, si forma ferrimanganite di sodio, idrogeno ed anidride carbonica. Alla fine di questa fase l’idrogeno viene separato dal vapore acqueo in eccesso e dalla CO2, che viene riciclata nella
seconda fase del processo.
Nella seconda reazione, variando opportunamente le condizioni di temperatura e di pressione, l’anidride carbonica reagisce con la ferrimanganite di sodio e ripristina il materiale di partenza, con produzione di ossigeno.
Il risultato di tale processo consiste nella produzione di idrogeno ed ossigeno per scissione mediata della molecola di acqua in due fasi ben distinte. Si evita in tal modo l’arduo problema della contemporanea separazione dell’idrogeno e dell’ossigeno prodotti, ad esempio, nei tradizionali processi di elettrolisi dell’H2O, con ovvi benefici in termini di
sicurezza del processo.
Ciclo zolfo – iodio
Questo processo si basa su tre reazioni fondamentali:
- produzione di acido solforico e acido iodidrico (reazione esotermica, condotta a bassa temperatura);
- dissociazione dell’acido solforico, con produzione di vapore acqueo, ossigeno ed anidride solforosa, quest’ultima riciclata alla fase di produzione degli acidi;
H SO2 4 H O2 SO2 1O 2
→ + + 2
2
(~850°C)
- dissociazione catalitica dell’acido iodidrico con produzione di idrogeno e iodio; quest’ultimo viene riciclato alla reazione di produzione degli acidi (reazione debolmente endotermica, con temperature variabili in funzione dei catalizzatori e delle condizioni operative).
2 HI→H2 +I (200÷700°C)